16/06/2010
Les lacs : généralités
Notions de limnologie. Différents types de lacs. Zonation limnétique
14/06/2010
Classification trophique des lacs
Classification trophique des lacs. Le réseau alimentaire. Eutrophisation et pollution
11:23 Publié dans Géologie-hydrogéologie-Climatologie, Limnologie-hydrobiologie | Tags : lacs, limnologie, chaine alimentaire, plancton, matière organique, lacs oligotrophes, lacs mésotrophes, lacs eutrophes, lacs dystrophes, lacs sapropélotrophes | Lien permanent | Commentaires (13) | ![]() Facebook | | |
Facebook | | |
11/06/2010
Principaux lacs du Jura
Caractéristiques des principaux lacs du Massif du Jura
11:43 Publié dans Géologie-hydrogéologie-Climatologie, Limnologie-hydrobiologie | Tags : lacs, jura, limnologie, poissons, lac de saint-point, lac de remoray, lac de chalain, lac d'ilay, lac de la motte, lac du petit-maclu, lac du grand-maclu, lac de bonlieu, lacs de clairvaux les lacs | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
08/06/2010
Poissons des lacs du Jura
Les poissons des lacs du Jura. Échantillonnage et courbes de croissance
17:01 Publié dans Limnologie-hydrobiologie, Poissons | Tags : poissons, lacs du jura | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
07/06/2010
Proliférations algales dans la haute vallée du Doubs
Les récentes constatations de la pollution de la Loue par une efflorescence de Cyanobactéries (ou Algues Bleues) a semé l'émoi dans la population, les pêcheurs et les touristes. Pourtant les épisodes estivaux de prolifération algale ne sont pas rares dans la région.
16:07 Publié dans Environnement-Écologie, Limnologie-hydrobiologie, Nature et santé | Tags : proliférations algales, hydrobiologie | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Proliférations de Cyanobactéries dans la Loue
Une pollution de la Loue a entraîné une prolifération de Cyanobactéries toxiques. Ces organismes émettent des toxines mettant en danger la vie aquatique et notamment les populations de truites
13:40 Publié dans Environnement-Écologie, Limnologie-hydrobiologie, Nature et santé, Poissons | Tags : loue, poissons, pollution, cyanobactéries, algues bleues, bloom, efflorescence, oscillatoria | Lien permanent | Commentaires (5) | ![]() Facebook | | |
Facebook | | |
28/05/2010
Le Périophthalme : un poisson qui sort de l'eau
 Le Périophthalme : un poisson qui sort de l'eau
Le Périophthalme : un poisson qui sort de l'eau
Periophthalmus sp.
par André Guyard
Les Périophthalmes sont des poissons de la famille des Gobiidés appelés Gobies des mangroves ou Poissons grenouilles. En effet, ils sont communs dans les mangroves des zones intertropicales et sont capables de vivre provisoirement à l'air libre. On les rencontre dans toute l'Afrique tropicale, en Asie et en Australasie. Les périophthalmes présentés ici ont été observés dans les mangroves du nord-ouest de Madagascar.

Périophthalme sortant de l'eau
(cliché Christine Rouannet)
Poisson amphibie, le Périophthalme est capable de sortir de l'eau pour se hisser sur les berges et grimper sur les racines échasses des palétuviers Rhizophora sp. grâce à ses nageoires pectorales qu'il utilise comme des pattes. Il chasse à l'affût divers insectes (mouches) et autres invertébrés (petits crabes).
Sa respiration s'effectue alors par des échanges gazeux à travers la peau et certaines muqueuses riches en vaisseaux sanguins. Il se déplace avec agilité sur le sable ou la vase en utilisant ses nageoires pectorales puissantes et développées. Comme tous les Gobiidés, ses nageoires ventrales formant une ventouse, il peut rester fixé sur une surface verticale.
Le périophthalme utilise ses nageoires pectorales pour se déplacer sur la rive
Les yeux du Périophthalme ont une structure double, lui permettant une vision subaquatique et une vision aérienne d'où son nom. Ses yeux protubérants sont indépendants l'un de l'autre à la manière de ceux des caméléons.
Le Périophthalme est un poisson territorial qui défend son territoire contre ses congénères.
L'intérêt phylogénétique de cette espèce est évident : il représente une forme de transition entre les vertébrés aquatiques et les vertébrés terrestres.

10:46 Publié dans Océanographie, Poissons | Tags : périophthalme, poissons tropicaux, gobiidés, gobies, poisson grenouille | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
26/05/2010
Le Lémur à queue rousse
 Le Lémur à queue rousse
Le Lémur à queue rousse
Lepilemur ruficaudatus Grandidier, 1867
(Famille des Lepilemuridae)
par André Guyard
Le Lémur à queue rousse Lepilemur ruficaudatus ou Boenga est un Lémurien à pelage roux sombre. Comme pratiquement tous les Lémuriens, il constitue une espèce endémique de Madagascar qui fréquente les forêts denses sèches et les fourrés épineux. De mœurs nocturnes, il est fondamentalement folivore et accessoirement frugivore. Son poids est d'environ 800 grammes et le dimorphisme sexuel est peu marqué. En général, il vit en couple sur un territoire d'environ 1 ha et il n'y a pas chevauchement entre les territoires des couples voisins. De sorte que l'amplitude de chaque déplacement nocturne se situe entre 100 m et 1 km.

Individus observés : Parc National Kirindy Mitea aux environs de Morondava.
Voir également sur ce même blog :
Le Lémur noir ou Lémur macaco,
Références :
Groves, C. (2005). Wilson, D. E., & Reeder, D. M. Mammal Species of the World (3rd ed.). Baltimore : Johns Hopkins University Press. pp. 119.
Hoffmann, M. (2008). Lepilemur ruficaudatus. In: IUCN 2008. IUCN Red List of Threatened Species.
16:03 Publié dans Mammifères | Tags : madagascar, lepilemur ruficaudatus, lémuriens, prosimiens, le lémur à queue rousse | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Réflexions sur l'engeance humaine par Francis Rougerie
 Réflexions sur l'engeance humaine
Réflexions sur l'engeance humaine
par Francis Rougerie

Des pas sur le sable d'une plage, des pas humains qui sortent de la mer. Une piste qui s'approche... Où conduit cette piste ? Tel est le dilemme que pose Francis Rougerie qui s'interroge sur l'origine, la nature et le devenir de notre espèce. Une saga scientifiquement argumentée en trois volets : émergence, immanence et transcendance de cette espèce dominante : l'Homme.
D'où venons-nous ? La vie tire son origine du Big-bang. Parmi les différentes espèces vivantes, l'homme apparaît comme une belle réussite de la sélection naturelle... Mais le singe nu est devenu une redoutable engeance ! Les mythes et les symboles fondateurs ont formaté les cosmogonies et les civilisations, et alimenté les guerres pour le pouvoir de ce monde, et celles pour le pouvoir divin.
Qui sommes-nous ? L'homme éclairé tente de sortir de cette tenaille infernale par une quête identitaire jamais achevée, un questionnement humaniste et la recherche d'un bonheur immanent.
Où allons-nous ? Dans le mur peut-être car l'homme, engeance pour les autres espèces vivantes se heurte à l'ensemble des problèmes écologiques qu'il a lui-même engendrés. Une espèce qui risque de manquer d'espaces et de ressources. Il va lui falloir s'inventer de nouveaux horizons, trouver de nouvelles planètes où s'établir.
Mais pour aller jusqu'où, et vers quoi ?
Cet ouvrage ressort de la culture universelle d'un chercheur océanographe qui a navigué dans le Pacifique sud, s'intéressant à la chimie des eaux jusqu'au fonctionnement des récifs coralliens et des atolls. Une quête du savoir scientifique débouchant sur nombre de publications fondamentales et de vulgarisation. Un coup d'œil du grand large sur le sillage de notre espèce humaine.
Francis Rougerie : Réflexions sur l'engeance humaine - 251 p. Les Éditions Baudelaire (ISBN 978-2-35508-451-5) - 19 euros.
Pour contacter l'auteur : francis.rougerie0263@orange.fr
09:14 Publié dans Actualité des Sciences, Environnement-Écologie, Livres | Tags : espèce humaine, homme | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
21/05/2010
Dictature verte par Michel Tarier
 DICTATURE VERTE
DICTATURE VERTE
par Michel Tarier
Sur cette Terre, le genre humain s'est taillé la part belle. Tout en reconnaissant les limites vitales de cette position, il rechigne à revoir ses valeurs. C'est probablement au nom de cette politique de l'autruche que l'humanité voit d'un mauvais œil l'avènement d'une salutaire écorésistance qu'il préfère travestir en écoterrorisme pour mieux la désamorcer. Notre Terre est usée jusqu'à la corde, déjà sous perfusion. Au nom de quelle insouciance ne changerait-on pas de cap ? Pour rétablir la situation, pourquoi ne pas remplacer l'actuelle dictature du fric par une contrainte librement choisie et dont le but avoué, à la façon d'une Internationale verte, partirait de la base et ne serait pas imposée d'en haut ? Se réclamant de la pensée critique et d'un minimum de conscience universelle, prônant la décroissance tant économique que démographique, cet ouvrage n'a pour but que de faire prendre conscience de l'urgence des mesures à adopter face à l'accélération de la dégradation de l'état planétaire. Le lecteur de "Dictature verte" pourra ainsi se prononcer en son âme et conscience sur le bien-fondé d'une souhaitable écocratie.
Naturaliste, Michel Tarrier construisit très tôt sa vie autour de sa passion pour la nature. Persuadé que l'homme moderne va à sa perte en agressant outre-mesure la biosphère, il se fait essayiste et publie des ouvrages d'écosophie qui font polémique. Sa théorie est qu'en détruisant son milieu, l'humain pratique une politique de la terre brûlée qui va le conduire à un véritable autogénocide.

DICTATURE VERTE
Saura-t-on l'éviter ? Faut-il la souhaiter ? Comment continuer à vivre sur une Terre que l'on détruit ?
UN LIVRE QUI ANNONCE ENFIN LA COULEUR !
Puisqu'il faudra bien sauver la planète pour nous sauver nous-mêmes, qu'on le veuille ou non, on risque d'en arriver à cette ultime solution pour garantir, in extremis, le label « vie ». Dictature verte, un livre fiction ? Pas tant que ça !
Le Grenelle du renoncement et le pataquès de la conférence de Copenhague prouvent bien, entre autres récentes désillusions, qu'une écologisation du monde par le système en place n'est qu'un mythe, un leurre, une imposture.
Le développement durable prôné est bel et bien identifié comme un lubrifiant auto inventé de toutes pièces par l'ultralibéralisme, au service d'un green maquillage désormais incessant et envahissant.
Si nous ne montons pas d'un cran, l'humanité poursuivra sa course effrénée jusqu'à son autogénocide, sous l'aveugle pulsion d'un optimisme irraisonné.
La planète Terre, exsangue, est déjà sous perfusion, notre avenir n'est plus que sursis. Au nom de quelle insouciance ne changerait-on pas de cap ?
DICTATURE VERTE
Michel Tarrier, 300 pages, Éditions Les Presses du Midi, 20€
À commander dès maintenant chez l'éditeur. En vente chez votre libraire et dans toutes les librairies en ligne (Amazon, Fnac...) dès le 26 mai 2010.
Pour contacter l'auteur, n'utiliser que cette adresse : tarrierster@gmail.com
ISBN 978-2-8127-0140-5 • 20? • 300 PAGES • A5
23:38 Publié dans Actualité des Sciences, Environnement-Écologie, Livres | Tags : écologie, michel tarier | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Lémur à dos gris
 Le Lémur à dos gris
Le Lémur à dos gris
Lepilemur dorsalis Gray, 1870
par André Guyard
Le Lémur à dos gris est l'une des plus petites espèces appartenant au genre Lepilemur. Comme son nom l'indique, la face dorsale est gris-brun à brun moyen, avec une bande sombre brun le long du dos. La face ventrale est plus pâle brun grisâtre. La tête est grise avec une face gris-brun foncé avec un petit museau, des oreilles arrondies, qui sont presque cachées dans la fourrure. La queue est à peu près de la même longueur que le corps et devient plus sombre vers son extrémité. Les mains et les pieds sont dotés de grands blocs digitaux utilisés pour s'accrocher aux branches. La masse corporelle moyenne pour cette espèce est d'environ 500 grammes.

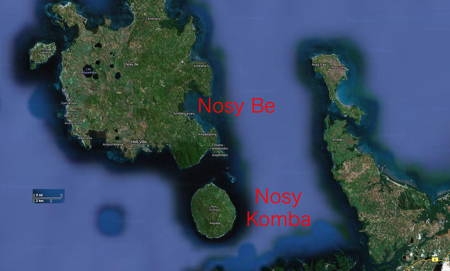
De tous les lépilémurs, cette espèce montre l'une des distributions les plus limitées. Le Lémur à dos gris vit dans les forêts humides de la région de Sambirano dans le Nord-Ouest de Madagascar, y compris la presqu'île d'Ampasindava et les îles de Nosy Be et Nosy Komba. C'est dans cette dernière île qu'ont été pris les clichés de cet article. Il s'agit d'une espèce arboricole et nocturne. Le Lémur à dos gris se déplace à travers la forêt en grimpant et en sautant dans les arbres.
Le Lémur à dos gris est une espèce folivore (mangeur de feuilles), bien qu'il puisse également se nourrir de fruits et d'écorce pour compléter son régime alimentaire. Cette espèce est aussi un cæcotrophe, ce qui signifie qu'il réingère ses excréments, ce qui facilite la décomposition de la cellulose contenue dans les feuilles et la rend plus digeste. Toujours en rapport avec la digestion de la cellulose, il est muni d'un cæcum important qui abrite des bactéries adaptées à la lyse de la cellulose.
Le Lémur à dos gris vit en famille, première forme de cohésion sociale. Le groupe de base est composé de la mère et sa progéniture. L'espèce est polygame mais le mâle vit en solitaire et son territoire chevauche ceux d'une ou de plusieurs femelles. Il visite chaque femelle pendant la saison de reproduction. Tous les ans, la femelle donne naissance à un seul petit qui naît entre septembre et novembre. Quand elle fourrage la nuit, elle délaisse son bébé sur une branche, mais reste en contact avec lui en émettant des cris qui ressemblent à des baisers.
Cette espèce est très territoriale et le mâle adulte défend vigoureusement son territoire. Il émet un appel sonore utilisé comme un appel territorial. L'appel de contact se compose d'une série de sifflements suivis par une vocalise en deux phases. Cet appel est utilisé quand deux congénères sont à proximité l'un de l'autre .
Le Lémur à dos gris est classé comme espèce vulnérable dans la liste rouge de l'UICN.
Documents : photos et vidéo par André Guyard.
Voir également dans le même blog :
Références :
Burton, Frances. 1995. The Multimedia Guide to the Non-human Primates. Prentice-Hall Canada Inc.
Fleagle, John G. 1988. Primate Adaptation and Evolution. Academic Press.
Harcourt, C. and Thornback, J. 1990. Lemurs of Madagascar and the Comoros. The IUCN Red Data Book. IUCN, Gland, Switzerland and Cambridge, U.K.
Petter, A. and Petter, J.J. 1971. Part 3.1 Infraorder Lemuriformes. in The Mammals of Africa : An Identification Manual. Smithsonian Institution Press, Washington, D.C.
Petter, J.J. and Charles-Dominique, P. 1979. Vocal communication in prosimians. in The Study of Prosimian Behavior. eds. G.A. Doyle and R.D. Martin. Academic Press, New York.
Tattersall, I. The Primates of Madagascar. Columbia University Press, New York.
19:56 Publié dans Mammifères | Tags : lémuriens, prosimiens, primates, mammifères, madagascar | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
20/05/2010
Le Lémur noir ou Lémur Macaco
 Le Lémur noir
Le Lémur noir
Eulemur macaco Linnaeus, 1766
par André Guyard
Le Lémur noir est un prosimien malgache de la famille des Lémuriens. Comme tous les Lémuriens, il s'agit d'une espèce protégée. Les spécimens que nous avons rencontrés à Madagascar se trouvaient dans la réserve de l'îlet de Nosy Komba au nord-est de la Grande Île, à proximité de l'île de Nosy Be.
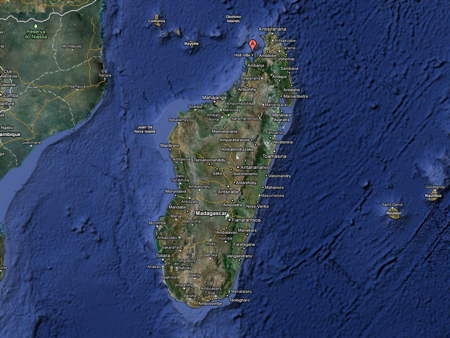
Il existe deux sous-espèces de lémurs noirs, qui se distinguent par la couleur des yeux : brune chez E. macaco macaco, la sous-espèce présentée ici et bleue chez E. macaco flavifrons. Malgré les efforts de Roland Albignac, le spécialiste des Lémuriens qui nous guidait, nous n'avons pas pu observer cette dernière sous-espèce.

Le Lémur noir a une taille moyenne de 90 à 100 cm (41 cm en moyenne pour le corps et 55 cm pour la queue), pour une masse corporelle d'environ 2,4 kg. Il présente un dichromatisme sexuel marqué : les mâles étant entièrement noirs et les femelles brun roux, avec le ventre blanc. Les oreilles sont recouvertes de longues touffes de poils, noires chez les mâles et blanches chez les femelles.
À Nosy Komba, les Lémurs noirs vivent
en bonne intelligence avec les humains
Le Lémur noir (Eulemur macaco macaco) se trouve uniquement au Nord-Ouest de Madagascar dans la région du Sambirano et dans les îles Nosy Be, Nosy Komba et Nosy Tanikely. C'est généralement la seule espèce du genre Eulemur dans ce domaine, cependant certaines zones de sympatrie avec E. fulvus fulvus ont été signalées. Le Lémur noir occupe la forêt primaire, la forêt secondaire dégradée et des plantations de caféiers, d'anarcadiers ou de cacaoyers. Il se nourrit de fruits, de feuilles, de fleurs, du nectar, occasionnellement d'insectes, et ce de façon variable en fonction de la saison. Pendant la saison humide les fruits prédominent dans le régime alimentaire, tandis que pendant la saison sèche les lémurs consomment certaines fleurs et feuilles qu'ils délaissent pendant d'autres parties de l'année.

Une femelle dans le feuillage
Le Lémur noir présente une activité cathémérale, c'est-à-dire qu'il présente des périodes significatives d'activité ayant lieu à la fois pendant les phases claires et obscures du cycle journalier.
Chez le Lémur noir, comme chez les autres lémuriens, la reproduction est saisonnière. La saison des accouplements s'étend de avril à juin à Madagascar. La maturité sexuelle est atteinte vers l'âge d'un an et demi, mais les jeunes ne se reproduisent généralement qu'à partir de la seconde saison de reproduction suivant leur naissance c'est-à-dire vers deux ans et demi. Le cycle œstral des femelles dure 33 jours, avec un œstrus de 3 jours pendant lequel la période de réceptivité est extrêmement courte : de quelques heures à 2 jours. Les femelles peuvent donner naissance à un ou deux jeunes après un temps de gestation moyen de 128 jours. La gestation a donc lieu pendant la saison sèche et les naissances au début de la saison humide.

Le Lémur noir vit en groupes multimâles multifemelles, de taille restreinte de l'ordre d'une dizaine d'individus en moyenne. L'organisation sociale de cette espèce se caractérise par une dominance des femelles : dans un contexte agonistique, toutes les femelles de Lémur noir peuvent supplanter tous les mâles de leur groupe. Cette caractéristique est partagée par un certain nombre de prosimiens malgaches dont le plus connu est le Maki catta.
Chez Eulemur macaco macaco les signaux de communication visuelle se résument essentiellement à des postures, des mouvements (de la queue en particulier) et de rares mimiques faciales. En revanche, ces animaux passent une grande partie de leur temps à échanger des signaux chimiques et sonores.
Pour en savoir plus : Wikipedia.
Documents : photos et vidéo : André Guyard.
Voir également dans ce même blog :
15:17 Publié dans Mammifères | Tags : lémuriens, mammifères, primates, lémur macaco, prosimiens | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Grand Hapalémur
 Le Grand Hapalémur
Le Grand Hapalémur
(Prolemur simus)
par André Guyard
dernière mise à jour : 27/05/2013
Nouvelle naissance d'un Grand Hapalémur au jardin zoologique du Muséum de la Citadelle de Besançon !
La naissance le 20 avril 2010 d'un Grand Hapalémur au jardin zoologique du Muséum de la Citadelle de Besançon constituait déjà un événement exceptionnel.
Exploit renouvelé où un couple de grands Hapalémurs a donné naissance à un nouveau petit.

Le petit..."grand hapalémur" est pour l'instant bien accroché au pelage de sa mère. Il y restera jusqu'à l'âge de deux mois. Mais les visiteurs du zoo peuvent déjà l'admirer.
En effet, classé en danger critique d'extinction par l'IUCN, le Grand Hapalémur (Prolemur simus) est le lémurien le plus menacé de Madagascar et l'un des cinq primates les plus menacés au monde. L'espèce fut considérée comme définitivement éteinte avant d'être redécouverte en 1986 dans la région de Ranomafana qui deviendra Parc National en 1991. D'autres populations furent découvertes dans les années suivantes, mais une étude publiée en 2008 tire la sonnette d'alarme en dénombrant moins de 60 exemplaires sauvages, dont seulement 4 pour le Parc national de Ranomafana !
À ce maigre effectif s'ajoute une trentaine d'animaux en captivité. Tous font l'objet d'un programme de sauvegarde, auquel participe le muséum de la citadelle de Besançon.

Bébé Hapalemur simus
(cliché Anna Feistner)
Une population de sauvegarde a été établie en captivité dès 1987 puis 1993 mais elle ne compte qu'une vingtaine d'individus dans le monde, dont la famille de quatre hapalémurs hébergée par le Muséum de Besançon au sein de la Citadelle, une famille heureuse de vous faire parrt de cette nouvelle naissance. Depuis, le bébé hapalémur reste fermement accroché au ventre de sa mère, Sorja, une femelle de 10 ans née en captivité au zoo de Vincennes à Paris et qui s'en occupe très bien.
Le Grand Hapalémur a un pelage gris brun (comme Hapalemur griseus). Les mâles mesurent jusqu'à 45 cm pour un poids de 2,400 kg à l'âge adulte. Il se distingue facilement des autres espèces par ses touffes de poils blancs sur les oreilles que les autres espèces n'ont pas. Sa face est aussi plus allongée, et on le trouve souvent au sol, alors que les autres espèces y vont rarement.

Hapalemur simus dans le parc de Ranomafana
(cliché Anna Feistner)
Le Grand Hapalémur vit dans les forêts de Madagascar et il est particulièrement menacé par l'activité humaine, comme le déboisement à des fins agricoles ou la construction de routes. Il se nourrit presque exclusivement de la moelle des tiges d'une espèce de bambou géant (Cathariostachys madagascariensis appelé localement volohosy à Madagascar). Il ouvre la tige, la déchire en petits morceaux et en déguste la moelle. À défaut, il peut consommer d'autres bambous, des fruits et même des champignons.
Voir également sur ce blog d'autre sujets sur les lémuriens :
Le Lémur noir ou Lémur macaco,
Sources :
Conférence de Anna Feistner, responsable du Centre Valbio à Ranomafana, Madagascar. Anna Feistner est une spécialiste de la conservation des primates.
09:23 Publié dans Mammifères | Tags : lémuriens, madagascar, muséum citadelle besançon | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
19/05/2010
Les demoiselles coiffées des Hautes-Alpes
 Les demoiselles coiffées des Hautes-Alpes
Les demoiselles coiffées des Hautes-Alpes
Théus et Savines
par André Guyard
Dans les Hautes Alpes, les glaciers quaternaires ont charrié des débris morainiques repris par les rivières. Ces débris constituent une espèce de brèche (conglomérat à éléments grossiers) plus ou moins compactée.
Dans cette région, la vallée de la Durance se présente comme une vallée glaciaire typique dont le profil en U a été taillé par les glaciers quaternaires.
Au-dessus des épaulements qui dominent les rives de la Durance, les vallons affluents sont comblés par des alluvions. Il s'agit d'un mélange "fluvio-glaciaire" qui s'est déposé en marge de la langue de glace qui s'écoulait dans la vallée principale (et barrait donc les écoulements de ces affluents).
L'entaille de la Durance et le ravinement corrélatif par ses affluents latéraux a occasionné la remise à nu, dans les basses pentes, du substrat rocheux ou bedrock (ici gypses et dolomies triasiques) des anciens vallons qui avaient été comblés au wurmien.
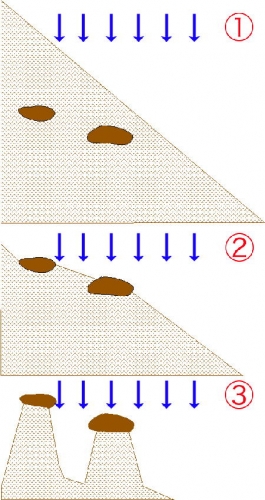
Ces moraines et ces alluvions contiennent de gros blocs largués par le glacier. Dans ces terrains hétérogènes (argiles et blocs), une cristallisation sous les blocs, combinée au ruissellement des eaux pluviales qui arrache et emporte les éléments instables, a entraîné la formation de demoiselles coiffées ou cheminées de fée. Les blocs forment ainsi un toit protecteur qui met à l'abri les alluvions plus meubles de leur soubassement. Ces demoiselles coiffées, sont nombreuses dans le vallon de Théus et au bord de la retenue de Serre-Ponçon à Savines le Lac.

Ces creusements récents (moins de 30 000 ans) se poursuivent toujours et ces cheminées de fée grandissent au fur et à mesure que le sol s'abaisse autour d'elles.
Des paysages remarquables à Théus et à Savines
Ces paysages s'ils restent modestes par rapport à Bryce Canyon (Utah) et à la Cappadoce (Turquie) n'en sont pas moins attachants.
Documents photos et vidéo : André Guyard
07:13 Publié dans Géologie-hydrogéologie-Climatologie | Tags : demoiselles coiffées, cheminées de fée | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
17/05/2010
Paysages de la Cappadoce
 Paysages de la Cappadoce
Paysages de la Cappadoce
par André Guyard
La Cappadoce est célèbre à cause de ses paysages ruiniformes exceptionnels montrant une densité impressionnante d'habitations et d'églises troglodytiques et de villes souterraines. Ces attraits naturels et culturels sont pour une bonne part liés à l'histoire géologique de la Cappadoce et à l'exploitation par la nature et par l'Homme, de formations géologiques singulières.

Habitations troglodytiques

Eglise troglodytique à Göreme

Un éboulement permet d'observer la structure d'une cité souterraine
voir également la cité souterraine de Deryncuju

La Cappadoce (vue satellite Google Maps)
L'histoire géologique de la Cappadoce n'est pas très ancienne et remonte au Miocène (vers 10-15 millions d'années). Depuis cette époque, la Cappadoce a été le plus souvent une région topographiquement déprimée et occupée par des lacs, dont on retrouve les traces sous forme de sédiments fins, dont les argiles utilisées par les potiers du secteur d'Avanos.

La Cappadoce au soleil levant

Survol en mongolfière de la Cappadoce
Depuis le Miocène et jusqu'à la période préhistorique, une activité volcanique très importante s'est développée dans toute la région. Sont encore visibles les deux grands volcans Hasan Dağ, à proximité d'Aksaray et Erciyes, à proximité de Kayseri. Ces deux volcans ont une morphologie bien préservée car ils sont très récents (autour de 2 millions d'années probablement, les dernières éruptions datant probablement de la période préhistorique). Cependant ils ne constituent qu'une partie infime en volume du volcanisme de Cappadoce et dans 2 ou 3 millions d'années, l'érosion les aura fait disparaître du paysage.

Le volcan Hasan Dağ
Les formations volcaniques de la région sont pour l'essentiel plus anciennes et sont des ignimbrites vulgairement appelées tufs volcaniques. On appelle ainsi des dépôts de particules volcaniques (pyroclastes) de taille infra-millimétrique (cendres) à centimétrique (ponces), mis en place par des écoulements pyroclastiques, c'est-à-dire des écoulements biphasés où le milieu de transport des particules est le gaz émis par l'éruption. Les ignimbrites sont typiquement produites par des éruptions explosives de grand volume : chaque dépôt ignimbritique a ainsi un volume de quelques centaines voire milliers de km3 et couvre une surface de dizaines ou centaines de milliers de km2.
Au cours des éruptions ignimbritiques, on observe systématiquement la formation d'un immense cratère, ou caldeira, dont le diamètre va typiquement de 5 à 15 km. Cette caldeira se forme par effondrement des roches qui surmontent le réservoir magmatique (en général à quelques kilomètres seulement sous la surface terrestre), lorsque ce réservoir se vide de ces énormes volumes de magma.
En Cappadoce, les études géologiques ont montré qu'il existe 7 à 8 ignimbrites principales d'au moins 500 km3 chacune, mises en place entre 14 et 3 millions d'années environ. Les caldeiras qui ont accompagné les éruptions de ces ignimbrites ne sont plus visibles dans le paysage et sont depuis longtemps comblées par les phénomènes d'érosion et de sédimentation. La plupart étaient concentrées dans la zone entre Nevşehir et Derinkuyu. Il est donc faux d'attribuer ces grandes formations ignimbritiques aux volcans Hasan Dağ ou Erciyes comme on le trouve souvent écrit à tort.
Les ignimbrites sont des formations clastiques, assemblages chaotiques de ponces et de débris de roches dans une matrice cendreuse. Meubles (et chaudes!) au moment de leur dépôt, elles peuvent s'indurer à des degrés divers. Dans certains cas, elles se compactent fortement dès leur dépôt et les particules encore à haute température peuvent se souder entre elles, donnant finalement une roche très compacte et très dure : les unités ignimbritiques nommées Valibaba Tepe et Kızılkaya dans la stratigraphie de la Cappadoce, en sont d'excellents exemples. Dans d'autres cas, elles restent relativement tendres et friables, comme par exemple les unités Zelve et Cemilköy de Cappadoce. Ce sont ces variations de résistance mécanique, faible dans certaines ignimbrites, meilleure dans d'autres, qui ont été utilisées en Cappadoce, par la nature pour donner les reliefs ruiniformes et les cheminées de fée, par l'Homme pour creuser les habitations troglodytiques et les villes souterraines.

La demoiselle est coiffée d'un bloc plus dur
Les cheminées de fée typiques (appelées demoiselles coiffées dans la région d'Embrun en France) sont formées d'une colonne surmontée d'un bloc, ce bloc étant constitué d'une roche plus dure et plus résistante à l'érosion. Le ruissellement par les eaux de pluie tend à contourner ce casque et à affouiller les roches tout autour, pour former finalement la colonne que le bloc protège. La force du vent a également un impact non négligeable tout comme la succession de périodes de gel et de dégel qui détruit la roche par dilatation.
Le poids de la roche dure qui surplombe la colonne renforce également la résistance de la colonne. En effet, le poids du casque applique une pression interne sur les couches de la colonne. Cela conduit à un compactage des roches qui renforce la résistance. Des phénomènes de calcification des colonnes permettent également d'améliorer la résistance.



Différentes étapes de la formation des cheminées de fée
Pour en revenir à la Cappadoce, la petite ville d'Ürgüp, cœur de la Cappadoce touristique, et d'autres villages touristiques des alentours (Uçhisar, Ortahisar, İbrahimpasa par exemple), sont installés dans l'unité stratigraphique la plus ancienne, dénommée Kavak dans la stratigraphie régionale. Il s'agit en fait d'un ensemble de plusieurs unités ignimbritiques, séparées localement par des cordons d'alluvions de rivière ou d'autres sédiments, mais le tout est relativement homogène, donnant des entaillements fortement pentés voire subverticaux de roches à teinte jaunâtre, dans lesquelles se développent facilement des cheminées grossières et irrégulières.
Plus au Nord, on observe le passage des ignimbrites Kavak à l'unité ignimbritique sus-jacente, dite Zelve. Au site même de Zelve, les cheminées de fée sont formées dans la partie sommitale de l'unité Kavak et sont coiffées de fragments d'un dépôt plus induré et moins friable qui correspond aux retombées de ponces marquant le début de l'éruption Zelve.
L'ignimbrite Zelve se voit au-dessus et alentour, formant des versants irrégulièrement et finement incisés dans une roche plus tendre, blanche dans sa partie basse puis passant progressivement vers le haut à des teintes rose à rougeâtre, cette variation de teinte étant due à l'oxydation des minéraux ferreux de l'ignimbrite par les eaux d'infiltration.
Des bancs subhorizontaux de calcaire lacustre plus dur surmontent et protègent l'ignimbrite Zelve dans ce secteur, formant le sommet des collines résiduelles en rive gauche du Kızılırmak.
La vallée d'Ilhara est un autre site touristique de la Cappadoce, dans sa partie occidentale. Là, une vallée verdoyante est limitée par des falaises verticales où des niches troglodytiques perchées à différents niveaux semblent inaccessibles. Dans ce site pittoresque, les falaises sont entaillées dans l'une des ignimbrites supérieures de la Cappadoce, l'ignimbrite Kızılkaya, âgée d'environ 5 millions d'années. Cette ignimbrite est la plus étendue de Cappadoce et se retrouve jusqu'en limite du bassin de Kayseri. C'est aussi la plus résistante à l'érosion, car elle est fortement soudée. Elle forme ainsi le sommet des plateaux, marqués par une petite falaise de 5 à 10 de mètres de haut, autour du bassin d'Ürgüp. À Ilhara, l'ignimbrite Kızılkaya a été canalisée dans une vallée à l'époque de sa mise en place et se trouve sur-épaissie.
Voir également sur ce même blog : Bryce canyon et Les demoiselles coiffées des Hautes-Alpes
Photos et vidéo : André Guyard
Texte : d'après Jean-Louis Bourdier
Sources :
Documents locaux.
Bourdier J.-L. La Formation des Paysages de Cappadoce. Université d'Orléans, Dépt. de la Science de la Terre, BP 6759 / 45067, Orléans.
18:32 Publié dans Géologie-hydrogéologie-Climatologie | Tags : cappadoce, églises troglodytiques, cités souterraines, cheminées de fée, demoiselles coiffées | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
15/05/2010
La Tortue d'Hermann
 La Tortue d'Hermann
La Tortue d'Hermann
Testudo hermanni Gmelin, 1789
Famille des Testudinidés
par André Guyard
Le site de Perge (Antalya Turquie) est célèbre pour ses vestiges romains. En particulier le stadium présente une construction en fer à cheval qui pouvait accueillir 12 000 visiteurs.
C'est dans ce stade antique, qu'en mai 2010, j'ai vu courir des tortues (elles sont sportives, ces tortues turques !). Il s'agit en fait de tortues à carapace très bombée et arrondie, s'élargissant légèrement vers l'arrière atteignant 25 cm. Les écailles vertébrales sont étroites, les médianes pratiquement carrées et nettement bombées chez l'adulte. La coloration de la carapace est d'un jaune plus ou moins mêlé de verdâtre ou de brunâtre, avec des zones sombres d'étendue variable. Il s'agit probablement de la Tortue levantine Testudo ibera que l'on peut confondre avec la Tortue d'Hermann, espèce protégée que l'on rencontre en France et qui se fait rare dans les Maures où elle est victime des feux de forêt.
On trouvera une description détaillée de la Tortue levantine sur le site Tortues du monde.

Pour l'instant, intéressons-nous à la Tortue d'Hermann.
La Tortue d'Hermann est la seule tortue terrestre de France où elle est présente dans la plaine et le massif des Maures (Var), et en Corse.
Elle se présente sous deux sous-espèces :
* La sous-espèce occidentale : Testudo hermanni hermanni. C'est la plus petite. Elle mesure de 18 à 20 cm à la taille adulte (le mâle étant légèrement plus petit que la femelle). Les écailles sont jaunes tachées de noir. La queue est plus longue chez le mâle. La Tortue d'Hermann se distingue des autres tortues par les bandes de couleur noire continues sous le plastron. En Europe, elle vit de l'Espagne à l'Italie, en passant par les îles méditerranéennes (Sardaigne, Corse, Baléares). C'est la sous-espèce la plus menacée, et elle est d'ailleurs classée comme « en danger » par l'IUCN.
* La sous-espèce orientale : Testudo hermanni boettgeri. Elle est plus grande que la sous-espèce occidentale (sa taille peut atteindre 28 cm, et son poids 3 à 4 Kg). Les bandes sous le plastron sont plus clairsemées. Sa tête va de la couleur marron à noir, avec de fines écailles ainsi que sur les pattes avant munies de 5 griffes. Elle vit en Europe du Sud-Est : Croatie, Macédoine, Roumanie, Bulgarie, Grèce et Turquie.

On peut confondre la Tortue d'Hermann avec la Tortue mauresque (Testudo graeca) et la Tortue levantine (Testudo ibera). La Tortue d'Hermann se distingue de la Tortue mauresque, par la scission médiane de l'écaille supracaudale, et par le tubercule corné et creusé de sillons qui orne l'extrémité de la queue, particulièrement chez le mâle.
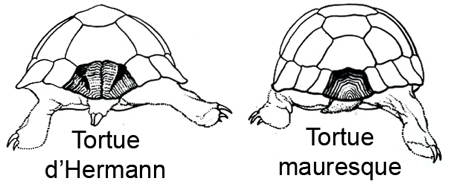
La pointe de la queue porte une ou deux grandes écailles lisses, et non de nombreuses petites écailles comme chez la Tortue mauresque. La face postérieure du bras ne possède pas d'éperons. Sur la face antérieure des avant-bras, les écailles sont plus petites que chez la Tortue mauresque.

Chez les adultes, la distinction des sexes est facile : le plastron du mâle est concave et sa queue est nettement plus longue que celle de la femelle, qui a le plastron plat. La forme concave du plastron du mâle lui permet de se maintenir sur le dos de la femelle lors de l'accouplement.
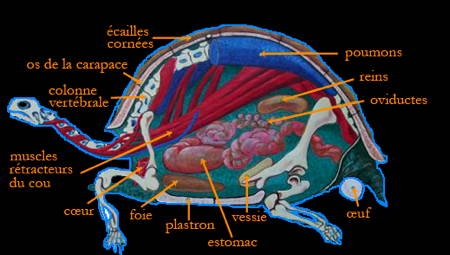
Anatomie de la Tortue d'Hermann
La Tortue d'Hermann peuplait originellement l'est du bassin méditerranéen. Son aire de répartition s'est élargie en quelques endroits, et s'étend des Baléares, de la Sardaigne et de la Corse à l'ouest jusqu'au Danube, en passant par les Balkans. Cette espèce vit également au sud et à l'ouest de l'Italie, et dans le sud de la France ainsi qu'en Sicile. Dans certaines de ces régions, c'est un animal très rare.
Espèce peu exigeante, elle peuple dans son aire de répartition les habitats les plus divers. On la trouve dans le maquis, dans les prairies maigres et sur les versants montagneux couverts d'herbe ; aussi bien sur les plateaux que dans les plaines du littoral, dans les forêts claires et dans les dunes envahies de broussailles, mais aussi sur les terres cultivées, à condition qu'elles présentent des murets de pierres, des buissons et des emplacements secs et sablonneux. La Tortue d'Hermann semble avoir trouvé dans les ruines romaines un biotope de choix.
La Tortue d'Hermann se nourrit essentiellement de verdure, qu'elle broute à l'aide de sa mâchoire cornée très tranchante. Son intestin renferme des bactéries qui participent à la digestion de cette nourriture riche en cellulose et en fibres, améliorant l'absorption des substances nutritives.
Cette alimentation végétale fournit à la tortue l'eau dont elle a besoin. À l'occasion, elle ne dédaigne pas dévorer des coléoptères, des vers, ou même la chair d'un animal mort. Des cas de coprophagie ont également été observés. Pour faciliter la digestion du bol alimentaire, les tortues, comme certains granivores, avalent de petits cailloux, qui aident l'estomac à broyer les plantes.
La température idéale supportée se situe entre 20 et 30 °C. Pour l'atteindre, les tortues s'exposent longuement au soleil le matin. Quand leur corps est assez réchauffé, elles commencent à chercher de la nourriture. Les peuplements de tortues ne peuvent se développer que si les températures estivales sont élevées, mais, quand il fait trop chaud, la tortue cesse toute activité pour estiver. Elle s'abrite à l'ombre pendant les grandes chaleurs de midi. Si les hautes températures subsistent, la tortue s'enterre dans le sol, et son métabolisme de base se ralentit tout comme pour l'hibernation. Ses besoins en eau étant largement couverts par la nourriture, elle se rend rarement au bord de l'eau pour boire. Mais, quand la sécheresse estivale persiste, elle aime se désaltérer dans les flaques.
À la fin de l'automne, la tortue choisit alors un emplacement abrité où elle s'enterre pour hiverner, mettant toutes ses fonctions vitales au ralenti jusqu'à la belle saison. La température corporelle descend alors aux alentours de 5 °C. L'hibernation dure environ 6 mois et brûle 10 à 40 g de la réserve de graisse d'un animal.
Au printemps, la Tortue d'Hermann sort de son abri hivernal et commence par se débarrasser des excréments qu'elle a accumulés pendant l'hiver. Le réveil printanier dépend d'un programme interne, il est peu influencé par les conditions extérieures. La tortue qui s'éveille se met à la recherche de nourriture, broutant les jeunes pousses riches en vitamines et se réchauffe au soleil printanier. La croissance qui en résulte se traduit par une zone d'accroissement claire sur la carapace, mais qui ne peut être prise en considération pour déterminer l'âge puisqu'il peut y avoir plusieurs poussées de croissance par an.
Testudo ibera (Tortue levantine)
Cette époque de grande activité du printemps est aussi celle des amours. Après la fin de l'hivernage et la première phase d'alimentation intensive, les mâles se mettent à errer à la recherche d'une femelle disposée à s'accoupler. Il n'est pas rare que plusieurs mâles se rencontrent et se combattent. Ils cherchent à se repousser par des chocs violents. Les femelles sont également traitées avec rudesse. Pour immobiliser sa partenaire, le mâle lui donne des coups de carapace, lui mord les pattes et en fait le tour plusieurs fois. L'accouplement est chose difficile : le mâle glisse souvent sur la carapace de sa partenaire. La copulation peut se dérouler quand la femelle s'est suffisamment rétractée dans sa carapace. Le mâle pousse alors, la gueule grande ouverte, d'étranges cris qui ressemblent aux jappements d'un petit chien ou aux plaintes d'un chaton.
Quelque temps après la fécondation, la femelle se met à creuser, avec ses membres postérieurs, un trou où elle pond ses œufs. Une jeune femelle ne pond que 1 ou 2 œufs, une femelle plus âgée peut en pondre jusqu'à 10. Avec son plastron et ses pattes arrières, la tortue recouvre sa ponte de terre, nivelant le sol.
Les œufs blancs ont une coquille dure et une forme quelque peu allongée. L'éclosion survient après une durée variable selon les conditions, généralement plusieurs mois. Les jeunes tortues qui sortent des œufs ont la carapace arrondie et nettement marquée de dessins. Elles mesurent environ 3,5 cm de longueur.
Les toutes jeunes tortues sont la proie de nombreux prédateurs. Une fois adultes, leur carapace les protège assez bien. Parfois, elles sont dévorées par des oiseaux de proie ou des renards, Mais l'ennemi principal des tortues terrestres est l'Homme.
Les personnes intéressées par la Tortue d'Hermann pourront consulter avec profit le site Tortue de terre.
Sources :
Diesener G. & J. Reichhof (1994) - Batraciens et Reptiles. Ed. France Loisirs.
21:41 Publié dans Herpétologie | Tags : tortue, chéloniens, tortue d'hermann, turquie, reptiles | Lien permanent | Commentaires (2) | ![]() Facebook | | |
Facebook | | |
14/05/2010
Le Lézard fouette-queue
 Le Lézard fouette-queue
Le Lézard fouette-queue
Uromastyx aegyptia Forskål, 1775
Famille des Agamidés
par André Guyard
Au cours d'un circuit en Cappadoce (Turquie) en mai 2010, j'ai eu l'occasion de filmer un fouette-queue qui se prélassait au soleil sur un replat d'une cheminée de fée.

Le genre Uromastyx comprend une quinzaine d'espèces réparties dans les régions désertiques ou semi désertiques du nord-ouest de l'Inde au sud-ouest de l'Asie, du Moyen-Orient à la péninsule arabique ainsi que dans les régions du Sahel, de l'Ethiopie et de la Somalie.

Le Fouette-queue se caractérise par une queue épineuse en forme de pomme de pin dont il n'hésite pas à se servir en cas de menace : il tente alors de "fouetter" l'intrus ou le prédateur au moyen de sa queue.
Fouette-queue filmé dans la vallée de Derben (Cappadoce)
(mai 2010)
C'est un lézard diurne, craintif qui s'expose volontiers au soleil matinal ou de fin de journée en évitant les fortes chaleurs.
Il habite les biotopes arides et pierreux et creuse de longs et profonds terriers.
Il se nourrit de végétaux, essentiellement de plantes annuelles et de vivaces, ainsi que de fleurs, feuilles et gousses de fabacées.
22:41 Publié dans Herpétologie | Tags : lézard fouette-queue, uromastyx aegyptia, agamidés, reptiles, squamata, sauriens | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
11/05/2010
La ville souterraine de DERINKUYU (Turquie)
La ville souterraine de DERINKUYU (Turquie)
En 1963 à Derinkuyu (Turquie, Cappadoce, province du Nevşehir), une vieille maison était en rénovation. Lors des travaux dans la cave, un mur a été abattu. Derrière ce mur, se cachait une chambre dont personne n'avait connaissance. Et cette chambre appartenait à une cité troglodytique tout entière !

Reconstitution de la cité troglodytique
(document DR)

(document DR)

Puits atteignant la nappe phréatique
(document DR)

Archéologues au travail
(document DR)

Chambres de repos
(document DR)

Passage entre deux niveaux
(document DR)

(document DR)

(document DR)

(document DR)

Passage avec sa porte circulaire
(document DR)

(document DR)

(document DR)

(document DR)
Depuis cette date, huit étages ont été explorés. Les niveaux supérieurs abritent principalement des salons et des chambres à coucher, mais on découvre plus en profondeur des étables, un pressoir à vin, un monastère et même une église au dernier niveau.

Étable
(document DR)
Un ingénieux système d'aération permettait aux hommes et aux animaux d'y cohabiter sans riquer de mourir d'asphyxie. Toute une cité qui pouvait loger environ 20 000 personnes.
Les archéologues pensent qu'il devrait exister une cinquantaine de villes comme celle-ci en Cappadoce. Derinkuyu est même connectée à la ville souterraine adjacente de Kaymakli par un tunnel de huit kilomètres.
Pazrmi les nombreuses théories sur l'existence de Derinkuyu, est que cette ville souterraine aurait abrité les Chrétiens pendant leur persécution par l'Empire ottoman. L'existence de grandes portes circulaires en pierre situées dans les tunnels d'accès principaux qu'on pouvait rouler pour obturer les boyaux de communication, soutiennent cette hypothèse.
En revanche, d'autres archéologues estiment que Derinkuyu est une ville souterraine bien plus ancienne qui aurait été construite il y a 4000 ans par les Hittites.
Images du Net
10:07 Publié dans Paléontologie - archéologie | Tags : turquie, cappadoce, villes troglytiques | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
23/04/2010
Le Manchot de Magellan
 Le Manchot de Magellan
Le Manchot de Magellan
Spheniscus magellanicus Forster, 1781
Famille Spheniscidae
par André Guyard et Marcel Hoeuillard
Le Manchot de Magellan (Spheniscus magellanicus) est une espèce de manchot sud-américain qui se reproduit sur les côtes de l'Argentine, du Chili et sur les îles Malouines.


Il constitue l'espèce la plus nombreuse appartenant au genre Spheniscus. Ses cousins les plus proches sont le Manchot du Cap, le Manchot de Humboldt et le Manchot des Galapagos.


Le Manchot à œil jaune ou Manchot antipode
(Megadiptes antipodes) vit en Nouvelle-Zélande
Quant au Manchot de Magellan, il est de taille moyenne (45 cm), et de couleur noir et blanc. Il a une tête noire entourée d'une bande blanche. Il a le dos gris-noirâtre et le ventre blanchâtre, avec deux bandes noires entre la tête et la poitrine, la bande inférieure en forme de fer à cheval inversé.
Il se nourrit de poisson, calmar, krill, et autres crustacés.


Les clichés qui illustrent cet article ont été réalisés en janvier 2010 dans la réserve de Punta Tombo (Argentine). D'une superficie de 2,10 km2, cette réserve a été créée en 1972. Elle se situe sur la côte atlantique de la province de Chubut.
Punta Tombo est une étroite frange rocheuse de 3 km de long pour 600 m de large qui pénètre dans l'Océan Atlantique. Ce cap rocheux prononcé est dû à l'existence d'un affleurement de roche cristalline, d'origine préjurassique, qui a résisté à l'érosion marine. Sur ce substrat on trouve de vastes zones de sable fin mais compacté, ce qui constitue un terrain idéal pour que les manchots puissent creuser leur nid. De vastes zones du sol sont littéralement minées de cavités de faible profondeur, où les manchots déposent chaque année leurs œufs et élèvent leurs poussins.

La pente douce de ces plages, facilite beaucoup le déplacement terrestre des oiseaux, qui plusieurs fois par jour effectuent le trajet entre leur nid et la mer pour s'y alimenter.
Précédant les femelles, les manchots mâles reviennent sur la plage à la fin du mois d'août et reprennent possession du nid utilisé la famille année après année. Au début du mois d'octobre, les femelles pondent deux œufs, qu'elles couvent avec les mâles pendant quarante jours. Pendant cette période, le couple se relaie pour s'alimenter et surveiller le nid. Toute inattention est utilisée par des goélands (gaviotas) et autres oiseaux pour s'alimenter aux dépens des œufs. À la fin du mois d'avril, les poussins ont appris à nager et à s'alimenter par eux-mêmes, et entreprennent avec leurs parents leur périple annuel dans l'Atlantique sud.
L'année suivante fin janvier, les juvéniles passent deux semaines à terre sans se nourrir pour acquérir leur plumage adulte définitif.






Gorfous sauteurs (Cliché Marcel Hoeuillard)
On a comptabilisé à Punta Tombo la présence de plus d'un million de Manchots de Magellan, ce qui fait de la réserve la plus grande colonie (en espagnol pingüinera) continentale de cette espèce.
D'autres espèces d'oiseaux nidifient aussi en ces lieux. Citons le Goéland cuisinier cocinera (Larus dominicanus) ou gaviota, le Goéland gris ou austral (Larus pacificus), les labbes (Stercorarius antarcticus et chilensis), le Cormoran royal (Phalacrocorax albiventer), le Cormoran de Magellan (Phalacrocorax magellanicus) et l'huîtrier de Garno ou ostrero (Haematopus leucopodus). La réserve est aussi visitée par les colombes antarctiques, les pétrels et les Sternes inca (Larosterna inca) ou gaviotínes.






10:24 Publié dans Océanographie, Ornithologie | Tags : amérique du sud, argentine, patagonie, oiseaux, manchots, spheniscidae | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
17/04/2010
La Moule perlière d'eau douce

La Moule perlière d'eau douce
Margaritifera margaritifera (L. 1758)
Famille des Margaritiféridés
par André Guyard
Pour s'assurer de la qualité des eaux douces, l'Onema inspecte 1500 sites de rivières tous les deux ans et 200 lacs tous les six ans.
La directive-cadre européenne (DCE) exige de définir les équilibres naturels entre espèces ainsi que la productivité optimale d'une rivière. Cette dernière se calcule en kilos de poissons par hectare de rivière. Pour l'instant, on estime qu'une rivière à cyprinidés "produit" de 200 à 600 kilos de poissons par hectare... une fourchette trop vaste pour avoir une idée précise du "bon état écologique" exigé par la DCE. Mais on manque de références historiques comme l'explique Philippe Barran : «La morphologie de presque tous nos cours d'eau a été modifiée depuis la révolution industrielle.»
Pour essayer de définir un bon état écologique de base, la meilleure approche est d'étudier la petite centaine de ruisseaux qui ont traversé les siècles sans dommages : le Chabot, la Lamproie de Planer, l'Écrevisse à pattes blanches et la Moule perlière y vivent encore. Ces quatre espèces sont évaluées dans le Morvan par un programme européen Life. Ces espèces sentinelles de la qualité des sites aquatiques sont appelées espèces indicatrices.
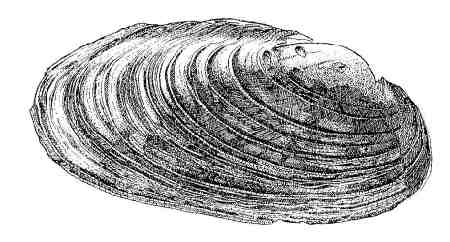
Parmi les espèces indicatrices de la qualité des sites aquatiques d'eau douce est la Mulette perlière ou Moule perlière (Margaritifera margaritifera). En France, son aire de répartition couvre l'essentiel des massifs cristallophylliens du territoire métropolitain français : Massif Armoricain, Massif Central, Morvan, Alpes et Pyrénées, à l'exclusion du bassin du Rhône. Elle était jadis si abondante que ses perles ont orné colliers et parures jusqu'au milieu du XXe siècle. C'est un mollusque lamellibranche des rivières claires d'Europe, de Russie, du Canada et de la façade Est des États-Unis, une espèce désormais protégée et connue pour sa durée de vie exceptionnelle (plus d'un siècle). Dans la nature, on rencontre une perle pour mille individus. À l'occasion du baptême de son fils, le futur Louis XIII, Marie de Médicis exigea une robe entièrement recouverte de milliers de perles venues des rivières françaises. On imagine l'hécatombe engendrée par ce caprice royal !
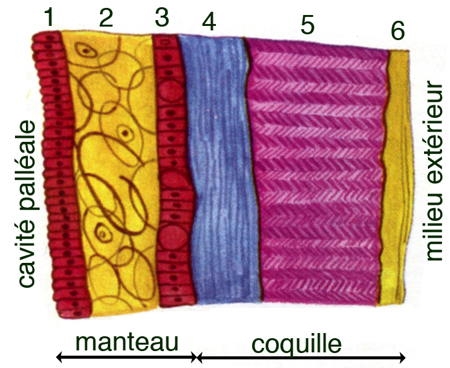
Le schéma ci-dessus montre une coupe de la coquille et du manteau d'une moule.
Le manteau est un repli tégumentaire qui enveloppe le corps de la moule. L'épiderme (en rouge) est replié sur le derme (2 en jaune). Sa face externe (3) secrète la coquille et la face interne (1) limite la cavité palléale.
La coquille présente trois couches : une couche externe : la cuticule ou périostracum (6 en jaune), pellicule cornée formée d'une substance organique la conchyoline ; une couche moyenne ou ostracum (5 en violet), formée de prismes constitués par des lames calcaires noyés dans de la conchyoline ; une couche interne, la nacre ou hypostracum (4 en bleu) formée de minces lamelles de conchyoline imprégnées de calcaire. Les interférences entre les rayons lumineux réfléchis par ces différentes lamelles donnent une irisation particulière à la nacre. Cette couche lamelleuse est sécrétée par toute la surface de la face externe du manteau. De sorte que l'accroissement en épaisseur de la coquille est due uniquement à la nacre qui participe à la réparation des brèches de la coquille et éventuellement à la formation de perles englobant des particules introduites accidentellement entre manteau et coquille. Ainsi, le germe d'une perle peut être un fragment de manteau voire un débri de coquille ou même un microinvertébré.

La Mulette est un mollusque lamellibranche qui se reconnaît à sa forme allongée. Les adultes mesurent de 8 à 14 cm et vivent aux deux tiers enfoncés dans le sédiment (sable ou gravier), en position quasi verticale. La Mulette filtre ainsi environ 50 litres d'eau par jour, se nourrissant des particules véhiculées par les courants. Pour résister au froid, elle exige un substrat gravillonnaire, voire sableux, lui permettant de s'enfouir, parfois plusieurs années. Elle est donc très sensible à la sédimentation des rivières constituant son habitat : la baisse des débits, colmatant les fonds, entraîne systématiquement sa disparition, bien qu'on observe parfois des déplacements volontaires de sujets adultes (baisse des niveaux d'eau ou augmentation de la turbidité).
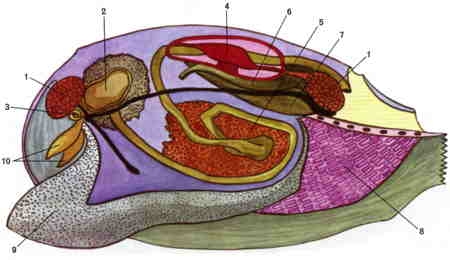
Dissection de la Mulette
Le schéma ci-dessus représente une dissection de la Mulette. 1. : muscles adducteurs ; 2. : estomac ; 3. : bouche ; 4. : ventricule cardiaque ; 5. : gonade ; 6. : canal excréteur ; 7 : rein ; 8. : branchie ; 9 : pied ; 10. : palpes labiaux.
Biologie
L'espèce a besoin d'une eau bien oxygénée pour assurer un cycle de reproduction complexe. "Cela impose qu'on ne perturbe pas la morphologie d'une rivière et que les eaux restent pures. Deux conditions qui n'ont cessé de reculer", explique Pierre Durlet, gérant du programme du Morvan. La France aura donc atteint le bon état écologique de ses eaux quand on reverra en bijouterie des colliers de perles de moule. C'est en tout cas le but recherché par les écologues. Les gestionnaires de l'eau se contenteraient de beaucoup moins.
Le cycle de vie de la Moule perlière est associé à celui de la Truite fario et à celui du Saumon atlantique, car les larves du mollusque se développent à l'abri des branchies de ces poissons, et uniquement de ceux-ci.
Les sexes sont séparés. Pour la reproduction, le mâle libère ses spermatozoïdes dans l'eau, ils rejoignent alors les ovules, très abondants de la femelle. Après fécondation, l'œuf commence son développement dans la cavité palléale de la femelle. Il évolue en une larve, nommée glochidium, qui est incubée par la femelle pendant un mois. La taille de 0,05 mm atteinte, la larve est libérée dans le cours d'eau. Le glochidium est doté d'une coquille bivalve pourvue d'un crochet recourbé à l'intérieur et d'une sorte de filament adhésif. Cette larve va se fixer sur l'appareil branchial d'une Truite fario ou d'un Saumon atlantique, provoquant chez son hôte la formation d'une tumeur où se développe le glochidium, qui se nourrit par la surface de son manteau. Cette phase parasitaire dure en général quelques semaines (jusqu'à 10 mois), temps au bout duquel le glochidium devient un véritable bivalve en miniature de 0,5 mm. La larve s'enkyste alors dans les sédiments durant plusieurs années et poursuit sa croissance, pour atteindre sa maturité sexuelle à 20 ans.
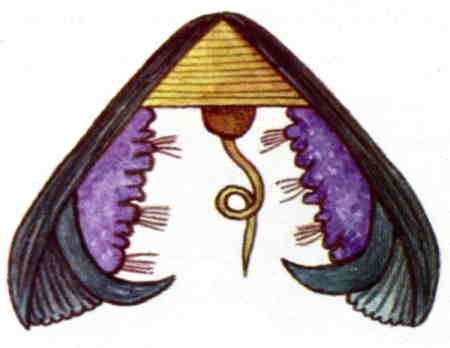
La larve glochidium
La longévité de cette espèce est remarquable, puisqu'elle varie entre 20 et 30 ans pour les individus vivant dans les eaux plus chaudes du sud de l'Europe, à plus de 150 ans pour ceux de Scandinavie.
État des populations
Cette moule constitue un excellent indicateur écologique. L'habitat de la Moule perlière correspond à des eaux fraîches, courantes, pauvres en calcaire, à fond de gravier ou de sable mais dépourvu de vase. Elle tolère très mal la présence de phosphates, ne supporte pas des eaux avec plus de 5 mg/l de nitrate et ne peut se reproduire avec plus de 1 mg/l ! (rappelons que la norme autorisée est 50 mg/l).

En tant que filtreur, elle accumule de nombreux toxiques (métaux lourds, pesticides...) qui peuvent la tuer ou nuire à ses capacités de développement et de reproduction. Il est possible que les perturbateurs endocriniens soient également un facteur de régression de l'espèce, comme c'est démontré pour d'autres mollusques.
La création de lacs de retenue (absence de courant), de microcentrales électriques (changement des débits), les pratiques agricoles (eutrophisation des cours d'eau, pollution par les pesticides, augmentation de l'érosion des sols et par suite de la turbidité), ainsi que l'introduction de truites arc-en-ciel (impropres au développement du glochidium) ont entraîné la quasi-disparition de cette espèce sur pratiquement toute son aire de répartition.
D'où le statut particulier de cette espèce, qui relève de l'annexe III de la Convention de Berne et sa cotation UICN : menacée d'extinction.
Protection
Suite au Grenelle de l'Environnement, la France a prévu un plan de restauration national, à décliner régionalement. La Directive cadre sur l'eau devrait contribuer à la restauration de la bonne qualité écologique des cours d'eau et des bassins versants, mais un certain nombre de paramètres critiques dont la turbidité restent préoccupants, voire montrent une dégradation. Le réchauffement climatique en mettant en été à sec les parties amont de cours d'eau est également un facteur de risque supplémentaire puisque Margaritifera margaritifera dépend de la présence de jeunes salmonidés, Saumon ou Truite fario.
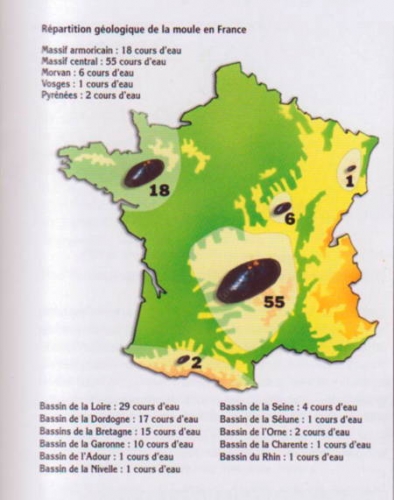
C'est une espèce menacée de disparition en Europe de l'Ouest en 2008. En France, la moule perlière est encore présente dans une centaine de rivières en France suite au recensement réalisé par Gilbert Cochet dans les années 1990.
La production de perles de culture en Chine
En Chine, l'élevage de moules d'eau douce en vue de la production de perles de culture peut se pratiquer en lac naturel, en réservoir ou en étang.

Aquaculture de moules perlières au centre piscicole du District de Qingpu (Shanghai)
(Cliché F.A.O.)
Trois espèces de moules perlières y sont élevées en étang: Hyriopsis cumingi (la meilleure), Cristaria plicata et Anodonta woodiana. Pour provoquer la formation de perles, on implante manuellement, entre le manteau et la coquille de chaque moule perlière, plusieurs dizaines de petits morceaux du manteau de moules sacrifiées. L'on utilise ainsi en moyenne quatre manteaux par moule perlière et un ouvrier spécialisé peut préparer environ 30 moules perlières par jour.


Ces moules sont ensuite placées en étang, suspendues individuellement à un fil vertical. La densité de stockage est de 150-225 individus par 100 m2 de plan d'eau. Après deux étés (température de l'eau 20-25°C), l'on récolte jusqu'à 40-50 perles de culture par moule, en fonction du nombre de noyaux implantés.

La qualité des perles ainsi produites est très variable. Même si, étant principalement destinées en Chine à l'usage médicinal, leur forme et leur qualité n'ont pas la même importance qu'au Japon, leur prix peut varier du simple au triple selon qu'elles se classent en quatrième (700 yuans/kg) ou en première (2 000 yuans/kg) catégorie.


En moyenne, 100 moules perlières produisent 0,5 kg de perles de culture, soit un rendement de 0,75-1,125 kg par 100 m2 d'étang. Le revenu de cette activité aquacole peut donc être intéressant si la qualité des perles produites est bonne, particulièrement lorsque cet élevage se fait en lac naturel et en réservoir où il permet d'intensifier l'exploitation du milieu aquatique sans grand investissement. C'est, par exemple, le cas à la Commune populaire "Libération" (District de Qingpu, Shanghai), qui exploite ainsi le Dianshan Hu et produit annuellement 500 kg de perles.


Un grand merci à Gilbert Cochet, éminent spécialiste de la Moule perlière pour ses envois de clichés photographiques et les corrections apportées à cet article.
Sources :
Cochet G. (2004) La moule perlière et les nayades de France Catiche Productions Ed. 32 p.
Chauveau L. : Les moules perlières jouent les sentinelles (Sciences et Avenir, juin 2009).
Perles de culture en Chine : http://www.fao.org/docrep/005/AD016F/AD016F15.htm
18:56 Publié dans Invertébrés, Limnologie-hydrobiologie, Mollusques | Tags : moule perlière, mollusques, bivalves, eau douce, pollution, bioindicateurs | Lien permanent | Commentaires (19) | ![]() Facebook | | |
Facebook | | |
15/04/2010
Le Canard siffleur
 Le Canard siffleur
Le Canard siffleur
Anas penelope (L. 1758)
Famille des Anatidés
par André Guyard
Le Canard siffleur niche dans l'extrême nord de l'Europe (dans la taïga), jusqu'en Sibérie, et migre pour hiverner dans le sud de l'Angleterre, sur les côtes françaises et espagnoles, de l'Italie, des Balkans, de l'Afrique du Nord.
Le Canard siffleur doit son nom à son cri caractéristique : il cancane, caquette, nasille et surtout émet un sifflement constitué de brèves syllabes, terminé par une note grave.
Vidéo enregistrée en Islande (juillet 2008)
Oiseau très sociable, il vit exclusivement en troupes qui, en hiver, fréquentent lacs, marais d'eau douce et fleuves. En période de reproduction, le Canard siffleur se cantonne dans les tourbières et les marécages situés à proximité d'une importante couverture boisée. Il choisit des prairies humides pour la nidification.

La formation des couples s'effectue dès l'arrivée sur les terres d'hivernage. A la fin de l'hiver, le début de la reproduction dépend de la photopériode, c'est-à-dire par l'augmentation de la luminosité et de la durée des jours, mais aussi par une multitude d'autres facteurs : qualité de l'habitat et abondance des ressources en nourriture. Le nid, construit d'herbes et de tiges, est dissimulé dans les hautes herbes, sur la terre ferme, à une grande distance de l'eau.

L'incubation débute après la ponte du dernier œuf et dure 25 jours en moyenne. C'est la femelle qui couve et s'occupe de l'alimentation de la couvée, le mâle passant la majeure partie de son temps sur l'eau.
Les petits sont nidifuges et quittent le nid environ 24 heures après l'éclosion. L'émancipation intervient au bout d'une quarantaine de jours.

La diversité des endroits fréquentés implique une grande variété dans les habitudes alimentaires. Le Canard siffleur choisit des secteurs où l'abondance d'insectes et de flore émergente est la plus grande. Il broute flore aquatique et terrestre, mais ne néglige pas insectes aquatiques (libellules et trichoptères) mais aussi insectes terrestres et de coléoptères. C'est également un consommateur opportuniste, filtrant les matériaux remontés à la surface par les canards plongeurs et les foulques grâce aux lamelles situées dans la partie supérieure de leur mandibule inférieure.
Source :
09:23 Publié dans Limnologie-hydrobiologie, Ornithologie | Tags : anas penelope, canard siffleur, anatidés, islande, oiseaux | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
14/04/2010
Le Grand Labbe
 Le Grand Labbe
Le Grand Labbe
Stercorarius skua
Famille : Stercorariidés
par André Guyard
Le Grand Labbe ressemble à un gros goéland brun. Parmi les autres espèces de labbes, il est plus lourd avec une envergure plus grande et une queue plus courte. Son plumage est identique toute l'année : brun noirâtre avec des écussons blancs frappants à la base des rémiges primaires. Le bec et les pattes palmées pourvus d'ongles arqués sont noirs.

Le Grand Labbe est une espèce pélagique qui vit presque toute l'année au large et ne se rencontre sur le rivage que pendant la période de reproduction. Sociable durant cette période, il est solitaire le reste de l'année. C'est un migrateur qui, au début de l'automne, quitte son aire de reproduction (Islande, îles Féroé, îles du nord de l'Ecosse et de la Grande-Bretagne) et se disperse dans l'Atlantique jusqu'au tropique du Cancer.
Les Grands Labbes nichent de préférence à proximité de la mer, dans les landes à une altitude variable. Pour faire leur nid, ils se rassemblent en petites colonies ou restent en couples isolés. Le nid, construit par le couple, est une simple dépression creusée dans le sol et doublée de débris d'herbes et d'autres matériaux. La ponte a lieu fin mai, début juin. Il n'y a qu'une seule couvée dans l'année. La taille de la ponte est généralement de 2 œufs qui revêtent une coloration brun-olive ou jaune grisâtre, tachetés de brun. Les petits naissent avec un duvet brun jaunâtre plus pâle dans sa partie inférieure. Ils sont semi-nidifuges, c'est-à-dire qu'ils quittent le nid assez précocement mais il en demeurent à proximité et dépendent encore des adultes pour leur subsistance.

Les Grands Labbes sont de redoutables prédateurs qui prélèvent des poissons, des petits mammifères, des œufs, d'autres oiseaux. Ils s'attaquent notamment aux jeunes macareux, aux guillemots, aux fous. Ils sont aussi d'habiles cleptoparasites, se montrant très agressifs à l'égard des autres oiseaux marins, en particulier les sternes arctiques, les harcelant implacablement jusqu'à ce qu'ils lâchent ou régurgitent leurs proies qu'ils récupèrent avant qu'elles ne tombent à l'eau.
La vidéo ci-dessus montre successivement un Labbe inquiet de voir les visiteurs s'approcher de son poussin, le poussin lui-même, un couple de Labbes et les attaques de Labbes sur les Sternes arctiques destinées à s'emparer des proies de ces derniers.
Photos et vidéo André Guyard, réalisées en Islande (juillet 2008).
Sources :
08:26 Publié dans Océanographie, Ornithologie | Tags : labbe, islande, oiseaux marins, stercoraire | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
01/04/2010
Les provocations de Claude Allègre
Outrés par les propos de Claude Allègre dans son dernier livre, L'imposture climatique, mettant en cause leurs travaux, 400 chercheurs se sont adressés au Ministre de tutelle, Valérie Pécresse pour dénoncer la position de l'ancien directeur de l'I.P.G. On doit rappeler que Claude Allègre n'en est pas à son coup d'essai de ses prévisions erronées : lors de l'éruption phréatique de la Soufrière de la Guadeloupe et contrairement aux avis de l'équipe Haroun Tazieff, c'est lui-même qui avait préconisé le déplacement en vain de 76 000 personnes pendant plus de six mois ?
L'analyse du livre par des journalistes de Sciences et Avenir, fustige l'ancien ministre.
 Les provocations de Claude Allègre
Les provocations de Claude Allègre
par David Larousserie et Rachel Mulot
Accusations non étayées, attaques ad hominem : loin de toute démarche scientifique, l'ancien ministre, climato-sceptique déclaré, dérape dans sa démonstration.
Le succès médiatique du dernier livre de Claude Allègre, L'imposture climatique, porté par une vague de « climato-scepticisme » (lire Sciences et Avenir, n° 757, mars 2010), oblige à revenir ici sur les erreurs et les manipulations qui l'entachent. Si la critique a des vertus, l'auteur osant revêtir les habits de Galilée -, hoqueter les mêmes arguments (vapeur d'eau, températures passées, etc.) en ignorant les réponses qui leur ont été apportées ne relève en rien d'une démarche scientifique. Le géochimiste feint toujours de confondre météorologie et climat, trouve dans les hivers froids un argument éclatant contre le réchauffement, alors qu'un réchauffement terrestre ne signifie pas une hausse linéaire des températures en toutes saisons et en tous lieux, comme l'expliquent les spécialistes.
Réfutant un lien dominant entre les dégagements d'origine humaine du CO2, et le climat, il écrit : "Tous les graphiques utilisés pour défendre cette idée se sont révélés faux et truqués." Or, leur fausseté n'est pas démontrée à ce jour, pas plus que le trucage, qui est une accusation grave. Et les preuves sont justement absentes de ce livre. Claude Allègre vitupère ainsi une courbe des températures passées dessinée en 1998 par l'Américain Michael Mann, mais passe sous silence le fait qu'une commission d'examen, certes critique, en a validé les principales conclusions et que d'autres équipes ont corroboré ces résultats depuis. Le Giec lui-même loin d'être l'institution "mafieuse", opaque et fermée aux débats qu'il décrit ne cache d'ailleurs pas dans son rapport de 2007 les discussions suscitées par ces reconstructions de températures. Enfin, en janvier dernier, une autre commission a blanchi ce chercheur de toute accusation de manipulation de données.
Claude Allègre n'échappe pas non plus aux contradictions. Tout en prétendant que les modélisations numériques sont incapables de prédire le climat, il développe ses propres prévisions en affirmant que le réchauffement sera bénéfique. "Les récoltes de blé en Ukraine [...] seront meilleures, qui s'en plaindra ? Les sols gelés de Sibérie vont se transformer en forêts : est-ce une menace pour la planète ?" À ce sujet, signalons que le dégel émettra du méthane, puissant gaz à effet de serre. Autre point navrant : les attaques ad hominem. Selon lui, le climatologue français Jean Jouzel, membre du Giec, n'aurait pas mérité sa médaille d'or du CNRS ; le climatologue américain Michael Mann serait ignorant des méthodes statistiques ; l'économiste britannique Nicholas Stem aurait été anobli par complaisance, etc. À marcher en mocassin sur la banquise, comme le montre le photomontage de couverture, on finit par déraper.
L'imposture climatique ou la fausse écologie, Claude Allègre avec Dominique de Montvalon, Plon, 293 p., 19,90 €.

Allègre fait la une de Charlie Hebdo
Commentaires :
Certains points de la "démonstration" de Claude Allègre méritent certaine attention.
Les mesures de température relevées au XIXe siècle n'avaient pas la précision des mesures actuelles. La lecture de thermomètres se faisait au degré près. Alors, comment justifier un réchauffement de 0,6°C quand la précision est de l'ordre de ± 1 °C ! De sorte que la courbe alarmante révélant un réchauffement brutal né lors de la révolution industrielle du XVIIIe siècle, repose sur des erreurs et des forçages…
D'autre part, l'examen des courbes de l'évolution des températures et de celles des variations du taux de carbone dans l'atmosphère révélées par l'analyse des carottes glaciaires montre un décalage dans le temps de ces courbes : celle des températures précédant celle du carbone !
Ces arguments sont repris par Benoît Rittaud dans son ouvrage : Le mythe climatique (Seuil 2010, 210 p., 17 €) dans le quel l'auteur conteste la thèse d'un réchauffement climatique dû aux émissions de dioxyde de carbone en n'omettant pas de citer ses sources.
L'analyse de ce livre a été faite par Didier Gordon (Pour la Science, mai 2010). qui souligne que "l'essentiel du livre est consacré à critiquer ce qu'il nomme le « carbocentrisme ». Selon l'auteur, les climatologues ne pensent pas tous que les émissions carbonées jouent un rôle majeur dans révolution du climat. Les cycles d'éruption solaire, les interactions de l'océan avec l'atmosphère, le fait que la vapeur d'eau contribue plus à l'effet de serre que le dioxyde de carbone, sont des éléments allant contre le carbocentrisme.
Si le carbocentrisme s'est imposé, c'est que la science est dans une période où on lui demande de résoudre des problèmes... À ce compte, elle a intérêt à annoncer des catastrophes et à se faire donner des crédits pour les déjouer. Dès lors, B. Rittaud dénonce l'existence d'une pseudoscience à l'œuvre dans notre société, la «climatomancie». Il en donne la définition que voici : art divinatoire visant à déduire du comportement humain l'avenir climatique de la Terre, dans l'idée de prescrire à chacun des actions de pénitence."
Douche froide pour Claude Allègre
En octobre 2010, en affirmant que l’augmentation du CO2 dans l’atmosphère est liée aux activités humaines, l’Académie des Sciences a infligé à Claude Allègre et aux climato-sceptiques un cinglant désaveu. Depuis l’échec du sommet de Copenhague, les thèses des climato-sceptiques, faisaient la une de l’actualité. Claude Allègre dans son dernier ouvrage, L’imposture climatique mettait notamment en cause « l’objectivité et la qualité » des rapports du GIEC (Groupe intergouvernemental sur l’évolution du climat).
16:45 Publié dans Actualité des Sciences, Environnement-Écologie | Tags : réchauffement climatique, imposture, climat, guadeloupe | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
25/03/2010
La Bernache nonnette
 La Bernache nonnette
La Bernache nonnette
Branta leucopsis (Bechstein, 1803)
par André Guyard
Oie de petite taille, la Bernache nonnette se reconnaît immédiatement à la coloration noire du cou et de la poitrine et à la tête blanche. Le dos est gris barré de noir et le ventre est plus pâle. dessus gris barré contrastant avec un dessous très pâle. La Bernache nonnette a un petit bec triangulaire noir, des pattes noires et un croupion blanc.

En été, la Bernache nonnette fréquente les falaises et les éboulis des îles arctiques. En hiver, elle habite les prés inondés et les marais côtiers, les rives basses des baies maritimes et les vasières à marée basse.
Provenant du Groenland, du Spitzberg et de la Nouvelle Zemble les Bernaches nonnettes commencent leur migration à la fin août ou au début du mois de septembre. Elles atteignent les rivages de l'Ecosse, de l'Irlande, la côte ouest de la Grande-Bretagne et le littoral de l'Allemagne et des Pays-Bas en ce qui concerne le dernier groupe. En France, l'espèce est très rare en temps normal, quelques dizaines d'individus qu'on trouve principalement en baie de Somme ou du Mont St-Michel. Cependant, lors d'hivers très rigoureux, la France a accueilli jusqu'à 8 000 bernaches nonnettes. Son aire de répartition est alors plus vaste et affecte toutes les petites baies et les estuaires abrités.

La saison de nidification commence peu après le retour dans l'Arctique. Les Bernaches nonnettes se réunissent pour nicher en colonies. Le nid, construit principalement de végétaux et tapissé de duvet, est situé sur la corniche d'une falaise, sur un îlot non éloigné du littoral ou à même la toundra dégagée. Le site est parfois partagé avec des guillemots. La femelle y dépose 3 à 5 œufs qu'elle couve seule pendant une période variant de 24 à 25 jours alors que le mâle monte une garde vigilante à proximité. Les jeunes sont actifs dès l'éclosion et savent voler vers 40 ou 45 jours. Le groupe familial reste uni pendant la migration et l'hivernage.
Comme toutes les oies, la Bernache nonnette est végétarienne et broûte les graminées. En hiver, lorsque l'herbe est moins drue, la Bernache mange aussi des algues, des insectes aquatiques, des mollusques et des crustacés. L'espèce se nourrit à toute heure du jour et préfère l'herbe de la zone côtière périodiquement submergée par les flots. Si elle n'en dispose pas, elle se rabat sur les prairies situées en arrière du littoral.
Vidéo et photos : André Guyard
Sources :
Peterson R, Mounfort G., Hollom P.A.D. (1962-. - Guide des Oiseaux d'Europe. 358 p. Delachaux & Niestlé Ed.
http://www.oiseaux.net/oiseaux/bernache.nonnette.html
Une vidéo impressionnante : sortie du nid d'un poussin d'oie bernache
15:03 Publié dans Limnologie-hydrobiologie, Océanographie, Ornithologie | Tags : anatidés, ansériformes, oies, oiseaux, bernache | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
23/03/2010
Les oiseaux du parc national de Celestún (Yucatan, Mexique)
 Les oiseaux du parc national de Celestún (Yucatan, Mexique)
Les oiseaux du parc national de Celestún (Yucatan, Mexique)
par André Guyard
Situé dans l'État du Yucatan à 92 kilomètres de Mérida, le parc national de Celestún s'étend sur 60 000 hectares comprenant l'estuaire d'une rivière et les marais environnants. L'estuaire a 25 kilomètres de long et une profondeur moyenne de 1,50 m. Sa température moyenne annuelle est de 26,2°C.
Le 19 Juillet 1979, le site a été déclaré "Celestún Wildlife Refuge" par le gouvernement fédéral mexicain et, plus tard, en 1986, Patrimoine de l'Humanité par l'ONU. La réserve, qui couvre une variété de milieux humides, est considérée comme l'une des plus grandes zones de mangrove du Golfe du Mexique.

La mangrove est un milieu naturel qui, par l'enchevêtrement des racines des palétuviers rouges constitue une défense naturelle contre l'érosion due aux cyclones et aux tsunamis mais surtout une zone de nursery pour de nombreuses espèces de poissons et de crustacés. Le palétuvier rouge est l'arbre que l'on trouve en bordure de mer. Ses racines échasses constituent un barrage pour les vagues et également un refuge pour de nombreux organismes fixés (huîtres, coraux, ascidies, etc.).
Celestún Nature Reserve est une des plus importantes zones protégées du pays en raison de l'abondance des espèces d'oiseaux indigènes et migrateurs qui s'y trouvent. Le parc de représente une importante aire d'alimentation et de repos pour un grand nombre d'oiseaux migrateurs. Il constitue l'un des deux sites de nidification et de reproduction des flamants rouges des Caraïbes. Dans cette zone de refuge, on a identifié de nombreuses espèces d'oiseaux migrateurs qui arrivent chaque année pour passer la saison d'hiver, comme le Grand Héron, le Canard Chipeau et le Balbuzard pêcheur, entre autres. On y rencontre également pélicans, albatros et cormorans.
Les Flamants de Celestún
La principale attraction de ce parc est la lagune des flamants rouges qui exigent un habitat avec des fonds vaseux, une eau saumâtre et peu profonde. Ils sont protégés des vagues et des inondations. Les lagunes sont bordées par une mangrove dense et luxuriante appelée Ria Celestún.
Pélicans blancs
Dans cette mangrove, on peut apercevoir des singes araignées (atèles) et, avec de la chance, des ocelots. On peut y voir également des tortues.
Cormorans
14:15 Publié dans Limnologie-hydrobiologie, Océanographie, Ornithologie | Tags : mexique, yucatan, celestun, flamants, pélicans, hérons, canards, cormorans | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
19/03/2010
L'Eider à duvet
 L'Eider à duvet
L'Eider à duvet
Somateria mollissima (L. 1758)
Par André Guyard
L'Eider appartient à l'ordre des Ansériformes et à la famille des Anatidés (canards).
L'Eider à duvet se distingue des autres canards par sa grande taille (60 cm), le profil droit de son bec et son vol qui alterne vol battu (vol habituel des canards) et vol plané.

Le mâle présente une calotte noire, une nuque verte, des joues blanc et vert.C'est le seul canard qui possède un dos blanc et un ventre noir.
La femelle présente une livrée brune striée de nombreuses barres foncées.

L'Eider à duvet est un habitant du littoral marin. On le rencontre aussi bien sur les côtes rocheuses ou sablonneuses. En hiver, on peut l'apercevoir occasionnellement à l'intérieur des terres sur les fleuves ou les lacs.
Son aire de nidification se situe sur l'Atlantique Nord, à la limite de la banquise. L'Eider à duvet est hivernant en France où on le retrouve sur les côtes de la Manche et en Bretagne. Formidable plongeur qui récolte crustacés et coquillages jusqu'à 15 mètres.

Le duvet de canard étant depuis longtemps connu pour ses propriétés isolantes, il est récolté après la période de nidification pour confectionner des édredons.
La période de reproduction commence fin mai-début juin. La femelle bâtit son nid tout près de l'eau sur le sable ou dans une anfractuosité de rocher. Il est construit de matériaux divers : débris végétaux, fragments de coquillages, et garni d'une épaisse couronne de duvet de la femelle. Elle y dépose 4 à 6 œufs couvés pendant 25 à 28 jours. Les jeunes sont nidifuges et s'envolent dans un délai de 65 à 75 jours.
Les femelles seules assurent la protection des poussins
Après la période de reproduction, couvaison et soins aux jeunes sont dévolus aux femelles. Pendant ce temps, les mâles se rassemblent en troupes nombreuses qui peuvent dépasser une centaine d'individus.
L'Eider se nourrit surtout de mollusques (moules, coques, bigorneaux mesurant de 7 à 40 mm) et de crustacés (crabes). Cependant, il ne dédaigne pas les insectes aquatiques, les poissons et les échinodermes (étoiles de mer) qui sont des ingrédients courants à son menu. Son alimentation est complétée par divers végétaux qu'il glane sur le littoral.
Vidéos et photos réalisées en Islande en juillet 2008 par André Guyard
Source :
http://www.oiseaux.net/oiseaux/eider.a.duvet.html
12:05 Publié dans Océanographie, Ornithologie | Tags : eider, oiseaux, somateria mollissima, islande, atlantique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
La Conure à gros bec
 La Conure à gros bec
La Conure à gros bec
Rhynchopsitta pachyrhyncha (Swainson, 1827)
par André Guyard
La Conure à gros bec ou Perroquet des pins est une espèce d'oiseau appartenant à la famille des Psittacidae.
Ce perroquet ressemble à un ara dont il reproduit le comportement criard. Il mesure environ 38 cm. Il possède un corps robuste et trapu. Son plumage est vert avec des marques rouges sur le front, au-dessus des yeux, aux épaules et sur les culottes. Les cercles oculaires sont jaunâtres et les iris orange. Le bec est noir et les pattes grises.
La coloration rouge est moins étendue et le bec est grisâtre chez le juvénile.

La Conure à gros bec est un perroquet au gros bec noir de taille moyenne, allant jusqu'à 38 cm de longueur, au plumage vert vif avec des taches rouges sur le front, les épaules et les cuisses. Les yeux des adultes sont jaunes, tandis que les jeunes ont les yeux bruns.

Couple de conures à gros bec
La Conure à gros bec vit en zone tempérée dans des forêts de pins et de sapins, entre 1200 à 3600 mètres d'altitude. Son aire de répartition se limite à la Sierra Madre occidentale du Mexique et à la Californie.
L'espèce niche dans les cavités des arbres, occupant surtout les anciens trous de pics. Elle se nourrit surtout de graines de différentes espèces de pins, si bien que leur vie dépend de la production de cônes. D'ailleurs, la reproduction se produit au moment de la maturation des graines de pin. Ces perroquets montrent un comportement grégaire et les troupes se déplacent en fonction de l'abondance des cônes.
Conures à gros bec filmés à San Francisco
L'espèce est en voie de disparition et figure sur la liste rouge de l'UICN des espèces menacées. Ses effectifs sont estimés à seulement 1000-4000 couples. Cependant, cette espèce de perroquet indigène des États-Unis est relativement commune en captivité dans beaucoup de zoos à travers le monde. Ces oiseaux ont été réintroduits sans succès en Arizona dans les années 1980, mais cet effort s'est avéré infructueux, les perroquets étant victimes des prédateurs naturels.
Vidéo et photos : André Guyard octobre 2009 en Californie
Sources :
fr.wikipedia.org/wiki/Conure_à_gros_bec
Vidéo et photos : André Guyard
09:10 Publié dans Ornithologie | Tags : oiseaux, perroquet, conure, usa, californie, psittacidés, perroquets | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
18/03/2010
Les Iguanes dans la province caraïbe
 Les Iguanes dans la province caraïbe
Les Iguanes dans la province caraïbe
par André Guyard
Cette famille de reptiles est caractéristique de l'Amérique du Sud, de l'Amérique Centrale et de la partie sud de l'Amérique du Nord.
Les deux genres Iguana et Anolis sont bien représentés aux Antilles.
Le genre Iguana comporte deux espèces :
- Iguana Iguana est l'Iguane vert que l'on trouve en Amérique du Sud et, en ce qui concerne les Antilles, en Basse-Terre et aux Saintes ;
- Iguana delicatissima ou Iguane comestible se rencontre aux Saintes, en Grande-Terre, à la Désirade, Saint-Martin, Saint Barthélémy, Martinique, Dominique.

Iguana iguana (cliché R. Butler)
Le genre Anolis est représenté aux Antilles par quatre espèces:
- Anolis marmoratus, présent en Guadeloupe avec 11 sous-espèces ou races locales :
- Anolis roquet présent en Martinique avec 6 races locales ;
- Anolis gingivus présent à Saint-Martin et à Saint-Barthélémy ;
- Anolis wattsi rencontré à Saint-Martin et à Trinidad.

Anolis marmoratus mâle déployant son fanon
(cliché P. Nyman)
La famille des Iguanidés appartient au sous-ordre des Sauriens qu'on peut assimiler aux Lézards et à la super-famille des Iguanoïdes caractérisée par une peau écailleuse et des paupières mobiles.
Œil d'Iguane et ses paupières
(d'après Ph. Currat)
Les Iguanidés comprennent des "Lézards" à vie terrestre et arboricole dont les membres sont terminés par des doigts munis de griffes bien développées favorisant le déplacement dans les arbustes et les arbres. La queue, plus longue que le corps, est comprimée latéralement. La langue de tous les Iguanidés est épaisse, courte et charnue.

Iguana delicatissima des Saintes (Guadeloupe)

Face dorsale de la tête d'un Iguane montrant l'emplacement de l'œil pinéal
L'œil pinéal est parfois bien visible. Il s'agit d'une vésicule, située sous la peau dans le trou pariétal du crâne au niveau de l'épiphyse. Cette vésicule limite un cristallin et une rétine à bâtonnets internes chez certains Reptiles actuels : genre Sphenodon de Nouvelle-Zélande, genres Lacerta (lézards) et Anguis (Orvets) d'Europe et peut alors être assimilée à un organe visuel. Cependant, chez la plupart des Sauriens actuels, l'œil pinéal est réduit à une vésicule sans structure oculaire.
Tous les représentants de cette famille sont mimétiques par homochromie. Plusieurs pigments dermiques leur permettent de changer de couleur et de se confondre avec le milieu (protection contre les prédateurs).
L'épiderme est protégé par des écailles épidermiques et limité à sa base par la couche germinative de Malpighi.
Coupe de la peau d'un Iguane montrant les écailles épidermiques
(d'après Ph. Currat)
Sous-jacent à l'épiderme, le derme, épais, contient de nombreux chromatophores à noyau central et cytoplasme ramifié, étoile, riche en pigments tégumentaires. Dans chaque chromatophore, sous l'influence de différents facteurs : illumination, stimuli visuels, chimiques, nerveux, hormonaux, les pigments peuvent soit se disperser dans le cytoplasme, ce qui a pour effet d'assombrir le chromatophore et la peau par effet de masse, soit se rassembler autour du noyau et éclaircir le chromatophore et la peau.
Chez les Iguanidés, trois types de chromatophores sont responsables des variations de coloration.
- Les lipophores ou xanthophores. Ce sont des cellules dermiques, superficielles, situées sous la couche de Malpighi. Ils contiennent des grains de pigments jaune orangé : xanthophylles-caroténoïdes et sont séparés par des gouttelettes lipidiques orangées (avec pigments jaunes ou rouges liposolubles). L'ensemble : lipophores + gouttelettes lipidiques, forme une couche pigmentaire jaune sous-épidermique.
- Les leucophores ou iridophores ou guanophores empilés sous les xanthophores, contiennent des microcristaux de guanine réfléchissant la lumière.
- Les mélanophores. Ce sont des cellules plus profondes, à cytoplasme digité très contractile qui contiennent un pigment granuleux brun-noirâtre : la mélanine. Ce pigment, normalement situé dans le cytoplasme périnucléaire, peut, dans certains cas, se disperser dans toute la cellule ou. se concentrer au maximum autour du noyau.
Le mécanisme de la régulation chromatique et le contrôle de cette régulation sont plus ou moins complexes suivant les espèces. En général, lorsque la lumière solaire traverse un milieu hétérogène (derme contenant les chromatophores), les radiations de grande longueur d'onde (rouges) sont absorbées; les autres radiations du spectre sont réfléchies par les guanophores, puis traversent les lipophores étalés ; les lipophores arrêtent les radiations bleues et violettes ; seul le vert est réfléchi et le saurien apparaît vert ou bleu vert lorsque lumière et chaleur ont des valeurs modérées (la teinte bleue, réfléchie, a pour origine des phénomènes d'interférence de la lumière, au niveau des cristaux de guanine, donnant une coloration irisée, et la diffraction des ondes courtes bleues en milieu hétérogène).
Cette teinte bleu vert est modifiée quand les mélanophores interviennent. S'ils se rassemblent au maximum dans les mélanophores contractés, les radiations sont peu absorbées, et les guanophores et lipophores étalés assurent la dispersion totale de la lumière avec abondance des radiations jaunes : la peau apparaît jaunâtre. Au contraire, si les granules de mélanine se dispersent dans la cellule étalée, la couleur de fond de la peau s'assombrit de même que les autres teintes : le saurien paraît gris-gris brun. En général cette livrée grise est fréquente à l'ombre ; lorsque la chaleur est excessive ou trop basse, la livrée devient brun sombre.
Chromatophores. A : pigment concentré (livrée claire). B : pigment dispersé (livrée sombre)
En conclusion, les changements de coloration de la livrée permettent aux Iguanidés de se dissimuler aux yeux des prédateurs et de jouer un rôle important dans la thermo-régulation.
Le genre Iguana
Tête d'Iguana delicatissima
(d'après Ph. Currat)
Les deux espèces d'Iguanes, présentes dans les îles et îlets antillais, sont protégées car en voie de disparition. Elles sont originaires du Nouveau-Monde, en particulier de l'Amérique Centrale tropicale. L'introduction de l'espèce Iguana iguana dans les Antilles françaises est postérieure à celle de l'espèce Iguana delicatissima. La prolifération actuelle de l'Iguana iguana met en péril la seconde espèce.

Tête d'Iguana iguana mâle
Les deux espèces vivent dans les régions basses, chaudes et sableuses, au voisinage des points d'eau ; elles ont donc des biotopes semblables mais se rencontrent rarement simultanément.

Tête d'Iguana iguana mâle avec le fanon étalé
Elles sont présentes toutes deux dans les îlets des Saintes : Terre de Haut, Ilet à Cabris, La Coche. Ailleurs, elles forment isolément, des peuplements reliques.
- En Basse-Terre, l'espèce Iguana iguana se rencontre essentiellement dans les Monts Caraïbes au Massif du Houelmont.
- À la Désirade, l'espèce Iguana delicatissima fréquente les ravines de la côte Nord et la région des Galets ; elle s'aventure rarement sur le plateau central.
- En Martinique, l'espèce Iguana delicatissima se trouve dans les forêts du Nord de l'île et sur l'îlet Chancel dans la baie du Robert.

Iguana delicatissima
Les Iguanes sont des Sauriens pouvant atteindre 1,60 m de longueur totale et peser 15 kg.
Le corps est trapu, comprimé transversalement. La tête est puissante avec deux yeux protégés par des paupières bien développées. Toute la surface du corps est couverte d'une peau écailleuse de teinte verte chez les mâles, grise chez les femelles (dimorphisme sexuel). Les deux espèces antillaises diffèrent par la disposition des plaques écailleuses autour des yeux et par la taille des écailles tympaniques : chez Iguana iguana. Les écailles tympaniques sont rondes et de grande dimension. Une crête écailleuse dorsale et caudale, formée d'épines libres et plus ou moins molles, s'étend de la tête à la queue. La face ventrale du cou porte un fanon dentelé épineux. Crête dorsale et fanon sont plus développés chez les mâles que chez les femelles (caractères sexuels secondaires permanents). La queue est longue et atteint les 2/3 du corps. Elle est garnie d'écailles souvent plus épaisses et présentent un bord coupant. - Les quatre membres pentadactyles, grêles, "hauts", sont terminés par des doigts fins et inégaux munis de griffes crochues et puissantes. Au niveau de la face interne des fémurs, chez les Iguanes mâles, des pores fémoraux rejettent une sécrétion de nature cireuse contenant des xanthophylles d'origine alimentaire.
Extrémités des membres d'un Iguane
A : membre antérieur gauche, B : membre postérieur gauche
(d'après Ph. Currat)
Les Iguanes sont des Sauriens diurnes et arboricoles, localisés dans un territoire précis. Lorsqu'ils partent à la recherche de leur nourriture, ils sont guidés par leur odorat et les mouvements de leurs proies. Leur régime alimentaire peut être très varié : insectivore, carnivore - œufs et oiseaux -, mais les Iguanes sont surtout herbivores végétariens et marquent une préférence pour les fleurs, les fruits et les feuilles de Mapou (genre Cordia). En captivité, il est possible de les alimenter avec des fleurs, des fruits et de la salade.
La prise de nourriture est assurée par de fortes mâchoires munies de dents insérées sur le bord interne des maxillaires - dents à trois pointes spatulées - et par leur langue épaisse charnue, courte et large, villeuse, gluante, lobée antérieurement, et adhérente à la mâchoire inférieure par une large surface.
Le schéma ci-dessous montre le crâne d'un Iguane. À noter que maxillaire et dentaire sont munis de dents munies de trois pointes. 1 : prémaxillaire, 2 : maxillaire, 3 : nasal, 4 : préfrontal, 5 : frontal, 6 : postorbitaire, 7 : pariétal, 8 : squamosal, 9 : carré, 10 : basioccipiatal, 11 : prootique, 12 : supraoccipital, 13 : dentaire, 14 : coronoïde, 15 : supraangulaire, 16 : articulaire, 17 : angulaire.
Crâne d'Iguana iguana
(d'après Ph. Currat)
Au sol, les quatre pattes grêles et hautes servent à la marche, à la course et au saut. Le mouvement des membres se fait dans un ordre déterminé : au déplacement d'une patte antérieure vers l'avant, succède le déplacement vers l'avant de la patte postérieure du côté opposé. Ainsi, lors d'un déplacement lent, trois pattes seulement reposent suc le sol pendant un court instant. Lors de la course, deux pattes seulement touchent le sol, et le tronc et la queue sont un peu surélevés. Comme chez tous les Sauriens capables de se mouvoir rapidement, la queue de l'Iguane est longue. Lors d'un saut, le corps est projeté vers l'avant ; cette projection est facilitée par les mouvements de la queue. Au-dessus du sol, la disposition et la longueur des doigts - des pattes postérieures surtout - la présence de griffes puissantes, longues et courbes, assurent une progression aisée dans les branches des arbres : l'Iguane grimpe très facilement et peut sauter d'une branche à l'autre ; la queue sert de balancier et maintient l'équilibre. Dans l'eau : l'Iguane nage avec aisance. Les points d'eau, près desquels il vit, constituent des refuges en cas de danger.
Dans leur biotope naturel, les Iguanes sont difficiles à observer du fait de leur mimétisme et de la discrétion de leurs mouvements, lents ou rapides, mais toujours silencieux.
Différents Iguana iguana observés dans le Yucatan
Les mâles, généralement inoffensifs, deviennent belliqueux au moment de la reproduction. L'accouplement a lieu en mars et la ponte se situe de mai - juin à août. Les Iguanes sont ovipares. La femelle change de biotope au moment de la ponte ; dans le sol meuble, le sable, ou un trou au pied d'un arbre, elle dépose, en une seule fois, 15 à 20 œufs ovoïdes (5 cm/ 2,5 cm) à membrane souple. L'incubation des œufs abandonnés par la femelle est fonction de la température ambiante et dure de 6 à 14 semaines. A l'éclosion, les jeunes, de couleur vert-émeraude, ont une crête dorso-caudale peu développée.
Jeune iguane en captivité
L'Iguane est un animal craintif, très vulnérable pendant la mue (mue par lambeaux) au cours de laquelle il apparaît sombre et amaigri. Ses ennemis comprennent les prédateurs naturels occupant le même biotope, et l'homme. La Mangouste dévore ses œufs ; les jeunes Iguanes sont la proie des Mammifères carnivores (Mangoustes - Chats) des Oiseaux et des Hommes, Les Iguanes adultes, comestibles, sont très recherchés, notamment Iguana delicatissima. Lorsqu'il y a danger, l'Iguane prend une teinte sombre, "siffle" et, pour se défendre, peut mordre et utiliser sa queue à écailles coupantes à la manière d'un fouet dangereux. Pour se protéger, l'Iguane s'immobilise, prend la teinte du substrat ce qui le dissimule à la vue des prédateurs ; seule la queue, pendante, de couleur gris brun, est visible. Souvent l'Iguane se déplace dans les épineux xérophiles de son biotope : acacias, campêches, orangers... Il peut fuir rapidement, s'enfouir dans des terriers profonds, sauter dans l'eau lorsqu'il est inquiété.
Note : Les Iguanes rencontrés dans les Antilles françaises diffèrent, par leur biologie et leur morphologie, des Iguanes marins des Iles Galapagos, des Iguanes à queue préhensile d'Amérique du Sud et des Iguanes de la Jamaïque.
Alors qu'ils sont communs en Amérique, les iguanes ne sont présents en Océanie que sur les archipels de Tonga et de Fidji, comment y sont-ils arrivés ? Jusqu'à présent, les biologistes privilégiaient "l'hypothèse du radeau", selon laquelle ce sont des iguanes américains qui auraient colonisé ces îles, traversant le Pacifique sur des débris végétaux. Mais pour Brice Noonan, chercheur à l'université du Mississippi, cette hypothèse ne tient plus. D'abord parce qu'un périple de près de 8000 km apparaît hautement improbable. Ensuite parce que "des éléments géologiques ont révélé que, contrairement à ce que l'on pensait jusqu'alors, ces îles ne sont pas pleinement océaniques: elles ont été rattachées à l'Asie. De ce fait, les iguanes ont pu les coloniser en marchant, il y a environ 40 millions d'années", explique-t-il. Le chercheur vient justement d'établir un arbre généalogique qui montre que les iguanes du Pacifique sont bien plus proches de ceux dont on connaît quelques fossiles en Asie que des iguanes américains. Fidji et Tonga seraient donc le dernier refuge des iguanes asiatiques, qui ont disparu depuis.
Le genre Anolis (en créole = Anoli)
Dans les Antilles françaises, les quatre espèces présentes, appartenant au genre Anolis, se subdivisent au moins en 17 sous-espèces. À la Désirade, certains spécimens ont une livrée verte ponctuée de gris. Les Anolis proviennent des régions intertropicales du continent américain.

Les Anolis sont des Sauriens sédentaires, arboricoles, nombreux dans les arbres et arbustes des régions basses et sèches, dans les zones cultivées, autour des habitations. Ce sont des sauriens de petite taille avec une queue bien développée (12 à 20 cm de longueur totale - corps + queue -, au maximum). Leur corps, comprimé est recouvert d'écailles épidermiques de petite dimension. La couleur de la livrée des Anolis est fonction de la lumière ambiante, de la température du substrat liée d'ailleurs à la luminosité et de l'humeur. La faculté de changer rapidement de couleur est en rapport, comme chez les Iguanes, avec la structure de la peau. Ces changements de teinte assurent, dans certaines limites, la régulation thermique.
Cependant, lorsque la température du substrat, plus importante que la température de l'air, s'éloigne par trop du préférendum thermique, les Anolis changent de milieu. En général, à la lumière et lorsque la chaleur est modérée, la livrée est vert vif ; la teinte s'assombrit et devient gris brun à l'ombre ou lorsque la chaleur est excessive. Chez les Anolis, le mécanisme de la régulation chromatique a fait l'objet d'études expérimentales précises et nombreuses. Il est sous contrôle hormonal et a pour point de départ la réception visuelle de la lumière :
- Une hormone sécrétée par le lobe intermédiaire de l'hypophyse : hormone mélanodispersante = hormone mélanophorodilatatrice = intermédine, provoque la dispersion de la mélanine dans les mélanophores en extension, d'où. assombrissement de la livrée.
- Une hormone antagoniste : l'adrénaline, produite par la zone médullaire des capsules surrénales, concentre la mélanine dans les mélanophores rétractés : l'action de l'adrénaline est suivie de l'éclaircissement de la peau.
Chez les Anolis, le dimorphisme sexuel se traduit dans la taille des individus et la couleur de la livrée.
- Les mâles, verts en général, présente un repli cutané extensible formant un fanon (couteau, majole ou sac gulaire) inséré sous la gorge et tendu sur un cartilage en bâtonnet médio-ventral. Le fanon est blanchâtre, plus ou moins taché ou rayé. Lorsqu'il n'est pas tendu, il apparaît vivement coloré, en rouge-orangé ou jaune, par des ptéridines, lorsqu'il est en extension. Les Anolis mâles déploient leur sac gulaire au cours de parades nuptiales, ou pour avertir et menacer les intrus pénétrant dans leur territoire.
- Les femelles, généralement plus petites que les mâles, ont une teinte plus grise et ne possèdent pas de fanon. Souvent, femelles et jeunes présentent dorsalement une ligne claire plus ou moins festonnée latéralement.

Anolis wattsi mâle

L'Anolis "maître des lieux" se place plus haut que l'intrus, et s'aplatit sur le support pour paraître plus imposant.
- II tend son fanon à plusieurs reprises, et de plus en plus vite, en signe d'avertissement et de menace.
- II effectue des mouvements de la tête, séparés par des extensions du fanon.
- Son excitation se manifeste ensuite par "des pompes" : élévation et abaissement du corps sur les quatre pattes à un rythme rapide, et des balancements d'arrière en avant et inversement.
- Enfin apparaissent les mouvements de la queue, et l'Anolis "maître du territoire", au paroxysme de l'intimidation, sort sa langue lobée et "se coiffe" d'une crête cervico-dorsale menaçante.
L'intrus réplique par le même comportement ou se retire. S'il reste, après les manœuvres d'intimidation, le conbat a lieu et le vaincu prend la fuite. De gris-cendré lors de la phase d'approche, le vaincu devenu gris-jaune bat en retraite, tandis que le vainqueur arbore une livrée d'un vert très vif.
Quand un Anolis pénètre en terrain neuf, en quête de nourriture, il signale sa présence en tendant son fanon.
Iguanidé insectivore, il chasse à l'affût et reste parfois immobile très longtemps avant de saisir ses proies. Lorsqu'il guette ses victimes, en pleine lumière, ses paupières mobiles contribuent à la fermeture du diaphragme pupillaire.
La langue, courte et large, lobée antérieurement, charnue, gluante, aide à la préhension de la nourriture: insectes (mouches et moustiques, pucerons, fourmis, termites, papillons) et arachnides. A l'occasion, l'Anolis peut consommer des fruits : mangues, bananes... et du sucre.

Anolis marmoratus mâle
(cliché R. Hoogveld)
Comme l'Iguane, l'Anolis peut se déplacer à la surface du sol soit en marche lente avec la queue appliquée contre le substrat, soit en marche rapide, course, saut avec la queue surélevée.
Il peut aussi grimper et sauter dans les branches des arbustes et sur les feuilles. Ses quatre membres pentadactyles possèdent des doigts et orteils griffus, munis de coussinets plantaires. Ces coussinets, dilatés et mous, assurent l'adhérence sur les supports lisses et verticaux. L'adaptation à la vie arboricole se manifeste surtout au niveau des membres postérieurs : les pieds très longs possèdent des métatarsiens inégaux et l'orteil externe, éloigné des autres doigts griffus, forme pince avec eux pour saisir les branches.
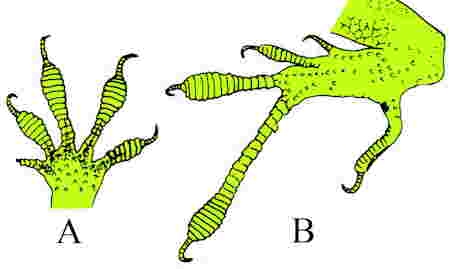
Extrémités des membres d'un Anolis
A : membre antérieur, B : membre postérieur
(d'après Ph. Currat)
Les Anolis sont ovipares. L'accouplement est précédé d'une parade nuptiale, avec extension rythmée du sac gulaire du partenaire mâle, puis mouvements du corps des deux partenaires. Le mâle saisit ensuite la femelle entre ses mâchoires - par le cou ou les flancs - et, au cours de l'accouplement, la retient grâce à l'une de ses pattes postérieures.
Les œufs sont pondus isolément ou par deux (quatre au maximum), de mai à septembre, dans la terre meuble et humide, dans l'humus, sous les feuilles mortes, puis sont abandonnés. Ils sont ovoïdes (1/2 cm de longueur) et protégés par une membrane souple. L'incubation dure de 6 à 10 semaines suivant l'espèce et la température ambiante.
Une particularité intéressante chez Anolis sagrei : les femelles de cet anoli brun ont la possibilité de choisir le sexe de leur progéniture selon la taille du père. Si le mâle est de grande taille, les petits seront mâles. Si le mâle est petit, davantage de femelles viendront au monde. Découvert par des chercheurs de l'université d'Hanover (U.S.A.), ce mécanisme permet de s'assurer que les caractéristiques avantageant les mâles comme la taille, soient bien transmises à des lézards de même sexe.
Les Anolis Sauriens anthropophiles, ont de nombreux prédateurs : Oiseaux ( Merles - Gli-gli = faucons) Mangoustes - Chats - Chiens terriers et hommes. Leur durée de vie, en liberté, ne dépasse pas un an pour 98 % d'entre eux, alors qu'en terrarium, ils peuvent vivre quatre ans.
Les Anolis sont vulnérables à l'époque des mues. Deux fois par an, la couche cornée de l'épiderme se détache par lambeaux (mue mangée par l'animal) et les Anolis moins vivaces et alertes qu'en temps normal, sont la proie de nombreux prédateurs. Les moyens de défense des Anolis sont réduits : avertissement, menace, morsure d'adversaires plus faibles. Leurs moyens de protection sont semblables, en partie, à ceux des Iguanes :
- dissimulation dans le milieu environnant = mimétisme par homochromie ;
- fuite avec ou sans autotomie caudale, (la queue régénérée, souvent de plus petite taille que la queue antérieure, peut être simple ou bifide).
- lorsque le danger ne peut être évité, les Anolis font une chute spontanée et restent immobiles, inanimés, pour feindre une mort apparente.
Sources :
Currat Ph. 1980. Reptiles des Antilles. Bulletin de l'APBG Guadeloupe. 122 p. CDDP Guadeloupe Ed.
16:51 Publié dans Herpétologie | Tags : iguane, anolis, reptiles, antilles, caraïbe, mexique, sauriens | Lien permanent | Commentaires (14) | ![]() Facebook | | |
Facebook | | |
15/03/2010
La Ciguatera aux Antilles françaises
 La Ciguatera aux Antilles françaises
La Ciguatera aux Antilles françaises
par André Guyard
Les touristes qui se rendent en bord de mer en zone intertropicale ignorent pour la plupart l'existence d'un risque encouru en consommant du poisson de mer. Dans certains cas, tout comme la population locale, ils peuvent subir une intoxication alimentaire : c'est la Ciguatera.
1. Historique
La Ciguatera est une maladie singulière provoquée par l'absorption de la chair de plus de quatre cents espèces de Poissons et d'Invertébrés marins. L'intoxication ciguatérique ou ichtyosarcotoxisme fait partie des toxi-infections alimentaires collectives (TIAC). Le nom de Ciguatera viendrait de "Cigua", un petit Mollusque vivant à Cuba et provoquant des troubles analogues.
Cette maladie est connue depuis fort longtemps ; le premier auteur l'ayant signalée fut Martyr en 1555. Christophe Colomb, Vasco de Gama, Magellan l'ont rencontrée dans les Caraïbes au XVIe siècle. Harmensen l'a signalée dans l'Océan Indien en 1601. Les marins de Fernandez de Quiros ont été intoxiqués en 1606 aux Nouvelles Hébrides : l'équipage avait pêché de nombreux poissons dont des "Pargos" (Lutjanidés) ; les matelots qui en mangèrent furent rapidement à toute extrémité. En 1675, John Locke (philosophe anglais) donna une description clinique et épidémiologique de la maladie aux îles Bahamas.
Plus récemment, le 8 mai 1949, 57 Philippins mangèrent aux îles Mariannes une très grosse murène. Tous furent très malades, onze entrèrent dans le coma et deux moururent.
Le 11 juillet 1951 à Terre de Bas (Saintes), 12 personnes de deux familles furent empoisonnées en mangeant une grosse bécune (barracuda). Les malades souffrirent beaucoup. Trois moururent et un autre devint fou trois mois plus tard.
En 1959, la Martinique a eu à déplorer quelques cas graves d'empoisonnement par des poissons pêchés à St Barthélémy.
Le 7 octobre 1960, 58 malades de l'hôpital de Pointe-à-Pitre ont été victimes d'une intoxication collective après avoir mangé de la "Vieille" en court-bouillon et en friture.
Ainsi chaque année dans les îles volcaniques et coralliennes tropicales des trois océans, plusieurs milliers de personnes sont victimes de la Ciguatera. Les Antilles françaises ne sont bien sûr pas épargnées.
Depuis 1992, la DDASS de Guadeloupe recueille, de façon hebdomadaire, les cas de TIAC par l'intermédiaire d'un réseau de surveillance sanitaire, le réseau Sentinelle.
De 1997 à 1999, 28 incidents ciguatériques impliquant 90 personnes ont été déclarés par l'intermédiaire du réseau Sentinelle. L'endémie est variable selon l'année et touche toutes les classes d'âge (46 % des cas recensés concernent les adultes de 30 à 49 ans).
2. Symptômes de la maladie
Les premiers signes d'intoxication surviennent généralement dans les 12 h qui suivent l'ingestion d'un poisson toxique. La Ciguatera est caractérisée par des effets digestifs précoces, cardio-vasculaires transitoires et neurologiques persistants. Le tableau du syndrome ciguatérique en Guadeloupe est similaire à celui observé dans d'autres îles de la Caraïbe ou en Floride avec une prédominance des signes digestifs, de l'asthénie et des paresthésies des extrémités.
Les symptômes cliniques de la Ciguatera apparaissent dans les heures suivant l'ingestion des poissons. Ils sont aussi bien gastro-intestinaux que neurologiques. Le début est marqué par des vomissements, diarrhées, crampes intestinales ; ensuite viennent des sensations alternatives de chaud et de froid, un goût amer dans la bouche, l'engourdissement de la langue et des lèvres, l'endolorissement des mâchoires avec sensation de perdre les dents, des douleurs dans les articulations, de fortes démangeaisons dans les membres et une fatigue musculaire très nette. On observe de plus une baisse de la tension artérielle, un ralentissement et une irrégularité du rythme cardiaque, une dilatation de la pupille.
Les atteintes cardio-vasculaires, (hypotension et bradycardie) ainsi que les troubles de la sensibilité comme l'inversion de la sensation de chaud et de froid interviennent également mais dans des proportions moindres. Certains signes comme le prurit et les signes neurologiques, peuvent se déclarer plusieurs jours après l'ingestion du poisson.
Dans les formes graves, on peut observer une incoordination des mouvements, des difficultés respiratoires ou urinaires, des troubles visuels. Les cas mortels sont exceptionnels et consécutifs à un état de choc cardiovasculaire.
En général l'évolution est favorable en une semaine environ, mais il n'est pas rare que les troubles de la sensibilité, les douleurs et les démangeaisons persistent plusieurs semaines et soient ravivées par toute nouvelle consommation trop hâtive de poisson même sain (hypersensibilisation). Des malaises neurodigestifs chroniques et des lésions de grattage subsistent d'où le nom de "gratte" donné parfois à l'affection. La durée moyenne de rétablissement paraît être de six mois environ.
Remarque : L'empoisonnement par la Ciguatera diffère dans ses origines comme par ses symptômes des autres sortes d'empoisonnements dus à des poissons comme les Tetraodontidae (Tetrodon sphaeroïdes), les Scombridae (thazards) ou des empoisonnements alimentaires causés par une contamination bactérienne (poissons avariés).
3. Traitements
Dans toutes les îles où sévit la Ciguatera existent des traitements locaux utilisant les propriétés de certaines plantes. Bien souvent ces médications empiriques soulagent les malades et aident à leur guérison.
Aux Antilles françaises et aux îles Vierges on utilise des infusions faites avec des feuilles de Passiflora foetida (Passifloracées), de Rhizophora mangle (Rhizophoracées), de Conocarpus erectus (Combrétacées).
Henri Stéhlé signale également des plantes efficaces comme Bontia daphnoïdes (Myoporacées), Annona muricata (Annonacées), Ricinus communis (Euphorbiacées).
La patate douce râpée crue mélangée à du lait frais et le jus de papaye donneraient aussi de bons résultats.
Pour le docteur Bagnis, chef de l'Unité Océanographique Médicale à l'institut Louis Malardé de Tahiti, les médicaments les plus efficaces sont les sels de calcium, l'atropine, les vitamines du groupe B, les antihistaminiques de synthèse et les corticoïdes dont l'indication respective est fonction des symptômes.
4. Quelques observations faites à propos de la Ciguatera
La Ciguatera est inconnue dans les zones tempérées. Les zones où l'on trouve des espèces toxiques sont nombreuses et très diversifiées (bancs coralliens, récifs barrières, lagons, etc.) mais elles sont souvent limitées.
Aux Bahamas, aux îles de la Société, les poissons de l'un des versants des îles sont beaucoup plus dangereux que ceux de l'autre côté. Les zones accores (à pente rapide) situées au vent ou à l'Est sont plus dangereuses que les zones sous le vent et peu profondes. Une zone toxique peut devenir saine après une longue période de toxicité et inversement.
La phase aiguë d'une recrudescence de Ciguatera classique couvre une période de dix à quinze ans. Les poissons toxiques sont des poissons de récif ou des poissons prédateurs de ces derniers. Les plus dangereux sont les grands prédateurs. À l'intérieur d'une même espèce, plus le poisson est gros, plus il a de chance d'être toxique. Toutes les parties du poisson n'ont pas la même toxicité, le foie et les viscères sont toujours plus toxiques que la musculature. Un poisson très frais peut être toxique. Un poisson peut être toxique à n'importe quelle époque de l'année. Le mode de préparation ou de cuisson ne modifie pas la toxicité.
5. Causes de la Ciguatera
Pendant très longtemps les causes de la maladie sont restées mystérieuses et de nombreuses croyances ont essayé de les expliquer. Certaines sont totalement fantaisistes comme celle affirmant que les vertus toxiques se développent si les poissons ont été exposés au clair de lune. Une autre, encore persistante, suppose qu'une substance chimique contamine le milieu ; le cuivre est le plus souvent impliquée probablement parce que des navires à coque doublée de ce métal ont coulé et parce que des dépôts naturels de cuivre ont été associés à des poissons vénéneux. Cette hypothèse n'explique pas pourquoi des poissons toxiques sont trouvés très loin de ces sources chimiques et pourquoi tous les poissons de la zone ne sont pas dangereux.
Ce n'est que vers 1958 que l'on a commencé à entrevoir la solution en impliquant des toxines sécrétées par des microalgues microscopiques. Les symptômes de la Ciguatera sont dus à l'imbrication plus ou moins marquée d'un mécanisme pharmacologique et d'un mécanisme immunologique résultant de l'action isolée ou conjuguée de toxines ; trois principales ont été mises en évidence.
- La ciguatoxine (C.T.X.) isolée à Hawaï dans les muscles d'une grosse murène et trouvée ensuite chez de nombreux autres poissons. Elle est très active et une dose de 0,1 pg produit des troubles chez l'Homme ;
- La scaritoxine (S.T.X.) isolée à Tahiti en 1976 chez un poisson perroquet (Scarus) est également très toxique ;
- La maitotoxine (M.T.X.) isolée en 1975 au Japon dans les viscères d'un poisson chirurgien. On ne la trouve que dans les viscères des poissons herbivores. Il semble qu'elle puisse se transformer en C.T.X.
Gambierdiscus toxicus Adachi and Fukuyo, 1979 (microalgue dinoflagellée) est l'agent causal principal de la Ciguatera dans la province caraïbe et en Polynésie française. Il a été découvert par T. Yasumoto et R. Bagnis aux îles Gambier à la fin des années 1970. Pour cette raison, les auteurs l'ont appelée Gambierdiscus toxicus.
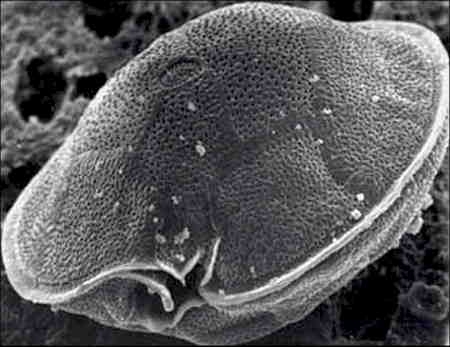
Il s'agit d'un Dinoflagellé appartenant à la classe des Dinophyceae ordre des Péridiniales, famille des Heterolacaceae. Cette microalgue était autrefois rattachée au genre Diplopsalis. D'un diamètre moyen de 80 µm, elle est enveloppée d'une thèque armée et possède une "bouche" profondément échancrée en forme d'encoche oblique, (voir photos). Les auteurs ont pu démontrer que cette microalgue était capable de fabriquer tant en milieu naturel qu'en milieu artificiel les deux toxines (CTX et MTX) responsables de la maladie. Cette microalgue unicellulaire testacée se trouve généralement attachée à des macrophytes qui prolifèrent sur les substrats coralliens morts.
À l'état endémique, l'algue existe dans la plupart des écosystèmes récifaux du Pacifique, de l'Océan indien et des Antilles, mais avec une très faible densité. Le genre Gambierdiscus est caractérisé par une circumdistribution entre 35° N et 35° S. il prolifère sur les coraux morts et les algues brunes en particulier du genre Turbinaria. Remarquons à ce propos que l'espèce Turbinaria turbinata ne se trouve aux Antilles que de la Guadeloupe à la Floride. Elle n'existe pas au Sud et ceci explique peut-être que les accidents ciguatoxiques soient plus fréquents en Guadeloupe et dans les îles du Nord qu'à la Martinique par exemple.
Gambierdiscus est endémique dans des densités relativement faibles dans la plupart des zones de Tahiti. Toutefois, des efflorescences épisodiques de ce dinoflagellé peuvent se produire, et les densités de cellules jusqu'à 10.000 cellules/g de microalgues ont été rapportées occasionnellement. Chacune de ces efflorescences contribue à maintenir un réservoir toxique riche en poison et peut être suivie par des flambées de ciguatera. Les facteurs précis de démarrage de ces efflorescences ont fait l'objet d'une enquête à long terme des populations de Gambierdiscus à Tahiti, de 1993 à 1997. La température joue un rôle important dans le cycle saisonnier de ce dinoflagellé car les populations de Gambierdiscus tendent à atteindre l'abondance maximale pendant la saison chaude (septembre à mars). La morbidité du corail, résultant soit d'événements cycloniques, des épisodes de blanchissement du corail, la pollution marine ou des activités anthropomorphiques, constitue un autre facteur critique dans la genèse naturelle des proliférations de ce dinoflagellé en créant des zones aussitôt colonisées par des macroalgues opportunistes qui sont des hôtes de choix pour les cellules de Gambierdiscus.
En revanche, Gambierdiscus toxicus prolifère énormément dans certaines circonstances, au sein des gazons recouvrant des zones coralliennes mortes. Ainsi après des tempêtes, cyclones, séismes ou par suite de travaux sous-marins en tous genres, de vastes zones de coraux morts peuvent se constituer et permettre la prolifération soudaine de la microalgue. La chaîne alimentaire de la Ciguatera est essentiellement inféodée aux poissons. Il peut cependant arriver que les Mollusques, les Crustacés, les Échinodermes soient touchés.
La toxicité des efflorescences de Gambierdiscus - exprimées en MU/1000 cellules - varie considérablement. Aucune corrélation directe n'a été établie entre cette toxicité et l'efflorescence de la biomasse cellulaire et le caractère saisonnier de divers paramètres environnementaux (température, salinité...).
Le responsable de l'intoxication est donc Gambierdiscus qui constitue la source des puissantes toxines marines vues plus haut. Le problème est que ces composés toxiques vont s'accumuler dans la chaîne alimentaire, depuis les herbivores se nourrissant sur les récifs coralliens jusqu'aux prédateurs de ces herbivores.
La consommation de poissons de récifs qui ont accumulé les divers ciguatoxines induit en quelques heures après le repas toxique, un large éventail de symptômes gastro-intestinaux, neurologiques et cardio-vasculaires. La gravité des symptômes dépend de l'espèce de poisson, du taux de ciguatoxine ingérée et de la susceptibilité individuelle. La physiopathologie est caractérisée par un ensemble de symptômes neurologiques pour lesquels les signes déterminants sont essentiellement des modifications de la sensibilité sensorielle cutanée telles que paresthésies (sur les extrémités et/ou de la zone péri-orale) et dysesthésie (inversion de la perception de chaleur et la froideur). En outre, l'ataxie, arthralgie, myalgie, vertiges, hypersalivation, des démangeaisons et une asthénie plus ou moins durables dans le temps sont des symptômes très fréquents. [Institut Malardé, Tahiti, Site Web, 2002]. Ces efflorescences de Gambierdiscus peuvent être comparées aux marées rouges entraînées par la pullulation de certains dinoflagellés planctoniques des zones tempérées qui fabriquent une variété de toxines connexes, tels que la saxitoxine et la brévétoxine.
Les toxines sont introduites dans la chaîne alimentaire par les poissons herbivores. Si la MTX reste localisée aux contenus digestifs (pour des raisons d'ailleurs inconnues), la CTX se retrouve aussi bien dans le tube digestif que le foie et les muscles des herbivores. La toxine va se concentrer par le jeu de la chaîne alimentaire : on retrouvera donc cette toxine principalement dans les poissons carnivores benthiques et pélagiques. Plus le prédateur sera gros, plus son organisme contiendra de toxines accumulées et plus il sera dangereux. On a en effet démontré qu'un poisson toxique n'éliminait pas ses toxines même si artificiellement en aquarium, on le nourrit plusieurs mois avec de la nourriture privée de substances ciguatoxiques. Ainsi, une "Bécune" (Barracuda) qui mange un "Chirurgien" absorbe dans un seul repas toute l'accumulation de toxines qu'à reçu cet herbivore pendant sa vie.
6. Précautions à prendre pour lutter contre la Ciguatera
- Protéger le milieu marin
Les agressions naturelles du milieu généralement saisonnières ou cycliques entraînent des perturbations écologiques diffuses et passagères responsables de "flambées" épisodiques de Ciguatera. En temps normal donc, seules les espèces de poissons carnivores de très grande taille ont accumulé suffisamment de toxines dans leurs tissus pour être dangereuses à consommer.
En revanche, les agressions anthropiques du milieu marin perturbent considérablement les écosystèmes coralliens. L'aménagement de ports, de marinas, de zones urbanisées, les dragages, la pollution chimique, thermique ou organique croissante, risquent à brève échéance de multiplier les zones où la microalgue toxique pourra pulluler.
- Éviter de consommer les espèces risquant d'être toxiques
D'après I. Pottier (2002), les spécimens toxiques appartiennent à quatre familles de poissons carnivores et de haut niveau trophique : carangues, pagres, mérous et barracudas. Les pourcentages de poissons toxiques pour l'homme s'élèvent à 29 % chez la Carangue gros yeux, 27 % chez la Carangue jaune, et 33 % chez la Carangue noire. Une corrélation positive entre le poids et la toxicité a été trouvée pour l'espèce Carangue gros yeux et pour les pagres toutes espèces confondues. Les poissons carnivores de petite taille appartenant à différentes espèces de Mérous ont montré une toxicité moyenne tandis que les espèces atoxiques sont
- des poissons pélagiques (les Dorades Coryphènes, les Bonites blanches et les Thons rélés),
- des petits mangeurs d'invertébrés ou des microphages,
- les bourses blanches et les vives,
- des poissons appartenant à des espèces à risque mais de petite taille,
- des poissons appartenant à des familles habituellement comestibles.

Dorade coryphène
L'arrêté préfectoral du 22 novembre 1960 interdit la consommation aux Antilles françaises des espèces suivantes :
Sphyraena barracuda : Bécune ou Barracuda.

Sphyraena barracuda
Seriola dumerili : Badiane ou fausse Carangue.

Seriola dumerili
Caranx latus : Carangue gros yeux,"Mayol".

Caranx latus
Caranx bartolomaei : Carangue jaune.

Gymnothorax funebris : Murène verte "Congre vert".

Gymnothorax funebris
Sphaeroïdes greeleyi : "Tchouf Tchouf" "Pelpète".

Sphaeroïdes greeleyi
Les espèces suivantes sont toxiques à Saint Martin et Saint Barthélémy :
Espèces déjà citées ci-dessus.
Mulloidichtys martinicus : "Barbarin blanc" "Souris".

Mulloidichtys martinicus
Scomberomorus regalis : "Thazard".

Scomberomorus regalis
Caranx ruber : Carangue à Pisquette. Carangue franche.

Caranx ruber
Caranx lugubris: Carangue noire.

Caranx lugubris
Malacanthus plumieri : "Vive".

Malacanthus plumieri
Les espèces suivantes sont parfois toxiques à Saint Martin et Saint Barthélémy :
Epinephelus morio : "Nègre" - "Vieille" - "Couronné" - "Tanche".

Epinephelus morio
Epinephelus guttatus : "Vieille rouge".

Epinephelus guttatus
Mycteroperca bonaci : "Vieille".

Mycteroperca bonaci
Mycteroperca venenosa : "Vieille à carreaux".

Mycteroperca venenosa
Echeneis naucrates : "Sucet" ou Rémora. Le rémora est ce poisson qui, grâce à sa ventouse céphalique, se fixe sur un poisson plus gros, notamment un requin.

Echeneis naucrates
Lactophrys bicaudalis : Coffre.

Lactophrys bicaudalis
Lactophrys triqueter : Coffre.

Lactophrys triqueter
Lachnolainus maximus : "Capitaine" "Aigrette".

Lachnolainus maximus
Balistes vetula : "Bourse".

Balistes vetula
- Ne jamais donner suite aux affirmations empiriques supposées distinguer les poissons toxiques des poissons sains
On ne connaît pas à l'heure actuelle aucun test simple et rapide pour détecter la toxicité des poissons ni d'ailleurs de moyens de protection efficaces des consommateurs. Les seules techniques biochimiques que l'on peut utiliser sont incompatibles avec les impératifs d'une commercialisation du poisson.
Il est toujours possible de faire un test sur un chat, mais celui-ci vomit souvent le poisson vénéneux. Par contre Banner et Boroughs ont remarqué que la mangouste est très sensible à la Ciguatera ; elle ne vomit jamais le poisson et montre des symptômes caractéristiques tels que la perte de certains réflexes et l'incoordination des membres postérieurs puis antérieurs. Un coma précède la mort de l'animal.
Quant aux moyens empiriques qui permettraient de détecter une éventuelle toxicité, ils sont très nombreux, plus ou moins fantaisistes et ne doivent pas être pris au sérieux. Citons-en quelques-uns pour mémoire.
On place un objet argenté avec le poisson pendant sa cuisson : si l'objet noircit, le poisson est toxique.
Les mouches évitent les poissons vénéneux ; si les mouches viennent, elles volent de manière désordonnée et meurent.
Si l'on incise la chair du poisson avec un couteau et que l'on arrose la partie incisée avec du jus de citron, la chair noircit si le poisson est vénéneux ; elle blanchit dans le cas contraire.
Si l'on respire profondément au niveau des ouïes du poisson, on doit éternuer si celui-ci est toxique.
- Informer les scolaires, les pêcheurs et la population en général
Les professeurs de SVT ont une mission importante à accomplir vis-à-vis de leurs élèves. En effet à propos de l'étude de la nutrition et des chaînes alimentaires, ils peuvent aisément expliquer les causes de la Ciguatera et les moyens de l'éviter en faisant reconnaître les principales espèces dangereuses grâce à des montages audio-visuels. Un rôle d'information que pourraient reprendre périodiquement les médias : presse écrite et surtout télévision.
Conclusion
Si l'on connaît maintenant l'origine et la transmission de la Ciguatera dans la nature, tous les problèmes sont loin d'être pour autant résolus et on explique encore mal la manière dont l'affection agit sur l'Homme. Les objectifs scientifiques à atteindre sont donc :
- la découverte d'un diagnostic simple, rapide et fiable de la toxicité des poissons avant leur commercialisation ;
- la mise au point d'une méthode de traitement spécifique de la maladie ;
- la prévention de l'intoxication humaine. C'est à la recherche active de ces objectifs, que s'appliquent les équipes travaillant actuellement sur la Ciguatera à Hawaï, au Japon et à Tahiti.
Bibliographie
Adachi R., and Y. Fukuyo. 1979. The thecal structure of the marine toxic dinoflagellate Gambierdiscus toxicus gen. et sp. nov. collected in the ciguatera-endemic area. Bull. J. Soc. Sci. Fish. 45:67-71.
Anderson D.M., and P.S. Lobel. 1987. The continuing enigma of ciguatera. Biol. Bull. 172:89-107.
Baden D., L.A. Fleming, and J.A. Bean. 1994. Marine toxins. In Handbook of Clinical Neurology 21:1-34.
Baden D. G., K.S. Rein, M. Kinoshita, and R.E. Gawley. 1990. Computational modeling of the polyether ladder toxins brevetoxins and ciguatoxin. In T.R.Tosteson (Ed.). Ciguatera. Polyscience Publishing, Quebec.
Bagnis R. 1972. Quand le corail se venge in Science et Vie, septembre 1980.
Bagnis R., A.M. Legrand, and A. Inoue. 1990. Follow-up of a bloom of the toxic dinoflagellate Gambierdiscus toxicus on a ringing reef in Tahiti. Pp. 98-103 in E. Graneli, B. Sundstrom, L. Edler, and D.M. Anderson (Eds.). Toxic Marine Phytoplankton. Elsevier, Amsterdam.
Ballentine, D.L., T.R. Tosteson, and A.T. Bardales. 1988. Population dynamics and toxicity of natural populations of benthic dinoflagellates in southwestern Puerto Rico. Journal of Experimental Marine Biology and Ecology 119:201-212.
Bomber, J.W., M.G Rubio, and D.R. Norris. 1989. Epiphytism of dinoflagellates associated with the disease ciguatera: substrate specificity and nutrition. Phycologia 28:360-368.
Bomber, J.W., R.R.L. Guillard, and W. G. Nelson. 1988. Roles of temperature, salinity and light in seasonality, growth and toxicity of ciguatera-causing Gambierdiscus toxicus Adachi et Fukuyo (Dinophyceae). Journal of Experimental Marine Biology and Ecology 115: 53-65.
Bomber, J.W., D.R. Norris, and L.E. Mitchell. 1985. Benthic dinoflagellates associated with ciguatera from the Florida Keys II. Temporal, spatial and substrate heterogeniety of Prorocentrum lima. Pp. 45-50 in D.M. Anderson, A. White, and D.G. Baden (Eds.). Toxic Dinoflagellates. Elsevier, New York.
De Sylva, D. 1994. Distribution and ecology of ciguatera poisoning in Florida, with emphasis on the Florida Keys. Bulletin of Marine Science 54: 944-954.
Durand-Clement, M. 1986. A study of toxin production by Gambierdiscus toxicus in culture. Toxicon 24:153-1157.
Ébroin A. 1972. Poissons venimeux et vénéneux des Antilles Françaises. Ed. Désormeaux Fort-de-France.
Faust, M.A. 1996. Dinoflagellates in a mangrove ecosystem, Twin Cays, Belize. Nova Hedwiga 112:445-458.
Gillespie, N.C., M.J. Holmes, J.B. Burke, and J. Doley. 1985. Distribution and periodicity of Gambierdiscus toxicus in Queensland, Australia. Pp. 183-188 in D.M. Anderson, A. White, and D.G. Baden (Eds.). Toxic Dinoflagellates. Elsevier, New York.
Holmes, M.J., R.J. Lewis, M.A. Poli, and N.C. Gillespie. 1991. Strain dependent production of ciguatoxin precursors (gambiertoxins) by Gambierdiscus toxicus (Dinophyceae) in culture. Toxicon 29:761-775.
Landsberg, J.H. 1995. Tropical reef-fish disease outbreaks and mass mortalities in Florida, USA: What is the role of dietary biological toxins ? Dis. aquat. org. 22:83-100.
Lawrence, D. N., R.M. Enriquez, A. Lumesh, and A. Maceo. 1980. Ciguatera fish poisoning in Miami. Journal of the American Medical Association 224:224-254.
Lewis S.J. 1992. Ciguatoxins are potent ichthyotoxins. Toxicon 30:207-211.
Morice J. 1961 Liste préliminaire des poissons vénéneux côtiers de l'île de St Barthélémy. Institut des pêches maritimes. Gustavia St Barth.
Palafax, N., L. Jain, A.Z. Pinano, T.M. Gulick, R.K. Williams, and I.J. Schatz. 1988. Successful treatment of ciguatera fish poisoning with intravenous mannitol. Journal of the American Medical Association 259:2740-2742.
Pottier I. (2002). La ciguatera aux Antilles : épidémiologie, analyse de la C-CTX-1 et étude de la diversité des ciguatoxines dans les poissons toxicophores. Université de Caen.
Randall J. 1961. Empoisonnement par des poissons tropicaux. University of Miami Florida.
Renoux G. 1982. La Ciguatera. Bull. APBG Guadeloupe 9:68-75.
Shimizu Y. 1987. Dinoflagellate toxins. In F.J.R. Taylor (Ed.). The Biology of Dinoflagellates. Blackwell Scientific Publications, Oxford.
Stauch A. 1981. La Ciguatera. Une maladie causée par l'absorption d'aliments d'origine marine. F.A.0. Port au Prince Haïti.
Steidinger, K.A. 1993. Some taxonomic and biologic aspects of toxic dinoflagellates. In I. Falconer (Ed.). Algal Toxins in Seafood and Drinking Water. Academic Press, New York.
Tindall, D.R., and S.L. Morton. 1998. Community dynamics and physiology of epiphytic/benthic dinoflagellates associated with ciguatera. In D.M. Anderson, A.D. Cembella, and G.M. Hallegraeff (Eds.). Physiological Ecology of Harmful Algal Blooms. Springer-Verlag, Berlin.
Tomas, C. 1996. An overview of toxic episodes in the Western Hemisphere. In D. Baden (Ed.). Proceedings of the Workshop Conference on Seafood Intoxications: Pan American Implications of Natural Toxins in Seafood.
Pour en savoir plus sur le web
http://www.ilm.pf/ : la page de l'Institut Louis Malardé de Papeete
http://www.com.univ-mrs.fr/IRD/atollpol/glossaire/cigua.htm
http://www.tahiti1.com/fishing/ciguatera-fr.htm
18:03 Publié dans Nature et santé, Pollution | Tags : ciguatera, poissons toxiques, ichtyosarcotoxisme, poissons tropicaux, gambierdiscus, polynésie, pacifique, atlantique | Lien permanent | Commentaires (4) | ![]() Facebook | | |
Facebook | | |
27/02/2010
Le Crocodile de Morelet
 Le Crocodile de Morelet
Le Crocodile de Morelet
(Crocodylus moreletti)
par André Guyard
Les crocodiliens (Crocodilia) constituent un ordre de reptiles adapté à la vie aquatique. Cet ordre comporte trois familles : les crocodilidés (crocodile) qu'on rencontre principalement en Afrique, les alligatoridés trouvés en Amérique (alligator et caïman) et les gavialidés (gavial) qui se cantonnent en Asie. Pourtant on peut rencontrer au Mexique un véritable crocodile : le Crocodile de Morelet. Il s'agit d'une espèce relativement peu connue de la côte atlantique du Mexique et du nord de l'Amérique centrale. Il s'agit d'une petite espèce, dépassant rarement 3 m de longueur et caractérisée par un museau large. Ces animaux vivent principalement dans les habitats d'eau douce, en particulier les marais, les marécages, les étangs et les lagunes, mais dans certaines régions, cette espèce peut être trouvée dans les zones d'eau saumâtre.
Principales caractéristiques morphologiques : museau relativement court avec un léger renflement médian ; suture transversale prémaxillo-maxillaire ; crêtes préorbitales présentes ; écailles supérieures des membres lisses ; six écailles nucales dont quatre antérieures très grandes et deux plus petites en arrière ; écailles dorsales en 16 rangées transversales.
La vidéo ci-dessous montre quelques spécimens filmés dans le canyon de Sumatero sur la rivière Chiapas au Mexique en janvier 2010.
06:16 Publié dans Herpétologie | Tags : reptiles, crocodiles, mexique, amérique, sauriens | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |