Les Tiques et la maladie de Lyme
Les Tiques et la maladie de Lyme
par André Guyard
(dernière mise à jour : 21 juin 2018)
Voir la bibliographie au bas de cet article
Au cours de balades ou de randonnées, il n'est pas rare de récolter sur sa peau une tique. Or cet acarien peut être vecteur de maladies, notamment de la maladie de Lyme qui est une affection loin d'être bénigne. Il convient donc de bien réagir à la piqûre ou morsure d'une tique. (Voir également l'affichette émise par le CHUR de Besançon pour mettre en garde forestiers et promeneurs contre les tiques). Outre les animaux sauvages, chiens et chats ramassent fréquemment ce genre de bestioles. Voir également le reportage de France 3 Alsace à ce sujet.
Pas très grosses les tiques qui nous envahissent
Les tiques
Les tiques sont les plus grands représentants de l'ordre des acariens : certaines peuvent dépasser un centimètre de long. Ce sont des acariens ectoparasites. Elles passent une partie de leur cycle ancrées sur la peau de mammifères, d'oiseaux ou de reptiles, se nourrissant de leur sang grâce à un rostre. Au cours de leur cycle de vie, qui comporte deux stades larvaires, les tiques changent trois fois d'hôte.

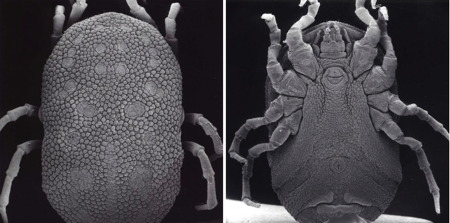
Une tique vue au microscope électronique à balayage
Cliché EYE OF SCIENCE/SPL/COSMOS
Le problème de santé humaine avec les tiques, c'est que leur salive peut contenir des bactéries responsables de pathologies comme la maladie de Lyme. D'où l'intérêt de bien connaître l'anatomie de l'appareil buccal qui permet une fixation solide dans la peau de l'hôte.
Description de l'appareil buccal due à la plume alerte de Jean-Yves Cretin.
Les pièces buccales forment un organe d'ancrage, le rostre (ou capitulum), qui se plante dans la peau de l'hôte et par lequel le sang est aspiré.
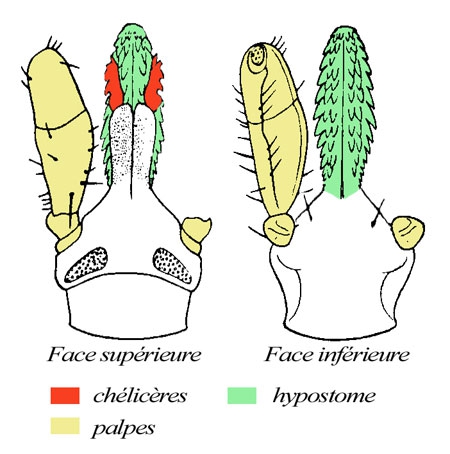
Aspect de l'appareil buccal
(schéma J.-Y. Cretin modifié de P.-P. Grassé)
— De part et d'autre, les palpes en brun clair, avec les articles portant des sensiles thermo- et chémorécepteurs à leur extrémité. Ils servent à détecter l'emplacement idéal de la morsure, mais ne pénètrent pas dans la peau de l'hôte.
— Portées par un prolongement dorsal de la tête, les chélicères (en rouge), des pièces qui sont spéciales aux Arachnides = Chélicérates (limules, scorpions, opilions, araignées, acariens...) : elles sont mobiles et déchirent l'épiderme en permettant la pénétration du rostre.
— Face ventrale, prolongeant l'orifice buccal, l'hypostome (en vert) percé d'un canal où passent la salive dans un sens et le sang dans l'autre ; il est garni de forts crochets tournés vers l'arrière qui permettent l'ancrage de l'animal dans l'épiderme et le derme de l'hôte, qu'il faut atteindre car c'est là que se trouvent les vaisseaux sanguins !
Le rostre est donc constitué de l'hypostome et du prolongement dorsal de la tête qui porte les chélicères. C'est lui qui reste dans la plaie quand l'extraction n'est pas optimale.
La salive contient des molécules anesthésiantes locales (on ne sent pas la morsure), des anticoagulants qui fluidifient le sang, des protéines qui lysent les tissus, et s'il n'y avaient les parasites en prime, les tiques seraient des "prédateurs" sans importance...
Différents types de tiques
Les tiques sont classées en deux familles principales caractérisées par des génomes, morphologies et mode de vie différents.
Les argasidés ou tiques molles
Ce sont les plus grosses tiques. Leur rostre situé sur le ventre est invisible en vue dorsale. Elles vivent généralement près de leur hôte dans les crevasses, terriers, nids ou habitations et viennent se nourrir plusieurs fois sur leur hôte lorsque celui-ci est immobile. Elles peuvent jeûner jusqu'à cinq ans. En Europe, elles sont surtout présentes dans le pourtour méditerranéen.
Ornithodoros amblus femelle, faces dorsale et ventrale.
Le rostre n'est pas visible, face dorsale.
Microscope électronique à balayage © National Tick Collection, 2004
Les ixodidés ou tiques dures
De petite taille, le rostre est proéminent et visible en vue dorsale. Elles vivent dans les bois et dans la végétation épaisse où elles grimpent sur les plantes basses d'où elles peuvent atteindre les animaux frôlant ces herbes. Dans les lieux infestés, on peut en trouver jusqu'à 5 ou 6 sur une seule feuille d'ortie. Elles se détachent de leur hôte gorgées de sang, après un repas qui peut durer plus d'une semaine.
Ixodes ricinus. Femelle à gauche et mâle à droite
A, vue ventrale d'un adulte d'Ixode.
B, détail montrant la plaque spiraculaire (SP)
et la gouttière anale en U inversé (AG)
(Document Washington State Public Health Laboratories)
Vue dorsale d'un adulte (A) et et ventrale d'une nymphe (B)
de la région antérieure d'Ixodes sp.
HY : hypostome, A : palpes, BA : base capitulaire
(Document Washington State Public Health Laboratories)
La tique la plus commune en Europe, Ixodes ricinus appartient à cette famille.
Larve (A), nymphe (B), mâle adulte (C), femelle adulte (D)
et femelle adulte engorgée avec œufs (E) of I. scapularis
(Document Dr. James Ochi)
Accouplement d'Ixodes ricinus.
Le mâle est beaucoup plus petit que la femelle
Femelle adulte, mâle adulte, nymphe
et larve de I. scapularis
(Document Dr. Marc Dolan)
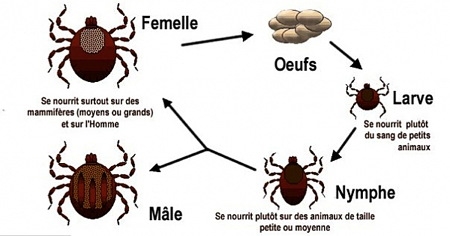
Cycle d'une tique

Tailles comparées de diverses phases de la tique femelle (Ixodes ricinus)
En Amérique du Nord, la souris à pattes blanches P. leucopus, est l'hôte principal d'Ixodes scapularis (tiques à pattes noires) aux stades larvaire et nymphal, vectrice de la maladie de Lyme. Les adultes sont également communs chez le cerf de Virginie (Odocoileus virginianus), au printemps et à l'automne principalement, mais cette tique a été trouvée chez plus de 50 autres espèces de mammifères et chez plus de 55 espèces d'oiseaux.
Les tiques et leurs hôtes
Les tiques sont parasites externes de nombreux mammifères : chiens, chats, vaches, carnivores… ainsi que de nombreux oiseaux et reptiles.
Ci-dessous quelques photos dues à Jean-Yves Cretin :

Un mâle de Dermacentor reticulatus sur une brindille en attente d'un hôte au bord de la terrasse devant chez moi aux Auxons au bord de sa terrasse,
(photo © Jean-Yves Cretin)
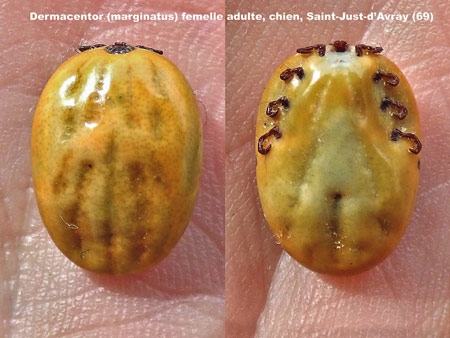
Dermacentor marginatus femelle
adulte (Ixodidae)
récupérée sur la chienne de ma fille
dans le Beaujolais
Cliché © Jean-Yves Cretin
une femelle adulte (et une autre à peine visible) d'Ixodes ricinus sur Lézard vert (aperçu à Gizia, Jura),

Ixodes ricinus sur Lézard vert
(photo © Jean-Yves Cretin)
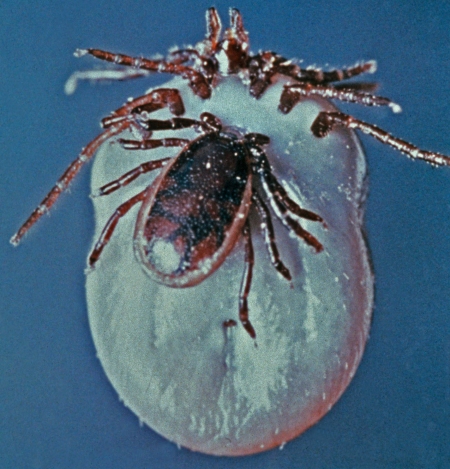
et un couple d'Ixodes sur l'hôte (mon chat) juste avant extraction au tire-tique. Mâle et femelle doivent se retrouver SUR l'hôte pour s'accoupler.

Couple d'Ixodes sur l'hôte
(photo © Jean-Yves Cretin)
Maladies transmises par les tiques
Les tiques sont des agents véhiculant certaines maladies humaines dont les :
- Rickettsioses,
- Borrélioses (fièvres récurrentes à tiques, maladie de Lyme),
- Arboviroses (fièvre de Crimée-Congo, fièvre de la vallée du Rift, fièvre de Kyasanur, fièvre d'Omsk).
Deuxième vecteur de maladies au monde après le moustique, la tique n'effectue au cours de sa vie que trois "repas" sanguins en moyenne. Autant d'occasions de transmettre, par l'intermédiaire de sa salive, plusieurs dizaines d'agents pathogènes pour l'animal et l'homme. Chez ce dernier, plusieurs bactéries du genre Borrelia responsables de la maladie de Lyme ont été décrites : Borrelia burgdorferi senso lato ; B. garirdi; B. afzelii... S'y ajoute Borrelia miyamotoi, récemment mise en évidence en France, responsable en Asie d'une maladie apparentée, une fièvre dite récurrente. Mais les tiques peuvent transmettre d'autres bactéries comme les Rickettsia ou Anaplasnia, responsables de maladies émergentes (rickettsioses et anaplasmoses), des parasites Babesia et Theileria, provoquant des troubles proches de la maladie de Lyme, et même des virus.
En 2014, une équipe de l'Inra met l'accent sur un aspect méconnu de l'acarien, l'identification des autres bactéries pathogènes dont il peut être porteur et leur éventuelle action sur les maladies transmises (voir note publiée dans PLOS Neglected Tropical Disease). Les chercheurs du laboratoire Inra de Maisons-Alfort, aidés par leurs collègues d'autres stations, ont étudié des tiques présentes dans les Ardennes françaises. Près de 267 spécimens femelles d'Ixodes ricinus ont été collectés entre mai et août 2012 sur 80 km dans 6 zones forestières et 3 de bocages avec beaucoup de haies. Le genre Ixodes est le plus répandu (670 espèces connues) et Ixodes ricinus est la tique la plus commune en Europe. On sait qu'elle peut transmettre, lors de son repas de sang humain, des bactéries, des virus ou d'autres parasites. Mais quelles bactéries ?
Les scientifiques ont donc testé les acariens pour 37 pathogènes (bactéries et parasites), pour le virus de l'encéphalite à tique TBV et pour 4 espèces de bactéries symbiotiques de la tique (qui vivent en symbiose avec elle). Près de 45 % des spécimens analysés étaient porteurs d'au moins un des pathogènes recherchés. Parmi ceux ceux-ci, 45 % (54 tiques) étaient porteurs d'au moins deux pathogènes ou plus. En prenant en compte les bactéries symbiotiques, certaines tiques étaient porteuses de 8 micro-organismes différents. Résultat, la co-infection de la tique, c'est-à-dire la présence d'au moins deux pathogènes, est plutôt la règle que l'exception. D'où, sans doute, les réactions différentes des personnes infectées.
«Ce phénomène de co-infection massive a d'importantes implications pour la santé humaine et animale, souligne le Dr Vayssier-Taussat, responsable de l'étude. Cela révèle la nécessité de tenir compte de ces interactions microbiennes dans le développement de nouvelles stratégies alternatives pour contrôler les tiques et les maladies qu'elles véhiculent.»
En ce qui concerne les virus, certains de ces derniers sont connus, comme le Flavirus, responsable d'une encéphalite, mais d'autres, encore inconnus, peuvent se révéler mortels... Ce fut notamment le cas en 2014 avec l'identification du « Bourbon virus », un Thogotovirus, baptisé d'après le nom du comté du Kansas (États-Unis) où vivait l'unique victime connue à ce jour, un homme de 50 ans décédé, en moins de deux semaines, à la suite de morsures de tique.
La maladie de Lyme
La borréliose de Lyme, ou maladie de Lyme, est une maladie infectieuse, non contagieuse, due à une bactérie, Borrelia burgdorferi, transmise par des tiques du genre Ixodes. Certaines formes de la maladie avaient été décrites de longue date en Europe. C'est notamment le cas de formes cutanées comme l'acrodermatite chronique atrophiante, décrite dès la fin du XIXe siècle, l'érythème migrant, le lymphocytome cutané bénin, décrits au début du XXe siècle, ou encore de formes neurologiques. Cependant, ce n'est qu'avec l'apparition, au milieu des années 1970, de 51 cas d'arthrite inflammatoire dans le Comté de Lyme (Connecticut, États-Unis) que de vastes études épidémiologiques sont entreprises et aboutissent, en 1981, à la découverte, par Willy Burgdorfer, de l'agent causal et de son vecteur.
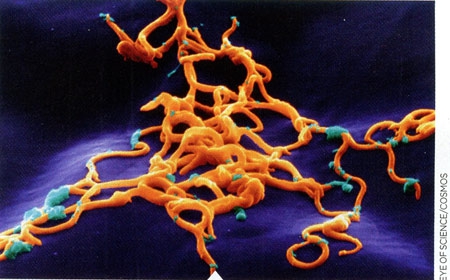
Borrelia burgdorferi est l'une des bactéries du genre Borrelia
responsable de la maladie
La maladie de Lyme sévissait avant l'Homme : des bactéries similaires à celles qui provoquent la maladie de Lyme ont été retrouvées en République dominicaine au sein de tiques fossilisées dans de l'ambre il y a 15 millions d'années, 12 millions d'années environ avant l'apparition du genre Homo. (Source : George Poinar, Université d'État de l'Orégon, Corvallis).
Épidémiologie
La maladie de Lyme est une zoonose transmise par les tiques du genre Ixodes. Ces tiques sont caractérisées par la grande variété d’hôtes qu’elles parasitent, des petits mammifères aux plus gros (cervidés, suidés), ainsi que les oiseaux et les reptiles, lesquels constituent des réservoirs plus ou moins importants de la bactérie.
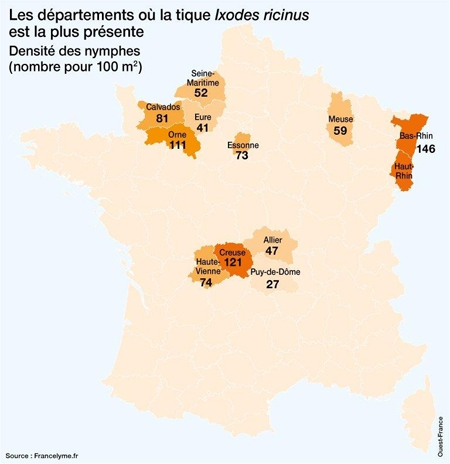
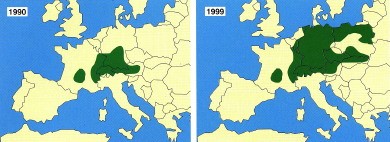
C’est une maladie très largement répandue dans les régions tempérées et froides de l’hémisphère nord, de la Chine à l’Amérique du Nord et de la Scandinavie à l’Afrique du Nord. Actuellement, elle est la première maladie vectorielle dans l’hémisphère nord, avec 15 000 cas annuels en moyenne aux États-Unis, plus de 50 000 en Europe, où il semble exister un gradient positif d’Ouest en Est.
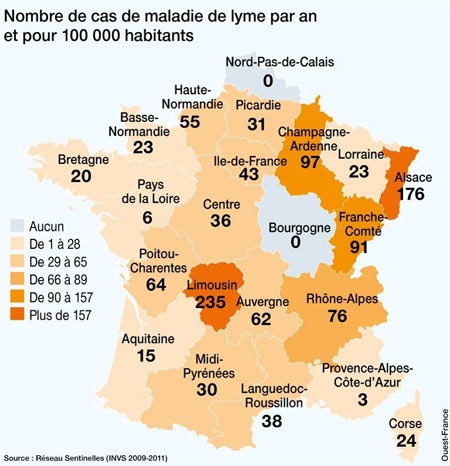
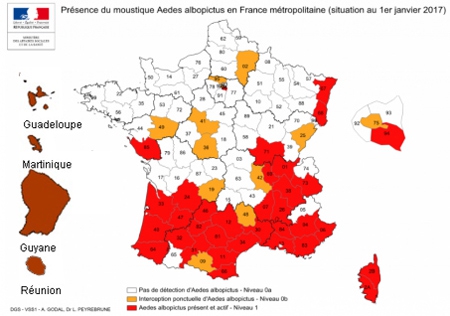
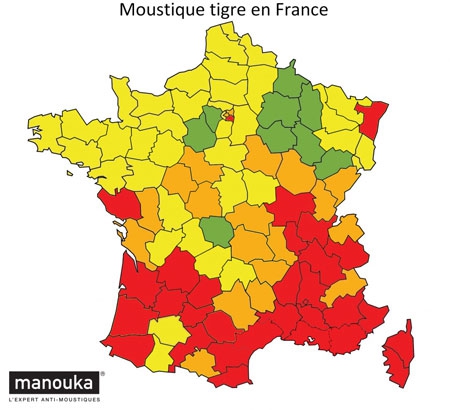
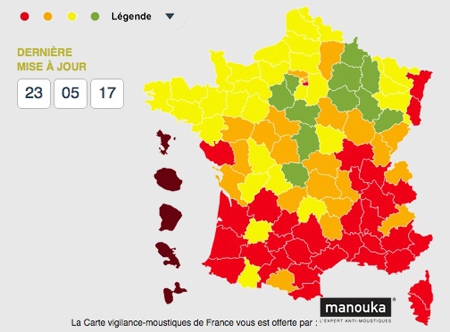
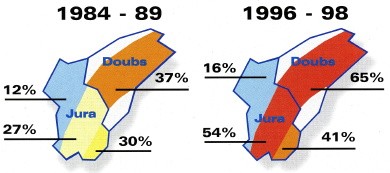
En France, l’incidence présente des variations considérables d’une région à l’autre et on estime à 10 000 environ le nombre de nouveaux cas par an. L’Est et le Centre du pays sont les plus touchés, avec une incidence pouvant atteindre plus de 200 cas/100 000 habitants en Alsace. Des études menées en milieu naturel montrent que les tiques infectées sont très largement répandues sur l’ensemble du territoire français, à l’exception d’une petite bande de territoire en zone méditerranéenne et des régions situées à une altitude élevée.
Tiques et maladie de Lyme, une coévolution
Les travaux de thèse de Coralie Hermann, une doctorante de l'université de Neuchâtel, en Suisse, souligne un bel exemple de coévolution : les tiques infectées par Borrelia burgdorferi, la bactérie responsable de la maladie de Lyme, résistent mieux à la sécheresse et aux variations de température que les autres.
En effet, très sensible à la sécheresse, la tique doit régulièrement quitter son perchoir pour aller se réhydrater dans l'humus.
Entre 2010 et 2013, C. Hermann a étudié la résistance de 1500 tiques de l'espèce Ixodes ricinus placées dans des enceintes où régnaient différents taux d'humidité (13, 32, 51,5, 61 et 89 pour cent) et températures (12,5 et 25°C). Elle a observé que certains individus demeuraient dans des endroits secs, tandis que d'autres fuyaient à la recherche d'humidité. Des tests génétiques ont révélé que les tiques les plus résistantes étaient infectées par Borrelia burgdorferi. C. Hermann a alors mis au point un protocole pour quantifier la masse de graisse d'une tique et, à la faveur d'une nouvelle expérience, a prouvé que les réserves des tiques infectées sont 12,1 pour cent supérieures à celles des tiques saines, ce qui est très significatif chez des acariens aussi vulnérables aux conditions sèches. Manifestement, Borrelia burgdorferi agit sur le métabolisme de son vecteur d'une façon qui améliore sa survie et, par là, augmente ses chances d'infecter un hôte, un humain par exemple. De sorte que la bactérie engraisse son vecteur, la tique! À croire que la bactérie arme l'acarien contre les mauvaises conditions météorologiques ! Ce germe augmenterait les réserves de graisse de l'animal et modifierait ses capacités de stockage d'eau. Autant de ressources nécessaires à une meilleure survie, en attendant de trouver une proie humaine ou animale à laquelle s'agripper pour troquer un repas en échange de la maladie de Lyme. International Journal of Parasitology (2013), vol. 43 (6), pp. 477-483.
Aspect clinique
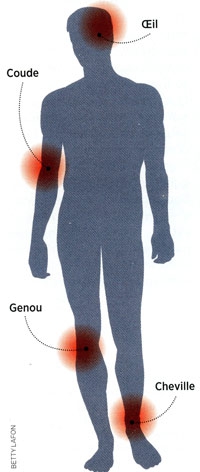 Comme nous l'avons vu plus haut, l'Homme contracte la maladie dans l’environnement forestier, où se trouvent préférentiellement les tiques vectrices et leurs hôtes. La maladie montre plus de 70 signes essentiellement cutanés, articulaires et neurologiques. L’évolution clinique, en l’absence de traitement, comporte trois phases.
Comme nous l'avons vu plus haut, l'Homme contracte la maladie dans l’environnement forestier, où se trouvent préférentiellement les tiques vectrices et leurs hôtes. La maladie montre plus de 70 signes essentiellement cutanés, articulaires et neurologiques. L’évolution clinique, en l’absence de traitement, comporte trois phases.
- La phase primaire se caractérise par une inflammation de la peau nommée érythème migrant (plaque rouge s’étendant rapidement), véritable marqueur de la maladie, parfois associé à des manifestations générales. Cette rougeur cutanée disparaît spontanément en quelques semaines. Sont parfois associées une fièvre modérée, une fatigue et des douleurs articulaires ou musculaires diffuses.
- La phase secondaire (de quelques semaines ou de quelques mois après la morsure) n'apparaît qu'en l'absence de traitement antibiotique. Elle se traduit à la fois par des formes neurologiques — paralysies faciales, oculaires, névralgies (c'est-à-dire des douleurs sur le trajet des nerfs) — mais aussi par des formes rhumatologiques (articulations inflammatoires, essentiellement le genou, mais aussi les épaules, les coudes, les chevilles, etc.). Plus rarement, apparaissent des signes cardiaques (palpitations, troubles du rythme, péricardite) et oculaires (conjonctivite, kératite), l'ensemble évoluant le plus souvent par poussées, des manifestations cutanées (lymphocytome cutané bénin).
-
La phase tertiaire ou tardive de la maladie (de quelques mois à quelques années après la morsure), en l'absence de traitement, correspond à l'évolution chronique des symptômes de la phase secondaire, en particulier des manifestations cutanées (ACA : acrodermatite chronique atrophiante), neurologiques ou articulaires.
Érythème migrant caractéristique de la maladie de Lyme
Mais avec au moins 70 symptômes possibles, le diagnostic de la maladie est très difficile à poser. Et les tests sanguins, controversés, sont souvent mal utilisés. Résultat : les traitements sont fréquemment prescrits trop tard.
Une problématique propre à alimenter controverses et débats passionnés. Les associations de malades estiment en effet que déni médical et omerta des autorités de santé sont responsables d'une large sous-estimation des cas et d'une mauvaise prise en charge de la maladie, sources d'errance médicale. Pour les autorités médicales, au contraire, le nombre de personnes infectées est stable et celles-ci peuvent être le plus souvent guéries par la prise d'antibiotiques durant trois semaines.
Différents rapports ont bien tenté de mettre un peu d'ordre dans ce tableau, le dernier en date étant celui du Haut Comité de santé publique (HCSP) remis en décembre 2014. Il plaide, entre autres, pour une meilleure information des patients et des médecins vis-à-vis d'une affection qui a même été à l'ordre du jour de l'Assemblée nationale. En février 2015, un projet de loi soumis par 70 députés a demandé la mise en place d'un plan national sur cinq ans. En vain. Le projet a été enterré. Et il n'y a bien que les mesures de prévention qui fassent aujourd'hui l'unanimité.
Pour ne rien simplifier, aucun test diagnostique biologique fiable n'est disponible. Car Borrelia, présente en trop faible quantité, n'est pas détectable dans le sang. Les médecins doivent donc recourir à des tests sanguins indirects. Ces sérologies dites Elisa ou Western Blot (WB) détectent, comme c'est le cas pour de nombreuses autres maladies infectieuses, la présence d'anticorps, témoins d'une rencontre de l'organisme avec l'agent pathogène. Mais les tests disponibles (plus de 30 !) présentent des performances variables. Résultat : « ils ne permettent pas d'atteindre ce que l'on appelle un "gold standard" [référence] », souligne le dernier rapport du HCSP. Ces tests font d'ailleurs l'objet d'une analyse toujours en cours par l'Agence nationale de sécurité médicale. En France, leur utilisation — et donc leur remboursement — demeure très encadrée et est âprement discutée par les associations de patients qui contestent tant leur intérêt que leur étalonnage.
Dans la pratique, en cas de doute diagnostique, la réglementation et les recommandations européennes prévoient en effet dans un premier temps la pratique d'un test Elisa (WB). En cas de négativité, le diagnostic de maladie de Lyme est, a priori, écarté. Et c'est uniquement en cas de positivité qu'un WB, plus spécifique, est demandé pour confirmation. Or Elisa est souvent d'interprétation difficile d'autant que les anticorps apparaissent tardivement dans cette maladie : ils ne sont présents qu'une fois sur deux dans les trois premières semaines après la morsure, alors qu'ils le sont à plus de 70 % dans la phase secondaire et tertiaire. « Les tests sont souvent demandés trop tôt, au stade de l'érythème migrant où ils n'ont aucun intérêt », insiste le Pr Jaulhac. Enfin, les anticorps persistant longtemps dans le sang, même avec un traitement efficace, ils peuvent aussi être le témoin d'une contamination ancienne, pas forcément en lien avec les symptômes récents des patients. Il s'ensuit une errance médicale très préjudiciable, d'autant que les patients vivent douloureusement la réputation de maladies imaginaires qui leur est souvent faite, certains ayant même subi des hospitalisations abusives en psychiatrie.
Borrelia burgdorferi est un complexe de 12 espèces dont quatre ont un pouvoir pathogène certain pour l’homme : B. burgdorferi sensu stricto (ss), B. garinii, B. afzelii et B. spielmanii. Il existe un tropisme d’organe particulier à chacune de ces espèces : si le premier stade d’érythème est indistinctement lié aux quatre espèces, l’évolution vers une forme neurologique est préférentiellement associée à l’espèce B. garinii, les arthrites plutôt à B. burgdorferi ss ; quant à l’ACA, son agent étiologique spécifique est B. afzelii. Les quatre espèces pathogènes circulent en Europe tandis qu’une seule, B. burgdorferi sensu stricto, est connue aux États-Unis.
Traitement
Toutes les manifestations de la maladie de Lyme doivent faire l’objet d’un traitement antibiotique (cyclines ou béta-lactamines). Le traitement au stade primaire entraîne une guérison rapide et prévient les complications. Non traité, le stade primaire peut évoluer vers le stade secondaire et les arthrites et les manifestations neurologiques peuvent évoluer vers la chronicité. La prophylaxie antibiotique systématique consécutive à une piqûre de tique est déconseillée.
Une conférence de consensus — autrement dit une commission d'experts chargée d'établir une position collective — a rendu en 2006 un avis formel sur la question des traitements. Selon celui-ci, une prise quotidienne d'antibiotiques pendant trois semaines permet d'éliminer la bactérie dans 95 % des cas. Certes... mais à une condition : que le traitement soit prescrit tôt. Car pour les phases tardives, si d'autres antibiotiques sont possibles, l'efficacité est moins bonne. En pratique, nombreux sont les patients qui se plaignent encore de symptômes multiples une fois la cure achevée. Ce qui entretient le doute sur l'efficacité du traitement recommandé.
Aux États-Unis, la moitié des praticiens choisissent ainsi de prescrire un traitement sur une période plus longue que celle officiellement recommandée. Les médecins français font-ils de même ? Impossible de le savoir, aucun chiffre n'étant disponible et aucune enquête officielle de terrain n'ayant été entreprise pour l'établir. Pour le Pr Jaulhac, « les traitements sont souvent prescrits trop tard, à des doses insuffisantes et ne sont pas forcément suivis pendant les 21 jours recommandés », argumente le biologiste. « Nombreux sont les patients qui évoquent des guérisons partielles ou des rechutes fréquentes », précise le Pr Perronne.
Les prescriptions alternatives en procès
Les multiples incertitudes tant diagnostiques que thérapeutiques forment un terreau pour les offres alternatives. Souvent des "cocktails" très atypiques, mélangeant antiallergiques, antipaludéens, huiles essentielles, plantes ou médicaments utilisés pour traiter... les troubles de l'érection. Ces prescriptions, qui soulagent beaucoup de patients, sont faites par des médecins ou des pharmaciens qui prennent le risque de se voir accusés d'escroquerie à l'assurance-maladie ou d'exercice illégal, au grand dam des associations qui demandent que cessent ces "persécutions". Un pharmacien et son associé ont été condamnés à Strasbourg en novembre 2014, respectivement pour escroquerie et pour exercice illégal. Le premier était accusé d'avoir abaissé le seuil de réactivité d'Elisa et prescrit des tests en dehors des règles officielles. Le deuxième d'avoir vendu un produit non autorisé.
Conseils pratiques
Prévention
La meilleure façon de prévenir les maladies portées par la tique est d'éviter la piqûre par le port de vêtements couvrants. Une inspection soigneuse du corps après les promenades ou activité en forêt permet de détecter et enlever les tiques avant qu'elles n'aient eu le temps de transmettre la maladie de Lyme. Il existe aussi de nombreux produits répulsifs, mais dont l'efficacité n'est pas toujours évidente.
Aménagement du territoire
La fragmentation des forêts et la régression des prédateurs carnivores des micro-mammifères constituent des facteurs de pullulation des tiques. Reconstituer des continuités écopaysagères et œuvrer à la restauration d'équilibres écologiques pourrait donc, à moyen et long terme être une mesure de prévention utile.
En balade dans la campagne
Il est conseillé au cours de promenades en forêt ou dans les champs :
* De porter des vêtements longs et clairs pour localiser les tiques plus facilement,
* De porter des chaussures fermées pour éviter que les tiques ne se fixent sur la peau,
* D'utiliser des répulsifs (ou insectifuges) à base de DEET ou du Bayrepel (plus récent que le DEET, et efficace durant 4 heures contre les tiques et 8 heures contre moustiques et taons).
Lors des promenades, se débarrasser rapidement des tiques trouvées sur les vêtements.
Au retour d'une promenade à risques, au moment de la douche, se faire examiner attentivement toutes les parties du corps pour y dépister les tiques éventuellement fixées à la peau.
À la maison
Il est possible de limiter la prolifération des tiques dans la maison ou le jardin.
- Couper l'herbe des jardins, éliminer les feuilles mortes => refuges des larves.
- Surveiller vos vêtements après avoir tailler votre haie.
- Aspirer puis boucher les crevasses et interstices dans les planchers, les murs.
- Inspecter les animaux de compagnie au retour de promenade ainsi que leurs endroits favoris (panier, etc.) Vous pouvez aussi traiter l'endroit où vos animaux vivent grâce à des produits spécifiques.
- Décourager la nidification des petits rongeurs aux abords de la maison et éloigner les mangeoires pour oiseaux.
En cas de morsure de tique
Si la tique est découverte, il faut la retirer rapidement car le risque de contamination augmente avec la durée du contact.
- Afin d'éviter que la tique ne régurgite et surinfecte la plaie, il faut bien prendre garde à ne pas l'écraser, ni la blesser. Pour la même raison il est généralement déconseillé d'appliquer tout produit (éther, alcool...). En effet, en se sentant agressée, la tique risque de régurgiter et d'envoyer ses microbes dans l'hôte qui l'héberge.
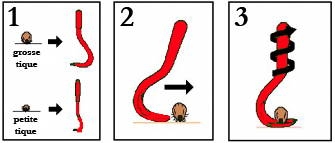
- Saisir la tique au plus près de la peau à l'aide d'une pince à tiques (vendue en pharmacie), un "tire-tic", petit appareil ingénieux qui se fixe entre le rostre et la peau et permet d'effectuer un mouvement rotatif tout en tirant la tique. et qui ne presse pas l'abdomen de la tique quand on l'enlève. Tournez lentement dans le même sens jusqu’à ce que la tique se décroche de la peau. Attention, il ne faut aucunement tirer. En tirant, il y a de fortes chances pour que le rostre reste dans la peau. Une fois la tique retirée, ne pas oublier de bien désinfecter et de détruire l'animal.
Manipulation du tire-tique
- Surveiller attentivement la plaie pendant trois semaines. Consultez un médecin si vous avez une auréole rouge qui évolue (érythème migrant) ou que vous ressentez un état grippal. La prescription peut être un bilan sanguin et/ou un traitement antibiotique.
En résumé, sur le site de "Notre Temps" regardez la vidéo
Cas des animaux domestiques
Les infestations à tiques sont importantes et de plus en plus fréquentes pour les animaux sauvages et domestiques, elles peuvent :
- Entraîner la mort par anémie dans les cas extrêmes.
- Être responsable de diverses infections dont des maladies à protozoaires, à rickettsies ou à virus, avec en particulier la paralysie à tiques (peu étudiée dans le milieu naturel, mais constatée chez quelques espèces animales : bovins et homme notamment). Elle paralyse les membres qui deviennent alors flasques (mortalité élevée).
Les tiques semblent être les uniques vecteurs d'une maladie parasitaire du sang appelée piroplasmose (ou babésiose) due à un protozoaire (Babesia sp, en particulier B. canis, B. microtii. La piroplasmose atteint les canidés, les équidés, les bovidés. Le protozoaire parasite les globules rouges dans lesquels il se multiplie et les détruit lorsqu'il s'en libère. La piroplasmose entraîne une anémie avec un ictère pâle et généralement une forte fièvre. Dans les stades avancés de la maladie, une coloration brun foncé des urines peut être notée : elle correspond à la bilirubine issue de la dégradation de l'hémoglobine libérée dans le sang par la destruction des globules rouges. La piroplasmose est une maladie potentiellement mortelle.
Pour ôter une tique à un animal domestique (chat, chien, bétail…), il faut écarter les poils de l’animal puis utiliser un tire-tique au plus près de peau. Certains enduisent la tique avec du savon liquide qui aidera l’extraction de la tique par son action glissante. Tournez ensuite, lentement dans le même sens jusqu’à ce que la tique se décroche de la peau en prenant les mêmes précautions que pour une tique sur la peau humaine (voir ci-dessus). Après avoir retiré la tique, détruisez-la et désinfectez bien la plaie avec un désinfectant ou de l’alcool modifié.
Moyens de luttes contre les parasites
- Action pour rompre le cycle externe => épandage de produits acaricides. Ils semblent peu efficaces en raison du réservoir naturel.
- Action sur l’animal pour détruire le parasite => douchage, balnéation avec une solution acaricide.
- Défragmenter les écosystèmes et y laisser les prédateurs vivre, pour y restaurer des équilibres écologiques, de manière à limiter les pullulations de tiques.
À l'Institut Pasteur
Le laboratoire du Centre National de Référence des Borrelia, situé à l’Institut Pasteur, a largement contribué à l’élaboration de la taxonomie du complexe Borrelia burgdorferi sensu lato et à la description notamment des espèces européennes, B. garinii, B. afzelii, B. valaisiana, B. lusitaniae et B. spielmanii. Les autres apports de ce laboratoire ont concerné la démonstration d’un tropisme préférentiel d’organe pour chacune des trois espèces pathogènes B. burgdorferi sensu stricto, B. garinii, et B. afzelii.
Les travaux les plus récents ont permis d’établir une corrélation entre le génotype ospC (gène codant une protéine majeure de membrane externe) et la capacité des souches de B. burgdorferi sensu lato à disséminer dans l’organisme hôte, et à déterminer ainsi des formes disséminées de la maladie. Cette capacité d’invasion des tissus serait liée à l’interaction entre la protéine OspC et le plasminogène de l’hôte.
Le Centre National de Référence des Borrelia de l'Institut Pasteur actuellement dirigé par Murielle Cornet, a diverses missions :
- Estimation de l’incidence de la borréliose de Lyme en France,
- Mise au point de techniques de diagnostic et de typage génotypique des souches de Borrelia,
- Étude épidémiologique du vecteur des Borrelia (densité et taux d’infection des tiques) dans plusieurs régions de France.
Ajout du 21 mai 2017 :
Maladie de Lyme : la situation est explosive (Sciences et Avenir, mai 2017)
Pour en savoir plus :
Une enquête permanente est en cours sur le site "Tiques et France" à laquelle on peut participer pour augmenter le nombre de données en France.
Ajout du 7 octobre 2016 :
Des témoignages recueillis par France 3 Franche-Comté
Enfin ! Un plan national de prévention
Ajout du 18 juillet 2017 :
Piqûre de tiques: Comment prévenir la maladie de Lyme ?
Ajout du 8 août 2017 : Renards et fouines ennemis des tiques
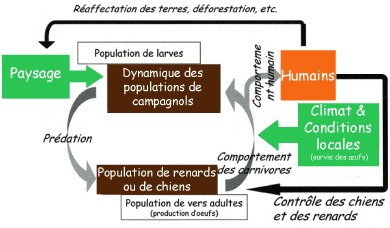
Un renard mort : 6000 à 10 000 souris, mulots et campagnols sauvés que le dit nuisible renard aurait mangé dans l'année ! Merci les gars ! Et vive la bromadiolone et autres anticoagulants ! Dans le cas qui nous préoccupe, les renards seraient une arme efficace contre la maladie de Lyme ! Une étude publiée sur le site de The Royal Society établit un lien bénéfique entre l'activité des prédateurs de rongeurs et la densité de nymphes de tiques vectrices d'infections et rapportée dans Sciences et Avenir.fr d'août 2018 par Valentin Thévenot le 04.08.2017 à 16h14. Obtenus grâce à plusieurs centaines de caméras placées dans les forêts, les résultats des scientifiques parlent d'eux-mêmes : plus le nombre de renards (Vulpes Vulpes) et de fouines (Martes foina) était important, plus le nombre de tiques infectées était faible !
Maladie de Lyme : des Francs-Comtois participent à une étude scientifique nationale
Protéger les prédateurs de rongeurs peut réduire l’incidence Maladie de Lyme
par Michel Deprost le 13 novembre 2017
Les rongeurs sont des hôtes privilégiés des tiques qui transmettent la maladie de Lyme. Pour la première fois, une étude parue dans la revue The Royal Society Publishing confirme, par des analyses de terrain, que la diminution des prédateurs tels que le renard roux, la martre ou le blaireau ont des effets directs sur la transmission de la maladie.
La Fondation de la Recherche pour la Biodiversité rappelle que ces dernières décennies, la maladie de Lyme a augmenté dans le nord-ouest de l’Europe et le nord-est des États-Unis. En France depuis le début de la surveillance de cette maladie par le réseau Sentinelles, aucune évolution significative n'a été observée mais plus de 33 000 nouveaux cas ont été recensés en 2015.
En 2012, une équipe de recherche mettait en évidence le lien entre la perte de biodiversité et le déploiement de cette maladie. L’équipe démontrait que l'émergence de la maladie de Lyme en Amérique du Nord était due à la diminution du renard roux prédateur spécialiste des rongeurs, hôtes privilégiés pour la majorité des tiques.
En 2017, l'équipe menée par Tim R. Hofmeester de l'Université de Wageningen a démontré, en condition réelle, que l‘activité des prédateurs, en régulant les populations de rongeurs porteurs des tiques pouvait abaisser le nombre de tiques dans un écosystème. Moins il y a de tiques, moins elles sont elles-mêmes infestées par des pathogènes comme la bactérie responsable de la maladie de Lyme.
Cette étude est la première à établir, par des analyses de terrain, la corrélation entre l'activité des prédateurs, la densité totale des tiques et la densité des tiques infectées pour trois agents pathogènes transmissibles par les tiques. Elle confirme que la diminution des prédateurs ont des effets en cascade sur la transmission des pathogènes.
La protection des espèces prédatrices telles que le renard roux, la martre, le putois ou le blaireau est une solution fondée sur la nature pour réduire la prévalence des maladies transmises par les tiques.




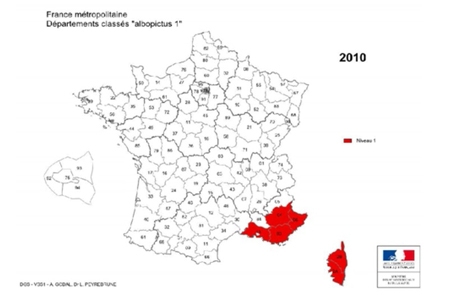
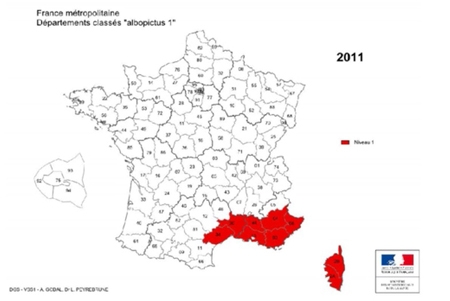
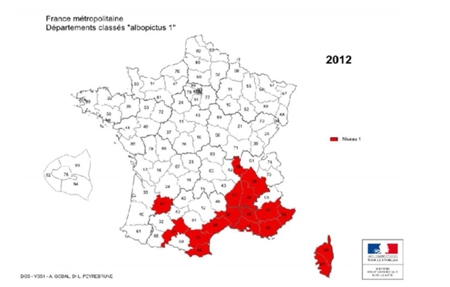
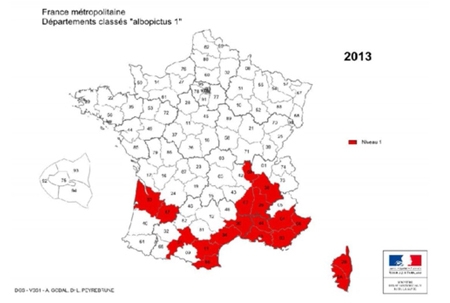




































 Comme nous l'avons vu plus haut, l'Homme contracte la maladie dans l’environnement forestier, où se trouvent préférentiellement les tiques vectrices et leurs hôtes. La maladie montre
Comme nous l'avons vu plus haut, l'Homme contracte la maladie dans l’environnement forestier, où se trouvent préférentiellement les tiques vectrices et leurs hôtes. La maladie montre 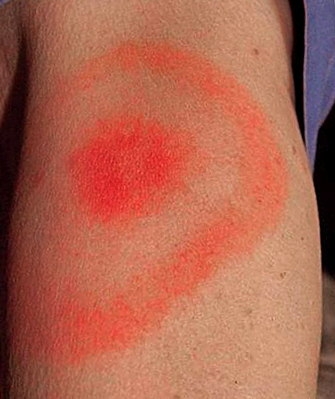


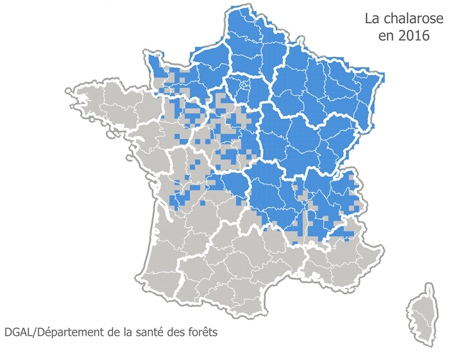
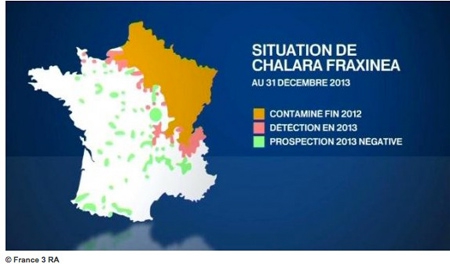
 La chalarose du Frêne
La chalarose du Frêne





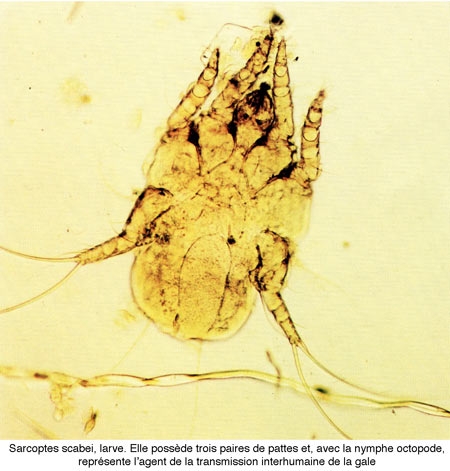
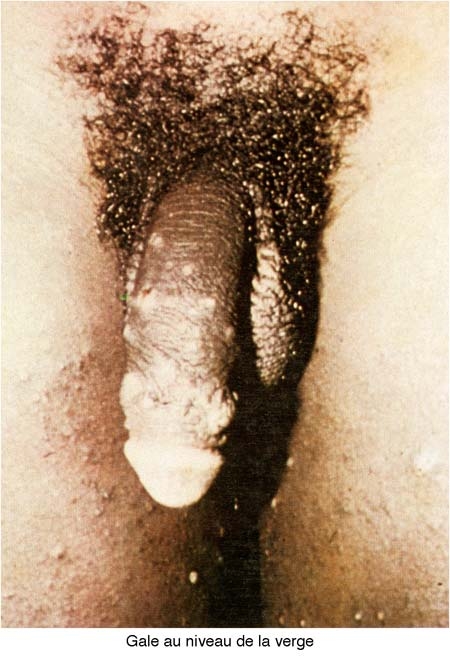
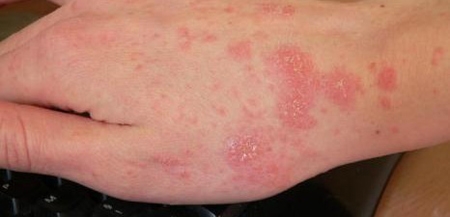
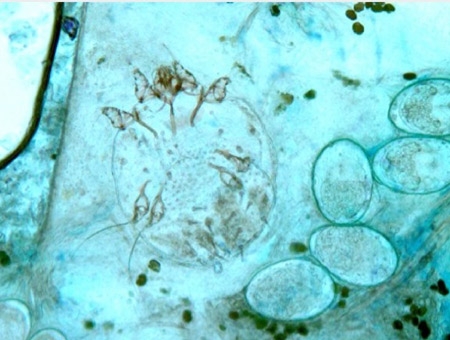
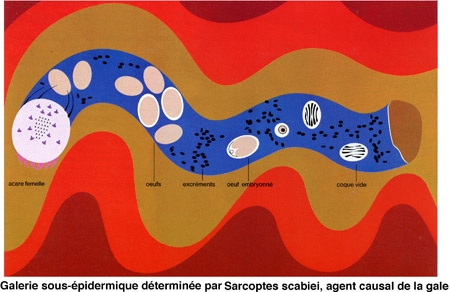
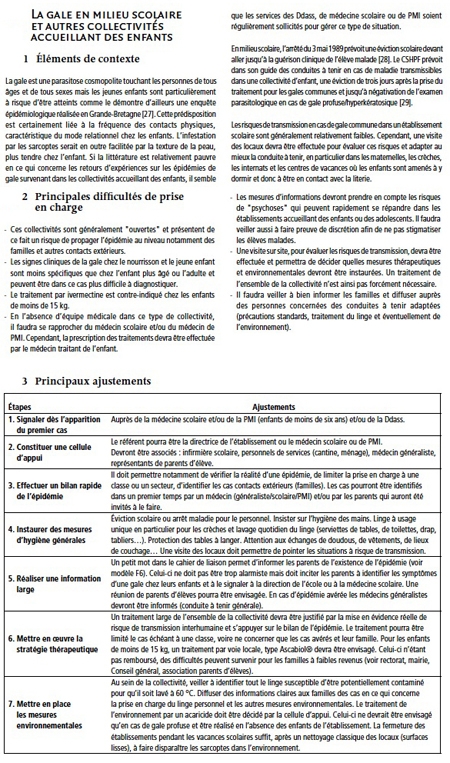
 La gale
La gale



 Une mouche parasite: un nouveau suspect dans le phénomène de disparition des abeilles américaines
Une mouche parasite: un nouveau suspect dans le phénomène de disparition des abeilles américaines 1. Généralités : parasitose et agent de la parasitose
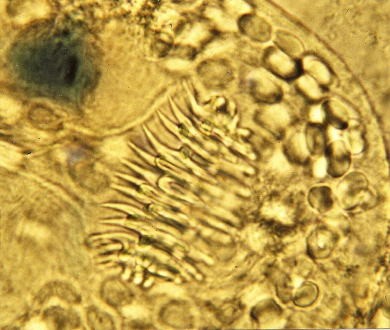
1. Généralités : parasitose et agent de la parasitose
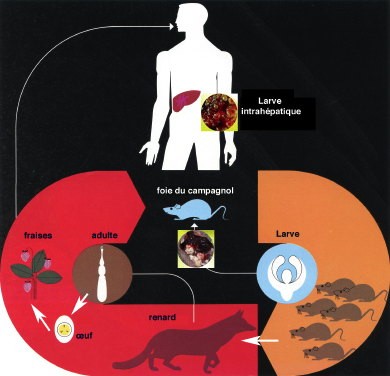
 2. Le cycle parasitaire de l'échinocoque
2. Le cycle parasitaire de l'échinocoque



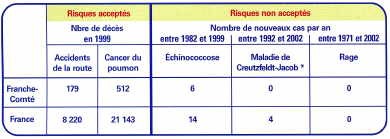
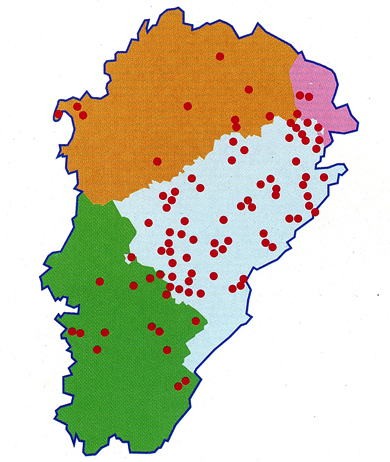
 3. La répartition géographique de l’échinococcose alvéolaire
3. La répartition géographique de l’échinococcose alvéolaire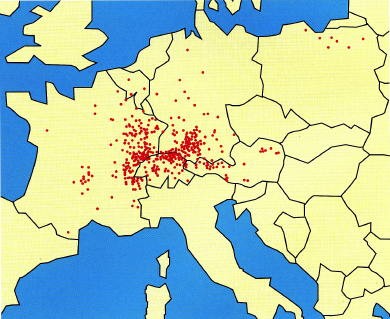
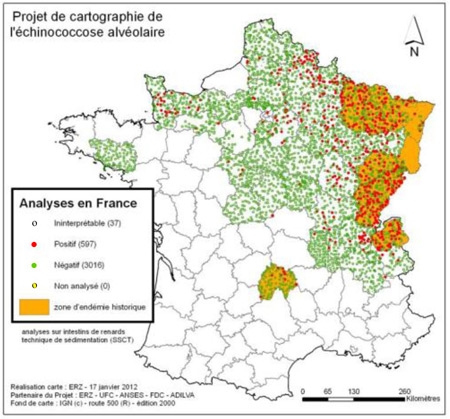
 4. L’échinococcose alvéolaire : évolution épidémiologique et options de contrôle
4. L’échinococcose alvéolaire : évolution épidémiologique et options de contrôle

 5. La clinique de l'échinococcose alvéolaire
5. La clinique de l'échinococcose alvéolaire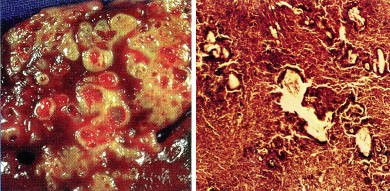

 6. Le diagnostic de l'échinococcose alvéolaire
6. Le diagnostic de l'échinococcose alvéolaire 7. Le traitement de l'échinoccose alvéolaire
7. Le traitement de l'échinoccose alvéolaire