19/03/2010
L'Eider à duvet
 L'Eider à duvet
L'Eider à duvet
Somateria mollissima (L. 1758)
Par André Guyard
L'Eider appartient à l'ordre des Ansériformes et à la famille des Anatidés (canards).
L'Eider à duvet se distingue des autres canards par sa grande taille (60 cm), le profil droit de son bec et son vol qui alterne vol battu (vol habituel des canards) et vol plané.

Le mâle présente une calotte noire, une nuque verte, des joues blanc et vert.C'est le seul canard qui possède un dos blanc et un ventre noir.
La femelle présente une livrée brune striée de nombreuses barres foncées.

L'Eider à duvet est un habitant du littoral marin. On le rencontre aussi bien sur les côtes rocheuses ou sablonneuses. En hiver, on peut l'apercevoir occasionnellement à l'intérieur des terres sur les fleuves ou les lacs.
Son aire de nidification se situe sur l'Atlantique Nord, à la limite de la banquise. L'Eider à duvet est hivernant en France où on le retrouve sur les côtes de la Manche et en Bretagne. Formidable plongeur qui récolte crustacés et coquillages jusqu'à 15 mètres.

Le duvet de canard étant depuis longtemps connu pour ses propriétés isolantes, il est récolté après la période de nidification pour confectionner des édredons.
La période de reproduction commence fin mai-début juin. La femelle bâtit son nid tout près de l'eau sur le sable ou dans une anfractuosité de rocher. Il est construit de matériaux divers : débris végétaux, fragments de coquillages, et garni d'une épaisse couronne de duvet de la femelle. Elle y dépose 4 à 6 œufs couvés pendant 25 à 28 jours. Les jeunes sont nidifuges et s'envolent dans un délai de 65 à 75 jours.
Les femelles seules assurent la protection des poussins
Après la période de reproduction, couvaison et soins aux jeunes sont dévolus aux femelles. Pendant ce temps, les mâles se rassemblent en troupes nombreuses qui peuvent dépasser une centaine d'individus.
L'Eider se nourrit surtout de mollusques (moules, coques, bigorneaux mesurant de 7 à 40 mm) et de crustacés (crabes). Cependant, il ne dédaigne pas les insectes aquatiques, les poissons et les échinodermes (étoiles de mer) qui sont des ingrédients courants à son menu. Son alimentation est complétée par divers végétaux qu'il glane sur le littoral.
Vidéos et photos réalisées en Islande en juillet 2008 par André Guyard
Source :
http://www.oiseaux.net/oiseaux/eider.a.duvet.html
12:05 Publié dans Océanographie, Ornithologie | Tags : eider, oiseaux, somateria mollissima, islande, atlantique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
15/03/2010
La Ciguatera aux Antilles françaises
 La Ciguatera aux Antilles françaises
La Ciguatera aux Antilles françaises
par André Guyard
Les touristes qui se rendent en bord de mer en zone intertropicale ignorent pour la plupart l'existence d'un risque encouru en consommant du poisson de mer. Dans certains cas, tout comme la population locale, ils peuvent subir une intoxication alimentaire : c'est la Ciguatera.
1. Historique
La Ciguatera est une maladie singulière provoquée par l'absorption de la chair de plus de quatre cents espèces de Poissons et d'Invertébrés marins. L'intoxication ciguatérique ou ichtyosarcotoxisme fait partie des toxi-infections alimentaires collectives (TIAC). Le nom de Ciguatera viendrait de "Cigua", un petit Mollusque vivant à Cuba et provoquant des troubles analogues.
Cette maladie est connue depuis fort longtemps ; le premier auteur l'ayant signalée fut Martyr en 1555. Christophe Colomb, Vasco de Gama, Magellan l'ont rencontrée dans les Caraïbes au XVIe siècle. Harmensen l'a signalée dans l'Océan Indien en 1601. Les marins de Fernandez de Quiros ont été intoxiqués en 1606 aux Nouvelles Hébrides : l'équipage avait pêché de nombreux poissons dont des "Pargos" (Lutjanidés) ; les matelots qui en mangèrent furent rapidement à toute extrémité. En 1675, John Locke (philosophe anglais) donna une description clinique et épidémiologique de la maladie aux îles Bahamas.
Plus récemment, le 8 mai 1949, 57 Philippins mangèrent aux îles Mariannes une très grosse murène. Tous furent très malades, onze entrèrent dans le coma et deux moururent.
Le 11 juillet 1951 à Terre de Bas (Saintes), 12 personnes de deux familles furent empoisonnées en mangeant une grosse bécune (barracuda). Les malades souffrirent beaucoup. Trois moururent et un autre devint fou trois mois plus tard.
En 1959, la Martinique a eu à déplorer quelques cas graves d'empoisonnement par des poissons pêchés à St Barthélémy.
Le 7 octobre 1960, 58 malades de l'hôpital de Pointe-à-Pitre ont été victimes d'une intoxication collective après avoir mangé de la "Vieille" en court-bouillon et en friture.
Ainsi chaque année dans les îles volcaniques et coralliennes tropicales des trois océans, plusieurs milliers de personnes sont victimes de la Ciguatera. Les Antilles françaises ne sont bien sûr pas épargnées.
Depuis 1992, la DDASS de Guadeloupe recueille, de façon hebdomadaire, les cas de TIAC par l'intermédiaire d'un réseau de surveillance sanitaire, le réseau Sentinelle.
De 1997 à 1999, 28 incidents ciguatériques impliquant 90 personnes ont été déclarés par l'intermédiaire du réseau Sentinelle. L'endémie est variable selon l'année et touche toutes les classes d'âge (46 % des cas recensés concernent les adultes de 30 à 49 ans).
2. Symptômes de la maladie
Les premiers signes d'intoxication surviennent généralement dans les 12 h qui suivent l'ingestion d'un poisson toxique. La Ciguatera est caractérisée par des effets digestifs précoces, cardio-vasculaires transitoires et neurologiques persistants. Le tableau du syndrome ciguatérique en Guadeloupe est similaire à celui observé dans d'autres îles de la Caraïbe ou en Floride avec une prédominance des signes digestifs, de l'asthénie et des paresthésies des extrémités.
Les symptômes cliniques de la Ciguatera apparaissent dans les heures suivant l'ingestion des poissons. Ils sont aussi bien gastro-intestinaux que neurologiques. Le début est marqué par des vomissements, diarrhées, crampes intestinales ; ensuite viennent des sensations alternatives de chaud et de froid, un goût amer dans la bouche, l'engourdissement de la langue et des lèvres, l'endolorissement des mâchoires avec sensation de perdre les dents, des douleurs dans les articulations, de fortes démangeaisons dans les membres et une fatigue musculaire très nette. On observe de plus une baisse de la tension artérielle, un ralentissement et une irrégularité du rythme cardiaque, une dilatation de la pupille.
Les atteintes cardio-vasculaires, (hypotension et bradycardie) ainsi que les troubles de la sensibilité comme l'inversion de la sensation de chaud et de froid interviennent également mais dans des proportions moindres. Certains signes comme le prurit et les signes neurologiques, peuvent se déclarer plusieurs jours après l'ingestion du poisson.
Dans les formes graves, on peut observer une incoordination des mouvements, des difficultés respiratoires ou urinaires, des troubles visuels. Les cas mortels sont exceptionnels et consécutifs à un état de choc cardiovasculaire.
En général l'évolution est favorable en une semaine environ, mais il n'est pas rare que les troubles de la sensibilité, les douleurs et les démangeaisons persistent plusieurs semaines et soient ravivées par toute nouvelle consommation trop hâtive de poisson même sain (hypersensibilisation). Des malaises neurodigestifs chroniques et des lésions de grattage subsistent d'où le nom de "gratte" donné parfois à l'affection. La durée moyenne de rétablissement paraît être de six mois environ.
Remarque : L'empoisonnement par la Ciguatera diffère dans ses origines comme par ses symptômes des autres sortes d'empoisonnements dus à des poissons comme les Tetraodontidae (Tetrodon sphaeroïdes), les Scombridae (thazards) ou des empoisonnements alimentaires causés par une contamination bactérienne (poissons avariés).
3. Traitements
Dans toutes les îles où sévit la Ciguatera existent des traitements locaux utilisant les propriétés de certaines plantes. Bien souvent ces médications empiriques soulagent les malades et aident à leur guérison.
Aux Antilles françaises et aux îles Vierges on utilise des infusions faites avec des feuilles de Passiflora foetida (Passifloracées), de Rhizophora mangle (Rhizophoracées), de Conocarpus erectus (Combrétacées).
Henri Stéhlé signale également des plantes efficaces comme Bontia daphnoïdes (Myoporacées), Annona muricata (Annonacées), Ricinus communis (Euphorbiacées).
La patate douce râpée crue mélangée à du lait frais et le jus de papaye donneraient aussi de bons résultats.
Pour le docteur Bagnis, chef de l'Unité Océanographique Médicale à l'institut Louis Malardé de Tahiti, les médicaments les plus efficaces sont les sels de calcium, l'atropine, les vitamines du groupe B, les antihistaminiques de synthèse et les corticoïdes dont l'indication respective est fonction des symptômes.
4. Quelques observations faites à propos de la Ciguatera
La Ciguatera est inconnue dans les zones tempérées. Les zones où l'on trouve des espèces toxiques sont nombreuses et très diversifiées (bancs coralliens, récifs barrières, lagons, etc.) mais elles sont souvent limitées.
Aux Bahamas, aux îles de la Société, les poissons de l'un des versants des îles sont beaucoup plus dangereux que ceux de l'autre côté. Les zones accores (à pente rapide) situées au vent ou à l'Est sont plus dangereuses que les zones sous le vent et peu profondes. Une zone toxique peut devenir saine après une longue période de toxicité et inversement.
La phase aiguë d'une recrudescence de Ciguatera classique couvre une période de dix à quinze ans. Les poissons toxiques sont des poissons de récif ou des poissons prédateurs de ces derniers. Les plus dangereux sont les grands prédateurs. À l'intérieur d'une même espèce, plus le poisson est gros, plus il a de chance d'être toxique. Toutes les parties du poisson n'ont pas la même toxicité, le foie et les viscères sont toujours plus toxiques que la musculature. Un poisson très frais peut être toxique. Un poisson peut être toxique à n'importe quelle époque de l'année. Le mode de préparation ou de cuisson ne modifie pas la toxicité.
5. Causes de la Ciguatera
Pendant très longtemps les causes de la maladie sont restées mystérieuses et de nombreuses croyances ont essayé de les expliquer. Certaines sont totalement fantaisistes comme celle affirmant que les vertus toxiques se développent si les poissons ont été exposés au clair de lune. Une autre, encore persistante, suppose qu'une substance chimique contamine le milieu ; le cuivre est le plus souvent impliquée probablement parce que des navires à coque doublée de ce métal ont coulé et parce que des dépôts naturels de cuivre ont été associés à des poissons vénéneux. Cette hypothèse n'explique pas pourquoi des poissons toxiques sont trouvés très loin de ces sources chimiques et pourquoi tous les poissons de la zone ne sont pas dangereux.
Ce n'est que vers 1958 que l'on a commencé à entrevoir la solution en impliquant des toxines sécrétées par des microalgues microscopiques. Les symptômes de la Ciguatera sont dus à l'imbrication plus ou moins marquée d'un mécanisme pharmacologique et d'un mécanisme immunologique résultant de l'action isolée ou conjuguée de toxines ; trois principales ont été mises en évidence.
- La ciguatoxine (C.T.X.) isolée à Hawaï dans les muscles d'une grosse murène et trouvée ensuite chez de nombreux autres poissons. Elle est très active et une dose de 0,1 pg produit des troubles chez l'Homme ;
- La scaritoxine (S.T.X.) isolée à Tahiti en 1976 chez un poisson perroquet (Scarus) est également très toxique ;
- La maitotoxine (M.T.X.) isolée en 1975 au Japon dans les viscères d'un poisson chirurgien. On ne la trouve que dans les viscères des poissons herbivores. Il semble qu'elle puisse se transformer en C.T.X.
Gambierdiscus toxicus Adachi and Fukuyo, 1979 (microalgue dinoflagellée) est l'agent causal principal de la Ciguatera dans la province caraïbe et en Polynésie française. Il a été découvert par T. Yasumoto et R. Bagnis aux îles Gambier à la fin des années 1970. Pour cette raison, les auteurs l'ont appelée Gambierdiscus toxicus.
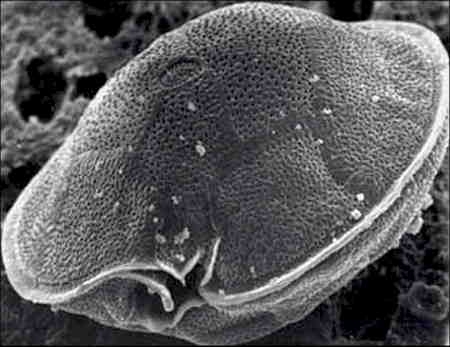
Il s'agit d'un Dinoflagellé appartenant à la classe des Dinophyceae ordre des Péridiniales, famille des Heterolacaceae. Cette microalgue était autrefois rattachée au genre Diplopsalis. D'un diamètre moyen de 80 µm, elle est enveloppée d'une thèque armée et possède une "bouche" profondément échancrée en forme d'encoche oblique, (voir photos). Les auteurs ont pu démontrer que cette microalgue était capable de fabriquer tant en milieu naturel qu'en milieu artificiel les deux toxines (CTX et MTX) responsables de la maladie. Cette microalgue unicellulaire testacée se trouve généralement attachée à des macrophytes qui prolifèrent sur les substrats coralliens morts.
À l'état endémique, l'algue existe dans la plupart des écosystèmes récifaux du Pacifique, de l'Océan indien et des Antilles, mais avec une très faible densité. Le genre Gambierdiscus est caractérisé par une circumdistribution entre 35° N et 35° S. il prolifère sur les coraux morts et les algues brunes en particulier du genre Turbinaria. Remarquons à ce propos que l'espèce Turbinaria turbinata ne se trouve aux Antilles que de la Guadeloupe à la Floride. Elle n'existe pas au Sud et ceci explique peut-être que les accidents ciguatoxiques soient plus fréquents en Guadeloupe et dans les îles du Nord qu'à la Martinique par exemple.
Gambierdiscus est endémique dans des densités relativement faibles dans la plupart des zones de Tahiti. Toutefois, des efflorescences épisodiques de ce dinoflagellé peuvent se produire, et les densités de cellules jusqu'à 10.000 cellules/g de microalgues ont été rapportées occasionnellement. Chacune de ces efflorescences contribue à maintenir un réservoir toxique riche en poison et peut être suivie par des flambées de ciguatera. Les facteurs précis de démarrage de ces efflorescences ont fait l'objet d'une enquête à long terme des populations de Gambierdiscus à Tahiti, de 1993 à 1997. La température joue un rôle important dans le cycle saisonnier de ce dinoflagellé car les populations de Gambierdiscus tendent à atteindre l'abondance maximale pendant la saison chaude (septembre à mars). La morbidité du corail, résultant soit d'événements cycloniques, des épisodes de blanchissement du corail, la pollution marine ou des activités anthropomorphiques, constitue un autre facteur critique dans la genèse naturelle des proliférations de ce dinoflagellé en créant des zones aussitôt colonisées par des macroalgues opportunistes qui sont des hôtes de choix pour les cellules de Gambierdiscus.
En revanche, Gambierdiscus toxicus prolifère énormément dans certaines circonstances, au sein des gazons recouvrant des zones coralliennes mortes. Ainsi après des tempêtes, cyclones, séismes ou par suite de travaux sous-marins en tous genres, de vastes zones de coraux morts peuvent se constituer et permettre la prolifération soudaine de la microalgue. La chaîne alimentaire de la Ciguatera est essentiellement inféodée aux poissons. Il peut cependant arriver que les Mollusques, les Crustacés, les Échinodermes soient touchés.
La toxicité des efflorescences de Gambierdiscus - exprimées en MU/1000 cellules - varie considérablement. Aucune corrélation directe n'a été établie entre cette toxicité et l'efflorescence de la biomasse cellulaire et le caractère saisonnier de divers paramètres environnementaux (température, salinité...).
Le responsable de l'intoxication est donc Gambierdiscus qui constitue la source des puissantes toxines marines vues plus haut. Le problème est que ces composés toxiques vont s'accumuler dans la chaîne alimentaire, depuis les herbivores se nourrissant sur les récifs coralliens jusqu'aux prédateurs de ces herbivores.
La consommation de poissons de récifs qui ont accumulé les divers ciguatoxines induit en quelques heures après le repas toxique, un large éventail de symptômes gastro-intestinaux, neurologiques et cardio-vasculaires. La gravité des symptômes dépend de l'espèce de poisson, du taux de ciguatoxine ingérée et de la susceptibilité individuelle. La physiopathologie est caractérisée par un ensemble de symptômes neurologiques pour lesquels les signes déterminants sont essentiellement des modifications de la sensibilité sensorielle cutanée telles que paresthésies (sur les extrémités et/ou de la zone péri-orale) et dysesthésie (inversion de la perception de chaleur et la froideur). En outre, l'ataxie, arthralgie, myalgie, vertiges, hypersalivation, des démangeaisons et une asthénie plus ou moins durables dans le temps sont des symptômes très fréquents. [Institut Malardé, Tahiti, Site Web, 2002]. Ces efflorescences de Gambierdiscus peuvent être comparées aux marées rouges entraînées par la pullulation de certains dinoflagellés planctoniques des zones tempérées qui fabriquent une variété de toxines connexes, tels que la saxitoxine et la brévétoxine.
Les toxines sont introduites dans la chaîne alimentaire par les poissons herbivores. Si la MTX reste localisée aux contenus digestifs (pour des raisons d'ailleurs inconnues), la CTX se retrouve aussi bien dans le tube digestif que le foie et les muscles des herbivores. La toxine va se concentrer par le jeu de la chaîne alimentaire : on retrouvera donc cette toxine principalement dans les poissons carnivores benthiques et pélagiques. Plus le prédateur sera gros, plus son organisme contiendra de toxines accumulées et plus il sera dangereux. On a en effet démontré qu'un poisson toxique n'éliminait pas ses toxines même si artificiellement en aquarium, on le nourrit plusieurs mois avec de la nourriture privée de substances ciguatoxiques. Ainsi, une "Bécune" (Barracuda) qui mange un "Chirurgien" absorbe dans un seul repas toute l'accumulation de toxines qu'à reçu cet herbivore pendant sa vie.
6. Précautions à prendre pour lutter contre la Ciguatera
- Protéger le milieu marin
Les agressions naturelles du milieu généralement saisonnières ou cycliques entraînent des perturbations écologiques diffuses et passagères responsables de "flambées" épisodiques de Ciguatera. En temps normal donc, seules les espèces de poissons carnivores de très grande taille ont accumulé suffisamment de toxines dans leurs tissus pour être dangereuses à consommer.
En revanche, les agressions anthropiques du milieu marin perturbent considérablement les écosystèmes coralliens. L'aménagement de ports, de marinas, de zones urbanisées, les dragages, la pollution chimique, thermique ou organique croissante, risquent à brève échéance de multiplier les zones où la microalgue toxique pourra pulluler.
- Éviter de consommer les espèces risquant d'être toxiques
D'après I. Pottier (2002), les spécimens toxiques appartiennent à quatre familles de poissons carnivores et de haut niveau trophique : carangues, pagres, mérous et barracudas. Les pourcentages de poissons toxiques pour l'homme s'élèvent à 29 % chez la Carangue gros yeux, 27 % chez la Carangue jaune, et 33 % chez la Carangue noire. Une corrélation positive entre le poids et la toxicité a été trouvée pour l'espèce Carangue gros yeux et pour les pagres toutes espèces confondues. Les poissons carnivores de petite taille appartenant à différentes espèces de Mérous ont montré une toxicité moyenne tandis que les espèces atoxiques sont
- des poissons pélagiques (les Dorades Coryphènes, les Bonites blanches et les Thons rélés),
- des petits mangeurs d'invertébrés ou des microphages,
- les bourses blanches et les vives,
- des poissons appartenant à des espèces à risque mais de petite taille,
- des poissons appartenant à des familles habituellement comestibles.

Dorade coryphène
L'arrêté préfectoral du 22 novembre 1960 interdit la consommation aux Antilles françaises des espèces suivantes :
Sphyraena barracuda : Bécune ou Barracuda.

Sphyraena barracuda
Seriola dumerili : Badiane ou fausse Carangue.

Seriola dumerili
Caranx latus : Carangue gros yeux,"Mayol".

Caranx latus
Caranx bartolomaei : Carangue jaune.

Gymnothorax funebris : Murène verte "Congre vert".

Gymnothorax funebris
Sphaeroïdes greeleyi : "Tchouf Tchouf" "Pelpète".

Sphaeroïdes greeleyi
Les espèces suivantes sont toxiques à Saint Martin et Saint Barthélémy :
Espèces déjà citées ci-dessus.
Mulloidichtys martinicus : "Barbarin blanc" "Souris".

Mulloidichtys martinicus
Scomberomorus regalis : "Thazard".

Scomberomorus regalis
Caranx ruber : Carangue à Pisquette. Carangue franche.

Caranx ruber
Caranx lugubris: Carangue noire.

Caranx lugubris
Malacanthus plumieri : "Vive".

Malacanthus plumieri
Les espèces suivantes sont parfois toxiques à Saint Martin et Saint Barthélémy :
Epinephelus morio : "Nègre" - "Vieille" - "Couronné" - "Tanche".

Epinephelus morio
Epinephelus guttatus : "Vieille rouge".

Epinephelus guttatus
Mycteroperca bonaci : "Vieille".

Mycteroperca bonaci
Mycteroperca venenosa : "Vieille à carreaux".

Mycteroperca venenosa
Echeneis naucrates : "Sucet" ou Rémora. Le rémora est ce poisson qui, grâce à sa ventouse céphalique, se fixe sur un poisson plus gros, notamment un requin.

Echeneis naucrates
Lactophrys bicaudalis : Coffre.

Lactophrys bicaudalis
Lactophrys triqueter : Coffre.

Lactophrys triqueter
Lachnolainus maximus : "Capitaine" "Aigrette".

Lachnolainus maximus
Balistes vetula : "Bourse".

Balistes vetula
- Ne jamais donner suite aux affirmations empiriques supposées distinguer les poissons toxiques des poissons sains
On ne connaît pas à l'heure actuelle aucun test simple et rapide pour détecter la toxicité des poissons ni d'ailleurs de moyens de protection efficaces des consommateurs. Les seules techniques biochimiques que l'on peut utiliser sont incompatibles avec les impératifs d'une commercialisation du poisson.
Il est toujours possible de faire un test sur un chat, mais celui-ci vomit souvent le poisson vénéneux. Par contre Banner et Boroughs ont remarqué que la mangouste est très sensible à la Ciguatera ; elle ne vomit jamais le poisson et montre des symptômes caractéristiques tels que la perte de certains réflexes et l'incoordination des membres postérieurs puis antérieurs. Un coma précède la mort de l'animal.
Quant aux moyens empiriques qui permettraient de détecter une éventuelle toxicité, ils sont très nombreux, plus ou moins fantaisistes et ne doivent pas être pris au sérieux. Citons-en quelques-uns pour mémoire.
On place un objet argenté avec le poisson pendant sa cuisson : si l'objet noircit, le poisson est toxique.
Les mouches évitent les poissons vénéneux ; si les mouches viennent, elles volent de manière désordonnée et meurent.
Si l'on incise la chair du poisson avec un couteau et que l'on arrose la partie incisée avec du jus de citron, la chair noircit si le poisson est vénéneux ; elle blanchit dans le cas contraire.
Si l'on respire profondément au niveau des ouïes du poisson, on doit éternuer si celui-ci est toxique.
- Informer les scolaires, les pêcheurs et la population en général
Les professeurs de SVT ont une mission importante à accomplir vis-à-vis de leurs élèves. En effet à propos de l'étude de la nutrition et des chaînes alimentaires, ils peuvent aisément expliquer les causes de la Ciguatera et les moyens de l'éviter en faisant reconnaître les principales espèces dangereuses grâce à des montages audio-visuels. Un rôle d'information que pourraient reprendre périodiquement les médias : presse écrite et surtout télévision.
Conclusion
Si l'on connaît maintenant l'origine et la transmission de la Ciguatera dans la nature, tous les problèmes sont loin d'être pour autant résolus et on explique encore mal la manière dont l'affection agit sur l'Homme. Les objectifs scientifiques à atteindre sont donc :
- la découverte d'un diagnostic simple, rapide et fiable de la toxicité des poissons avant leur commercialisation ;
- la mise au point d'une méthode de traitement spécifique de la maladie ;
- la prévention de l'intoxication humaine. C'est à la recherche active de ces objectifs, que s'appliquent les équipes travaillant actuellement sur la Ciguatera à Hawaï, au Japon et à Tahiti.
Bibliographie
Adachi R., and Y. Fukuyo. 1979. The thecal structure of the marine toxic dinoflagellate Gambierdiscus toxicus gen. et sp. nov. collected in the ciguatera-endemic area. Bull. J. Soc. Sci. Fish. 45:67-71.
Anderson D.M., and P.S. Lobel. 1987. The continuing enigma of ciguatera. Biol. Bull. 172:89-107.
Baden D., L.A. Fleming, and J.A. Bean. 1994. Marine toxins. In Handbook of Clinical Neurology 21:1-34.
Baden D. G., K.S. Rein, M. Kinoshita, and R.E. Gawley. 1990. Computational modeling of the polyether ladder toxins brevetoxins and ciguatoxin. In T.R.Tosteson (Ed.). Ciguatera. Polyscience Publishing, Quebec.
Bagnis R. 1972. Quand le corail se venge in Science et Vie, septembre 1980.
Bagnis R., A.M. Legrand, and A. Inoue. 1990. Follow-up of a bloom of the toxic dinoflagellate Gambierdiscus toxicus on a ringing reef in Tahiti. Pp. 98-103 in E. Graneli, B. Sundstrom, L. Edler, and D.M. Anderson (Eds.). Toxic Marine Phytoplankton. Elsevier, Amsterdam.
Ballentine, D.L., T.R. Tosteson, and A.T. Bardales. 1988. Population dynamics and toxicity of natural populations of benthic dinoflagellates in southwestern Puerto Rico. Journal of Experimental Marine Biology and Ecology 119:201-212.
Bomber, J.W., M.G Rubio, and D.R. Norris. 1989. Epiphytism of dinoflagellates associated with the disease ciguatera: substrate specificity and nutrition. Phycologia 28:360-368.
Bomber, J.W., R.R.L. Guillard, and W. G. Nelson. 1988. Roles of temperature, salinity and light in seasonality, growth and toxicity of ciguatera-causing Gambierdiscus toxicus Adachi et Fukuyo (Dinophyceae). Journal of Experimental Marine Biology and Ecology 115: 53-65.
Bomber, J.W., D.R. Norris, and L.E. Mitchell. 1985. Benthic dinoflagellates associated with ciguatera from the Florida Keys II. Temporal, spatial and substrate heterogeniety of Prorocentrum lima. Pp. 45-50 in D.M. Anderson, A. White, and D.G. Baden (Eds.). Toxic Dinoflagellates. Elsevier, New York.
De Sylva, D. 1994. Distribution and ecology of ciguatera poisoning in Florida, with emphasis on the Florida Keys. Bulletin of Marine Science 54: 944-954.
Durand-Clement, M. 1986. A study of toxin production by Gambierdiscus toxicus in culture. Toxicon 24:153-1157.
Ébroin A. 1972. Poissons venimeux et vénéneux des Antilles Françaises. Ed. Désormeaux Fort-de-France.
Faust, M.A. 1996. Dinoflagellates in a mangrove ecosystem, Twin Cays, Belize. Nova Hedwiga 112:445-458.
Gillespie, N.C., M.J. Holmes, J.B. Burke, and J. Doley. 1985. Distribution and periodicity of Gambierdiscus toxicus in Queensland, Australia. Pp. 183-188 in D.M. Anderson, A. White, and D.G. Baden (Eds.). Toxic Dinoflagellates. Elsevier, New York.
Holmes, M.J., R.J. Lewis, M.A. Poli, and N.C. Gillespie. 1991. Strain dependent production of ciguatoxin precursors (gambiertoxins) by Gambierdiscus toxicus (Dinophyceae) in culture. Toxicon 29:761-775.
Landsberg, J.H. 1995. Tropical reef-fish disease outbreaks and mass mortalities in Florida, USA: What is the role of dietary biological toxins ? Dis. aquat. org. 22:83-100.
Lawrence, D. N., R.M. Enriquez, A. Lumesh, and A. Maceo. 1980. Ciguatera fish poisoning in Miami. Journal of the American Medical Association 224:224-254.
Lewis S.J. 1992. Ciguatoxins are potent ichthyotoxins. Toxicon 30:207-211.
Morice J. 1961 Liste préliminaire des poissons vénéneux côtiers de l'île de St Barthélémy. Institut des pêches maritimes. Gustavia St Barth.
Palafax, N., L. Jain, A.Z. Pinano, T.M. Gulick, R.K. Williams, and I.J. Schatz. 1988. Successful treatment of ciguatera fish poisoning with intravenous mannitol. Journal of the American Medical Association 259:2740-2742.
Pottier I. (2002). La ciguatera aux Antilles : épidémiologie, analyse de la C-CTX-1 et étude de la diversité des ciguatoxines dans les poissons toxicophores. Université de Caen.
Randall J. 1961. Empoisonnement par des poissons tropicaux. University of Miami Florida.
Renoux G. 1982. La Ciguatera. Bull. APBG Guadeloupe 9:68-75.
Shimizu Y. 1987. Dinoflagellate toxins. In F.J.R. Taylor (Ed.). The Biology of Dinoflagellates. Blackwell Scientific Publications, Oxford.
Stauch A. 1981. La Ciguatera. Une maladie causée par l'absorption d'aliments d'origine marine. F.A.0. Port au Prince Haïti.
Steidinger, K.A. 1993. Some taxonomic and biologic aspects of toxic dinoflagellates. In I. Falconer (Ed.). Algal Toxins in Seafood and Drinking Water. Academic Press, New York.
Tindall, D.R., and S.L. Morton. 1998. Community dynamics and physiology of epiphytic/benthic dinoflagellates associated with ciguatera. In D.M. Anderson, A.D. Cembella, and G.M. Hallegraeff (Eds.). Physiological Ecology of Harmful Algal Blooms. Springer-Verlag, Berlin.
Tomas, C. 1996. An overview of toxic episodes in the Western Hemisphere. In D. Baden (Ed.). Proceedings of the Workshop Conference on Seafood Intoxications: Pan American Implications of Natural Toxins in Seafood.
Pour en savoir plus sur le web
http://www.ilm.pf/ : la page de l'Institut Louis Malardé de Papeete
http://www.com.univ-mrs.fr/IRD/atollpol/glossaire/cigua.htm
http://www.tahiti1.com/fishing/ciguatera-fr.htm
18:03 Publié dans Nature et santé, Pollution | Tags : ciguatera, poissons toxiques, ichtyosarcotoxisme, poissons tropicaux, gambierdiscus, polynésie, pacifique, atlantique | Lien permanent | Commentaires (4) | ![]() Facebook | | |
Facebook | | |


