20/02/2013
Macrophytes littoraux et écosystèmes lacustres
 Rôle des macrophytes littoraux dans le fonctionnement des écosystèmes lacustres
Rôle des macrophytes littoraux dans le fonctionnement des écosystèmes lacustres
par Paul Testard
I. Introduction
Dans le vocabulaire limnologique, le terme de macrophytes désigne l'ensemble des végétaux visibles à l'œil nu et inféodés à des degrés divers au milieu aquatique.
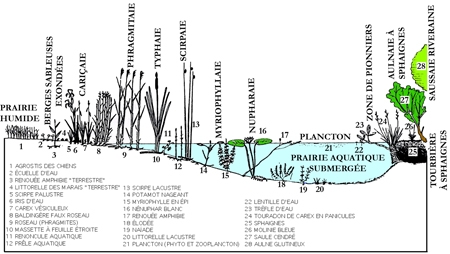
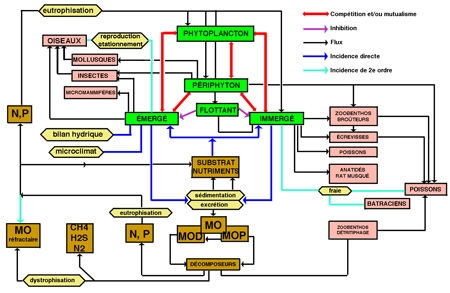
Sous ce terme est rassemblé un patrimoine biologique commun aux spécialistes des zones humides, représenté schématiquement par des végétaux émergés, supportant une immersion partielle (hélophytes), et aux limnologues, plus directement concernés par le rôle des herbiers littoraux résultant d'associations entre des hélophytes, des végétaux immergés et flottants (hydrophytes) (figure 1). Par extension, le terme de macrophytes désigne aussi un compartiment de l'écosystème aquatique susceptible d'être intégré à des modèles globaux de fonctionnement (figure 2).
Figure 1— Représentation schématique de la répartition des macrophytes dans la zone littorale d'un lac tempéré peu profond . au contact de formations prairiales (partie gauche de la figure) et arbustive (partie droite) (Montegur. Doc. ACTA. Tome 1, 1987).
Leur intervention spécifique dans le fonctionnement global des écosystèmes lacustres reste assez peu connue et peut-être sous-estimée. Il s'ajoute une difficulté analytique particulière à ces herbiers : leur association étroite avec des communautés microphytiques (algues + bactéries), qui constituent elles-mêmes la base structurelle du périphyton (ou Aufwuchs).
On peut concevoir que leur impact sur le fonctionnement des écosystèmes lacustres varie globalement en raison inverse de la dimension des milieux. Selon Duarte et al. (1986), une distinction doit être faite entre les hélophytes dont la biomasse et la surface de recouvrement sont proportionnelles à la surface des milieux lacustres (7% en moyenne), tandis que la biomasse et la surface occupée par les immergés diminuent d'une manière inversement proportionnelle aux dimensions des lacs. Dans la série continue des écosystèmes limniques, reliant les grands lacs aux milieux calmes et peu profonds, on peut ainsi trouver toutes les situations : depuis leur absence totale, l'existence de franges littorales ténues et dispersées, jusqu'à une occupation presque totale de l'espace en eau.
Figure 2— Incidences principales de la présence des macrophytes dans la zone littorale d'un lac tempéré.
Pour conclure, les petits milieux et les milieux peu profonds en général, représentent en nombre et en surface totale un patrimoine naturel bien supérieur à celui des grands lacs (figure 3). Dans l'hémisphère nord en particulier, des millions de lacs ont une surface inférieure à 10 ha et une profondeur moyenne inférieure à 3 m. De ce fait, on ne peut que s'interroger sur l'importance des macrophytes dans l'économie des systèmes aquatiques continentaux.
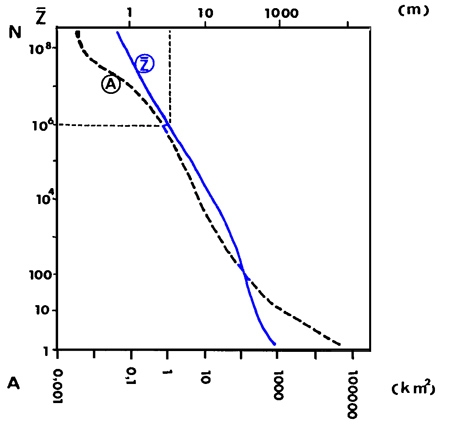
Figure 3 — Distribution numérique des systèmes lacustres en fonction de leur surface (A : tiretés) et de leur profondeur moyenne (Z : tracé bleu) (Wetzel 1990).
II. Conditions d'implantation
La présence en milieu lacustre de macrophytes enracinés est largement conditionnée par l'existence de sédiments constitués et stables (sables limoneux, argiles, vases organiques). En milieu tempéré, seules les mousses s'implantent sur des substrats rocheux, tandis que les flottants développent leurs racines dans l'eau même. L'extension des herbiers est déterminée par un ensemble complexe, souvent synergique, de facteurs morphométriques et physico-chimiques (cf. Duarte et al. 1986), voire historiques. Y sont associés : la morphologie et la pente des rives, le marnage, la nature des substrats (granulométrie et teneur en matière organique, oxygénation), la profondeur, les turbulences littorales (fetch, exposition des rives aux vents dominants), et plus spécialement pour les immergés, la turbidité de l'eau et la pression hydrostatique.
Les blooms phytoplanctoniques précoces et intenses en milieu eutrophe sont ainsi susceptibles d'inhiber leur développement, voire d'entraîner leur disparition (Sculthorpe 1967, Jupp & Spence 1977, Pokorny et al. 1990). Une forte charge en MES (Matières En Suspension) inorganiques a des effets identiques, avec leur remplacement éventuel par des végétaux flottants ou à feuilles flottantes (Malthus et al. 1990).
Enfin, envisagée sous ses aspects dynamiques, l'implantation des herbiers littoraux conduit à l'établissement de formations “climaciques” relativement peu stables ou à évolution lente. La phase pionnière de la colonisation de nouveaux milieux, quant à elle, est souvent marquée par un envahissement massif, de durée variable, par une seule espèce (Ceratophyllum, Elodea et Myriophyllum tempérées, Pistia tropicale,...). Un état d'équilibre dynamique, même en conditions de stabilité hydrologique, ne semble pouvoir être atteint qu'au terme de longues périodes (de 10 à 30 ans et plus en milieu tempéré, cf. Hutchinson 1975). Un tel équilibre s'établit en effet sur la base de processus compétitifs : entre hélophytes ou entre hélophytes et hydrophytes. Dans ce cas-ci, ce sont évidemment les variations du niveau moyen du milieu lacustre qui constituent le facteur directeur de la colonisation. Cette compétition se fonde aussi sur leur capacité relative à se développer sur des substrats anoxiques, selon leur possibilité d'entamer leur cycle végétatif en immersion prolongée, selon leur taux relatif de croissance (tiges et/ou rhizomes, filamenteuses contre hélophytes), ou sur la durée respective de leur phase végétative.
III. Organisation spatiale
Pour un certain nombre des raisons énoncées ci-avant, les macrophytes ne s'étendent qu'exceptionnellement au delà de 10 m de profondeur (jusqu'à 30 m en milieu oligotrophe), à un niveau où Iz est compris entre 0,01 et 0,02 I0 (Hutchinson 1975). À échelle plus réduite, leur implantation est déterminée au premier chef par la topographie locale et l'hétérogénéité des sols. Il en résulte souvent un système de répartition en mosaïque, où peuvent même s'interpénétrer zones d'eau libre, hélophytes et hydrophytes. Les herbiers littoraux peuvent donc constituer des structures très diversifiées, se prêtant à des analyses phytosociologiques (cf. Hejny & Husak 1978).
Il n'en reste pas moins que l'organisation des herbiers littoraux peut aussi s'établir suivant des schémas de zonation stricte (cf. la succession classique caricaie, phragmitaie, jonchaie, typhaie, potamaie,..) où chaque strate peut à la limite, être constituée par une seule espèce ou un seul genre, (figure 1). La salinité des eaux intérieures, enfin, constitue un obstacle à l'extension des macrophytes dulcicoles. Cette barrière n'est pas totalement étanche, lorsque les eaux sont à dominante sulfatée (calcique, sodique ou magnésienne), (Hammer & Hebeltine 1988) ; les Characées étant les moins affectées par ce type de salure des eaux (Comin & Alonso 1978).
IV. Biomasse et productivité
Sous climat tempéré, la biomasse chlorophyllienne des macrophytes en majorité annuels atteint son maximum au cours de l'été ou à la fin de l'été (juillet-août / début septembre). En l'absence de prédation ou de déprédation significatives, leur production annuelle moyenne est estimée à 1,20 fois la biomasse maximale. En milieu tropical (cas des papyrus), le renouvellement de la biomasse est continu et la production annuelle est estimée égale à 3 ou 4 fois la biomasse maximale.
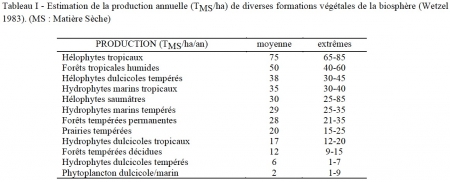
Les macrophytes se signalent en tant que producteurs efficaces (tableau I). Les émergés littoraux, en particulier le genre cosmopolite Phragmites sp., ou Eichornia crassipes (la jacinthe d'eau flottante), figurent parmi les meilleurs producteurs primaires de la planète. Le rendement net de photosynthèse chez des hélophytes de lacs d'Europe centrale par exemple a été estimé varier de 4 à 7%, soit des valeurs similaires à celles obtenues avec des plantes à usage industriel, cultivées intensivement (Dykyjova 1978). A titre indicatif pour le domaine tropical, la biomasse des herbiers à hélophytes du lac Tchad (Phragmites + Typha + Papyrus) a été estimée à environ 70 T/ha, et jusqu'à 180 T pour les seuls Papyrus (Lévêque 1972).
En milieu lacustre tempéré, cette capacité productive décroît dans la série reliant les émergés aux immergés et aux végétaux à feuilles flottantes (tableau II). L'impact des herbiers sur leur propre environnement tend donc à décroître de la zone littorale jusqu'aux niveaux les plus profonds. Les flottants de la zone tempérée sont eux-mêmes capables de réaliser une production importante. C'est le cas de la châtaigne d'eau (Trapa natans) qui produit annuellement de 5 à 7 T/ha en Italie du nord (Guilizzoni & Galanti 1989, Galanti et al. 1990).
Bien que l'eutrophisation d'un milieu puisse favoriser la production végétale jusqu'à provoquer une exubérance extrême des herbiers, cette production n'est pas en correspondance aussi directe et immédiate avec le statut trophique des eaux lacustres (teneur en nutriments) que ne l'est la production phytoplanctonique ou celle des algues filamenteuses.
Dans le lac Stechlin, oligotrophe, les Characées sont ainsi capables de produire en moyenne 5 TMS/ha et localement jusqu'à 10 T/ha ; la production du Potametum lucentis peut atteindre jusqu'à 9,8 T/ha/an. Celle des hélophytes (Typha et Phragmites) peut atteindre ou dépasser 10 T/ha/an (Casper 1980). Une partie importante des macrophytes (hélophytes, Nymphaeacées, Potamots, ...) se signale par la production d'un tissu racinaire volumineux et par la production de rhizomes riches en réserves hydrocarbonées. L'ensemble représente fréquemment plus de 50% de la biomasse maximale, jusqu'à 90% chez Pragmites. C'est chez les végétaux inférieurs les plus profonds (Characées, Isoetes) que le système “racinaire” est le moins développé.
V. Influences sur l'environnement physique
1. Distribution de l'énergie lumineuse
Alors que les macrophytes flottants ou à feuilles flottantes peuvent constituer de véritables écrans empêchant toute pénétration significative de lumière, les herbiers à hélophytes et les immergés vrais interviennent dans la distribution de l'énergie suivant une loi exponentielle répondant à une relation du type:
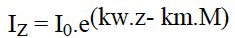
où I0 désigne la quantité d'énergie parvenant au sommet de l'herbier et Iz celle atteignant le niveau z au sein de la formation végétale. Kw et Km représentent les coefficients d'atténuation de la lumière propres à l'eau et à la biomasse. M correspond au stock de biomasse située au dessus du niveau z. Il en résulte que le niveau d'éclairement à la base de denses formations d'hélophytes peut atteindre une valeur proche de la limite pour la photosynthèse (Iz # 0,01.10) ou inférieure à celle-ci (figure 4).
2. Influence sur le microclimat
Cette captation de l'énergie a pour conséquence immédiate un réchauffement diurne du biotope, jusqu'à 4-5°C au printemps, à la base des jeunes pousses d'hélophytes ou à la surface d'herbiers à feuilles flottantes par exemple, avec comme corollaire une accentuation éventuelle des cycles nycthéméraux et de la stratification thermique (jusqu'à 10°C/m dans les herbiers à feuilles flottantes ; Dale & Guillespie 1977). Le réchauffement littoral peut aussi générer des courants de convection orientés perpendiculairement à la rive suffisamment importants pour assurer un transfert d'éléments dissous au-delà de la zone strictement littorale (de 36 cm/min. en surface et de 25 cm/min. au fond et jusqu'à 130 cm/min en période de fortes chaleurs, dans le lac de Constance, Schröder 1975).
Toutefois, les hélophytes à leur plein développement peuvent avoir une action modératrice sur le microclimat littoral en produisant d'importantes quantités de vapeur d'eau par la transpiration et en la retenant au sein de la formation émergée.
3. Évapotranspiration et incidences hydrologiques
Les herbiers ont en effet une capacité évaporative - par évapotranspiration - en général supérieure à celle de l'eau libre. Elle est maximale chez les hélophytes pouvant atteindre en été 6 à 7 fois celle de l'évaporation d'une surface d'eau libre, soit concrètement : de 50 à 100 T d'eau évaporée à l'hectare en période estivale (Rychnovska 1978). Cette capacité se réduit chez les végétaux à feuilles flottantes chez lesquels l'évapotranspiration ne représente qu'environ 2 fois l'évaporation naturelle. Elle peut même lui être inférieure en période de vent. Ce processus d'évapotranspiration, phénomène étroitement associé à la photosynthèse, atteint son maximum au cours de l'été et peut donc jouer un rôle significatif dans le bilan hydrique de milieux peu profonds et faiblement renouvelés.
4. Hydrodynamisme et sédimentation
Les herbiers constituent des amortisseurs efficaces des turbulences littorales (réduction de 36% de la vitesse des courants côtiers dans le lac Wingra par exemple, Weiler 1978). Non seulement ils s'opposent àl'érosion des berges, mais ils constituent des pièges à sédiments efficaces, en retenant les sédiments fins en période de calme et les éléments les plus grossiers (sables) en phase de turbulences. A la limite, dans le cas d'exubérance extrême, ces herbiers s'opposent à la circulation de l'eau entre les zones littorale et pélagique, entretenant ainsi des entités fonctionnelles autonomes, confinées, au centre desquelles la sédimentation est à prédominance organique.
Les macrophytes littoraux génèrent leurs propres sédiments par l'accumulation de feuilles mortes, de tiges lignifiées réfractaires (hélophytes), de racines et/ou de rhizomes, voire de la quasi totalité de la plante dans les conditions de dystrophie maximale (franges littorales tourbeuses).
Ces deux types de processus concourent à l'exhaussement des zones rivulaires à faible pente et des bordures marécageuses en général. L'accumulation de sédiments inorganiques contribue à la formation de sols particuliers, soit acides et humifiés, à C/N très élevé # 40 (le dy) ou alcalins (le gyttja), biologiquement actifs et à C/N < 10.
Les herbiers sont donc des éléments moteurs de l'atterrissement des lacs peu profonds réalisé par une avancée progressive des émergés littoraux au détriment des immergés ; des sols tourbeux (alcalins ou acides) peuvent aussi se superposer au dy ou au gyttja.
VI. Intervention dans les cycles biogéochimiques
1. Impact hydrochimique en relation avec la photosynthèse
La participation des herbiers au bilan d'oxygène des zones littorales s'inscrit dans une alternance d'enrichissement et de consommation la fois journalière et saisonnière : enrichissement diurne et consommation nocturne par le complexe macrophytes-périphyton d'une part, et forte demande en oxygène lors de leurs phases de sénescence (septembre, sous nos climats) et détritique (octobre novembre) d'autre part. Le bilan photosynthèse-respiration peut donc être négatif. Dans le cas de très fortes densités, sous l'effet de l'absorption de la lumière, une anoxie sévère peut être entretenue continuement à la base de la formation végétale. Elle peut même s'accompagner d'un abaissement très important du potentiel redox de l'eau (Eh # -100 mv, papyraies d'Afrique orientale, Beadle 1974) et d'une production intensive de méthane (CH4).
Comme autre conséquence de leur activité photosynthétique, indirecte celle-ci, les macrophytes ont également un impact sur les modalités et les taux de circulation des éléments nutritifs.
L'action la plus facilement décelable est liée à leur capacité d'oxygénation de leur rhizosphère (cf. Sand-Jensen et al. 1982) sur des profondeurs qui peuvent, au moins chez les hélophytes, largement dépasser 20 cm, jusqu'à un mètre et plus dans certaines roselières. Cette propriété “détoxifiante” conditionne leur survie et leur développement sur des sédiments anoxiques. Sachant que le réseau racinaire (filamenteux) peut représenter de 10 à 80% de la biomasse totale, leur capacité d'oxydation des sédiments peut être considérable.
L'élévation du potentiel redox résultante (cf. Carpenter et all. 1983, Jaynes & Carpenter 1986) tend en principe à réduire le taux de transfert de métaux (Fe et Mn) et des nutriments sédimentaires vers l'eau libre. Toutefois, cette oxydation cesse d'être mesurable dans les sédiments anoxiques et dystrophes, à potentiel redox fortement négatif, dont ils peuvent entretenir la dystrophie par la rétention et l'accumulation de matériaux organiques réfractaires.
En outre, à travers leur activité photosynthétique (utilisation du CO2 ou du HCO3-), ils sont capables de modifier les équilibres carbonates-bicarbonates et d'élever suffisamment le pH de l'eau à leur contact pour provoquer la précipitation de carbonates, voire leur coprécipitation avec des phosphates.
2. Stockage et transferts d'éléments
L'évidente intervention des macrophytes dans les cycles géochimiques tient à leur capacité de stockage d'éléments inorganiques et à leur fonction de redistribution de ces éléments, extraits des sédiments et de l'eau. Ils ne sont eux-mêmes que des bioaccumulateurs transitoires, dès lors qu'il s'agit en grande majorité de plantes annuelles, à cycles végétatifs courts, prolongés éventuellement par la production de rhizomes et de racines plus durables (durée de vie estimée de 2 à 4 ans chez Phragmites et Typha , Dykyjova & Kvet 1978). On considère que les macrophytes enracinés réintroduisent dans les circuits métaboliques globaux essentiellement des éléments d'origine sédimentaire (cf. Marshall & Westlake 1978, Wetzel 1990).
Leur intervention exprimée en termes de bilan annuel fait apparaître une perte nette de P et d'N sédimentaires au cours de la phase végétative, renforcée éventuellement par une dénitrification induite par une surcharge organique. Ces nutriments sont pour une part recyclés in situ pendant la phase de sénescence et de dégradation de la matière organique. L'importance des transferts vers la zone pélagique est très mal connue. Il semble toutefois que les herbiers contribuent le plus souvent à l'enrichissement global des eaux lacustres (Carpenter 1980, Carpenter & Lodge 1986) quand ils ne contribuent pas à ralentir le processus d'oligotrophisation de lacs en cours de restauration (cf. Malthus et al. 1990). A l'inverse, les zones d'herbiers se signalent par un gain net de carbone sédimentaire (excrétion racinaire, accumulation passive en anaérobiose). Les pertes par méthanogénèse toujours importantes dans les zones littorales, y compris en milieu oligotrophe (Lac Stechlin, CH4<1 mmol/m2/h, Casper 1980), sont semble-t-il, sans commune mesure avec les gains de carbone par biosynthèse. En conclusion, on peut considérer que les macrophytes activent, ou réactivent, la circulation des nutriments sédimentaires (figure 5). A l'inverse, ils ralentissent celle des éléments dissous dans l'eau, normalement assimilés et recyclés rapidement en eau libre par l'association phytoplancton-bactéries.
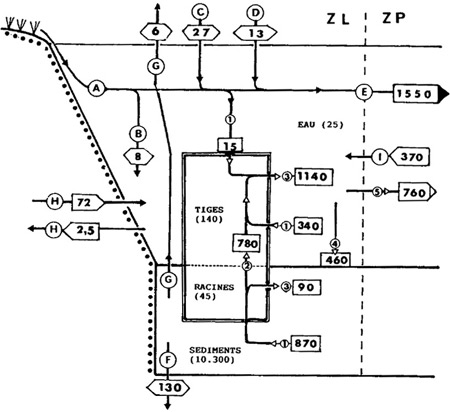
Figure 5 — Bilan du phosphore exprimé en kg/an, dans la zone littorale d'un lac eutrophe fortement renouvelé : le lac Wingra (Wisconsin USA). Importance des macrophytes immergés (Myriophyllum spicatum) dans les transferts entre la zone littorale (ZL) et la zone pélagique (ZP). 1 à 5, processus liés à la présence et/ou à l'activité des macrophytes. 1) assimilation, 2) transferts racines/tiges, 3) M.O. détritique, lyse cellulaire, 4) sédimentation, 5) export de P dissous. A à E, transferts directs en provenance des apports superficiels, B) par diffusion/dispersion. C & D, apports aériens solides (C) et pluviaux (D), E) export dans la zone pélagique, F) transfert en zone 4 sédimentaire profonde (<- 35 cm), C) export par les insectes, H) échanges phréatiques, I) import de P particulé (estimé). (Adams & Prentki 1982, in Naiman & Décamps 1990, modifié).
Bioconcentration des éléments minéraux
Par ailleurs, les macrophytes se signalent par une affinité particulière pour certains métaux. Pour le bore, qu'ils soient enracinés ou non, les facteurs de concentration par rapport à l'eau sont de l'ordre de 100. Il en est de même, par exemple, pour le cuivre où les facteurs de concentration se situent entre 64 et 433 (moyenne 200) et pour le zinc, concentré jusqu'à des rapports de 2000:1 (Hutchinson 1975). C'est sur la base de telles propriétés que les mousses sont utilisées en tant que bioindicateurs de pollutions métalliques (Mouvet 1986). Les macrophytes immergés semblent toutefois être des polyconcentrateurs efficaces, mais non spécifiques. Selon Guilizzoni et al. (1989), les Myriophylles et Cératophylles sont de meilleurs polyconcentrateurs que les mousses du genre Fontinalis et présentent l'avantage, en tant que bioindicateurs de pollutions, d'être plus largement répandus que les mousses.
Conditions de stockage des éléments biogènes
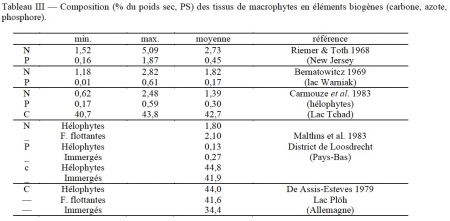
Selon Straskraba (1968), la teneur en eau des macrophytes croît dans la série réunissant les émergés (79%), ceux à feuilles flottantes (82%) et les immergés (88%). Pour Hutchinson (1975), la biomasse sèche représente en moyenne 10% du poids vif. Les teneurs en éIéments biogènes (N, P et C) décroissent depuis le carbone, de l'ordre de 40% du poids sec, à l'azote, de l'ordre de 2% et au phosphore, beaucoup plus variable, de 0,2 à 0,4% en moyenne (tableau III).
On ne saurait se limiter à une vision aussi statique du processus d'immobilisation des nutriments par les macrophytes. Ils sont en mesure d'accumuler de l'azote et du phosphore en excès, bien au-delà de leurs quota de subsistance. Ceux-ci sont respectivement de 0,13% pour le phosphore et de 1,3% pour l'azote (Denny 1980). Il en résulte que leur capacité minimale d'extraction et d'immobilisation (à l'échelle saisonnière) de l'azote et du phosphore s'établit respectivement à 13 et 1,3 kg par tonne produite (MS) et par hectare.
Cette consommation “de luxe” est d'autant plus importante que le milieu est plus eutrophe. Elle s'inscrit dans un gradient spécifique où les Phragmites, riches en tissus de soutien, et les Lemna, lentilles d'eau nitrophiles, représentent les extrêmes. Ces dernières peuvent stocker de l'azote et du phosphore à raison respectivement, de 4 et de 1% de leur biomasse (Rejmankova, in Dykyjova & Kvet 1978).
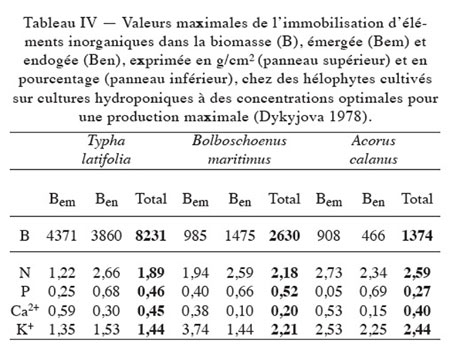
Sur un plan général, les macrophytes montrent une plasticité physiologique spécifique, en relation également avec le niveau de concentration des sédiments, et suivant un mode de répartition inégal entre les parties émergée et endogée (tableau IV).
Cinétique des transferts
Les flux de matière qui empruntent la voie macrophytique s'ordonnent suivant des rythmes de stockage et de déstockage (relargage) en direction tant des compartiments aqueux que sédimentaire.
- Au cours du cycle végétatif (figure 6)
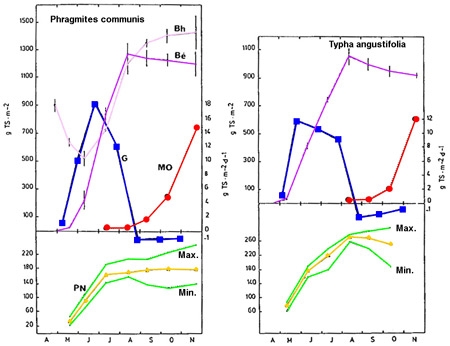
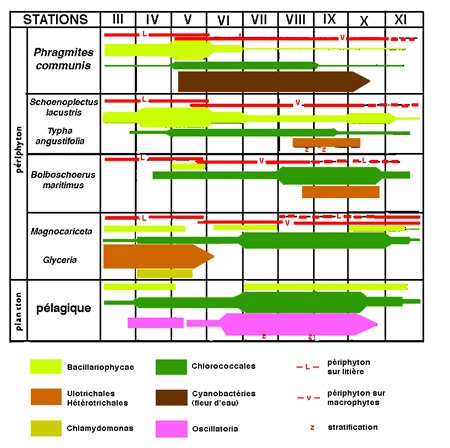
Figure 6 — Dynamique saisonnière de la production végétale chez deux hélophytes : Phragmites communis et Typha angustifolia (Plöhsee, Allemagne). Biomasses épigée (Bé) et hypogée (Bh), en gMS/m2. Stocks de matière organique détritique (MO). Variation journalière du taux de croissance (G), en gMS/m2/j. Variation saisonnière de la production nette globale (PN). (De Assis-Esteves 1978).
Ils sont conditionnés par le rythme même de la production végétale (tempéré versus tropical) et de sa redistribution alternée et successive entre la fraction érigée de la plante (gains printemps-été, pertes automnales), et endogée (pertes printanières et reconstitution estivale de réserves rhizomateuses, développement racinaire printanier).
Par ailleurs, la cinétique de stockage des éléments minéraux présente un décalage par rapport au rythme de croissance de ces macrophytes. L'accumulation tissulaire de nutriments est maximale au printemps et peut être plus rapide que celle de la biomasse. C'est ainsi, par exemple, qu'au cours des 45 premiers jours de leur cycle végétatif, deux hélophytes (Justicia et Typha) réalisent une production égale à 30% de leur biomasse maximum. Dans le même temps, les accroissements relatifs de stocks d'éléments minéraux sont bien supérieurs : de 60, 92, 73 et 56% du stock terminal, respectivement pour l'azote, le phosphore, le potassium et le magnésium (Good et al. 1978).
Enfin, au terme du cycle végétatif, ou en continu dans le cas de végétaux pérennes et tropicaux, ces éléments font l'objet d'un double transfert : d'une part dans les tissus endogés (rhizomes + racines), demeurant incorporés aux sédiments, et dans la partie détritique, d'autre part.
Dans les conditions normales de développement des herbiers (nénuphars et hélophytes, en particulier), cette biomasse endogée tend à s'accroître au fil des années. Son accumulation se trouve accélérée dans les conditions d'eutrophisation et peut même se poursuivre lors d'épisodes d'oligotrophisation des eaux. Il n'en reste pas moins que les herbiers constituent des systèmes largement ouverts même en cours de développement végétatif :
- de 10 à 20% de la production primaire, sous forme d'organes végétatifs morts, rejoignent naturellement les sédiments littoraux,
- de 1 à 10% de la production sont excrétés sous forme de COD, ainsi que 5% environ du phosphore assimilé.
Ces valeurs d'apparence modeste doivent être replacées dans un contexte de production massive de biomasse (cf. ci-avant) sous une faible épaisseur d'eau. Ces apports constituent le support pour une intense activité microphytique à la fois autotrophe et hétérotrophe.
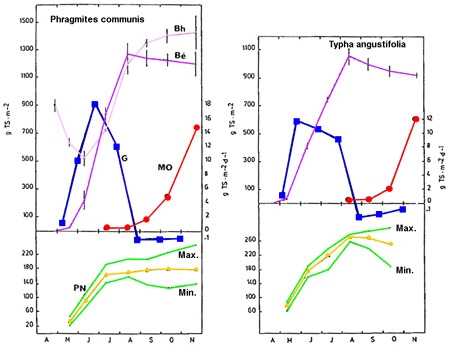
Figure 6 — Dynamique saisonnière de la production végétale chez deux hélophytes : Phragmites communis et Typha angustifolia (Plöhsee, Allemagne). Biomasses épigée (Bé) et hypogée (Bh), en gMS/m2. Stocks de matière organique détritique (MO). Variation journalière du taux de croissance (G), en gMS/m2/j. Variation saisonnière de la production nette globale (PN). (De Assis-Esteves 1978).
Il s'y ajoute la diffusion transracinaire de COD, celui-ci constituant un support utilisable pour une activité selon les cas nitrificatrice (substrats bien drainés) ou dénitrifiante parfois considérable (substrats eutrophes-dystrophes).
- Au cours de la phase détritique
Dès lors qu'ils sont généralement peu consommés à l'état vivant (tempéré), les herbiers participent aux flux de matière, principalement sous forme de matière organique détritique.
Schématiquement, la mise en circulation de matière organique particulaire (MOP) et dissoute (MOD) permet d'étendre la zone où les organismes lacustres peuvent exister et survivre, en particulier en dessous de la zone euphotique des lacs où dominent des communautés détritivores et hétérotrophes. Les herbiers littoraux participent à l'entretien de ce stock assimilable, exploité par étapes successives et itératives (colonisation bactérienne et fungique, fragmentation, filtration, digestion, resuspension des egesta, attaque bactérienne,...) in situ et lors de son transfert vers le domaine pélagique.
Les macrophytes représentent un réservoir assez considérable de MOD (en moyenne de 20 à 40% du poids sec, 30% chez les Nymphaeacées), sous forme d'hydrocarbones, de protéines hydrosolubles et d'acides aminés, libérés en totalité dans le milieu en l'espace de quelques dizaines d'heures après la mort des tissus. Cette libération est la première étape et sans doute la plus importante, d'une éventuelle contribution de la zone littorale aux bilans du carbone et des nutriments des eaux libres, son importance étant fonction du degré de confinement du secteur littoral par rapport au secteur pélagique.
La restitution à l'environnement des éléments biogènes hydrosolubles (nutriments + carbone) lors de la lyse cellulaire, suit une séquence régulière par la libération successive de phosphore, de carbone et pour finir d'azote (essentiellement sous forme de NH4+). La mort des macrophytes tend donc à provoquer la relance successive des productions bactérienne et algale. L'activation de la flore bactérienne est perceptible après seulement quelques jours et prépare d'une manière optimale l'attaque du résiduel particulé. Des poussées algales préautomnales ou automnales peuvent en outre être observées dans les zones littorales, même parmi les détritus, dès le début de la dégénérescence des herbiers. L'étape suivante est représentée par la dispersion du résidu particulé fortement cellulosique, initialement à forte valeur du rapport C/N (>10). Faiblement consommée in situ, cette fraction détritique particulaire peut être exploitée comme dans les eaux courantes à une distance éloignée de son lieu d'origine - en fonction de sa taille - tout en subissant dans son parcours une double érosion : dimensionnelle, jusqu'à la dimension colloïdale, par effets mécaniques du broyage ou sans doute davantage par les turbulences, et biochimique par une simplification progressive de sa structure moléculaire sous l'action des exoenzymes bactériens.
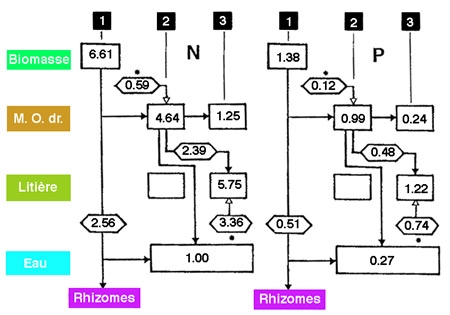
Figure 7 — Évolution temporelle des stocks d'azote et de phosphore d'origine hélophytique (Scirpus fluviatilis), dans la zone littorale du lac Goose (Iowa, (USA). 1 et 2, août et novembre 1974 ; 3, juin 1975. Bilans de circulation entre la biomasse, les rhizomes, les tiges mortes issues de cette biomasse (M.O. dr.), la litière progressivement accumulée et l'eau libre. Données en g/m2. La litière présente un enrichissement significatif en azote et en phosphore au cours du printemps. (Davis & Van Der Walk 1978, modifié).
Au cours de sa transformation, cette MOP connaît assez régulièrement un enrichissement en azote, d'apparence paradoxale (figure 7). Celui-ci peut s'expliquer par deux voies : celle d'une réduction relative de la fraction cellulosique (production d'hydrocarbones hydrosolubles par les cellulolytiques) et celle d'un enrichissement périphérique en microphytes (décomposeurs surtout, et algues au contact des flux de nutriments produits par les cellulolytiques et minéralisateurs). La décomposition de la MOP résiduelle est un processus lent, au cours duquel sont régulièrement réalimentés les compartiments organiques (sous forme de MOD) et nutritifs. Le résidu particulé se décompose à un rythme variable ( t< ou >un an), selon le climat, la nature des tissus, la taille des détritus et leur résistance mécanique (cellulose ou lignine). Les immergés, succulents ou herbacés, sont plus rapidement fragmentés et minéralisés que les hélophytes ligneux. Dans tous les cas, la cinétique de disparition de la matière organique particulaire est fonction des conditions locales. Elle dépend plus précisément des turbulences littorales, de la température et de l'oxygénation de l'eau (la vitesse de dégradation est considérablement plus élevée en aérobiose), du pH de l'eau ou des sols lacustres (zones palustres), et plus particulièrement enfin, en fonction de la concentration en NO3 de l'eau et/ou de la teneur tissulaire initiale en azote.
C'est donc dans les milieux oligotrophes ou dystrophes froids et acides que la minéralisation de la MOP d'origine macrophytique est la plus lente.
En moyenne, le taux de décomposition initial de la MOP d'origine hélophytique est de l'ordre de 1% par jour et décroît exponentiellement au cours du temps (figure 8).
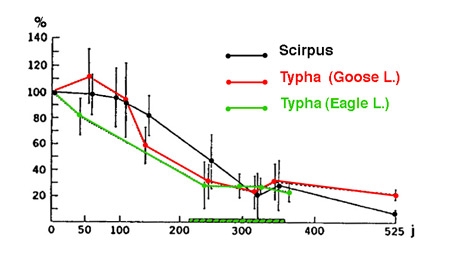
Figure 8 — Décomposition de la matière organique d'origine hélophytique dans deux lacs froids (lacs Goose et Eagle, Iowa, USA). Les 100% correspondent aux stocks au temps T0. La zone hachurée correspond à la repousse des herbiers l'année suivante. (Davis & Van Der Walk 1978).
La fraction organique la plus réfractaire (lignine et tissus humifiés) quant à elle, est décomposée en particulier sous climat froid, à raison de quelques % par an seulement. À la limite (acidification, anoxie et anaérobiose), le blocage de la minéralisation du carbone peut conduire à une accumulation continue de la matière organique par humification.
En définitive, les macrophytes sont beaucoup plus impliqués dans les cycles hétérotrophes et détritiques que ne le sont les algues dont la stratégie est différente: les stocks instantanés de biomasse phytoplanctonique sont toujours faibles et la fraction non consommée rapidement dégradée. Les macrophytes participent à la régulation des flux nutritionnels en fonction de la biomasse produite, le plus immédiatement en direction des bactéries minéralisatrices et secondairement des algues phytobenthiques ou phytoplanctoniques. Les bactéries interviennent à tous les stades de sa transformation, offrant ainsi une ressource aux filtreurs, sous forme d'agrégats homogènes ou associées aux microdétritus filtrables, à des moments où la production du phytoplancton est en déclin (fin d'été) ou n'a pas encore atteint un niveau suffisant (début du printemps). Il demeure que la contribution des herbiers à la charge interne organique et inorganique des zones pélagiques lacustres est liée à leur étendue mais aussi au degré de confinement des zones littorales par rapport aux eaux libres. L'essentiel des transferts vers les eaux libres semble s'effectuer en général sous la forme de MOD (Wetzel 1990). Celle-ci représente dans les eaux douces un stock de réserve organique supérieur de plusieurs ordres de grandeur au compartiment particulé (de l'ordre de 9:1).
Le recyclage in situ des éléments biogènes peut néanmoins être plus importante que les flux de transfert en direction des zones de liaison littoralo-pélagiques. La résultante en est la formation de secteurs littoraux ou marginaux constamment plus eutrophes que des zones voisines plus ouvertes. C'est le cas du lac de Constance (Bodensee) où coexistent des zones eutrophes (45 mg/l de P, en moyenne) densément peuplées et des secteurs mésotrophes (18 mg/l) non colonisés (Schröder 1975). Ce confinement littoral est responsable de perturbations éventuelles dont la plus commune est le développement de fleurs d'eau à filamenteuses. Dans des milieux de faibles dimensions, c'est toute la masse d'eau qui peut présenter un enrichissement significatif(cf. Carpenter 1980). Les lacs de Loosdrecht (Pays-Bas), par exemple, présentent ainsi un enrichissement important en phosphore (concentration multipliée par 5 ou 7 entre l'été et le début de l'automne, en l'absence d'apports par les affluents (Malthus et al. 1990). Les hélophytes littoraux constituent aussi le filtre primaire des imports inorganiques et organiques d'origine terrestre et/ou palustre.
Dans les zones humides sensu stricto où l'accumulation de matériaux organiques particulaires est associée à une libération de matériaux colloïdaux et dissous (polymérisés ou non, à noyau aliphatique et/ou aromatique), ces formes lessivables transitent par la zone littorale des lacs où elles sont utilisées par un compartiment bactérien aérobie important, entretenu par le complexe végétal. Ce compartiment agit à la manière d'un filtre en métabolisant la fraction assimilable ou hydrolysable, sans véritablement modifier le stock d'éléments réfractaires (Wetzel 1991). Cette composante colloïdale et réfractaire, représentée typiquement par les acides humiques, est dotée d'un pouvoir adsorbant et/ou complexant vis-à-vis des nutriments (N et P), du Fe3+ et du Ca2+ , mais aussi des exoenzymes bactériens. Ces colloïdes assurent le transport à distance de ces éléments. Ce transport favoriserait ainsi la libération au sein de l'écosystème lacustre des ions mobilisés et la réactivation à terme des enzymes lors de la dislocation (par photolyse U.V.) des structures colloïdales et aromatiques (polyphénoliques) qui constituent l'édifice humique.
Pour conclure, dans le cadre des cycles biogéochimiques propres au milieu lacustre, la fonction initiale et prédominante des macrophytes est d'activer les transferts entre les sédiments et l'eau. Ils agissent ensuite comme une membrane dialysante au profit de la zone littorale des lacs. En tant que régulateurs des flux nutritionnels (C, N, P), ils se comportent comme des sédiments, au rythme près de la fréquence de restitution des réserves accumulées. Celles-ci se répartissent diversement entre les zones palustres (lorsqu'elles existent) et pélagiques, selon la quantité de matières produites de part et d'autre de la zone de marnage, en fonction de l'hydrodynamisme local, et selon la nature de ces produits et de leur biodégradabilité.
VII. Relations macrophytes-microphytes
1. Le périphyton
La composante algale du périphyton est en général largement dominée par les Diatomées pennées, surtout en période froide, de l'automne au printemps en zone tempérée, suivies, selon le degré de trophie, par une dominance estivale de Chlorophycées et/ou de Péridiniens et éventuellement de Cyanobactéries ou de filamenteuses (voir par exemple la figure 9). Lorsque le périphyton développe des séquences saisonnières de dominance analogues à celles observées chez le phytoplancton, il s'en distingue toutefois, soit par la relative constance de sa biomasse selon Wetzel (1990), ou par sa rythmicité saisonnière particulière induite par les macrophytes (maxima printaniers et automnaux), par son caractère concentré et par l'hétérogénéité de sa distribution spatiale : selon le niveau d'eau, la proximité des sédiments (favorable aux Cyanobactéries), l'exposition aux turbulences et la nature du support.
Figure 9 — Exemple de successions saisonnières au sein du phytoplancton pélagique et du périphyton associé à diverses formations végétales (étang d'Opatovicky, Bohême du Sud). (Marvan et al. 1978).
Le périphyton constitue un sous système composite (éléments planctoniques + benthiques) largement accessible aux invertébrés brouteurs mais aussi aux microconsommateurs, en raison de la présence continue de stocks importants de Diatomées et de bactéries.
2. Symbioses ou antagonismes
Dans le jeu multiple de restructuration des communautés et de réorientation des flux de matière assumé par les herbiers, il est nécessaire d'inclure les algues et bactéries du périphyton qui leur sont étroitement associées : physiquement (effet de surface, implantation dans un film de matière organique amorphe) et physiologiquement (exploitation immédiate des excreta). Il s'agit sans doute d'une symbiose incomplète dès lors que les épiphytes n'exploitent qu'une partie du P excrété par les plantes supports : moins de 10% du P, selon Sculthorpe (1967), Carpenter & Lodge (1986) ; de 60 à 65%, selon Wetzel (1990). Quoi qu'il en soit, le périphyton constitue une membrane semi-perméable s'opposant à la diffusion totale des exsudats dans l'eau libre. Par ailleurs, à travers le processus d'excrétion de carbone organique sous forme dissoute (de 1 à 10% de la production des immergés, Carpenter & Lodge 1986), la production bactérienne se trouve relancée par rapport aux eaux pélagiques. Enfin, selon Sand-Jensen & Borum (1991), une compétition semble pouvoir s'établir entre le périphyton et les macrophytes pour la captation du carbone inorganique dissous dans l'eau, en particulier dans des eaux chargées en Ca2+.
Dans un bilan coûts-bénéfices de cette “symbiose” (cf. Hutchinson 1975), le périphyton assurerait une protection passive des végétaux supports contre les brouteurs (Carpenter & Lodge 1986). Sa plus grande accessibilité aux brouteurs, en raison de sa faible taille, se trouve compensée par une production de biomasse importante : de 4 à 93% de la production des macrophytes hôtes, résultant d'une capacité de renouvellement de sa biomasse (P/B) bien supérieure à celui des macrophytes et comparable à celle du phytoplancton, en raison de la similitude de sa composition en taille. En contrepartie, une croissance excessive d'épiphytes volumineux (Cladophorales filamenteuses, en particulier) en conditions d'eutrophie, peut être inhibitrice du développement des macrophytes (cf. Sand-Jensen & Soongard 1981). C'est seulement dans de telles conditions que le broutage (par des mollusques, des Cyprinidés et des larves d'insectes) assure une protection aux macrophytes.
Il demeure par ailleurs qu'à l'intérieur du réseau relationnel macro-/microphytes, les macrophytes les plus littoraux (hélophytes et à feuilles flottantes), en captant la lumière, inhibent le développement à la fois du phytoplancton et du périphyton. Cette inhibition prend une allure saisonnière en relation avec le développement de l'appareil foliaire (Dykyjova & Kvet 1978). Cette association oscille en fait autour de schémas saisonniers où la cinétique de production semble être contrô1ée le plus souvent par les macrophytes (figure 10).
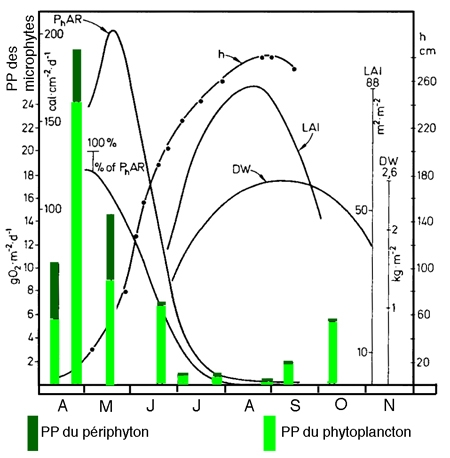
Figure 10 — Relations entre la production nette des tiges de Phragmites (DW, en kgMS/m2) et la production brute (O2, en g/m2/j) du phytoplancton (colonnes vides), du périphyton (colonnes sombres), l'indice de surface foliaire (LAI. en m2/m2) ou la hauteur des macrophytes (h, en cm). Incidence de l'absorption de l'énergie (PhAR) par les macrophytes sur la production algale. (Étang d'Opatavicky, Tchécoslovaquie). (Komarkonta & Marvan 1978).
On observe régulièrement sous climat tempéré des cycles biphasiques avec deux maxima, un maximum printanier et le second automnal, aux limites du cycle de développement des macrophytes (Westlake 1972). Il reste à hiérarchiser les facteurs du déclin estival, à savoir : l'ombrage, la compétition et le broutage. Si le bilan global de production primaire littorale (macrophytes + périphyton + phytoplancton) dépasse en général celui de la production pélagique, il n'y a pas nécessairement compensation quantitative de la réduction de la production phytoplanctonique par celle du périphyton. On peut observer, dans le cas de milieux eutrophes (Komarkova & Komarek 1975), que la somme des productions du périphyton et du phytoplancton littoral peut être inférieure à celle du phytoplancton pélagique. Il en va différemment en milieu mésoeutrophe (lacs de Mazurie, Pologne) où les deux productions sont équilibrées (Pieczynska & Szczepanska 1966).
VIII. Les macrophytes en tant que ressource nutritionnelle
D'une manière similaire aux herbiers marins littoraux, les macrophytes lacustres, globalement, sont relativement peu consommés àl'état vivant. Leur accessibilité et leur valeur nutritionnelle sont inférieures à celle des algues en raison de la forte proportion de cellulose dans leurs tissus, quand ils ne sont pas lignifiés et peu consommables.
Une valeur de consommation moyenne des immergés, de 10 à 20% de la biomasse, est souvent avancée bien que de telles estimations soient difficilement généralisables, tant ils sont exposés à une exploitation intensive par des oiseaux (Anatidés), des mammifères (ragondin, rat musqué), certains poissons (carpe chinoise, Tilapia) ou par quelques invertébrés de grande taille (écrevisses). Les émergés considérés globalement subiraient quant à eux un prélèvement encore plus faible, inférieur à 10% de la biomasse produite annuellement. En fait, les herbiers peuvent être localement très largement utilisés ou même être consommés en totalité (cf. Gaevskaya 1969, Weller 1978, Lodge et al. 1985, Carpenter & Lodge 1986, Lodge & Norman 1987). Par ailleurs, les macrophytes font l'objet d'une consommation diffuse - sans que soit affectée leur vitalité - par de nombreux petits Invertébrés. Gaevskaya (1969), par exemple, a recensé 499 espèces d'invertébrés eurasiatiques dont 78% sont des consommateurs exclusifs de macrophytes littoraux. En définitive, la multiplicité d'actes mécaniques vulnérants que subissent en particulier les hydrophytes ne peut qu'accentuer la libération de MOD dans le milieu. Ce phénomène ne saurait évidemment être appréhendé d'une manière simple et n'a jamais donné lieu à des estimations quantitatives. Ces quelques éléments tendent à montrer que les macrophytes vivants ne sauraient être considérés systématiquement comme un simple appoint nutritionnel aux communautés animales locales.
IX. Les macrophytes en tant qu'habitat. Relations avec les communautés vivantes
Les herbiers littoraux occupent des espaces fluctuant en étendue entre les domaines terrestre et aquatique. Les habitats qu'ils constituent sont de nature composite tant au plan de la structure physique que des ressources.
1. Les macrophytes et la capacité d'accueil des milieux
Les herbiers ont en commun d'accroître considérablement la capacité d'accueil du milieu : leur surface développée peut être considérablement accrue par rapport au seul substrat inerte. L'effet de surface est maximal dans les herbiers immergés : par exemple 4 m2/m2 en moyenne et jusqu'à 46 m2/m2 dans des herbiers mixtes à Potamots et Élodées du lac de Mikolajski (Pieczynska 1976) ou encore 24 m2/m2 dans les herbiers immergés du lac Lawrence (Burkholder & Wetzel 1990). On retiendra de ce fait que la contribution du périphyton microphytique à la productivité des milieux n'est pas reliable directement au taux de recouvrement des herbiers ni même à leur biomasse. Dans le lac Lawrence par exemple, où les herbiers n'occupent que 12% de la surface totale, les algues épiphytes contribuent pour 80-85% à la productivité primaire totale (Wetzel 1990).
2. Organisation des communautés d'Invertébrés
Le complexe macrophytes-périphyton héberge et entretient une mosaïque de faunes ou de communautés de Protozoaires, de microinvertébrés et de macroinvertébrés, sessiles ou mobiles et libres, inféodées parfois à des associations macrophytiques particulières, voire à une seule espèce.
La microfaune sessile
Sous ce terme, sont rassemblés des organismes reliés à leur support par un pédoncule ou encore adhérant simplement au substrat et disposant ainsi d'une certaine autonomie de déplacement. Cette microfaune, constitutive du périphyton, réunit des protozoaires (Péritriches, Suctoria), des Gastrotriches, des Turbellariés Rhabdocoeles et des Rotifères.
Epiphyte dans son ensemble, cette faunule peut néanmoins coloniser des substrats inertes, tandis que quelques espèces sont hautement sélectives, comme le Rotifère Ptygura beauchampi strictement inféodé aux Myriophyllum, (Wallace 1978).
Les communautés héléoplanctoniques
Outre ces éléments épiphytes, les herbiers hébergent et entretiennent une microfaune libre pouvant se différencier entre les hélophytes et les hydrophytes, parfois typique des divers éléments de la zonation ou des mosaïques. Coexistent ainsi parmi les microcrustacés, des planctoniques vrais, filtreurs typiques (Daphniidés et Bosminidés), et une microfaune d'affinités benthiques (Cladocères Sididés et Chydoridés, Ostracodes, Cyclopoïdes benthiques et Harpacticides), de comportement racleur-filtreur, se nourrissant du micropériphyton phytobactérien, ou même détritivore.
À cet ensemble composite ou héléoplancton, sont mêlés des Rotifères spécifiquement littoraux et des pélagiques, des protozoaires ciliés et des microturbellariés microphages et prédateurs.
Si la richesse spécifique globale de l'héléoplancton est sensiblement équivalente ou supérieure à celle du zooplancton, sa diversité spécifique est variable selon les milieux, selon la présence ou l'absence de poissons planctonophages et selon la saison. Son abaissement correspond à un renforcement de la structure de dominance au sein du peuplement, illustré éventuellement (figure 11) par la réussite d'espèces d'origine pélagique (g. Bosmina et Ceriodaphnia, entre autres), (Pieczynska 1976, Lehtovaara & Sarvala 1984).
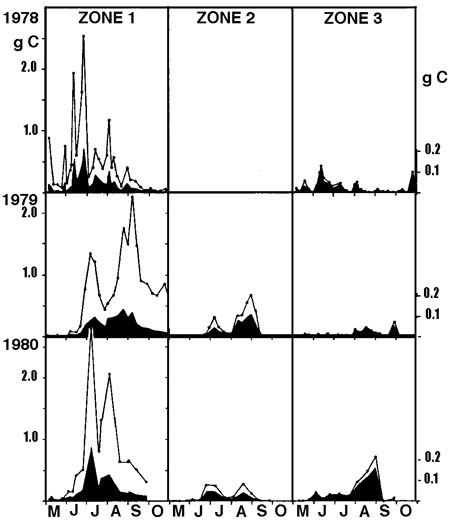
Figure 11 — Répartition des biomasses zooplanctoniques dans un gradient décroissant (de la zone 1 à la zone 3) de la densité d'un hélophyte (Equisetum fluviatile), dans la zone littorale du lac Päajärvi (Finlande). Variations interannuelles des biomasses (1978-1980), exprimées en gC/m2 (courbe supérieure) et en gC/m3 (graphe inférieur, noir). Bosmina domine en 1978 et 1980, Ceriodaphnia en 1979. Le cycle bimodal de 1979 est dû à un effet de dilution par les eaux pélagiques, à la suite d'une crue estivale exceptionnelle. La faible représentation du zooplancton pélagique (zone 3) est attribuée à la prédation par les poissons. (Lehrovaara & Sarvala 1984).
Par ailleurs, l'héléoplancton occupe le milieu suivant un mode fortement agrégatif (nuages, mosaïques), indépendant éventuellement de la composition des herbiers (figure 12). Il est sujet à de larges fluctuations de biomasse, d'abondance numérique et de composition, associées à la phénologie des herbiers et à l'augmentation progressive de leur confinement au cours du cycle végétatif.
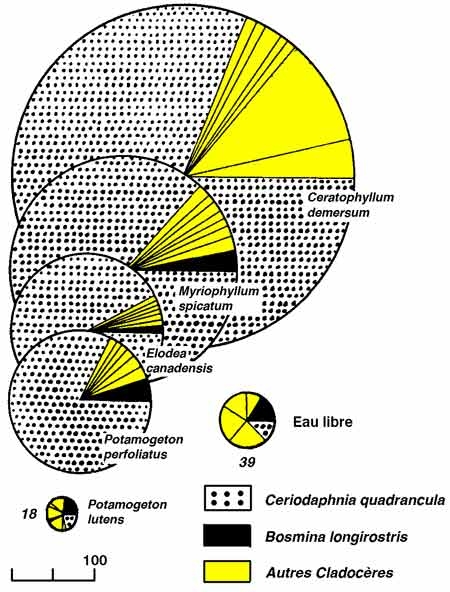
Figure 12 — Structure et densité des peuplements de Cladocères (n ind./l). en relation avec la composition des herbiers du lac Mikolajskie, en août 1971. (Gliwicz & Rybak 1976).
Les herbiers à Characées abritent des communautés particulières, sans que l'on sache véritablement si l'organisation de ces communautés procède de la structure architectonique de l'herbier, de la nature du périphyton ou qu'elles résultent d'une action répulsive spécifique, largement démontrée en laboratoire (émission d'alkyl-sulfures), Une action discriminante similaire vis-à-vis d'éléments planctoniques (microcrustacés, larves de Culicides,...) ou même périphytiques, est attribuée également à l'algue filamenteuse Cladophora glomerata, aux Elodées, aux Myriophylles et Cératophylles émettrices de substances phénoliques répulsives.
Les communautés macrobenthiques
Les herbiers littoraux modérément denses abritent et entretiennent une riche faune de macroinvertébrés relativement bien connue dans sa composition (cf. Tachet et al. 1980), moins bien connue toutefois quant à son organisation et sa dynamique. L'enrichissement numérique et en biomasse par rapport aux espaces littoraux découverts semble toutefois être la règle (cf. Soszka 1975), (figure 13). Cette faune réunit un ensemble d'espèces couvrant un large spectre trophique : soit des algivores ou plus rarement des macrophytophages, des brouteurs-racleurs de périphyton et/ou détritiphages, accompagnés de leurs prédateurs également invertébrés.
Figure 13 — Comparaison de la structure et de la densité du zoobenthos, dans des stations colonisées (A) ou non (B), par des hydrophytes de la zone littorale du lac Mikolajskie. (Wiktonak 1974. In Pieczynska 1976).
On n'observe pas en général, de relation stable entre la composition du macrozoobenthos mobile et celle des herbiers, qu'ils soient mono- ou plurispécifiques. Ce sont seulement les Gastéropodes qui présentent une ségrégation nette et permanente entre les zones à hélophytes et à hydrophytes (Lodge 1986). C'est aussi le cas des Chrysomélides (Coléoptères) adultes et larves, des chenilles de Pyralidés (Lépidoptères) ou certains Chironomides (Diptères) associés assez strictement à des hélophytes.
Les herbiers littoraux constituent aussi parfois un support privilégié pour des macroépiphytes grégaires (Dreissena, Lamellibranche fixé, figure 14), ou coloniaux : Bryozoaires, Éponges et Hydraires. Lorsqu'ils sont pris en compte, ce sont les Nématodes qui constituent la part numériquement la plus importante de leur faune associée. Ils sont suivis par les Chironomes et Oligochètes (Naïdidés périphytiques & Tubificidés fouisseurs), puis par d'autres insectes à larves aquatiques (Diptères autres que les Chironomes, Ephémères, Trichoptères, Mégaloptères, Odonates,...) ou complètement aquatiques, à capacité variable de migration par la voie aérienne (Hémiptères et Coléoptères). Habitat spécifique des écrevisses (d'avril à octobre), les herbiers peuvent localement héberger des Asellidés détritiphages (Isopodes) et plus rarement des Gammaridés (Amphipodes). Alors que les Dreissènes peuvent envahir les herbiers littoraux (cf. Stanczykowska & Lewandowski 1993), les autres Lamellibranches filtreurs sont faiblement représentés (Sphéridés de petite taille). La faune malacologique peut être représentée par un nombre significatif d'espèces de Gastéropodes et constituer des biomasses importantes. Ils entretiennent eux-mêmes une faune d'Hirudinées prédateurs en quantité parfois significative. Les zones littorales sont aussi le site privilégié de concentration des Hydracariens partiellement ectoparasites (larves).
Figure 14 — Importance de la colonisation des macrophytes littoraux (V) par le Lamellibranche fixé Dreissena polymorpha, dans 24 lacs polonais du District de Mazurie. (Recomposé d'après les données de Lewandowski 1982, In : Stanczykowska & Lewandowski 1993).
Il est simple d'opposer cette diversité des faunes littorales au zoobenthos profond constitué d'une manière uniforme d'organismes fouisseurs : Chironomes, Tubificidés (Oligochètes), et Nématodes accompagnés parfois de Lamellibranches filtreurs. On relève toutefois qu'en milieu tropical (Beadle 1974), où les macrophytes sont plus largement consommés, la faune des formations denses (papyraies, par exemple), s'appauvrit considérablement par rapport à des stations plus ouvertes ou moins denses. Ce type de milieu est sélectif au point d'en limiter la pénétration à quelques invertébrés capables de respirer à la surface (des mollusques, Chironomes et Culicidés), ou de développer un métabolisme anaérobie (l'Oligochète Alma emini), ainsi qu'aux seuls poissons à respiration aérienne (Protoptères et Clarias).
Au plan général, ce zoobenthos littoral est exploité en parts variables par les poissons, souvent sur la base de migrations nocturnes (tempéré) et par des consommateurs terrestres (oiseaux), in situ et en milieu aérien lors des émergences (insectes). La position du macrozoobenthos sur les divers substrats et/ou leur mobilité les rendent plus accessibles aux poissons (Cyprinidés) que le zoobenthos fouisseur des zones profondes.
Les communautés de Vertébrés
Les zones marécageuses et les herbiers littoraux constituent aussi un habitat permanent ou transitoire pour des Vertébrés terrestres (nombreux oiseaux, micromammifères, reptiles), amphibiontes (batraciens) ou aquatiques (poissons). Ces vertébrés peuvent d'ailleurs se remplacer au cours des cycles hydrologiques (avancée des poissons en période de hautes eaux et des Vertébrés terrestres lors des basses eaux).
Rares sont les poissons tempérés qui soient strictement inféodés au stade adulte à l'habitat macrophytique, en dehors de la phase de reproduction des éléments phytophiles. Par ailleurs, la multiplicité des ressources disponibles favorise les Cyprinidés omnivores. Ces herbiers enfin, offrent des conditions optimales pour la réussite des éclosions, la maturation des alevins et leur protection contre les prédateurs ichthyophages.
Les herbiers constituent ainsi un habitat spécifique dont la capacité d'accueil, les stocks, la diversité et la richesse spécifiques sont le plus souvent supérieures aux zones littorales restées minérales (Pieczynska 1990). Ils sont en outre responsables d'une diversification de fonctions (“niches”) assumée à la fois par des animaux terrestres et aquatiques, que ceux-ci soient inféodés strictement au milieu ou en stationnement obligé dans ce type d'habitat. Ces deux entités (communautés) largement interdépendantes s'interpénètrent à l'intérieur de ces franges écotonales. Elles participent éminemment à une redistribution des ressources de part et d'autre de l'interface.
X. Discussion
Les herbiers à macrophytes occupant la périphérie des milieux lacustres, constituent des ensembles parfaitement identifiables et assimilables sans ambiguïté à des écotones. Au sein de l'interface terrestre/aquatique, ces macrophytes constituent le “lieu géométrique” des sous-systèmes particuliers qui en assurent la pérennité : réserve hydrique/atmosphère, sédiments/eau, nutriments/microphytes, périphyton/héléoplancton, périphyton/brouteurs, zooplancton/alevins, détritus/consommateurs, détritus/décomposeurs. Leur discontinuité structurelle et fonctionnelle par rapport aux écosystèmes adjacents est aussi une marque d'identification d'un véritable écotone (cf: Shugart 1991).
Les herbiers intègrent la variabilité d'une zone de balancement entre deux systèmes de nature totalement différente, porteurs de contraintes éminemment contrastées ou dissymétriques. Ainsi, la contrainte hydrique conditionne à elle seule la mise en place, la dynamique spatio-temporelle et la pérennité de ce type de formation. La contrainte terrestre (géomorphologique) semble avoir un impact limité à son organisation interne. Ces contraintes s'équilibrent lorsqu'il s'agit d'en délimiter l'étendue. Enfin, la contrainte terrestre redevient prédominante lorsqu'elle conduit à une surcharge eutrophisante des habitats lacustre et périlacustre.
Historiquement, le jeu de ces contraintes s'est avéré très sélectif. La richesse spécifique des macrophytes aquatiques est en effet considérablement plus faible que celle de leurs homologues strictement terrestres. Par ailleurs, les formations à forte résilience - envahissantes ou non - sont constituées pour une part très importante d'éléments (genres ou espèces) à tendance cosmopolite ou couvrant des espaces géographiques ou climatiques transcontinentaux.
Sur quelles bases peut s'établir la stabilité de tels écotones ? La plus importante nous paraît être le renouvellement des ressources qu'elles concourrent elles-mêmes à mobiliser, plutôt que tout autre mécanisme interne spécifique à ce type de formation.
Le renouvellement et/ou l'autorenouvellement de leurs ressources (hydriques, édaphiques, nutritionnelles) en conditions optimales d'éclairement situent en effet les macrophytes littoraux (hélophytes) parmi les producteurs les plus efficaces de la biosphère (tableau I).
Il n'en reste pas moins que ces assemblages hautement spécialisés et paucispécifiques (Hutchinson 1975) sont fragiles. Leur déclin, au moins en Europe (De Nie 1987), dans un contexte généralisé d'eutrophisation, de manipulation des flux hydriques dans leur bassin versant (drainage), voire le tourisme, concourrent à une déqualification des paysages périlacustres et à un déficit global en matière de diversité et de productivité biologiques.
Ces écotones paraissent théoriquement les plus aptes à fournir des réponses dynamiques de type “hystéresis” (Shugart 1990), en réponse à des fluctuations hydrologiques progressives et réversibles (Weller 1978). Par contre, ils produisent des réponses de type chaotique sous les impacts déstabilisants totalement exogènes comme l'eutrophisation, l'acidification ou encore la prédation. Enfin à l'échelle historique, ils présentent la particularité de développer une stratégie à double effet, apparemment contradictoire, concrétisée par le processus d'atterrissement. L'exhaussement par accumulation de matériaux, y compris végétaux, correspond à une “stratégie” d'échappement à la contrainte hydrique. Concrètement, elle conduit pourtant à une avancée sur le domaine proprement aquatique.
Dans le cas du passage au marais et à l'atterrissement, ce sont les processus internes à l'écotone fondateur qui constituent la base “stratégique” conduisant à une formation nouvelle, climacique éventuellement, et dotée d'un mode de fonctionnement autonome entretenu par son propre confinement. Ce qui précède correspond à une vision d'échelle relativement restreinte, sans doute schématique et faiblement représentative de l'immense variabilité des situations concrètes où le confinement hydrologique en relation avec la géomorphologie, la nature du bassin versant et son climat, présentent une infinité de combinaisons, dont la résultante la plus commune en termes d'écologie du paysage est la formation de zones humides (sensu lato) qui elles ne sont pas forcément adjacentes à des systèmes lacustres constitués et permanents. Leur degré de connectivité avec le milieu pélagique est aussi une donnée significative pour le fonctionnement du milieu récepteur.
La conduite séparée ou asynchrone des études sur les deux types d'écosystèmes, palustre et littoral, contribue à entretenir un certain nombre d'incertitudes. Il demeure qu'une meilleure coordination des recherches ne saurait à elle seule assurer une pleine compréhension des processus écologiques, de leur nature et de leur intensité, qui régissent les interrelations entre zones humides, franges littorales colonisées et écosystèmes lacustres proprement dits. Ceci tient surtout au nombre considérable et à la diversité des milieux concernés ainsi qu'à leur distribution sur de vastes étendues. Les grands lacs, comparables à des “mers intérieures” et pratiquement dépourvus de macrophytes sont en nombre très limité et répartis inégalement entre les deux hémisphères. A l'opposé, les milieux lacustres colonisés par les macrophytes sont représentés par des millions de cas et distribués essentiellement dans l'hémisphère nord, suivant un gradient sud-nord de profondeur décroissante.
Une ultime approche du problème, à une échelle appropriée (mondiale), consiste comme l'a fait Wetzel (1989) à évaluer d'une manière indirecte le nombre d'écosytèmes lacustres soumis à l'influence de leur environnement immédiat (littoral) et/ou de leurs annexes palustricoles (figure 15). De fait, cette distinction entre environnements proche et éloigné établie par Wetzel (op. cit.), sur des rapports d'étendue entre les différentes composantes, palustre, littorale et pélagique, révèle àl'évidence que le compartiment macrophytique est un constituant à part entière des écosystèmes lacustres continentaux. La limnologie, telle qu'elle s'est constituée - autour des grands lacs - ne semble pas avoir pleinement rendu compte de la complexité du fonctionnement de ces “écocomplexes” que sont, à quelques exceptions près, les systèmes aquatiques continentaux. Sur un plan général, l'appréciation du rôle des macrophytes dans les écosystèmes est positive et basée d'abord sur leur fonction régulatrice et diversificatrice des systèmes écologiques.
Le point d'équilibre entre le développement de l'écosystème et la survie de nombreux organismes passe dans de très nombreux cas par la dynamique des macrophytes (cf. Carpenter 1981 et 1988). Leur disparition (hypereutrophie) ou la simplification des communautés (cas de l'acidification des eaux) entraînent inévitablement une réduction du potentiel productif des milieux concernés et une réduction de la diversité écologique locale ou régionale. Par ailleurs, ils peuvent présenter un intérêt économique. La présence et le développement contrôlé des herbiers littoraux sont souhaités pour la pisciculture en étang. Les herbiers à macrophytes constituent aussi un moyen naturel d'épuration des eaux superficielles, à travers la pratique du lagunage ou enfin, un instrument de dénitrification des eaux phréatiques. Localement (zones tropicales), ils peuvent constituer une ressource économique directe et importante (Little 1979).
De tels avantages s'annulent dans tous les cas d'exubérance incontrôlable de végétaux flottants et/ou immergés. L'envahissement de toute la zone intertropicale par la jacinthe d'eau ou les Salvinia en est l'illustration la plus significative. Des immergés, Cératophylles, Myriophylles, Elodées, et les algues filamenteuses peuvent aussi donner lieu à des développements massifs sous climat tempéré, en relation éventuellement avec l'eutrophisation générale des eaux.
Au plan de l'utilisation des milieux, un développement massif des Phanérogames s'oppose à la navigation et à la pratique de la pêche, voire à une production pisciaire optimale (cf. Gopal 1986).
Leur effondrement relativement concentré dans le temps (tempéré), leur exubérance même, peuvent entraîner des déficits en oxygène importants. La floraison massive de végétaux flottants entretient ou accentue la dystrophie du milieu, responsable secondairement de la mort de poissons ou de la disparition des autres hydrophytes enracinés.
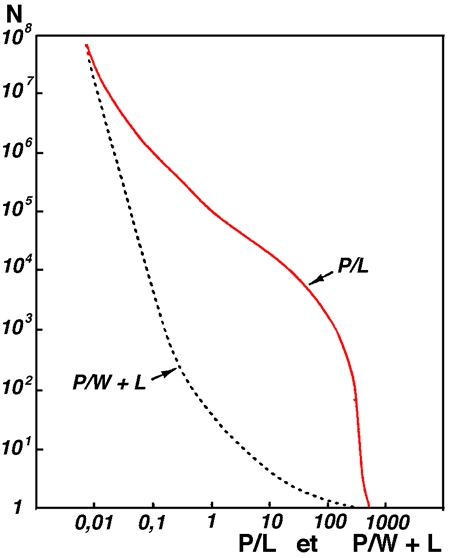
Figure 15 — Distribution numérique des lacs du monde en fonction de l'importance relative de leur surface en eau libre (P) par rapport à celle des zones littorales (L) et/ou périphériques constituées en zones humides (W). L'incidence des zones littorale et périphérique sur le fonctionnement global des lacs s'accroît inversement aux valeurs de P/L ou de P/W + L. (Wetzel 1990).
Au plan sanitaire, le développement incontrôlable des herbiers tropicaux (cf. la jacinthe d'eau), se traduit par une relance de maladies parasitaires transmises par des invertébrés phytophiles ou inféodés aux zones calmes (bilharziose, malaria et filarioses, encéphalites...).
Une politique de gestion écologique de ce compartiment, associant contrôle et/ou restauration s'avère très délicate dès lors que les causes de perturbation les affectant sont le plus souvent diffuses, parfois très éloignées de leurs sites d'implantation et dans tous les cas faiblement réversibles, voire irréversibles.
XI. Conclusion
L'importance des macrophytes dans les milieux ou espaces littoraux peu profonds résulte de leur forte capacité de production de biomasse, créant ainsi des formations capables d'intervenir dans l'évolution géomorphologique des stations ou milieux qu'ils occupent. Ils restituent à leur environnement d'une manière rythmique les nutriments (C, N, P), qu'ils extraient activement des sédiments ou de l'eau et sont susceptibles de ce fait d'accélérer l'eutrophisation ou la dystrophisation de leur milieu.
Ce sont des acteurs intervenant selon leur rythme propre de biosynthèse dans les cycles biogéochimiques, souvent plus importants que le phytoplancton, dans les espaces qu'ils occupent.
Ils constituent également un support actif pour le développement du périphyton algal, une ressource d'habitat surtout, et de nourriture pour des communautés composites (terrestres + aquatiques) particulières.
Facteurs de diversification des paysages, ils constituent aussi des écotones particuliers dont la dynamique et/ou la résilience sont sans équivalent.
Soumis à des manipulations d'origine humaine, ces formations manifestent néanmoins leur très grande fragilité.
15:26 Publié dans Environnement-Écologie, Limnologie-hydrobiologie | Tags : limnologie, macrophytes lacustres, écosystèmes lacustres, fonctionnement | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
19/02/2013
La zone littorale lacustre
 La zone littorale lacustre
La zone littorale lacustre
La zone littorale des lacs se caractérise par sa faible profondeur. Elle s'étend plus ou moins, selon la pente, la transparence et la couleur des eaux et l'exposition aux vents (donc aux vagues et aux courants de dérive). ROUND (1956) limite la zone littorale à la région située de chaque côté du niveau moyen de l'eau, donc directement affectée par l'eau et la terre contiguë. C'est donc la zone d'interpénétration des milieux aquatique et terrestre.
Verticalement, elle s'apparente étroitement avec la partie supérieure de la zone trophogène. La limite inférieure est souvent confondue avec la zone de compensation (profondeur critique où photosynthèse et respiration s'équilibrent). Elle est notablement plus profonde que la profondeur limite de visibilité surtout dans les zones peu profondes ou turbides. Ainsi les communautés seront à dominance végétale, et l'extension de ces communautés sera liée à l'existence de substrats fermes favorisant l'enracinement et à la pénétration de la lumière favorisant la photosynthèse.
A. ASSOCIATIONS DE LA ZONE LITTORALE
I. Communautés benthiques de surface
Se développant en surface, on distingue :
1. le rhizomenon
constitué de plantes aquatiques fixées :
algues macroscopiques : Nitelle, Chara, mousses : fontinales (Fontinalis), sphaignes (Sphagnum), hypnes (Hygrohypnum), plantes vasculaires : Potamots.
2. le biotecton ou couverture biologique ou Aufwuchs ou bioderme
Il s'agit de la pellicule de microorganismes qui recouvre le substrat plus ou moins solide et notamment les pierres, les détritus minéraux et organiques.
D'après Margalef (1955), le biotecton se décompose en :
- un pecton : feutrage superficiel fait de Cyanobactéries et faune associée ;
- un plocon : couverture d'algues filamenteuses.
- Une forme particulière de biotecton est constituée par le périphyton, ensemble des organismes vivant sur les plantes aquatiques supérieures de la ceinture végétale.
On distingue aussi dans la flore benthique :
- une flore épipélique vivant sur les sédiments mous ;
- une flore épilithique vivant sur le substrat rocheux ;
- une flore épiphytique vivant sur les végétaux supérieurs (partie végétale du périphyton).
L'ensemble des algues libres vivant entre les plantes supérieures est le métaphyton de BEHRE (1956) ou le pseudopériphyton de Sladeckova (1960).
II. Communautés endobenthiques
La faune interstitielle ou faune phréatobie (Motas & Tanasachi, 1946) est la fraction animale qui colonise les interstices des sédiments grossiers au niveau des rivages lacustres.
L'ensemble des organismes vivant à l'intérieur du substrat plus fin constitue l'endobenthon qui se subdivise en :
- psammon : ensemble des organismes vivant dans le sable.
- pélon : ensemble des organismes vivant dans le sédiment fin et fluide (vases).
La formation la plus caractéristique de la zone littorale est la ceinture végétale.
B. LA CEINTURE VÉGÉTALE
I. TYPES BIOLOGIQUES DE VÉGÉTAUX CONSTITUANT LA CEINTURE VÉGÉTALE
Les végétaux se développant dans l'eau ou sur un sol engorgé d'eau sont appelées plantes hygrophiles ou hygrophytes. Cependant, on appelle végétaux aquatiques les plantes se développant en présence d'un plan d'eau.
Nota : Chaque lien renvoie à la description de la plante citée.
On distingue :
- les végétaux aquatiques sensu stricto qui ne se développent qu'en présence d'un plan d'eau permanent ;
- les végétaux semi-aquatiques dont l'appareil souterrain (racines, rhizomes ou rhizoïdes) est submergé et l'appareil aérien émergé ;
- les végétaux amphibies (Roripa amphibia, Polygonum amphibium), plantes semi-aquatiques qui peuvent se maintenir après assèchement du plan d'eau : Callitriches, Renoncules aquatiques, Lentilles d'eau.
Un caractère commun à toutes ces plantes est leur exigence en eau, facteur qui fournit le milieu ambiant chez les aquatiques ou qui assure les importants besoins en eau chez les semi-aquatiques.
Les écologues, à la suite de Raunkier (1950) et de Sell (1965) classent les végétaux aquatiques selon le degré d'immersion.
- les amphiphytes sont les plantes du sommet des rives des cours d'eau, des sous-bois humides, des fossés, des marécages et des zones humides. Ex : Linaigrette, Caltha palustris, Salicaire, Carex formant les touradons dans les tourbières, Molinia coerulea, Petasites officinalis, Tussilago farfara, Scirpus sylvaticus, Juncus effusus, Prêles, Saules, Aulnes, etc..
- les hélophytes (He) : pied dans l'eau et tête au soleil. Deux strates à distinguer :
* strate haute : Typhacées, Roseaux, Joncs, Grande Glycérie, Acore calame, Baldingère, Butomus umbellatus, Iris pseudacorus, Sagittaria sagittifolia, Sparganium...
* strate basse : Cresson, Véronique, Myosotis, Trèfle d'eau, Menthe...
- les hydrophytes (Hy) avec trois catégories :
* fixés et submergés en permanence, formant des prairies au fond de l'eau : Naias, Chara, Faux Aloes, Isoetes, Fontinalis, Lobelia, Vallisneria, Elodea, Hottonia palustris...
* fixés mais à feuilles flottantes d'un seul type (Nymphéacées, Nuphar et Nymphaea, Alisma natans, Aponogeton, Hydrocharis, Potamogeton natans) ou affleurantes à deux types de feuilles, les unes submergées, modifiées, découpées en segments laciniés, les autres flottantes, élargies, à surface vernissée non mouillable (Potamogeton gramineus, P. fluitans, Myriophylles, Cératophylles, Polygonum amphibium, Ranunculus aquatilis, Hippurus…)
* non fixés et à feuilles flottantes : Lemnacées, Rixia fluitans (Hépatiques), Eichornia crassipes (Jacinthe d'eau) Châtaigne d'eau, Ulothrix (Algues), Utriculaires, Azolla (Fougères)...
De nombreux hélophytes dressés au-dessus du plan d'eau en fin de développement, présentent d'abord une phase hydrophytique plus ou moins longue (Alisma plantago, Equisetum limosum, Scirpus lacustris, Sparganium, Typha).
II. ZONATION VÉGÉTALE
Lorsque la pente est douce, la zonation montre un développement maximal. Si l'on va du rivage vers la zone profonde, on rencontre successivement :
1. Étage littoral
La végétation terrestre cherche à coloniser la plage exondée. C'est une végétation palustre constituée par les amphiphytes décrits plus haut : saussaie, aulnaie, cariçaie. On note une dominance de monocotylédones (Iris, Carex, Poacées) mêlées à quelques dicotylédones arborescentes (Aulne, Saule) et herbacées (Caltha, Polygonum).
2. Étage sublittoral
Dans cette zone toujours submergée, on rencontre successivement :
- la phragmitaie ou phragmiretum, zone des roseaux (Phragmites, Arundo) et la typhaie (Typha) avec des ptéridophytes comme des prêles (Equisetum) ;
- la scirpaie ou scirpetum, zone des joncs, jonc des chaisiers, (Scirpus, Juncus) avec rubaniers, (Sparganium), renoncules aquatiques (Ranunculus), plantains d'eau (Alisma) ;
- la potamaie, zone des potamots (Potamogeton) avec cornifles (Ceratophyllum), volants d'eau (Myriophyllum), Élodée (Elodea), châtaigne d'eau (Trapa), renouée aquatique (Polygonum) ;
- la nupharaie ou nupharetum, zone des nénuphars (Nuphar et Nymphea) avec quelques potamots ;
- la charaie ou characetum située au pied du mont où Chara, Nitella, Fontinalis, Littorella ou Isoetes tapissent en prairie le fond de l'eau.
III. FACTEURS DE RÉPARTITION
Le développement de ces zones dépend de nombreux facteurs : pente, exposition, qualité de l'eau, nature du substrat.
1. Pente
Si la pente est abrupte, la zone des Hélophytes peut manquer.
Si la rive est plate, on peut éventuellement rencontrer une zone tourbeuse à Erica et Molinia, avec sphaignes et touradons de Carex dominés par la saussaie (Saules et bouleaux).
2. Nature du substrat et qualité de l'eau
La nature du substrat influence la richesse minérale de l'eau, l'implantation des systèmes racinaires et rhizomateux des végétaux et par là sur la richesse floristique et sur la masse de végétation.
2.1. Sur les substrats siliceux, sableux, graveleux (argiles à silex) et rocheux, les eaux sont faiblement minéralisées, pauvres en azote et en phosphore : la végétation est clairsemée, le plancton peu abondant. De ce fait, la consommation d'oxygène et l'accumulation de CO2 sont réduites et favorisent l'insolubilisation du fer, laissant les eaux claires et oligotrophes. Le pH est de 5 à 6,5. Le maintien de l'état oligotrophe suppose que l'eau d'alimentation reste peu minéralisée (cas de lacs de plateau). Mais l'évolution vers l'eutrophie est le plus souvent la règle, compte tenu de l'environnement. Les espèces rhizomateuses littorales sont désavantagées par suite de la compacité du substrat.
2.2. Sur les substrats marneux et en cas d'alimentation d'eau minéralisée, les eaux sont riches en calcaire, en azote et en phosphore. Le pH est de l'ordre de 6,5 à 8. Le plancton et les macrophytes sont prospères. Il en résulte un appauvrissement globale en oxygène et un enrichissement en CO2 qui laissent le fer à l'état de carbonate ferreux assombrissant la teinte de l'eau. Les végétations littorales sont très dynamiques et contribuent au remplissage progressif des lacs eutrophes.
2.3. En cas de pollution agricole, ou de développement de tourbières à Sphaignes ou à Hypnacées, il y a enrichissement de l'eau en matière organique en suspension et brunification de l'eau : c'est la dystrophie.
2.4. Les eaux saumâtres renferment des espèces particulières (Ruppia, Zannichellia). Mais certaines espèces d'eau douce sont euryhalines : Scirpe maritime, roseau).
IV. ÉVOLUTION DE LA CEINTURE VÉGÉTALE
Le dynamisme de certaines espèces colonisatrices fait déplacer vers le large les différents anneaux de végétation littorale au fur et à mesure du remplissage périphérique. C'est le cas des Carex à touradons, des Scirpes lacustres, des Roseaux, des Massettes, des Rubaniers dont les rhizomes entrelacés puis superposés forment un plancher qui s'élève d'année en année. L'homme par faucardage et le rat musqué lutte contre cet envahissement végétal. Les zones de végétation littorale peuvent être envahies par des plantes flottantes telles que des hépatiques (Riccia), des monocotylédones (Lemna, Eichornia, Pistia). Plantes flottantes et plantes à rhizomes peuvent ainsi former des radeaux qui se forment par décollement du fond et sur lesquels s'intallent d'autres végétaux, formant des îles flottantes (lac Tchad).
V. RÔLE DE LA VÉGÉTATION AQUATIQUE
L'examen de la végétation aquatique, phanérogames, mousses ou algues permet d'apprécier les qualités physico-chimiques de l'eau.
- En eau peu minéralisée et acide on trouvera la Châtaigne d'eau Trapa natans et la Desmidrée.
- En eau riche en matière organique, on rencontrera la lentille d'eau (Lemna minor) et des Cyanobactéries ;
- En eau bien minéralisée et alcaline, de nombreuses espèces.
L'absence de végétation aquatique suggère un déséquilibre du milieu : il peut s'agir d'un déséquilibre naturel, ou d'une pollution toxique ou par des M.E.S. qui suppriment la transparence de l'eau.
En d'autres termes, la nature de la végétation constitue un indicateur de faciès.
On trouvera sur ce même blog la description de quelques macrophytes liés à la végétation des zones humides.
1. Rôle physico-chimique
1.1. Producteurs primaires de matière organique
Grâce à la photosynthèse, les végétaux sont des producteurs primaires.
1.2. Producteurs d'oxygène
Ce phénomène de photosynthèse libère de l'oxygène qui reste dissous dans l'eau et dont la teneur dépend de la température. À 5°C, le taux de saturation est de 12,8 mg/l et à 20°C, il tombe à 9,2 mg/l. Dans les herbiers, on assiste à une sursaturation 150 % à la fin d'une journée d'été.
L'oxygène fourni par les plantes est utilisé par la faune et notamment par les poissons. Ceux-ci ont des besoins respiratoires différents. Par exemple, une truite a besoin de 8 mg/l d'oxygène alors qu'une carpe résiste à des teneurs de 2-3 mg/l.
Un équilibre doit s'instaurer entre producteurs d'oxygène et consommateurs. Pendant la nuit, les plantes sont improductives et sont consommatrices d'oxygène du fait de leur respiration. Si la masse végétale est trop importante, il y a surconsommation d'oxygène et au matin l'oxygène risque l'épuisement jusqu'à un seuil critique pour les poissons.
1.3. Autoépuration
Les plantes sont les meilleurs agents de l'épuration de l'eau
- par leur production d'oxygène qu'elles fournissent aux processus d'oxydation
- par l'utilisation de sels dissous qu'elles éliminent.
Cette autoépuration permet la récupération des rivières après réception d'un effluent polluant. C'est le principe du lagunage pour l'oxydation des eaux usées riches en azote.
1.4. Destruction de molécules toxiques (phénols)
1.5. Stockage de métaux lourds (Empain et Descy)
2. Rôle biologique
2.1. Rôle trophique
Les algues planctoniques ou benthiques et les plantes servent de nourriture à tous les alevins et à quelques poissons adultes (Hotu, Gardon, Brême, Carpe, Tilapia, cyprinidés asiatiques) mais surtout à une foule d'invertébrés benthiques (mollusques, crustacés, larves d'insectes) et planctoniques, consommateurs primaires essentiels dans la chaîne alimentaire des poissons.
2.2. Support de ponte
Les feuilles flottantes de nénuphar, renouée, potamot ou leurs longs pétioles servent de supports de ponte aux mollusques et insectes.
2.3. Abris
Les herbiers servent souvent d'abri aux poissons où ils se trouvent protégés du soleil, du courant et des prédateurs. Dans un peuplement pisciaire comportant des voraces, la survie des alevins et des espèces fourrages est assurée par la présence d'herbiers.
2.4. Aires de reproduction
De nombreuses espèces de poissons (brochet, perche, tanche, gardon, rotengle, sandre, brème, carpe) fraient dans les zones de végétation : c'est le cas des mousses, élodées, cératophylles, renoncules, potamots, racines de châtaignes d'eau. Les oeufs adhérents restent fixés sur les tiges et les feuilles. Les alevins vivent ensuite plusieurs jours protégés par la végétation dans laquelle ils trouvent leur première nourriture sous forme de bactéries ou d'algues.
2.5. La végétation permet la nidification des oiseaux et l'édification des fourreaux de Trichoptères
3. Rôle mécanique
Les berges sont consolidées par les appareils souterrains de certaines espèces : joncs, roseaux, iris, Carex et résistent ainsi à l'action des vagues et des courants. Réciproquement, dans les zones calmes, la végétation aquatique est responsable de la retenue, de la fixation et de la consolidation des alluvions ou sédiments (massettes, rubaniers, scirpes, roseaux). Dans le processus de colmatage des étangs et des noues, des espèces comme le trèfle d'eau ou le Carex paniculata jouent un rôle de pionniers.
4. Rôle éducatif et esthétique
VI. NUISANCES
La présence de plantes ne doit pas provoquer un déséquilibre dans le milieu ou une gêne dans l'exploitation de l'eau.
1. Nuisances dans les étangs
1.1. Modifications du plan d'eau
Le comblement progressif des plans d'eau est accéléré par le développement d'une végétation semi-aquatique à racines traçantes (Scirpes et joncs) ou à rhizomes (Phragmites, Typha et Iris) qui progresse des berges vers la pleine eau.
1.2. Modifications climatiques
Le surdéveloppement de la végétation limite l'ensoleillement et l'échauffement de l'eau. Il faut réduire dans ces conditions le développement des plantes arbustives des berges et surtout des plantes à feuilles flottantes (Nuphar, Nympheae, Trapa, Hydrocharis, Nymphoides, Polygonum amphibium, Alisma, Potamogeton natans) et enrayer le développement des lentilles d'eau (Lemna) et des algues filamenteuses flottant en surface (Cladophora, Spirogyra).
1.3. Modifications physico-chimiques
Par absorption foliaire, les macrophytes absorbent les sels minéraux dissous dans l'eau.
Si l'on admet que le phytoplancton est la production primaire indispensable à la vie aquatique, il faut limiter le développement des macrophytes si l'on fait un aménagement piscicole. Avant de fertiliser un étang, il faut s'assurer de pouvoir contrôler la végétation.
1.4. Modifications biologiques
Les macrophytes surabondants limitent la circulation des poissons et par conséquent, l'accès à la nourriture. Les alevins nés dans une zone de frayère restreinte restent groupés et souffrent de sous-alimentation qui entraine un taux de croissance faible et une mortalité accrue. Au niveau des prédateurs, on note le développement du cannibalisme. Elodea, Ceratophyllum, Potamogeton densus et lucens sont des plantes dont la densité de développement est extraordinaire.
1.5. Modifications esthétiques
Les feutrages d'algues gonflés de bulles flottant à la surface des eaux, les plaques de cyanobactéries (Oscillatoria, Phormidium) apparaissant sur le fond et remontant en surface provoquent des troubles esthétiques sur les plans d'eau.
1.6. Difficultés d'exploitation
Dans les étangs vidés pour la pêche d'automne, la végétation surabondante provoque une gêne.
L'accès aux étangs où se pratique la pêche à la ligne devient difficile si les zones de pêche sont impraticables. La pratique des loisirs nautiques est incompatible avec une trop grande densité de végétation.
2. Entrave à la circulation de l'eau
La végétation devient nocive à son environnement quand elle constitue une entrave à la libre circulation de l'eau que ce soit dans des eaux de drainage, d'irrigation, ou simplement transportées. Les plantes arrachées par le courant viennent s'entasser contre les grilles et filtres des ouvrages des régulateurs et des stations le long des rivières, les algues viennent obturer les arroseurs et les canalisations...
VII. MOYENS DE LUTTE
1. Lutte mécanique
Faucardage des macrophytes, curage des vases, reprofilage des étangs pas assez profonds.
2. Lutte biologique
Il s'agit de rompre l'équilibre biologique en favorisant une espèce ou en introduisant une espèce nouvelle dans un habitat, provoquant ainsi un phénomène nouveau de compétition. Le problème de toute lutte biologique est de rester maître du processus. C'est pourquoi le contrôle biologique de la végétation doit être prudent.
2.1. Organismes inférieurs
En étang, l'apport massif d'engrais provoque la prolifération de phytoplancton qui crée une importante turbidité de l'eau qui diminue les possibilités de photosynthèse des phanérogames immergés dont la croissance est entravée.
2.2. Mammifères
Les végétations rivulaires et émergées sont paturées par les bovins (roseaux), les chevaux (Glyceria) et les porcs (Lemna). Eviter les moutons à cause du danger de distomatose.
Le ragondin (Myocastor) est un excellent agent de faucardage d'hélophytes et d'hydrophytes. En outre, son élevage apporte une plus-value intéressante par la valeur de sa peau. Le Rat musqué, qui joue le même rôle, a la fâcheuse habitude de creuser des galeries et de faire effondrer les berges et les digues.
2.3. Oiseaux
Oies et canards consomment les feuilles et les graines des plantes aquatiques, empêchent la prolifération des lentilles d'eau et des algues. Leur efficacité est limitée surtout si leur nombre est faible et si la végétation de la berge reste à leur disposition.
2.4. Poissons
Tous les alevins mangent du plancton, des algues et du périphyton pendant quelques jours. En France, seules quelques espèces (Hotu, Soffie, Chevesne, Gardon, Muge) restent en partie herbivores. Brème, Tanche, Carpe et surtout cyprinidés asiatiques (Carpes chinoises ou Amours) peuvent intervenir sur le développement de la végétation.
3. Lutte chimique
On utilise également des herbicides de synthèse, mais on a tendance à privilégier de plus en plus les procédés mécaniques et biologiques.
Pour en savoir plus :
Consulter les différents articles de ce blog concernant la végétation rivulaire.
Consulter également le guide téléchargeable : Guide des végétaux du sud-ouest
09:27 Publié dans Limnologie-hydrobiologie | Tags : limnologie, ceinture végétale, zonation littorale, macrophytes lacustres | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
16/06/2010
Cycle et bilan de l'oxygène en milieu aquatique
 Cycle et bilan de l'oxygène
Cycle et bilan de l'oxygène
par Guy BARROIN
INRA, station de Thonon les Bains
1. L'oxygène, un précieux déchet
Dans un univers essentiellement composé d'hydrogène, règle à laquelle ne déroge pas le système solaire, la présence d'oxygène libre en abondance dans l'atmosphère terrestre constitue une anomalie. La plus ancienne source d'oxygène terrestre a été la photolyse de la vapeur d'eau par les radiations solaires les plus énergétiques (λ < 200 nm). Strictement abiotique, cette réaction produit également de l'hydrogène qui s'échappe vers l'espace ; actuellement elle est localisée dans la haute atmosphère et sa contribution est parfaitement négligeable. Une autre source, tout aussi négligeable, est la photolyse de l'oxyde nitreux qui provient de la dénitrification bactérienne.
Il reste que la quasi totalité de l'oxygène atmosphérique est une conséquence directe de l'activité photosynthétique des organismes vivants, terrestres ou aquatiques. Ceux-ci utilisent l'eau comme donneur d'électrons pour réduire le gaz carbonique en matière organique, réaction de synthèse dont l'oxygène moléculaire est le sous-produit. L'accumulation de ce déchet métabolique est d'un intérêt tout particulier pour les organismes aérobies, végétaux et animaux. Consommé en permanence par les uns comme par les autres, il n'est produit que par les végétaux sous réserve qu'il y ait assez de lumière et de sels nutritifs.
Abondant dans l'air, sa disparition totale n'y est qu'un phénomène local et rare. En revanche, dans l'eau, où sa concentration n'excède pas 5% de ce qu'elle est dans l'air, il en est tout autrement. S'il n'est pas renouvelé, ce qui arrive fréquemment dans les écosystèmes limniques, l'oxygène finit par être totalement consommé par les phénomènes de respiration et de décomposition.
Le fait que la plus totale anoxie puisse s'installer aussi aisément concerne en premier lieu tous les organismes à respiration aérobie, influençant leur distribution, leur comportement et leur croissance physiologique, quelle que soit l'étape de leur développement. Mais la concentration en oxygène affecte aussi très fortement la solubilité de nombreuses substances et par conséquent la disponibilité des nutriments et des composés toxiques, ce qui n'est pas sans conséquence sur la biocénose.
Il n'est donc pas étonnant que l'oxygène soit, après l'eau, bien entendu, le constituant le plus fondamental et le paramètre le plus étudié des écosystèmes limniques.
2. Les termes du bilan
2.1 Un bilan en perpétuel déséquilibre
Fondamentalement, la présence de l'oxygène dans l'eau, régie par la solubilité de l'oxygène atmosphérique, tend à un certain équilibre. Elle détermine, entre autres, les états et les processus d'oxydo-réduction auxquels participent finalement peu d'éléments : C, N, O, S, Fe, Mn. Dans une eau en équilibre avec l'oxygène atmosphérique, tous ces éléments devraient théoriquement exister sous leur état d'oxydation le plus élevé : CO2, HCO3- ou CO32- pour le carbone, NO3- pour l'azote, SO42- pour le soufre, FeOOH ou Fe2O3 pour le fer et MnO2 pour le manganèse. En fait, il n'en est rien : dans une eau qui contient de l'oxygène dissous on trouve communément du carbone à l'état de matière organique et de l'azote à l'état de gaz N2. C'est que la présence d'un élément est moins le reflet exact d'un équilibre statique que la résultante d'un ensemble de réactions d'oxydo-réduction et de processus de diffusion et de mélange aux vitesses fort différentes.
En ce qui concerne les réactions d'oxydo-réduction, la situation de déséquilibre est entretenue par deux types d'activité. D'une part, l'activité photosynthétique qui, piégeant l'énergie lumineuse pour la convertir en énergie chimique, produit de la matière organique, véritable accumulateur d'états réduits. D'autre part l'activité respiratoire et minéralisatrice de tous les organismes, à commencer par celle des organismes non-photosynthétiques, qui tend à rééquilibrer la situation en catalysant l'oxydation de cette matière organique et en utilisant l'énergie ainsi libérée pour maintenir en vie les cellules en place et pour en synthétiser de nouvelles.
Finalement, la situation d'équilibre à laquelle l'oxygène aboutirait sous la seule contrainte de lois physiques est perpétuellement remise en question par la photosynthèse, par la respiration, la décomposition ainsi que par quelques réactions chimiques.
2.2 La dissolution de l'oxygène atmosphérique
L'air est un mélange de gaz qui contient environ 20,95% d'oxygène en volume (tableau 1). Quand l'air est au contact de l'eau, celle-ci dissout une certaine quantité d'oxygène en fonction des caractéristiques intrinsèques de solubilité du gaz mais aussi en fonction des conditions de milieu qui règnent dans l'atmosphère (pression atmosphérique, humidité) et dans l'eau (température, pression hydrostatique, salinité).
Effet de la pression atmosphérique
D'après la loi de Henry, à l'équilibre et à une température donnée, la concentration en oxygène dissous de l'eau est proportionnelle à sa pression partielle dans la phase gazeuse.
À 10°C et sous 1 atm. (760 mm de Hg), 1 litre d'eau pure en contact avec de l'oxygène pur en dissout 38,46 ml (54,94 mg).
Mis en contact avec de l'air sec, il n'en dissout plus que 38,46 x 0,2095 soit 8,06 ml (11,51 mg), 0,2095 atm. représentant la pression partielle d'oxygène dans l'air (20,95% d'oxygène) sous 1 atm. (tableau I).
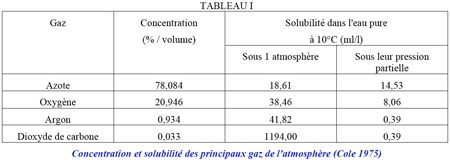
Comme la pression atmosphérique diminue avec l'altitude et varie avec les conditions météorologiques, il en est de même de la pression partielle, donc de la solubilité de l'oxygène. À 2000 m d'altitude, l'eau pure contient 22% d'oxygène en moins qu'au niveau de la mer à température égale (tableau II). Une chute de la pression atmosphérique de 30 mm de Hg entraîne une diminution de solubilité d'environ 4%.
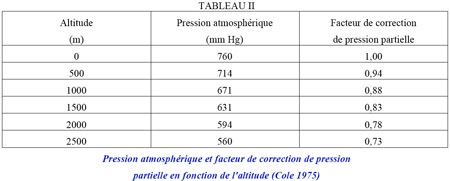
Effet de la température
La solubilité des gaz diminue avec la température, mais la détermination précise de la solubilité de l'oxygène dans l'eau n'a pas été une opération facile. Depuis la fin du XIXe siècle, de nombreux chercheurs s'y sont employés, obtenant des résultats dont les discordances résultèrent autant du manque de fiabilité des méthodes de dosage que de la diversité des conditions expérimentales, notamment de l'humidité de l'air. En effet, si l'air est humide, c'est-à-dire comme dilué par de la vapeur d'eau, la pression partielle de l'oxygène doit être calculée par rapport à la pression barométrique diminuée de la pression partielle de vapeur d'eau, cette dernière augmentant avec la température d'environ 1 mm de Hg/°C (tableau 3). Les standard methods (1971) donnent la formule :
OD =(P-u). 0,678 / (35 + t)
OD = oxygène dissous (mg.l-1)
P = pression barométrique (mm Hg)
u = pression de vapeur d'eau saturante (mm Hg)
t = température (°C) valable pour 0°C < t < 30°C.
Une autre formule, plus simple, valable pour 4°C < t < 33°C, au niveau de la mer, à ± 0,04 mg.l-1 est proposée par Montgomery et al (1964) :
OD = 468 / (31,6 + t)
Hitchman (1978) finit par dresser un tableau à partir de la moyenne des résultats obtenus par 11 auteurs différents (tableau III).
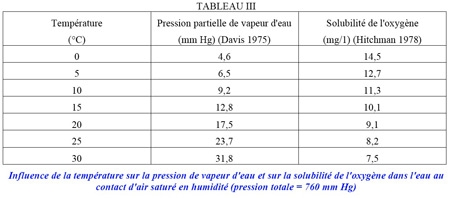
Compte tenu de ces difficultés, Monod et al. (1984) estiment plus prudent de ne pas garantir la seconde décimale.
Effet de la pression hydrostatique
Tout dépend si l'oxygène est évalué en termes de pression partielle ou en termes de solubilité. La pression partielle augmente avec 1a profondeur : par 10 000 m de fond, elle est 3,55 fois celle de la surface, à température égale. Par contre la solubilité est indépendante de la pression hydrostatique dans l'eau pure et diminue légèrement dans l'eau salée : par 10 000 m de fond dans une eau salée de densité 1,023, elle est inférieure de 3% à celle de la surface à température égale. Pratiquement, si l'on évalue la concentration en oxygène par voie titrimétrique, il n'y a pas lieu de tenir compte de la pression hydrostatique. Par contre, si l'on utilise une sonde à oxygène, qui mesure la pression partielle, il faut effectuer une correction qui atteint -5% pour 400 m de profondeur (Hitchman 1978).
Effet de la salinité
Les sels minéraux dissous dans l'eau ont pour effet de diminuer légèrement la pression de vapeur d'eau saturante et par conséquent la solubilité de l'oxygène (tableau IV). La diminution de cette dernière est exponentielle et atteint presque 20% pour une eau de mer de densité 1,035. On peut négliger le phénomène en eau douce, mais il peut avoir son intérêt en eau salée ou même saumâtre.
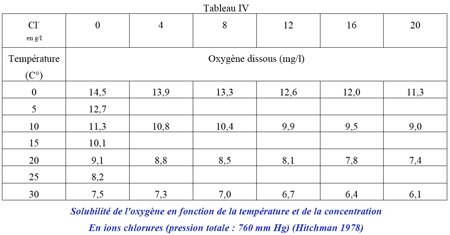
11:35 Publié dans Environnement-Écologie, Limnologie-hydrobiologie | Tags : limnologie, cycle de l'oxygène, oxygène dissous | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Qu'est-ce qu'un lac ?
Un lac est une étendue d'eau libre stagnante remplissant une dépression naturelle des continents, sans contact direct avec les océans. On le caractérise par différents paramètres morphologiques. Il occupe une dépression due à différents agents tectoniques, géologiques ou géographiques. La morphologie du lac dépend de son origine, de son mode d'alimentation et de son âge.
09:56 Publié dans Géologie-hydrogéologie-Climatologie, Limnologie-hydrobiologie | Tags : lac, eaux douces, eaux stagnantes, limnologie | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Les lacs : généralités
Notions de limnologie. Différents types de lacs. Zonation limnétique
14/06/2010
Classification trophique des lacs
Classification trophique des lacs. Le réseau alimentaire. Eutrophisation et pollution
11:23 Publié dans Géologie-hydrogéologie-Climatologie, Limnologie-hydrobiologie | Tags : lacs, limnologie, chaine alimentaire, plancton, matière organique, lacs oligotrophes, lacs mésotrophes, lacs eutrophes, lacs dystrophes, lacs sapropélotrophes | Lien permanent | Commentaires (13) | ![]() Facebook | | |
Facebook | | |
11/06/2010
Principaux lacs du Jura
Caractéristiques des principaux lacs du Massif du Jura
11:43 Publié dans Géologie-hydrogéologie-Climatologie, Limnologie-hydrobiologie | Tags : lacs, jura, limnologie, poissons, lac de saint-point, lac de remoray, lac de chalain, lac d'ilay, lac de la motte, lac du petit-maclu, lac du grand-maclu, lac de bonlieu, lacs de clairvaux les lacs | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |