28/02/2013
Audition et surdités
 L'Oreille,
L'Oreille,
l'Audition
et
les surdités
I. L'audition permet la communication
L'audition est le sens de l'ouïe, c'est-à-dire de la perception des sons.
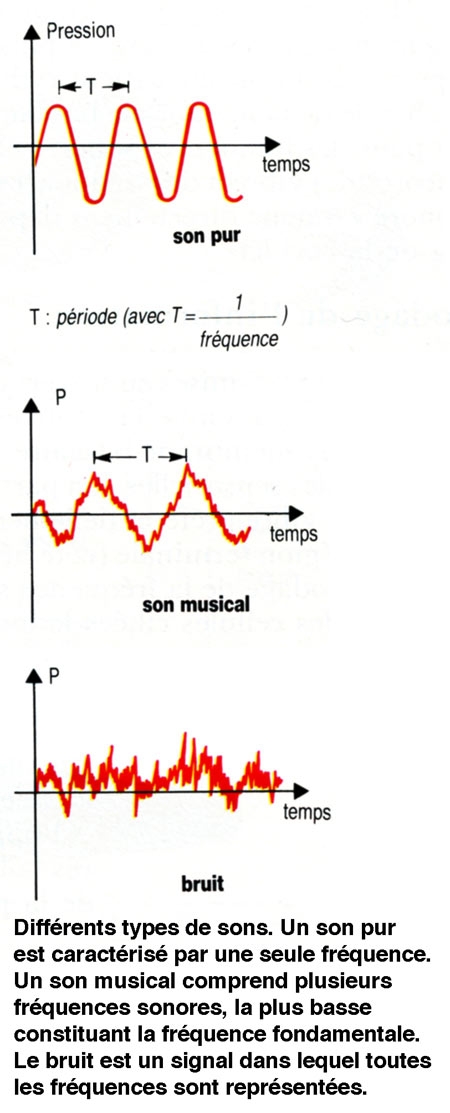
1. Qu'est-ce que le son ?
Le son est lié à une variation de pression du milieu. Il correspond à la mise en oscillation d'un milieu. Dans le cas de l'homme, il s'agit généralement de l'air, mais l'émission et la conduction sonores peuvent se faire également en milieu liquide ou solide. L'énergie est ensuite transmise, de molécule à molécule, à une vitesse de 340 m.s-1 (dans l'air). Les ondes sonores correspondent à l'alternance de zones de pression élevée et de zones de pression faible. L'amplitude des variations de pression est qualifiée de pression sonore. Elle peut être mesurée à l'aide d'un microphone, qui traduit la variation de pression en une variation de tension électrique.
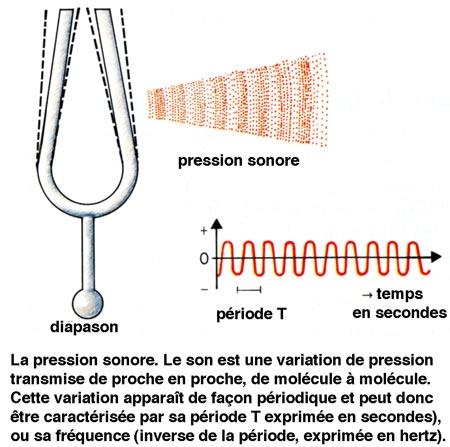
Compte tenu de l'importance de la gamme des niveaux sonores, l'échelle utilisée pour quantifier les pressions sonores est logarithmique. Le niveau de pression de référence PO a été placé légèrement en dessous du seuil de stimulation moyen de l'oreille. Pour une fréquence de 1000 Hz ; il est égal à 2.10-5 N.m-2. Ainsi, le niveau de pression sonore S d'un son donné est égal à :
S = 20 log (P/Po)
L'unité de S est appelée le décibel (dB). À 1 000 Hz, un décibel équivaut à un phone.
Un second paramètre du son est sa fréquence. Celle-ci est exprimée en cycles par secondes ou herz (Hz). Un son constitué d'une seule fréquence est qualifié de son pur. Cependant, un son est généralement constitué d'un mélange de plusieurs fréquences : une fréquence minimale ou fondamentale et des fréquences multiples de cette fondamentale ou harmoniques. Un son dans lequel toutes les fréquences sont représentées de façon quasi identique est qualifié de bruit blanc.
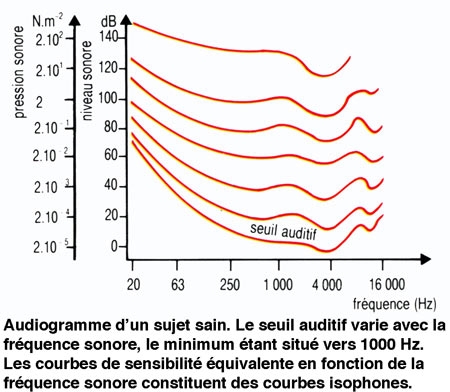
2. La sensibilité de l'ouïe varie avec la fréquence du son
L'homme est sensible à des vibrations sonores comprises entre 20 Hz et 20 000 Hz (ou 20 kHz). Le seuil d'audition varie en fonction de la fréquence d'un son pur stimulant. Il est minimal pour une fréquence de 1 kHz, et de l'ordre de 4 dB ou 4 phones. Au-delà de ce seuil, la sensibilité varie également en fonction de la fréquence du son stimulant. Ce phénomène peut être représenté sous forme de courbes isophones. À partir d'une valeur d'environ 130 phones, une sensation douloureuse remplace la sensation auditive. De tels sons peuvent endommager l'appareil auditif. Les ondes sonores émises au cours du langage parlé correspondent aux zones de meilleure sensibilité auditive.
3. Des sons graves et des sons aigus
La fréquence sonore est généralement décrite sous forme de hauteur d'un son. Un son grave est un son de basse fréquence, et un son aigu un son de haute fréquence. Dans la musique occidentale, la fréquence sonore est organisée en octaves. Un accroissement de la valeur tonale d'une octave s'obtient en doublant la fréquence d'un son.
4. Deux oreilles pour faciliter l'orientation auditive dans l'espace
Une écoute à l'aide des deux oreilles permet à un sujet de situer la source sonore dans l'espace. Le son étant conduit à vitesse finie, il ne parvient en même temps au niveau des deux oreilles que si rémission sonore a lieu dans l'axe de la tête. Dans les autres cas, l'onde sonore atteint les deux oreilles avec un décalage temporel qui permet au sujet de détecter la position de l'émetteur sonore.
II. Anatomie de l'oreille et physiologie de l'audition
1. Les sons sont canalisés avant de frapper l'oreille interne
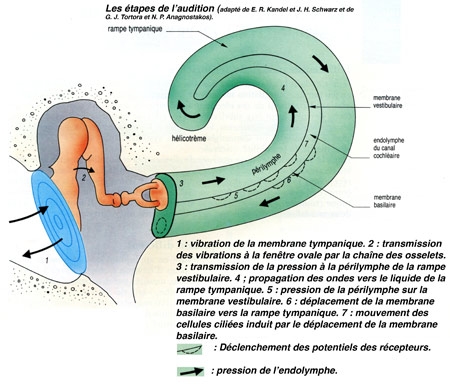
L'oreille représente l'organe de l'audition. En fait, ce que nous avons coutume d'appeler l'oreille n'est que sa partie apparente. L'oreille se compose en réalité de trois parties : externe, moyenne, et interne.. Le conduit entre l'oreille externe et l'oreille moyenne est séparé par une fine membrane : le tympan.
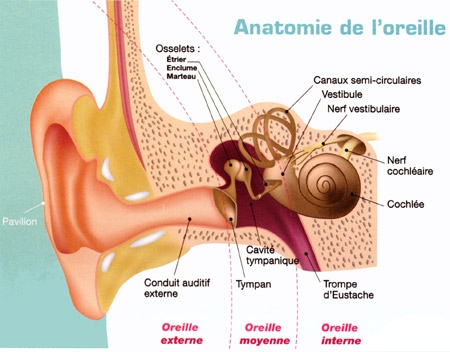
Sa partie visible est l'oreille externe qu'on appelle pavillon, nous sert d'antenne acoustique et de capteur. Les sons pénètrent dans le conduit auditif externe.
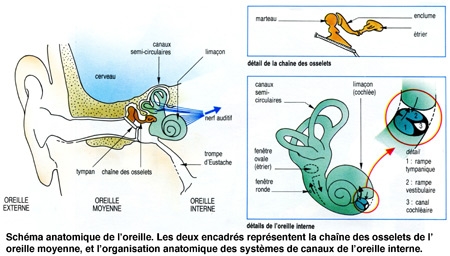
Les ondes sonores mettent ensuite en vibration le tympan qui obture l'oreille moyenne, située dans une cavité osseuse du crâne. Dans cette cavité, une chaîne de trois osselets, le marteau, l'enclume et 1'étrier, permet de transmettre les vibrations du tympan vers une structure qui sépare oreille moyenne et oreille interne : la fenêtre ovale. Les trois osselets vont servir d'amplificateurs pour compenser la perte d'énergie liée au passage de l'onde sonore du milieu aérien au milieu liquidien de la cochlée dans l'oreille interne. Saisissant les déplacements du tympan, le marteau transmet son énergie à l'enclume, qui la communique à l'étrier.
Pour égaliser les pressions de part et d'autres du tympan un conduit, la trompe d'Eustache relie la cavité de l'oreille moyenne au pharynx, une fonction très utile surtout lors du décollage d'un avion par exemple.
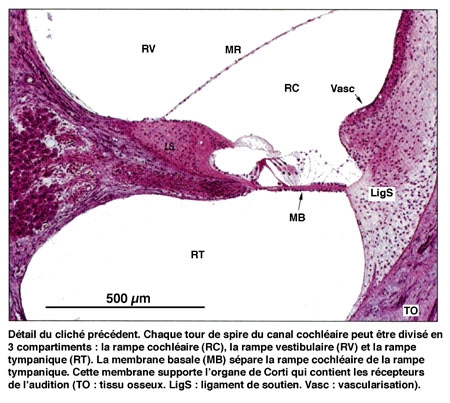
L'étrier (le plus petit os du corps humain) est en contact avec la membrane obturant la fenêtre ovale, point d'entrée dans l'oreille interne où se trouve l'organe de l'audition : la cochlée ou limaçon, sorte de long cône composé de trois tubes ou rampes caractérisés par un enroulement hélicoïdal et remplis de liquide.
III. L'oreille interne permet de coder les fréquences sonores
1. La membrane basilaire vibre en fonction de la fréquence sonore
Les vibrations, qui atteignent la fenêtre ovale par l'intermédiaire de la chaîne des osselets, sont transmises au travers des différentes rampes, jusqu'au niveau de la fenêtre ronde. La mise en mouvement du canal cochléaire, et plus particulièrement de la membrane basilaire, provoque un fléchissement rythmique des cils des cellules sensorielles.
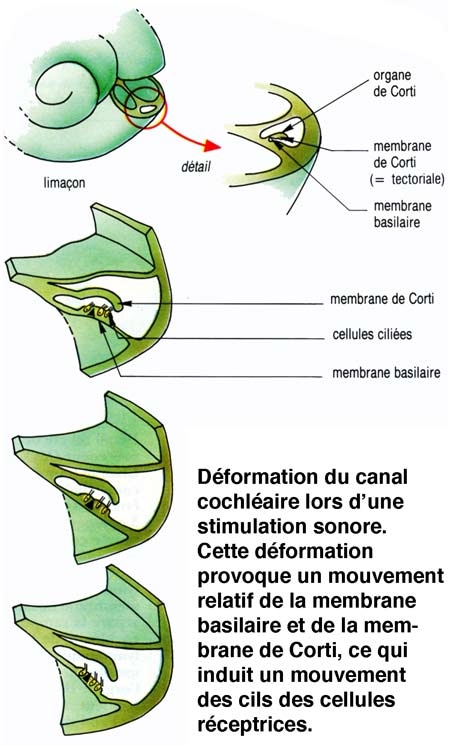
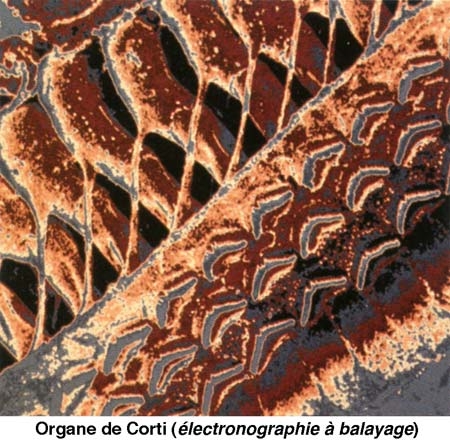
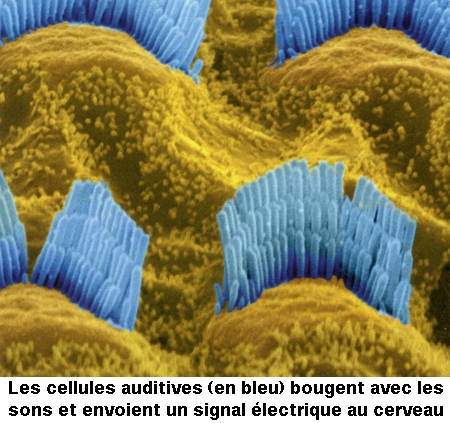
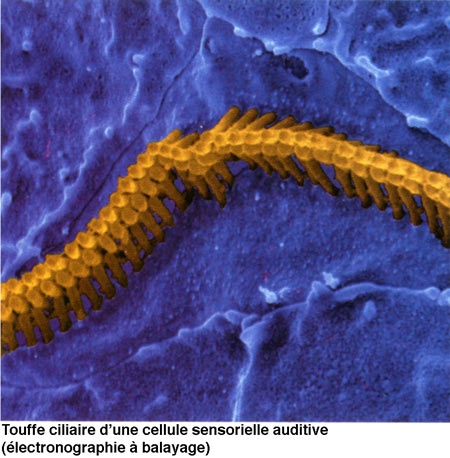
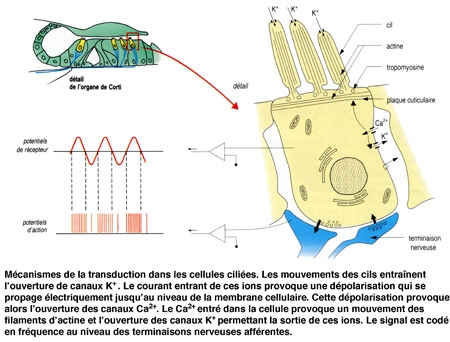
Le canal central contient l'organe sensoriel de l'audition, l'organe de Corti, tapissé des cellules sensorielles auditives : les cellules ciliées (15 000 par cochlée). La rampe vestibulaire et la rampe tympanique contiennent de la périlymphe riche en Na+, et encadrent le canal cochléaire qui, lui, contient de l'endolymphe riche en K+. Les cellules ciliées sont coiffées d'une touffe de stéréocils, qui transforment l'onde sonore en signal électrique. La partie basale de la membrane basilaire, peu large et épaisse, vibre préférentiellement pour des fréquences sonores élevées. À l'opposé, la région terminale (côté hélicotrème) vibre à des fréquences sonores faibles. Le codage de la fréquence sonore est donc directement dépendant de la position des cellules ciliées le long de la cochlée. La rampe tympanique et le canal cochléaire sont séparés par la membrane basilaire qui porte l'organe sensoriel proprement dit, ou organe de Corti. Ce dernier contient des cellules réceptrices ciliées, organisées en trois rangées externes et une rangée interne. L'ensemble est recouvert d'une membrane tectoriale attachée au côté interne de la cochlée.
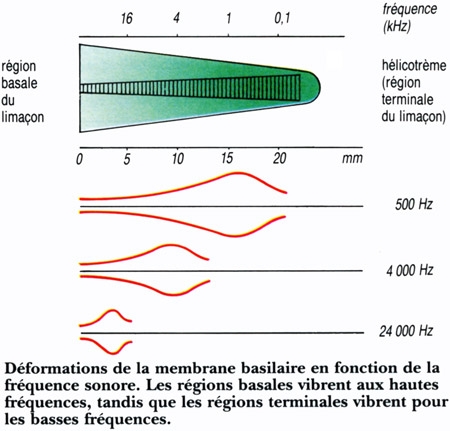
L'onde sonore amplifiée par l'oreille moyenne est en effet transformée en onde liquidienne qui va mettre en vibration la touffe ciliaire des cellules ciliées. Ces cellules sont des transducteurs : elles transforment les mouvements de leurs stéréocils en signal nerveux transmis au nerf auditif. Le long de la cochlée, chaque cellule ciliée répond préférentiellement à une fréquence sonore donnée, pour permettre au cerveau de différencier la hauteur des sons (batterie de résonateurs) : dans la partie basale de la cochlée sont codés les sons aigus, au sommet les sons graves.
2. Les cellules ciliées assurent le codage de l'information
La différence de potentiel transmembranaire des cellules ciliées varie de façon synchrone avec le mouvement des cils. Au cours du mouvement des cils vers remplacement équivalent du kinocil, la membrane de leur extrémité se déforme, et permet l'ouverture de canaux K+. Les cils baignant dans une endolymphe riche en K+, un courant entrant d'ions positifs (K+) s'établit, provoquant une dépolarisation de la membrane. Cette dépolarisation provoque l'entrée d'ions Ca2+ qui permettent à la fois le mouvement des filaments contractiles de la plaque cuticulaire (ce qui accentue le mouvement des cils) et l'ouverture de canaux K+ situés sur la membrane du corps cellulaire. Ces derniers étant ouverts vers la périlymphe, le courant K+ qui s'établit est un courant sortant, repolarisant la membrane. Le potentiel générateur et les potentiels d'action apparaissent au niveau postsynaptique, dans la fibre sensorielle.
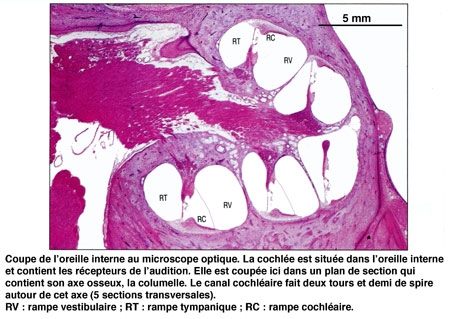
L'oreille interne contient, outre l'organe de l'ouïe, le vestibule, organe de perception de l'équilibre, repérant la position angulaire de la tête et les mouvements d'accélération.
3. Le cerveau traite les signaux
Le cerveau interprète le signal comme un son de la hauteur tonale correspondant au groupe de cellules excitées. L'analyse de l'intensité du son repose, quant à elle, sur divers mécanismes selon la fréquence sonore, le taux de décharges des neurones auditifs et la nature des neurones qui répondent (neurones à haut seuil ou à bas seuil).
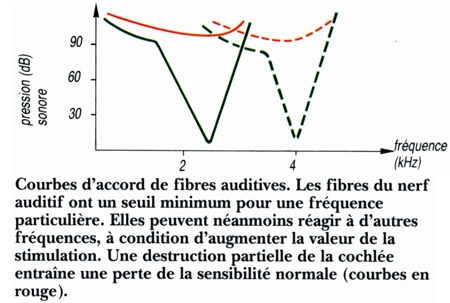
Chaque fibre sensorielle est préférentiellement mise enjeu pour une fréquence particulière, mais peut également être mise en jeu par des fréquences différentes. La courbe du seuil de ces fibres en fonction de la fréquence sonore constitue leur courbe d'accord. Au niveau du cortex auditif les cellules sont organisées en colonnes fonctionnelles. Les neurones appartenant à une même colonne ont tous des courbes d'accord semblables. Les informations auditives liées au langage sont ensuite traitées dans des régions corticales particulières. Les aires principales impliquées dans ce traitement sont localisées normalement à l'hémisphère gauche. Ce sont l'aire temporale du langage, encore appelée aire de Wernicke, et l'aire frontale du langage, ou aire de Broca. La première est impliquée dans les processus sensoriels de reconnaissance de la parole, tandis que la seconde est plus directement liée à l'expression orale.
IV. Les surdités
- Origine des surdités
S'il existe quelques rares surdités d'origine centrale (impliquant le cerveau), la grande majorité des surdités est liée à un défaut de l'oreille elle-même.
Les surdités de transmission ont pour origine un défaut de l'oreille externe ou moyenne.
Les surdités neurosensorielles (surdités de perception) ont essentiellement pour origine une atteinte de la cochlée.
Dans ces deux catégories, certaines surdités sont génétiques, d'autres acquises.
- Surdité : la part des gènes
L'audition est un outil majeur de communication, d'autant plus qu'elle est essentielle à l'acquisition de la parole : l'afflux d'informations auditives vers les «aires cérébrales de traitement du langage » est capital dans le jeune âge (au cours des six premières années de la vie - et tout particulièrement entre 0 et 3 ans) pour qu'un enfant apprenne à parler. Si la perception de la parole ou de la musique est une activité essentiellement cérébrale, la première étape du traitement des signaux sonores est effectuée par le système auditif périphérique. En cas de déficit non corrigé des atteintes auditives, le langage oral ne peut être acquis.
- Un millier d'enfants naît sourd chaque année et 65% des plus de 65 ans sont malentendants
Or en France, la surdité sévère ou profonde touche chaque année près d'un millier de nouveau-nés, avec les conséquences mentionnées sur l'acquisition du langage oral et sur le développement du lien du tout-petit avec ses proches. Un individu sur mille est de plus affecté par la surdité plus tard au cours de l'enfance. Ensuite, le pourcentage de malentendants dans la population ne cesse de progresser : 6% entre 15 et 24 ans, 9% entre 25 et 34 ans, 18% entre 35 et 44 ans et plus de 65% après 65 ans. Au total, la surdité concerne plusieurs millions de Français, à divers degrés de perte auditive, avec des conséquences variables sur leur vie sociale, Au-delà des surdités légères, les surdités moyennes ont, chez l'enfant, un impact négatif sur l'apprentissage scolaire, le développement cognitif et l'adaptation sociale. On l'a vu, les surdités profondes contrarient chez lui l'acquisition du langage oral et ont, chez l'adulte, l'isolement social pour conséquence majeure.
Face à ce problème considérable, la génétique a totalement modifié la donne, permettant une meilleure prise en charge des surdités de l'enfant, préparant pour lui de futures thérapies, et plus récemment, apportant un espoir supplémentaire : celui de prévenir les surdités liées au vieillissement.
- Surdités tardives : des problèmes de perception des fréquences aux acouphènes
« On peut imaginer l'organe sensoriel auditif comme un clavier de piano, où chaque région traite une fréquence qui lui est spécifique », explique Aziz El Amraoui, de l'unité Génétique et physiologie de l'audition, à l'Institut Pasteur. « La cochlée décompose les sons en ses fréquences élémentaires : les sons aigus (hautes fréquences) sont captées à la base de la spirale cochléaire. les sons graves (basses fréquences) dans sa partie haute. Avec le temps, les sons les plus aigus sont moins bien entendus ». La perte de l'audition avec l'âge s'accompagne d'une difficulté à distinguer les sons, à entendre par exemple une conversation dans un brouhaha. De plus, les surdités acquises sont assez fréquemment accompagnées d'acouphènes, des perceptions auditives (battements, grésillements, sifflements) en l'absence de stimulus externe, souvent très invalidantes : en France, près de 5 millions de personnes en souffriraient. Il semble que la perte auditive s'accompagne d'une augmentation de l'activité spontanée le long des voies auditives du cerveau aboutissant à ces perceptions « fantômes ». « Un rétablissement des entrées sensorielles à un niveau similaire à celui qui prévalait avant la perte auditive réduirait le gain central et supprimerait ainsi les acouphènes », avance Arnaud Norena, de l'Université Aix-Marseille, dans la revue Biofutur (novembre 2012). « Cette prédiction est en partie corroborée par la réduction/suppression des acouphènes produites par les aides auditives, les implants cochléaires et la stimulation acoustique ciblée sur les fréquences de la perte auditive. » Une raison de plus, donc, pour améliorer le traitement des surdités...
V. Les appareils auditifs existants
- Les aides auditives
Avec les aides auditives, le son est capté par un ou plusieurs microphones et le signal traité par un microprocesseur, amplifié, puis réémis via un écouteur dans le conduit auditif externe.
- Les aides en conduction osseuse stimulent directement l'oreille interne à travers les os du crâne ; un microphone capte les vibrations sonores, transmises à l'os temporal par un vibrateur placé derrière l'oreille ; les vibrations de la paroi osseuse autour de la cochlée sont ensuite transférées aux cellules sensorielles. Ces aides auditives sont parfois insuffisantes ou inadaptées à certaines formes de surdité. Deux sortes d'implants peuvent alors optimiser une audition résiduelle ou suppléer des structures défaillantes.
- L'implant d'oreille moyenne, fixé sur un osselet ou à proximité de l'oreille interne, capte les vibrations et les transmet à l'oreille interne.
- Avec l'implant cochléaire, un processeur externe transforme les sons en signaux électriques et les transmet par ondes à la partie interne implantée chirurgicalement, composée d'un ensemble d'électrodes. Ces dernières délivrent des impulsions électriques qui stimulent les fibres du nerf auditif.
- Les trois-quarts des surdités de l'enfant sont d'origine génétique
Dans les années 90, on ne connaissait pas la cause du déficit auditif des enfants qui naissaient sourds. Une équipe de généticiens à l'Institut Pasteur (voir Entretien) localisait alors les premiers gènes associés à des surdités sur des chromosomes humains. Ils firent cette découverte grâce à des collaborations avec plusieurs pays du bassin méditerranéen qui leur permirent de regrouper des données sur de nombreux individus appartenant à différentes familles, caractérisées par une forte consanguinité. Après ces premières grandes analyses génétiques, l'équipe contribua à l'identification d'une trentaine de gènes associés à des surdités, et d'autres dans le monde lui emboîtèrent le pas : 70 gènes impliqués dans des surdités héréditaires sont aujourd'hui connus. L'un d'eux, comme l'ont montre les chercheurs pasteuriens dès 1997, est à lui seul responsable de la moitié de ces surdités [le gène de la connexine 26]. Et l'on sait aujourd'hui que les trois-quarts des surdités de l'enfant sont d'origine génétique, le reste étant notamment dû a des traumatismes ou infections pendant la grossesse.
- Détecter le plus tôt possible les surdités néonatales, pour pouvoir appareiller
Cette aventure scientifique a révolutionné la prise en charge des surdités de l'enfant. Aujourd'hui, grâce aux travaux des chercheurs, des tests de diagnostic moléculaire des surdités les plus fréquentes sont utilisés en routine dans de nombreux pays du monde. Il est en effet important de détecter le plus tôt possible les surdités congénitales. Connaître le gène en cause permet de décider s'il faudra appareiller ou non l'enfant (dans certains cas, heureusement rares, l'appareillage ne résoudra rien] : plus l'enfant pourra entendre tôt, plus le retentissement de la surdité sur ses aptitudes linguistiques sera faible. Les chercheurs ont par exemple montré en 2006 que chez les enfants dont la surdité était due à un défaut du gène de l'otoferline, une protéine nécessaire à la transmission du signal par les cellules sensorielles auditives aux neurones auditifs, la pose précoce d'un implant cochléaire était recommandée alors que les caractéristiques de leur perte auditive conduisaient à s'interroger sur le bénéfice possible de l'implant. Parallèlement à ces avancées, ces recherches ont permis de comprendre de façon plus approfondie le fonctionnement de notre appareil auditif, et tout particulièrement celui de la cochlée, l'organe sensoriel de l'audition logé dans l'oreille interne.
- Un espoir majeur : la thérapie par les gènes
Aujourd'hui, beaucoup d'espoirs sont fondés sur la thérapie génique. Il s'agit là de restaurer la fonction auditive à l'aide du transfert du gène normal [«gène-médicament»], afin de compenser la fonction défectueuse de ce même gène chez le malentendant. Les méthodes envisagées sont diverses, combinant par exemple thérapie cellulaire et thérapie génique : certaines passent par l'introduction du « gène-médicament » dans des cellules souches ensuite différenciées en cellules de la cochlée, puis ré-introduites dans l'organe sensoriel. Les premiers résultats expérimentaux encouragent les scientifiques à poursuivre l'exploration de ces voies thérapeutiques nouvelles. Mais le domaine de l'enfance ne sera pas le seul bénéficiaire de la « révolution génétique » des recherches sur les surdités. Il s'agit désormais d'empêcher la dégradation de l'appareil auditif chez l'adulte. Les surdités de l'adulte, acquises au cours de la vie, sont liées à des traumatismes sonores, des infections (environ 20% des cas sont dus à des otites chroniques), des accidents liés à l'hyperpression (plongée) ou encore à une toxicité médicamenteuse. La plupart de ces facteurs contribuent à la destruction progressive des cellules sensorielles de la cochlée, indispensables à l'audition, et non renouvelables. Le vieillissement contribue par lui-même à une perte auditive qui apparaît le plus souvent à partir de 50-60 ans, la presbyacousie, aujourd'hui irréversible.
- De même que nous avons chacun un « capital soleil », nous aurions aussi un « capital son »
Là encore, la génétique joue un rôle : il existe une grande variabilité dans la sensibilité individuelle à l'atteinte auditive par la surexposition au bruit comme au traumatisme acoustique. Ainsi, chacun d'entre nous serait - selon son ADN - plus ou moins sensible au bruit. De même que nous avons chacun un « capital soleil », nous aurions aussi un « capital son ». Des gènes de prédisposition interviennent également dans notre sensibilité aux médicaments toxiques pour le système auditif (médicaments « ototoxiques »). Les scientifiques sont désormais engagés dans une nouvelle voie de recherche : comprendre comment notre oreille s'abîme, comment elle vieillit. La génétique est un outil majeur dans cette quête. Les réponses trouvées par les chercheurs devraient ouvrir la voie à des solutions thérapeutiques, que ce soit par traitements pharmacologique, génique ou cellulaire, associés ou non à des appareillages « classiques » du type implant cochléaire.
À ce jour - où le diagnostic génétique d'une surdité chez l'enfant est désormais une réalité - la perspective de prévenir l'apparition des surdités liées à l'âge n'a plus rien d'utopique...
- Face à un syndrome de surdité-cécité : l'espoir de traiter la cécité
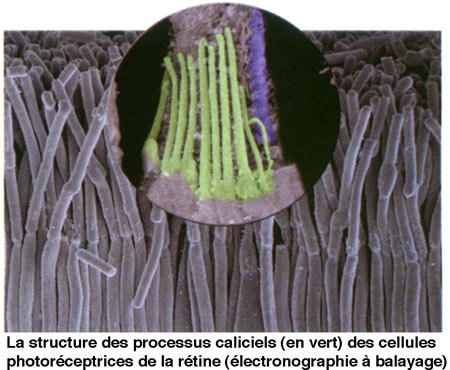
L'équipe du Pr Christine Petit à l'Institut Pasteur étudie depuis quelques années une maladie génétique heureusement rare (elle touche une personne sur 10 000) qui associe surdité et cécité : le syndrome de Usher. Les enfants touchés naissent sourds et leur vision est progressivement altérée en raison du développement d'une rétinite pigmentaire. Parmi les différentes formes de la maladie, le type 1 (40% des cas) est le plus sévère : la surdité est profonde et les troubles de la vision apparaissent précocement. S'il existe une bonne prise en charge des patients concernant les troubles auditifs, - notamment grâce aux travaux des chercheurs et des équipes médicales -, aucun traitement ne permet aujourd'hui de stopper l'issue de la rétinite pigmentaire. Or les travaux du Pr Christine Petit[1], en collaboration avec le Pr José-Alain Sahel (Institut de la Vision), ont récemment permis de découvrir l'origine de la rétinite pigmentaire qui touche les patients atteints. Il s'agit d'un défaut dans l'organisation d'édifices cellulaires indispensables au maintien de la vision, les processus caliciels (voir photo) des cellules photoréceptrices de la rétine, dû au dysfonctionnement de l'une quelconque des cinq protéines impliquées dans cette maladie, et qui, ensemble, assurent la cohésion de ces structures. Ces travaux qui définissent les cibles de la maladie vont guider les approches thérapeutiques, aujourd'hui en cours, de cette cécité.
L'interview du Pr Christine Petit
Christine Petit est professeure au Collège de France et à l'Institut Pasteur, responsable de l'unité de Génétique et physiologie de l'audition.
Notre nouvel objectif est de comprendre les processus défectueux dans la surdité tardive pour en prévenir la survenue et la progression.
"Le domaine des surdités héréditaires de l'enfant a été transformé par les recherches de notre équipe."
Comment est née l'approche génétique de l'audition ? L'audition a été initialement explorée par les physiciens - intrigués par les performances exceptionnelles de l'organe sensoriel, la cochlée, qui se comporte comme un analyseur fréquentiel, transforme les sons, signaux mécaniques, en signaux électriques, les amplifie et aussi les distord... -, puis par les physiologistes, et enfin, par les généticiens. Nous avons mis en œuvre une approche génétique de l'audition pour déchiffrer les bases cellulaires et moléculaires du développement et du fonctionnement de la cochlée, qui échappaient jusque là à toute analyse en raison du tout petit nombre de cellules cochléaires. La cochlée ne comporte en effet que quelques milliers de cellules sensorielles auditives. La rétine, pour comparaison, est dotée d'une centaine de millions de cellules sensorielles photoréceptrices. L'intérêt de rapproche génétique pour identifier les molécules requises pour une fonction cochléaire puis en déchiffrer les mécanismes moléculaires correspondants tient au fait que son efficacité est indépendante du nombre de cellules ou de molécules impliquées dans la fonction explorée.
Qu'avez-vous découvert ?
En localisant les premiers gènes responsables de cette atteinte sensorielle sur les chromosomes humains, dans les années 1990, nous avons ouvert le domaine de l'audition à l'analyse génétique. Puis nous avons développé une approche spécifique pour identifier les gènes dont l'atteinte était susceptible d'être à l'origine de surdité chez l'enfant. Cette démarche nous a conduit à la découverte rapide de plusieurs gènes responsables de surdité précoce. Aujourd'hui, 70 de ces gènes sont connus. Par le développement d'approches pluridisciplinaires, impliquant à côté des généticiens, des biologistes cellulaires, des biochimistes, des électrophysiologistes et des physiciens, nous nous sommes ensuite engagés dans l'étude des mécanismes défectueux dans ces surdités. Nous avons pu en parallèle, déchiffrer les mécanismes moléculaires qui sous-tendent certaines propriétés physiologiques connues de la cochlée et éclairer les rôles de plusieurs structures cochléaires. Un grand nombre de laboratoires à travers le monde se sont ensuite engagés dans ce champ disciplinaire. C'est un domaine scientifique et médical particulièrement dynamique.
Quelles applications ces découvertes ont-elles permis pour les surdités de l'enfant ?
Le développement du diagnostic moléculaire de surdité héréditaire permet d'informer les familles qui le souhaitent sur le risque de récurrence d'une atteinte auditive chez les enfants à venir. La connaissance de la pathogénie des diverses formes de surdité permet, dans certains cas, de recommander l'utilisation d'appareils auditifs, en particulier de l'implantation cochléaire, alors que les caractéristiques audiologiques de la surdité suscitent le doute sur leur efficacité. Elle permet parfois, à l'inverse, de conseiller d'éviter tout appareillage auditif et de s'en remettre à des traitements pharmacologiques, dont la connaissance des mécanismes pathogéniques de ces surdités permet de prédire l'efficacité. Aujourd'hui, fondés sur ces avancées, des espoirs de traitements se profilent. Plusieurs laboratoires à travers le monde sont engagés dans la recherche de traitements des surdités, en particulier par voie génétique.
Vous vous intéressez aussi aux surdités tardives. Que peut-on espérer ?
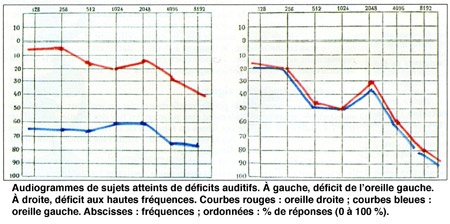
Notre objectif est de comprendre les processus défectueux dans la surdité tardive pour en prévenir la survenue et la progression. On sait que certains gènes prédisposent à la presbyacousie, et aux atteintes auditives liées à une surexposition au bruit. La plupart d'entre eux restent à découvrir. C'est une étape incontournable pour caractériser les processus pathogéniques en cause. Nous identifions par exemple un nombre croissant d'atteintes auditives liées à des perturbations du métabolisme antioxydant que l'on pourrait vraisemblablement prévenir par des médicaments existants. Dans ce but, nous avons créé au cours des dernières années un réseau national qui comporte plusieurs services d'ORL afin de regrouper des familles atteintes de presbyacousie pour rechercher les gènes impliqués. Une analyse approfondie de leur audition a été mise en place. Elle comporte des tests psychoacoustiques pour nous permettre de reconnaître les atteintes de l'intelligibilité de la parole qui sont souvent, chez ces personnes, beaucoup plus sérieuses que ne le prédit la mesure du seuil de leur perception auditive par l'audiogramme. C'est un effort collectif important. Il nous permet aujourd'hui d'analyser environ 150 familles, auxquelles s'ajoute plus d'un millier d'individus atteints. On imagine aisément que le coût de cette recherche, qui repose sur l'analyse exhaustive des génomes de ces personnes, est très élevé.
Glossaire :
Courbe isophone : courbe reliant, sur un audiogramme, les valeurs de pressions sonores entraînant des sensations d'intensité identique.
Décibel (dB) : n.m., unité de pression sonore relative. 1 dB = 20 log.(P/2.10-5 ), où P est la pression sonore exprimée en newton.m-2.
Phone : n. m., unité sans dimension permettant de graduer l'échelle de sensibilité auditive en fonction de la fréquence des sons. La référence se situe à 1 kHz où 1 phone = 1dB.
Cochlée : n.f., partie de l'oreille interne formée de l'enroulement de trois canaux et dans laquelle sont situées les cellules réceptrices sensibles aux vibrations sonores.
Hélicotrème : n.m., extrémité apicale de la cochlée.
Organe de Corti : partie de la cochlée regroupant les cellules sensorielles.
Tympan : n.m., membrane séparant l'oreille externe de l'oreille moyenne.
[1] Menés avec les Drs Azizi El Amraoui et Iman Sahly.
Sources :
- Surdités La lettre de l'Institut Pasteur, revue trimestrielle février 2013.
- Périlleux E., Anselme B., Richard D. (1995). - Biologie humaine, anatomie, physiologie, santé. Ed. Nathan.
18:20 Publié dans Biologie, Environnement-Écologie, Médecine | Tags : audition, oreille, surdité, institut pasteur | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
25/02/2013
Le belvédère du Fondereau
Le belvédère du Fondereau
par Dominique Delfino
photographe animalier et paysagiste
Libre et sauvage, le belvédère du Fondereau offre l'un des plus beaux points de vue à découvrir dans la côte de Maîche.
Juste après le tunnel à gauche, la petite route en direction de Montandon, vous permet d'accéder à un petit parking signalant le belvédère aménagé 150 mètres plus loin. Le panorama est exceptionnel laissant apprécier et découvrir les plateaux du Haut-Doubs fracturés par la vallée du Dessoubre. Un rayon de soleil vient caresser une ferme isolée installée sur le versant d'une dépression plongeant vers la vallée du Dessoubre.
À cette saison, la neige enveloppe le paysage dans une ambiance de paix et me permet de réaliser des images comparatives aux différentes saisons, l'automne étant particulièrement très intéressant depuis ce site.


07:58 Publié dans Environnement-Écologie, Nature & philosophie | Tags : hiver, campagne, haut-doubs, maîche, fondereau | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
23/02/2013
Risque nucléaire : la France cesse de faire l'autruche
 Le risque nucléaire : il était temps que la France cesse de faire l'autruche !
Le risque nucléaire : il était temps que la France cesse de faire l'autruche !
On est content que la France avec ses 58 réacteurs s'inquiète enfin.
par Vincent Nouyrigat
(Science & Vie, n° 1146, mars 2013, p. 34).
Quatre cent trente milliards d'euros. Vous avez bien lu : 430 milliards d'euros ou, dit autrement, 20 % du PIB de la France. Tel serait le coût apocalyptique d'une catastrophe nucléaire sur notre territoire, selon une évaluation de l'IRSN - le gendarme français de l'atome. Un chiffre injustement passé inaperçu cet automne... Inutile de chercher un quelconque équivalent parmi les grands désastres technologiques : même l'explosion de l'usine AZF fait figure de péripétie avec "seulement" 2 milliards d'euros de dommages.
Non, l'éventuelle fusion d'un réacteur dans l'Hexagone, assortie de rejets radioactifs massifs, appartient à une tout autre espèce. De celles qui laissent un pays aux abois, comme ravagé par une guerre : des territoires entiers condamnés pour des décennies, sans doute près de 100 000 réfugiés à reloger, la production électrique en péril, une image durablement salie (tourisme, exportations)... Autant de conséquences pétrifiantes face auxquelles notre Autorité de sûreté nucléaire présentait, le 21 novembre dernier, ses premières ébauches de parades. De "premières" ébauches seulement ? Oui, mais saluons déjà cette bonne nouvelle : la France, ce pays aux 58 réacteurs, ose enfin affronter l'hypothèse d'un accident nucléaire majeur !
Il était temps, près de trente ans après la catastrophe de Tchernobyl et alors même que les autorités japonaises semblent toujours dépassées par les effets de Fukushima. Mais voilà : jusqu'à présent, nos pouvoirs publics avaient soigneusement éludé les scénarios catastrophes, pour des raisons mêlant confiance aveugle en l'atome français et farouche volonté de taire certaines questions embarrassantes, comme la prise en compte de ce risque dans les coûts du kilowattheure nucléaire. Et jusqu'ici, la sécurité civile s'était contentée d'établir de classiques mesures d'urgence dans un périmètre minuscule (distribution de pastilles d'iode, exercices d'évacuation). Sans se soucier, donc, des suites à donner une fois qu'un nuage radioactif aura contaminé toute une région. D'accord, ce travail d'anticipation est d'une ampleur intimidante : il s'agit ni plus ni moins d'envisager tous les détails de la vie d'un vaste territoire en crise pour des décennies.
Cette réflexion en amont n'en est pas moins indispensable, si l'on songe aux innombrables décisions qu'il faudrait prendre, à la fois complexes et déchirantes. Les Ukrainiens et les Japonais en savent quelque chose désormais... Au vrai, personne ne voudrait improviser à l'heure de désigner les régions que les Français devraient abandonner dans l'urgence (et les laissera-t-on revenir un jour prendre leurs affaires ?), d'autoriser ou non les éleveurs à alimenter leur bétail en zone radioactive, ou d'organiser en quelques heures la décontamination de tous les lieux publics qui peuvent l'être, en décapant trottoirs, murs, toits, en élaguant tous les arbres, en remplaçant les bacs à sable des jardins d'enfants... Au passage, il faut bien avoir cogité plusieurs années avant de trouver le moyen de traiter ces montagnes de déchets radioactifs !
Réaliser que la France héberge depuis un demi-siècle quantité de réacteurs sans jamais avoir planché sur ces casse-tête, voilà qui fait frémir rétrospectivement... Apprendre qu'elle commence seulement depuis peu à y réfléchir ne rassure qu'à moitié. Mais il n'est jamais trop tard pour ouvrir les yeux.
14:29 Publié dans Actualité des Sciences, Nature et santé, Pollution | Tags : sortir du nucléaire, nucléaire, risque nucléaire, catastrophe nucléaire | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
20/02/2013
Royal, le Milan
Royal, le Milan
par Dominique Delfino
Photographe naturaliste et animalier
Si les Cigognes blanches ont déjà été signalées à plusieurs reprises dans la région, il est également possible d'observer de retour de migration, un très grand et beau rapace à cette époque de l'année.
À l'affût dans la neige sur le plateau de Brognard, j'observe le comportement de Buses variables profitant de quelques proies abandonnées lorsque se dessine dans le ciel le vol spectaculaire et majestueux de deux milans royaux.
Chassés constamment par les corneilles, les milans les déjouent d'un vol acrobatique pour leur échapper. À ma grande surprise, l'un deux se pose à proximité d'une buse, le milan semblant très intéressé par la proie de celle-ci.
Je profite de ce bref instant pour déclencher avant que la buse ne riposte pour conserver sa place car il est assez rare que le milan royal se pose au sol. Habituellement, le milan royal effectue un vol plongeant sur sa cible.
Cliché © Dominique Delfino
En cette fin d'hiver froid et enneigé, les animaux souffrent. Les buses notamment sont au bout de leurs réserves et ont beaucoup de mal a trouver leur nourriture. Affaiblies, elles sont victimes de collisions routières et, dans le meilleur des cas, elles sont apportées au Centre de Sauvegarde de la Faune Sauvage à L'Étoile. Buses, chauve-souris, chouettes, hérissons, la salle de soin du centre Athénas ne désemplit pas.
17:18 Publié dans Art et Nature, Environnement-Écologie, Ornithologie, Photographes naturalistes et scientifiques | Tags : dominique delfino, milan royal, buse variable, photographie animalière, oiseaux, rapaces diurnes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Macrophytes littoraux et écosystèmes lacustres
 Rôle des macrophytes littoraux dans le fonctionnement des écosystèmes lacustres
Rôle des macrophytes littoraux dans le fonctionnement des écosystèmes lacustres
par Paul Testard
I. Introduction
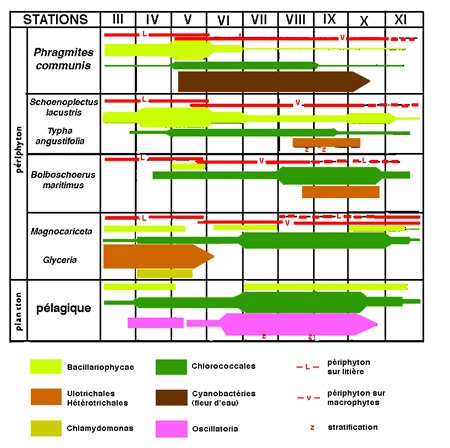
Dans le vocabulaire limnologique, le terme de macrophytes désigne l'ensemble des végétaux visibles à l'œil nu et inféodés à des degrés divers au milieu aquatique.
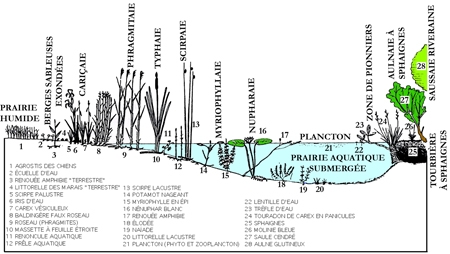
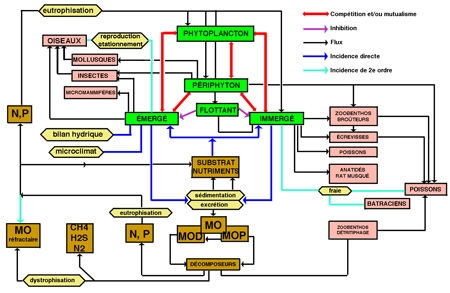
Sous ce terme est rassemblé un patrimoine biologique commun aux spécialistes des zones humides, représenté schématiquement par des végétaux émergés, supportant une immersion partielle (hélophytes), et aux limnologues, plus directement concernés par le rôle des herbiers littoraux résultant d'associations entre des hélophytes, des végétaux immergés et flottants (hydrophytes) (figure 1). Par extension, le terme de macrophytes désigne aussi un compartiment de l'écosystème aquatique susceptible d'être intégré à des modèles globaux de fonctionnement (figure 2).
Figure 1— Représentation schématique de la répartition des macrophytes dans la zone littorale d'un lac tempéré peu profond . au contact de formations prairiales (partie gauche de la figure) et arbustive (partie droite) (Montegur. Doc. ACTA. Tome 1, 1987).
Leur intervention spécifique dans le fonctionnement global des écosystèmes lacustres reste assez peu connue et peut-être sous-estimée. Il s'ajoute une difficulté analytique particulière à ces herbiers : leur association étroite avec des communautés microphytiques (algues + bactéries), qui constituent elles-mêmes la base structurelle du périphyton (ou Aufwuchs).
On peut concevoir que leur impact sur le fonctionnement des écosystèmes lacustres varie globalement en raison inverse de la dimension des milieux. Selon Duarte et al. (1986), une distinction doit être faite entre les hélophytes dont la biomasse et la surface de recouvrement sont proportionnelles à la surface des milieux lacustres (7% en moyenne), tandis que la biomasse et la surface occupée par les immergés diminuent d'une manière inversement proportionnelle aux dimensions des lacs. Dans la série continue des écosystèmes limniques, reliant les grands lacs aux milieux calmes et peu profonds, on peut ainsi trouver toutes les situations : depuis leur absence totale, l'existence de franges littorales ténues et dispersées, jusqu'à une occupation presque totale de l'espace en eau.
Figure 2— Incidences principales de la présence des macrophytes dans la zone littorale d'un lac tempéré.
Pour conclure, les petits milieux et les milieux peu profonds en général, représentent en nombre et en surface totale un patrimoine naturel bien supérieur à celui des grands lacs (figure 3). Dans l'hémisphère nord en particulier, des millions de lacs ont une surface inférieure à 10 ha et une profondeur moyenne inférieure à 3 m. De ce fait, on ne peut que s'interroger sur l'importance des macrophytes dans l'économie des systèmes aquatiques continentaux.
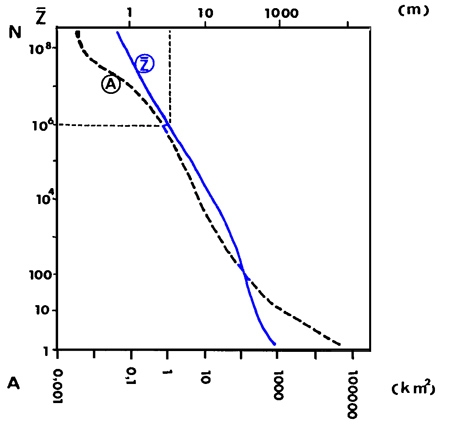
Figure 3 — Distribution numérique des systèmes lacustres en fonction de leur surface (A : tiretés) et de leur profondeur moyenne (Z : tracé bleu) (Wetzel 1990).
II. Conditions d'implantation
La présence en milieu lacustre de macrophytes enracinés est largement conditionnée par l'existence de sédiments constitués et stables (sables limoneux, argiles, vases organiques). En milieu tempéré, seules les mousses s'implantent sur des substrats rocheux, tandis que les flottants développent leurs racines dans l'eau même. L'extension des herbiers est déterminée par un ensemble complexe, souvent synergique, de facteurs morphométriques et physico-chimiques (cf. Duarte et al. 1986), voire historiques. Y sont associés : la morphologie et la pente des rives, le marnage, la nature des substrats (granulométrie et teneur en matière organique, oxygénation), la profondeur, les turbulences littorales (fetch, exposition des rives aux vents dominants), et plus spécialement pour les immergés, la turbidité de l'eau et la pression hydrostatique.
Les blooms phytoplanctoniques précoces et intenses en milieu eutrophe sont ainsi susceptibles d'inhiber leur développement, voire d'entraîner leur disparition (Sculthorpe 1967, Jupp & Spence 1977, Pokorny et al. 1990). Une forte charge en MES (Matières En Suspension) inorganiques a des effets identiques, avec leur remplacement éventuel par des végétaux flottants ou à feuilles flottantes (Malthus et al. 1990).
Enfin, envisagée sous ses aspects dynamiques, l'implantation des herbiers littoraux conduit à l'établissement de formations “climaciques” relativement peu stables ou à évolution lente. La phase pionnière de la colonisation de nouveaux milieux, quant à elle, est souvent marquée par un envahissement massif, de durée variable, par une seule espèce (Ceratophyllum, Elodea et Myriophyllum tempérées, Pistia tropicale,...). Un état d'équilibre dynamique, même en conditions de stabilité hydrologique, ne semble pouvoir être atteint qu'au terme de longues périodes (de 10 à 30 ans et plus en milieu tempéré, cf. Hutchinson 1975). Un tel équilibre s'établit en effet sur la base de processus compétitifs : entre hélophytes ou entre hélophytes et hydrophytes. Dans ce cas-ci, ce sont évidemment les variations du niveau moyen du milieu lacustre qui constituent le facteur directeur de la colonisation. Cette compétition se fonde aussi sur leur capacité relative à se développer sur des substrats anoxiques, selon leur possibilité d'entamer leur cycle végétatif en immersion prolongée, selon leur taux relatif de croissance (tiges et/ou rhizomes, filamenteuses contre hélophytes), ou sur la durée respective de leur phase végétative.
III. Organisation spatiale
Pour un certain nombre des raisons énoncées ci-avant, les macrophytes ne s'étendent qu'exceptionnellement au delà de 10 m de profondeur (jusqu'à 30 m en milieu oligotrophe), à un niveau où Iz est compris entre 0,01 et 0,02 I0 (Hutchinson 1975). À échelle plus réduite, leur implantation est déterminée au premier chef par la topographie locale et l'hétérogénéité des sols. Il en résulte souvent un système de répartition en mosaïque, où peuvent même s'interpénétrer zones d'eau libre, hélophytes et hydrophytes. Les herbiers littoraux peuvent donc constituer des structures très diversifiées, se prêtant à des analyses phytosociologiques (cf. Hejny & Husak 1978).
Il n'en reste pas moins que l'organisation des herbiers littoraux peut aussi s'établir suivant des schémas de zonation stricte (cf. la succession classique caricaie, phragmitaie, jonchaie, typhaie, potamaie,..) où chaque strate peut à la limite, être constituée par une seule espèce ou un seul genre, (figure 1). La salinité des eaux intérieures, enfin, constitue un obstacle à l'extension des macrophytes dulcicoles. Cette barrière n'est pas totalement étanche, lorsque les eaux sont à dominante sulfatée (calcique, sodique ou magnésienne), (Hammer & Hebeltine 1988) ; les Characées étant les moins affectées par ce type de salure des eaux (Comin & Alonso 1978).
IV. Biomasse et productivité
Sous climat tempéré, la biomasse chlorophyllienne des macrophytes en majorité annuels atteint son maximum au cours de l'été ou à la fin de l'été (juillet-août / début septembre). En l'absence de prédation ou de déprédation significatives, leur production annuelle moyenne est estimée à 1,20 fois la biomasse maximale. En milieu tropical (cas des papyrus), le renouvellement de la biomasse est continu et la production annuelle est estimée égale à 3 ou 4 fois la biomasse maximale.
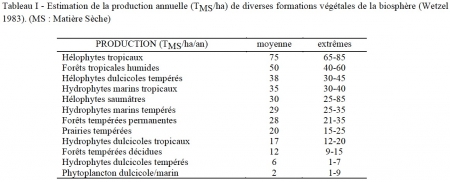
Les macrophytes se signalent en tant que producteurs efficaces (tableau I). Les émergés littoraux, en particulier le genre cosmopolite Phragmites sp., ou Eichornia crassipes (la jacinthe d'eau flottante), figurent parmi les meilleurs producteurs primaires de la planète. Le rendement net de photosynthèse chez des hélophytes de lacs d'Europe centrale par exemple a été estimé varier de 4 à 7%, soit des valeurs similaires à celles obtenues avec des plantes à usage industriel, cultivées intensivement (Dykyjova 1978). A titre indicatif pour le domaine tropical, la biomasse des herbiers à hélophytes du lac Tchad (Phragmites + Typha + Papyrus) a été estimée à environ 70 T/ha, et jusqu'à 180 T pour les seuls Papyrus (Lévêque 1972).
En milieu lacustre tempéré, cette capacité productive décroît dans la série reliant les émergés aux immergés et aux végétaux à feuilles flottantes (tableau II). L'impact des herbiers sur leur propre environnement tend donc à décroître de la zone littorale jusqu'aux niveaux les plus profonds. Les flottants de la zone tempérée sont eux-mêmes capables de réaliser une production importante. C'est le cas de la châtaigne d'eau (Trapa natans) qui produit annuellement de 5 à 7 T/ha en Italie du nord (Guilizzoni & Galanti 1989, Galanti et al. 1990).
Bien que l'eutrophisation d'un milieu puisse favoriser la production végétale jusqu'à provoquer une exubérance extrême des herbiers, cette production n'est pas en correspondance aussi directe et immédiate avec le statut trophique des eaux lacustres (teneur en nutriments) que ne l'est la production phytoplanctonique ou celle des algues filamenteuses.
Dans le lac Stechlin, oligotrophe, les Characées sont ainsi capables de produire en moyenne 5 TMS/ha et localement jusqu'à 10 T/ha ; la production du Potametum lucentis peut atteindre jusqu'à 9,8 T/ha/an. Celle des hélophytes (Typha et Phragmites) peut atteindre ou dépasser 10 T/ha/an (Casper 1980). Une partie importante des macrophytes (hélophytes, Nymphaeacées, Potamots, ...) se signale par la production d'un tissu racinaire volumineux et par la production de rhizomes riches en réserves hydrocarbonées. L'ensemble représente fréquemment plus de 50% de la biomasse maximale, jusqu'à 90% chez Pragmites. C'est chez les végétaux inférieurs les plus profonds (Characées, Isoetes) que le système “racinaire” est le moins développé.
V. Influences sur l'environnement physique
1. Distribution de l'énergie lumineuse
Alors que les macrophytes flottants ou à feuilles flottantes peuvent constituer de véritables écrans empêchant toute pénétration significative de lumière, les herbiers à hélophytes et les immergés vrais interviennent dans la distribution de l'énergie suivant une loi exponentielle répondant à une relation du type:
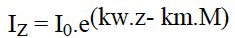
où I0 désigne la quantité d'énergie parvenant au sommet de l'herbier et Iz celle atteignant le niveau z au sein de la formation végétale. Kw et Km représentent les coefficients d'atténuation de la lumière propres à l'eau et à la biomasse. M correspond au stock de biomasse située au dessus du niveau z. Il en résulte que le niveau d'éclairement à la base de denses formations d'hélophytes peut atteindre une valeur proche de la limite pour la photosynthèse (Iz # 0,01.10) ou inférieure à celle-ci (figure 4).
2. Influence sur le microclimat
Cette captation de l'énergie a pour conséquence immédiate un réchauffement diurne du biotope, jusqu'à 4-5°C au printemps, à la base des jeunes pousses d'hélophytes ou à la surface d'herbiers à feuilles flottantes par exemple, avec comme corollaire une accentuation éventuelle des cycles nycthéméraux et de la stratification thermique (jusqu'à 10°C/m dans les herbiers à feuilles flottantes ; Dale & Guillespie 1977). Le réchauffement littoral peut aussi générer des courants de convection orientés perpendiculairement à la rive suffisamment importants pour assurer un transfert d'éléments dissous au-delà de la zone strictement littorale (de 36 cm/min. en surface et de 25 cm/min. au fond et jusqu'à 130 cm/min en période de fortes chaleurs, dans le lac de Constance, Schröder 1975).
Toutefois, les hélophytes à leur plein développement peuvent avoir une action modératrice sur le microclimat littoral en produisant d'importantes quantités de vapeur d'eau par la transpiration et en la retenant au sein de la formation émergée.
3. Évapotranspiration et incidences hydrologiques
Les herbiers ont en effet une capacité évaporative - par évapotranspiration - en général supérieure à celle de l'eau libre. Elle est maximale chez les hélophytes pouvant atteindre en été 6 à 7 fois celle de l'évaporation d'une surface d'eau libre, soit concrètement : de 50 à 100 T d'eau évaporée à l'hectare en période estivale (Rychnovska 1978). Cette capacité se réduit chez les végétaux à feuilles flottantes chez lesquels l'évapotranspiration ne représente qu'environ 2 fois l'évaporation naturelle. Elle peut même lui être inférieure en période de vent. Ce processus d'évapotranspiration, phénomène étroitement associé à la photosynthèse, atteint son maximum au cours de l'été et peut donc jouer un rôle significatif dans le bilan hydrique de milieux peu profonds et faiblement renouvelés.
4. Hydrodynamisme et sédimentation
Les herbiers constituent des amortisseurs efficaces des turbulences littorales (réduction de 36% de la vitesse des courants côtiers dans le lac Wingra par exemple, Weiler 1978). Non seulement ils s'opposent àl'érosion des berges, mais ils constituent des pièges à sédiments efficaces, en retenant les sédiments fins en période de calme et les éléments les plus grossiers (sables) en phase de turbulences. A la limite, dans le cas d'exubérance extrême, ces herbiers s'opposent à la circulation de l'eau entre les zones littorale et pélagique, entretenant ainsi des entités fonctionnelles autonomes, confinées, au centre desquelles la sédimentation est à prédominance organique.
Les macrophytes littoraux génèrent leurs propres sédiments par l'accumulation de feuilles mortes, de tiges lignifiées réfractaires (hélophytes), de racines et/ou de rhizomes, voire de la quasi totalité de la plante dans les conditions de dystrophie maximale (franges littorales tourbeuses).
Ces deux types de processus concourent à l'exhaussement des zones rivulaires à faible pente et des bordures marécageuses en général. L'accumulation de sédiments inorganiques contribue à la formation de sols particuliers, soit acides et humifiés, à C/N très élevé # 40 (le dy) ou alcalins (le gyttja), biologiquement actifs et à C/N < 10.
Les herbiers sont donc des éléments moteurs de l'atterrissement des lacs peu profonds réalisé par une avancée progressive des émergés littoraux au détriment des immergés ; des sols tourbeux (alcalins ou acides) peuvent aussi se superposer au dy ou au gyttja.
VI. Intervention dans les cycles biogéochimiques
1. Impact hydrochimique en relation avec la photosynthèse
La participation des herbiers au bilan d'oxygène des zones littorales s'inscrit dans une alternance d'enrichissement et de consommation la fois journalière et saisonnière : enrichissement diurne et consommation nocturne par le complexe macrophytes-périphyton d'une part, et forte demande en oxygène lors de leurs phases de sénescence (septembre, sous nos climats) et détritique (octobre novembre) d'autre part. Le bilan photosynthèse-respiration peut donc être négatif. Dans le cas de très fortes densités, sous l'effet de l'absorption de la lumière, une anoxie sévère peut être entretenue continuement à la base de la formation végétale. Elle peut même s'accompagner d'un abaissement très important du potentiel redox de l'eau (Eh # -100 mv, papyraies d'Afrique orientale, Beadle 1974) et d'une production intensive de méthane (CH4).
Comme autre conséquence de leur activité photosynthétique, indirecte celle-ci, les macrophytes ont également un impact sur les modalités et les taux de circulation des éléments nutritifs.
L'action la plus facilement décelable est liée à leur capacité d'oxygénation de leur rhizosphère (cf. Sand-Jensen et al. 1982) sur des profondeurs qui peuvent, au moins chez les hélophytes, largement dépasser 20 cm, jusqu'à un mètre et plus dans certaines roselières. Cette propriété “détoxifiante” conditionne leur survie et leur développement sur des sédiments anoxiques. Sachant que le réseau racinaire (filamenteux) peut représenter de 10 à 80% de la biomasse totale, leur capacité d'oxydation des sédiments peut être considérable.
L'élévation du potentiel redox résultante (cf. Carpenter et all. 1983, Jaynes & Carpenter 1986) tend en principe à réduire le taux de transfert de métaux (Fe et Mn) et des nutriments sédimentaires vers l'eau libre. Toutefois, cette oxydation cesse d'être mesurable dans les sédiments anoxiques et dystrophes, à potentiel redox fortement négatif, dont ils peuvent entretenir la dystrophie par la rétention et l'accumulation de matériaux organiques réfractaires.
En outre, à travers leur activité photosynthétique (utilisation du CO2 ou du HCO3-), ils sont capables de modifier les équilibres carbonates-bicarbonates et d'élever suffisamment le pH de l'eau à leur contact pour provoquer la précipitation de carbonates, voire leur coprécipitation avec des phosphates.
2. Stockage et transferts d'éléments
L'évidente intervention des macrophytes dans les cycles géochimiques tient à leur capacité de stockage d'éléments inorganiques et à leur fonction de redistribution de ces éléments, extraits des sédiments et de l'eau. Ils ne sont eux-mêmes que des bioaccumulateurs transitoires, dès lors qu'il s'agit en grande majorité de plantes annuelles, à cycles végétatifs courts, prolongés éventuellement par la production de rhizomes et de racines plus durables (durée de vie estimée de 2 à 4 ans chez Phragmites et Typha , Dykyjova & Kvet 1978). On considère que les macrophytes enracinés réintroduisent dans les circuits métaboliques globaux essentiellement des éléments d'origine sédimentaire (cf. Marshall & Westlake 1978, Wetzel 1990).
Leur intervention exprimée en termes de bilan annuel fait apparaître une perte nette de P et d'N sédimentaires au cours de la phase végétative, renforcée éventuellement par une dénitrification induite par une surcharge organique. Ces nutriments sont pour une part recyclés in situ pendant la phase de sénescence et de dégradation de la matière organique. L'importance des transferts vers la zone pélagique est très mal connue. Il semble toutefois que les herbiers contribuent le plus souvent à l'enrichissement global des eaux lacustres (Carpenter 1980, Carpenter & Lodge 1986) quand ils ne contribuent pas à ralentir le processus d'oligotrophisation de lacs en cours de restauration (cf. Malthus et al. 1990). A l'inverse, les zones d'herbiers se signalent par un gain net de carbone sédimentaire (excrétion racinaire, accumulation passive en anaérobiose). Les pertes par méthanogénèse toujours importantes dans les zones littorales, y compris en milieu oligotrophe (Lac Stechlin, CH4<1 mmol/m2/h, Casper 1980), sont semble-t-il, sans commune mesure avec les gains de carbone par biosynthèse. En conclusion, on peut considérer que les macrophytes activent, ou réactivent, la circulation des nutriments sédimentaires (figure 5). A l'inverse, ils ralentissent celle des éléments dissous dans l'eau, normalement assimilés et recyclés rapidement en eau libre par l'association phytoplancton-bactéries.
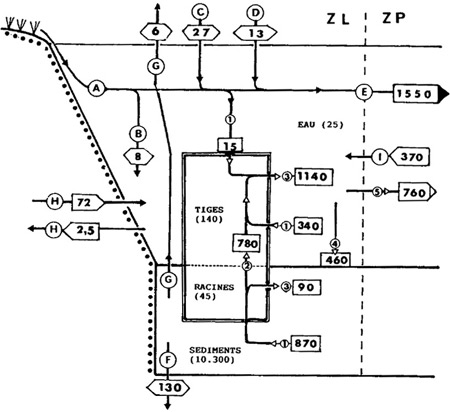
Figure 5 — Bilan du phosphore exprimé en kg/an, dans la zone littorale d'un lac eutrophe fortement renouvelé : le lac Wingra (Wisconsin USA). Importance des macrophytes immergés (Myriophyllum spicatum) dans les transferts entre la zone littorale (ZL) et la zone pélagique (ZP). 1 à 5, processus liés à la présence et/ou à l'activité des macrophytes. 1) assimilation, 2) transferts racines/tiges, 3) M.O. détritique, lyse cellulaire, 4) sédimentation, 5) export de P dissous. A à E, transferts directs en provenance des apports superficiels, B) par diffusion/dispersion. C & D, apports aériens solides (C) et pluviaux (D), E) export dans la zone pélagique, F) transfert en zone 4 sédimentaire profonde (<- 35 cm), C) export par les insectes, H) échanges phréatiques, I) import de P particulé (estimé). (Adams & Prentki 1982, in Naiman & Décamps 1990, modifié).
Bioconcentration des éléments minéraux
Par ailleurs, les macrophytes se signalent par une affinité particulière pour certains métaux. Pour le bore, qu'ils soient enracinés ou non, les facteurs de concentration par rapport à l'eau sont de l'ordre de 100. Il en est de même, par exemple, pour le cuivre où les facteurs de concentration se situent entre 64 et 433 (moyenne 200) et pour le zinc, concentré jusqu'à des rapports de 2000:1 (Hutchinson 1975). C'est sur la base de telles propriétés que les mousses sont utilisées en tant que bioindicateurs de pollutions métalliques (Mouvet 1986). Les macrophytes immergés semblent toutefois être des polyconcentrateurs efficaces, mais non spécifiques. Selon Guilizzoni et al. (1989), les Myriophylles et Cératophylles sont de meilleurs polyconcentrateurs que les mousses du genre Fontinalis et présentent l'avantage, en tant que bioindicateurs de pollutions, d'être plus largement répandus que les mousses.
Conditions de stockage des éléments biogènes
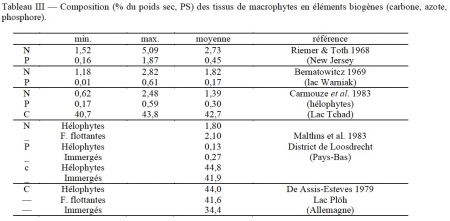
Selon Straskraba (1968), la teneur en eau des macrophytes croît dans la série réunissant les émergés (79%), ceux à feuilles flottantes (82%) et les immergés (88%). Pour Hutchinson (1975), la biomasse sèche représente en moyenne 10% du poids vif. Les teneurs en éIéments biogènes (N, P et C) décroissent depuis le carbone, de l'ordre de 40% du poids sec, à l'azote, de l'ordre de 2% et au phosphore, beaucoup plus variable, de 0,2 à 0,4% en moyenne (tableau III).
On ne saurait se limiter à une vision aussi statique du processus d'immobilisation des nutriments par les macrophytes. Ils sont en mesure d'accumuler de l'azote et du phosphore en excès, bien au-delà de leurs quota de subsistance. Ceux-ci sont respectivement de 0,13% pour le phosphore et de 1,3% pour l'azote (Denny 1980). Il en résulte que leur capacité minimale d'extraction et d'immobilisation (à l'échelle saisonnière) de l'azote et du phosphore s'établit respectivement à 13 et 1,3 kg par tonne produite (MS) et par hectare.
Cette consommation “de luxe” est d'autant plus importante que le milieu est plus eutrophe. Elle s'inscrit dans un gradient spécifique où les Phragmites, riches en tissus de soutien, et les Lemna, lentilles d'eau nitrophiles, représentent les extrêmes. Ces dernières peuvent stocker de l'azote et du phosphore à raison respectivement, de 4 et de 1% de leur biomasse (Rejmankova, in Dykyjova & Kvet 1978).
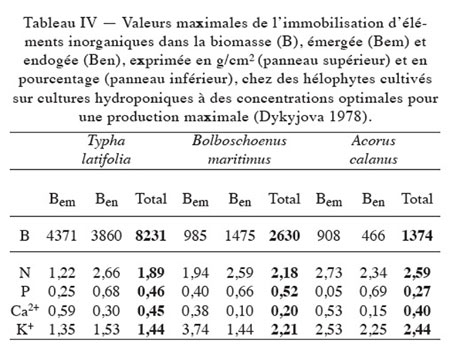
Sur un plan général, les macrophytes montrent une plasticité physiologique spécifique, en relation également avec le niveau de concentration des sédiments, et suivant un mode de répartition inégal entre les parties émergée et endogée (tableau IV).
Cinétique des transferts
Les flux de matière qui empruntent la voie macrophytique s'ordonnent suivant des rythmes de stockage et de déstockage (relargage) en direction tant des compartiments aqueux que sédimentaire.
- Au cours du cycle végétatif (figure 6)
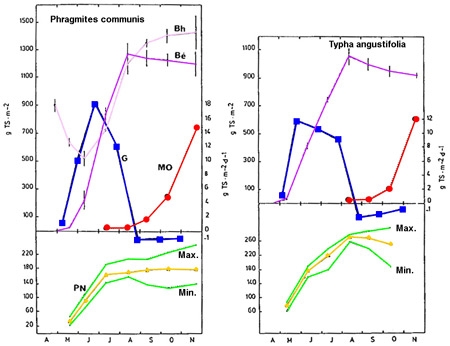
Figure 6 — Dynamique saisonnière de la production végétale chez deux hélophytes : Phragmites communis et Typha angustifolia (Plöhsee, Allemagne). Biomasses épigée (Bé) et hypogée (Bh), en gMS/m2. Stocks de matière organique détritique (MO). Variation journalière du taux de croissance (G), en gMS/m2/j. Variation saisonnière de la production nette globale (PN). (De Assis-Esteves 1978).
Ils sont conditionnés par le rythme même de la production végétale (tempéré versus tropical) et de sa redistribution alternée et successive entre la fraction érigée de la plante (gains printemps-été, pertes automnales), et endogée (pertes printanières et reconstitution estivale de réserves rhizomateuses, développement racinaire printanier).
Par ailleurs, la cinétique de stockage des éléments minéraux présente un décalage par rapport au rythme de croissance de ces macrophytes. L'accumulation tissulaire de nutriments est maximale au printemps et peut être plus rapide que celle de la biomasse. C'est ainsi, par exemple, qu'au cours des 45 premiers jours de leur cycle végétatif, deux hélophytes (Justicia et Typha) réalisent une production égale à 30% de leur biomasse maximum. Dans le même temps, les accroissements relatifs de stocks d'éléments minéraux sont bien supérieurs : de 60, 92, 73 et 56% du stock terminal, respectivement pour l'azote, le phosphore, le potassium et le magnésium (Good et al. 1978).
Enfin, au terme du cycle végétatif, ou en continu dans le cas de végétaux pérennes et tropicaux, ces éléments font l'objet d'un double transfert : d'une part dans les tissus endogés (rhizomes + racines), demeurant incorporés aux sédiments, et dans la partie détritique, d'autre part.
Dans les conditions normales de développement des herbiers (nénuphars et hélophytes, en particulier), cette biomasse endogée tend à s'accroître au fil des années. Son accumulation se trouve accélérée dans les conditions d'eutrophisation et peut même se poursuivre lors d'épisodes d'oligotrophisation des eaux. Il n'en reste pas moins que les herbiers constituent des systèmes largement ouverts même en cours de développement végétatif :
- de 10 à 20% de la production primaire, sous forme d'organes végétatifs morts, rejoignent naturellement les sédiments littoraux,
- de 1 à 10% de la production sont excrétés sous forme de COD, ainsi que 5% environ du phosphore assimilé.
Ces valeurs d'apparence modeste doivent être replacées dans un contexte de production massive de biomasse (cf. ci-avant) sous une faible épaisseur d'eau. Ces apports constituent le support pour une intense activité microphytique à la fois autotrophe et hétérotrophe.
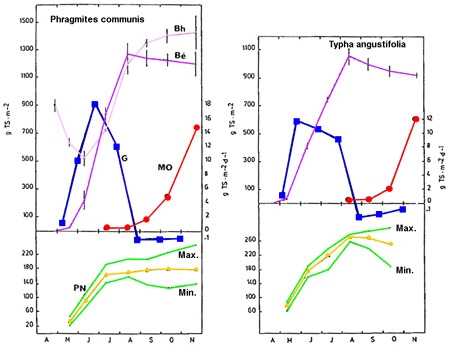
Figure 6 — Dynamique saisonnière de la production végétale chez deux hélophytes : Phragmites communis et Typha angustifolia (Plöhsee, Allemagne). Biomasses épigée (Bé) et hypogée (Bh), en gMS/m2. Stocks de matière organique détritique (MO). Variation journalière du taux de croissance (G), en gMS/m2/j. Variation saisonnière de la production nette globale (PN). (De Assis-Esteves 1978).
Il s'y ajoute la diffusion transracinaire de COD, celui-ci constituant un support utilisable pour une activité selon les cas nitrificatrice (substrats bien drainés) ou dénitrifiante parfois considérable (substrats eutrophes-dystrophes).
- Au cours de la phase détritique
Dès lors qu'ils sont généralement peu consommés à l'état vivant (tempéré), les herbiers participent aux flux de matière, principalement sous forme de matière organique détritique.
Schématiquement, la mise en circulation de matière organique particulaire (MOP) et dissoute (MOD) permet d'étendre la zone où les organismes lacustres peuvent exister et survivre, en particulier en dessous de la zone euphotique des lacs où dominent des communautés détritivores et hétérotrophes. Les herbiers littoraux participent à l'entretien de ce stock assimilable, exploité par étapes successives et itératives (colonisation bactérienne et fungique, fragmentation, filtration, digestion, resuspension des egesta, attaque bactérienne,...) in situ et lors de son transfert vers le domaine pélagique.
Les macrophytes représentent un réservoir assez considérable de MOD (en moyenne de 20 à 40% du poids sec, 30% chez les Nymphaeacées), sous forme d'hydrocarbones, de protéines hydrosolubles et d'acides aminés, libérés en totalité dans le milieu en l'espace de quelques dizaines d'heures après la mort des tissus. Cette libération est la première étape et sans doute la plus importante, d'une éventuelle contribution de la zone littorale aux bilans du carbone et des nutriments des eaux libres, son importance étant fonction du degré de confinement du secteur littoral par rapport au secteur pélagique.
La restitution à l'environnement des éléments biogènes hydrosolubles (nutriments + carbone) lors de la lyse cellulaire, suit une séquence régulière par la libération successive de phosphore, de carbone et pour finir d'azote (essentiellement sous forme de NH4+). La mort des macrophytes tend donc à provoquer la relance successive des productions bactérienne et algale. L'activation de la flore bactérienne est perceptible après seulement quelques jours et prépare d'une manière optimale l'attaque du résiduel particulé. Des poussées algales préautomnales ou automnales peuvent en outre être observées dans les zones littorales, même parmi les détritus, dès le début de la dégénérescence des herbiers. L'étape suivante est représentée par la dispersion du résidu particulé fortement cellulosique, initialement à forte valeur du rapport C/N (>10). Faiblement consommée in situ, cette fraction détritique particulaire peut être exploitée comme dans les eaux courantes à une distance éloignée de son lieu d'origine - en fonction de sa taille - tout en subissant dans son parcours une double érosion : dimensionnelle, jusqu'à la dimension colloïdale, par effets mécaniques du broyage ou sans doute davantage par les turbulences, et biochimique par une simplification progressive de sa structure moléculaire sous l'action des exoenzymes bactériens.
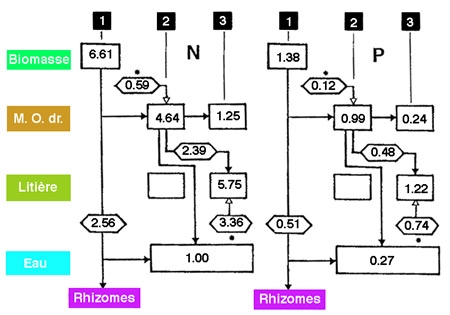
Figure 7 — Évolution temporelle des stocks d'azote et de phosphore d'origine hélophytique (Scirpus fluviatilis), dans la zone littorale du lac Goose (Iowa, (USA). 1 et 2, août et novembre 1974 ; 3, juin 1975. Bilans de circulation entre la biomasse, les rhizomes, les tiges mortes issues de cette biomasse (M.O. dr.), la litière progressivement accumulée et l'eau libre. Données en g/m2. La litière présente un enrichissement significatif en azote et en phosphore au cours du printemps. (Davis & Van Der Walk 1978, modifié).
Au cours de sa transformation, cette MOP connaît assez régulièrement un enrichissement en azote, d'apparence paradoxale (figure 7). Celui-ci peut s'expliquer par deux voies : celle d'une réduction relative de la fraction cellulosique (production d'hydrocarbones hydrosolubles par les cellulolytiques) et celle d'un enrichissement périphérique en microphytes (décomposeurs surtout, et algues au contact des flux de nutriments produits par les cellulolytiques et minéralisateurs). La décomposition de la MOP résiduelle est un processus lent, au cours duquel sont régulièrement réalimentés les compartiments organiques (sous forme de MOD) et nutritifs. Le résidu particulé se décompose à un rythme variable ( t< ou >un an), selon le climat, la nature des tissus, la taille des détritus et leur résistance mécanique (cellulose ou lignine). Les immergés, succulents ou herbacés, sont plus rapidement fragmentés et minéralisés que les hélophytes ligneux. Dans tous les cas, la cinétique de disparition de la matière organique particulaire est fonction des conditions locales. Elle dépend plus précisément des turbulences littorales, de la température et de l'oxygénation de l'eau (la vitesse de dégradation est considérablement plus élevée en aérobiose), du pH de l'eau ou des sols lacustres (zones palustres), et plus particulièrement enfin, en fonction de la concentration en NO3 de l'eau et/ou de la teneur tissulaire initiale en azote.
C'est donc dans les milieux oligotrophes ou dystrophes froids et acides que la minéralisation de la MOP d'origine macrophytique est la plus lente.
En moyenne, le taux de décomposition initial de la MOP d'origine hélophytique est de l'ordre de 1% par jour et décroît exponentiellement au cours du temps (figure 8).
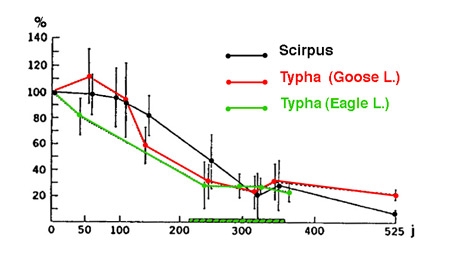
Figure 8 — Décomposition de la matière organique d'origine hélophytique dans deux lacs froids (lacs Goose et Eagle, Iowa, USA). Les 100% correspondent aux stocks au temps T0. La zone hachurée correspond à la repousse des herbiers l'année suivante. (Davis & Van Der Walk 1978).
La fraction organique la plus réfractaire (lignine et tissus humifiés) quant à elle, est décomposée en particulier sous climat froid, à raison de quelques % par an seulement. À la limite (acidification, anoxie et anaérobiose), le blocage de la minéralisation du carbone peut conduire à une accumulation continue de la matière organique par humification.
En définitive, les macrophytes sont beaucoup plus impliqués dans les cycles hétérotrophes et détritiques que ne le sont les algues dont la stratégie est différente: les stocks instantanés de biomasse phytoplanctonique sont toujours faibles et la fraction non consommée rapidement dégradée. Les macrophytes participent à la régulation des flux nutritionnels en fonction de la biomasse produite, le plus immédiatement en direction des bactéries minéralisatrices et secondairement des algues phytobenthiques ou phytoplanctoniques. Les bactéries interviennent à tous les stades de sa transformation, offrant ainsi une ressource aux filtreurs, sous forme d'agrégats homogènes ou associées aux microdétritus filtrables, à des moments où la production du phytoplancton est en déclin (fin d'été) ou n'a pas encore atteint un niveau suffisant (début du printemps). Il demeure que la contribution des herbiers à la charge interne organique et inorganique des zones pélagiques lacustres est liée à leur étendue mais aussi au degré de confinement des zones littorales par rapport aux eaux libres. L'essentiel des transferts vers les eaux libres semble s'effectuer en général sous la forme de MOD (Wetzel 1990). Celle-ci représente dans les eaux douces un stock de réserve organique supérieur de plusieurs ordres de grandeur au compartiment particulé (de l'ordre de 9:1).
Le recyclage in situ des éléments biogènes peut néanmoins être plus importante que les flux de transfert en direction des zones de liaison littoralo-pélagiques. La résultante en est la formation de secteurs littoraux ou marginaux constamment plus eutrophes que des zones voisines plus ouvertes. C'est le cas du lac de Constance (Bodensee) où coexistent des zones eutrophes (45 mg/l de P, en moyenne) densément peuplées et des secteurs mésotrophes (18 mg/l) non colonisés (Schröder 1975). Ce confinement littoral est responsable de perturbations éventuelles dont la plus commune est le développement de fleurs d'eau à filamenteuses. Dans des milieux de faibles dimensions, c'est toute la masse d'eau qui peut présenter un enrichissement significatif(cf. Carpenter 1980). Les lacs de Loosdrecht (Pays-Bas), par exemple, présentent ainsi un enrichissement important en phosphore (concentration multipliée par 5 ou 7 entre l'été et le début de l'automne, en l'absence d'apports par les affluents (Malthus et al. 1990). Les hélophytes littoraux constituent aussi le filtre primaire des imports inorganiques et organiques d'origine terrestre et/ou palustre.
Dans les zones humides sensu stricto où l'accumulation de matériaux organiques particulaires est associée à une libération de matériaux colloïdaux et dissous (polymérisés ou non, à noyau aliphatique et/ou aromatique), ces formes lessivables transitent par la zone littorale des lacs où elles sont utilisées par un compartiment bactérien aérobie important, entretenu par le complexe végétal. Ce compartiment agit à la manière d'un filtre en métabolisant la fraction assimilable ou hydrolysable, sans véritablement modifier le stock d'éléments réfractaires (Wetzel 1991). Cette composante colloïdale et réfractaire, représentée typiquement par les acides humiques, est dotée d'un pouvoir adsorbant et/ou complexant vis-à-vis des nutriments (N et P), du Fe3+ et du Ca2+ , mais aussi des exoenzymes bactériens. Ces colloïdes assurent le transport à distance de ces éléments. Ce transport favoriserait ainsi la libération au sein de l'écosystème lacustre des ions mobilisés et la réactivation à terme des enzymes lors de la dislocation (par photolyse U.V.) des structures colloïdales et aromatiques (polyphénoliques) qui constituent l'édifice humique.
Pour conclure, dans le cadre des cycles biogéochimiques propres au milieu lacustre, la fonction initiale et prédominante des macrophytes est d'activer les transferts entre les sédiments et l'eau. Ils agissent ensuite comme une membrane dialysante au profit de la zone littorale des lacs. En tant que régulateurs des flux nutritionnels (C, N, P), ils se comportent comme des sédiments, au rythme près de la fréquence de restitution des réserves accumulées. Celles-ci se répartissent diversement entre les zones palustres (lorsqu'elles existent) et pélagiques, selon la quantité de matières produites de part et d'autre de la zone de marnage, en fonction de l'hydrodynamisme local, et selon la nature de ces produits et de leur biodégradabilité.
VII. Relations macrophytes-microphytes
1. Le périphyton
La composante algale du périphyton est en général largement dominée par les Diatomées pennées, surtout en période froide, de l'automne au printemps en zone tempérée, suivies, selon le degré de trophie, par une dominance estivale de Chlorophycées et/ou de Péridiniens et éventuellement de Cyanobactéries ou de filamenteuses (voir par exemple la figure 9). Lorsque le périphyton développe des séquences saisonnières de dominance analogues à celles observées chez le phytoplancton, il s'en distingue toutefois, soit par la relative constance de sa biomasse selon Wetzel (1990), ou par sa rythmicité saisonnière particulière induite par les macrophytes (maxima printaniers et automnaux), par son caractère concentré et par l'hétérogénéité de sa distribution spatiale : selon le niveau d'eau, la proximité des sédiments (favorable aux Cyanobactéries), l'exposition aux turbulences et la nature du support.
Figure 9 — Exemple de successions saisonnières au sein du phytoplancton pélagique et du périphyton associé à diverses formations végétales (étang d'Opatovicky, Bohême du Sud). (Marvan et al. 1978).
Le périphyton constitue un sous système composite (éléments planctoniques + benthiques) largement accessible aux invertébrés brouteurs mais aussi aux microconsommateurs, en raison de la présence continue de stocks importants de Diatomées et de bactéries.
2. Symbioses ou antagonismes
Dans le jeu multiple de restructuration des communautés et de réorientation des flux de matière assumé par les herbiers, il est nécessaire d'inclure les algues et bactéries du périphyton qui leur sont étroitement associées : physiquement (effet de surface, implantation dans un film de matière organique amorphe) et physiologiquement (exploitation immédiate des excreta). Il s'agit sans doute d'une symbiose incomplète dès lors que les épiphytes n'exploitent qu'une partie du P excrété par les plantes supports : moins de 10% du P, selon Sculthorpe (1967), Carpenter & Lodge (1986) ; de 60 à 65%, selon Wetzel (1990). Quoi qu'il en soit, le périphyton constitue une membrane semi-perméable s'opposant à la diffusion totale des exsudats dans l'eau libre. Par ailleurs, à travers le processus d'excrétion de carbone organique sous forme dissoute (de 1 à 10% de la production des immergés, Carpenter & Lodge 1986), la production bactérienne se trouve relancée par rapport aux eaux pélagiques. Enfin, selon Sand-Jensen & Borum (1991), une compétition semble pouvoir s'établir entre le périphyton et les macrophytes pour la captation du carbone inorganique dissous dans l'eau, en particulier dans des eaux chargées en Ca2+.
Dans un bilan coûts-bénéfices de cette “symbiose” (cf. Hutchinson 1975), le périphyton assurerait une protection passive des végétaux supports contre les brouteurs (Carpenter & Lodge 1986). Sa plus grande accessibilité aux brouteurs, en raison de sa faible taille, se trouve compensée par une production de biomasse importante : de 4 à 93% de la production des macrophytes hôtes, résultant d'une capacité de renouvellement de sa biomasse (P/B) bien supérieure à celui des macrophytes et comparable à celle du phytoplancton, en raison de la similitude de sa composition en taille. En contrepartie, une croissance excessive d'épiphytes volumineux (Cladophorales filamenteuses, en particulier) en conditions d'eutrophie, peut être inhibitrice du développement des macrophytes (cf. Sand-Jensen & Soongard 1981). C'est seulement dans de telles conditions que le broutage (par des mollusques, des Cyprinidés et des larves d'insectes) assure une protection aux macrophytes.
Il demeure par ailleurs qu'à l'intérieur du réseau relationnel macro-/microphytes, les macrophytes les plus littoraux (hélophytes et à feuilles flottantes), en captant la lumière, inhibent le développement à la fois du phytoplancton et du périphyton. Cette inhibition prend une allure saisonnière en relation avec le développement de l'appareil foliaire (Dykyjova & Kvet 1978). Cette association oscille en fait autour de schémas saisonniers où la cinétique de production semble être contrô1ée le plus souvent par les macrophytes (figure 10).
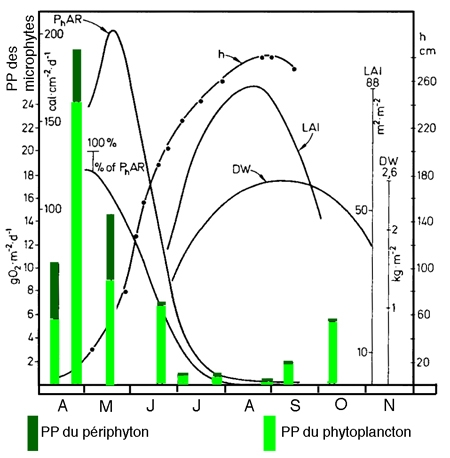
Figure 10 — Relations entre la production nette des tiges de Phragmites (DW, en kgMS/m2) et la production brute (O2, en g/m2/j) du phytoplancton (colonnes vides), du périphyton (colonnes sombres), l'indice de surface foliaire (LAI. en m2/m2) ou la hauteur des macrophytes (h, en cm). Incidence de l'absorption de l'énergie (PhAR) par les macrophytes sur la production algale. (Étang d'Opatavicky, Tchécoslovaquie). (Komarkonta & Marvan 1978).
On observe régulièrement sous climat tempéré des cycles biphasiques avec deux maxima, un maximum printanier et le second automnal, aux limites du cycle de développement des macrophytes (Westlake 1972). Il reste à hiérarchiser les facteurs du déclin estival, à savoir : l'ombrage, la compétition et le broutage. Si le bilan global de production primaire littorale (macrophytes + périphyton + phytoplancton) dépasse en général celui de la production pélagique, il n'y a pas nécessairement compensation quantitative de la réduction de la production phytoplanctonique par celle du périphyton. On peut observer, dans le cas de milieux eutrophes (Komarkova & Komarek 1975), que la somme des productions du périphyton et du phytoplancton littoral peut être inférieure à celle du phytoplancton pélagique. Il en va différemment en milieu mésoeutrophe (lacs de Mazurie, Pologne) où les deux productions sont équilibrées (Pieczynska & Szczepanska 1966).
VIII. Les macrophytes en tant que ressource nutritionnelle
D'une manière similaire aux herbiers marins littoraux, les macrophytes lacustres, globalement, sont relativement peu consommés àl'état vivant. Leur accessibilité et leur valeur nutritionnelle sont inférieures à celle des algues en raison de la forte proportion de cellulose dans leurs tissus, quand ils ne sont pas lignifiés et peu consommables.
Une valeur de consommation moyenne des immergés, de 10 à 20% de la biomasse, est souvent avancée bien que de telles estimations soient difficilement généralisables, tant ils sont exposés à une exploitation intensive par des oiseaux (Anatidés), des mammifères (ragondin, rat musqué), certains poissons (carpe chinoise, Tilapia) ou par quelques invertébrés de grande taille (écrevisses). Les émergés considérés globalement subiraient quant à eux un prélèvement encore plus faible, inférieur à 10% de la biomasse produite annuellement. En fait, les herbiers peuvent être localement très largement utilisés ou même être consommés en totalité (cf. Gaevskaya 1969, Weller 1978, Lodge et al. 1985, Carpenter & Lodge 1986, Lodge & Norman 1987). Par ailleurs, les macrophytes font l'objet d'une consommation diffuse - sans que soit affectée leur vitalité - par de nombreux petits Invertébrés. Gaevskaya (1969), par exemple, a recensé 499 espèces d'invertébrés eurasiatiques dont 78% sont des consommateurs exclusifs de macrophytes littoraux. En définitive, la multiplicité d'actes mécaniques vulnérants que subissent en particulier les hydrophytes ne peut qu'accentuer la libération de MOD dans le milieu. Ce phénomène ne saurait évidemment être appréhendé d'une manière simple et n'a jamais donné lieu à des estimations quantitatives. Ces quelques éléments tendent à montrer que les macrophytes vivants ne sauraient être considérés systématiquement comme un simple appoint nutritionnel aux communautés animales locales.
IX. Les macrophytes en tant qu'habitat. Relations avec les communautés vivantes
Les herbiers littoraux occupent des espaces fluctuant en étendue entre les domaines terrestre et aquatique. Les habitats qu'ils constituent sont de nature composite tant au plan de la structure physique que des ressources.
1. Les macrophytes et la capacité d'accueil des milieux
Les herbiers ont en commun d'accroître considérablement la capacité d'accueil du milieu : leur surface développée peut être considérablement accrue par rapport au seul substrat inerte. L'effet de surface est maximal dans les herbiers immergés : par exemple 4 m2/m2 en moyenne et jusqu'à 46 m2/m2 dans des herbiers mixtes à Potamots et Élodées du lac de Mikolajski (Pieczynska 1976) ou encore 24 m2/m2 dans les herbiers immergés du lac Lawrence (Burkholder & Wetzel 1990). On retiendra de ce fait que la contribution du périphyton microphytique à la productivité des milieux n'est pas reliable directement au taux de recouvrement des herbiers ni même à leur biomasse. Dans le lac Lawrence par exemple, où les herbiers n'occupent que 12% de la surface totale, les algues épiphytes contribuent pour 80-85% à la productivité primaire totale (Wetzel 1990).
2. Organisation des communautés d'Invertébrés
Le complexe macrophytes-périphyton héberge et entretient une mosaïque de faunes ou de communautés de Protozoaires, de microinvertébrés et de macroinvertébrés, sessiles ou mobiles et libres, inféodées parfois à des associations macrophytiques particulières, voire à une seule espèce.
La microfaune sessile
Sous ce terme, sont rassemblés des organismes reliés à leur support par un pédoncule ou encore adhérant simplement au substrat et disposant ainsi d'une certaine autonomie de déplacement. Cette microfaune, constitutive du périphyton, réunit des protozoaires (Péritriches, Suctoria), des Gastrotriches, des Turbellariés Rhabdocoeles et des Rotifères.
Epiphyte dans son ensemble, cette faunule peut néanmoins coloniser des substrats inertes, tandis que quelques espèces sont hautement sélectives, comme le Rotifère Ptygura beauchampi strictement inféodé aux Myriophyllum, (Wallace 1978).
Les communautés héléoplanctoniques
Outre ces éléments épiphytes, les herbiers hébergent et entretiennent une microfaune libre pouvant se différencier entre les hélophytes et les hydrophytes, parfois typique des divers éléments de la zonation ou des mosaïques. Coexistent ainsi parmi les microcrustacés, des planctoniques vrais, filtreurs typiques (Daphniidés et Bosminidés), et une microfaune d'affinités benthiques (Cladocères Sididés et Chydoridés, Ostracodes, Cyclopoïdes benthiques et Harpacticides), de comportement racleur-filtreur, se nourrissant du micropériphyton phytobactérien, ou même détritivore.
À cet ensemble composite ou héléoplancton, sont mêlés des Rotifères spécifiquement littoraux et des pélagiques, des protozoaires ciliés et des microturbellariés microphages et prédateurs.
Si la richesse spécifique globale de l'héléoplancton est sensiblement équivalente ou supérieure à celle du zooplancton, sa diversité spécifique est variable selon les milieux, selon la présence ou l'absence de poissons planctonophages et selon la saison. Son abaissement correspond à un renforcement de la structure de dominance au sein du peuplement, illustré éventuellement (figure 11) par la réussite d'espèces d'origine pélagique (g. Bosmina et Ceriodaphnia, entre autres), (Pieczynska 1976, Lehtovaara & Sarvala 1984).
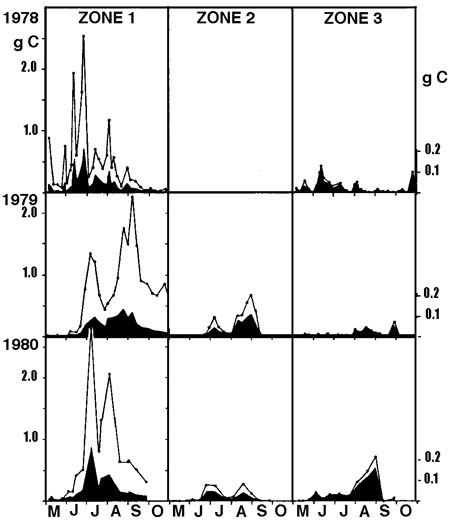
Figure 11 — Répartition des biomasses zooplanctoniques dans un gradient décroissant (de la zone 1 à la zone 3) de la densité d'un hélophyte (Equisetum fluviatile), dans la zone littorale du lac Päajärvi (Finlande). Variations interannuelles des biomasses (1978-1980), exprimées en gC/m2 (courbe supérieure) et en gC/m3 (graphe inférieur, noir). Bosmina domine en 1978 et 1980, Ceriodaphnia en 1979. Le cycle bimodal de 1979 est dû à un effet de dilution par les eaux pélagiques, à la suite d'une crue estivale exceptionnelle. La faible représentation du zooplancton pélagique (zone 3) est attribuée à la prédation par les poissons. (Lehrovaara & Sarvala 1984).
Par ailleurs, l'héléoplancton occupe le milieu suivant un mode fortement agrégatif (nuages, mosaïques), indépendant éventuellement de la composition des herbiers (figure 12). Il est sujet à de larges fluctuations de biomasse, d'abondance numérique et de composition, associées à la phénologie des herbiers et à l'augmentation progressive de leur confinement au cours du cycle végétatif.
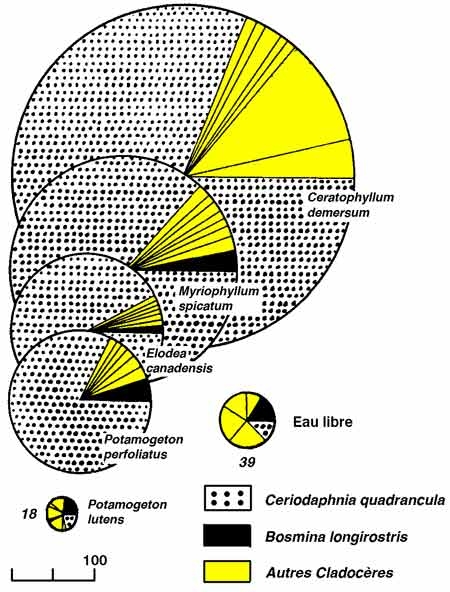
Figure 12 — Structure et densité des peuplements de Cladocères (n ind./l). en relation avec la composition des herbiers du lac Mikolajskie, en août 1971. (Gliwicz & Rybak 1976).
Les herbiers à Characées abritent des communautés particulières, sans que l'on sache véritablement si l'organisation de ces communautés procède de la structure architectonique de l'herbier, de la nature du périphyton ou qu'elles résultent d'une action répulsive spécifique, largement démontrée en laboratoire (émission d'alkyl-sulfures), Une action discriminante similaire vis-à-vis d'éléments planctoniques (microcrustacés, larves de Culicides,...) ou même périphytiques, est attribuée également à l'algue filamenteuse Cladophora glomerata, aux Elodées, aux Myriophylles et Cératophylles émettrices de substances phénoliques répulsives.
Les communautés macrobenthiques
Les herbiers littoraux modérément denses abritent et entretiennent une riche faune de macroinvertébrés relativement bien connue dans sa composition (cf. Tachet et al. 1980), moins bien connue toutefois quant à son organisation et sa dynamique. L'enrichissement numérique et en biomasse par rapport aux espaces littoraux découverts semble toutefois être la règle (cf. Soszka 1975), (figure 13). Cette faune réunit un ensemble d'espèces couvrant un large spectre trophique : soit des algivores ou plus rarement des macrophytophages, des brouteurs-racleurs de périphyton et/ou détritiphages, accompagnés de leurs prédateurs également invertébrés.
Figure 13 — Comparaison de la structure et de la densité du zoobenthos, dans des stations colonisées (A) ou non (B), par des hydrophytes de la zone littorale du lac Mikolajskie. (Wiktonak 1974. In Pieczynska 1976).
On n'observe pas en général, de relation stable entre la composition du macrozoobenthos mobile et celle des herbiers, qu'ils soient mono- ou plurispécifiques. Ce sont seulement les Gastéropodes qui présentent une ségrégation nette et permanente entre les zones à hélophytes et à hydrophytes (Lodge 1986). C'est aussi le cas des Chrysomélides (Coléoptères) adultes et larves, des chenilles de Pyralidés (Lépidoptères) ou certains Chironomides (Diptères) associés assez strictement à des hélophytes.
Les herbiers littoraux constituent aussi parfois un support privilégié pour des macroépiphytes grégaires (Dreissena, Lamellibranche fixé, figure 14), ou coloniaux : Bryozoaires, Éponges et Hydraires. Lorsqu'ils sont pris en compte, ce sont les Nématodes qui constituent la part numériquement la plus importante de leur faune associée. Ils sont suivis par les Chironomes et Oligochètes (Naïdidés périphytiques & Tubificidés fouisseurs), puis par d'autres insectes à larves aquatiques (Diptères autres que les Chironomes, Ephémères, Trichoptères, Mégaloptères, Odonates,...) ou complètement aquatiques, à capacité variable de migration par la voie aérienne (Hémiptères et Coléoptères). Habitat spécifique des écrevisses (d'avril à octobre), les herbiers peuvent localement héberger des Asellidés détritiphages (Isopodes) et plus rarement des Gammaridés (Amphipodes). Alors que les Dreissènes peuvent envahir les herbiers littoraux (cf. Stanczykowska & Lewandowski 1993), les autres Lamellibranches filtreurs sont faiblement représentés (Sphéridés de petite taille). La faune malacologique peut être représentée par un nombre significatif d'espèces de Gastéropodes et constituer des biomasses importantes. Ils entretiennent eux-mêmes une faune d'Hirudinées prédateurs en quantité parfois significative. Les zones littorales sont aussi le site privilégié de concentration des Hydracariens partiellement ectoparasites (larves).
Figure 14 — Importance de la colonisation des macrophytes littoraux (V) par le Lamellibranche fixé Dreissena polymorpha, dans 24 lacs polonais du District de Mazurie. (Recomposé d'après les données de Lewandowski 1982, In : Stanczykowska & Lewandowski 1993).
Il est simple d'opposer cette diversité des faunes littorales au zoobenthos profond constitué d'une manière uniforme d'organismes fouisseurs : Chironomes, Tubificidés (Oligochètes), et Nématodes accompagnés parfois de Lamellibranches filtreurs. On relève toutefois qu'en milieu tropical (Beadle 1974), où les macrophytes sont plus largement consommés, la faune des formations denses (papyraies, par exemple), s'appauvrit considérablement par rapport à des stations plus ouvertes ou moins denses. Ce type de milieu est sélectif au point d'en limiter la pénétration à quelques invertébrés capables de respirer à la surface (des mollusques, Chironomes et Culicidés), ou de développer un métabolisme anaérobie (l'Oligochète Alma emini), ainsi qu'aux seuls poissons à respiration aérienne (Protoptères et Clarias).
Au plan général, ce zoobenthos littoral est exploité en parts variables par les poissons, souvent sur la base de migrations nocturnes (tempéré) et par des consommateurs terrestres (oiseaux), in situ et en milieu aérien lors des émergences (insectes). La position du macrozoobenthos sur les divers substrats et/ou leur mobilité les rendent plus accessibles aux poissons (Cyprinidés) que le zoobenthos fouisseur des zones profondes.
Les communautés de Vertébrés
Les zones marécageuses et les herbiers littoraux constituent aussi un habitat permanent ou transitoire pour des Vertébrés terrestres (nombreux oiseaux, micromammifères, reptiles), amphibiontes (batraciens) ou aquatiques (poissons). Ces vertébrés peuvent d'ailleurs se remplacer au cours des cycles hydrologiques (avancée des poissons en période de hautes eaux et des Vertébrés terrestres lors des basses eaux).
Rares sont les poissons tempérés qui soient strictement inféodés au stade adulte à l'habitat macrophytique, en dehors de la phase de reproduction des éléments phytophiles. Par ailleurs, la multiplicité des ressources disponibles favorise les Cyprinidés omnivores. Ces herbiers enfin, offrent des conditions optimales pour la réussite des éclosions, la maturation des alevins et leur protection contre les prédateurs ichthyophages.
Les herbiers constituent ainsi un habitat spécifique dont la capacité d'accueil, les stocks, la diversité et la richesse spécifiques sont le plus souvent supérieures aux zones littorales restées minérales (Pieczynska 1990). Ils sont en outre responsables d'une diversification de fonctions (“niches”) assumée à la fois par des animaux terrestres et aquatiques, que ceux-ci soient inféodés strictement au milieu ou en stationnement obligé dans ce type d'habitat. Ces deux entités (communautés) largement interdépendantes s'interpénètrent à l'intérieur de ces franges écotonales. Elles participent éminemment à une redistribution des ressources de part et d'autre de l'interface.
X. Discussion
Les herbiers à macrophytes occupant la périphérie des milieux lacustres, constituent des ensembles parfaitement identifiables et assimilables sans ambiguïté à des écotones. Au sein de l'interface terrestre/aquatique, ces macrophytes constituent le “lieu géométrique” des sous-systèmes particuliers qui en assurent la pérennité : réserve hydrique/atmosphère, sédiments/eau, nutriments/microphytes, périphyton/héléoplancton, périphyton/brouteurs, zooplancton/alevins, détritus/consommateurs, détritus/décomposeurs. Leur discontinuité structurelle et fonctionnelle par rapport aux écosystèmes adjacents est aussi une marque d'identification d'un véritable écotone (cf: Shugart 1991).
Les herbiers intègrent la variabilité d'une zone de balancement entre deux systèmes de nature totalement différente, porteurs de contraintes éminemment contrastées ou dissymétriques. Ainsi, la contrainte hydrique conditionne à elle seule la mise en place, la dynamique spatio-temporelle et la pérennité de ce type de formation. La contrainte terrestre (géomorphologique) semble avoir un impact limité à son organisation interne. Ces contraintes s'équilibrent lorsqu'il s'agit d'en délimiter l'étendue. Enfin, la contrainte terrestre redevient prédominante lorsqu'elle conduit à une surcharge eutrophisante des habitats lacustre et périlacustre.
Historiquement, le jeu de ces contraintes s'est avéré très sélectif. La richesse spécifique des macrophytes aquatiques est en effet considérablement plus faible que celle de leurs homologues strictement terrestres. Par ailleurs, les formations à forte résilience - envahissantes ou non - sont constituées pour une part très importante d'éléments (genres ou espèces) à tendance cosmopolite ou couvrant des espaces géographiques ou climatiques transcontinentaux.
Sur quelles bases peut s'établir la stabilité de tels écotones ? La plus importante nous paraît être le renouvellement des ressources qu'elles concourrent elles-mêmes à mobiliser, plutôt que tout autre mécanisme interne spécifique à ce type de formation.
Le renouvellement et/ou l'autorenouvellement de leurs ressources (hydriques, édaphiques, nutritionnelles) en conditions optimales d'éclairement situent en effet les macrophytes littoraux (hélophytes) parmi les producteurs les plus efficaces de la biosphère (tableau I).
Il n'en reste pas moins que ces assemblages hautement spécialisés et paucispécifiques (Hutchinson 1975) sont fragiles. Leur déclin, au moins en Europe (De Nie 1987), dans un contexte généralisé d'eutrophisation, de manipulation des flux hydriques dans leur bassin versant (drainage), voire le tourisme, concourrent à une déqualification des paysages périlacustres et à un déficit global en matière de diversité et de productivité biologiques.
Ces écotones paraissent théoriquement les plus aptes à fournir des réponses dynamiques de type “hystéresis” (Shugart 1990), en réponse à des fluctuations hydrologiques progressives et réversibles (Weller 1978). Par contre, ils produisent des réponses de type chaotique sous les impacts déstabilisants totalement exogènes comme l'eutrophisation, l'acidification ou encore la prédation. Enfin à l'échelle historique, ils présentent la particularité de développer une stratégie à double effet, apparemment contradictoire, concrétisée par le processus d'atterrissement. L'exhaussement par accumulation de matériaux, y compris végétaux, correspond à une “stratégie” d'échappement à la contrainte hydrique. Concrètement, elle conduit pourtant à une avancée sur le domaine proprement aquatique.
Dans le cas du passage au marais et à l'atterrissement, ce sont les processus internes à l'écotone fondateur qui constituent la base “stratégique” conduisant à une formation nouvelle, climacique éventuellement, et dotée d'un mode de fonctionnement autonome entretenu par son propre confinement. Ce qui précède correspond à une vision d'échelle relativement restreinte, sans doute schématique et faiblement représentative de l'immense variabilité des situations concrètes où le confinement hydrologique en relation avec la géomorphologie, la nature du bassin versant et son climat, présentent une infinité de combinaisons, dont la résultante la plus commune en termes d'écologie du paysage est la formation de zones humides (sensu lato) qui elles ne sont pas forcément adjacentes à des systèmes lacustres constitués et permanents. Leur degré de connectivité avec le milieu pélagique est aussi une donnée significative pour le fonctionnement du milieu récepteur.
La conduite séparée ou asynchrone des études sur les deux types d'écosystèmes, palustre et littoral, contribue à entretenir un certain nombre d'incertitudes. Il demeure qu'une meilleure coordination des recherches ne saurait à elle seule assurer une pleine compréhension des processus écologiques, de leur nature et de leur intensité, qui régissent les interrelations entre zones humides, franges littorales colonisées et écosystèmes lacustres proprement dits. Ceci tient surtout au nombre considérable et à la diversité des milieux concernés ainsi qu'à leur distribution sur de vastes étendues. Les grands lacs, comparables à des “mers intérieures” et pratiquement dépourvus de macrophytes sont en nombre très limité et répartis inégalement entre les deux hémisphères. A l'opposé, les milieux lacustres colonisés par les macrophytes sont représentés par des millions de cas et distribués essentiellement dans l'hémisphère nord, suivant un gradient sud-nord de profondeur décroissante.
Une ultime approche du problème, à une échelle appropriée (mondiale), consiste comme l'a fait Wetzel (1989) à évaluer d'une manière indirecte le nombre d'écosytèmes lacustres soumis à l'influence de leur environnement immédiat (littoral) et/ou de leurs annexes palustricoles (figure 15). De fait, cette distinction entre environnements proche et éloigné établie par Wetzel (op. cit.), sur des rapports d'étendue entre les différentes composantes, palustre, littorale et pélagique, révèle àl'évidence que le compartiment macrophytique est un constituant à part entière des écosystèmes lacustres continentaux. La limnologie, telle qu'elle s'est constituée - autour des grands lacs - ne semble pas avoir pleinement rendu compte de la complexité du fonctionnement de ces “écocomplexes” que sont, à quelques exceptions près, les systèmes aquatiques continentaux. Sur un plan général, l'appréciation du rôle des macrophytes dans les écosystèmes est positive et basée d'abord sur leur fonction régulatrice et diversificatrice des systèmes écologiques.
Le point d'équilibre entre le développement de l'écosystème et la survie de nombreux organismes passe dans de très nombreux cas par la dynamique des macrophytes (cf. Carpenter 1981 et 1988). Leur disparition (hypereutrophie) ou la simplification des communautés (cas de l'acidification des eaux) entraînent inévitablement une réduction du potentiel productif des milieux concernés et une réduction de la diversité écologique locale ou régionale. Par ailleurs, ils peuvent présenter un intérêt économique. La présence et le développement contrôlé des herbiers littoraux sont souhaités pour la pisciculture en étang. Les herbiers à macrophytes constituent aussi un moyen naturel d'épuration des eaux superficielles, à travers la pratique du lagunage ou enfin, un instrument de dénitrification des eaux phréatiques. Localement (zones tropicales), ils peuvent constituer une ressource économique directe et importante (Little 1979).
De tels avantages s'annulent dans tous les cas d'exubérance incontrôlable de végétaux flottants et/ou immergés. L'envahissement de toute la zone intertropicale par la jacinthe d'eau ou les Salvinia en est l'illustration la plus significative. Des immergés, Cératophylles, Myriophylles, Elodées, et les algues filamenteuses peuvent aussi donner lieu à des développements massifs sous climat tempéré, en relation éventuellement avec l'eutrophisation générale des eaux.
Au plan de l'utilisation des milieux, un développement massif des Phanérogames s'oppose à la navigation et à la pratique de la pêche, voire à une production pisciaire optimale (cf. Gopal 1986).
Leur effondrement relativement concentré dans le temps (tempéré), leur exubérance même, peuvent entraîner des déficits en oxygène importants. La floraison massive de végétaux flottants entretient ou accentue la dystrophie du milieu, responsable secondairement de la mort de poissons ou de la disparition des autres hydrophytes enracinés.
Figure 15 — Distribution numérique des lacs du monde en fonction de l'importance relative de leur surface en eau libre (P) par rapport à celle des zones littorales (L) et/ou périphériques constituées en zones humides (W). L'incidence des zones littorale et périphérique sur le fonctionnement global des lacs s'accroît inversement aux valeurs de P/L ou de P/W + L. (Wetzel 1990).
Au plan sanitaire, le développement incontrôlable des herbiers tropicaux (cf. la jacinthe d'eau), se traduit par une relance de maladies parasitaires transmises par des invertébrés phytophiles ou inféodés aux zones calmes (bilharziose, malaria et filarioses, encéphalites...).
Une politique de gestion écologique de ce compartiment, associant contrôle et/ou restauration s'avère très délicate dès lors que les causes de perturbation les affectant sont le plus souvent diffuses, parfois très éloignées de leurs sites d'implantation et dans tous les cas faiblement réversibles, voire irréversibles.
XI. Conclusion
L'importance des macrophytes dans les milieux ou espaces littoraux peu profonds résulte de leur forte capacité de production de biomasse, créant ainsi des formations capables d'intervenir dans l'évolution géomorphologique des stations ou milieux qu'ils occupent. Ils restituent à leur environnement d'une manière rythmique les nutriments (C, N, P), qu'ils extraient activement des sédiments ou de l'eau et sont susceptibles de ce fait d'accélérer l'eutrophisation ou la dystrophisation de leur milieu.
Ce sont des acteurs intervenant selon leur rythme propre de biosynthèse dans les cycles biogéochimiques, souvent plus importants que le phytoplancton, dans les espaces qu'ils occupent.
Ils constituent également un support actif pour le développement du périphyton algal, une ressource d'habitat surtout, et de nourriture pour des communautés composites (terrestres + aquatiques) particulières.
Facteurs de diversification des paysages, ils constituent aussi des écotones particuliers dont la dynamique et/ou la résilience sont sans équivalent.
Soumis à des manipulations d'origine humaine, ces formations manifestent néanmoins leur très grande fragilité.
15:26 Publié dans Environnement-Écologie, Limnologie-hydrobiologie | Tags : limnologie, macrophytes lacustres, écosystèmes lacustres, fonctionnement | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
19/02/2013
La zone littorale lacustre
 La zone littorale lacustre
La zone littorale lacustre
La zone littorale des lacs se caractérise par sa faible profondeur. Elle s'étend plus ou moins, selon la pente, la transparence et la couleur des eaux et l'exposition aux vents (donc aux vagues et aux courants de dérive). ROUND (1956) limite la zone littorale à la région située de chaque côté du niveau moyen de l'eau, donc directement affectée par l'eau et la terre contiguë. C'est donc la zone d'interpénétration des milieux aquatique et terrestre.
Verticalement, elle s'apparente étroitement avec la partie supérieure de la zone trophogène. La limite inférieure est souvent confondue avec la zone de compensation (profondeur critique où photosynthèse et respiration s'équilibrent). Elle est notablement plus profonde que la profondeur limite de visibilité surtout dans les zones peu profondes ou turbides. Ainsi les communautés seront à dominance végétale, et l'extension de ces communautés sera liée à l'existence de substrats fermes favorisant l'enracinement et à la pénétration de la lumière favorisant la photosynthèse.
A. ASSOCIATIONS DE LA ZONE LITTORALE
I. Communautés benthiques de surface
Se développant en surface, on distingue :
1. le rhizomenon
constitué de plantes aquatiques fixées :
algues macroscopiques : Nitelle, Chara, mousses : fontinales (Fontinalis), sphaignes (Sphagnum), hypnes (Hygrohypnum), plantes vasculaires : Potamots.
2. le biotecton ou couverture biologique ou Aufwuchs ou bioderme
Il s'agit de la pellicule de microorganismes qui recouvre le substrat plus ou moins solide et notamment les pierres, les détritus minéraux et organiques.
D'après Margalef (1955), le biotecton se décompose en :
- un pecton : feutrage superficiel fait de Cyanobactéries et faune associée ;
- un plocon : couverture d'algues filamenteuses.
- Une forme particulière de biotecton est constituée par le périphyton, ensemble des organismes vivant sur les plantes aquatiques supérieures de la ceinture végétale.
On distingue aussi dans la flore benthique :
- une flore épipélique vivant sur les sédiments mous ;
- une flore épilithique vivant sur le substrat rocheux ;
- une flore épiphytique vivant sur les végétaux supérieurs (partie végétale du périphyton).
L'ensemble des algues libres vivant entre les plantes supérieures est le métaphyton de BEHRE (1956) ou le pseudopériphyton de Sladeckova (1960).
II. Communautés endobenthiques
La faune interstitielle ou faune phréatobie (Motas & Tanasachi, 1946) est la fraction animale qui colonise les interstices des sédiments grossiers au niveau des rivages lacustres.
L'ensemble des organismes vivant à l'intérieur du substrat plus fin constitue l'endobenthon qui se subdivise en :
- psammon : ensemble des organismes vivant dans le sable.
- pélon : ensemble des organismes vivant dans le sédiment fin et fluide (vases).
La formation la plus caractéristique de la zone littorale est la ceinture végétale.
B. LA CEINTURE VÉGÉTALE
I. TYPES BIOLOGIQUES DE VÉGÉTAUX CONSTITUANT LA CEINTURE VÉGÉTALE
Les végétaux se développant dans l'eau ou sur un sol engorgé d'eau sont appelées plantes hygrophiles ou hygrophytes. Cependant, on appelle végétaux aquatiques les plantes se développant en présence d'un plan d'eau.
Nota : Chaque lien renvoie à la description de la plante citée.
On distingue :
- les végétaux aquatiques sensu stricto qui ne se développent qu'en présence d'un plan d'eau permanent ;
- les végétaux semi-aquatiques dont l'appareil souterrain (racines, rhizomes ou rhizoïdes) est submergé et l'appareil aérien émergé ;
- les végétaux amphibies (Roripa amphibia, Polygonum amphibium), plantes semi-aquatiques qui peuvent se maintenir après assèchement du plan d'eau : Callitriches, Renoncules aquatiques, Lentilles d'eau.
Un caractère commun à toutes ces plantes est leur exigence en eau, facteur qui fournit le milieu ambiant chez les aquatiques ou qui assure les importants besoins en eau chez les semi-aquatiques.
Les écologues, à la suite de Raunkier (1950) et de Sell (1965) classent les végétaux aquatiques selon le degré d'immersion.
- les amphiphytes sont les plantes du sommet des rives des cours d'eau, des sous-bois humides, des fossés, des marécages et des zones humides. Ex : Linaigrette, Caltha palustris, Salicaire, Carex formant les touradons dans les tourbières, Molinia coerulea, Petasites officinalis, Tussilago farfara, Scirpus sylvaticus, Juncus effusus, Prêles, Saules, Aulnes, etc..
- les hélophytes (He) : pied dans l'eau et tête au soleil. Deux strates à distinguer :
* strate haute : Typhacées, Roseaux, Joncs, Grande Glycérie, Acore calame, Baldingère, Butomus umbellatus, Iris pseudacorus, Sagittaria sagittifolia, Sparganium...
* strate basse : Cresson, Véronique, Myosotis, Trèfle d'eau, Menthe...
- les hydrophytes (Hy) avec trois catégories :
* fixés et submergés en permanence, formant des prairies au fond de l'eau : Naias, Chara, Faux Aloes, Isoetes, Fontinalis, Lobelia, Vallisneria, Elodea, Hottonia palustris...
* fixés mais à feuilles flottantes d'un seul type (Nymphéacées, Nuphar et Nymphaea, Alisma natans, Aponogeton, Hydrocharis, Potamogeton natans) ou affleurantes à deux types de feuilles, les unes submergées, modifiées, découpées en segments laciniés, les autres flottantes, élargies, à surface vernissée non mouillable (Potamogeton gramineus, P. fluitans, Myriophylles, Cératophylles, Polygonum amphibium, Ranunculus aquatilis, Hippurus…)
* non fixés et à feuilles flottantes : Lemnacées, Rixia fluitans (Hépatiques), Eichornia crassipes (Jacinthe d'eau) Châtaigne d'eau, Ulothrix (Algues), Utriculaires, Azolla (Fougères)...
De nombreux hélophytes dressés au-dessus du plan d'eau en fin de développement, présentent d'abord une phase hydrophytique plus ou moins longue (Alisma plantago, Equisetum limosum, Scirpus lacustris, Sparganium, Typha).
II. ZONATION VÉGÉTALE
Lorsque la pente est douce, la zonation montre un développement maximal. Si l'on va du rivage vers la zone profonde, on rencontre successivement :
1. Étage littoral
La végétation terrestre cherche à coloniser la plage exondée. C'est une végétation palustre constituée par les amphiphytes décrits plus haut : saussaie, aulnaie, cariçaie. On note une dominance de monocotylédones (Iris, Carex, Poacées) mêlées à quelques dicotylédones arborescentes (Aulne, Saule) et herbacées (Caltha, Polygonum).
2. Étage sublittoral
Dans cette zone toujours submergée, on rencontre successivement :
- la phragmitaie ou phragmiretum, zone des roseaux (Phragmites, Arundo) et la typhaie (Typha) avec des ptéridophytes comme des prêles (Equisetum) ;
- la scirpaie ou scirpetum, zone des joncs, jonc des chaisiers, (Scirpus, Juncus) avec rubaniers, (Sparganium), renoncules aquatiques (Ranunculus), plantains d'eau (Alisma) ;
- la potamaie, zone des potamots (Potamogeton) avec cornifles (Ceratophyllum), volants d'eau (Myriophyllum), Élodée (Elodea), châtaigne d'eau (Trapa), renouée aquatique (Polygonum) ;
- la nupharaie ou nupharetum, zone des nénuphars (Nuphar et Nymphea) avec quelques potamots ;
- la charaie ou characetum située au pied du mont où Chara, Nitella, Fontinalis, Littorella ou Isoetes tapissent en prairie le fond de l'eau.
III. FACTEURS DE RÉPARTITION
Le développement de ces zones dépend de nombreux facteurs : pente, exposition, qualité de l'eau, nature du substrat.
1. Pente
Si la pente est abrupte, la zone des Hélophytes peut manquer.
Si la rive est plate, on peut éventuellement rencontrer une zone tourbeuse à Erica et Molinia, avec sphaignes et touradons de Carex dominés par la saussaie (Saules et bouleaux).
2. Nature du substrat et qualité de l'eau
La nature du substrat influence la richesse minérale de l'eau, l'implantation des systèmes racinaires et rhizomateux des végétaux et par là sur la richesse floristique et sur la masse de végétation.
2.1. Sur les substrats siliceux, sableux, graveleux (argiles à silex) et rocheux, les eaux sont faiblement minéralisées, pauvres en azote et en phosphore : la végétation est clairsemée, le plancton peu abondant. De ce fait, la consommation d'oxygène et l'accumulation de CO2 sont réduites et favorisent l'insolubilisation du fer, laissant les eaux claires et oligotrophes. Le pH est de 5 à 6,5. Le maintien de l'état oligotrophe suppose que l'eau d'alimentation reste peu minéralisée (cas de lacs de plateau). Mais l'évolution vers l'eutrophie est le plus souvent la règle, compte tenu de l'environnement. Les espèces rhizomateuses littorales sont désavantagées par suite de la compacité du substrat.
2.2. Sur les substrats marneux et en cas d'alimentation d'eau minéralisée, les eaux sont riches en calcaire, en azote et en phosphore. Le pH est de l'ordre de 6,5 à 8. Le plancton et les macrophytes sont prospères. Il en résulte un appauvrissement globale en oxygène et un enrichissement en CO2 qui laissent le fer à l'état de carbonate ferreux assombrissant la teinte de l'eau. Les végétations littorales sont très dynamiques et contribuent au remplissage progressif des lacs eutrophes.
2.3. En cas de pollution agricole, ou de développement de tourbières à Sphaignes ou à Hypnacées, il y a enrichissement de l'eau en matière organique en suspension et brunification de l'eau : c'est la dystrophie.
2.4. Les eaux saumâtres renferment des espèces particulières (Ruppia, Zannichellia). Mais certaines espèces d'eau douce sont euryhalines : Scirpe maritime, roseau).
IV. ÉVOLUTION DE LA CEINTURE VÉGÉTALE
Le dynamisme de certaines espèces colonisatrices fait déplacer vers le large les différents anneaux de végétation littorale au fur et à mesure du remplissage périphérique. C'est le cas des Carex à touradons, des Scirpes lacustres, des Roseaux, des Massettes, des Rubaniers dont les rhizomes entrelacés puis superposés forment un plancher qui s'élève d'année en année. L'homme par faucardage et le rat musqué lutte contre cet envahissement végétal. Les zones de végétation littorale peuvent être envahies par des plantes flottantes telles que des hépatiques (Riccia), des monocotylédones (Lemna, Eichornia, Pistia). Plantes flottantes et plantes à rhizomes peuvent ainsi former des radeaux qui se forment par décollement du fond et sur lesquels s'intallent d'autres végétaux, formant des îles flottantes (lac Tchad).
V. RÔLE DE LA VÉGÉTATION AQUATIQUE
L'examen de la végétation aquatique, phanérogames, mousses ou algues permet d'apprécier les qualités physico-chimiques de l'eau.
- En eau peu minéralisée et acide on trouvera la Châtaigne d'eau Trapa natans et la Desmidrée.
- En eau riche en matière organique, on rencontrera la lentille d'eau (Lemna minor) et des Cyanobactéries ;
- En eau bien minéralisée et alcaline, de nombreuses espèces.
L'absence de végétation aquatique suggère un déséquilibre du milieu : il peut s'agir d'un déséquilibre naturel, ou d'une pollution toxique ou par des M.E.S. qui suppriment la transparence de l'eau.
En d'autres termes, la nature de la végétation constitue un indicateur de faciès.
On trouvera sur ce même blog la description de quelques macrophytes liés à la végétation des zones humides.
1. Rôle physico-chimique
1.1. Producteurs primaires de matière organique
Grâce à la photosynthèse, les végétaux sont des producteurs primaires.
1.2. Producteurs d'oxygène
Ce phénomène de photosynthèse libère de l'oxygène qui reste dissous dans l'eau et dont la teneur dépend de la température. À 5°C, le taux de saturation est de 12,8 mg/l et à 20°C, il tombe à 9,2 mg/l. Dans les herbiers, on assiste à une sursaturation 150 % à la fin d'une journée d'été.
L'oxygène fourni par les plantes est utilisé par la faune et notamment par les poissons. Ceux-ci ont des besoins respiratoires différents. Par exemple, une truite a besoin de 8 mg/l d'oxygène alors qu'une carpe résiste à des teneurs de 2-3 mg/l.
Un équilibre doit s'instaurer entre producteurs d'oxygène et consommateurs. Pendant la nuit, les plantes sont improductives et sont consommatrices d'oxygène du fait de leur respiration. Si la masse végétale est trop importante, il y a surconsommation d'oxygène et au matin l'oxygène risque l'épuisement jusqu'à un seuil critique pour les poissons.
1.3. Autoépuration
Les plantes sont les meilleurs agents de l'épuration de l'eau
- par leur production d'oxygène qu'elles fournissent aux processus d'oxydation
- par l'utilisation de sels dissous qu'elles éliminent.
Cette autoépuration permet la récupération des rivières après réception d'un effluent polluant. C'est le principe du lagunage pour l'oxydation des eaux usées riches en azote.
1.4. Destruction de molécules toxiques (phénols)
1.5. Stockage de métaux lourds (Empain et Descy)
2. Rôle biologique
2.1. Rôle trophique
Les algues planctoniques ou benthiques et les plantes servent de nourriture à tous les alevins et à quelques poissons adultes (Hotu, Gardon, Brême, Carpe, Tilapia, cyprinidés asiatiques) mais surtout à une foule d'invertébrés benthiques (mollusques, crustacés, larves d'insectes) et planctoniques, consommateurs primaires essentiels dans la chaîne alimentaire des poissons.
2.2. Support de ponte
Les feuilles flottantes de nénuphar, renouée, potamot ou leurs longs pétioles servent de supports de ponte aux mollusques et insectes.
2.3. Abris
Les herbiers servent souvent d'abri aux poissons où ils se trouvent protégés du soleil, du courant et des prédateurs. Dans un peuplement pisciaire comportant des voraces, la survie des alevins et des espèces fourrages est assurée par la présence d'herbiers.
2.4. Aires de reproduction
De nombreuses espèces de poissons (brochet, perche, tanche, gardon, rotengle, sandre, brème, carpe) fraient dans les zones de végétation : c'est le cas des mousses, élodées, cératophylles, renoncules, potamots, racines de châtaignes d'eau. Les oeufs adhérents restent fixés sur les tiges et les feuilles. Les alevins vivent ensuite plusieurs jours protégés par la végétation dans laquelle ils trouvent leur première nourriture sous forme de bactéries ou d'algues.
2.5. La végétation permet la nidification des oiseaux et l'édification des fourreaux de Trichoptères
3. Rôle mécanique
Les berges sont consolidées par les appareils souterrains de certaines espèces : joncs, roseaux, iris, Carex et résistent ainsi à l'action des vagues et des courants. Réciproquement, dans les zones calmes, la végétation aquatique est responsable de la retenue, de la fixation et de la consolidation des alluvions ou sédiments (massettes, rubaniers, scirpes, roseaux). Dans le processus de colmatage des étangs et des noues, des espèces comme le trèfle d'eau ou le Carex paniculata jouent un rôle de pionniers.
4. Rôle éducatif et esthétique
VI. NUISANCES
La présence de plantes ne doit pas provoquer un déséquilibre dans le milieu ou une gêne dans l'exploitation de l'eau.
1. Nuisances dans les étangs
1.1. Modifications du plan d'eau
Le comblement progressif des plans d'eau est accéléré par le développement d'une végétation semi-aquatique à racines traçantes (Scirpes et joncs) ou à rhizomes (Phragmites, Typha et Iris) qui progresse des berges vers la pleine eau.
1.2. Modifications climatiques
Le surdéveloppement de la végétation limite l'ensoleillement et l'échauffement de l'eau. Il faut réduire dans ces conditions le développement des plantes arbustives des berges et surtout des plantes à feuilles flottantes (Nuphar, Nympheae, Trapa, Hydrocharis, Nymphoides, Polygonum amphibium, Alisma, Potamogeton natans) et enrayer le développement des lentilles d'eau (Lemna) et des algues filamenteuses flottant en surface (Cladophora, Spirogyra).
1.3. Modifications physico-chimiques
Par absorption foliaire, les macrophytes absorbent les sels minéraux dissous dans l'eau.
Si l'on admet que le phytoplancton est la production primaire indispensable à la vie aquatique, il faut limiter le développement des macrophytes si l'on fait un aménagement piscicole. Avant de fertiliser un étang, il faut s'assurer de pouvoir contrôler la végétation.
1.4. Modifications biologiques
Les macrophytes surabondants limitent la circulation des poissons et par conséquent, l'accès à la nourriture. Les alevins nés dans une zone de frayère restreinte restent groupés et souffrent de sous-alimentation qui entraine un taux de croissance faible et une mortalité accrue. Au niveau des prédateurs, on note le développement du cannibalisme. Elodea, Ceratophyllum, Potamogeton densus et lucens sont des plantes dont la densité de développement est extraordinaire.
1.5. Modifications esthétiques
Les feutrages d'algues gonflés de bulles flottant à la surface des eaux, les plaques de cyanobactéries (Oscillatoria, Phormidium) apparaissant sur le fond et remontant en surface provoquent des troubles esthétiques sur les plans d'eau.
1.6. Difficultés d'exploitation
Dans les étangs vidés pour la pêche d'automne, la végétation surabondante provoque une gêne.
L'accès aux étangs où se pratique la pêche à la ligne devient difficile si les zones de pêche sont impraticables. La pratique des loisirs nautiques est incompatible avec une trop grande densité de végétation.
2. Entrave à la circulation de l'eau
La végétation devient nocive à son environnement quand elle constitue une entrave à la libre circulation de l'eau que ce soit dans des eaux de drainage, d'irrigation, ou simplement transportées. Les plantes arrachées par le courant viennent s'entasser contre les grilles et filtres des ouvrages des régulateurs et des stations le long des rivières, les algues viennent obturer les arroseurs et les canalisations...
VII. MOYENS DE LUTTE
1. Lutte mécanique
Faucardage des macrophytes, curage des vases, reprofilage des étangs pas assez profonds.
2. Lutte biologique
Il s'agit de rompre l'équilibre biologique en favorisant une espèce ou en introduisant une espèce nouvelle dans un habitat, provoquant ainsi un phénomène nouveau de compétition. Le problème de toute lutte biologique est de rester maître du processus. C'est pourquoi le contrôle biologique de la végétation doit être prudent.
2.1. Organismes inférieurs
En étang, l'apport massif d'engrais provoque la prolifération de phytoplancton qui crée une importante turbidité de l'eau qui diminue les possibilités de photosynthèse des phanérogames immergés dont la croissance est entravée.
2.2. Mammifères
Les végétations rivulaires et émergées sont paturées par les bovins (roseaux), les chevaux (Glyceria) et les porcs (Lemna). Eviter les moutons à cause du danger de distomatose.
Le ragondin (Myocastor) est un excellent agent de faucardage d'hélophytes et d'hydrophytes. En outre, son élevage apporte une plus-value intéressante par la valeur de sa peau. Le Rat musqué, qui joue le même rôle, a la fâcheuse habitude de creuser des galeries et de faire effondrer les berges et les digues.
2.3. Oiseaux
Oies et canards consomment les feuilles et les graines des plantes aquatiques, empêchent la prolifération des lentilles d'eau et des algues. Leur efficacité est limitée surtout si leur nombre est faible et si la végétation de la berge reste à leur disposition.
2.4. Poissons
Tous les alevins mangent du plancton, des algues et du périphyton pendant quelques jours. En France, seules quelques espèces (Hotu, Soffie, Chevesne, Gardon, Muge) restent en partie herbivores. Brème, Tanche, Carpe et surtout cyprinidés asiatiques (Carpes chinoises ou Amours) peuvent intervenir sur le développement de la végétation.
3. Lutte chimique
On utilise également des herbicides de synthèse, mais on a tendance à privilégier de plus en plus les procédés mécaniques et biologiques.
Pour en savoir plus :
Consulter les différents articles de ce blog concernant la végétation rivulaire.
Consulter également le guide téléchargeable : Guide des végétaux du sud-ouest
09:27 Publié dans Limnologie-hydrobiologie | Tags : limnologie, ceinture végétale, zonation littorale, macrophytes lacustres | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Callitriche des étangs
Le Callitriche des étangs
Le Callitriche des étangs ou Étoile d'eau [Callitriche stagnalis SCOP] appartient à la famille des Callitrichacées.
La plante se présente comme un semis d'étoiles. Les Callitriches sont des hydrophytes fixés et dont le feuillage présente un aspect artistique.
Le classement systématique des Callitriches et la recherche de liens de parenté avec d'autres plantes sont très difficiles. L'ordre des Callitrichales est formé d'une seule famille les Callitrichacées qui ne comportent que le seul genre Callitriche. Ces plantes, nées sous le signe de l'unicité, ont des fleurs unisexuées et les fleurs mâles sont réduites à une seule étamine.
Ce sont des plantes très variables, petites et fragiles, qui ont des formes aquatiques, immergées ou flottantes, et des formes terrestres, qui vivent, éphémères, sur la boue humide.
Le Callitriche des étangs (C. stagnalis) pousse le plus souvent dans les eaux peu profondes, dormantes ou à faible courant ; plus rarement sur un sol humide. En Europe, on le trouve surtout dans l'ouest et le centre ; C. palustris L. est plus abondant ; il est considéré comme un élément arctico-alpin qui pousse même en Scandinavie et en Islande. En Angleterre, on ne le connaît que dans une seule station. Il supporte bien le froid et verdoie parfois sous la glace.

Les Callitriches sont des plantes vivaces quand elles poussent dans l'eau, annuelles quand elles poussent sur terre, fines, vert vif, à feuilles étroitement linéaires, groupées en étoiles au sommet de la plante, particulièrement remarquables quand on les voit de haut (1).
Les fleurs unisexuées sont très réduites ; les fleurs mâles n'ont qu'une seule étamine, les fleurs femelles un seul pistil à 2 styles et 4 ovules. Les pièces florales se réduisent à 2 écailles. Les fruits de C. stagnalis (2) sont entourés par des ailes et les styles, s'ils se maintiennent, sont retombants. Les fruits de C. palustris (3) ont des ailes peu développées à leur partie supérieure et les styles disparaissent rapidement.
Les fleurs s'épanouissent l'une après l'autre du mois d'avril au mois d'octobre.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
09:14 Publié dans Botanique, Limnologie-hydrobiologie | Tags : callitriche, étoile d'eau, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Les Lentilles d'eau
Les Lentilles d'eau
Les Lentilles d'eau appartiennent à la famille des Lemnacées. Ce sont de petites plantes aquatiques flottant à la surface dont les organes sont très réduits. Leur corps est représenté par un organe foliaire considéré soit comme une seule vraie feuille plus ou moins transformée, soit comme une tige plate en forme de feuille. Dans le genre Spirodela, on peut dire que la grande feuille plate est une tige car elle possède en dessous deux vraies feuilles en écailles. Les Lentilles d'eau fleurissent très rarement, mais se multiplient végétativement de façon très intense. Dans la "feuille" maternelle se trouve un creux qui contient la gemmule : elle donne une nouvelle "feuille" qui s'émancipe chez la plupart des Lentilles d'eau mais reste attachée chez certaines autres (Lemna trisuica).
Les Lentilles d'eau sont des plantes cosmopolites transportées facilement et à de grandes distances, par exemple sur les pattes et dans les plumes des oiseaux aquatiques. Elles poussent dans toutes les eaux calmes, souvent en très grand nombre. La représentation des différentes espèces dans leurs associations peut varier considérablement au cours d'une même période de végétation : c'est ainsi que dans un étang, entre le mois de mai et le mois de juillet, on a constaté une extension continue de Spirodela polyrhiza (L) SCHL. suivie de son déclin. Lemna trisulca évolua de manière inverse, tandis que Lemna minor déclina continûment depuis son maximum printanier.

La Petite Lentille d'eau (Lemna minor L.) a des feuilles (articles) plates aux deux faces vertes, flottant à la surface, et une seule racine (1).
La Lenticule bossue (Lemna gibba L) a des feuilles gonflées (2).
La Lenticule à trois lobes (Lemna trisuica L ) a des feuilles ovoïdes, lancéolées, comme enfoncées dans l'eau, à longs pétioles et attachées ensemble (3) pendant plusieurs "générations".
La Spirodèle à racines nombreuses [Spirodela polyrhiza (L) SCHL] a des feuilles ovoïdes arrondies à l'envers rougeâtre et portant chacune un petit faisceau de racines filamenteuses (4).
Les fleurs des Lentilles d'eau, quand elles fleurissent, sont réduites à une seule étamine ou un seul pistil.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
09:07 Publié dans Botanique, Limnologie-hydrobiologie | Tags : lentilles d'eau, lemnacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Les Renoncules d'eau
La Renoncule flottante
La Renoncule flottante [Ranunculus fluitans Lam., 1779] appartient à la famille des Renonculacées.
Les surfaces aquatiques où fleurissent des Renoncules d'eau ont l'air d'être couvertes d'une sorte d'écume blanchâtre. Et l'impression produite par la masse fleurie des Renoncules est renforcée du fait qu'elles ne sont pas seules dans les eaux calmes.
La Renoncule flottante (Ranunculus fluitans) habite les cours d'eau au plus fort du courant Dans les zones calmes où elles sont enracinées, elles forment des amas épais entraînés par les eaux où s'abritent souvent les brochets et les anguilles.
La Renoncule aquatique [Ranunculus aquatilis (L.) DUM.] plante importante, pratiquement cosmopolite, préfère les eaux dormantes, les mares et les bras morts des cours d'eau, à 50 cm de profondeur environ. Sur les fonds asséchés, et sur les rives, elle produit une forme terrestre aux feuilles entières.
Les Renoncules d'eau sont souvent classées dans le genre Ranunculus. De récentes études sur l'anatomie, la morphologie et la biologie florales de ces plantes montrent qu'elles forment un groupe séparé, indépendant. Les Renoncules d'eau sont des plantes vivaces dépendant presque entièrement du milieu aquatique. Les feuilles submergées des plantes flottantes sont souvent divisées en filaments.

Les plantes et les filaments foliaires de Ranunculus fluitans (1) flottent avec le courant ; les feuilles de Ranunculus aquatilis sont doubles : feuilles immergées en filaments et feuilles flottantes ou émergées dont le limbe est plat (2).
Les fleurs sont à 5 divisions (3) ; mais il y a parfois jusqu'à 7 pétales. Les Renoncules qui fleurissent en juin ont des fleurs beaucoup plus grandes que celles qui refleurissent en août et septembre.
Les fleurs fécondées donnent une tête (4) composée d'akènes bien séparés (5) qui flottent à la surface.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
09:02 Publié dans Botanique, Limnologie-hydrobiologie | Tags : renoncule aquatique, renoncule flottante, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
La Renouée amphibie
La Renouée amphibie
La Renouée amphibie [Polygonum amphibium L.] est une plante de la famille des Polygonacées.
C'est une plante réellement amphibie. Elle peut passer toute sa vie dans l'eau, sous sa forme flottante, ou bien sur la terre ferme sous sa forme terrestre. Ces formes diffèrent au premier regard par leur aspect et un profane peut les prendre pour deux espèces indépendantes. Comme beaucoup de plantes dépendant de l'eau, elles poussent circumpolairement dans toute la zone tempérée, en Europe, en Asie et en Amérique du Nord, mais aussi en Inde, au Mexique, etc.
La Renouée amphibie est une plante fréquente et utile des eaux dormantes ou à faible courant. Elle préfère des eaux peu profondes à fond sableux ou vaseux, les étangs de profondeur moyenne. Elle s'échappe des roselières des rives jusqu'aux eaux libres et profondes, mais sans excès. La Renouée offre de bons abris pour le frai des poissons. À l'époque où l'on asséchait les étangs une fois par an, la Renouée était une des plantes aquatiques qui supportait le mieux cette période de sécheresse, subsistant alors sur les fonds sous sa forme terrestre.
Le nom du genre Polygonum dérive du grec poly (beaucoup) et gonia (nœud) : les tiges de la Renouée ont en effet de nombreux nœuds apparents.

La Renouée amphibie (1) forme de longues feuilles flottantes et des tiges assez ramifiées ayant souvent plus d'un mètre de long. Les feuilles supérieures flottent à la surface et meurent au cours de l'année. Les feuilles sont groupées en faux épis toujours émergés ; les fleurs sont rose vif.
La forme terrestre (2) a des tiges dressées d'environ 50 cm aux entre-nœuds raccourcis (2 à 7 cm au lieu de 20 cm dans la forme flottante), aux feuilles sortant d'une ochréa à longs poils. Cette forme terrestre fleurit rarement ; les faux épis sont courts, les fleurs roses.
Les Renouées fleurissent en juin et juillet et refleurissent parfois plus tard.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
08:57 Publié dans Botanique, Limnologie-hydrobiologie | Tags : renouée amphibie, polygonium amphibium, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
15/02/2013
Le Myriophylle en épi
Le Myriophylle en épi
Le Myriophylle en épi [Myriophyllum spiccitum L.] fait partie de la famille des Halorragidacées. C'est une plante hydrophyte à feuilles submergées.
La comparaison des Myriophylles avec les Cératophylles montre bien comment un même milieu peut influencer l'évolution et l'aspect de plantes assez éloignées dans la classification.
Les Halorragidacées sont des plantes aquatiques ou de marécage qui poussent depuis les tropiques jusqu'aux zones tempérées, en particulier dans l'hémisphère sud et sur le littoral de l'Australie. Le genre Myriophyllum rassemble environ quarante espèces : les espèces australiennes sont habituellement amphibies, les espèces américaines sont plutôt aquatiques.
L'appellation scientifique composée des mots grecs myrios = très nombreux, innombrable et phyllon = feuille rappelle l'aspect du Myriophylle.
Le Myriophylle en épi est cosmopolite dans les eaux de l'Europe, de l'Amérique du Nord et du nord de l'Afrique; on ne le trouve ni en Amérique du Sud ni en Australie. Ses belles tiges ornementales peuvent avoir jusqu'à 2 mètres de long et sont garnies de feuilles de près de 2,5 cm. Il pousse disséminé dans les eaux dormantes ou à faible courant, seul ou en petits peuplements.
À la différence de nombreuses autres plantes aquatiques, qui forment dans le courant de longues feuilles flottantes, les Myriophylles ne produisent dans les eaux courantes que de courtes tiges de 30 à 50 cm au maximum.
Le Myriophylle en épi supporte les eaux profondes et pures des lacs mais aussi les eaux calcaires. Par contre, M. alterniflorum DC. qui est plus abondant dans l'ouest de l'Europe et l'est de l'Amérique du Nord, exige une eau propre et fraîche, non calcaire et riche en oxygène, un fond caillouteux et un mètre de profondeur au maximum.

Les Myriophylles sont des plantes aquatiques vivaces aux rhizomes rampants. Les feuilles sont disposées en verticilles par 5 chez M. verticillatum L, par 4 chez M. spicatum et M. altemiflorum; elles sont penniséquées, formées de 6 à 20 divisions filamenteuses sur chaque moitié de feuille (1).
Les tiges du Myriophylle en épi sont rougeâtres, ce qui donne aux plantes flottant dans les eaux un aspect exotique, irréel.
Les fleurs s'épanouissent en épis terminaux émergés. Elles sont hermaphrodites [ou bien femelles à la base (2) et mâles au sommet (3)], petites, rougeâtres ou rosés. Le fruit se divise en quatre parties (4). La plante fleurit en juillet et août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
16:26 Publié dans Botanique, Limnologie-hydrobiologie | Tags : myriophylle en épi, myriophyllum spiccitum, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Cératophylle immergé
Le Cératophylle immergé
Le Cératophylle immergé [Ceratophyllum demersum L.] fait partie de la famille des Cératophyllacées. C'est une plante hydrophyte à feuilles submergées.
Le petit Cératophylle immergé, aux feuilles en filaments, ne rappelle pas le Nénuphar. Il est pourtant classé dans l'ordre des Nymphéales.
Les tissus des Cératophylles sont très simplifiés : un seul vaisseau, rigide, au centre de la tige, entouré de liber, représente son système vasculaire. La structure des feuilles est également différente : celles-ci, divisées en fourche, sont disposées en verticilles sur les tiges.
La famille des Cératophyllacées est représentée par le seul genre Ceratophyllum dont les trois espèces poussent dans les régions méridionales de la Russie, l'une en Extrême-Orient, les deux autres étant pratiquement cosmopolites. En Europe, le Cératophylle pousse depuis près de 70 millions d'années, depuis le milieu du Tertiaire.
Le Cératophylle immergé pousse dans les eaux dormantes ou à faible courant, dans les mares, les bras morts, mais aussi dans les étangs et, plus particulièrement, en plaine. Il peut pousser en eau profonde où les conditions d'éclairement lui conviennent (lumière diffuse) ; il forme parfois des peuplements denses et continus qui gênent la pêche au filet. Ni lui, ni C. submersum L. ne prospèrent en aquarium où ils périssent au bout d'une saison.
C. submersum est une espèce thermophile voisine qui supporte les eaux saumâtres où il remplace C. demersum. Les Cératophylles sont des plantes aquatiques vivaces qui ne peuvent vivre en dehors de l'eau. Les racines sont atrophiées ou même absentes, remplacées éventuellement par de courts "rhizoïdes".

Les feuilles se divisent en filaments disposés en fourches [1 —2 x chez C. demersum (1) et 3 x chez C. submersum (2)]. Sur les tiges, qui peuvent avoir 1 à 2 mètres de long et qui sont ramifiées, les feuilles sont disposées en verticilles. C. demersum fleurit rarement ; les fleurs isolées, sessiles à l'aisselle des feuilles sont unisexuées. Les fleurs mâles ont 10 à 20 étamines et un périanthe à 12 divisions ; il y a environ 10 divisions dans les fleurs femelles et un seul ovaire qui donne une petite noisette à 3 arêtes (3).
La floraison, quand elle se produit, a lieu de juin à septembre.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
16:22 Publié dans Botanique, Limnologie-hydrobiologie | Tags : cératophylle immergé, ceratophyllum demersum, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L'Élodée du Canada
L'Élodée du Canada
L'Élodée du Canada [Elodea canadensisMICHX.] fait partie de la famille des Hydrocharitacées. C'est une plante hydrophyte à feuilles submergées.
L'Élodée a reçu, dans plusieurs langues, le nom injurieux de "peste d'eau". Les premières plantes sont arrivées en Europe, venant d'Amérique du Nord, vers 1840. Dix ans après, les jardins botaniques d'Europe échangeaient ces plantes intéressantes. Mais il ne leur fallut pas un si long temps pour envahir toutes les eaux qu'elles pouvaient rencontrer. Bien qu'on n'eût fait traverser l'océan qu'à des fleurs femelles incapables de produire fruits et graines, cette peste aquatique se répandit rapidement. Tout fragment de tige voguant sur l'eau donnait rapidement des pousses nouvelles de plusieurs mètres de long, étroitement enchevêtrées. Elle devenait un fléau pour les pêcheurs et la navigation fluviale.
L'Élodée pousse à toutes les profondeurs. À l'état frais, c'est un excellent fourrage vert dont la valeur alimentaire vaut celle du Trèfle. On la cultive en aquarium avec l'espèce voisine Elodea densa PLANCH. qui provient de l'Amérique du Sud subtropicale ; en passant par l'Amérique du Nord, elle a été introduite sur les autres continents. On a constaté, en Allemagne, sa présence dans certains canaux.

E. canadensis est une plante vivace, immergée, à tiges articulées, très ramifiées, portant de nombreuses feuilles. Les feuilles poussent en verticilles, généralement par trois (1) ; elles sont sessiles et légèrement dentées. La plante femelle introduite en Europe (la population européenne actuelle est vraisemblablement un clone) fleurit rarement et ses petites fleurs sont pratiquement invisibles de la rive.
E. densa a de grandes fleurs femelles (2) d'un blanc lumineux et les feuilles sont groupées par cinq dans des verticilles.
Les Elodées fleurissent rarement, de mai à août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
16:19 Publié dans Botanique, Limnologie-hydrobiologie | Tags : élodée, elodea canadensis, hydrocharitacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Faux Aloès
Le Faux Aloès
Le Faux Aloès [Stratiotes aloides L.] fait partie de la famille des Hydrocharitacées. C'est une plante hydrophyte à feuilles submergées.
Dans beaucoup de langues, cette plante porte le nom d'Aloès aquatique (cf. l'allemand : Wasseraloë, le français Faux Aloès). Le nom scientifique de l'espèce, aloides, évoque lui aussi la ressemblance des feuilles et de toute la rosette avec celles de quelques plantes du genre Aloe.
Il s'agit pourtant d'une plante aquatique dont la rosette de feuilles s'ouvre tout près de la surface de l'eau. Dans les eaux profondes, on trouve parfois des rosettes submergées, aux feuilles plus fines et bien enracinées dans le fond. Normalement, les rosettes semi-immergées, flottent et les longues racines massives ne se fixent que parfois dans l'eau.
Le Faux Aloès pousse dans les eaux dormantes ou à faible courant, dans les mares, les bras morts, formant parfois des peuplements très étendus et impénétrables ; il concourt ainsi au comblement des pièces d'eau et des canaux. Il s'agit néanmoins de plantes assez rares dont le domaine est l'Europe centrale et l'ouest de la Sibérie ; on les trouve isolément dans le nord et le nord-ouest de l'Europe.

Le Faux Aloès est une plante vivace, du court rhizome de laquelle s'élève une rosette de nombreuses feuilles rigides, triangulaires en coupe (1) dont le bord est denté et piquant. Cette particularité expliquerait le nom de la plante, car le mot grec stratiotes signifie soldat, homme armé.
Les très belles fleurs blanches sont unisexuées : les fleurs mâles ont de longs pédoncules, de nombreuses étamines dont une douzaine ont des iinihères. Les fleurs femelles sont plus petites, à courts pédoncules et 6 stigmates. Le fruit est une capsule coriace, munie de piquants. La multiplication est surtout végétative : à l'extrémité de longs rejets rampants de la partie inférieure du pied-mère, naissent de nouvelles rosettes de feuilles.
Le Faux Aloès fleurit à partir de juin, souvent plusieurs fois jusqu'au début de septembre.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
16:17 Publié dans Botanique, Limnologie-hydrobiologie | Tags : faux aloès, stratiotes aloides, hydrocharitacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L'Hippurus vulgaire
L'Hippurus vulgaire
L'Hippurus vulgaire [Hippuris vulgaris L.] fait parite de la famille des Hippuridacées. C'est une plante hydrophyte à feuilles submergées.
Hippuris est le seul genre de l'unique famille (Hippuridacées) de l'ordre des Hippuridales et les relations avec les autres groupes d'angiospermes sont assez confuses. En tout cas, il n'y a aucun rapport avec les Prêles même si les Hippurus leur ressemblent beaucoup. Il semble qu'il s'agisse d'une ancienne branche d'évolution, développée dès le Secondaire, c'est-à-dire il y a environ 140 millions d'années. On a trouvé leurs restes au Quaternaire, dans les sédiments des périodes interglaciaires. Plusieurs espèces du genre Hippuris poussent aujourd'hui dans l'hémisphère nord et en Amérique du Sud, et, parmi elles, H. vulgaris.
Les Hippurus poussent dans les eaux dormantes ou sur les rives le long de cours d'eau, dans la boue et forment des peuplements continus d'aspect assez exotique. Quand elles parviennent à se fixer dans un courant plus rapide, elles adoptent la forme flottante (en ruban), constamment immergée.
Les Hippurus supportent bien les basses températures : on les trouve même dans les régions arctiques et antarctiques.
L'Hippurus vulgaire est un habitant caractéristique des lacs septentrionaux, sur les bords pauvres en végétation desquels il pousse avec un petit nombre d'autres espèces, comme par exemple Potentilla palustris (L.) SCOP.
L'Hippurus vulgaire est une plante aquatique et des marécages, vivace, à long rhizome rampant et tiges dressées, d'environ 40 cm de haut. Les tiges, dans les eaux à fort courant, peuvent atteindre un mètre.
La tige est articulée et les feuilles disposées en verticilles.

À l'aisselle des feuilles supérieures qui émergent de l'eau, se forment des fleurs réduites. Elles sont unisexuées et formées soit d'une étamine unique soit d'un seul pistil. Les enveloppes florales sont atrophiées. La disposition des fleurs et la forme des verticilles des feuilles est plus facile à voir sur une coupe transversale de la tige à l'endroit de l'insertion des feuilles (1). Le fruit est une petite drupe sèche.
L'Hippurus fleurit de mai à août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
16:13 Publié dans Botanique, Limnologie-hydrobiologie | Tags : hippurus vulgaire, hippuridacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L'Hottonie des marais
L'Hottonie des marais
L'Hottonie des marais [Hottonia palustris L.] fait partie de la famille des Primulacées.
C'est une plante hydrophyte à feuilles submergées. Les Hottonies sont sans doute les seules représentantes de la famille des Primulacées dont les feuilles soient découpées en filaments. Cette particularité provient du milieu aquatique dans lequel elles vivent. Nous avons déjà rencontré de nombreux exemples de cette adaptation des feuilles au milieu aquatique. Ces plantes doivent leur nom à P. Hotton, professeur de botanique à Leyde.
Hottonia palustris pousse dispersée dans les mares et dans les eaux peu profondes des étangs ainsi que dans les bras morts des rivières. Elle pousse aussi assez souvent dans les sous-bois des aulnaies périodiquement inondées. À l'époque des basses eaux, elle peut y affecter des formes terrestres : la plante possède alors une tige considérablement raccourcie et des feuilles pennées, agglomérées, formant comme une rosette radicale. Elles sont très décoratives vues d'en haut.
L'Hottonie se multiplie souvent végétativement par des "boutons" qui passent l'hiver dans la boue ; parfois, avant la floraison, la plante tout entière s'arrache au fond, monte à la surface et ne s'enracine à nouveau dans la vase, qu'à la fin de l'été.
H. palustris pousse dans la zone tempérée d'Europe, depuis l'Angleterre et le sud de la Suède jusqu'à l'Oural. Les aquariophiles européens cultivent quelquefois l'espèce nord-américaine H. influta ELL. à la tige plate, originaire des états de l'est des États-Unis.
Ce sont des plantes vivaces, de 20 à 60 cm de haut (dans les eaux profondes, on en a trouvé de plus d'un mètre) aux tiges ramifiées, aux feuilles alternes, parfois apparemment verticillées. Le limbe des feuilles est divisé en filaments. À l'aisselle des feuilles apparaissent parfois de petites racines blanches filamenteuses.

Les fleurs se développent sur des hampes de 10 à 30 cm de long. On y remarque parfois, comme chez les autres Primulacées. un dimorphisme floral (hétérostylie). Après la pollinisation, la hampe florale se rétracte avec les fruits mûrissants (1) sous la surface.
L'Hottonie fleurit de mai à juin.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
16:08 Publié dans Botanique, Limnologie-hydrobiologie | Tags : hottonie des marais, hottonia palustris, primulacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L'Isoète
L'Isoète
L'Isoète [Isoëtes lacustris L.] fait partie de la famille des Isoétacées. C'est une plante hydrophyte à feuilles submergées.
Les Isoètes constituent un groupe isolé de ptéridophytes dont le biotype est le fond des lacs et des étangs. Avec le genre sud-américain Stylites, ils sont les derniers exemplaires vivants d'une branche d'évolution pratiquement presque disparue, les Lycopodiophytes.
Ce groupe a connu son apogée au carbonifère (Primaire) et l'on trouve ses fossiles dans les gisements de charbon. Les vigoureux genres, en arbres de terre ferme, ont depuis longtemps disparu et il ne reste plus qu'environ soixante-dix espèces d'Isoètes dont les plus grands centres d'expansion sont le nord de l'Amérique et la Méditerranée.
Dans l'Europe du nord-ouest, subsistent deux espèces dont on trouve des stations isolées en Europe centrale. À la fin de la dernière période glaciaire, les Isoètes étaient beaucoup plus abondants en Europe mais ils se sont réfugiés aujourd'hui dans les lacs glaciaires où ils peuvent vivre entre 0,5 et 5 mètres de profondeur, parfois davantage. Ils sont considérés comme des plantes "reliques". Le nom des Isoètes dérive du grec isos = semblable et etos = année, parce que ces plantes gardent toute l'année le même aspect.
Les Isoètes sont des plantes vivaces, en touffes, aux feuilles linéaires et pointues (1) : celles-ci ont à la base des sporogones surmontés d'une excroissance membraneuse dite lingula (2). Les spores sont de deux ordres : les macrospores, qui donnent naissance aux organes sexuels femelles, et les microspores qui donnent les spermatozoïdes mâles.
I. lacustris et I. echinospora DURIEU sont deux espèces qui ne diffèrent qu'à peine dans la structure fine de la surface des macrospores (3) et dans leur taille, dans la forme des feuilles [coupe de feuille de I. lacustris (4)] et dans la couleur : I. echinospora est d'un vert plus clair, Il est difficile d'indiquer la période de "floraison" : les spores s'échappent des sporogones environ de mai à septembre.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
16:03 Publié dans Botanique, Limnologie-hydrobiologie | Tags : isoète, isoetes lacustris, isoétacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Potamot nageant
Le Potamot nageant
Le Potamot nageant [Potamogeton natans L.] fait partie de la famille des Potamogétonacées. C'est une plante hydrophyte à feuilles submergées.
II n'est pas aisé de choisir un spécimen représentatif parmi les quatre-vingt-dix espèces du genre Potamogeton ; chacun est intéressant à sa manière. Les Potamogétonacées constituent une famille très étendue dont on trouve des représentants sous les tropiques et dans la zone tempérée. Ils s'adaptent facilement au milieu dans lequel ils vivent et sont très variables en particulier dans la forme des feuilles. On trouve des espèces à larges feuilles flottant à la surface (P. natans), des espèces au limbe en filaments et à la manière d'un peigne (P. pectinatus) ou linéaires allongées (P. rutilus).
Ce sont des plantes habituellement immergées ou flottant à la surface mais toujours bien enracinées dans la boue du fond. Leurs feuilles et leurs tiges renferment suffisamment de tissus aériens qui alimentent en air les parties immergées de la plante. Elles se multiplient végétativement avec une grande facilité, les parties cassées produisant rapidement des racines. Les oiseaux concourent à leur dissémination : les graines du Potamot ne sont pas digérées et sont ainsi rejetées avec la plante dans les eaux éloignées ou isolées.
L'économie des étangs tire profit des peuplements de Potamot (flore molle) et ils sont un abri convenable pour le frai des poissons. Par contre, les colonies cachées de Potamot crépu sont très désagréables pour les nageurs. En grec, potamos signifie fleuve ; geiton, voisin, proche ; Potamogeton désignait jadis certaines plantes aquatiques et ne désigne plus aujourd'hui que le Potamot.
Les Potamots sont des plantes vivaces aux rhizomes solidement fixés dans la boue et aux longues tiges flottantes. Les feuilles de P. natans (1) mesurent jusqu'à 12 cm de long et 6 cm de large ; elles sont longuement pétiolées, coriaces, et nagent à la surface. P. fluitans ROTH. est un Potamot à deux types de feuilles : les feuilles immergées sont étroites, lancéolées, celles qui nagent à la surface sont largement ovoïdes (2). Les feuilles de P. crispus L sont ondulées sur les bords (3).
Les fleurs (4) s'épanouissent de juin à août sur des épis dressés émergeant au-dessus de la surface. Elles sont hermaphrodites et le connectif vert assume la fonction du périanthe qui n'est pas développé.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
15:57 Publié dans Botanique, Limnologie-hydrobiologie | Tags : potamot, potamogeton nageant, pomatogétonacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L'Utriculaire vulgaire
L'Utriculaire vulgaire
L'Utriculaire vulgaire [Utricularia vulgaris L.] fait partie de la famille des Lentibulariacées. C'est une plante hydrophyte à feuilles submergées.
Les Utriculaires sont des plantes aquatiques, sans racines, mixotrophes, aux feuilles adaptées à la capture des petits animaux aquatiques. (Les plantes mixotrophes sont celles qui, en dehors de la photosynthèse, c'est-à-dire d'une alimentation autotrophe, se procurent les substances qui leur manquent dans le corps d'autres organismes, c'est-à-dire d'une manière hétérotrophe).
Entre les segments des feuilles existent des vésicules, d'origine foliaire, fermées par une sorte de valve et ne s'ouvrant que vers l'intérieur. Autour de l'orifice, s'étalent des poils, des antennes, qui réagissent aux contacts. Si par exemple un petit crustacé aquatique heurte une antenne, la valve s'ouvre brutalement et toute la vésicule se dilate. Par là même, elle aspire de l'eau et en même temps l'animalcule qui finit par périr dans la vésicule et dont les substances résultant de sa décomposition sont absorbées par les tissus de la plante.
Certains naturalistes attribuent à ces vésicules une fonction natatoire : avant la floraison, elles sont normalement emplies d'air de sorte que la plante flotte près de la surface, les hampes florales émergeant au-dessus.
Les Utriculaires sont des plantes rares, disséminées dans les eaux dormantes à fond vaseux, cosmopolites ou circumpolaires dans l'hémisphère nord.
Ce sont de petites plantes aquatiques vivaces, sans racines. (Il arrive que la partie non verte de la plante se fixe dans la boue, comme par exemple chez l'espèce Utricularia intermedia HAYNE). Les tiges sont peu ramifiées, les feuilles sont alternes, palmées, longuement divisées en filaments et portent des vésicules (1a, 1b). Le mot latin utriculus signifie petit sac, bourse.
Les fleurs s'ouvrent au bout d'un long pédoncule émergeant à la surface sous forme d'épi ; le calice est composé de deux sépales, la corolle est à deux lèvres, il n'y a que deux courtes étamines.
L'Utriculaire fleurit rarement, entre juin et août. Elle se multiplie végétativement par des bourgeons qui passent l'hiver sur le fond.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
15:52 Publié dans Botanique, Limnologie-hydrobiologie | Tags : utriculaire, utricularia vulgaris, lentibulariacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L'Hydrocharis Mors de grenouille
L'Hydrocharis Mors de grenouille
L'Hydrocharis Mors de grenouille [Hydrocharis morsus-ranae L.] fait partie de la famille des Hydrocharitacées. C'est un hydrophyte à feuilles flottantes.
Le Mors de grenouille et le Faux Aloès constituent une exception dans la famille des Hydrocharitacées, essentiellement marines. Dans les mers, poussent neuf genres et trente et une espèces qui, avec les Potamogétonacées, sont les plus fréquents et souvent les seuls représentants des angiospermes dans la flore marine.
L'Hydrocharis Mors de grenouille pousse dans les eaux dormantes ou à faible courant, dans les mares, les petits lacs, dans les petites surfaces d'eau où il peut former des peuplements denses et continus. La plante produisant souvent des rejets, de tels peuplements (colonies) sont presque impénétrables, ils assombrissent les eaux et gênent les pêcheurs.
L'Hydrocharis est précieux pour étudier le système radiculaire des plantes aquatiques. Il s'agit là de plantes flottantes ou plutôt se soutenant sur leurs feuilles flottantes, dont les racines pendent librement dans l'eau et qui, à la différence des plantes terrestres enracinées dans le sol, conservent pendant toute leur existence leurs poils absorbants ; la surface totale des racines se trouve ainsi multipliée par huit.
C'est une plante euro-sibérienne que l'on trouve surtout dans l'ouest et le centre de l'Europe et qui est absente en Écosse, dans le nord de la Scandinavie et le sud de l'Europe. Le nom latin de cette plante semble assez paradoxal car, si Hydrocharis signifie à peu près, "ornement des eaux", "mors de grenouille" signifie "morsure de grenouille" ce qui a une connotation nettement moins agréable.

L'Hydrocharis est une plante aquatique vivace à court rhizome et longues racines ; les feuilles forment des rosettes caractéristiques qui flottent à la surface. On peut distinguer facilement le Petit Nénuphar (Nymphoides peltata) (GMEL.) KUNTZE de l'Hydrocharis qui possède des écailles à la base des pétioles des plantes hors floraison.
Les fleurs sont unisexuées et à trois divisions : les fleurs mâles, à l'extrémité de longs pédoncules, ont 12 étamines et se développent à l'aisselle de spathes membraneuses ; les fleurs femelles sont presque sessiles dans les spathes et possèdent 6 stigmates divisés (1). La plante se multiplie souvent par de longs stolons à l'extrémité desquels se développent de nouvelles rosettes de feuilles ou des "boutons" ovoïdes qui passent l'hiver et montent à la surface au printemps.
La floraison a lieu de juin à août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
15:29 Publié dans Botanique, Limnologie-hydrobiologie | Tags : hydrocharis, mors de grenouille, hydrocharidacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Nénuphar jaune
Le Nénuphar jaune
Le Nénuphar jaune [Nuphar lutea (L.) SM.] fait partie de la famille des Nymphéacées. Les nénuphars sont des plantes hydrophytes à feuilles flottantes.
Le développement des Nénuphars est d'abord lent : à partir des graines dispersées par les oiseaux aquatiques ou par le courant, naissent des plantules qui ne fleurissent pour la première fois qu'au bout de quatre ans. Les premières feuilles de chaque année se développent dès l'automne de l'année précédente. Dès que la température tombe à 10°C le développement s'arrête et les Nénuphars se préparent à hiverner. Le développement reprend au printemps et, après les feuilles minces, immergées, apparaissent à la surface les caractéristiques feuilles flottantes, plates et coriaces.
Le Nénuphar jaune pousse à 80-200 cm de profondeur dans les étangs, les lacs, les mares et les zones calmes ou les bras morts des cours d'eau. Ce sont des plantes euro-sibériennes. La construction de barrages, les déchets industriels dans les eaux, l'excès d'engrais dans les étangs ont provoqué le déclin de ce précieux élément de la flore européenne. Les guérisseurs et les anciens herboristes appréciaient le Nénuphar jaune. Son rhizome contient certains alcaloïdes et un glucoside cardio-tonique ; on l'utilisait comme sédatif pour calmer les grands nerveux, mais à forte dose, il pouvait provoquer la paralysie des centres respiratoires.

Le Nénuphar jaune est une plante aquatique vivace à longs rhizomes (parfois 10 cm d'épaisseur et plus de 2 mètres de long) dont la face inférieure produit les racines et dont la face supérieure bosselée garde la cicatrice des feuilles tombées (1). À l'extrémité du rhizome poussent des feuilles longuement pétiolées dont certaines restent immergées, et d'autres, à nervures ramifiées caractéristiques (2), flottent à la surface. Leur limbe peut atteindre 40 cm de long et 30 cm de large.
Les fleurs jaunes s'épanouissent à l'extrémité de longues hampes, de juin à août, et se ferment la nuit. Après la pollinisation, le pistil et son stigmate se transforment en un long fruit en forme de bouteille et à plusieurs loges (3).
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
15:23 Publié dans Botanique, Limnologie-hydrobiologie | Tags : nénuphar jaune, nuphar lutea, nymphéacées, zones humides, hydrophytes | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
Le Nénuphar blanc
Le Nénuphar blanc
Le Nénuphar blanc [Nymphaea alba L.] fait partie de la famille des Nymphéacées. Les nénuphars sont des plantes hydrophytes à feuilles flottantes.
Le Nénuphar blanc pousse dans les eaux dormantes à fond vaseux dans le centre et l'ouest de l'Europe (N. alba est européen, N. candida PRESL euro-sibérien ; ce dernier pousse un peu plus au nord-ouest et on ne le trouve ni en Grande-Bretagne, ni sur le littoral atlantique).
Les feuilles flottantes du Nénuphar blanc sont le modèle des feuilles flottantes dont les stomates ne se trouvent que sur la face supérieure (l'endroit) des feuilles. Les fleurs s'ouvrent périodiquement, vers 7 h du matin par temps clair, pour se fermer entre 16 et 17 h. La pollinisation est assurée par les insectes, plus particulièrement par les mouches. Les pétales tombent au bout d'une semaine et le pédoncule floral s'enroule en spirale sous la surface. Il donne une grande capsule charnue qui ressemble à la capsule de pavot.
Les rhizomes du Nénuphar blanc fournissaient une substance qu'on utilisait comme calmant pour les nerveux.
Les Nénuphars blancs sont des plantes aquatiques vivaces à rhizome ovale (1), d'environ 5 cm d'épaisseur, 30 à 50 cm de long, poussant presque verticalement dans la boue, à la différence des rhizomes du Nénuphar jaune qui poussent obliquement. Les cicatrices dues aux feuilles se répartissent sur toute la surface du rhizome qui peut donner des feuilles sur sa totalité.

Les feuilles du Nénuphar blanc ont des nervures caractéristiques, différentes de celles du Nénuphar jaune. Les feuilles du Nénuphar blanc (Nymphaea alba) (2) ont des lobes cordiformes à leur base, écartés ; celles de N. candida (3) ont des lobes rapprochés, se recouvrant parfois.
Les fleurs blanches qui peuvent atteindre parfois 12 cm de diamètre, à nombreux pétales, s'épanouissent de juin à août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
15:19 Publié dans Botanique, Limnologie-hydrobiologie | Tags : nénuphar blanc, nymphéacées, nymphea alba, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Petit Nénuphar
Le Petit Nénuphar
Le Petit Nénuphar [Nymphoides peltata (GMEL.) KUNTZE] fait partie de la famille des Ményanthacées. Comme les nénuphars proprement dits le Petit Nénuphar est une plante hydrophyte à feuilles flottantes.
À la différence des Gentianes voisines, qui poussent souvent très haut dans la montagne et très loin vers le nord, la plupart des Nymphoïdés sont des plantes tropicales, thermophiles. Le Petit Nénuphar lui-même aime la chaleur. Il forme des rhizomes de deux sortes :
- longs rhizomes de plus d'un mètre à grands entre-nœuds de 8 à 20 cm, pendant l'été ;
- courts rhizomes, de 2 à 20 cm de long, en automne.
Ce sont les longs rhizomes de l'été qui servent plus particulièrement à la rapide multiplication végétative du Petit Nénuphar. L'aspect des feuilles se modifie également suivant la saison en liaison avec la température et la luminosité : les premières feuilles flottantes, qui apparaissent dès la fin avril, sont vert clair; les feuilles définitives postérieures sont vert foncé et rigides, l'envers est rouge violacé et parsemé de petits points. Les dernières feuilles, celles d'automne, renferment plus d'anthocyane et sont vert violacé foncé. Les Petits Nénuphars qui se développent en eau profonde ont des feuilles immergées plus petites. Sur le fond des étangs asséchés en été, le Petit Nénuphar a une forme terrestre caractérisée par des feuilles à court pétiole.
Le Petit Nénuphar est une espèce euro-asiatique : il pousse depuis l'Europe centrale (mais il s'étend jusqu'en Hollande) jusqu'en Chine, mais il a été introduit partout comme plante ornementale et il semble qu'en beaucoup d'endroits il soit retourné à l'état sauvage.

Les feuilles du Petit Nénuphar rappellent par leur aspect les petites feuilles du Nénuphar. Cette convergence, vraisemblablement écologique, a déterminé l'appellation de la plante. C'est une plante vivace dont le rhizome rampant (1) donne naissance à des tiges ovales aux feuilles presque opposées, aux longs pétioles munis de gaines. Les fleurs, à cinq divisions, ont de longs pédoncules; la corolle jaune d'or est en entonnoir dont les lobes sont ciliés et mesurent jusqu'à 3 cm de large. Les fleurs sont pollinisées par les abeilles. Le fruit est une capsule pointue.
Les Petits Nénuphars fleurissent en juillet et août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
15:13 Publié dans Botanique, Limnologie-hydrobiologie | Tags : petit nénuphar, nymphoides peltata, ményanthacées, zones humides, hydrophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Plantain d'eau ou Alisma
Le Plantain d'eau ou Alisma
L'Alisma Plantain d'eau [Alisma plantago-aquatica L.] fait partie de la famille des Alismatacées. C'est une plante hélophyte.
Les Alismatacées sont des plantes qui, pratiquement, ne peuvent vivre que dans l'eau. C'est une famille cosmopolite qui, à l'exception de l'Antarctique, croît sur tous les continents. L'Alisma Plantain d'eau a, lui aussi, un domaine étendu et pousse (en dehors des régions arctiques les plus rudes) dans tous les continents de l'hémisphère nord. On trouve un Alisma fossile du Tertiaire dans les régions arctiques actuelles.
Cette plante est souvent très grande, elle peut avoir près d'un mètre de haut et sa période de végétation est relativement courte : elle fleurit et donne ses graines deux mois après le début de sa végétation.
Elle se multiplie aussi végétativement par des bourgeons latéraux. Sa facilité de multiplication fait qu'elle est l'une des premières plantes de rives et de marécages qui apparaisse dans les pièces d'eau nouvelles ou rénovées. On en a vu se développer avec les massettes dans les flaques d'eau de chemins peu fréquentés. L'Alisma prospère surtout sur les rives marécageuses et dans les eaux calmes et peu profondes. Elle se développe dans des eaux plus profondes et prend alors sa forme immergée. Son système radiculaire est puissant et solide.
C'est une plante vivace dont la taille dépend de nombreuses conditions externes : elle peut n'avoir que 10 cm mais mesurer aussi un mètre de haut. À partir d'une souche bulbeuse, s'élève une touffe puissante de feuilles à longs pétioles. Les feuilles immergées peuvent être seulement linéaires avec des formes de passage vers les feuilles flottantes, comme cela se produit pour la Sagittaire.

Les inflorescences sont de grandes panicules ; les ramifications latérales poussent par trois ou davantage, en verticilles. Les fleurs hermaphrodites sont du type trois (1). Elles s'ouvrent de juin à septembre. Les fruits (akènes) ne mûrissent que sur les plantes émergées.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
14:59 Publié dans Botanique, Limnologie-hydrobiologie | Tags : plantain d'eau, alisma plantago, alismatacées, zones humides, hélophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L'Acore calame
L'Acore calame
L'Acore calame [Acorus calamus L.] fait partie de la famille des Aracées. C'est une plante hélophyte.
De nos jours, nous aurions peine à nous représenter un étang et un lac sans sa végétation d'Acore calame. Il n'en a pas toujours été ainsi. À l'époque de la création de la plupart des étangs européens, c'est-à-dire entre le XIVe et le XVIe siècle, il n'y avait pas trace d'Acore en Europe. Il croissait alors quelque part dans l'est de l'Inde et en Chine sans que l'on puisse préciser davantage. C'est vers la fin du XVIe siècle que les premières souches sont arrivées des environs de Constantinople à Vienne, d'où ensuite, l'Acore s'est répandu dans toutes les eaux douces de l'Europe.
L'Acore, quand il n'est pas fleuri, se distingue mal au milieu des Massettes et des Iris mais, par contre, on sent son odeur. Le parfum d'une feuille d'Acore froissée est unique et ne se confond avec aucun autre ; comme d'ailleurs le parfum d'une de ses souches. C'est à elle que l'Acore doit son renom, car on remployait en médecine et en confiserie, dès l'Antiquité en Inde, en Grèce et à Rome. Radix calami aromatici, la racine de l'Acore, est une substance très utile. L'Acore était utilisé pour confectionner des tisanes digestives amères qui étaient réputées donner de l'appétit aux animaux comme aux personnes. On prescrit des bains d'Acore pour les cas de nervosité excessive.
Les Acores introduits en Europe et en Amérique fleurissent quelquefois mais les graines ne mûrissent pas. Tous les Acores des peuplements européens actuels sont donc des clones, c'est-à-dire des individus multipliés végétativement.

L'Acore fait partie de la famille des Aracées dont la structure des fleurs est caractéristique.
Les petites fleurs (1) sont agglomérées sur un spadice gros comme un doigt qui est entouré par une spathe verte, très semblable aux feuilles et continue dans le sens de la tige. L'inflorescence, le spadice, apparaît donc comme latérale (2) bien qu'elle soit au sommet.
Les feuilles de l'Acore sont brillantes, en longs rubans, parfois frangées sur le pourtour du limbe.
Les rhizomes renferment jusqu'à 4% d'essences, de sels et le séchage fait apparaître des tanins. L'odeur est attribuée à des aldéhydes.
L'Acore fleurit en juin et juillet.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
14:48 Publié dans Botanique, Limnologie-hydrobiologie | Tags : acore calame, acorus calanus, aracées, zones humides, hélophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
La Baldingère
La Baldingère ou Ruban de bergère
La Baldingère ou Ruban de bergère ou Phalaris [Phalaris arundinacea L.] appartient à la famille des Poacées (ex-Graminacées). Il s'agit d'une plante hélophyte.
La Baldingère, surtout quand elle n'est pas en fleurs, est souvent confondue avec le Roseau par les profanes. Elle lui ressemble un peu par la couleur et la rugosité des feuilles. Elle pousse très souvent au bord des eaux, dans les fosses et dans les prairies humides. Elle ne souffre pas des variations du niveau de l'eau, il semble au contraire que cela lui soit profitable. Elle pousse très souvent sur les rives des cours d'eau où elle forme des peuplements caractéristiques dans les méandres et les zones calmes, à l'écart du courant principal.
Le Phalaris peut constituer un bon aliment pour les chevaux et le bétail : on prétend que manger du Phalaris donne au chevaux un poil très lustré et que les vaches donnent alors du beurre d'une saveur d'une particulière délicatesse. On a même développé des cultures de Phalaris dans les prairies difficiles à drainer.
La Baldingère pousse dans presque toute l'Europe, dans l'ouest, le nord et l'est de l'Asie et en Amérique du Nord. C'est donc une espèce circumpolaire ; on considère qu'elle a été introduite dans le sud de l'Afrique.
On cultive comme plante d'ornement dans les jardins des variétés panachées : la variété 'Picta' (Ruban de bergère) a des feuilles bigarrées, la variété 'Elegans' est rayée de blanc.

La Baldingère est une herbe vivace vigoureuse à rhizome rampant. Les chaumes se terminent par une panicule assez grande, étroite et lobée. Avant la floraison, celle-ci est blanc verdâtre teinté de rouge puis, comme toute la plante quand elle s'est desséchée, jaune paille (1). Mais elle ne se disloque pas et reste sur les chaumes jusqu'à la saison suivante. Cela donne aux peuplements de Phalaris leur aspect caractéristique.
Les épillets de l'inflorescence n'ont qu'une fleur (2), hermaphrodite et l'on y trouve les restes (les enveloppes) de deux autres fleurs atrophiées.
La Baldingère fleurit en juin et juillet.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
14:16 Publié dans Botanique, Limnologie-hydrobiologie | Tags : baldingère, ruban de bergère, phalaris arundinacea, poacées, zones humides, hélophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Butome en ombelle
Le Butome en ombelle
Le Butome en ombelle [Butomus umbellatus L.] appartient à la famille des Butomacées. C'est une plante hélophyte.
Les Butomacées sont des plantes des eaux et des marécages. Leur seul représentant, Butomus umbellatus, pousse dans toute l'Europe, à l'exception des régions septentrionales de l'Écosse et de la Scandinavie, il ne pousse pas dans les montagnes très élevées. Son aire d'extension continue s'étend jusqu'au centre de l'Asie.
Le Butome pousse dans les plaines et les collines qui jouissent d'une température clémente. On le trouve dans les mares, les étangs et les lacs, sur les rives et au milieu des roselières, de préférence dans la vase. Il a des feuilles étroites, rubanées, très fermes et qui, comme celles des Rubaniers et des Massettes, servaient à tresser des nattes et des paniers.
On utilisait jadis la racine amère dans la médecine populaire sous le nom Radix Junci floridi. L'aspect de ses feuilles et son habitat évoquaient sans doute le Jonc (Juncus) pour nos ancêtres, mais la fleur est plus colorée.
Le Butome en ombelle est une plante vivace dont le robuste rhizome donne naissance à des feuilles étroitement rubanées (linéaires), élargies en gaine à la base, puis en gouttière, puis plates à l'extrémité et mesurant jusqu'à 2 mètres de long.

L'inflorescence naît au sommet d'une hampe ovale. Les fleurs (1) sont régulières, hermaphrodites, du type trois. Les fruits sont des follicules (2) renfermant des semences légères, qui peuvent flotter. Ces graines germent facilement, même après avoir passé une longue période hors de l'eau. Néanmoins, le Butome se multiplie plus souvent végétativement par les bourgeons du rhizome.
Il fleurit de juin jusqu'en août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
14:05 Publié dans Botanique, Limnologie-hydrobiologie | Tags : butome en ombrelle, butomus umbellatus, butomacées, zones humides, hélophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
La Grande Glycérie
La Grande Glycérie
La Grande Glycérie [Glyceria maxima (HARTMAN) HOLMBERG] appartient à la famille des Poacées (ex-Graminacées). C'est une plante hélophyte.
La Glycérie est, après le Roseau et la Massette, la troisième grande composante des hautes roselières des rives. Comme ces deux autres plantes, elle s'est montrée une plante utile. À l'aube de l'histoire, les caryopses de la Glycérie flottante [G. fluitans (L) R.BR.] récoltées et moulues en semoule servaient de nourriture (manne) en période de disette ; les feuilles servaient à confectionner des toitures.
La Grande Glycérie est une plante circumpolaire dont les centres d'expansion se trouvent dans l'ouest, la centre et l'est de l'Europe, dans le centre de l'Asie et dans la partie non arctique de l'Amérique du Nord ; la Glycérie flottante vit en Europe où elle s'étend plus au nord que la Grande Glycérie, et dans un petit nombre d'endroits de la côte atlantique de l'Amérique du Nord.
La Grande Glycérie est une robuste plante qui forme des peuplements étendus et monotones (les prairies "à Glycéries"), dans les eaux peu profondes. Elle supporte bien les basses températures et sa période de végétation est longue. Grâce à une multiplication végétative intensive, elle supporte bien la fauchaison ou les dégâts causés par exemple par le rat musqué. Dans les eaux profondes et courantes (les canaux d'alimentation des étangs par exemple), elle forme des feuilles submergées ou flottantes et ne fleurit pas.
La Glycérie flottante est appréciée dans l'économie des étangs car elle indique de bonnes conditions pédologiques et parce qu'elle assure aux poissons des refuges et des lieux de frai.
Les Glycéries donnaient un bon fourrage sucré pour le bétail et les chevaux. De là vient probablement leur nom, glykeros. en grec, signifiant sucré ; mais on peut aussi en chercher l'étymologie dans une caractéristique des caryopses de la Glycérie flottante, la manne, qui renferme 40% de sucre assimilable.

La Grande Glycérie (1a) est une plante vivace qui atteint souvent 2,5 mètres, à long rhizome rampant et peu profondément immergé. Les chaumes rigides sont lisses et brillants ; l'inflorescence est une panicule étalée assez épaisse. Les épillets (1b) ont plusieurs fleurs jaune verdâtre ou violacées.
La Glycérie flottante est également vivace ; les feuilles ont 50 à 200 cm de long. Les chaumes fertiles n'ont que 30 à 100 cm de haut et se terminent par une panicule unilatérale (2) dont les ramifications, en pleine floraison, sont presque horizontales.
Les Glycéries fleurissent de mai (juin) jusqu'en août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
11:53 Publié dans Botanique, Limnologie-hydrobiologie | Tags : grande glycérie, glyceria maxima, poacées, zones humides, hélophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L'Iris jaune
L'Iris jaune
L'Iris jaune [Iris pseudacorus L.] appartient à la famille des Iridacées. Il s'agit d'une plante hélophyte.
L'Iris jaune n'est pas une plante très abondante : bien qu'il se multiplie végétativement avec facilité, il disparaît rapidement de ses lieux d'origine et c'est pourquoi, dans un certain nombre de pays, il est protégé. La disparition de l'Iris jaune est due surtout aux anciens herboristes qui récoltaient la plante et prescrivaient la "racine" (rhizome) de l'Iris contre les hémorragies (dans l'herbier de Mattiolla contre les hémorroïdes). À l'époque où Acorus calamus L. est apparu en Europe, le rhizome de l'Iris était appelé Radix Acori palustris (racine d'Acore des marais) et l'Iris lui-même Faux Acore. Cela résulte sans doute de la ressemblance des feuilles des deux plantes et de certaines autres propriétés communes. Le rhizome de l'Iris jaune était également mis en conserve dans le vin et utilisé comme remède contre la jaunisse.
On peut démontrer la flétrissure par le froid par l'exemple des feuilles persistantes de l'Iris jaune. Les feuilles normalement rigides se fanent par basse température. Cela résulte de la déshydratation car les feuilles vertes transpirent même en hiver mais les organes souterrains, dans le sol gelé ne peuvent leur procurer de l'eau. On peut observer le même phénomène chez les plantes ligneuses toujours vertes telles que les rhododendrons.
Le nom grec Iris désignait l'arc-en-ciel. Les fleurs de nombreux Iris, en particulier celles des hybrides horticoles modernes, ont en effet des couleurs éclatantes. Finalement, à côté d'eux, l'Iris jaune est une plante modeste.

Il est vivace, mesure 50 à 100 cm de haut et possède un vigoureux rhizome ramifié, la tige est dressée, légèrement aplatie, ramifiée, terminée par des fleurs à long pétiole qui poussent à l'aisselle des feuilles vertes. Ces feuilles ont une forme gladiolée caractéristique ; elles sont plus longues que la tige fleurie. Le fruit est une grande capsule triangulaire, arrondie et pointue (1).
L'Iris jaune pousse disséminé au bord des étangs et des plans d'eau, dans la broussaille des rives et dans les aulnaies dans presque toute l'Europe, à l'exception des régions arctiques ; il s'étend jusqu'à l'ouest de la Sibérie.
II fleurit en juin.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
11:45 Publié dans Botanique, Limnologie-hydrobiologie | Tags : iris jaune, iris pseudoacorus, iridacées, zones humides, hélophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
La Massette à larges feuilles
La Massette à larges feuilles
La Massette à larges feuilles [Typha latifolia L. ] appartient à la famille des Typhacées. Il s'agit d'une plante hélophyte.
Les Massettes poussent partout où l'eau stagne, ne serait-ce qu'un court instant, même dans les flaques sur les routes. Les plus répandues sont probablement les Massettes à larges feuilles qui poussent dans le monde entier et donc dans tout l'hémisphère nord. T. angustifolia L, la Massette à feuilles étroites, est également une espèce circumpolaire dont les centres d'extension se trouvent dans l'est de l'Amérique du Nord, en Europe et dans le nord-ouest de l'Asie.
Les Massettes sont de gros producteurs de biomasse. Elles poussent en grands peuplements homogènes sur les rives des eaux dormantes ou vives, pouvant être recouvertes d'eau de façon continue jusqu'à la moitié de leur hauteur. Leur multiplication végétative par les rejets souterrains est très active de sorte qu'elles occupent rapidement les eaux peu profondes. À l'état frais, les Massettes constituaient un fourrage de complément pour le bétail et leurs rhizomes servaient à nourrir les porcs. Elles ont un ennemi naturel, le rat musqué, qui est capable de dévaster rapidement de grandes surfaces.

Les Massettes sont des plantes vivaces, souvent très vigoureuses, atteignant jusqu'à 3 mètres de haut. Dans la boue, elles se multiplient par de vigoureux rhizomes tendres partant du pied-mère dans tous les sens (1a, 1b). Au cours d'une saison, un peuplement de Massettes peut ainsi devenir le triple de ce qu'il était.
L'inflorescence se compose de deux spadices : l'inférieur femelle et le supérieur mâle. Chez la Massette à larges feuilles, ils sont immédiatement réunis (2), alors que chez la Massette à feuilles étroites ils sont séparés de 1 à 9 cm (3). L'inflorescence mâle disparaît rapidement après la floraison, les fleurs femelles donnent des akènes à longs poils.
Les fleurs de Massettes (hermaphrodites, sans périanthe, limitées à 3 — rarement 1 à 7 — étamines ou un pistil) fleurissent en juillet et août.
Source :
V. Vetvicka (1981). - Plantes du bord de l'eau et des prairies. Ed. Gründ.
11:39 Publié dans Botanique, Limnologie-hydrobiologie | Tags : massette, typha latifolia, typhacées, zones humides, hélophytes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |