16/03/2016
Boire du lait du soir aide à s'endormir
Boire du lait du soir aide à s'endormir
En effet, la vache ne produit pas le même lait le matin que le soir. La traite du soir contient dix fois plus de mélatonine et 24 % de tryptophane en plus. C'est la conclusion d'une récente étude par une équipe coréenne (Sahmyok University, Séoul) : des souris consommant du lait du soir sont moins anxieuses et s'endorment plus vite.
Les aliments protéiques tels que le lait et les produits laitiers contiennent du tryptophane, un acide aminé induisant le sommeil. Le tryptophane est un acide aminé qui favorise le sommeil et qui se trouve en petites quantités dans tous les aliments protéiques. Il est un précurseur de la sérotonine (un neurotransmetteur), et de la mélatonine induisant le sommeil (une hormone qui agit également en tant que neurotransmetteur). Ainsi, pour que le tryptophane ait un effet sédatif, il doit pénétrer dans le cerveau en traversant la barrière hémato-encéphalique. En outre, étant donné que le tryptophane utilise le même système de transport que d'autres acides aminés, il doit rivaliser avec eux pour entrer dans le cerveau.
Bien qu'il soit peu probable d'induire efficacement le sommeil en consommant des aliments protéiques uniquement en raison de leur teneur insuffisante en tryptophane, consommer des glucides et des protéines dans le même repas rend le tryptophane plus disponible pour le cerveau. Un grand repas, en particulier un riche en glucides, stimule la libération d'insuline. Cela favorise la clairance d'autres acides aminés de la circulation sanguine et facilite l'entrée du tryptophane dans le cerveau. Mais la quantité de glucides nécessaire pour induire le sommeil n'est pas déterminée.
11:48 Publié dans Médecine, Nature et santé | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
07/03/2016
De nouvelles armes contre les bactéries résistantes
 De nouvelles armes contre les bactéries résistantes
De nouvelles armes contre les bactéries résistantes
Pneumonies, bronchites, otites, méningites, angines, infections urinaires, panaris, septicémies... de très nombreuses infections sont provoquées par des bactéries.
Nos médecins nous ont alors prescrit des antibiotiques. Ces "armes" de référence contre les bactéries ont sauvé et sauvent encore des millions de vies. Mais leur utilisation et leur emploi abusif chez l'homme comme chez les animaux a conduit à accélérer l'émergence de bactéries résistantes à ces médicaments. L'efficacité des antibiotiques est aujourd'hui sérieusement menacée. Il y a urgence à en trouver de nouveaux ou à développer des alternatives pour lutter contre les bactéries pathogènes.
Des infections transitoirement maîtrisées redeviennent graves
« On risque à l'avenir de ne plus disposer d'antibiotiques permettant de soigner les infections bactériennes courantes », s'alarme l'Organisation mondiale de la santé. Déjà, chaque année en Europe, 400 000 personnes sont infectées par des bactéries multirésistantes aux antibiotiques, dont 158 000 en France. Quand de telles bactéries sont en cause, on peut aujourd'hui mourir d'une infection jugée "banale" — car traitée facilement il y a quelques années (12 500 décès annuels surviennent ainsi en France). Les médecins se retrouvent de plus en plus souvent en situation d'impasse thérapeutique face à certains patients, aucun antibiotique n'ayant plus le moindre effet sur leur infection. Les chiffres parlent d'eux-mêmes : la résistance des pneumocoques à la pénicilline G était quasiment nulle il y a vingt ans ; 27% des souches de cette bactérie en France y sont désormais insensibles ; dans un cas sur cinq, les infections par le staphylocoque doré acquises à l'hôpital (infections nosocomiales) sont résistantes à l'antibiotique de référence. L'antibiorésistance croissante depuis 10 ans d'une autre bactérie, Escherichia coli, est aussi source d'inquiétude : elle provoque par exemple des infections urinaires — autrefois qualifiées de bénignes — dont beaucoup de patients n'arrivent plus à se débarrasser.
La recherche de nouveaux antibactériens, un défi majeur
L'Institut de Veille Sanitaire soulignait en novembre dernier à propos de la consommation antibiotique en ville (hors hôpital) : « La France se situe parmi les pays les plus consommateurs en Europe, juste derrière la Grèce. Elle consomme 30 % de plus que la moyenne européenne, trois fois plus que les pays les plus vertueux. » Or la pression médicamenteuse accélère la sélection de bactéries résistantes. Les autorités de santé tentent donc de diminuer cette consommation pour contenir l'évolution de l'antibiorésistance. Pour freiner la dissémination de ces bactéries à l'hôpital et la contamination des malades, les mesures d'hygiène ont été considérablement intensifiées ces dernières années. Mais ces initiatives, bien qu'essentielles, ne peuvent que limiter le problème. Les bactéries multi-résistantes sont là.
Un des défis majeurs de la recherche biomédicale est de trouver de nouvelles solutions thérapeutiques pour les combattre. Dans les laboratoires, plusieurs pistes sont en cours d'investigation : criblage de nouveaux antibiotiques, conception de nanomédicaments (voir ci-dessous : Nouveaux antibiotiques et nanomédicaments), thérapie par des "virus de bactéries" (voir ci-dessous Phagothérapie : utiliser les ennemis naturels des bactéries), élaboration d'antibactériens "intelligents" (voir ci-dessous : Vers des antibiotiques "intelligents")... De plus, les bactéries pathogènes, même si elles sont individuellement sensibles aux antibiotiques, sont capables d'échapper à leur action lorsqu'elles s'organisent en communauté : elles forment des biofilms à la surface de certains tissus de l'organisme (voir ci-dessous : Lutter contre les biofilms), mais aussi sur des matériaux médicaux comme les cathéters ou les prothèses implantables (voir plus loin : Des chambres implantables aux prothèses). L'arsenal antibiotique actuel ne parvient pas à détruire ces biofilms et des solutions spécifiques sont à l'étude.
Nouveaux antibiotiques et nanomédicaments
Face au problème croissant de l'antibiorésistance, si la recherche de nouveaux antibiotiques est indispensable, des initiatives visent également à les administrer différemment, par exemple en les enrobant dans des nanoparticules, un assemblage de lipides ou de sucres. Cette formulation aurait l'avantage de délivrer les antibiotiques à des doses inférieures, ce qui freinerait l'apparition des résistances et permettrait d'utiliser des molécules aujourd'hui délaissées car mal tolérées. Le projet NAREB[1] lancé en février 2014 et coordonné à l'Institut Pasteur, associe 15 laboratoires dans 8 pays d'Europe autour d'un objectif commun : développer des nanomédicaments contre deux types d'infections très préoccupantes, celles dues au staphylocoque doré résistant à la méthicilline (SARM) et la tuberculose multirésistante. Les SARM sont des causes fréquentes d'infections nosocomiales sévères : les personnes touchées ont un risque de décès supérieur de 64% à celui des personnes atteintes d'une forme non résistante de l'infection. Quant à la tuberculose multirésistante, près de 480 000 personnes l'ont développée en 2014, et presque un dizième de ces cas seraient des infections "ultrarésistantes" signalées dans une centaine de pays et contre lesquelles même les antibiotiques de deuxième intention sont inefficaces.
Phagothérapie : utiliser les ennemis naturels des bactéries
De plus en plus de chercheurs se penchent, avec des méthodes d'investigation modernes, sur une thérapie lancée au début du XXe siècle, avant la découverte des premiers antibiotiques. Elle consiste à attaquer et détruire les bactéries avec leurs ennemis naturels : des "virus de bactéries" appelés bactériophages, qui sont chacun spécifique d'une bactérie donnée, n'infectant donc que la bactérie hôte sans détruire, par exemple, la flore microbienne.
Dès 1917 à l'Institut Pasteur, Félix d'Hérelle décrit pour la première fois le phénomène de destruction des bactéries par les bactériophages et rapporte le premier essai expérimental de "phagothérapie".
Deux ans plus tard cette nouvelle thérapie est appliquée à l'Homme alors qu'on ne dispose d'aucune arme contre les bactéries, responsables de nombreuses maladies infectieuses et d'innombrables décès. Des solutions de bactériophages sont commercialisées et la phagothérapie connaît un âge d'or jusqu'à l'arrivée des antibiotiques en médecine du début des années 1940, des molécules chimiques que l'industrie peut facilement standardiser. Seuls certains pays de l'Est ont continué à l'utiliser jusqu'à nos jours. Mais le standard des études cliniques actuel ne correspond plus à celui des années passées et il faut donc réévaluer l'efficacité thérapeutique de ces "virus guérisseurs".
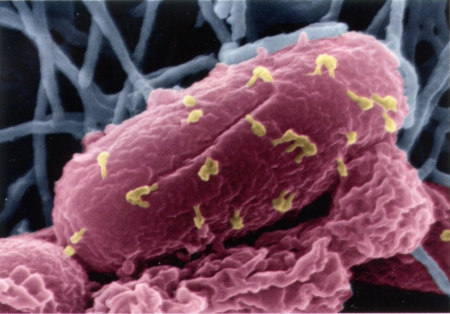
Bactériophages, en jaune, sur la bactérie Escherichia coli.
Vers des antibiotiques "intelligents"
Au-delà du problème de l'antibiorésistance, les antibiotiques ont un défaut majeur: ils s'attaquent sans distinction aux bonnes et aux mauvaises bactéries. On sait notamment qu'ils détruisent en partie les bactéries de notre microbiote, essentielles au bon fonctionnement de notre organisme. De récentes avancées biotechnologiques ont permis la conception d'armes totalement nouvelles qui cibleraient uniquement les bactéries néfastes.
Des "robots" biologiques
Pour cela, les chercheurs utilisent des bactériophages, ces "virus de bactéries" à l'origine d'une thérapie alternative aux antibiotiques, la phagothérapie (voir ci-dessus Phagothérapie : utiliser les ennemis naturels des bactéries). Mais il ne s'agit pas ici d'administrer ces virus antibactériens tels quels. Grâce à l'ingénierie génétique, les chercheurs sont capables de les transformer en véritables petits robots biologiques tueurs de bactéries bien précises. Comment ? Seule l'enveloppe du bactériophage — la "capside" — est utilisée. L'intérêt est qu'elle peut injecter de l'ADN dans des bactéries, mais pas dans les cellules humaines. Cette capside va donc servir à délivrer un "circuit génétique" aux bactéries néfastes : il comprend des ciseaux moléculaires couplés à un "guide" (voir l'article sur ce même blog) qui va cibler exclusivement un petit morceau d'ADN défini de la bactérie visée, au sein d'un gène de résistance ou de virulence. Le bactériophage a été transformé en cheval de Troie : il injecte le circuit dans la bactérie, le programme génétique se met en marche. Le ciseau "scanne" l'ADN. S'il trouve le fragment de gène, il coupe. La bactérie meurt. S'il ne le trouve pas, il n'y a rien à couper. La bactérie survit.
Lutter contre les biofilms
Quand les bactéries vivent en communauté, il est encore plus difficile de s'en débarrasser. Or sur nos tissus, sur des cathéters, sur des prothèses, les bactéries peuvent former des "biofilms": elles adhèrent à la surface, sécrètent une — la matrice —, se multiplient et s'agrègent les unes aux autres pour former une masse pouvant contenir des millions de milliards de bactéries. Comme l'union fait la force, ces biofilms bactériens deviennent "tolérants" aux antibiotiques : même si individuellement les bactéries qui les composent sont sensibles aux antibiotiques, ces médicaments n'ont plus d'effet contre elles lorsqu'elles sont organisées en biofilm (le problème est bien sûr amplifié si un biofilm est composé de bactéries résistantes). La médecine est aujourd'hui démunie face à ces communautés bactériennes et la lutte contre les biofilms est devenue un enjeu de taille pour la recherche biomédicale. Surtout quand on sait qu'ils seraient impliqués dans 60% des infections acquises à l'hôpital (infections nosocomiales).
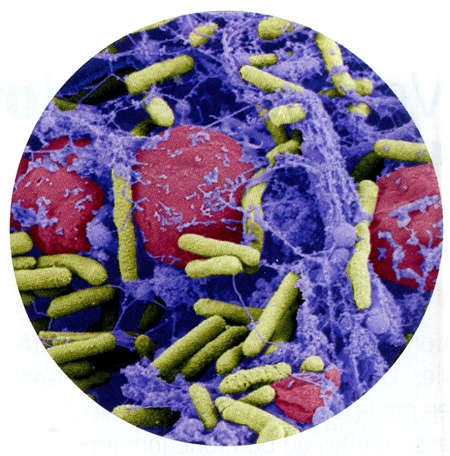
Biofilm sur un cathéter.
En jaune : les bactéries. En violet : La matrice du biofilm. En rouge : des cellules immunitaires.
Des chambres implantables aux prothèses par Jean-Marc Ghigo
Responsable de l'unité Génétique des biofilms à l'Institut Pasteur.
L'équipe de Jean-Marc Ghigo à l'Institut Pasteur est spécialisée dans l'étude des biofilms, analysant leur formation et les différents aspects du mode de vie en communauté des bactéries. Le chercheur nous précise le mécanisme qui empêche les antibiotiques d'être efficaces : « si un antibiotique agit sur un biofilm, beaucoup de bactéries vont être tuées, mais certaines bactéries qu'on nomme "persistantes" vont survivre au traitement, et permettre la reformation du biofilm ». Heureusement, des solutions se profilent. L'équipe pasteurienne a mené en collaboration avec des cliniciens[2] une étude sur les chambres implantables, ces petits boîtiers installés sous la peau qui permettent l'administration de médicaments, notamment en cas de chimiothérapie anticancéreuse. « Ces chambres sont infectées par des biofilms dans 4 à 5% des cas », explique Jean-Marc Ghigo. « Quand une infection est suspectée, elles doivent être retirées, ce qui n'est pas un acte anodin, surtout chez des patients fragilisés ».
Aujourd'hui, entre deux utilisations de la chambre, un "verrou" antibiotique est appliqué pour limiter le phénomène de formation des biofilms ; il consiste à injecter dans la chambre un faible volume d'antibiotiques. « Nous souhaitons mettre au point un verrou "curatif" capable de supprimer efficacement d'éventuels biofilms dans ces chambres implantables. Pour cela, nous couplons un antibiotique classiquement utilisé à une molécule qui s'attaque à la matrice des biofilms tout en augmentant la pénétration de l'antibiotique dsns les bactéries persistantes. Nous avons prouvé au laboratoire l'efficacité de ce mélange ». Ce nouveau "verrou " antibactérien est actuellement en fabrication par la pharmacie des Hospices Civils de Lyon en vue de futurs essais cliniques. Une autre piste est à l'étude dans l'unité : il s'agit cette fois de prévenir la formation des biofilms.
« On "greffe" sur des surfaces une molécule qui les rend "glissantes" et empêche ainsi les bactéries d'adhérer, de s'attacher à ces surfaces », explique le chercheur Christophe Beloin, qui mène toutes ces expérimentations avec Jean-Marc Ghigo. « Pour l'instant, il est difficile d'avoir un effet à long terme avec cette stratégie. Mais elle pourrait être utilisée sur le court terme, lors de la pose d'une prothèse par exemple.

Unité de Génétique des biofilms
Source : La Lettre de l'Institut Pasteur, n° 92 - février 2016.
[1] Nanotherapeutics for antibiotic résistant émergent bacterial pathogens.
[2] L'unité de Génétique des biofilms collabore avec David Lebeaux de l'hopital Necker et de l'hopitai George Pompidou à Paris, et avec des cliniciens de l'hopitai Dupuytren à Limoges.
15:58 Publié dans Médecine | Tags : bactéries, résistance aux antibiotiques, nouvaus antibiotiques, nanomédicaments, phagothérapie, bactériophes, antibiotiques intelligents, éligobitiques, biofilms | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
15/02/2016
La fabrique de micro-organes humains
La fabrique de micro-organes humains
Une équipe viennoise de l’Institut de biologie moléculaire de l’Académie des sciences d’Autriche a réussi à cultiver in vitro, à partir de cellules souches humaines, un mini-cerveau de 4 mm dont l'architecture intérieure reproduit, en effet, certaines caractéristiques propres au cerveau humain.
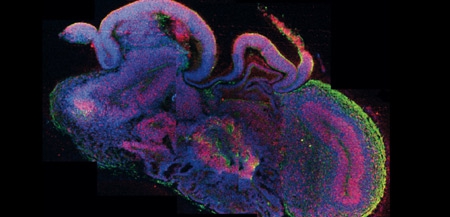
Coupe transversale d'un mini-cerveau
obtenu par culture de cellules souches
Ainsi, ces cellules sont parvenues, au bout de 20 à 30 jours, à reproduire des tissus ressemblant à un organe humain en récapitulant les mêmes processus que lors de la formation d’un embryon : elles se sont spontanément associées avant de se différencier puis de s’agencer au sein du tissu en formation.
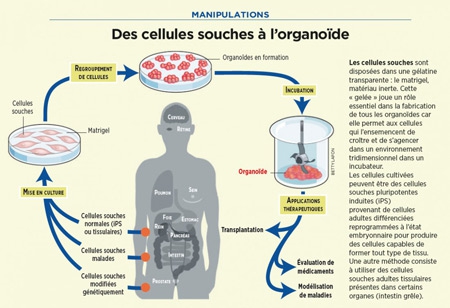
Des cellules souches à l'organoïde
Cliquez sur l'infographie pour l'agrandir (©Betty Lafon / Sciences et Avenir)
Objectif de ces recherches : tester des médicaments, servir de modèles de maladies, notamment des cancers, ou être utilisés comme thérapie cellulaire.
Source : Gozlan M. (2016) La fabrique de micro-organes humains Sciences et Avenir n° 828 — février 2016, pp. 70-72.
15:12 Publié dans Actualité des Sciences, Biologie, Médecine, Sexualité-embryologie | Tags : cellules souches, cellule souche adulte, ips, culture organotypique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
09/01/2016
Cellules souches pluripotentes : une recette de fabrication qui fait polémique
 Cellules souches pluripotentes :
Cellules souches pluripotentes :
une recette de fabrication qui fait polémique
"Une annonce à la limite du malhonnête". C'est en ces termes que Mathilde Girard, chargée de recherche en modélisation pathologique iPS à l'institut I-Stem à Evry, qualifie le communiqué de la prestigieuse École polytechnique fédérale de Lausanne (EPFL). L'EPFL faisait savoir qu'une équipe de recherche était parvenue à produire des cellules souches pluripotentes induites (capables de se différencier en types de cellules qui composent un organisme adulte, exactement comme une cellule souche embryonnaire) en comprimant certaines cellules. Des travaux intéressants publiés dans la revue Nature materials mais dont l'annonce -"survendue", dixit Mathilde Girard - a soulevé un vent de critiques de la part de spécialistes francophones et anglophones des cellules souches.
Pour en savoir plus : Article de Lise Loumé sur le site de Sciences et Avenir.
17:42 Publié dans Biologie, Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
29/11/2015
Un implant ostéo-articulaire vivant pour régénérer le cartilage
Un implant ostéo-articulaire vivant
pour régénérer le cartilage
Une nouvelle technique pour régénérer totalement une articulation abîmée — os et cartilage — en quelques mois. Il s'agit d'un implant vivant et en 3D qui recouvrira bientôt les articulations abîmées.
Réparer le cartilage d’une articulation en cas de lésion ou de dégénérescence n’est pas une mince affaire ! Face à cette difficulté, une équipe de chercheurs spécialisés en nanomédecine régénérative, travaillant au sein de l’Université de Strasbourg et des hôpitaux universitaires de Strasbourg sous la direction de Nadia Benkirane-Jessel[1], a imaginé une nouvelle approche d’implant ostéo-articulaire.
Réparer toute l’articulation
Actuellement, la stratégie de reconstruction du cartilage (en dehors de la pose d’une prothèse) consiste à injecter dans l’articulation du patient un échantillon de ses propres cellules de cartilage (chondrocytes).
Mais le résultat est souvent décevant car la régénération a alors lieu sur un os lésé. "En cas de dégénérescence du cartilage, il est très rare de développer des symptômes au stade de l’érosion : la douleur apparaît quand le cartilage a totalement disparu et que l’os sous-chondral, situé juste en dessous, commence à s’abimer. Il faut donc s’attaquer en parallèle à la réparation des deux couches : l’os et le cartilage", explique Nadia Jessel-Benkirane, coauteur des travaux avec Laetitia Keller.
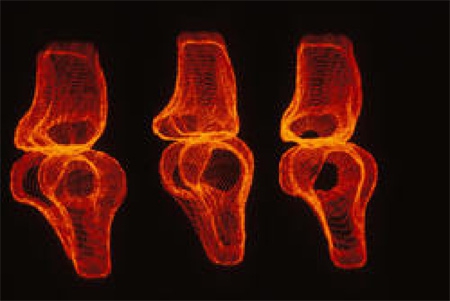
Biomécanique de la pathologie ostéoarticulaire
Cliché © Inserm, MC Hobatho
Deux compartiments superposés
Pour cela, les chercheurs ont créé un implant composé de deux compartiments :
- Le premier est une membrane nanofibreuse, à base de collagène ou de polymères, dotée de nanoréservoirs de facteurs de croissance osseux, pour favoriser la réparation de l’os.
- Le second est une couche d’hydrogel (alginate) renfermant de l’acide hyaluronique et des cellules souches dérivées de la moelle osseuse du patient, favorisant la régénération du cartilage.
L’organisation en trois dimensions du dispositif favorise la croissance et la différenciation des cellules souches en cellules du cartilage. « Imaginez la membrane nanofibreuse comme une feuille de papier déposée par le chirurgien sur l’os abimé. Immédiatement après, il dépose la seconde couche contenant les cellules souches et termine son intervention. Ensuite, le travail se fait seul ! L’objectif est d’obtenir une régénération totale de l’articulation -os sous-chondral et cartilage- dans les mois qui suivent », explique la chercheuse.
Vers un premier essai clinique
Les matériaux utilisés dans cet implant sont déjà autorisés par les autorités de santé et utilisés en clinique. Seule la membrane polymérique fabriquée au sein du laboratoire doit encore obtenir un marquage CE, compte tenu de sa nouveauté. En attendant, les chercheurs ont démarré les essais précliniques avec le soutien de la société d'accélération de transfert de technologies (SATT) Conectus, en Alsace. L’implant a été testé dans différents modèles animaux, en utilisant cette membrane active innovante ou une membrane de collagène d’origine animale. Cette dernière semble "moins sûre et moins efficace car elle est d’épaisseur unique. L’épaisseur de la membrane polymérique peut quant à elle être modifiée selon les besoins", précise Nadia Jessel-Benkirane.
Les chercheurs d’ores et déjà ont breveté cet implant et viennent de créer une start-up, ARTiOS Nanomed SAS, pour concrétiser ce projet. Début 2016, une demande de financement sera déposée dans le cadre des programmes européens de recherche Horizon 2020, afin d’être en mesure de lancer un premier essai chez l’Homme. Il inclura 62 patients présentant des lésions du genou, dans trois pays dont la France. "Nous pourrons ainsi tester la faisabilité, la sécurité et l’efficacité de notre implant sur cette articulation et dans une population homogène, avant d’étendre nos travaux à d’autres articulations", prévoit la chercheuse.
Source :
- Keller et coll. Double compartmented and hybrid implant outfitted with well-organized 3D stem cells for osteochondral regenerative nanomedicine, Nanomedicine, édition en ligne du 7 septembre 2015
[1] Unité 1109 Inserm/Université de Strasbourg
12:04 Publié dans Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
09/09/2015
Le microbiote intestinal
Le microbiote intestinal
(Dernier ajout : mars 2016)
Nous avons plus de bactéries dans notre corps que de nos propres cellules. Sur la peau, les muqueuses, et surtout l'intestin. Au cœur de nos entrailles, quelque 13 000 milliards de microbes vivent en permanence avec nous, nichés à la surface de nos intestins — le désormais fameux microbiote intestinal — une surface de 200 m2, équivalant à celle d'un court de tennis. De sorte que nos bactéries intestinales résidentes (500-1000 sp.) sont plus nombreuses que les cellules somatiques et les cellules germinales humaines (10 000 milliards) et représentent un génome microbien combiné (métagénome) supérieur (x 1,3) au génome humain.

Villosités intestinales
Remarque :
Durant de nombreuses années, on considérait que le microbiote intestinal était composé de 100 000 miliards de microbes. Or en 2015, trois chercheurs de l’Institut des sciences Weizman (Rehovot, Israël) se sont rendu compte que ce chiffre traînait dans la littérature biomédicale depuis 1977 et qu’il avait été lui-même repris d’un article publié en 1972. Bref, depuis tout ce temps, tout se monde se copie, sans que personne n’aille vérifier ce qu’il en est vraiment sur la base des données disponibles les plus fiables et les plus récentes. Les chercheurs israéliens ont alors décidé d'effectuer de nouveaux calculs, et leur résultat bat en brèche ce chiffre de 1014 bactéries. Le rapport bactéries/cellules serait plus proche de 1,3/1. En d’autres termes, il y aurait sensiblement le même nombre de bactéries que de cellules humaines.
Cliché © Institut Pasteur
Pourquoi hébergeons-nous une flore intestinale ?
 Dans la relation symbiotique entre bactéries résidentes et l'hôte eucaryote, les bactéries profitent d'un environnement stable (température, oxygène, pH, nutriments approvisionnement). Ces microbes intestinaux vivent pour la plupart en bonne intelligence avec nous et sont en quelque sorte nos alliés : ils jouent un rôle crucial dans notre nutrition et notre santé. Sans notre microbiote intestinal, nous serions incapables d'assimiler certains aliments que seules les bactéries savent digérer. Elles ont un rôle fondamental dans la conversion des aliments en nutriments et en énergie, et assurent la synthèse de vitamines indispensables à l'organisme. Notre microbiote intestinal constitue de plus une barrière contre les microbes pathogènes, et participe à la maturation de notre système immunitaire. Il assure donc des fonctions essentielles pour celui qui l'héberge. L'hôte y gagne une extension métabolique, une capacité digestive, une inhibition compétitive contre les microbes pathogènes / allogéniques (effet barrière) et la stimulation contrôlée de la muqueuse du système immunitaire / systémique.
Dans la relation symbiotique entre bactéries résidentes et l'hôte eucaryote, les bactéries profitent d'un environnement stable (température, oxygène, pH, nutriments approvisionnement). Ces microbes intestinaux vivent pour la plupart en bonne intelligence avec nous et sont en quelque sorte nos alliés : ils jouent un rôle crucial dans notre nutrition et notre santé. Sans notre microbiote intestinal, nous serions incapables d'assimiler certains aliments que seules les bactéries savent digérer. Elles ont un rôle fondamental dans la conversion des aliments en nutriments et en énergie, et assurent la synthèse de vitamines indispensables à l'organisme. Notre microbiote intestinal constitue de plus une barrière contre les microbes pathogènes, et participe à la maturation de notre système immunitaire. Il assure donc des fonctions essentielles pour celui qui l'héberge. L'hôte y gagne une extension métabolique, une capacité digestive, une inhibition compétitive contre les microbes pathogènes / allogéniques (effet barrière) et la stimulation contrôlée de la muqueuse du système immunitaire / systémique.
La coévolution a créé un "paradoxe immunologique ou "inflammation physiologique" chez les hôtes mammifères qui oblige à conjuguer la tolérance aux bactéries commensales et la reconnaissance rapide et efficace et l'élimination des agents pathogènes bactériens entraînant une inflammation.
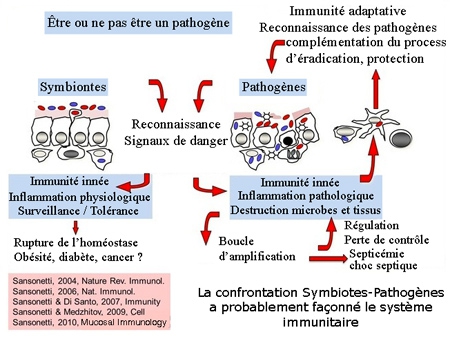
D'après P. Sansonnetti
De sorte que l'on peut considérer le microbiote intestinal comme un organe supplémentaire virtuel à part entière, non palpable mais avoisinant les deux kilogrammes chez l'adulte, un poids supérieur à celui de notre cerveau... La flore intestinale représente une activité métabolique collective équivalente à un organe.
1000 espèces de bactéries
Un peu plus de 1000 espèces bactériennes entrent dans sa composition chez l'Homme. Chacun d'entre nous en héberge près de 200. Chaque individu a donc un microbiote qui lui est propre en termes de combinaison d'espèces.
Ces données ont été révélées par deux grands programmes, l'un aux États-Unis[1], l'autre en Europe[2], visant notamment à identifier l'ensemble des gènes du microbiote, qu'on nomme « microbiome ». Dès 2010, à partir de l'analyse des microbiotes de 124 européens, le consortium MetaHit établissait que le microbiome - notre « autre » génome - comprenait 3,3 millions de gènes (150 fois plus que le génome humain).
Le poids du microbiote intestinal avoisine les deux kilogrammes chez l'adulte, un poids supérieur à celui de notre cerveau... Il est essentiellement constitué de bactéries, mais contient aussi virus, parasites ou champignons microscopiques.
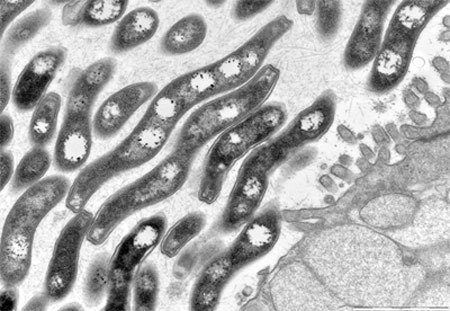
Microbiote et villosités intestinales
(Coupe au microscope électronique)
Le microbiote intestinal humain est dominé par cinq phyla bactériens (Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria et Verrucomicrobia) et un Archaea (Euryarchaeota).
Les groupes bactériens les moins répandus sont distribués parmi les Cyanobacteria, Fusobacteria, Lentisphaerae, spirochaetes et TM7.
Le phylum des Firmicutes comprend les genres Ruminococcus, Clostridium, Lactobacillus (dont plusieurs sont des probiotiques), les producteurs de butyrate Eubacterium, Faecalibacterium et Roseburia.
Le phylum des Bacteroidetes comprend les genres Bacteroides, Prevotella et Xylanibacter dégradant une série de glycanes complexes.
Le phylum des Actinobacteria comprend les genres Coninsella et Bifidobacterium (contenant des souches probiotiques).
Le phylum des Proteobacteria comprend les genres Escherichia (famille des entérobactéries) et desulfovibrio (contenant des bactéries réductrices de sulfates), Verrucomicrobia (récemment découvert) et Akkermanala (specialiste de la dégradation de mucus).
Le phylum des Euryarchaeota contient le genre Methanobrevibacter (impliqué dans la poursuite de la méthanogenèse intestinale).
Cette flore intestinale fait l'objet d'un nombre croissant d'études. Et pour cause : un déséquilibre de ce microbiote a été associé à de très nombreuses maladies — maladies inflammatoires de l'intestin mais aussi obésité, diabète, sclérose en plaques, allergies, cancer du côlon, et même maladies psychiatriques (autisme, dépression...). Contre elles, des traitements radicalement nouveaux sont désormais envisagés.
Comment se constitue ce microbiote intestinal ?
 Presque stérile in utero, l'intestin est colonisé à la naissance. Dès que les membranes fœtales se rompent, la colonisation bactérienne commence. Le mode d'accouchement (les enfants nés par césarienne auraient un microbiote différent de ceux nés par voie vaginale), le type d'alimentation (lait maternel ou lait en bouteille, alimentation de sevrage), le microbiote maternel, l'environnement et l'hygiène de l'environnement néonatal, la prise de médicaments et d'antibiotiques influencent cette colonisation microbienne chez le nouveau-né.
Presque stérile in utero, l'intestin est colonisé à la naissance. Dès que les membranes fœtales se rompent, la colonisation bactérienne commence. Le mode d'accouchement (les enfants nés par césarienne auraient un microbiote différent de ceux nés par voie vaginale), le type d'alimentation (lait maternel ou lait en bouteille, alimentation de sevrage), le microbiote maternel, l'environnement et l'hygiène de l'environnement néonatal, la prise de médicaments et d'antibiotiques influencent cette colonisation microbienne chez le nouveau-né.
Une exposition à une faible diversité bactérienne dans la période néonatale peut empêcher ou retarder la maturation du système immunitaire et favoriser des réponses rnucosales aberrantes à des allergènes ou des auto-antigènes et l'apparition de pathologies associées.
La composition du microbiote intestinal se complexifie ensuite progressivement avec l'âge, mais s'établit principalement au cours des 3 premières années de vie. Cette composition est ensuite relativement stable chez l'adulte, mais peut varier provisoirement en fonction des conditions extérieures : régime alimentaire, infections virales ou bactériennes, prise d'antibiotiques... Le microbiote tend néanmoins à revenir à son état initial en 1 à 2 mois. Mais une succession de déséquilibres transitoires finit par l'altérer, avec des conséquences néfastes sur la santé.
L'appauvrissement du microbiote en question
Ces déséquilibres sont particulièrement cruciaux dans la période critique de 0 à 3 ans. L'administration d'un traitement antibiotique à des nouveau-nés de faible poids entraîne une diminution drastique de leur microbiote intestinal, qui perd en densité et en diversité, ce qui pourrait favoriser la genèse de maladies inflammatoires intestinales, de certaines formes d'obésité ou encore de l'asthme: des études ont par exemple montré que le microbiote intestinal des enfants asthmatiques différait de celui des enfants sains. Chez l'adulte, les études épidémiologiques et expérimentales se multiplient, mettant en cause des déficiences du microbiote intestinal (une perte de sa diversité le plus souvent) dans les maladies inflammatoires de l'intestin (maladie de Crohn, rectocolite hémorragique...), l'obésité, le diabète de type II, la sclérose en plaques, le cancer du côlon, certaines maladies cardiovasculaires (voir plus loin le paragraphe "de l'athérosclérose au cancer du côlon).
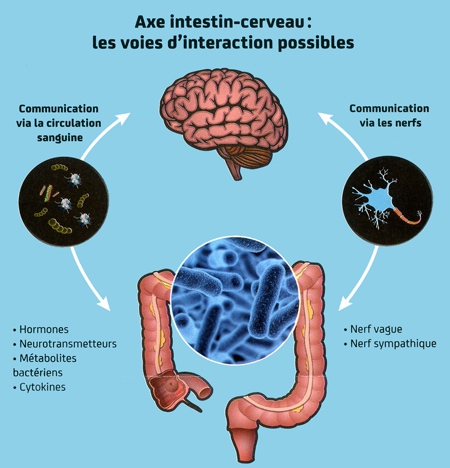
Un axe « intestin-cerveau »
Plus étonnant encore, le microbiote intestinal interviendrait sur les fonctions cérébrales et le comportement. Des expériences sur des modèles expérimentaux ont montré que perturber la composition des populations de bactéries intestinales — avec des antibiotiques par exemple — pouvait induire un comportement anxieux. Des études de plus en plus nombreuses pointent l'influence du microbiote dans l'émergence de pathologies psychiatriques comme les troubles de l'humeur, la dépression, l'autisme ou la schizophrénie. On parle aujourd'hui d'un "axe intestin-cerveau" où s'établirait un "dialogue" entre nos bactéries intestinales et notre cerveau. Comment cette communication a-t-elle lieu ? Les hypothèses sont nombreuses, mais rien n'est aujourd'hui établi.
Des stratégies thérapeutiques nouvelles
De l'obésité à la dépression en passant par l'asthme ou la sclérose en plaques, toutes les études impliquant le microbiote amènent une même interrogation : pourrait-on soigner certaines maladies en modifiant ce microbiote ? De nouvelles stratégies sont envisagées : des interventions nutritionnelles, l'administration de probiotiques - c'est-à-dire de microbes vivants ayant un effet bénéfique sur la santé (voir p. 9) —, de pré biotiques — des composés qui stimulent la croissance de nos « bonnes » bactéries — ou d'antibiotiques. (voir paragraphe suivant : Comment nos bactéries intestinales communiquent-elles avec notre cerveau ?).
L'objectif est de renforcer et favoriser les populations microbiennes bénéfiques. Soigner un jour la dépression ou l'asthme avec des compléments alimentaires semble aujourd'hui du domaine du possible et de nombreuses expérimentations visant à modifier le microbiote intestinal sont en cours.
Une autre thérapie, plus radicale, a le vent en poupe ; la transplantation fécale, qui consiste à remplacer la flore intestinale d'un malade par celle d'un donneur. À l'essai pour diverses maladies, elle a récemment fait ses preuves pour soigner des patients souffrant d'une infection chronique causée par la bactérie Clostridium difficile. Cette bactérie responsable de nausées et de diarrhées sévères pouvant entraîner la mort est de plus en plus résistante à l'antibiothérapie. La greffe de microbiote permet alors de l'éradiquer dans 90% des cas. Quelques milliers de personnes dans le monde, y compris en France, ont déjà bénéficié de cette technique contre Clostridium difficile. Administration de probiotiques ou greffes de microbiotes : des thérapies nouvelles sont en train de naître, mais la manipulation du microbiote — un écosystème complexe s'il en est — n'en est qu'à ses balbutiements. L'exploration de notre monde intérieur ne fait que commencer.
Comment nos bactéries intestinales communiquent-elles avec notre cerveau ?
« Il y a plusieurs façons possibles pour nos bactéries de communiquer avec le cerveau », souligne le neurobiologiste Uwe Maskos. « Certaines bactéries du microbiote intestinal sécrètent par exemple des neurotransmetteurs comme la sérotonine, dont certains pourraient agir sur le nerf vague qui assure une communication bidirectionnelle cerveau-intestin. Des composés microbiens peuvent aussi agir directement sur les autres cellules du tube digestif, comme les neurones qui permettent à l'intestin de se contracter ou les cellules immunitaires qui montent la garde. Ou encore certains produits bactériens issus de la lumière intestinales et accédant à la circulation sanguine agiraient directement sur le cerveau, ce qui pourrait être le cas pour un composé bactérien que nous étudions ici, à l'Institut Pasteur».
Ces trois dernières années en effet, un projet collaboratif entre microbiologistes, immunologistes et neurobiologistes[3] de l'Institut Pasteur a porté sur une molécule de la paroi des bactéries : le "peptidoglycane". «Relargué lors de la division bactérienne, il est sans cesse sécrété par le microbiote intestinal», explique le microbiologiste Ivo Gomperts Boneca. « Et nous avons montré qu'il était capable d'agir à distance sur le cerveau ». Les chercheurs pasteuriens ont mis en évidence que des récepteurs microbiens, les récepteurs "NOD", découverts il y a une quinzaine d'années à l'Institut Pasteur, étaient présents sur certains neurones du cerveau. D'après leurs résultats préliminaires, obtenus dans des modèles expérimentaux, en l'absence de ces récepteurs, des changements de comportement apparaissent et les phases du sommeil paradoxal (le sommeil des rêves) ont tendance à disparaître. Le peptidoglycane passe-t-il la barrière hémato-encéphalique pour agir directement sur ces récepteurs dans le cerveau ou bien existe-t-il des étapes intermédiaires, avec des médiateurs ? C'est ce que les chercheurs essayent de comprendre. Déchiffrer le dialogue moléculaire entre microbiote et cerveau est un enjeu majeur si l'on veut à terme proposer de nouvelles stratégies thérapeutiques pour traiter des maladies psychiatriques.

Cliché © Institut Pasteur
Chimiothérapie : Quand nos bactéries intestinales viennent en renfort
Les traitements de chimiothérapie anticancéreuse agiraient plus efficacement à l'aide de la flore intestinale. C'est l'étonnante découverte de chercheurs de Gustave Roussy, de l'Inserm, de l'Institut Pasteur et de l'Inra[4] : ils ont démontré dès 2013 que l'efficacité d'une des molécules les plus utilisées en chimiothérapie anticancéreuse (la cyclophosphamide) repose en partie sur sa capacité à entraîner le passage de certaines bactéries du microbiote intestinal vers la circulation sanguine et les ganglions. Une fois dans les ganglions lymphatiques, ces bactéries stimulent de nouvelles défenses immunitaires qui vont aider l'organisme à combattre encore mieux la tumeur cancéreuse. Un peu comme un adjuvant pour vaccin. Les chercheurs ont aussi montré qu'à l'inverse, en supprimant certaines bactéries du microbiote intestinal dans des modèles expérimentaux, l'efficacité de la chimiothérapie diminuait. «Maintenant que les bactéries "bénéfiques" potentialisant la réponse immunitaire et tumorale ont été identifiées, on devrait réussir rapidement à en fournir plus à l'organisme, notamment via des pro- ou des pré-biotiques et/ou une alimentation spécifique », explique le Dr Ivo Gomperts Boneca à l'Institut Pasteur. « Nous avons déjà identifié deux souches bactériennes (un entérocoque et un lactobacille) qui améliorent la réponse à un traitement assez classique. »

Cliché © Institut Pasteur
Un grand programme "Microbes et cerveau" lancé à l'Institut Pasteur
Quel est l'impact du microbiote sur l'activité du cerveau ? Comment des micro-organismes — en sécrétant des molécules ou par d'autres mécanismes — peuvent-ils affecter les fonctions cérébrales ? Quel est le lien réel entre microbiote et maladies mentales ?
Pour répondre à de telles questions, l'Institut Pasteur vient de lancer le Grand Programme Fédérateur Microbes et cerveau[5], réunissant des chercheurs de différents départements de l'Institut Pasteur à Paris (Neuroscience, Microbiologie, Immunologie...), des scientifiques du Réseau International des Instituts Pasteur et des collaborateurs extérieurs. Plusieurs projets de recherche sont tancés. L'un vise à comprendre la sensibilité des nouveau-nés aux méningites bactériennes, liée à l'immaturité du microbiote intestinal, en étudiant l'impact de ce microbiote sur la barrière hémato-encéphalique et sur l'immunité du système nerveux central. D'autres concernent par exemple la possible contribution du microbiote intestinal dans la dépendance aux drogues via des récepteurs dans le cerveau (récepteurs nicotiniques à l'acétylcholine), ou bien encore le lien entre microorganismes et schizophrénie (avec l'hôpital Henri Mondor à Créteil), deux projets qui évalueront également, sur des modèles expérimentaux, l'utilisation thérapeutique de probiotiques.
De l'athérosclérose au cancer du colon
« Mon équipe est formée à l'analyse moléculaire des échanges entre les microbes et l'hôte, et nous avons longtemps travaillé sur des microbes pathogènes avant d'adapter nos connaissances à l'étude du microbiote », raconte le Pr Philippe Sansonetti, responsable de l'Unité de Pathogénie microbienne moléculaire à l'Institut Pasteur. « Un de nos projets porte par exemple sur une bactérie intestinale appelée Lactobacillus casei. Nous avons identifié les gènes qui lui permettent de coloniser l'intestin, puis nous avons montré que cette bactérie jouait un rôle sur le métabolisme des lipides et particulièrement sur la façon dont l'épithélium intestinal les perçoit, les absorbe, les métabolise et les transfère dans la circulation. Nous étudions actuellement l'impact de la quantité et la qualité de ces lipides sur l'installation ou l'aggravation éventuelle des plaques d'athérome, dépôts de graisse sur la paroi des vaisseaux sanguins à l'origine de maladies cardio-vasculaires.… »
Ces travaux sont d'ailleurs inscrits dans un programme européen sur l'athérosclérose - Atheroflux - qui vise à identifier des facteurs de risque et des biomarqueurs de l'athérosclérose et à découvrir de nouvelles pistes de recherche sur cette pathologie.
Un autre projet de l'équipe de Philippe Sansonetti concerne les "cryptes intestinales", situées à la base des microvillosités intestinales : y sont stockées les cellules souches de l'épithélium intestinal, qui servent à son renouvellement. Là encore, le microbiote jouerait un rôle. « En collaboration avec le service de gastroentérologie de l'hôpital Henri Mondor à Créteil, nous avons identifié certaines bactéries dans le côlon dont on pense qu'elles stabilisent les conditions intestinales et protègent les cellules souches », précise Philippe Sansonetti. « La rupture de cet équilibre au niveau de la crypte pourrait être en cause dans des maladies inflammatoires de l'intestin et le cancer du côlon. »
Cliché © Institut Pasteur
Nous entrons dans une nouvelle ère thérapeutique
ENTRETIEN avec Gérard Eberl Chef de l'Unité Microenvironnement et immunité à l'Institut Pasteur
 Vous êtes un des scientifiques travaillant sur le Grand Programme Fédérateur "Microbes et cerveau" lancé à l'Institut Pasteur (voir paragraphe précédent : Un grand programme "Microbes et cerveau" lancé à l'Institut Pasteur). Que sait-on aujourd'hui des relations entre nos bactéries intestinales et notre cerveau ?
Vous êtes un des scientifiques travaillant sur le Grand Programme Fédérateur "Microbes et cerveau" lancé à l'Institut Pasteur (voir paragraphe précédent : Un grand programme "Microbes et cerveau" lancé à l'Institut Pasteur). Que sait-on aujourd'hui des relations entre nos bactéries intestinales et notre cerveau ?
On sait encore très peu de choses. Des études épidémiologiques montrent que les maladies mentales, comme l'autisme par exemple, sont associées à des problèmes intestinaux. Et nous savons tous que le stress passe souvent par le ventre. Il existe également une comorbidité entre les maladies gastro-intestinales chroniques et des symptômes psychiatriques. Mais les mécanismes d'interaction entre microbiote et cerveau sont inconnus. Des composés bactériens issus de la lumière intestinale et qui accèdent à la circulation sanguine pourraient agir directement sur la physiologie et le cerveau de l'hôte, comme le suggèrent les premiers résultats d'études que nous menons à l'Institut Pasteur (voir encadré p. 2). Grâce aux techniques modernes de manipulation du microbiote et d'analyse des molécules impliquées dans le dialogue microbe-hôte, l'impact du microbiote sur le cerveau est un champ d'investigation qui connaît un nouvel essor. À l'Institut Pasteur, nous avons la chance d'avoir des chercheurs de disciplines très variées. Un atout majeur du nouveau programme "Microbes et cerveau" vient précisément de la synergie entre différentes expertises, en associant notamment des microbiologistes, des immunologistes et des neurobiologistes.
Plus globalement, en tant qu'immunologiste, comment abordez-vous l'étude du microbiote ?
Je vois le système immunitaire comme une interface entre le microbiote et l'hôte. Le système immunitaire produit des récepteurs programmés pour percevoir des bactéries ou des virus, et génère des millions de nouveaux récepteurs tous les jours. En ce sens, il est essentiellement un système de reconnaissance qui perçoit l'environnement et traduit ce qu'il voit à son hôte. De plus, on s'aperçoit aujourd'hui qu'il y a une période très importante après la naissance, pendant laquelle le système immunitaire continue à se développer. Si l'on altère le microbiote pendant cette période, on observe des déviations du système immunitaire à long terme. Par exemple, les enfants traités tôt avec des antibiotiques auront une tendance à développer des allergies. Le microbiote joue donc un rôle très important dans sa maturation. Un des projets de mon laboratoire est d'identifier les bactéries qui influencent le développement du système immunitaire pendant cette période critique, de comprendre comment se fait cette interaction et quelles sont les conséquences si cette interaction est altérée.
Quid des applications thérapeutiques ? Sont-elles encore lointaines ?
Non, nous n'en sommes pas loin, il y a déjà des données très intéressantes. Comme le transfert de microbiote chez des patients quasiment inguérissables auparavant car infectés par une bactérie très résistante aux antibiotiques, Clostridium difficile. Un transfert de microbiote à partir de gens sains permet de chasser le pathogène. Comment ça marche ? Des bactéries du microbiote vont prendre sa place et créer un environnement défavorable au pathogène. Chaque microbe a sa petite niche, son petit chez soi. D'ailleurs, Clostridium difficile a des cousins Clostridium dans le microbiote, mais qui ne sont pas pathogènes et vont entrer en compétition pour la même niche. Nous entrons donc dans une nouvelle ère thérapeutique. Avec l'antibiotique, on tue de nombreuses bactéries ; avec les nouvelles thérapies agissant sur le microbiote comme les probiotiques, on amène une bonne bactérie qui chasse la mauvaise.
[1] The Human Microbiome Project
[2] The Metagenomics of the Human Intestinal Tract (MetaHIT) en Europe
[3] Équipes d'Ivo Gomperts Boneca lUnirô Biologie et génétique de la paroi bactérienne), de Gérard Eberl (Unité Microenvironnement et Immunité) avec Grégoire Chevalier, de Pierre-Marie iledo (Unité Perception et mémoire) avec Gabriel Lepousez, et d'Uwe Maskos (Unité Neurobiologie intégrative des systèmes cholinergiques) avec Morgane Besson.
[4] Équipe dirigée par le Pr Laurence Zitvogel, à l'Institut Gustave Roussy et directrice de l'Unité Inserm 1015 Immunologie des tumeurs et immunothérapie, en collaboration avec l'Institut Pasteur (Dr Ivo Gomperts Boneca, unité Biologie et génétique de la paroi bactérienne) et des chercheurs del'INRA (Dr Patricia Lepage et Dr Joël Doré, Unité Micalis Microbiologie de l'alimentation au service de la Santé).
[5] Ce programme a reçu le soutien de la Fondation Daniel & Nina Caressa
Source : La lettre de l'Institut Pasteur n° 90 septembre 2015.
Voir aussi le blog de Max Gozlan.
En savoir plus :
Le magazine Science & Vie consacre un dossier complet sur le microbiote intestinal dans son numéro d'avril 2016
Science & Vie, Les super-pouvoirs du ventre n° 1183 avril 2016 pp 48-66.
08:55 Publié dans Médecine | Tags : microbiote intestinal, microbiome, institut pasteur | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
04/03/2015
L'Ambroisie bientôt en Franche-Comté ?
L'Ambroisie bientôt en Franche-Comté ?
Dernière mise à jour : 6 septembre 2016

Ambrosia artemisiifolia
Règlementation récente sur les plantes exotiques envahissantes (Bruno Chauvel & Rebecca Bilon, 2015)
Les invasions biologiques sont généralement considérées comme une cause majeure d'appauvrissement de la diversité biologique, juste après la destruction des habitats naturels. Les animaux ou végétaux, introduits involontairement ou volontairement pour des raisons agricoles, horticoles ou de loisirs peuvent au cours du temps en proliférant dans les milieux naturels avoir des impacts majeurs en modifiant les écosystèmes.
Certaines de ces espèces (ragondins, renouée du Japon...) ont des impacts à des échelles spatiales importantes ce qui a entraîné une réaction au niveau européen et la mise en place d'un règlement (CIE. ?1143/2014) relatif à la « prévention et à la gestion de l'introduction et de la propagation des espèces exotiques envahissantes »
Ce règlement vise les espèces exotiques « dont l'introduction ou la propagation s'est révélée constituer une menace pour la biodiversité » et ne vise donc pas des espèces natives dont l'aire de répartition serait en augmentation du fait de modifications climatiques par exemple. Les espèces (animales, végétales, champignons) ont été listées au niveau de l'Union le 2 janvier 2016. Cette liste d'Union sera revue tous les six ans. Chaque espèce retenue sera décrite avec les risques de toute nature qu'elle engendre.
Du point de vue du contrôle, chaque État membre est tenu de prendre des mesures de gestion visant à l'éradication ou au contrôle de l'espèce exotique envahissante par des actions physiques, chimiques ou biologiques, tout en respectant les règles environnementales. Enfin, les États membres peuvent établir une liste nationale d'espèces envahissantes pour lesquelles ils peuvent appliquer, à l'échelle de leur territoire, des mesures de gestion similaires à celles prises pour les espèces de la liste de l'Union.
À noter que l'Assemblée nationale a adopté en avril 2015 dans le cadre du projet de loi de modernisation du système de santé un projet d'article sur la "lutte contre les espèces végétales et animales dont la prolifération est nuisible à la santé humaine". Sont visées dans ce projet de loi des espèces telles que les ambroisies, la berce du Caucase ou le datura officinal.
En France, depuis juin 2011, afin de renforcer la coordination des moyens de lutte contre l'ambroisie à feuilles d'armoise, le Ministère chargé de la Santé et l'Institut national de la recherche agronomique (Inra) ont mis en place l'Observatoire des ambroisies qui a pour rôle de mettre en valeur et favoriser les actions efficaces pour un meilleur contrôle du développement cette plante au pollen très allergisant et une réduction de son impact sur la santé et les milieux.
Qu'est-ce qu'une plante envahissante ?
L'arrivée de nouvelles plantes est un phénomène naturel qui a contribué au cours du temps à la formation des communautés végétales telles que nous les connaissons aujourd'hui. Les échanges commerciaux entre continents ces cinq derniers siècles ont contribué à l'accroissement de l'arrivée de néophytes[1] telles que l'ambroisie à feuilles d'armoise (Ambrosia artemisiifolia L.) qui progresse actuellement en Bourgogne Franche-Comté.
[1] Néophyte : plante exotique introduite accidentellement ou intentionnellement dans l'environnement naturel.
Pour être reconnue comme envahissante, une espèce végétale doit bénéficier d'un ou de plusieurs vecteur(s) d'introduction, pouvoir s'installer dans une zone favorable (colonisation) et elle doit pouvoir se reproduire et se disperser (naturalisation). C'est le cas de l'Ambroisie à feuilles d'armoise, plante annuelle dont les semences en provenance d'Amérique du Nord ont été introduites vers 1860 avec du trèfle violet. L'Ambroisie a ensuite réussi à s'installer principalement en région Rhône-Alpes avant de se disperser sur tout le territoire, essentiellement grâce aux activités humaines : transport par les machines agricoles, déplacement de terres végétales, dispersion par les rivières, passage de véhicules le long des routes et de façon plus anecdotique dans les mélanges de graines pour oiseaux.
Le cas spécifique de l'Ambroisie à feuilles d'Armoise
Originaire d'Amérique du Nord, l'Ambroisie à feuilles d'Armoise se trouve désormais également en Australie, en Asie, en Amérique du Sud, et en Europe, où elle a été introduite à la fin du XIXe siècle. Très bien implantée en France, dans la région de Lyon, dans le nord de l'Italie et en Hongrie, elle est reconnaissable par sa taille, qui peut atteindre deux mètres de hauteur et par ses petites fleurs.
L'Ambroisie s'adapte aux sols riches en azote des cultures, mais aussi aux grèves sableuses oligotrophes des rivières. C'est une plante rudérale[1] et pionnière[2] qui supporte bien les stress : manque d'eau, broyage ou travail du sol. L'ambroisie disparaît dès que la végétation naturelle prend le dessus (prairies ou forêts). Sa capacité à produire des semences malgré les opérations de gestion et la longue durée de vie des semences dans le sol en font une plante qu'il faut gérer dès son installation sous peine de devoir ensuite consentir des efforts sur le long terme.
[1] Rudérale : plante qui pousse spontanément dans les friches, les décombres le long des chemins, souvent à proximité des lieux habités par l'homme.
[2] Espèce pionnière : espèce capable de coloniser un milieu instable, très pauvre et capable de supporter des conditions de croissance très difficiles.
La croissance de l'Ambroisie pourrait en partie s'expliquer par le réchauffement climatique et donc par des températures plus favorables à son développement, selon les scientifiques qui ont travaillé sur l'étude.
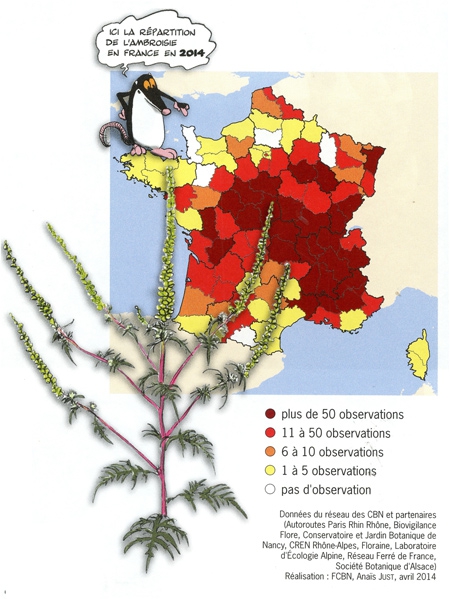
Quatre fois plus de pollen d'ambroisie en Europe d'ici 2050
Le Figaro.fr Santé Tristan Vey - le 26/05/2015
L'Ambroisie est surtout connue pour son pollen allergisant responsable de rhinite, de toux et d'asthme qui représente un coût de plusieurs millions d'euros en termes de santé en Rhône-Alpes. C'est aussi une mauvaise herbe très agressive dans les cultures de printemps et plus particulièrement dans le tournesol où la proximité botanique entre les deux espèces (famille des Asteraceae) rend la gestion très complexe. Par contre, l'Ambroisie semble, contrairement à d'autres envahissantes, avoir un effet réduit sur la biodiversité des écosystèmes. Sa présence dans des milieux très perturbés par l'homme fait qu'elle n'aurait que des effets réduits sur les communautés naturelles.
Si rien n'est fait pour l'en empêcher, l'ambroisie à feuilles d'armoise, dont le pollen est un puissant allergisant, se répandra en Europe dans les prochaines décennies à la faveur du réchauffement climatique.
Dans l'Hexagone, l'Ambroisie a progressivement gagné les régions Rhône-Alpes, l'Auvergne et la Bourgogne, comme l'illustrent bien ces cartes de l'Observatoire des ambroisies de 1860 à aujourd'hui.
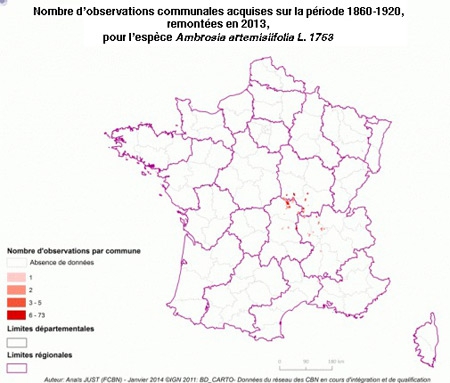
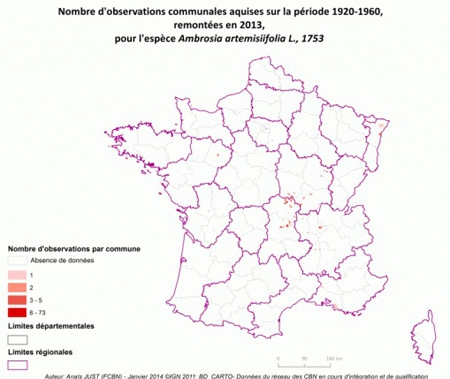

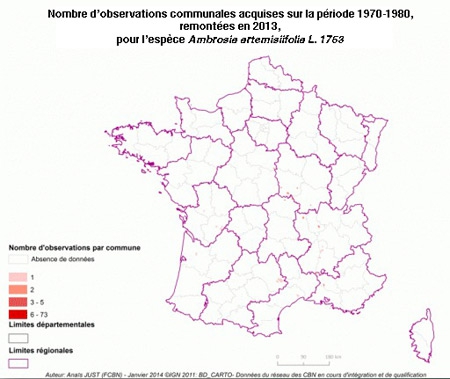
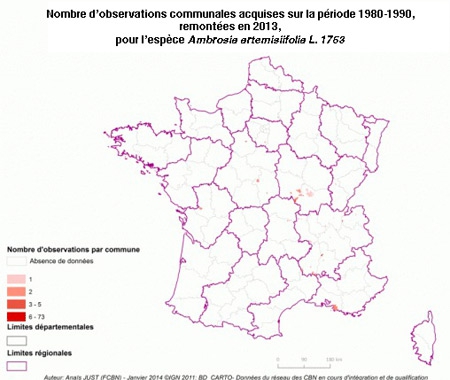
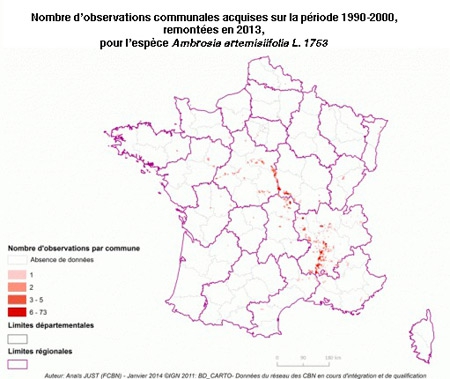

D'ici 2050, la concentration moyenne en pollen d'ambroisie pourrait quadrupler en Europe, d'après une étude européenne publiée en mai 2015 dans Nature Climate Change. Une estimation inquiétante quand on sait que le pollen de cette plante importée d'Amérique du Nord à la fin du XIXe siècle est particulièrement allergisant. À titre d'exemple, dans la région Rhône-Alpes où elle est déjà bien installée, la plante provoque des allergies chez 13% de la population !
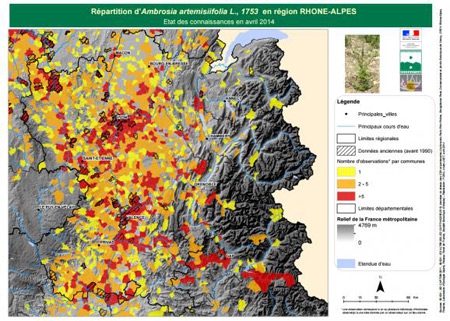
Aujourd'hui, la plante répand ses pollens entre fin juillet et début octobre. Elle ne peut pas s'installer dans les régions où les premiers gels sont trop précoces, et profite pleinement de températures chaudes au printemps et en été. Elle aime particulièrement les écarts de température jour/nuit et s'épanouit particulièrement en Hongrie, en Serbie et en Croatie où elle constitue un véritable fléau. Outre la région Rhône-Alpes, on en trouve sur 30% du territoire français, principalement en Bourgogne et en Auvergne. Désormais, elle atteint la Franche-Comté par le sud, c'est-à-dire par le département du Jura. À ce jour, l’Ambroisie est en pleine progression notamment dans la plaine du Jura.
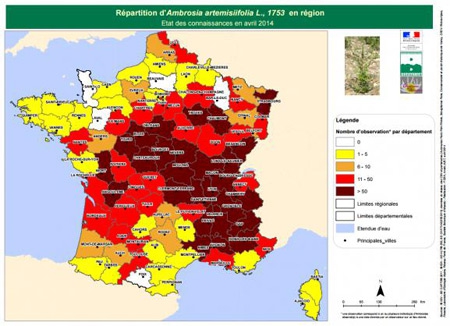
Ajout du 6 septembre 2016 : par Robin Cannone (Le Figaro.fr Santé)
Pic d'allergies au pollen d'ambroisie
En 2016, les deux grandes régions Auvergne-Rhône-Alpes et Bourgogne-Franche-Comté sont particulièrement touchées. D'après les prévisions du Réseau national de surveillance aérobiologie (RNSA), les pollens de l'Ambroisie « au sommet de leur période de dispersion » dans le sud-est de la France, et plus particulièrement les départements des régions Auvergne-Rhône-Alpes et Bourgogne-Franche-Comté.
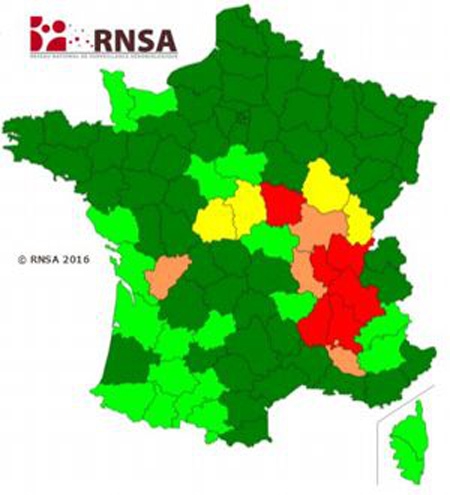
Carte d'allergie des pollens 1re semaine septembre 2016
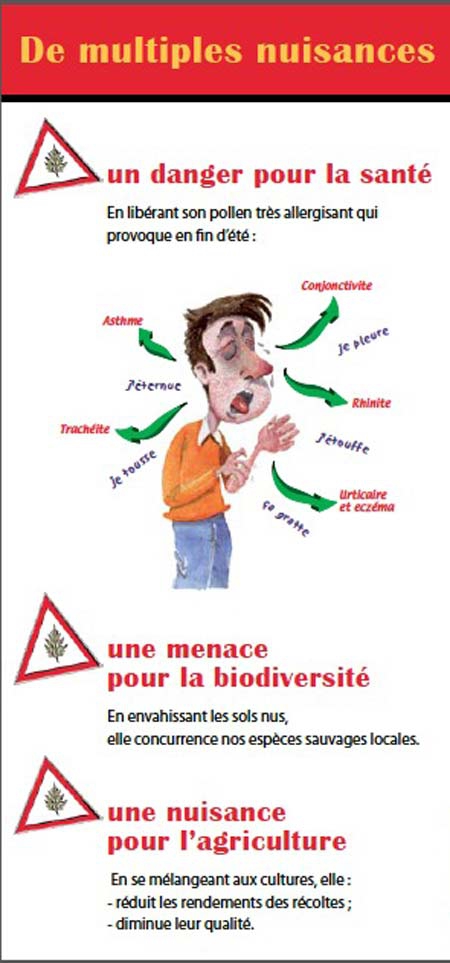
Le pollen de cette plante envahissante originaire d'Amérique du Nord provoque de fortes allergies saisonnières dont les symptômes comprennent notamment rhinite, conjonctivite, trachéite, asthme, démangeaisons et autres atteintes cutanées. Néanmoins, certaines mesures peuvent être prises afin de se protéger. Les activités en plein air telles que le sport, les promenades ou les pique-niques sont fortement déconseillées pour éviter tout contact avec l'allergène. En outre, les antihistaminiques, des médicaments permettant de traiter n'importe quelle allergie au pollen, constituent une solution préventive efficace. Si malgré ces précautions la gêne persiste, l'immunothérapie, également appelée désensibilisation, apparaît comme un moyen de se débarrasser d'une allergie de façon plus ou moins durable.
Malgré des campagnes d'arrachage régulières, l'ambroisie est largement présente dans le centre et le sud de l'Europe ainsi que le sud-est de la France. Afin de limiter sa propagation, la présence de cette plante peut être signalée sur la plateforme de signalement ambroisie.
D'après une étude de la revue Environmental Health Perspectives datée du 24 août 2016, l'allergie au pollen d'ambroisie pourrait toucher 70 millions d'Européens d'ici à 2050, soit deux fois plus qu'aujourd'hui. Pour Iain Lake, qui a dirigé l'étude, cette augmentation pourrait être due au rallongement de la durée des « saisons » durant lesquelles se répandent les pollens, conséquence du réchauffement climatique, et de la propagation naturelle de cette plante envahissante.

Ambroisie à feuilles d'armoise dans une parcelle de soja
(cliché © Inra)
En ce qui concerne notre région, le Conservatoire botanique de Franche-Comté distribue la brochure ci-dessous :

Remplissez le formulaire en ligne
Remplissez le formulaire en ligne

Remplissez le formulaire en ligne

Remplissez le formulaire en ligne

Remplissez le formulaire en ligne
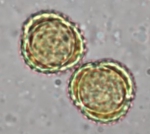 Ce sont les grains de pollens qui sont extrêmement allergisants.
Ce sont les grains de pollens qui sont extrêmement allergisants.
http://www.fredonfc.com/activite-lambroisie.html
Regarder également l'émission de Arte sur les plantes invasives.
Pollen d'ambroisie
Problème de santé publique
« Avec le réchauffement en cours, elle ne s'épanouira pas simplement entre 43 et 47 degrés de latitude, soit entre Nîmes et Orléans, mais jusqu'à 53 ou 54 degrés au nord (soit jusqu'à Berlin et Hambourg, NDLR) », s'inquiète Robert Vautard, climatologue au CEA qui a participe à l'étude (le CNRS, l'INERIS et le RNSA sont aussi impliqués pour la France). « 80 à 90% du territoire français pourrait être concerné. Seules le pourtour méditerranéen très sec et le littoral seront épargnés. » La plante ne supporte en effet pas la sécheresse estivale ou la douceur du climat océanique.
En ligne de mire, un véritable problème de santé publique risque d'émerger si rien n'est fait. Si le réchauffement est responsable des deux tiers de la prolifération, un tiers est lié au transport des graines. « L'ambroisie se développe assez naturellement au bord des routes, des cours d'eau et des voies de chemin de fer, c'est-à-dire des zones idéales pour exporter leurs graines », souligne Robert Vautard. Des campagnes de fauchage ou d'arrachage pourraient peut-être permettre de limiter le développement de cette plante opportuniste. Sans garantie de succès.
Contrôle de l’ambroisie grâce à la lutte biologique
Une équipe italienne* a réussi à induire la compétition entre plantes afin de contrôler l’expansion de l’ambroisie dans des sols de carrières.
Afin de respecter des conditions environnementales équivalentes, trois aires de 300 m2, dans des carrières abandonnées du bassin lombard de Botticino, avec une même pente et une même orientation vers le sud, ont été recouvertes d’un sol constitué de débris de carrière sur une épaisseur de 50 cm. Les sols n’ont pas eu de traitements chimiques ultérieurs.
Chacun des trois sites a été divisé en trois parties : une où la végétation spontanée a été laissée, une très enrichie par un mélange commercial de graines, une très enrichie avec des graines locales issues du foin de l’an passé d’une zone proche riche en plantes.
L’expérimentation a porté sur la première année de croissance, suffisante car la plus critique selon les auteurs. L’ambroisie, plante annuelle, est en effet ensuite remplacée progressivement par des plantes pluriannuelles.
Selon les auteurs, il ressort que les deux milieux ensemencés par un apport de graines ont vu une réduction très significative de l’établissement de l’ambroisie, tant en termes de croissance et donc de biomasse (abondance réduite, hauteur de la plante plus petite, développements latéraux moindres) que d’aptitude à la reproduction (nombre de semences plus faible et donc en rapport avec leur présence moindre l’année suivante dès la germination).
Si le mélange commercial a été le plus efficace, les auteurs mettent cependant en avant l’ensemencement avec des graines locales, plus en adéquation avec la conservation de la biodiversité locale et moins perturbateurs potentiellement : principalement la luzerne minette, la vulnéraire, la pimprenelle, le chiendent et l’ivraie.
*R. Gentili, F.Gilardelli, S. Ciapetta, A. Ghiani et S. Citterio 2015. Inducing competition: intensive grassland seeding to control Ambrosia artemisiifolia.Weed Research, 55, 278-288.
Sources :
— Bulletin de l’Association Française d’Étude des Ambroisies : AFEDA Flash info n°18 - juillet 2015.
— Bruno Chauvel & Rebecca Bilon (2015). — Règlementations plus strictes pour les plantes exotiques envahissantes. Cas de l'Ambroisie Bourgogne Nature n° 21-22 p. 11.
— Bruno Chauvel & Rebecca Bilon (2015). — Attention à l'Ambroisie Bourgogne Nature n° 21-22 pp. 20-21.
Un insecte dévoreur d'Ambroisie
Dans son bulletin n°23 de janvier 2016, l’AFEDA (Association Française d’étude de l’Ambroisie) décrit l’action d’Ophraella communa, un insecte consommateur de l’Ambroisie dans la région de Milan.
EN SAVOIR PLUS :
» Ambroisie : des graines, des pollens et des allergies, documentaire vidéo de 14 minutes (2014)
» La carte des pollens semaine par semaine
» Comment se prémunir des pollens ?
» Quatre fois plus de pollen d'ambroisie en Europe d'ici 2050
» Allergie au pollen: se soigner dès les premiers signes
» Comment passer sereinement le pic des pollens
09:51 Publié dans Environnement-Écologie, Médecine | Tags : ambroisie, ambroisie en franche-comté | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
25/06/2014
Bactéries résistantes aux antibiotiques : l'élevage en cause !
Bactéries résistantes aux antibiotiques : l'élevage en cause !
Une équipe médicale de Besançon citée dans le Canard Enchaîné dénonce l'utilisation des antibiotiques dans l'alimentation des animaux de boucherie.
Voir ci-dessous l'article du "Canard" du 18 juin 2014 et aussi le lien ci-dessous sur le même sujet !
http://www.altermonde-sans-frontiere.com/spip.php?article...

07:54 Publié dans Environnement-Écologie, Médecine, Nature et santé, Pollution | Tags : antibiotiques, escherichia coli, alimentation animaux, animaux de boucherie | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
12/05/2014
Greffe d’ovaire : Besançon confirme son excellence
 Greffe d’ovaire : Besançon confirme son excellence
Greffe d’ovaire : Besançon confirme son excellence
(reproduction d'un article de "en Direct")
La cryoconservation de tissu ovarien est un espoir pour toutes les femmes ayant un jour à subir des traitements toxiques susceptibles de provoquer une insuffisance ovarienne prématurée, voire une stérilité.
Le tissu ovarien est prélevé, conditionné, congelé, puis stocké dans l’azote liquide à -196°C, dans l’attente de pouvoir être réimplanté chez la patiente après sa guérison, si elle émet le souhait d’une grossesse.
Le 22 juin 2009 naissait au CHRU de Besançon le premier bébé français conçu après cryoconservation et autogreffe d’un ovaire, une intervention réalisée par l’équipe du professeur Christophe Roux. C’était la première fois au monde qu’une grossesse était rendue possible chez une patiente ayant auparavant bénéficié d’une greffe de moelle osseuse. Trois autres bébés sont nés en France depuis, et l’équipe comtoise peut s’enorgueillir d’avoir encore mené à terme l’une de ces grossesses, en 2011.
Depuis juillet 2013, l’unité de biologie de la reproduction du CHRU de Besançon pilote l’un des deux protocoles de recherche français dédiés à la réutilisation par autogreffe du cortex ovarien cryoconservé. Ce protocole, sous la responsabilité du docteur Clotilde Amiot, regroupe une douzaine de centres hospitalo-universitaires. Assurer l’innocuité de la greffe figure dans les objectifs prioritaires de la structure. « Certaines pathologies cancéreuses présentent le risque de réintroduire la maladie dans l’organisme de la patiente, au cas où des cellules malignes auraient colonisé le tissu avant son ablation et sa conservation », explique le professeur Christophe Roux. D’où l’accent mis sur la recherche au laboratoire Interaction hôte-greffon / tumeur et ingénierie cellulaire et génique pour détecter les cellules anormales dans le tissu ovarien. « Nous avons recours à la biologie moléculaire et à la cytométrie en flux multicouleurs, dont la sensibilité de détection des marqueurs de surface sur une cellule cancéreuse est aujourd’hui aussi excellente pour du tissu ovarien que pour le sang ou la moelle osseuse », précise le docteur Clotilde Amiot.
Des résultats obtenus grâce à la plateforme de biomonitoring installée à l’Établissement français du sang Bourgogne - Franche-Comté, un outil particulièrement performant pour mener à bien ces recherches de pointe.
Contact : Christophe Roux - Clotilde Amiot
Laboratoire Interaction hôte-greffon / tumeur et ingénierie cellulaire et génique
Établissement français du sang Bourgogne - Franche-Comté / Université de Franche-Comté / INSERM
Tél. (0033/0) 3 81 21 86 98 / 86 81
Source : "En direct" Le Journal de la Recherche et du Transfert de l'Arc Jurassien, n° 253, mai-juin 2014, p. 4.
14:06 Publié dans Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
05/01/2014
Zone atelier de l'Arc jurassien
Zone atelier de l'Arc jurassien : le sens de l'observation
par Patrick Giraudoux
professeur à l'Université de Franche-Comté
« Terre de terroirs », l'Arc jurassien se prête à de nombreuses recherches sur les interactions entre environnement, écosystèmes et société. Sous la forme d'une zone atelier labellisée par le CNRS. Ces travaux interdisciplinaires pourront s'inscrire dans le long terme, et faire l'objet d'une véritable gestion des données recueillies sur le terrain.
Terre à la fois agricole et industrielle, l'Arc jurassien est marqué par des relations de longue date entre l'homme et son environnement. Dans son acception française, il évoque pêle-mêle le Comté, le Morbier, le Bleu de Gex, le vin jaune et les automobiles Peugeot. Très vite associé dans les esprits à son versant suisse, il suggère alors la mobilité transfrontalière et le développement des lotissements résidentiels.
On ne s'étonnera donc pas que la toute jeune zone atelier Arc jurassien (ZAAJ) pur produit des instances de recherche française, lorgne du côté de la Suisse pour un ralliement qui lui donnerait sa pleine envergure. Le territoire de la ZAAJ, tel qu'il est défini aujourd'hui, s'étend le long des contreforts du Jura, de Belfort à Chambéry. Labellisée par le CNRS en 2013, la zone atelier est née d'un projet porté par le laboratoire Chronoenvironnement de l'université de Franche-Comté, rejoint dans cette aventure par ses voisins immédiats ThéMA pour la géographie et LMB pour les mathématiques, par l'URTAL de Poligny, spécialisé en technologie et analyse laitière, et par le laboratoire EDYTEM de l'université de Savoie, comme lui pluridisciplinaire. Elle bénéficie par ailleurs du soutien d'autres grandes structures fédératives (cf. encart). Son objectif ? Assurer à long terme la collecte, le traitement, la sauvegarde et l'analyse des données de terrain, toutes dédiées à l'étude du lien entre environnement, écosystèmes et société. Des informations utiles à la fois à la recherche et à la gestion du territoire.

Informations régionales
Quatre grands thèmes de recherche définissent l'action de la ZAAJ : écosystèmes et environnement ; contaminants et santé ; usages d'un espace en mutation ; observatoires et modélisation. Différents dispositifs d'observation apportent à chacun leurs enseignements dans une optique pluridisciplinaire. « Jurassic karst » vise à caractériser l'évolution des hydrosystèmes karstiques du massif du Jura ; « Tourbières » observe le fonctionnement de ces zones protégées soumises aux perturbations climatiques et anthropiques ; un concept décliné avec « Lacs jurassiens » et « Biodiversité des prairies », chacun pour la partie qui le concerne sur le territoire ; « Santé humaine » considère différentes pathologies humaines liées à l'environnement ; « Rongeurs - prédateurs » s'intéresse à certaines populations de campagnols et à leurs prédateurs ; « Faune sauvage et contaminants » mesure les effets des polluants sur les populations animales ; « Forêt de Chaux » est dédié aux sols hydromorphes. c'est-à-dire dont le fonctionnement est influencé par une nappe d'eau de la célèbre forêt comtoise ; enfin, « Les Échelles » fédère de nombreuses problématiques sur un même site, de la géologie au tourisme patrimonial. Les interactions entre le milieu et les sociétés se mesurent donc ici à l'échelle régionale, et investissent des travaux scientifiques interdisciplinaires. dont les résultats seront valorisés sur le long terme. « La gestion des données est un paramètre d'une importance capitale » rappelle Patrick Giraudoux, responsable de la ZAAJ. Le stockage et l'analyse bénéficieront à la fois de la grande expérience de l'OSU THETA, dont l'Observatoire de Besançon engrange des informations célestes depuis plus d'un siècle, et des compétences du Laboratoire de mathématiques de Besançon (LMB).
Outre leur intérêt scientifique permettant la compréhension de phénomènes interdépendants pour expliquer le fonctionnement et l'évolution d'un territoire, ces informations seront utiles aux gestionnaires de terrain et élus locaux pour la prise de décision en matière environnementale.
Contact : Patrick Giraudoux - Laboratoire Chrono-environnement - Université de Franche-Comté / CNRS Tél. (0033/0)3 8l 66 57 45 - patrick.giraudoux@univ-fcomte.fr
Adresses des sites :
Grosse UMR CNRS en place centrée sur le thème : (http://chrono-environnement.univ-fcomte.fr)
Zone atelier Arc jurassien en place : http://zaaj.univ-fcomte.fr
Projection internationale labellisée avec le GDRI : http://gdri-ehede.univ-fcomte.fr
Master recherche en écologie établi depuis 2000 : http://scienvir.univ-fcomte.fr
Source : En direct, le journal de la recherche et du transfert de l'Arc jurassien, n° 251 – janvier-février 2014.
13:30 Publié dans Actualité des Sciences, Environnement-Écologie, Médecine, Préhistoire | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
29/12/2013
Cœur artificiel : une première
Cœur artificiel : une première
par Nicolas Rodrigues
(Notre Temps 24 décembre 2013)
(Dernière mise à jour du 17 mars 2014)
La première implantation d’un cœur artificiel a été réalisée avec succès. Mais quels seront les critères pour bénéficier de cette nouvelle prouesse médicale ?
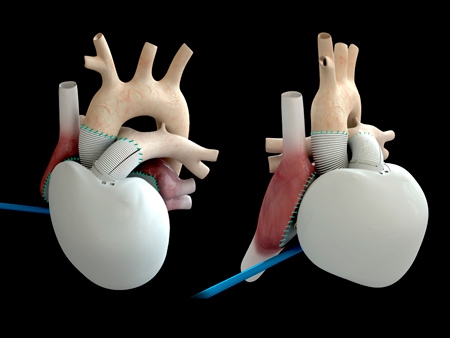
Une première mondiale
L'opération aura duré une dizaine d'heures. Le 18 décembre 2013, à l'hôpital européen Georges Pompidou à Paris, l'équipe du Pr Christian Latrémouille a implanté un cœur artificiel à un patient de 75 ans atteint d'insuffisance cardiaque terminale. Et aux dernières nouvelles, le patient se porte "bien".
Depuis une dizaine d'années, on implante des cœurs artificiels. Mais cette fois, il s'agit d'un cœur définitif, qui n'est plus seulement destiné à faire patienter le malade avant une greffe.
Cette prothèse mime le fonctionnement du cœur humain : composé de deux ventricules, elle accélère les battements en cas d'effort et ralentit ensuite. De plus, elle est recouverte à l'intérieur d'une membrane biologique pour éviter la formation de caillots de sang. Du coup, Le patient n'a plus besoin de prendre de traitement anti-coagulant lourd.
Le but est d'obtenir une vie normale. Avec tout de même quelques contraintes, comme celles liées à l'alimentation électrique indispensable pour faire fonctionner une telle machine", a commenté le Pr Fabiani, chef du service de chirurgie cardiovasculaire à l'hôpital Pompidou. Les médecins espèrent apporter au malade au minimum cinq ans d’espérance de vie.
La volonté d'un chirurgien français
Cette prouesse médicale est le fruit de la ténacité d'un chirurgien et cardiologue français : le Pr Alain Carpentier, 80 ans, qui tenait absolument à réaliser cette première mondiale en France.
Il y a près de 10 ans, il s'est allié avec EADS, leader de l'aéronautique, pour créer la société Carmat (Carpentier-Matra Défense). Il bénéficie alors d'un soutien financier et technologique. Au total, plus de 100 ingénieurs et médecins ont été impliquées dans ce projet.
Aujourd'hui, Carmat est une start-up cotée en bourse, financée à la fois par des investisseurs privés et publics. Sa technologie représente un espoir pour les patients atteints d'une insuffisance cardiaque terminale: sur 100 000 patients en attente d'une greffe en Europe et aux États-Unis, seuls 4000 bénéficient d'une transplantation chaque année, faute de greffons disponibles.
La mise sur le marché de ce cœur artificiel n'est pas pour demain
Les équipes doivent finaliser l'étude en cours, sous la surveillance de deux comités d'experts indépendants. Si tout va bien, une seconde implantation devrait intervenir dans les prochaines semaines. Au total, quatre opérations sont prévues au cours de cet essai, avant d'engager une 2ème phase sur une vingtaine de patients. "Un an de recul sera nécessaire pour juger le cœur Carmat", prévient le Pr Jean-Noël Fabiani. La société espère démarrer la commercialisation de son cœur en 2015.
Des critères de sélection pour les futurs bénéficiaires
Mais pour en bénéficier, les futurs patients devront répondre à certains critères physiques : ce cœur artificiel nouvelle génération pèse 900 g, bien plus lourd qu'un cœur humain (300 g). De fait, il ne pourra être implanté que chez des personnes assez corpulentes. La société Carmat estime ainsi qu'il est compatible avec 70% des thorax d'hommes et 25 % de ceux de femmes.
Des critères médicaux constituent aussi des contre-indications plus ou moins rédhibitoires : hypertension pulmonaire irréversible, infection active, cancer, voire diabète, insuffisance rénale, obésité morbide, etc.
Enfin, son prix risque de restreindre encore l'accès à ce cœur artificiel. Un bijou technologique qui coûte environ 160 000€. Un coût prohibitif comparé à une greffe cardiaque dont le tarif s'élève en moyenne à 40 000€, auquel s'ajoutent les frais liés à la prise – à vie – de médicaments anti-rejets. Des frais supplémentaires qui ne sont pas nécessaires avec ce cœur artificiel... pour autant, pas certain que la Sécurité sociale puisse le rembourser.
L’alliance de la chirurgie et de l’aéronautique
Si l’idée de Carmat est l’œuvre du célèbre chirurgien Alain Carpentier, cette prothèse n’aurait pu voir le jour sans les finances et l’expertise du groupe aéronautique Matra. Dans les années 80, Alain Carpentier avait en effet convaincu Jean-Luc Lagardère d’investir dans son projet. Mais les deux hommes ne s’attendaient pas à mettre autant de temps pour le faire aboutir. Entre-temps, Lagardère père est mort et Matra a été refondu dans EADS. Mais le groupe européen n’a pas abandonné le dossier.

Ce sont ses ingénieurs qui ont réussi à miniaturiser l’organe artificiel imaginé par Carpentier et qui ont mis au point les capteurs et le microprocesseur qui équipent la prothèse. D’autres implantations en Belgique, Pologne, Slovénie et Arabie Saoudite devraient suivre avant la mise sur le marché de Carmat. Reste également à alléger encore le poids de la prothèse – 900 grammes tout de même – et simplifier son dispositif d’alimentation très contraignant. Et il y a le coût prohibitif de cette petite merveille : 160 000 euros au moins. On doute que la sécurité sociale envisage de le rembourser…
Cette première mondiale ouvre un nouveau chapitre de l’histoire de la médecine. On peut espérer que d’autres organes artificiels verront le jour sur son modèle comme des reins, des foies ou des pancréas. L'homme augmenté est déjà une réalité.
Découvrez l'animation sur : http://www.carmatsa.com/
Mise à jour du 2 mars 2014 : Décès de Claude Dany, premier malade ayant reçu le cœur artificiel.
Pourquoi le cœur artificiel de Claude Dany, implanté le 18 décembre 2013, s'est-il arrêté de battre le 2 mars dernier ? L'un des chirurgiens ayant participé à cette première mondiale, le Pr Daniel Duveau, révélait dimanche au Figaro que « pendant deux heures, à chaque arrêt du dispositif, la machine faisait tout ce qu'elle pouvait pour faire repartir la pompe ».
Pour en savoir plus, lire l'article du Figaro.fr Santé.
07:50 Publié dans Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
26/12/2013
Cancer : Bactéries intestinales en renfort de la chimiothérapie
Quand les bactéries intestinales viennent en renfort de la chimiothérapie
(Article mis à jour le 5 septembre 2014)
Appelé autrefois "flore microbienne", le microbiote est l'ensemble des microbes (bactéries et champignons essentiellement) qui peuplent notre corps. Ces micro-organismes vivent avec nous, logés à la surface de la peau, dans les cavités buccale et vaginale, et surtout dans notre intestin : celui-ci contient 100 000 milliards de bactéries - soit 10 fois le nombre de nos propres cellules - et leur masse avoisine les deux kilogrammes chez l'adulte !
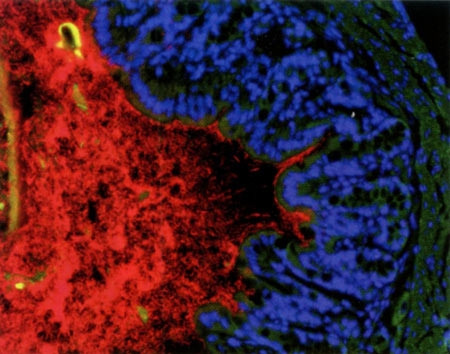
Les bactéries du microbiote apparaissent en rouge
contre la paroi du colon (bleu et vert) © Institut Pasteur
Ce microbiote intestinal est aujourd'hui considéré comme un véritable organe, avec une activité métabolique égale à celle du foie car les espèces bactériennes qui le composent exercent des fonctions cruciales pour notre santé comme l’élimination des substances étrangères à l’organisme (et potentiellement toxiques) ou le maintien à distance de pathogènes qui nous contaminent. Elles assurent également la dégradation des aliments ingérés pour une meilleure absorption intestinale et un métabolisme optimal. Ces milliards de bactéries colonisent l’intestin dès la naissance et jouent un rôle-clef dans la maturation des défenses immunitaires.
Les espèces bactériennes qui composent le microbiote intestinal diffèrent toutefois d'un individu à l'autre et la présence ou l'absence de telle ou telle bactérie semble influencer la survenue de certaines maladies ou au contraire nous protéger. Il nous permet de digérer les sucres complexes et les fibres, intervient dans la biosynthèse des vitamines ou encore dans la détoxification de certaines substances de l'alimentation, et il forme une barrière protectrice contre les pathogènes. Il comprend environ 1000 espèces de bactéries et sa composition varie d'un individu à l'autre. Chacun d'entre nous a donc son propre microbiote intestinal, constitué dans les premières années de la vie à partir des bactéries de notre environnement : seul un tiers des bactéries intestinales est commun à tous.
Ce microbiote intestinal joue un rôle crucial dans le développement du système immunitaire et, sans doute, dans une large gamme de maladies : l'obésité, la résistance à l'insuline et diverses maladies inflammatoires de l'intestin (maladie de Crohn, rectocolite hémorragique...) peuvent résulter d'un déséquilibre du microbiote intestinal. Plus étonnant : il pourrait intervenir dans certaines pathologies de l'humeur comme la dépression. De plus en plus d'études montrent en effet que nos bactéries intestinales envoient des signaux au cerveau et semblent ainsi capables d'influencer le comportement.
Une recherche menée conjointement par des chercheurs de Gustave Roussy, de l'Inserm, de l’Institut Pasteur et de l'Inra a permis une découverte assez étonnante sur la façon dont les traitements de chimiothérapie anticancéreuse agissent plus efficacement grâce à l'aide du microbiote intestinal. Les chercheurs viennent en effet de démontrer que l’efficacité d'une des molécules les plus utilisées en chimiothérapie, repose en partie sur sa capacité à entraîner le passage de certaines bactéries de la flore intestinale vers la circulation sanguine et les ganglions. Une fois dans les ganglions lymphatiques, ces bactéries stimulent de nouvelles défenses immunitaires qui iront aider l'organisme à combattre encore mieux la tumeur cancéreuse.

Arbre phylogénétique bactérien sur fond de muqueuse du côlon d'une souris. La taille des cercles renseigne sur l'importance des populations bactériennes du microbiote. Les points rouges correspondent aux bactéries renforçant l'action d'une immunothérapie anticancéreuse, les verts à celles inhibant la réponse à une chimiothérapie.
Dans le domaine du cancer, l’équipe française* dirigée par le Pr Laurence Zitvogel, à l’Institut Gustave Roussy et directrice de l'Unité Inserm 1015 "Immunologie des tumeurs et immunothérapie", en collaboration étroite avec l’Institut Pasteur (Dr Ivo Gomperts Boneca, Unité "Biologie et génétique de la paroi bactérienne") et des chercheurs de l’INRA (Dr Patricia Lepage et Dr Joël Doré, Unité Micalis "Microbiologie de l'Alimentation au service de la Santé"), vient d'apporter la preuve que la flore intestinale stimule les réponses immunitaires d'un individu pour combattre un cancer lors d'une chimiothérapie.
*Équipe française dirigée par le Pr Laurence Zitvogel, à l'Institut Gustave-Roussy, directrice de l'Unité Inserm 1015 "Immunologie des tumeurs et immunothérapie", en collaboration étroite avec l'Institut Pasteur (Dr Ivo Gomperts Boneca, Unité "Biologie et génétique de la paroi bactérienne") et des chercheurs de l'INRA (Dr Patricia Lepage et Dr Joël Doré), Unité "Microbiologie de l'Alimentation au Service de la Santé Humaine".
Le cyclophosphamide est l’un des médicaments les plus utilisés en chimiothérapie. Comme tout traitement, il entraîne cependant des effets secondaires (inflammation des muqueuses etc.) et perturbe l'équilibre normal du microbiote intestinal. Chez la souris, l'équipe a démontré que le cyclophosphamide modifie la composition du microbiote dans l'intestin grêle et induit la translocation de certaines espèces de bactéries Gram-positives dans les organes lymphoïdes secondaires. Là, ces bactéries stimulent la production d'un sous-ensemble spécifique de "pathogène" T helper(17)" pTH17 cellules mémoire et des réponses immunitaires Th1. La synergie entre le microbiote et le cyclophosphamide débute lorsque le médicament facilite le passage à travers la barrière intestinale des bactéries Gram+ qui vont se retrouver dans la circulation sanguine et les ganglions lymphatiques. Ces bactéries sont considérées comme néfastes et l'organisme déclenche une réponse immunitaire. Une fois dans les ganglions lymphatiques, elles stimulent la production de globules blancs pTH17 qui vont agir comme de nouvelles défenses immunitaires et aider l'organisme à lutter contre la tumeur cancéreuse. "Cette réaction en chaîne, effet secondaire du traitement, va s'avérer en réalité très utile" explique Laurence Zitvogel. "De façon surprenante, la réponse immunitaire dirigée contre ces bactéries va aider le patient à lutter encore mieux contre sa tumeur en stimulant de nouvelles défenses immunitaires."
En détails, l'immunisation anti-bactérienne aboutit au recrutement de lymphocytes effecteurs différents de ceux mobilisés par la chimiothérapie. Leur rôle consiste à aider les lymphocytes anti-tumoraux à endiguer la croissance de tumeurs.
A contrario, des souris dépourvues de tout germe intestinal ou préalablement traitées par des antibiotiques dirigés contre les bactéries Gram+ se révèlent incapables de produire les précieuses cellules pTH17 antitumorales. De plus, leur tumeur est devenue résistante au cyclophosphamide. La situation est toutefois réversible : lorsque les sourisreçoivent une perfusion intraveineuse de pTH17, le médicament retrouve son efficacité antitumorale.
Les chercheurs suggèrent également que certains antibiotiques utilisés au cours d’une chimiothérapie pourraient détruire ces bactéries Gram+ et annuler ainsi leur effet bénéfique. "Maintenant que ces bactéries bénéfiques potentialisant la réponse immunitaire anti-tumorale ont été identifiées, on devrait réussir rapidement à en fournir plus à l'organisme, notamment via des pro- ou pré-biotiques et/ou une alimentation spécifique" conclut la chercheuse.
Ces travaux ont bénéficié du soutien de la Ligue nationale contre le cancer, de l'Institut national du cancer (INCa) (SIRIC SOCRATES) et du LABEX Onco-Immunologie.
Remarque :
Le cyclophosphamide n'est pas le seul traitement à profiter d'un microbiote intestinal performant. Le même numéro de Science fait ainsi part du travail d'une équipe américaine qui aboutit à des conclusions très proches : certains antibiotiques diminueraient l'action de la chimiothérapie.
Parallèlement au travail des chercheurs français, Elizabeth Pennisi, Noriho Lida et al, de l'Institut national du cancer (Frederick, États-Unis), montrent que le microbiote intestinal renforce les effets d'autres traitements anticancéreux, à savoir une immunothérapie ou une chimiothérapie par oxaliplatine (un autre médicament anticancéreux). Ici aussi, comme dans l'étude française, l'efficacité du traitement antitumoral a chuté drastiquement chez des souris débarrassées de leur flore bactérienne intestinale.
Même si ces deux études ont été menées sur la souris, il est vraisemblable que leurs résultats puissent être un jour applicables à l'être humain. Ils suggèrent en tout cas que certains antibiotiques pourraient diminuer l'efficacité d'une chimiothérapie antitumorale mais également qu'une supplémentation en pro- ou pré-biotiques, voire une alimentation spécifique, pourrait renforcer l'action du traitement.
Sources :
Laurence Zitvogel et al (2013). - The Intestinal Microbiota Modulates the Anticancer Immune Effects of Cyclophosphamide, Science22 November 2013, vol 342 n° 6161 pp. 971-976.
Elizabeth Pennisi et al (2013). - Cancer Therapies Use a Little Help From Microbial Friends, Science 22 November 2013 Vol. 342 n° 6161 p. 921.
Marc Gozlan (2013). - La flore intestinale en renfort de la chimiothérapie, Sciences et Avenir, janvier 2014 n° 803, p. 70.
Qu'est-ce que le microbiote ? Lettre de l'Institut Pasteur, septembre 2014 n° 86 p. 9.
11:55 Publié dans Actualité des Sciences, Biologie, Médecine | Tags : cancer, chimiothérapie, microbiote intestinal, flore intestinale | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
02/11/2013
Le premier cerveau éprouvette
Le premier cerveau éprouvette
par Aude Rambaud
(Science & Vie n° 1154, novembre 2013, pp. 92-95)
À première vue, ce n'est qu'un petit amas de cellules. Une sphère d'à peine 4 millimètres de diamètre, maintenue en suspension dans un liquide transparent. Rien, dans l'apparente insignifiance de cet objet biologique, ne laisse présager son importance. Et pourtant ! Prévenu de sa véritable nature, l'observateur ressent une indicible émotion. Car ce qu'il a sous les yeux, flottant dans une petite boîte, n'est ni plus ni moins que le tout premier embryon de cerveau humain cultivé en laboratoire. Une réplique vivante du futur organe de la pensée, comme il se présente chez un fœtus d'un peu plus de deux mois. Un choc ! Un choc et... une incroyable prouesse, que l'on doit aux chercheurs de l'Institut de biotechnologie moléculaire de Vienne (Autriche).

Encapsulés dans des microbilles de gel nutritif (à droite) placées en suspension dans un incubateur (à gauche), des amas de cellules souches ont donné naissance à un embryon de cerveau humain (ci-dessous, en coupe)
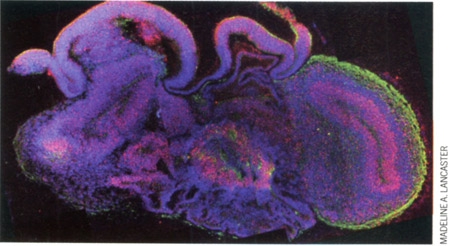
À l'origine de cet exploit, il y a les dernières découvertes en matière de cellules souches, ces cellules capables de donner naissance à tout type de tissu ou d'organe, et dont les potentialités ne laissent d'impressionner. Ainsi, à partir de quelques cellules de peau prélevées sur un donneur et génétiquement "reprogrammées" au stade de cellules souches, les chercheurs ont obtenu, deux mois et demi plus tard, la réplique quasi parfaite du cerveau du donneur... tel qu'il devait être aux prémices de son développement embryonnaire, après neuf semaines de gestation. "C'est un travail magnifique", commente, admiratif, Étienne Hirsch, directeur adjoint du Centre de recherche de l'institut du cerveau et de la moelle épinière (Paris). Pas de doute, la "fabrication" in vitro de l'organe le plus complexe du corps humain, même à un stade primaire, repousse les frontières du possible. En même temps qu'elle interroge les limites de la culture d'organes.
Des matrices pour organes
Le pari fou des chercheurs autrichiens n'était pourtant pas gagné d'avance. Certes, depuis le milieu des années 2000, les biologistes maîtrisent de mieux en mieux les cellules souches. Ils savent guider leur transformation, par des techniques de mise en culture, pour qu'elles donnent toutes les sortes de lignées cellulaires qui composent un être humain : cellules cardiaques, musculaires, pancréatiques... ou même neuronales. Mais sans support "physique", les cellules souches se bornent à former de simples tapis biologiques. Dans le même temps, d'autres équipes ont donc mis au point des matrices, sortes de charpentes pour culture cellulaire en trois dimensions, qui ont déjà permis de faire pousser in vitro des copies plus ou moins parfaites d'organes, comme la vessie, les vaisseaux sanguins ou le foie.
Presque comme un vrai !
Étant donné sa complexité, le cerveau restait toutefois hors de portée. Principale difficulté ? Il est constitué de neurones aux formes différentes et de cellules de soutien (cellules gliales) qui s'imbriquent les unes dans les autres. Un puzzle d'une précision telle qu'il semblait impossible à reproduire. "Les précédentes tentatives avaient abouti à des ensembles de neurones de même type. Cette fois, nous avons un véritable petit organe en développement, présentant tous les aspects d'un cerveau in vivo, malgré une organisation un peu anarchique ", estimait Jürgen Knoblich, auteur des travaux, lors de la présentation des résultats.
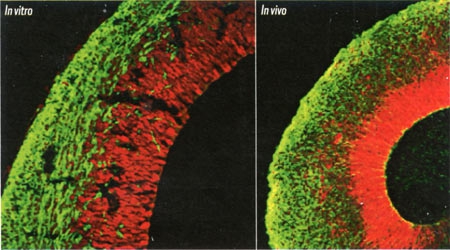
Le cortex embryonnaire a une structure identique in vivo (à droite) et in vitro (à gauche), même si l'organisation des cellules y est anarchique
Le secret ? Il ne réside pas dans le matériel biologique utilisé. En effet, les chercheurs autrichiens s'en sont tenus aux cellules souches classiquement obtenues. Lesquelles, mises en culture, se sont notamment différenciées en neuroectoderme, le tissu à l'origine du cerveau. Jusqu'ici, rien de vraiment neuf. Puis, les chercheurs ont découpé des fragments de ce tissu, qu'ils ont encapsulés dans des microbilles de gel nutritif contenant toutes les substances nécessaires à la croissance et au développement des cellules en culture. Voilà l'une des premières astuces. "L'utilisation de microbilles à la place d'une couche de gel au fond d'une boîte a amélioré l'adhérence entre les cellules", explique Mathilde Girard, de l'Institut des cellules souches I-Stem d'Évry.
Ensuite, et c'est là qu'est la véritable clé du succès, ils ont utilisé un bioréacteur tournant, une sorte d'incubateur qui a placé les microbilles en état de suspension permanente. "C'est la grande nouveauté du dispositif, s'enthousiasme la chercheuse. Les billes en suspension contournent le problème de la gravité. Lorsque les cellules commencent à former un amas au sein de la capsule de gel, elles ne se déforment pas et ne retombent pas comme dans une boîte de Pétri. En outre, cette mobilité permet d'améliorer l'oxygénation des cellules. "Autrement dit, c'est en se rapprochant des forces mécaniques exercées sur ces cellules durant une grossesse que les chercheurs ont triomphé.
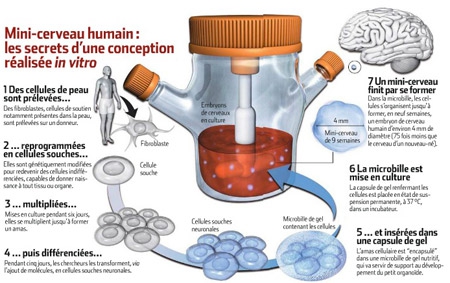
Frottements, gravité, mouvement... Le résultat de cette modification de l'environnement est étonnant. Dans leurs microbilles, les cellules se multiplient, se différencient et s'organisent de façon totalement autonome. Comme si les cellules avaient en mémoire le plan à respecter pour aboutir à un cerveau, avec des régions cérébrales bien distinctes : cavités remplies de liquide qui donneront les ventricules et le liquide céphalo-rachidien, couches internes du cortex cérébral avec neurones différenciés, plexus choroïdes produisant le liquide céphalo-rachidien, ou encore tissu rétinien chez environ 10 % des embryons de cerveau. Autant de structures présentes in vivo et qui montrent même des traces d'activité électrique identiques... "Certaines étapes du développement sont tout à fait semblables à ce qui se passe in vivo. Néanmoins, l'organisation spatiale au sein de ces régions, anarchique, ne reproduit pas l'architecture réelle d'un cerveau", tempère Jean Bernard Manent, chercheur à l'Institut de neurobiologie de la Méditerranée, à Marseille.
Un développement bloqué à neuf semaines
Cette première étape franchie, le cerveau n'a cependant pas continué à se développer. Pourquoi ? Les chercheurs ont bien essayé de pousser plus loin l'expérience, en laissant leur culture dans l'incubateur au-delà de neuf semaines... Mais si le mini-cerveau a pu survivre pendant plusieurs mois, l'absence de circulation sanguine, source d'oxygène et de nutriments, a empêché sa croissance. "Sans système vasculaire, le développement s'arrête rapidement. Or, il semble impossible de le reconstituer, car il faudrait pour cela reproduire la totalité de l'embryon in vitro ", explique Mathilde Girard.
Ces travaux n'en intéressent pas moins les médecins, qui espèrent utiliser ces cerveaux embryonnaires pour tester la toxicité de certains médicaments lors des premiers mois de la grossesse, ou étudier des pathologies liées au développement cérébral à partir des cellules d'un individu malade. Ils nous font pénétrer plus loin que jamais dans les coulisses de l'être humain en formation. L'homme parviendra-t-il un jour à créer en laboratoire un véritable cerveau humain parvenu à son stade adulte de développement ? L'avenir le dira. Mais l'idée, à la fois fascinante et effrayante, ne relève plus tout à fait du domaine de la science-fiction.
L'informatique aussi modèle le cerveau
In vitro ou in silico ? Modéliser le cerveau humain pour tester sur lui de futurs médicaments, c'est aussi l'un des objectifs poursuivis par le Human Brain Project. Cet autre projet fou compte reproduire, à l'aide de simulations informatiques, le fonctionnement cérébral d'ici dix ans (voir Science & Vie n° 1145, p. 44). Près de 80 instituts de recherche européens et internationaux regroupent et analysent actuellement toutes les données disponibles : biologiques, cliniques, issues de l'imagerie, etc. À terme, cette cartographie devrait permettre de reconstituer les circuits neuronaux, de modéliser certaines maladies neurologiques ou encore de tester des molécules. Si la majeure partie des recherches concerne le cerveau adulte, il est prévu d'ajouter au projet des données sur le développement cérébral, grâce à des clichés de cerveaux d'enfants prématurés ou plus âgés.
Quatre dates importantes sur ce sujet
1998 : découverte des cellules souches embryonnaires (CSE) chez l'Homme.
2006 : création de cellules souches induites, dites iPS, à partir de cellules de peau.
2009 : culture de neurones fonctionnels en laboratoire à partir de CSE.
2013 : fabrication du premier embryon de cerveau humain à partir de cellules iPS.
11:29 Publié dans Actualité des Sciences, Biologie, Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
10/10/2013
Les cellules souches pluripotentes induites (iPS)
 Les cellules souches pluripotentes induites (iPS)
Les cellules souches pluripotentes induites (iPS)
par Hervé Ratel
journaliste scientifique
(Sciences et Avenir n° 794, avril 2013, pp. 66-68)
(dernière mise à jour : 28 février 2014)
Le sigle iPS désigne les cellules souches pluripotentes induites, c'est-à-dire des cellules adultes rajeunies au stade embryonnaire. Un stade où elles sont capables de donner n'importe quel type de cellule de l'organisme (pluripotence). Les iPS ouvrent des perspectives majeures dans le traitement de nombreuses maladies incurables. Les premiers essais vont commencer au Japon.
Rajeunir les cellules, c'est la prouesse annoncée par ce simple sigle : iPS. Ce terme désigne les cellules souches pluripotentes induites, soit des cellules adultes reprogrammées jusqu'au stade primitif de cellules embryonnaires. Pour nombre de scientifiques, la révolution annoncée est comparable à celle des vaccins ou des antibiotiques en leur temps. Mise sous les projecteurs en octobre 2012 avec le prix Nobel décerné à leur découvreur, le Japonais Shinya Yamanaka (voir Sciences et Avenir n° 789, novembre 2012), ces cellules iPS sont en effet susceptibles de rendre d'immenses services dans le domaine des greffes de tissus, de faciliter la mise au point de médicaments pour des maladies génétiques et d'élucider certains mécanismes du cancer. Un comité d'éthique japonais a d'ailleurs donné son feu vert pour de premiers essais cliniques qui devraient débuter dès le mois d'avril 2013.
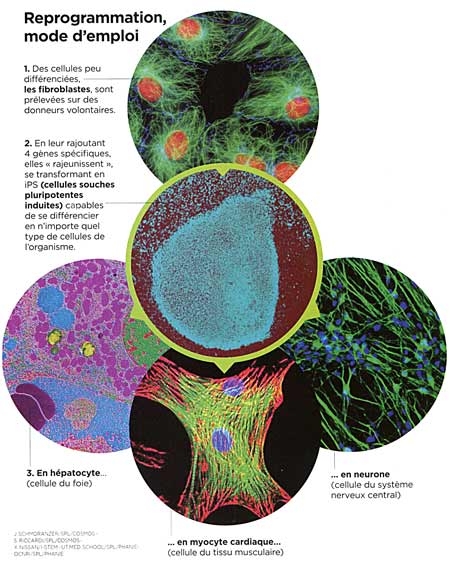
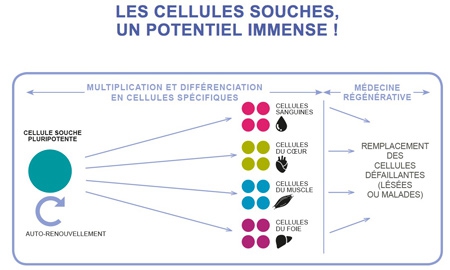
Diagramme © Institut Pasteur
Dans la course mondiale qui démarre, la France est bien placée. "Elle pourrait prendre la tête d'un consortium chargé de piloter un projet de banque européenne de cellules iPS. Celui-ci sera finalisé d'ici à la fm de cette année", pronostique Annelise Bennaceur-Griscelli (Inserm), qui coordonne la plate-forme nationale de cellules souches Ingestem, rassemblant plusieurs laboratoires de l'Hexagone.
Pourtant, les chercheurs français reviennent de loin ! En cause : la loi de bioéthique de 1994 - révisée en 2004 - qui interdit toute recherche sur les cellules souches embryonnaires humaines (CSEh). Ces dernières - qui ne sont pas des iPS - nécessitent en effet d'avoir directement recours à des embryons surnuméraires issus de fécondations in vitro. « Pour obtenir une dérogation les autorisant à travailler sur les CSEh, les chercheurs devaient remplir des documents faisant plusieurs dizaines de pages, raconte Frank Yates, enseignant-chercheur à l'école Sup'Biotech de Paris. Il fallait par exemple décrire à l'avance - exercice impossible et absurde les progrès médicaux attendus des expériences envisagées... Certains baissaient les bras ou s'exilaient à l'étranger devant ce cauchemar bureaucratique.» D'autres pays comme le Royaume-Uni, ont une réglementation moins restrictive, plus en phase avec la recherche fondamentale.

Les scientifiques abasourdis par ces résultats
La découverte des iPS en 2006 est donc venue bouleverser la donne puisque ces cellules ne nécessitent comme matériel de départ que des cellules adultes déjà différenciées, prélevées sur des donneurs consentants. Lors de leur découverte annoncée en 2006 dans la revue Cell c'est pourtant le scepticisme qui avait dominé parmi la communauté scientifique. « J'ai eu la chance d'assister à la première conférence du PrYamanaka sur le sujet, se remémore Frank Yates. Quand il a présente ses résultats, tout le monde était abasourdi. Parvenir à reprogrammer une cellule paraissait totalement improbable. » Improbable parce que cette découverte réduisait à néant l'un des dogmes majeurs de la biologie : une cellule différenciée, comme une cellule musculaire, ne pouvait pas se transformer en une cellule d'un autre type, une cellule hépatique par exemple. Pourtant, il n'a pas fallu longtemps pour que les résultats du chercheur japonais soient reproduits et confirmés par d'autres équipes de biologistes cellulaires à travers le monde. Les cellules iPS étaient bel et bien une réalité.
Pour comprendre, il faut revenir à l'intuition de génie de Shinya Yamanaka : le chercheur a voulu savoir ce qui se passerait si on transférait des gènes actifs uniquement au stade embryonnaire, dans une cellule différenciée adulte. Pour mener l'expérience, il a, avec son équipe, identifié dans un premier temps 24 gènes de ce type, avant de restreindre la sélection à 4 d'entre eux (Oct4, Sox2, Klf4 et c-Myc). Et ça a marché ! Les cellules adultes ont "remonté le temps" jusqu'à redevenir des cellules indifférenciées. Mais cette recette est évidemment bien plus délicate à mettre en œuvre. Et elle ne fonctionne pas à tous les coups : « Dans le meilleur des cas, le taux de conversion de cellules adultes en iPSn'excède pas 5 % », précise Jean-Marc Lemaitre (Inserm, Montpellier). De très nombreux obstacles restent donc à franchir avant de trouver des applications directes aux iPS.
Un travail de culture astreignant fait à la main
La première difficulté consiste à obtenir ces fameuses iPS en quantités suffisantes. Car développer une lignée, c'est un peu comme réussir un soufflé : les ingrédients sont peu nombreux, mais rien n'est possible sans un bon tour de main, du doigté et de la patience. Une fois une iPS obtenue au bout de quelques jours, il faut en effet absolument éviter qu'elle ne se différencie à nouveau et ne redevienne une cellule adulte. Comment ? En veillant en permanence à séparer les iPS nouvellement créées du reste de leurs consœurs encore à l'état différencié dans la boîte de Pétri, ces récipients où l'on cultive les cellules en laboratoire. Un travail astreignant qui, aujourd'hui, se fait encore manuellement. Trois semaines de culture sont nécessaires pour obtenir une colonie et il faut plusieurs mois avant que cette colonie compte quelques milliers de spécimens. « De plus, les cellules iPS sont très sensibles et capricieuses. Il faut les surveiller 24 h/24 », explique Lina El Kassar. Tous les trois mois, cette biologiste de l'I-Stem au Génopole d'Evry, dans l'Essonne, accueille ainsi des chercheurs dans son atelier pour leur transmettre son savoir-faire. À l'issue du stage, chacun repart avec ses propres lignées d'iPS sur lesquelles il peut poursuivre ses travaux de recherche. Une initiative fructueuse qui a permis de former rapidement à la culture des iPS quantité de biologistes français, contribuant au bon positionnement de la France.
Autre difficulté : les iPS souffrent de défauts épigénétiques. En effet, la cure de jouvence qu'elles subissent ne parvient pas à remettre parfaitement tous les compteurs biologiques à zéro. Ainsi, les iPS - à l'inverse des CSEh, les cellules souches embryonnaires humaines - conservent de petites « étiquettes » à la surface de leurs gènes indiquant toujours leur signature de cellules adultes. Autrement dit, vues sous l'angle épigénétique, les iPS n'ont que l'apparence de cellules embryonnaires. En profondeur, elles demeurent de "vieilles" cellules. « Que ce soit pour unefuturemédecine régénératrice ou comme modèle in vitro d'une pathologie, ces désordres épigénétiques doivent êtrepris en compte, explique Marc Peschanski, directeur scientifique de l'I-Stem. Il faudra vérifier au préalable qu'ils ne constituent pas une nuisance.» Car le risque que des iPS souffrant de tels défauts deviennent cancéreuses n'est pas à écarter.
Obtenir des cellules souches pluripotentes par balnéation acide ? (janvier 2014) (Sciences et Avenir n° 805, mars 2014, p. 23)
Plonger des cellules dans un bain légèrement acide est-il de nature à les stresser suffisamment pour les transformer en cellules souches comme le proclame l'équipe de Haruku Obokata, du centre Riken, à Kobe ?
Depuis la publication fin janvier dans les colonnes de Nature du travail des Japonais, des critiques n'ont pas tardé à apparaître sur Internet, et plusieurs équipes dans le monde ont tenté de reproduire ces résultats, pour l'instant, la moisson n'est pas fameuse.
Selon le décompte du site Ipscell, sur dix tentatives, une seule s'est révélée fructueuse, et encore avec une production très modeste. « J'aurais tendance à classer ce résultat des Japonais dans les artefacts de culture, avoue Frank Yates, enseignant-chercheur à Sup'Biotech. Intuitivement, nous sommes beaucoup à penser que s'il était aussi simple d'obtenir des cellules souches, nous y serions arrivés bien avant par accident... »
Irrégularités méthodologiques, fraude délibérée, erreurs de manipulation ou travail scientifique révolutionnaire de nature à changer la face des biotechnologies ? La réponse définitive viendra sous peu, à la fin des investigations scientifiques de rigueur.
Des champs d'application très larges
Étudier une maladie.
En prélevant des cellules sur un malade, les iPS permettent de suivre le développement d'une cellule affectée d'une mutation. Ce qui était impossible avec les CSEh, car il faut disposer d'embryons porteurs de la pathologie.
Mieux comprendre le cancer.
En suivant le devenir d'une cellule à partir de son stade embryonnaire, les chercheurs espèrent élucider les mécanismes conduisant aux processus tumoraux et notamment les métastases.
Concevoir de nouveaux médicaments.
Les iPS doivent permettre à terme détester facilement l'effet de molécules potentiellement intéressantes pour bon nombre de maladies. Cette recherche est actuellement au point mort.
Élaborer une médecine régénératrice.
C'est l'objectif ultime : pouvoir remplacer des neurones, des cellules musculaires, un épiderme, etc. à partir de cellules suffisamment proches du système immunitaire du malade. Voir également sur ce même blog les articles : cellules souches et rajeunissement, des cellules souches dans la rétine, régénération de la rétine humaine, élaboration d'une rétine humaine en culture à partir de cellules souches, obtenir des neurones à l'aide de fibroblastes, créer des dents biologiques grâce à des cellules souches,
L'industrie pharmaceutique n'est pas prête à investir
Les espoirs se tournent plutôt vers la constitution de banques de cellules iPS qui seraient immunologiquement compatibles avec la majeure partie d'une population donnée : Européens, Asiatiques, etc. Soit des banques ethniques qui risquent de faire grincer bien des dents... D'autant que les firmes pharmaceutiques ne semblent pas décidées à participer à la constitution de telles banques. « Culturellement, les industriels de la pharmacie sont des chimistes, pas des biologistes, justifie Marc Peschanski. Ils ont encore du mal à travailler avec du matériel vivant. » Un avis partagé par Laurence Daheron, responsable de la plate-forme iPS/CSEh à l'université Harvard (Cambridge. États-Unis) : « L'industrie pharmaceutique commence tout juste à entrevoir le potentiel des iPS. Elle est loin d'être prête à s'investir dans la thérapie cellulaire. Il n'y a aucun changement radical à attendre de sa part pour les années à venir. Elle se contentera d'utiliser les iPS pour rester des médicaments classiques, rien de plus. »
Pourtant, tout porte à croire que le jour où la recherche publique aura prouvé le potentiel thérapeutique des iPS, la demande de millions de patients en attente d'un traitement sera suffisamment pressante pour forcer la main des industriels. Il reste juste à espérer que ces derniers auront alors la capacité de prendre le train en marche...
S'affranchir des manipulations fastidieuses in vitro en produisant in vivo des cellules souches pluripotentes induites (iPS)
Dans un article de Nature paru le 11 septembre 2013, des chercheurs espagnols sont parvenus à reprogrammer « in vivo » des cellules adultes de souris. Cette technique permet donc de s'affranchir des fastidieuses et coûteuses mises en culture des cellules adultes !
Le premier défi pour les chercheurs du Centre national de recherche sur le cancer (CNIO, Madrid) était de reproduire l'expérience de Yamanaka chez un être vivant. Ils ont choisi la souris comme organisme modèle. En utilisant des techniques de manipulation génétique, les chercheurs ont créé des souris dans lesquelles quatre gènes de Yamanaka pouvaient être activés à volonté. Lorsque ces gènes sont activés, les chercheurs ont observé que les cellules adultes étaient capables de régresser dans leur développement évolutif pour devenir des cellules souches embryonnaires dans plusieurs tissus et organes
En outre, l'équipe de Manuel Serrano a ainsi obtenu des cellules souches de meilleure qualité que celles produites in vitro. C'est un résultat spectaculaire : faire en sorte que des souris fabriquent des cellules souches pluripotentes induites, capables de fournir quasiment n'importe quelle cellule spécialisée de l'organisme. Autrement dit, qu'au sein d'un animal vivant des cellules adultes redeviennent des cellules souches embryonnaires ! Reprogrammer in vivo des cellules est désormais possible. La démonstration chez l'animal de la faisabilité d'un tel concept pourrait bouleverser la pratique de la future médecine régénératrice.
Les chercheurs espagnols ont ainsi franchi une nouvelle étape, en obtenant les mêmes résultats que Yamanaka, mais cette fois au sein du même organisme, chez la souris, sans avoir besoin de passer à travers dans des boîtes de culture in vitro. La génération de ces cellules dans un organisme apporte cette technologie encore plus proche de la médecine régénérative.
L'étape du laboratoire sera ainsi supprimée. Jusqu'à présent, on imaginait que pour greffer ces cellules iPS à un malade souffrant de diabète insuline-dépendant, d'insuffisance cardiaque ou de la maladie de Parkinson, il fallait au préalable les produire en passant par des manipulations sophistiquées et coûteuses en laboratoire. Le travail réalisé par l'équipe de Manuel Serrano bouleverse ce protocole : il sera possible d'induire la production de ces précieuses cellules souches au sein même du tissu ou de l'organe à réparer sans passer par l'étape du laboratoire. Une fois ces iPS produites par le patient, elles seraient amenées à se différencier en un type cellulaire particulier, en cellule du pancréas, du cœur, en neurone, par exemple.
Comme indiqué au début de cet article, pour reprogrammer des cellules adultes (de peau notamment) en cellules souches, il faut y introduire quatre gènes clés (Oct4, Sox2, Kfl4 et c-Myc). Ceux-ci produisent quatre facteurs de croissance jouant un rôle dans les premiers temps du développement embryonnaire. Les cellules adultes ainsi reprogrammées, dénommées iPS, sont capables de « remonter le temps » jusqu'au stade embryonnaire.
Cette technique de production, mise au point en 2006, a d'ailleurs valu le prix Nobel de médecine en 2012 au Japonais Shinya Yamanaka. Les chercheurs espagnols sont allés plus loin : l'organisme de leurs souris transgéniques fabrique lui-même ces quatre facteurs de croissance. Pour activer les quatre gènes, ils ont fait boire aux rongeurs de l'eau contenant de faibles doses d'un antibiotique : la doxycycline. Résultat : au bout de deux semaines et demie, les rongeurs ont développé des tumeurs (tératomes,) issues de cellules souches pluripotentes et contenant plusieurs types cellulaires adultes. Preuve manifeste pour les chercheurs que des cellules adultes de ces rongeurs avaient bien été reprogrammées en iPS avant qu'elles ne se transforment, à leur tour, et en divers endroits, en plusieurs types cellulaires. Par ailleurs, l'analyse de tissus de l'estomac, de l'intestin, du pancréas et des reins des rongeurs a montré la présence disséminée d'une reprogrammation cellulaire in vivo. De même, les chercheurs ont détecté la présence d'iPS dans le sang des souris qui avaient été reprogrammées pour en fabriquer.
Ces cellules iPS sont d'une qualité supérieure
Une autre surprise attendait les chercheurs : les cellules iPS produites chez ces souris et obtenues directement à partir de l'intérieur de l'organisme, ont une plus grande capacité de différenciation que ceux obtenus par culture in vitro. Plus précisément,ces ceklules ont les caractéristiques des cellules totipotentes, un état primitif jamais obtenu dans un laboratoire.
En effet, outre leur capacité à se transformer en n'importe quel type de cellule d'un embryon, elles ont pu se différencier en placenta. Ce résultat étonnant fait dire aux chercheurs que ces iPS obtenues in vivo sont à un stade encore plus précoce que les iPS produites en laboratoire. Il est évidemment hors de question d'utiliser une procédure semblable chez l'Homme, dans la mesure où les cellules reprogrammées risqueraient de former des tumeurs. En revanche, une stratégie de régénération in vivo pourrait, dans l'avenir, consister à administrer au malade, localement et pendant un temps limité, des gènes synthétiques codant les quatre facteurs de croissance identifiés par le prix Nobel Shinya Yamanaka.
D'autres pistes sont à l'étude comme administrer, au sein d'un organe ou d'un tissu malade, un cocktail de petites molécules capables d'activer le programme génétique de production de cellules iPS ou utiliser des virus rendus inoffensifs pour délivrer les quatre fameux gènes clés.
María Abad, le principal auteur de l'article et chercheur dans le groupe de Serrano, a déclaré: "Ce changement de direction dans le développement n'a jamais été observé dans la nature, nous avons démontré que nous pouvons également obtenir des cellules souches embryonnaires dans les organismes adultes et pas seulement en. le laboratoire ".
"Nous pouvons maintenant commencer à penser à des méthodes pour induire la régénération localement et de manière transitoire pour un tissu endommagé particulier.", précise Manuel Serrano.
Les cellules souches obtenues chez la souris montrent également des caractéristiques totipotentes jamais produites dans un laboratoire, équivalentes à celles présentes dans les embryons humains au stade de 72 heures de développement, quand ils sont composés de seulement 16 cellules.
En comparaison avec les cellules obtenues avec la technique développée par Yamanaka, les cellules souches obtenues par le CNIO représentent donc un état encore embryonnaire plus précoce, avec une plus grande capacité de différenciation.
Les auteurs ont même été capables d'induire la formation de structures pseudo-embryonnaires dans les cavités thoracique et abdominale des souris. Ces pseudo-embryons affichaient les trois couches typiques des embryons (ectoderme, mésoderme et endoderme), et des structures extra-embryonnaires tels que la membrane vitelline et même l'ébauche de cellules sanguines.
"Ces données nous disent que nos cellules souches sont beaucoup plus polyvalentes que les cellules iPS obtenues in vitro par Yamanaka, qui génèrent les différentes couches de l'embryon mais jamais les annexes embryonnaires, comme le placenta", a déclaré Manuel Serrano.
Les auteurs soulignent que les applications thérapeutiques possibles de leurs travaux restent lointaines, mais ils admettent que, sans doute, cela pourrait signifier une réorientation de la recherche sur les cellules souches, la médecine régénérative et l'ingénierie tissulaire.
"Nos cellules souches survivent aussi en culture, permettant ainsi de les manipuler dans un laboratoire. L'étape suivante est d'étudier si ces nouvelles cellules souches sont capables de produire efficacement différents tissus tels que ceux du pancréas, du foie ou du rein. ", a déclaré Abad.
Sources :
- María Abad, Lluc Mosteiro, Cristina Pantoja,Marta Cañamero, Teresa Rayon,Inmaculada Ors, Osvaldo Graña, Diego Megías, Orlando Domínguez,Dolores Martínez, Miguel Manzanares,Sagrario Ortega & Manuel Serrano. (2013). Reprogramming in vivo produces teratomas and iPS cells with totipotency features Nature : 10.1038/nature12586.
- Marc Gozian (2013) Des souris vivantes ont produit des cellules souches (Sciences et Avenir, n° 800, octobre 2013, pp. 78-79).
Voir également dans ce blog, l'article : Les-potentialités infinies des cellules souches.
16:50 Publié dans Biologie, Médecine | Tags : cellules souches, cellules souches adultes induites, ips, cseh, rétine, cancer | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le myélome multiple
Le myélome multiple
Mise à jour 02/07/2014
par Violette DELARUELLE [1], Gisèle HOARAU [2], Nicole MOREL [3] Dr Madalina UZUNOV [4], Dr Sylvain CHOQUET [5]
[1] Membre du CA de l'AFITCH-OR
[2] Membre du CA de l'AFITCH-OR
[3] Membre du CA de l'AFITCH-OR
[4] Hématologue
[5] Hématologue

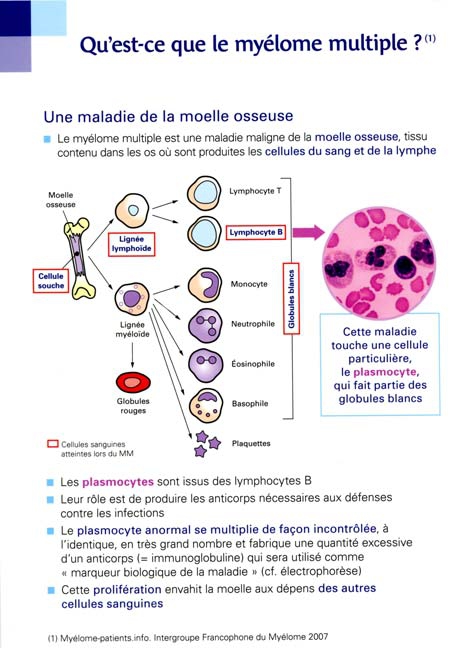
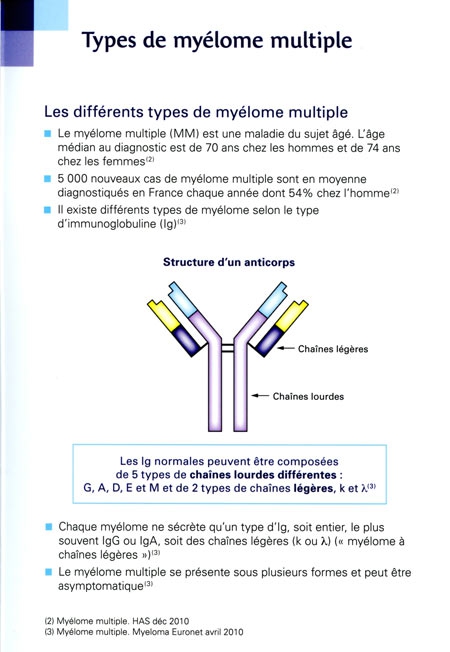
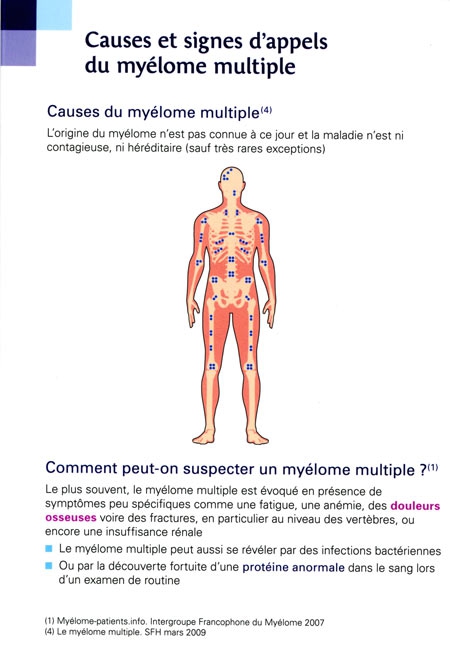
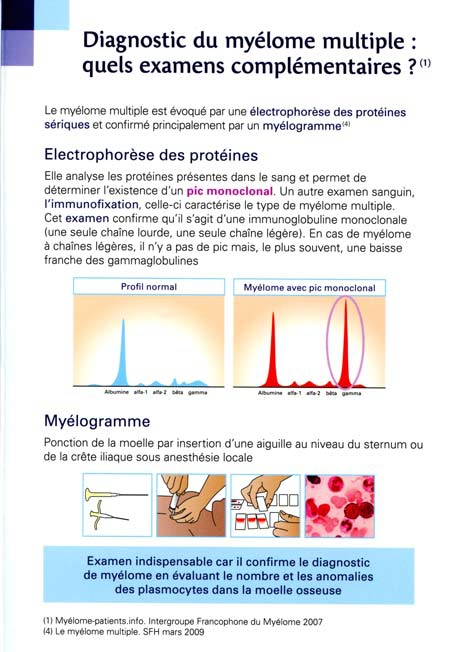
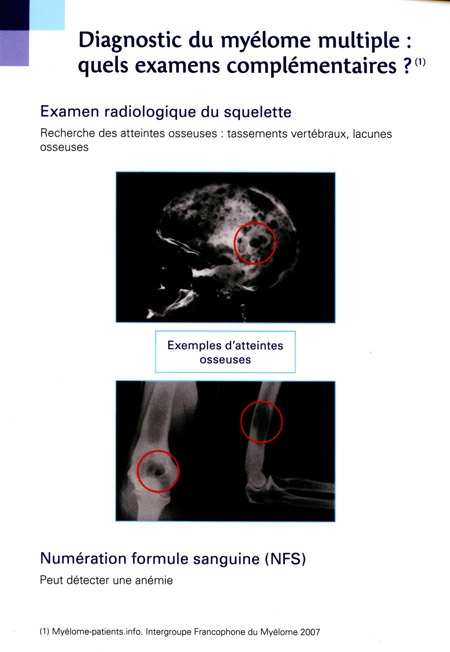
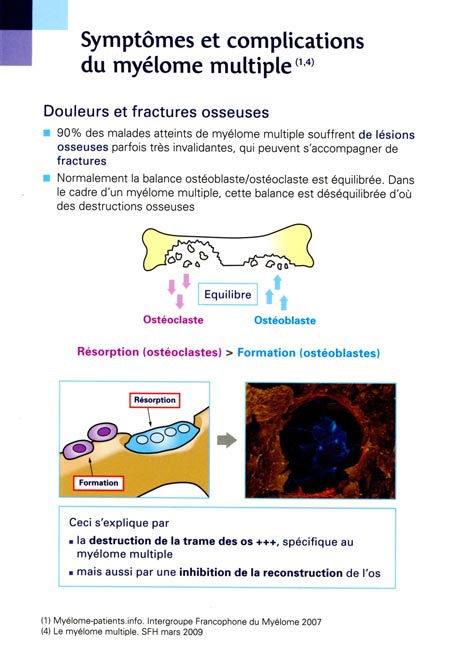





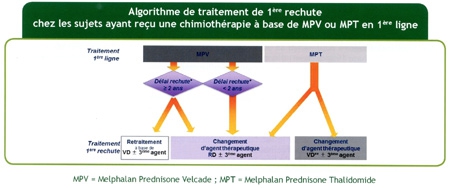
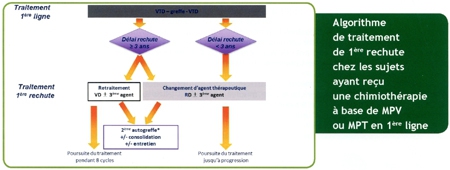
Rougeole et myélome : ajout du 16/05/2014.
Que faut-il en penser ? Voir l'article de Science et Avenir à ce propos.
Sites internet de référence :
Pour un premier contact : http://fr.wikipedia.org/wiki/My%C3%A9lome_multiple
Site d'information de l'Association des Malades du Myélome Multiple : www.af3m.org
Site d'information des malades sur le myélome : www.myelome.patients.info
16:49 Publié dans Médecine | Tags : myélome multiple | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Intensification thérapeutique avec support de cellules souches dans le traitement des myélomes multiples
Intensification thérapeutique avec support de cellules souches dans le traitement des myélomes multiples
(Dernière mise à jour : mars 2015)
Myélome multiple : image histopathologique d'un extrait de la moelle osseuse. Coloration à l'hématoxyline et à l'éosine (illustration @Wikimedia).
Introduction
La Chimiothérapie à haute dose avec support de cellules souches est une option thérapeutique importante pour les patients éligibles, atteints de myélome multiple. Qu'elle soit réalisée dans le cadre du traitement de première ligne ou au moment de la rechute de la maladie, elle peut donner des réponses d'excellente qualité et un avantage de survie. Le traitement à haute dose avec support de cellules souches, ou greffe de cellules souches, comme on rappelle parfois, est l'étape 5 des 10 étapes pour de meilleurs soins de l'IMF. Cette note explique le rationnel et le côté pratique de la chimiothérapie à haute dose avec greffe de cellules souches en tant qu'option thérapeutique dans le myélome. Les questions abordées seront les suivantes :
• Que sont les cellules souches hématopoïétiques ?
• Pourquoi les cellules souches sont-elles recueillies et utilisées pour une greffe ?
• Quels sont les avantages et les risques de la chimiothérapie à haute dose avec greffe de cellules souches dans le cadre du traitement du myélome ?
• Quel est le rôle de la chimiothérapie à haute dose depuis l'introduction de nouvelles drogues ces dix dernières années? Peuvent-elles être associées ?
Tous les mots qui apparaissent en caractères gras, ainsi que les autres termes pertinents sont définis à la fin de cette note.
Rationnel pour l'utilisation de la chimiothérapie à haute dose avec greffe ou support de cellules souches hématopoïétiques
Les cellules myélomateuses et les cellules souches normales ou cellules souches hématopoïétiques cohabitent dans le même microenvironnement au niveau de la moelle osseuse. Comme les cellules myélomateuses s'accumulent dans la moelle osseuse, elles se mélangent avec les cellules souches normales responsables de la production des globules rouges et blancs et des plaquettes. Tous les médicaments anti-myélome atteignant le microenvironnement de la moelle osseuse peuvent donc endommager à la fois les cellules myélomateuses et les cellules souches normales.
Le melphalan, un agent de chimiothérapie appartenant à la famille des alkylants, est un traitement très efficace dans le myélome, mais il peut aussi endommager les cellules souches normales. De fortes doses de melphalan peuvent être particulièrement utiles pour éradiquer les cellules myélomateuses dans la moelle osseuse. Pour contourner le problème des dommages collatéraux sur les cellules souches normales, ces cellules souches sont collectées et congelées avant que le melphalan ne soit administré à forte dose.
Les cellules souches normales sont collectées ou recueillies chez le patient ou un donneur par un processus appelé cytaphérèse. Les cellules souches recueillies sont ensuite congelées à -80 degrés. Elles peuvent être conservées indéfiniment à cette température. Lorsque le patient recevra les fortes doses de melphalan, les cellules souches seront alors décongelées et réinjectées dans la circulation sanguine du patient par un procédé analogue à celui d'une transfusion sanguine. Les cellules souches sont ensuite capables de retourner dans la moelle osseuse, où elles vont se diviser et croître pour repeupler la moelle osseuse. Environ 36 à 48 heures après son administration, les concentrations sanguines et tissulaires de melphalan sont très faibles et ne nuisent pas à la croissance des cellules souches. L'ensemble du processus de collecte et de réinjection est appelée greffe de cellules souches, ou support de cellules souches, parce que les cellules souches "sauvent" la moelle osseuse des effets de la chimiothérapie à haute dose.
Les différents types de greffe de cellules souches
• Autogreffe de cellules souches, ou, plus exactement, intensification thérapeutique avec autogreffe de cellules souches.
Les cellules souches sont recueillies chez le patient atteint de myélome après le traitement initial et réinjectées après un traitement par melphalan à haute dose. Il s'agit du type de greffe de cellules souches le plus courant. La procédure peut être effectuée une fois (autogreffe simple) ou deux fois (double transplantation ou en tandem) voire plusieurs fois.
• Greffe Syngénique de cellules souches
Les cellules souches sont recueillies chez un vrai jumeau. Dans ce cas, les cellules souches du vrai jumeau sont réinjectées après une chimiothérapie à haute dose par melphalan ou par d'autres agents.
• Allogreffe de cellules souches
Les cellules souches sont recueillies chez un membre de la famille qui n'est pas un jumeau identique, mais parfaitement compatible par typage tissulaire (système HLA). Habituellement, le meilleur donneur est un frère ou une sœur. Encore une fois, les cellules souches sont réinjectées après la chimiothérapie à haute dose. Les effets anti-cancer de ce type de greffe découlent en partie de la chimiothérapie à haute dose, et en partie de l'effet des cellules greffées, ou transplantées, sur la maladie. Les cellules transplantées reconnaissent les cellules cancéreuses comme étrangères, les attaquent et les tuent. C'est ce qu'on appelle l'effet du greffon contre le myélome. Le problème avec les cellules souches du donneur, c'est qu'elles peuvent aussi reconnaître certaines cellules normales du receveur comme étrangères, et donc les attaquer, provoquant la maladie du greffon contre l'hôte, ou GVH. Certains cas de GVH sont contrôlables, et certains ne le sont pas. Lorsque la GVH ne peut pas être contrôlée, elle peut être mortelle. Cette procédure est rarement utilisée chez les patients atteints de myélome, avec une chimiothérapie à très forte dose parce que le risque de décès par GVH est d'environ 45%. La greffe allogénique à pleine dose a été largement abandonnée pour les patients atteints du myélome au début des années 1990.
• "Mini"allogreffe ou non myéloablative
Il s'agit d'une procédure plus sûre que l'allogreffe complète ou standard. Elle utilise une chimiothérapie d'intensité réduite en association avec une greffe de cellules souches d'un donneur compatible. Une autogreffe est le plus souvent effectuée en premier, afin de réduire la charge tumorale du myélome, puis, dans les 180 jours, une dose réduite de la chimiothérapie est administrée avant que le patient ne reçoive les cellules souches du donneur. Bien que la GVH et l'effet du greffon contre le myélome puissent encore se produire, ils ne sont généralement pas aussi graves que dans l'allogreffe standard.
• Allogreffe de cellules souches de donneur non apparenté
Les cellules souches sont recueillies chez un donneur extrafamilial. Dans ce cas, les cellules souches sont plus rarement compatibles à 100%. D'où le terme de "mismatch" fréquemment utilisé dans cette situation. Une greffe non apparentée comporte un risque beaucoup plus élevé de GVH et est une procédure globalement plus risquée.
Comment l'intensification thérapeutique avec greffe de cellules souches est intégrée dans le traitement du myélome ?
- Généralités
La chimiothérapie à haute dose avec greffe de cellules souches est utilisée dans le traitement du myélome depuis plus de deux décennies. Les médecins tentent de tuer autant de cellules myélomateuses que possible pour "réduire la masse tumorale" avant de recueillir les cellules souches puis d'administrer la chimiothérapie à forte dose (HDT). Les patients doivent donc recevoir une induction ou traitement de "première ligne" avec divers médicaments avant de commencer le processus d'intensification thérapeutique. Même en cas de réponse minimale à l'induction, les patients peuvent procéder à la collecte, au traitement à haute dose avec greffe de cellules souches ; ils ont encore d'excellents résultats. La réponse après l'HDT est beaucoup plus importante que la réponse avant, et ce tant que la maladie n'est pas progressive.
- Les options de première ligne
Plusieurs options sont disponibles comme traitement d'induction ou de première ligne. Les traitements de première ligne les plus couramment utilisés sont :
•Velcade® (bortezomib) plus dexamethasone avec une troisième drogue comme le Thalidomide (T) voire le Revlimid® (lenalidomide) (R) ou l'Endoxan (C).
Les acronymes pour ces régimes d'induction sont : VTD, VRD et VCD ou CyBorD aux USA.
• Dans d'autres pays, l'association d'un des 2 IMiDs (agents immunomodulateurs) Thalidomide ou Revlimid à la dexamethasone peut être proposée aux patients candidats à l'intensification avec un recueil des cellules souches organisé après 4 cycles.
Options de première ligne à considérer et à éviter
Généralement, la greffe de cellules souches est une option pour tous les patients atteints du myélome à la fin du traitement d'induction. Toutefois, la greffe étant une approche intensive, les patients âgés de plus de 65 ans et/ou ceux atteints d'autres pathologies médicales peuvent ne pas être en mesure de tolérer la procédure et/ou peuvent courir le risque de graves complications. Si la greffe de cellules souches est envisagée comme une option, il est important d'éviter l'usage du melphalan avant le prélèvement des cellules souches, puisque cela peut les endommager. Ainsi, la stratégie la plus souvent recommandée consiste à éviter de prime abord l'usage du melphalan. Toutefois, si la greffe de cellules souches s'avère impossible ou n'est pas souhaitée, quelle qu'en soit la raison, le melphalan par voie orale (comprimés), utilisé dans le cadre du traitement initial, peut s'avérer un traitement simple et très efficace.
En résumé
Les cellules souches sont prélevées, la chimiothérapie à forte dose est ensuite administrée et la greffe est réalisée, tout cela à la suite du traitement d'induction ou de première ligne. Les deux points majeurs du traitement d'induction sont :
• Le traitement d'induction, pour une durée de 3 à 6 mois, doit préserver les cellules souches normales.
• Théoriquement, une réponse au traitement d'induction devrait entraîner une baisse de >50% de la protéine monoclonale et/ou d'autres indicateurs de myélome actif avant le prélèvement des cellules souches. Toutefois, un taux de réponse inférieur peut suffire pour réaliser dans de bonnes conditions un prélèvement de cellules souches (qui ne sont pas malades).
Quels sont les avantages de la chimiothérapie à forte dose avec support de cellules souches ?
Amélioration de la profondeur de la réponse
L'augmentation du taux de réponse obtenu dans le cadre du traitement de première ligne est un avantage important de l'intensification thérapeutique avec greffe de cellules souches. Dans plus de la moitié des cas, les réponses s'améliorent de façon considérable avec des réponses partielles qui deviennent une TBRP (très bonne réponse partielle, baisse de 90 % de la protéine monoclonale) voire une RC (réponse complète, disparition du composant monoclonal).
Amélioration de la survie
L'introduction des nouvelles drogues dans les régimes d'induction a permis d'augmenter considérablement les taux de TBRP ou RC et, l'avantage supplémentaire du traitement à haute dose dans ce contexte est étudié spécifiquement. La chimiothérapie à haute dose a démontré un bénéfice statistiquement significatif après chimiothérapie d'induction classique (par opposition aux nouvelles associations) utilisant anciennement le VAD. Toutefois, les nouvelles combinaisons thérapeutiques peuvent produire des niveaux plus élevés de TBRP et RC que la chimiothérapie classique. Les résultats de deux études comparant les nouvelles combinaisons seules contre nouvelles combinaisons plus HDT avec greffe de cellules souches ont été présentées au congrès de la AmericanSocietyofHematology (ASH) en décembre 2011. Les données préliminaires suggèrent que, malgré des effets toxiques accrus, les nouvelles combinaisons thérapeutiques suivies de fortes doses de melphalan avec greffe de cellules souches peuvent améliorer non seulement la survie sans progression, mais aussi la survie globale. D'autres études et un suivi à plus long terme sont nécessaires pour confirmer ces données préliminaires.
Rôle de la Consolidation et de la Maintenance
Un avantage particulier de l'intensification thérapeutique est que la réponse peut se compléter dans les semaines et les mois qui suivent la procédure. Si une RC ou une TBRP sont obtenues, alors ces patients peuvent être suivis sans devoir avoir recours à un traitement d'entretien ou de maintenance. On leur proposera certainement un traitement de consolidation. Les patients qui bénéficient de l'intensification thérapeutique sont souvent en rémission plus longtemps et donc profitent de périodes plus longues avant qu'un nouveau traitement soit requis. Toutefois, selon les caractéristiques initiales de la maladie, y compris l'analyse chromosomique, le traitement d'entretien et/ou autre traitement (consolidation) peuvent être recommandés après la greffe.
Rôle d'une seconde greffe
Si une RC ou au moins une TBRP ne sont pas obtenues après une première autogreffe, une seconde autogreffe ou une autre greffe, comme la "mini-allogreffe" voir ci-dessus, peuvent être effectuées. Poursuivre les efforts pour atteindre au moins une TBRP avec une seconde greffe ne semble pas conférer un avantage aux patients.
Facteurs influençant le devenir
II est généralement admis que les patients qui obtiennent une très bonne réponse comme une RC ou une TBRP ont un meilleur devenir (en comparaison, par exemple, à une réponse partielle [RP]). Toutefois, d'autres études s'imposent. Obtenir une réponse durable, que ce soit avec une simple RP (⩾ 50% d'amélioration), TBRP (⩾ 90%) ou RC (100%), est plus important que le niveau de réponse en soi. Une réponse qui dure au moins deux ans est bien plus avantageuse. Le bénéfice d'une maladie stable, quel que soit le niveau de réponse (RP, TBRP ou RC) fait actuellement l'objet d'une étude.
Étapes importantes avant de considérer l'intensification thérapeutique avec support de cellules souches comme une option de traitement
I.
• Confirmer le diagnostic de myélome multiple actif ou symptomatique, nécessitant un traitement spécifique.
• S'il y a le moindre doute quant au diagnostic ou la prise en charge thérapeutique, cela peut être le moment opportun pour demander un second avis avant de débuter le traitement de première ligne.
II.
• Débuter le traitement de première ligne ou d'induction afin de contrôler le myélome et d'obtenir une réponse initiale.
• Éviter le melphalan ou tout autre traitement qui pourraient affecter la qualité des collectes de cellules souches. Une radiothérapie étendue sur le basin peut diminuer les réserves de cellules souches et devrait être évitée si possible.
III.
• Évaluer la réponse au traitement à chaque cycle (habituellement toutes les 3 à 4 semaines).
• Après 3 à 4 cycles, une évaluation plus complète est souvent nécessaire, comprenant un examen de la moelle osseuse et de l'imagerie afin de déterminer le niveau de réponse.
IV.
• Revoir avec votre médecin les avantages et les inconvénients d'une intensification avec greffe de cellules souches (et/ou discuter d'un prélèvement de cellules souches sans greffe immédiate).
• Si une réponse de ⩾ 50% est atteinte (RP : baisse de ⩾ 50% de la concentration de protéine liée au myélome dans le sang et/ou l'urine), la collecte de cellules souches peut être organisée si le patient et le médecin pensent que c'est la meilleure option. S'il n'est pas prévu de procéder au prélèvement et/ou à une greffe, un nouveau plan de traitement et de suivi doit être proposé.
• Si la réponse est < 50%, alors un autre traitement peut être envisagé avant de réaliser la greffe.
Comment les cellules souches sont-elles recueillies ?
Les cellules souches sont situées dans la moelle osseuse. Jusqu'à il y a environ 20 ans, le patient ou le donneur devaient être sous anesthésie générale et subir de 50 à 100 ponctions de la moelle osseuse sur la partie postérieure de l'os iliaque du bassin afin de prélever suffisamment de moelle osseuse et de cellules souches pour une greffe ultérieure. Cette procédure était évidemment douloureuse, angoissante et incommodante. Il va sans dire que ce fut une avancée majeure que de découvrir que les cellules souches pouvaient être prélevées dans la circulation sanguine en administrant au patient ou au donneur des injections de facteurs de croissance ("facteurs stimulants les colonies ou CSF") tels que le Neupogen®, le Granocyte®, le Neulasta®.... pour déclencher la libération de cellules souches médullaires dans la circulation sanguine. Améliorée au fil des années, cette procédure constitue aujourd'hui la méthode standard. Il est rarement nécessaire d'utiliser l'ancienne méthode de prélèvement dans le bassin.
Comment prélever les cellules souches dans le sang périphérique (CSP) ?
Il existe trois méthodes de prélèvement de cellules souches périphériques :
1) sous facteurs de croissance seuls, 2) sous facteurs de croissance, combinés à une chimiothérapie, 3) sous facteurs de croissance, combinés à un autre agent mobilisateur.
1. Donner des facteurs de croissance seuls
Les facteurs de croissance sont des médicaments qui stimulent la croissance et la libération des cellules souches dans le sang. Ces traitements sont administrés par voie sous-cutanée (sous la peau). Les facteurs de croissance des globules blancs (Neupogen®, Neulasta®, Granocyte®...) sont utilisés pour le recueil de cellules souches. Ce processus s'appelle la "mobilisation". Les injections sont administrées quotidiennement durant une période minimale de cinq jours. Les cellules souches sont habituellement prélevées le cinquième jour après le début des injections. Les prélèvements et les injections se poursuivent de façon quotidienne jusqu'à l'obtention d'un nombre suffisant de cellules souches. Généralement, il est programmé de collecter assez de cellules souches pour au moins 2 greffes, c'est-à-dire au moins 2-3 millions de cellules souches par kg de poids du patients par greffe (soit 4-6 million/kg au total).
2. Facteurs de croissances combinés à la chimiothérapie
L'Endoxan (ou cyclophosphamide) est la chimiothérapie la plus souvent utilisée dans ce contexte pour augmenter la libération des cellules souches dans le sang. Bien évidemment, d'autres chimiothérapies peuvent être utilisées. Votre médecin vous expliquera pourquoi, selon le cas, il peut être ou non approprié d'avoir recours à une chimiothérapie, comme l'Endoxan, en combinaison avec des facteurs de croissance. Il vous expliquera également quels sont les effets positifs et négatifs de l'Endoxan s'il est utilisé pour mobiliser les cellules souches sanguines.
En premier lieu, l'Endoxan est utilisé pour augmenter le rendement des cellules souches et est donc recommandé si l'on craint que la collecte des cellules souches soit faible. L'Endoxan a l'avantage supplémentaire d'être également un traitement pour le myélome. L'inconvénient de l'Endoxan est qu'il est administré le plus souvent en hospitalisation pour la mobilisation. Qui plus est, il peut entraîner une aplasie et, lorsque les globules blancs (système immunitaire de l'organisme) sont à des niveaux très bas, une infection peut se déclarer, nécessitant éventuellement une autre hospitalisation.
Après la chimiothérapie de mobilisation, un facteur de croissance de la lignée granulocytaire (globules blancs) sera administré par injection sous la peau quotidiennement pendant environ 10 jours. Cette procédure est donc plus longue et beaucoup plus intensive que l'utilisation de facteurs de croissance seuls. Le patient ou son entourage peuvent être éduqués pour réaliser les injections eux même à la maison. Sinon, les patients peuvent recevoir les injections de facteur de croissance avec infirmière à domicile. Une fois le nombre de cellules souches dans le sang suffisamment élevé, elles seront collectées sur 2 à 5 jours, alors que le patient continue de recevoir des injections de facteurs de croissance.
3. Autre agent mobilisateur combiné à la chimiothérapie
Le Mozobil® (plérixafor) a été approuvé par la FDA en 2008 comme un agent supplémentaire pour la mobilisation des cellules souches. Le Mozobil® est utilisé en association avec des facteurs de croissance pour libérer les cellules souches dans le sang afin qu'elles puissent être collectées et utilisées pour la greffe chez les patients atteints de myélome (ainsi que les patients atteints de lymphome non hodgkinien). Les patients sont traités avec des facteurs de croissance pendant 4 jours avant de recevoir le Mozobil. Ce dernier est injecté en sous-cutanée environ 11 heures avant la collecte de cellules souches prévue pour un maximum de 4 jours consécutifs. Le Mozobil augmente le nombre de cellules souches qui peuvent être recueillies et est particulièrement utile pour les patients qui, pour diverses raisons (telles que l'âge ou des régimes de traitements antérieurs intensifs), ont du mal à générer des cellules souches pour le recueil.
Les essais cliniques ont démontré plusieurs avantages à utiliser le Mozobil en plus des facteurs de croissance par rapport aux facteurs de croissance seuls pour la mobilisation des cellules souches. Les avantages du Mozobil sont les suivants :
• Taux de réussite plus élevés pour la mobilisation de cellules souches. Plus de patients atteignent le nombre minimum et le nombre cible de cellules souches, et sont en mesure ainsi d'avoir à la greffe. La réinjection de plus de cellules souches au patient peut se traduire par une récupération de globules blancs, de globules rouges et de plaquettes de plus longue durée (ou "durable").
• Moins de procédures de cytaphérèses nécessaires, avec donc un nombre réduit de passage sur la machine.
• Pratiquement tous les patients atteints de myélome et de lymphome non hodgkiniens ayant reçu une mobilisation par Mozobil en combinaison avec des facteurs de croissance ont été greffes avec succès.
• Une présentation durant l'ASH 2011 par Adel et al du Mémorial Sloan Kettering a démontré que l'utilisation dès le départ du Mozobil serait plus rentable que l'approche actuelle largement utilisée employant l'Endoxan, non seulement parce que le Mozobil nécessite moins de jours de cytaphérèse, mais parce que les patients qui utilisent le Mozobil ne nécessite pas d'hospitalisation.
Le recueil ou la procédure de collecte
Dans le jargon médical, le prélèvement est dénommé cytaphérèse - c'est-à-dire l'extraction des globules blancs de la circulation sanguine. La cytaphérèse est une procédure grâce à laquelle le sang du patient ou du donneur circule à travers un appareil spécial qui sépare (par une technique de centrifugation) puis extrait les cellules souches. Le reste du sang est immédiatement réinjecté au patient ou au donneur. Il s'agit d'une procédure exceptionnellement simple et sans douleur comparativement au prélèvement de moelle osseuse dans le bassin.
Cytaphérèse
Avant de procéder aux cytaphérèses, un petit tube flexible en plastique appelé cathéter est inséré dans une veine afin de pouvoir y prélever du sang. Durant cette procédure, le sang est prélevé par le cathéter et traité dans un appareil afin de retirer les cellules souches. Le reste du sang est réacheminé à travers le même cathéter (la lumière qui n'est pas utilisée dans un cathéter à deux lumières) ou en utilisant un autre cathéter. On doit prévoir trois à quatre heures par jour pendant une à cinq journées pour les cytaphérèses. Les cytaphérèses sont habituellement effectuées en externe. Les effets secondaires les plus courants ressentis durant les cytaphérèses sont de légers étourdissements, sensations de fourmillement dans les mains et les pieds. Les effets secondaires les moins fréquents comportent les frissons, les tremblements et les douleurs musculaires. Ces effets secondaires sont temporaires et sont provoqués par les changements dans le volume sanguin du patient alors qu'il circule de l'intérieur à l'extérieur de l'appareil, ainsi que par les anticoagulants ajoutés au sang afin d'éviter la coagulation sanguine durant la cytaphérèse.
Traitement des cellules souches
À la suite du prélèvement, le sang périphérique (ou occasionnellement la moelle osseuse) est acheminé vers le laboratoire de traitement, habituellement situé à l'hôpital ou à la banque de sang locale (à Besançon à l'Institut Français du Sang [IFS]). Dans le laboratoire de traitement, la moelle osseuse ou les cellules souches sanguines sont préparées pour la congélation (cryoconservation). Les cellules souches sont mélangées dans une solution contenant le composé chimique DMSO (diméthylsulfoxide) afin de les préparer pour la congélation. Les cellules souches sont par la suite congelées et conservées dans de l'azote liquide. Les cellules souches restent congelées jusqu'au moment de la greffe. Elles peuvent être congelées aussi longtemps que nécessaire. On remarque une détérioration avec le temps, mais l'on peut maintenir une excellente fonction des cellules souches pendant au moins dix ans.
De combien de cellules souches ai-je besoin ?
Plusieurs études ont été réalisées au fil des ans afin de déterminer le nombre de cellules souches requises pour recevoir un traitement à fortes doses en toute sécurité. Le nombre de cellules souches est quantifié grâce à une technique de laboratoire spécialisée surnommée "analyse des cellules CD34+ par cytométrie en flux". Un petit échantillon des cellules souches qui ont été prélevées est analysé afin de déterminer la teneur en cellules CD34+. Nous savons que le nombre minimum de cellules souches requis pour effectuer une greffe en toute sécurité est de 2 millions de cellules CD34+ par kilogramme de poids corporel. Le nombre de cellules CD34+ est vérifié dans le prélèvement quotidien et inventorié. Le processus de prélèvement se poursuit de façon quotidienne jusqu'à ce que le nombre de cellules requises soit prélevé - habituellement de 1 à 4 jours. Certains centres de transplantation vérifient le nombre de cellules CD34+ le jour même AVANT d'effectuer la cytaphérèse afin de s'assurer que le prélèvement sera optimal. La plupart des médecins greffeurs prélèvent suffisamment de cellules souches pour deux greffes (plus de 4 voire 6 millions de cellules CD34+ par kilogramme de poids corporel).
Administrer la chimiothérapie à haute dose
Lorsque les cellules souches ont été congelées et conservées, le patient est prêt à recevoir une chimiothérapie à fortes doses. Ce traitement est conçu pour éliminer les cellules myélomateuses de façon plus efficace que les doses standards de chimiothérapie. Le but de la chimiothérapie à fortes doses est d'éliminer les cellules myélomateuses dans le corps du patient. Le type de chimiothérapie à fortes doses le plus couramment utilisé pour traiter le myélome est le melphalan administré à une dose de 200 milligrammes par mètre carré (mg/m2) de surface corporelle (selon la taille et le poids du patient). En tenant compte du type de myélome et d'autres facteurs, certains patients peuvent recevoir une deuxième greffe 3-6 mois après la première (double autogreffe ou greffe en tandem). Le patient devrait discuter, avec son médecin, des avantages et inconvénients de réaliser deux greffes consécutives comparativement à la possibilité de conserver les cellules pour une deuxième greffe à une date ultérieure.
Autogreffe de cellules souches
Les cellules souches déjà prélevées sont décongelées et réinjectées dans la circulation sanguine par un cathéter (comme c'est le cas pour un individu qui reçoit une transfusion sanguine) un à deux jours après la chimiothérapie à fortes doses. C'est ce qu'on appelle une "greffe", mais ce n'est pas le terme exact car les patients en fait reçoivent leurs propres cellules souches. Ces cellules ne sont pas greffées à partir d'un donneur. La greffe est réalisée dans la chambre du patient : il ne s'agit pas d'une intervention chirurgicale. Les poches congelées de cellules souches sont décongelées dans un bain d'eau chaude, et leur contenu réinjecté dans la circulation sanguine par le cathéter. Au moment de la décongélation, le DMSO (agent de congélation) s'évapore dans l'air et crée une odeur distincte et quelque peu désagréable d'ail. La plupart des centres perfusent une poche à la fois. La perfusion se déroule sur une période de 1 à 4 heures.
Les cellules souches réinjectées circulent dans le sang et retournent dans la moelle osseuse, où elles produisent de nouveaux globules blancs, globules rouges et plaquettes. Il faut prévoir de 10 à 14 jours pour que les nouvelles cellules sanguines puissent apparaître dans la circulation en nombre suffisant. Des facteurs de croissance peuvent être administrés au patient afin d'accélérer le processus.
En plus d'anéantir la moelle osseuse, la chimiothérapie à fortes doses peut provoquer d'autres effets secondaires graves pouvant nécessiter l'hospitalisation de certains patients afin qu'ils soient traités durant cette période. (Les centres de transplantation aux USA n'exigent pas tous que les patients demeurent à l'hôpital suivant la réinjection des cellules souches ; certains sont dotés d'établissements à proximité où les patients peuvent demeurer et être suivis de façon quotidienne en clinique externe, alors que d'autres permettent aux patients dont la résidence est située à proximité de l'hôpital de dormir à la maison et d'être suivis à l'hôpital). La durée moyenne du séjour à l'hôpital (ou dans un établissement à proximité) pour la chimiothérapie, la greffe et la convalescence est environ de trois semaines. Juste avant de commencer la chimiothérapie, les patients doivent habituellement consommer d'importantes quantités de liquides afin de prévenir la déshydratation et les lésions rénales occasionnées par la chimiothérapie.
Certains des effets secondaires fréquents de la chimiothérapie incluent les nausées, les vomissements, la diarrhée, les ulcères dans la bouche ou mucite, les éruptions cutanées, la perte de cheveux, la fièvre ou les frissons et les infections.
Des médicaments conçus pour prévenir ou atténuer certains des effets secondaires du traitement sont automatiquement administrés. Les patients sont suivis étroitement pendant et après la chimiothérapie à fortes doses. Le suivi comprend une vérification quotidienne du poids ainsi que des lectures fréquentes de la pression artérielle, du rythme cardiaque et de la température.
Prévenir les Infections
Au cours des deux à trois semaines suivant la greffe, les cellules souches injectées migrent vers la moelle osseuse et commencent à produire des cellules sanguines, un processus appelé prise de greffe. Jusqu'à ce que la prise de greffe ait lieu, les patients sont à risque de développer des infections. Même une infection bénigne, comme un rhume, peut mener à de sérieuses complications puisque le système immunitaire est affaibli par la chimiothérapie à fortes doses. Il faut donc prendre des précautions particulières durant la période de convalescence. Comme le système immunitaire est très affaibli, les patients doivent demeurer à l'hôpital jusqu'à ce que les concentrations de globules blancs atteignent un niveau suffisant pour qu'ils puissent sortir. Afin de prévenir les infections, les traitements de support suivants peuvent s'avérer nécessaires :
• Des antibiotiques sont souvent prescrits afin d'aider à prévenir les infections.
• Les visiteurs doivent se laver les mains et, à l'occasion, porter un masque et des gants afin de protéger le patient.
• II est parfois interdit d'apporter des fruits, des légumes frais et des fleurs dans la chambre du patient pour éviter les infections (bactéries et infections fongiques).
• En présence d'infection et/ou de fièvre (en raison d'une diminution des taux de globules blancs), le patient peut recevoir un traitement antibiotique intraveineux.
Prise de greffe et convalescence
Une fois que les cellules souches ont été réinjectées, on doit prévoir jusqu'à deux semaines pour que les globules blancs atteignent un niveau normal. À la suite d'une greffe, plusieurs centres de transplantation utilisent, là encore, des facteurs de croissance granulocytaires (Neupogen®, Neulasta®, Granocyte®....), pour stimuler la moelle osseuse afin qu'elle produise des cellules sanguines saines. Ces injections (sous-cutanées) peuvent se poursuivre jusqu'à ce que les leucocytes atteignent un niveau normal. Durant cette période dite d'aplasie, des transfusions de globules rouges et/ou de plaquettes peuvent s'avérer nécessaires.
Attendre la prise de greffe des cellules souches greffées, la remontée des globules blancs à un niveau normal et la disparition des effets secondaires, est souvent la période la plus difficile pour le patient, sa famille et ses amis. Au cours de cette période, les patients se sentent faibles et ressentent une grande fatigue. Il est très important d'avoir un soutien. La convalescence peut se comparer à un tour sur les montagnes russes : un jour, le patient se sent beaucoup mieux, puis le lendemain plus malade que jamais. Il est important de vivre les choses au jour le jour durant cette période. Lorsque les nouvelles cellules sanguines sont produites, les symptômes disparaissent, les risques d'infections graves diminuent et les transfusions ne sont plus nécessaires.
Après être sorti de l'hôpital, le patient poursuit sa convalescence à la maison pendant deux à quatre mois. Même si les patients sont en mesure de quitter l'hôpital, leur convalescence est loin d'être terminée.
Durant les premières semaines, ces patients sont faibles et ne réussissent souvent qu'à dormir, s'asseoir et marcher un peu dans la maison. Les patients peuvent habituellement reprendre leurs activités ou retourner au travail à temps plein trois à six mois après la greffe, bien que ceci puisse varier d'un individu à un autre.
Suis-je candidat à l'intensification thérapeutique avec greffe de cellules souches ?
Le traitement intensif avec greffe de cellules souches est une option thérapeutique pour de nombreux patients atteints d'un myélome ; toutefois, cela ne guérit pas. La greffe peut prolonger la période de rémission et la durée de vie. Elle peut également procurer une meilleure qualité de vie pour la plupart des patients.
Les patients atteints d'un myélome ne sont pas tous des candidats à une greffe de cellules souches. Plusieurs facteurs doivent être considérés. Ceux-ci incluent des facteurs liés au myélome en soi et des facteurs liés au patient.
Facteurs liés au Myélome
• type de myélome
• stade de la maladie
• agressivité de la maladie
• réponse au traitement
• taux d'albumine sérique
• taux de bêta-2 microglobuline initial
• analyse des chromosomes
Facteurs liés au Patient
• âge
• état de santé
• fonction rénale, cardiaque, pulmonaire,
et hépatique
• préférence du patient
• situation familiale
• situation professionnelle
On ne peut suffisamment insister sur le fait que le myélome est une maladie très particulière à chacun. Bien qu'il existe des similarités entre les patients, chaque cas présente ses propres caractéristiques distinctes.
De nombreuses variables sont examinées avant de déterminer si une greffe est recommandée. Par conséquent, les généralités au sujet du devenir pendant et après la greffe ne sont pas appropriées. Les données récentes d'essais cliniques suggèrent qu'une induction comprenant le thalidomide, le Revlimid, et/ou le Velcade peut donner des taux de réponse et une durée de réponse comparables à ceux obtenus après HDT avec support de cellules souches ; cela permettrait à certains patients de reporter l'HDT plus tard dans l'évolution de la maladie. D'autres études sont en cours pour valider ces données.
Souvenez-vous, dans la majorité des cas, avoir un myélome laisse le temps au patient d'effectuer des recherches et de recueillir les informations nécessaires pour prendre une décision plus avertie sur l'option la plus appropriée. Par exemple, un patient peut réaliser un prélèvement de cellules souches et les conserver pour un traitement ultérieur. Cela permet au patient de bénéficier de plus d'options de traitement de première ligne. Il s'agit de facteurs à discuter avec votre médecin. Il ne faut surtout pas oublier que même si un individu semble être un bon candidat pour une greffe, la décision finale de bénéficier ou non une greffe, et quand la réaliser revient au patient.
Greffe et essais cliniques
L'autogreffe de cellules souches est considérée comme le traitement de référence pour les patients atteints d'un myélome multiple. Toutefois, bon nombre de nouvelles approches font l'objet d'études dans le but d'améliorer le devenir des patients. Ces études sont réalisées sous forme d'essais cliniques. Elles comprennent :
Une autogreffe en tandem ou double autogreffe est une approche qui englobe deux autogreffes. Un nombre suffisant de cellules souches est prélevé avant la première greffe. Trois à six mois après la première greffe, le patient reçoit un deuxième traitement similaire à fortes doses suivi de la réinjection du reste ou d'une seconde partie des cellules souches. Des données préliminaires indiquent que les greffes en tandem entraînent un meilleur contrôle de la maladie et un meilleur taux de survie chez les patients qui n'obtiennent pas une TBRP ou une RC après la première autogreffe.
Le traitement séquentiel par autogreffe suivie d'une "mini" (non myéloablative) allogreffe comprend une chimiothérapie à fortes doses avec une autogreffe afin de détruire la plupart des cellules myélomateuses, suivie 2 à 4 mois plus tard d'une mini allogreffe pour permettre aux cellules immunitaires du donneur de détruire toute cellule myélomateuse résiduelle. Dès que les cellules souches allogéniques se multiplient, les cellules immunitaires du donneur attaquent le myélome ("l'effet greffon contre myélome" mentionné précédemment). Il s'agit d'une forme d'immunothérapie. Le risque associé à cette procédure est la GVH ou maladie du greffon contre l'hôte, qui peut être très grave et mettre la vie en danger.
L'autogreffe de cellules souches suivie d'une mini-allogreffe (ou "Auto-mini Allô") a été étudiée dans le cadre d'essais cliniques chez des patients atteints de myélome depuis de nombreuses années. En 2006, une étude de l'IFM (Intergroupe Francophone du Myélome) ne retrouvait aucun bénéfice en survie globale ni en survie sans progression d'une séquence Automini Allô vs double auto. En 2007, Bruno et al quant à eux, ont trouvé une amélioration de la survie chez les patients recevant la séquence Auto-mini Allô vs double auto. Lors du congrès de l'ASH (American Society of Hematology) en Décembre 2010, une large étude clinique du groupe BMT CTN comparant double autogreffe par rapport à la séquence Auto-mini Allô (Krishnan et al) chez 710 patients dans 43 centres n'a trouvé aucune différence ni en survie sans progression ni en survie globale. Compte tenu de l'absence de bénéfice de survie et de rémission et de l'augmentation de la mortalité liée au traitement chez les patients recevant la séquence auto-mini allô, l'International Myeloma Working Group (IMWG) recommande actuellement que les mini Allô ne soient effectuées que dans le cadre d'essais cliniques.
Le traitement d'entretien est une approche qui utilise des doses diminuées de médicaments anti-myélome afin de prolonger la rémission et la survie après une greffe. À l'heure actuelle, les traitements en cours d'évaluation en entretien dans les essais cliniques comprennent principalement le Revlimid et le Velcade, seuls ou en combinaison avec des corticoïdes.
Les essais de maintenance les plus convaincants et plus récemment menées sont deux essais de phase III de Revlimid en post-greffe conduits aux États-Unis (CALGB 100104) et en France (2005-02 IFM). Leurs résultats ont été présentés lors du congrès de l'ASH en Décembre 2010 ; les deux études à ce moment-là ont démontré une survie sans progression (PFS) deux fois plus longue pour les patients qui avaient été randomisés dans le panel Revlimid en entretien. Lors du congrès de l'ASH en Décembre 2011, les données de suivi de ces essais ont été présentées. Il persiste un doublement du taux de survie sans progression pour les patients du panel Revlimid, et l'étude américaine retrouve un bénéfice en survie globale (OS).
Un fait notable de discussion et de controverse dans ces essais était que ces études ont rapporté un taux plus élevé de tumeurs malignes secondaires chez les patients qui étaient dans les panel Revlimid en entretien par rapport au placebo. L'augmentation des tumeurs malignes secondaires de ces essais reste un domaine fortement étudié, car il n'y a eu aucune augmentation de cancers secondaires rapportée chez les patients en rechute et réfractaires traités par Revlimid.
Une théorie qui prévaut est que l'augmentation des cancers secondaires pourrait découler de l'utilisation du melphalan, un agent alkylant employé dans le traitement à haute dose avant greffe dans les deux essais du CALGB et de l'IFM, ayant des effets potentiellement cancérigènes en combinaison avec Revlimid.
Sur la base des données de ces essais de phase III, le National Comprehensive Cancer Network (NCCN) a récemment reclassé l'utilisation du Revlimid en tant qu'agent de maintenance de la catégorie 2A (ce qui signifie que les résultats des essais cliniques n'ont pas encore fait l'objet d'un réexamen complet, et que la sécurité et l'efficacité sont encore préliminaires), à la catégorie 1 (ce qui signifie qu'elle est fondée sur des preuves de haut niveau, et qu'il y a un consensus uniforme du NCCN). Étant donné les avantages évidents et les risques d'un traitement d'entretien post-greffe, chaque patient doit discuter du traitement d'entretien avec son oncologue, qui évaluera les facteurs de risque individuels et la réponse à la greffe avant de faire une recommandation de traitement.
Problèmes psychosociaux
Une chimiothérapie à haute dose et une autogreffe peuvent être sources d'un grand stress pour les patients et leurs familles. Le stress physique, psychologique, émotif et financier peut être accablant. Les patients et leurs familles peuvent éprouver des sentiments de colère, de dépression et d'anxiété attribuables à un avenir incertain et un manque de contrôle. Les services de soutien offerts dans les hôpitaux et plusieurs autres organismes, incluant les groupes de soutien pour les patients atteints de myélome, sont très importants durant cette période. Nous vous conseillons vivement d'utiliser ces services, ou de demander à votre oncologue de vous orienter vers des services de consultation psychologique et/ou psychiatrique.
Questions et Réponses au sujet de l'intensification thérapeutique avec greffe de cellules souches
Vous trouverez ci-dessous certaines des questions fréquemment posées par des patients atteints d'un myélome qui ont bénéficié ou qui vont bénéficier d'une greffe de cellules souches. Il est important de discuter de ces questions et de toute autre préoccupation avec le médecin et les membres de l'équipe soignante avant de prendre une décision au sujet du plan de traitement.
Q. Pourquoi une greffe de cellules souches est-elle nécessaire pour un patient atteint de myélome multiple ?
R. La greffe permet au patient de recevoir une chimiothérapie à fortes doses afin d'éliminer un plus grand nombre de cellules myélomateuses. Ce traitement est si puissant qu'il détruit toute la moelle osseuse. Sans la moelle osseuse, il est impossible pour l'organisme de produire les cellules du sang nécessaires pour transporter l'oxygène, faciliter la coagulation sanguine et prévenir les infections. Une greffe de cellules souches remplace donc la moelle qui a été détruite, épargnant le patient des effets de la chimiothérapie à fortes doses.
Q. Suis-je un candidat pour une intensification thérapeutique avec greffe de cellules souches ?
R. Les experts en médecine n'ont pas encore établi de recommandations fixes concernant la sélection des patients qui profitent le plus d'une greffe. Depuis longtemps intégrée dans les protocoles de traitement du myélome, la réussite de la greffe repose sur l'âge du patient, sa condition physique générale, le stade de sa maladie et sa réponse aux traitements antérieurs. Seul le médecin du patient peut offrir à ce dernier la meilleure évaluation de ses chances de survie à long terme.
Q. Est-ce que les agents alkylants tels que le melphalan, le busulfan et le cyclophosphamide(endoxan) réduisent mes chances de bénéficier d'une greffe ?
R. Les agents alkylants sont l'un des moyens les plus efficaces pour éliminer les cellules myélomateuses à l'intérieur du corps. Toutefois, une utilisation prolongée - de plus de 4 à 6 mois - réduit la capacité de prélever facilement les cellules souches d'un patient. Par conséquent, lorsqu'une greffe est envisagée, il est important que le patient discuter son plan de traitement global afin de s'assurer d'avoir le plus grand nombre d'options de traitement à court et à long terme. Il faut toutefois insister sur l'importance d'effectuer la collecte de cellules souches avant d'utiliser un alkylant.
Q. Comment choisir un centre de greffe ?
R. Une greffe est une procédure médicale complexe qui nécessite une équipe spécialisée constituée de médecins, infirmières, assistante sociale, psychologues et professionnels de la santé qui comprennent la procédure, l'ont réalisée avec succès à maintes reprises et qui sont capables de gérer à la fois les problèmes médicaux et émotionnels. On retrouve aujourd'hui plusieurs centres à travers le pays qui répondent à ces critères. Bon nombre de ces centres se spécialisent dans le traitement de patients atteints de cancer. Afin d'identifier le centre qui convient le mieux aux patients atteints de myélome multiple, vous devriez en discuter avec votre médecin, d'autres patients atteints de myélome multiple et l'IMF.
Q. Que se passe-t-il dans un centre de greffe ?
R. Afin de mieux comprendre ce qui se passe dans un centre de greffe, nous vous recommandons fortement d'effectuer une visite dans un ou plusieurs centres. Planifiez une rencontre avec le personnel - médecins, infirmières et autres membres de l'équipe soignante - afin d'en apprendre davantage sur leur approche de la greffe. Visitez une chambre où votre greffe sera réalisée et où vous séjournerez pendant votre convalescence. Renseignez-vous afin de savoir ce qui sera réalisé en ambulatoire ou à l'hôpital. Il est essentiel d'être en confiance avec le centre avant d'y recevoir votre greffe. À noter que dans certains pays, de nombreux centres ont un motel à proximité ou un complexe résidentiel où sont héberger les patients après avoir reçu leur chimiothérapie à haute dose et pendant qu'ils récupèrent des les effets secondaires. Non seulement les patients ont moins de risque d'infection hors de l'hôpital, mais en plus les coûts d'hébergement privé sont bien moindres que ceux d'une hospitalisation pendant deux semaines ou plus. Les patients sont vus à l'hôpital tous les jours pour leur prise de sang, et sont à proximité en cas d'urgence.
Q. Si mon médecin convient qu'une greffe de cellules souches est un traitement approprié pour ma maladie, que puis-je faire pour m'y préparer ?
R. Un patient peut se préparer de plusieurs façons. En prenant le temps de lire cette note, le patient a déjà réalisé une étape très importante : apprendre autant que possible au sujet de la procédure. Le patient devrait discuter avec son médecin et d'autres patients et lire tout ce qu'il peut, en incluant les publications et bulletins d'information de l'IMF. Les patients devraient poser des questions au sujet de ce qu'ils ont appris et s'efforcer de lire les informations les plus récentes issues de la recherche. Nous conseillons aux patients d'apporter un magnétophone ou d'être accompagnés d'un ami lors de leur visite chez le médecin afin de pouvoir bien se concentrer. Les patients devraient partager toute l'information avec leur famille et proches afin que ces derniers sachent à quoi s'attendre - et comment ils peuvent aider dans les semaines et les mois à venir. Le médecin effectue une série d'examens pour confirmer que le patient est suffisamment bien pour bénéficier de la greffe. Toutes les données recueillies sur l'état cardiaque, pulmonaire et rénal, et des autres organes vitaux permettent au médecin d'établir une comparaison entre la santé du patient avant et après la greffe. Dans la plupart des cas, le patient n'est pas hospitalisé pour les examens puisque ceux-ci peuvent être réalisés en externe.
Q. Quels effets secondaires dois-je prévoir après la greffe ?
R. Des effets secondaires peuvent être ressentis pour chaque type de traitement, même avec d'aspirine. Chaque patient réagit différemment à la chimiothérapie et aux autres médicaments administrés durant la greffe. Il n'y a pas deux patients qui partagent les mêmes effets secondaires. Les effets indésirables les plus fréquents sont des nausées, des aphtes dans la bouche ou mucite, la perte des cheveux, et la fatigue. Les patients doivent rechercher un centre où les médecins, les infirmières et l'équipe soignante ont réalisé un bon nombre de greffes chez des patients atteints de myélome et qui ont l'expérience et l'expertise de subvenir aux besoins individuels de chaque patient.
Q. Que se passe-t-il lors de la réinjection des cellules souches ?
R. En général deux jours après la chimiothérapie à fortes doses, les cellules souches du patient sont réinjectées. Les cellules souches sont décongelées et perfusées par le cathéter du patient dans une poche. Lors de la réinjection, le patient peut ressentir de la chaleur ou se sentir étourdi. Les produits chimiques utilisés pour conserver les cellules souches ont une senteur d'ail que le patient peut faiblement percevoir. L'oncologue peut prescrire ou ajuster les traitements du patient afin qu'il soit plus confortable pendant la greffe.
Q. La greffe en soi peut-elle entraîner la mort d'un patient ?
R. Toute procédure médicale comporte des risques et l'intensification thérapeutique chez un patient atteint de myélome multiple est risquée. Néanmoins, des études médicales ont démontré que la mortalité après greffe n'excède pas 5% voire même le plus souvent 1%.
Q. Un patient peut-il rechuter après une greffe ?
R. Oui. Malheureusement, la majorité (au moins 50%) des patients atteints d'un myélome multiple rechuteront dans les 18 à 36 mois après la greffe.
Q.J'ai beaucoup entendu parler de la purge du myélome. Est-ce bénéfique ?
R. Le processus de purge élimine les cellules myélomateuses du sang périphérique prélevé chez le patient avant la greffe. Une chimiothérapie à fortes doses est utilisée pour éliminer les cellules myélomateuses qui se retrouvent dans le corps. La sélection de cellules souches ou « purge », est utilisée pour éliminer les cellules myélomateuses des cellules souches prélevées avant la greffe. Le but de cette stratégie est de réduire le nombre de cellules myélomateuses présentes dans le corps du patient ainsi que dans le sang périphérique qui lui sera réinjecté. De récentes études indiquent que cette technologie n'est pas efficace pour le myélome. Par conséquent, peu de centres ont recours à la purge de cellules souches pour traiter les patients atteints d'un myélome.
Q. Quelle est la durée du séjour à l'hôpital pour le patient greffé ?
R. Les patients sont hospitalisés pendant 2 à 3 semaines environ. La durée du séjour varie d'un patient à un autre. Certains patients peuvent être admis pour plusieurs courts séjours.
Q. À quel moment les cellules souches commencent-elles à se reproduire ?
R. Les cellules souches commencent à se reproduire ou « à prendre » dans un délai de 10 à 14 jours après la réinjection.
Q. Qu'advient-il de la qualité de vie du patient après la greffe ?
R. En général, la récupération du patient dure entre 3 à 6 mois. À ce moment, le système immunitaire peut de nouveau combattre les infections puisque la moelle osseuse produit des cellules sanguines saines. Les cheveux repoussent, mais les papilles gustatives peuvent être encore affectées. Les aliments qui avaient bon goût avant la greffe n'ont pas nécessairement bon goût après la greffe. Toutefois, dans la majorité des cas, les patients sont en mesure de reprendre leurs activités quotidiennes. Certains prennent jusqu'à un an pour reprendre leur routine. Les patients et leur entourage doivent vivre au jour le jour au début. Il y aura des mauvais et des bons jours bons, pas nécessairement dans cet ordre. Les patients doivent se préparer à se sentir différemment chaque jour tout au long de leur convalescence.
Q. Les patients greffés doivent-ils s'attendre à des changements sur le plan émotionnel?
R. Oui. Une greffe est bien plus qu'une simple procédure médicale. Puisque le patient se retrouve à se reposer sur son oncologue et sur les autres membres de l'équipe de soins, en plus de la famille et des amis, il éprouve souvent un sentiment de perte d'autonomie et de contrôle. Des sentiments d'isolement, de dépression et de détresse sont courants chez les patients greffés. Les patients et les proches devraient alors demander l'aide d'un professionnel. Vous pouvez également recevoir de l'aide auprès des groupes de soutien pour les patients.
Q. Quelles thérapies parallèles et complémentaires peuvent être administrées pendant et après la greffe ?
R. Certains patients croient que les thérapies parallèles et complémentaires sont une composante importante de leur traitement. Du fait que tous les médicaments, synthétiques et naturels, interagissent, et peuvent créer des effets secondaires imprévus, les patients devraient toujours consulter leur médecin avant de les utiliser. Le médecin doit être informé du nom des thérapies parallèles et complémentaires prises. Il est important de noter que même les médicaments en vente libre, en apparence inoffensifs, comme l'ibuprofène par exemple, peuvent être dangereux pour un patient atteint d'un myélome.
Termes et Définitions
Agent alkylant : agent de chimiothérapie comme le melphalan (Alkeran®) ou le cyclophosphamide (Endoxan). Le terme Alkylant réfère à la façon dont ces agents interagissent avec l'ADN des cellules myélomateuses et bloquent la division cellulaire.
Agent Immunomodulateur : agent qui affecte, stimule ou inhibe le système immunitaire.
Allogreffe de cellules souches : la greffe est réalisée grâce à des cellules souches qui sont prélevées chez un donneur puis administrées au patient. La plupart des allogreffes de cellules souches utilisent des cellules souches du sang périphérique du donneur. Les allogreffes standards sont rarement réalisées pour les patients atteints d'un myélome en raison du risque qu'elles présentent pour le patient. Une technique récente et, pour le myélome, plus sécuritaire (discutée ci-après), est la greffe non myéloablative ou « mini greffe », actuellement étudiée dans des essais cliniques. Afin de déterminer si le patient a un donneur compatible potentiel, une analyse de sang particulière surnommée typage HLA est effectuée. Un donneur peut être un membre de la famille ou être identifié à partir d'un registre de donneurs volontaires. Les cellules souches sont rarement obtenues auprès d'une banque de sang de cordon ombilical.
Anémie : diminution du nombre normal de globules rouges, avec un taux d'hémoglobine habituellement inférieur à 10 g/dl (taux normal entre 12 et 15 g/dl). La présence du myélome dans la moelle osseuse bloque la production de globules rouges, provoquant ainsi l'anémie, dont les symptômes sont l'essoufflement, la faiblesse et la fatigue. Autogreffe de sang périphérique: (voir autogreffe de cellules souches) une procédure qui consiste d'abord à prélever, par cytaphérèse, les cellules souches dans le sang du patient puis à les conserver, et à les réinjecter à la suite d'une chimiothérapie à fortes doses.
Autogreffe (greffe autologue) de cellules souches : réinjection de cellules souches qui sont prélevées chez un patient et perfusées au même patient lorsqu'il a reçu une chimiothérapie à fortes doses. La plupart des greffes de cellules souches chez les patients atteints de myélome sont des autogreffes.
CD34+ : marqueur utilisé pour distinguer et quantifier les cellules souches dans la circulation sanguine. Un nombre minimum de cellules souches CD34+ est requis afin de pouvoir réaliser une greffe de façon sans danger.
Cellules souches (cellules souches hématopoïétiques) : Les cellules souches (hématopoïétiques) saines génèrent des composants sanguins normaux, incluant les globules rouges, les globules blancs et les plaquettes. Ces cellules souches se trouvent normalement dans la moelle osseuse et peuvent être prélevées pour une greffe.
Cellules souches du sang périphérique (CSP) : les cellules souches sont prélevées dans le sang. Ces cellules sont similaires aux cellules souches retrouvées dans la moelle osseuse. Le terme « périphérique » signifie que les cellules proviennent du sang à l'extérieur de la moelle.
Chimiothérapie : médicaments utilisés pour détruire les cellules cancéreuses.
Cytaphérèse : procédure grâce à laquelle les cellules souches périphériques sont extraites dans le sang d'un patient ou d'un donneur. La fraction du sang contenant le plasma, les globules blancs et les plaquettes est séparée. Les globules rouges sont reperfusés au patient ou donneur. La fraction qui contient les globules blancs est celle qui contient les cellules souches.
Facteurs de croissance : médicaments qui stimulent la croissance et la libération de cellules souches sanguines dans la circulation sanguine.
Facteurs de croissance des globules blancs : protéines qui stimulent le développement et la croissance des cellules sanguines. Le Neupogen®, le Neulasta® et le Granocyte® sont des facteurs de croissance des globules blancs utilisés pour mobiliser les cellules souches de la moelle osseuse dans la circulation sanguine avant la cytaphérèse. Ces derniers peuvent également être utilisés suite à la greffe pour accélérer la remontée des globules.
Globules blancs : l'un des trois types majeurs de cellules dans le sang. Il existe plusieurs types de globules blancs ou leucocytes (neutrophiles, lymphocytes et monocytes).
Globules rouges : cellules sanguines qui transportent l'oxygène des poumons à travers le corps.
Greffe ou transplantation : les cellules souches sont utilisées pour restaurer le potentiel hématopoïétique du patient à la suite d'une chimiothérapie à fortes doses et/ou d'une radiothérapie. La greffe n'est pas forcement un traitement mais une méthode de support pour permettre un traitement de chimiothérapie à fortes doses.
Greffe de cellules souches du sang périphérique (CSP) : obtenues de la circulation sanguine du patient ou du donneur. Utiliser les CSP pour réaliser la greffe permet de prélever de façon plus facile et sécuritaire les cellules souches et de raccourcir la convalescence comparativement à la greffe de cellules souches de moelle osseuse.
Greffe de moelle osseuse : réalisée au moyen de cellules souches issues directement de la moelle osseuse du patient ou du donneur. Très peu de greffes de moelle osseuse sont actuellement réalisées en raison de la disponibilité des cellules souches du sang périphérique. La moelle osseuse peut rarement être prélevée chez les patients qui ne sont pas en mesure de mobiliser un nombre suffisant de cellules souches dans le sang périphérique.
Greffe en tandem : un terme utilisé pour désigner une double greffe. Il peut s'agir de deux autogreffes ou d'une autogreffe suivie d'une allogreffe (provenant d'un donneur). On planifie habituellement un intervalle de 3 à 6 mois entre chaque greffe.
Greffe de sang de cordon ombilical : les cellules souches sont obtenues à partir des cordons ombilicaux de nouveau-nés. Celles-ci sont congelées et conservées dans des banques de sang de cordon ombilical.
Greffe Syngénique de cellules souches : les cellules souches sont prélevées chez un jumeau monozygote (identique) du patient.
Immunoglobuline : une protéine produite par les plasmocytes (un type de globule blanc) qui aident à combattre l'infection. Également reconnu comme un anticorps.
Lésions lytiques osseuses : trous dans l'os.
Moelle osseuse : Tissu mou spongieux, retrouvé dans la plupart des os plats et longs, qui produit les globules blancs, les globules rouges et les plaquettes.
Myéloablation : la destruction de la moelle osseuse au moyen de radiothérapie et/ou de chimiothérapie. Ce terme s'applique habituellement à la destruction complète ou presque complète de la moelle osseuse.
Myélome multiple : un cancer se développant à partir des plasmocytes dans la moelle osseuse. Les plasmocytes chez les patients atteints d'un myélome multiple forment des anticorps anormaux, qui endommagent possiblement les os, la moelle osseuse et d'autres organes.
Pic monoclonal : anticorps ou parties des anticorps retrouvés en quantité anormalement élevée dans le sang ou l'urine des patients atteints d'un myélome. Le pic monoclonal correspond au profil prononcé qui apparaît sur l'électrophorèse des protéines en présence d'une protéine M. Synonyme de protéine monoclonale et protéine liée au myélome.
Plaquettes : fragments cellulaires avec granules, essentiels à la coagulation sanguine et la guérison des plaies. Les plaquettes contribuent également à la réponse immunitaire.
Plasmocyte : un type de globules blancs qui produit des anticorps.
Plasmocytome : une tumeur composée de plasmocytes malins.
Ponction de la moelle osseuse : le prélèvement, au moyen d'un trocart d'aspiration, d'un échantillon de la moelle osseuse (liquide).
Prise de greffe : le processus au cours duquel les cellules souches greffées migrent vers la moelle osseuse du patient, commencent à se multiplier et à produire de nouveaux globules, globules rouges et plaquettes.
Protéine M (protéine monoclonale) : protéine anormale, produite par les cellules myélomateuses, qui s'accumule et peut endommager la moelle. Une concentration élevée de protéine M indique que les cellules myélomateuses sont présentes en grand nombre.
Rémission ou réponse : rémission ou réponse sont utilisées de manière interchangeable. Rémission complète (RC) est l'abréviation commune pour les deux. La RC est définie par l'absence de la protéine liée au myélome dans le sérum et/ou l'urine lors d'analyses standard, l'absence de cellules myélomateuses dans la moelle osseuse et/ou les autres régions affectées par le myélome, la rémission clinique, et la normalisation des autres paramètres biologiques.
Réponse complète (RC) : la RC est l'absence de la protéine liée au myélome dans le sérum et/ou l'urine lors d'analyses standard ; l'absence de cellules myélomateuses dans la moelle osseuse et/ou autres régions affectées par le myélome ; la rémission clinique et la normalisation des autres paramètres biologiques à un niveau normal. La RC n'est pas la même chose qu'une guérison.
Sélection de cellules souches : une technique de traitement des cellules utilisée pour obtenir un produit enrichi en cellules souches et ainsi contenant moins de cellules cancéreuses potentielles. S'est avéré inutile chez les patients atteints d'un myélome.
Système immunitaire : système qui protège le corps des organismes pathogènes, des autres corps étrangers et des cancers.
Système International de Stadification (ISS) : le plus récent système de stadification du myélome, il résulte de la collaboration de plus de 20 centres de recherche clinique à travers le monde.
Très bonne réponse partielle (TBRP) : une réponse qui n'est pas vraiment une réponse complète (c'est-à-dire, pas à 100%), mais qui représente une diminution de 90% ou plus de la protéine monoclonale sérique.
Sources : Brochure Comprendre l'intensification thérapeutique avec support de cellules souches par International Myeloma Foundation 26 p.
Sites internet de référence :
Pour un premier contact : http://fr.wikipedia.org/wiki/My%C3%A9lome_multiple
Site d'information de l'Association des Malades du Myélome Multiple : www.af3m.org
Site d'information des malades sur le myélome : www.myelome.patients.info
Après le congrès de l'American Society of Hematology (décembre 2013) :![]() Quelques minutes avec Hervé Avet-Loiseau président de l'IFM.
Quelques minutes avec Hervé Avet-Loiseau président de l'IFM.
Voir également l'interview de Thierry Facon (Lille), qui a présenté les résultats très attendus d’une grande étude internationale pilotée par l’Intergroupe Francophone du Myélome, l’IFM, qui pourrait changer la prise en charge en première ligne des patients souffrant de myélome non candidats à l’autogreffe.
Ajout du 23 février 2015 : Le cancer attaqué par ses cellules souches
par Pierre Kaldy (Sciences et Avenir, n° 817 mars 2015, p. 77).
Des chercheurs américains ont découvert des molécules capables de tuer spécifiquement les cellules qui résistent aux chimiothérapies. Il s'agit peut-être de la prochaine révolution dans le domaine de la lutte contre le cancer.
Des chercheurs américains ont découvert de petites molécules capables de tuer spécifiquement les cellules souches tumorales, celles qui résistent aux chimiothérapies et aux rayons X, disséminant des métastases dans le corps. Cette stratégie, qui peut se révéler cruciale quand on sait que cette maladie tue le plus souvent par ses récidives, offre « l'une des perspectives les plus prometteuses dans son traitement », souligne Christophe Ginestier, chercheur au Centre de recherche en cancérologie de Marseille. Ainsi des médecins de la société Boston Biomédical ont identifié une molécule, le BBI608, qui bloque le développement des cellules souches d'une dizaine de cancers différents tout en épargnant celles qui régénèrent le sang. Aucun agent de chimiothérapie n'avait pu jusqu'ici entraver la prolifération de ces cellules. Sans toxicité apparente, le BBI608 a bloqué l'apparition de métastases dans deux modèles de cancer chez la souris. Ces résultats très encourageants ont incité la société à engager plusieurs essais cliniques préliminaires chez des patients atteints de diverses tumeurs incurables. Là encore, des exemples surprenants de régression de la maladie ont été obtenus après traitement avec le BBI608 et un agent de chimiothérapie. Une étude clinique à plus vaste échelle sur le cancer colorectal avancé est en cours pour vérifier cet effet. S'il reste de nombreuses étapes avant la commercialisation de nouveaux inhibiteurs de cellules souches, des patients diabétiques traités par un hypoglycémiant courant, la metformine, semblent déjà bénéficier de cette nouvelle approche. Lorsqu'ils sont atteints de certains cancers, ils présentent un taux de récidive plus faible, probablement dû au fait que la metformine apparaît également toxique pour les cellules souches de la tumeur.
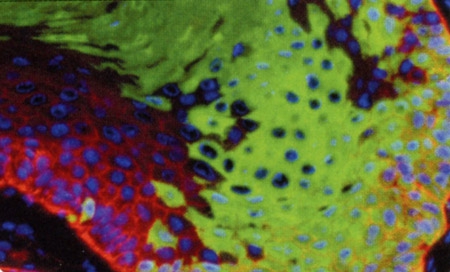
Le BBI608 bloque le développement des cellules souches tumorales
(ici en vert) tout en laissant intactes celles qui régénèrent le sang.
16:40 Publié dans Médecine | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
03/10/2013
Les bactéries font et défont les espèces
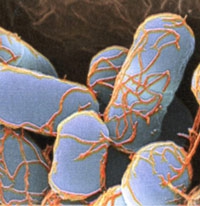 Les bactéries font et défont les espèces
Les bactéries font et défont les espèces
par Émilie Rauscher
(Science & Vie n° 1152, septembre 2013, pp. 106-111)
Les bactéries logées à l'intérieur de tout organisme vivant, y compris celles de la flore intestinale, influencent son évolution… Au point, parfois, de créer de nouvelles espèces. L'hypothèse avait été formulée il y a quelque temps déjà... En 1927, le microbiologiste américain Ivan Wallin notait :
"C'est une proposition pour le moins étonnante de dire que les bactéries, communément associées à la maladie, pourraient en fait être un facteur fondamental dans l'apparition de nouvelles espèces..."
Tellement étonnante, d'ailleurs, qu'elle fut rapidement oubliée, d'autant que les arguments pour la démontrer n'existaient pas... Ou plutôt pas encore. Car aujourd'hui, alors qu'ils mesurent encore à peine à quel point les bactéries sont partout – des abysses à nos cellules – ; alors qu'ils commencent à réaliser l'importance des relations ultimes et durables (symbioses) qu'elles ont tissées avec tout ce qui vit ; alors qu'ils découvrent enfin tout ce dont elles sont capables... finalement, les scientifiques en viennent à se dire qu'il y avait peut-être du vrai dans cette vieille idée folle !
Selon Bordenstein, professeur de biologie à l'université Vanderbilt (Nashville, EtatsUnis), lui, en est convaincu depuis plus de dix ans déjà : "Une nouvelle espèce pourrait bien apparaître, non seulement parce que ses gènes mutent au sein de ses propres cellules, mais aussi parce que les communautés microbiennes qu'elle héberge (dans ses intestins, etc.) changent ! " Et il a désormais de quoi étayer cette hypothèse, qui non seulement renouvelle notre compréhension de la complexe mécanique de l'évolution, mais fait des bactéries l'un des maîtres, aussi majeur que méconnu, du destin des espèces...
NOUS SOMMES TOUS DES ÉCOSYSTÈMES
Inspiré par Ivan Wallin, mais aussi par d'autres prédécesseurs visionnaires comme la biologiste américaine Lynn Margulis, qui avait perçu dès les années 1970 l'importance de la symbiose, Seth Bordenstein a patiemment réuni cas ambigus et phénomènes étranges, comme autant d'indices de l'influence des bactéries. Il mène des recherches, compile et dissèque les travaux dans lesquels des micro-organismes semblent être à l'origine d'une nouvelle espèce... Une gageure tant ce phénomène, la "spéciation", est discuté par les scientifiques : ses influences sont innombrables et ses causes multiples et difficiles à distinguer de ses conséquences.
Déjà se pose la question de ce qu'est une espèce. Cela semble simple si on regarde la chose d'un œil presbyte : de loin, les espèces se distinguent bien. De près, beaucoup moins. La faute à l'évolution et à la sélection naturelle qui poussent le vivant à changer en permanence, si bien qu'il est difficile de faire la part des choses quand une espèce se transforme ou que deux populations proches semblent s'hybrider. Par conséquent, depuis deux cent cinquante ans qu'ils travaillent dessus, les naturalistes, puis les biologistes ne se sont toujours pas accordés sur une définition claire... Retenons juste que des individus appartiennent à des espèces différentes s'ils ne peuvent pas se reproduire ensemble. Les raisons d'une telle barrière ? Soit l'acte est impossible entre eux, soit leurs hybrides sont condamnés ou stériles. Dans tous les cas, les ponts ont été coupés entre les partenaires et entre leurs espèces respectives — qui pouvaient n'en faire qu'une au départ. Incapables d'échanger des gènes, elles vont suivre chacune leur chemin évolutif et multiplier les différences. C'est ainsi qu'en partant d'un cousin de Velociraptor, on se retrouve quelques millions d'années plus tard avec des canards et des autruches. D'où viennent ces différences ? Comme le rappelle Seth Bordenstein, "les biologistes considèrent que l'apparition de nouvelles espèces est principalement dirigée par les changements qui se produisent dans nos gènes. Nous, nous démontrons que pour comprendre de façon globale comment se passe la spéciation, il faut certes considérer notre génome, mais aussi celui des micro-organismes qui sont en nous !" Pour le biologiste américain, la "cause première" de la séparation des espèces peut être, aussi, microbienne. Rappelons-nous que nous sommes de vrais écosystèmes, peuplés de nuées de bactéries. Tout comme deux populations appartenant à une même espèce peuvent être séparées physiquement par une montagne, ou génétiquement par un bouleversement chromosomique, elles peuvent l'être par ces mini-résidents !
Le chercheur a regroupé une collection inédite de cas où des bactéries ont sorti une artillerie lourde capable d'imposer cette ségrégation...
UN STRATAGÈME PARFAIT
Wolbachia est, à ce titre, exemplaire : cette bactérie infecte près de 60 % des arthropodes, l'immense groupe des insectes, acariens, araignées et crustacés. Parasite incontournable, elle s'insinue dans les cellules de son hôte et colonise la descendance des femelles. Pour favoriser sa transmission, elle réalise des prodiges.
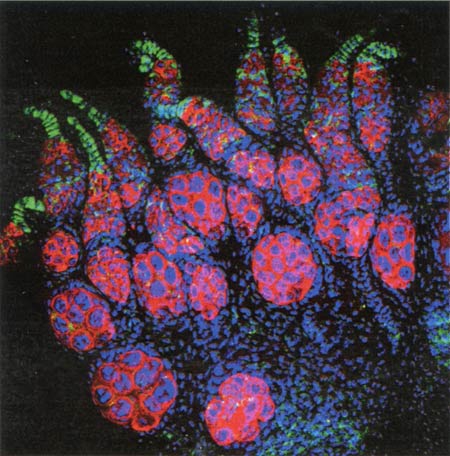
En infectant les cellules souches des organes reproducteurs de la Drosophile, la bactérie Wolbachia (en vert) modifie en sa faveur l'évolution de son hôte.
Ainsi, elle est capable d'imposer à ses hôtes une "spéciation asexuelle" : les femelles qu'elle infecte produisent sous sa houlette des ovules qui se développeront sans être fécondés par les mâles (qui deviennent ainsi inutiles). Chez des guêpes ou des acariens par exemple, on voit ainsi apparaître des lignées entièrement féminines et autonomes. "Ce cas est emblématique car immédiat, pointe Olivier Duron, spécialiste de l'évolution des symbioses à l'université de Montpellier 2. Dès l'arrivée de la bactérie, on a un isolement reproducteur, c'est-à-dire que l'individu infecté ne peut plus se reproduire avec les autres." Et qui dit isolement dit début de divergence entre les populations séparées.
Wolbachia a une seconde technique : elle sait influer sur les possibilités de reproduction de son hôte. Seules les femelles qu'elle infecte peuvent se croiser avec tous les mâles, transmettant ainsi le parasite à sa descendance. Une femelle non infectée est limitée aux mâles également non infectés, sous peine de voir ses œufs mourir. En quelques générations, près de 100 % de la population est parasitée. Ce procédé prend toute sa force quand on sait qu'il existe plusieurs types incompatibles de Wolbachia : ainsi, dans une même espèce d'arthropodes, on peut voir apparaître des groupes infectés par l'une ou l'autre souche bactérienne qui ne pourront plus se croiser !
DES ESPÈCES NAÎTRAIENT D'UN SIMPLE CHANGEMENT DE LEUR FLORE INTESTINALE
Preuve supplémentaire de la responsabilité de la bactérie : l'utilisation d'antibiotiques, en la tuant, fait tomber les barrières qu'elle dressait entre ses hôtes... À moins de s'y prendre trop tard, alors que l'évolution a déjà créé des lignées isolées. Séparées à l'origine par la bactérie, ces populations sont devenues trop différentes pour se croiser, même après sa disparition.
Ces exemples, Seth Bordenstein en connaissait l'importance, mais aussi les limites. Après tout, qu'un parasite niché au cœur même des cellules de son hôte ait un tel effet sur lui n'est sans doute pas si surprenant. Et si Wolbachia et ses consœurs sont courantes chez les arthropodes, on n'en connaît guère chez les mammifères, pour ne citer qu'eux. Ce qui limite leur impact à des groupes animaux, certes nombreux, mais bien particuliers...
Sauf que les bactéries n'ont pas besoin de s'incruster dans les cellules de leur hôte pour bouleverser sa vie. Partout dans le vivant, on observe des symbioses au cours desquelles elles se contentent de s'installer dans certains organes ! Pour rester chez les arthropodes, elles leur permettent de diversifier leur nourriture ou de s'adapter à un autre milieu, et donc de coloniser des zones interdites à leurs congénères. Grâce à elles, le termite mange du bois, le puceron conquiert de nouveaux végétaux, etc. "Puisqu'elle ouvre l'accès à une niche particulière, et donc facilite la divergence avec la population d'origine, la symbiose soutient la spéciation", souligne Olivier Duron. Voilà qui démultiplie les cas possibles !
Escherichia coli
Pourtant, Seth Bordenstein avait l'ambition d'aller encore plus loin. Pour ce défi, il reçoit en 2008 le soutien de son collègue Robert Brucker. Dans leur dernière étude, tout juste publiée, les deux biologistes soutiennent cette fois que même des bactéries banales, non symbiotiques, telles celles qui pullulent dans nos intestins, peuvent provoquer la spéciation ! "Ces dernières années, il est devenu clair que chaque animal avait des hôtes bactériens spécifiques, dont les gènes réunis (le microbiome) sont impliqués dans sa digestion comme dans son bon développement cérébral, rappelle le chercheur. Mais personne n'avait prouvé leur rôle dans la spéciation..."
Embryon hybride de Nasonia
Leurs bactéries créent une divergence entre les guêpes qui les empêche de se reproduire. Un traitement antibiotique a mis en valeur l'influence de la flore bactérienne de 3 guêpes du genre Nasonia qui les empêche de se reproduire. Sans traitement, leurs embryons hybrides ne survivraient pas, leurs flores étant incompatibles.
Avec l'aide de trois petites guêpes du genre Nasonia, d'une bonne dose d'antibiotiques et de logique, c'est désormais chose faite. Les chercheurs savaient que lorsque ces trois espèces se croisaient, leurs hybrides étaient condamnés. Ils prédirent, en s'inspirant des expériences avec Wolbachia, qu'un traitement antibiotique aurait un effet drastique... Ils ne se sont pas trompés : près de 90 % des hybrides furent sauvés ! L'incompatibilité entre les guêpes venait donc bien des bactéries. Et réinjecter les microbes restaurait leur lourde mortalité précédente. Un scénario qui a un air de déjà-vu... Sauf que, différence fondamentale, les microbes visés étaient, cette fois, simplement ceux de la flore intestinale !
UN JOUEUR DE PLUS À LA LOTERIE DE L'ÉVOLUTION
En étudiant cette dernière de plus près, Seth Bordenstein remarqua d'ailleurs que les hybrides survivant sans traitement étaient ceux qui avaient reçu une flore proche de celle d'un de leurs parents, au lieu d'un mélange chaotique. C'est donc bien cette flore qui détermine qui vit ou meurt et, ce faisant, imperméabilise les frontières entre les espèces concernées. "Cette étude est solide et l'idée qu'elle présente est séduisante. On savait que les bactéries intracellulaires pouvaient jouer sur l'isolement de populations... Mais que les bactéries intestinales en soient également capables est nouveau ! ", s'enthousiasme Olivier Duron. Ainsi, les espèces - et l'homme ne ferait pas exception - pourraient naître et prospérer par le fait de mutations dans leur génome mais aussi, simplement, par des changements dans leur flore intestinale.
Voilà une découverte qui ajoute un joueur particulièrement riche à la grande loterie de l'évolution... Et qui dit partenaire supplémentaire dit nouveaux gènes à prendre en compte : "Notre expérience donne ainsi une bonne raison de regarder 1'hologénome, c'est-à-dire la combinaison de l'ADN de l'hôte et de ses communautés de micro-organismes résidents, souligne Seth Bordenstein. L'objet de la sélection naturelle ne serait donc pas l'individu seul, mais lui et les communautés bactériennes associées." Pour le chercheur, nous étions jusqu'ici passés à côté de la plus grande part de l'information qui constitue chaque être vivant : les bactéries, ces marionnettistes invisibles et inconscients derrière l'évolution des espèces !
Proteus vulgaris
ET CHEZ L'HOMME ?
Notre part bactérienne est plus importante qu'on ne le croit : pour dix cellules humaines, nous abritons quatorze bactéries et pour dix gènes humains, nos microbes en comptent quatorze. Outre nos quelque vingt milliers de gènes, nous en comptons donc quelque trente milliers d'origine microbienne : deux patrimoines génétiques qui doivent fonctionner "en réseau".
Le rôle des bactéries dans l'évolution des insectes décrypté, on peut se demander ce qu'il en est des mammifères ou des poissons. Seth Bordenstein et Robert Brucker se posent bien sûr la question : "Nous espérons montrer que la flore intestinale et les gènes des microbes qui la composent, le microbiome, sont importants pour la spéciation animale. Une étude récente vient d'ailleurs de montrer que l'Homme et ses plus proches parents chez les primates ont des microbiomes spécifiques à chaque espèce, qui évoluent en même temps que l'ADN nucléaire (dans le noyau des cellules)." Cette coévolution plaide pour un lien fort entre notre génome et celui de notre flore. Les études se multiplient d'ailleurs pour recenser les bactéries que nous hébergeons et mieux comprendre le microbiome riche de plusieurs millions de gènes qu'elles constituent. On sait déjà qu'il existe trois "groupes bactériens" intestinaux, comme il y a des groupes sanguins, et que les perturber a des conséquences sur notre santé.
20:16 Publié dans Biologie, Médecine | Tags : spéciation, génomique, bactéries, flore bactérienne, microbiome | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
27/07/2013
Pesticides : leur impact sur la santé ne fait plus de doute
Pesticides : leur impact sur la santé ne fait plus de doute
(Dernière mise à jour 05/05/2014)
Dans son numéro 1072 de janvier 2007, Science et Vie pointait les risques d'un usage intensif des pesticides en France. Six ans plus tard, le rapport de l'Inserm vient confirmer les inquiétudes...
Propagés dans les champs, les pesticides se retrouvent dans nos maisons, dans l'air que nous respirons, dans ce que nous mangeons. Quels sont leurs effets sur notre santé ? Où en est la réglementation sur ce sujet ?
Qu'ils soient herbicides, fongicides ou insecticides, les pesticides ont un point commun : ils agissent sur des organismes vivants pour les détruire, les contrôler ou les repousser. Répartis au sein d'une centaine de familles chimiques, ils répondent à quatre grands usages. Le premier concerne l'agriculture, les parcs et les jardins. Les produits phytopharmaceutiques* sont alors diffusés par épandage. Le deuxième usage fait référence à des espaces intérieurs : bâtiments, locaux, maisons... Cette catégorie regroupe notamment les désinfectants, les vernis, les colles, les plaquettes insecticides, etc. Les pesticides sont également utilisés dans les médicaments humains (produits antipoux, antimycoses, antigales, etc.) et vétérinaires (antiparasites, antipuces, etc.). « Ces quatre usages couvrent un périmètre très large, analyse le docteur Pierre Lebailly, maître de conférences à l'université de Caen. Les pesticides sont donc présents partout et les populations agricoles ne sont pas les seules exposées. »
Quels risques pour quelle population ?
La France est bel et bien malade de ses pesticides, dont elle est la plus grosse utilisatrice en Europe. Difficile de leur échapper : ils sont dans la majorité des cours d'eau, des nappes phréatiques, des aliments. Mais aussi dans notre sang, nos urines, notre tissu adipeux... Sont-ils pour autant nocifs ? Cela ne fait plus guère de doute, à la lecture du rapport des experts réunis par l'Inserm. Ce rapport établi à la demande de la direction générale de la Santé, établit un bilan de la littérature scientifique publiée au cours des trente dernières années sur les risques associés aux pesticides. Rendu public en juin dernier, ce travail identifie « une association positive entre exposition professionnelle à des pesticides et certaines pathologies chez l'adulte : la maladie de Parkinson, le cancer de la prostate et certains cancers hématopoïétiques(lymphomes non hodgkiniens,myélomes multiples) ». Les ouvriers des usines de production des pesticides et les agriculteurs figureraient parmi les populations les plus exposées aux risques liés aux pesticides, mais aussi les jardiniers ou les désinsectiseurs. Les femmes enceintes, agricultrices ou non, seraient elles aussi concernées, notamment lors d'une exposition en période prénatale et périnatale. L'étude de l'Inserm distingue alors l'exposition en milieu professionnel - qui entraînerait une augmentation des risques de fausses couches, de malformations congénitales, mais aussi de leucémie et de tumeurs cérébrales de l'enfant de l'exposition résidentielle. Dans ce second cas, les enfants des femmes voisines d'une zone agricole ou liée à l'usage domestique de pesticides.
Car c'est principalement par contact avec la peau que se produirait l'imprégnation. L'excès de risque est conséquent : estimé à 62 % dans la maladie de Parkinson, il atteindrait 98 % dans le lymphome pour les ouvriers des usines de pesticides. Pour autant, le reste de la population ne semble pas à l'abri et pourrait être contaminé via l'alimentation, ou un usage domestique. Le rapport souligne le risque encouru par les jeunes enfants ou les fœtus dont les mères ont manipulé des pesticides pendant la grossesse : malformations congénitales, retards de croissance, de développement neurologique. Leur risque de leucémie serait augmenté de 35 à 100% ; celui de tumeurs cérébrales de 30 à 50%...

© Serge Bloch (Ligue contre le cancer)
Pas étonnant que les pesticides dérèglent notre santé. Destinés à lutter contre des organismes vivants, ils perturbent leurs processus physiologiques... Certaines substances – organochlorés et organophosphorés – sont encore utilisées comme gaz de combat. Dans certains cas, les mécanismes d'action des toxiques sont cohérents avec leur effet pathologique, confortant ainsi les données épidémiologiques. Dans d'autres, le lien est moins évident. D'où les recommandations des experts de poursuivre les recherches. Car de nombreuses questions restent sans réponse, en particulier celle des effets combinés de plusieurs substances. Et malheureusement, en dépit d'une réglementation votée au niveau européen, la consommation des pesticides ne cesse d'augmenter. Car c'est tout un modèle agro-chimico-économique qu'il faut reconsidérer.
Pourquoi les Français sont particulièrement exposés aux pesticides
Gros producteur européen, la France pratique une agriculture intensive faisant massivement appel aux pesticides. Dès lors, la contamination atmosphérique et alimentaire est inévitable.
En avril 2013, l'Institut de veille sanitaire (InVS) a présenté les résultats de la première étude sur l'exposition de la population aux composes chimiques. Quarante-deux "biomarqueurs" ont été dosés dans le sang ou l'urine d'un échantillon représentatif de 3 115 Français, vivant aussi bien à la campagne qu'en ville.
La plupart des biomarqueurs qui trahissent l'imprégnation de l'organisme par des pesticides ont été détectés chez quasiment tous les individus ! Même les organochlorés, dont certains sont interdits depuis 40 ans, restent détectables dans nos corps. Du reste, l'InV.S ajoute qu'une "attention particulière doit être portée aux organophosphorés et pyréthrinoïdes pour lesquels les niveaux français semblent être parmi les plus élevés en référence à des pays comparables". Entre autres l'Allemagne, proche voisin.
Pour comprendre cette spécificité française, il faut d'abord s'interroger sur la façon dont ces substances peuvent se retrouver dans notre corps. À la campagne, l'air ambiant peut être contaminé par les grandes quantités de produits épandus, en particulier près d'un vignoble ou d'un champ de céréales. Les pesticides utilisés à la maison, pour le jardinage, contre les insectes ou pour protéger nos animaux de compagnie, sont également vecteurs d'exposition.
Mais selon l'OMS, la principale source d'exposition est notre alimentation. Rien d'étonnant : 90% des pesticides sont utilisés par l'agriculture intensive.
Selon une étude récente de l'autorité européenne de sécurité des aliments (EFSA, 2010), la moitié des denrées alimentaires européennes analysées montre des résidus de pesticides... Certes, 97,2% des échantillons testés sont dans les limites européennes légales.
Mais il reste très difficile d'estimer l'impact sanitaire de ces produits. Les effets à long terme, de même que les risques liés au fameux "effet cocktail" dû à la combinaison de plusieurs molécules, sont mal connus. Même à faible dose, cette exposition chronique pourrait avoir un impact : effets neurologiques, endocriniens ou immunitaires, troubles de la reproduction et anomalies du développement de l'enfant, cancérogénicité...
Il s'agit maintenant d'en savoir plus - et vivement ! - sur les effets des pesticides afin que des mesures puissent être prises qui protégeront notre santé. Car le constat est désormais fait : c'est la population française dans son ensemble qui est aujourd'hui imprégnée par les pesticides.
Repères
En 2003 est créé l'Observatoire des résidus de pesticides [ORP], chargé d'évaluer leur présence dans la population et les écosystèmes.
Depuis 2008, leslimites appliquées aux résidus de pesticides dans l'alimentation sont harmonisées au niveau européen.
D'ici à 2018, leplan Ecophyto, né après le Grenelle de l'Environnement, vise une réduction de 50% de l'usage des pesticides en France. Leur utilisation est en constante augmentation...
La France, première agriculture européenne.
Avec près de 30 millions d'hectares, l'Hexagone possède presque deux fois plus de surface agricole utile [SAU] que l'Allemagne. Il est aussi le premier utilisateur de pesticides du continent. L'occupation du sol y étant très agricole, habitat et cultures sont étroitement liés et les Français sont donc plus exposés à la contamination atmosphérique par les produits épandus dans les champs.
La France utilise de grandes quantités de pesticides. (Source INRA)
Premier producteur de vin mondial, la France est aussi un gros producteur de pommes. Deux secteurs où la consommation de pesticide à l'hectare est très importante, avec des indices de fréquence de traitement [IFT] très élevés. À elle seule, la viticulture utilise 20% du volume annuel des pesticides, pour 3 % de la surface agricole !
Alors que le développement des produits "bio" est à la traîne…
Notre consommation de produits biologiques (le risque d'y retrouver des pesticides est 30 % inférieur aux produits non biologiques, selon une étude américaine de 2012) reste, année après année, derrière celle des Allemands. La France consomme en effet 19 % du marché bio européen, contre 32% pour l'Allemagne. De même au niveau de la production, l'agriculture biologique accuse du retard, avec seulement 3 % de la surface agricole utile en bio en 2010, deux fois moins qu'en Allemagne et sept fois moins qu'en Autriche !
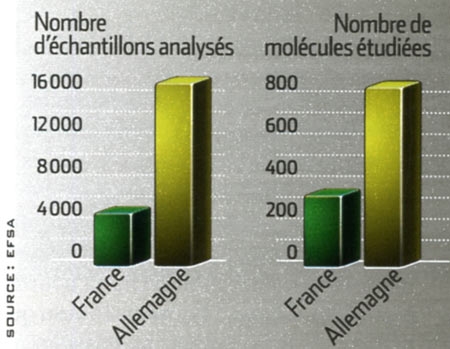
ainsi que la surveillance des aliments. (Source EFSA)
Nous avons un taux de non-conformité des denrées alimentaires (dépassement des limites maximales résiduelles autorisées en pesticides) plus élevé que nos voisins d'outre-Rhin : 3,1 % contre 2,1 %. Or, avec un nombre d'analyses beaucoup plus élevé, l'alimentation allemande est mieux contrôlée, et les anomalies sont retirées du marché. Il est donc probable que les denrées non conformes seraient encore plus nombreuses en France si le suivi y était aussi poussé qu'en Allemagne. Selon l'adage bien connu : plus on cherche, plus on trouve...
L'œil de Pierre Debailly, responsable du programme Agriculture et cancer (Agrican) :
« Nous suivons l'état de santé de 180 000 personnes et ce, sur 10 ans au minimum. » L'objectif de la cohorte Agrican, la plus grande étude jamais réalisée sur la santé en milieu agricole, est triple. Il s'agitd'abordd'identifierles risques d'exposition au cancer des agriculteurs pour améliorer la prévention. Dans un deuxième temps, notre ambition est aussi d'obtenir réparation pour les personnes victimes de maladies (pensions d'invalidité, etc.). Enfin, l'étude Agrican a pour but de faire évoluer la réglementation en faisant, par exemple, interdire ou encadrer l'usage de certains pesticides. Au commencement de cette étude, en 2005, nous avons recruté cent quatre-vingt mille agriculteurs, actifs et retraités, sur douze départements représentatifs de la variété agricole de la France et disposant de registres de recensement des cancers du réseau Francim. Nous suivons l'état de santé de ces personnes et ce, sur dix ans au minimum. Ce projet d'ampleur regroupe une quinzaine de personnes - épidémiologistes, gestionnaires de bases de données et bénéficie notamment du soutien de la Mutualité sociale agricole* (dont 180 000 adhérents forment la cohorte) et de la Ligue contre le cancer. Notre premier constat : l'état de santé global et l'espérance de vie sont meilleurs chez les agriculteurs que chez les citadins. Nos comparaisons entre ces deux populations vont ensuite porter sur le développement de nouveaux cancers. Actuellement, nous commençons les analyses des causes de cancers de la prostate et du sein, de cancers pulmonaires, mais aussi de cancers plus rares, comme le cancer du sein chez l'homme. Depuis cette année, nous mettons nos données (concernant les cancers hématologiques) en commun avec celles de deux autres cohortes créées aux États-Unis et en Norvège. Les résultats finaux de notre étude devraient être bouclés en 2020.
* La Mutualité sociale agricole (MS)! est un organisme mutualiste qui gère de façon globale la protection sociale des salariés et non salariés agricoles, ainsi que leurs ayants droit et les retraités.

Pesticides et myélomes : extraits de l'enquête Inserm 2013
Depuis les années 1980, les enquêtes épidémiologiques ont évoqué l'implication des pesticides dans plusieurs pathologies chez des personnes exposées professionnellement à ces substances, en particulier des pathologies cancéreuses. [...]
Dans ce contexte, la DGS a sollicité l'Inserm pour effectuer un bilan de la littérature scientifique permettant de fournir des arguments sur les risques sanitaires associés à l'exposition professionnelle aux pesticides, en particulier en secteur agricole et sur les effets d'une exposition précoce chez le fœtus et les jeunes enfants. [...]
D'après les données de la littérature scientifique internationale publiées au cours des 30 dernières années et analysées par ces experts, il semble exister une association positive entre exposition professionnelle à des pesticides et certaines pathologies chez l'adulte : la maladie de Parkinson, le cancer de la prostate et certains cancers hématopoïétiques (lymphome non Hodgkinien, myélomes multiples). [...] Si certaines substances sont mises en cause, c'est qu'elles ont été plus souvent étudiées que d'autres (en particulier dans le contexte des États-Unis) ; de nombreuses substances actives n'ont pas fait l'objet d'études épidémiologiques. [...]
Chez l'homme et chez la femme, l'incidence du myélome multiple et des maladies immunoprolifératives est en augmentation. En France, le taux d'incidence standardisé sur la population mondiale pour 100 000 personnes-années a augmenté de 2,2 % par an chez l'homme et de 1,8 % chez la femme entre 1980 et 2005, l'augmentation étant respectivement de 1,5 et 1,1 % entre 2000 et 2005.
En France, avec 5 930 nouveaux cas estimés en 2011, dont 54 % survenant chez l'homme, le myélome multiple des os et les maladies immunoprolifératives se situent au 15e rang des cancers et représentent 1,6 % de l'ensemble des cancers incidents. Les taux d'incidence standardisés pour 100 000 personnes-années sont de 5,3 chez l'homme et 3,5 chez la femme. Le myélome est très rarement observé avant 40 ans et son incidence augmente avec l'âge chez l'homme et chez la femme. Le myélome multiple se situe au 14e rang des décès par cancer, et représente 2,1 % de l'ensemble des décès par cancer.
Les taux de mortalité standardisés pour 100 000 personnes-années sont respectivement de 2,3 et de 1,4 chez l'homme et chez la femme. [...] Toutes ces méta-analyses montrent une augmentation de risque de survenue de myélomes multiples allant de 9 % à 39 % chez les professionnels exposés aux pesticides comparés à la population générale. [...]
Les plus fortes augmentations significatives de risque ont été observées dans la méta-analyse portant sur les agriculteurs ayant travaillé au moins 10 ans dans une ferme ainsi que pour ceux qui ont été exposés au DDT.
Sources :
Science et Vie n° 1150, juillet 2013, p. 32.
Science et Vie n° 1151, août 2013, p. 36.
Vivre, le magazine contre le cancer, n° 360, décembre 2013, pp.30-31.
af3m, bulletin n° 17, janvier 2014, p. 17.
Ajout du 07 mai 2014 : Pesticides, OGM : les vrais risques pour votre santé
Ci-dessous une interview du Pr Henri Joyeux qui à l'Institut pour la Protection de la Santé Naturelle (IPSN) livre ses impressions à la suite de l’affaire Emmanuel Giboulot, ce viticulteur bio de Bourgogne.
Le Pr Henri Joyeux est cancérologue, chercheur, nutritionniste, auteur de nombreux ouvrages dans le domaine de la santé et ancien président de Familles de France. Il est également membre du comité scientifique de l’IPSN.
Nous proposons cette interview à la suite du grand succès de la pétition de soutien à Emmanuel Giboulot, lancée par l’IPSN, qui a réuni plus de 500 000 signatures. Ce viticulteur de la Côte d’or (Bourgogne) a refusé d’épandre sur sa vigne un pesticide (le pyrèthre) imposé par la préfecture. Les autorités craignaient une extension de l’épidémie de flavescence dorée qui s’est déclarée dans le département voisin, la Saône-et-Loire. Emmanuel Giboulot, dont la vigne est cultivée en biodynamie depuis 40 ans, a refusé cette décision parce que sa vigne était située hors de la zone d’épidémie et que le produit proposé, bien que fabriqué à partir de produits naturels, est un produit toxique.
IPSN : Professeur, avez-vous été surpris par la mobilisation populaire et médiatique en faveur d’Emmanuel Giboulot ?
HJ : Oui, j’ai été surpris par le nombre de signataires. Cela démontre que nous n’allons pas si mal en France, que le bon sens pour la nature au service de l’humain est bien en place. Ce bon sens rejoint notre santé, celle de chacun d’entre nous et de la société tout entière.
IPSN : Est-ce que selon vous ce soutien massif montre que le public est davantage conscient des enjeux de l’agriculture biologique ?
HJ : Oui, point besoin de longues études pour voir que les colonies d’abeilles sont décimées par l’agriculture productiviste, que notre terre se stérilise, que les pesticides font des ravages en matière de santé publique. Je rejoins à 100 % Pierre Rabhi et mes collègues Gilles-Eric Séralini et Jean-Marie Pelt.
IPSN : Les pesticides sont-ils donc si dangereux ?
HJ : Je viens de préfacer le livre de Fabien Rodhain qui est sous presse : « Des semences et des hommes ».
Savez-vous que :
- L’industrie agrosemencière a mis sur le marché des plantes hybrides qui ne sont pas réutilisables, car entraînant des chutes de rendements si elles sont ressemées une deuxième fois. Il faut donc en re-acheter…
- L’industrie agrochimique mondiale s’est emparée de la génétique pour modifier les plantes, pour obtenir des PGM (Plantes génétiquement modifiées) pour une agriculture productiviste intensive en faisant croire qu’elle est nécessaire pour nourrir la planète, ce qui est FAUX.
- Les PGM sont à plus de 99 % des plantes à pesticides que l’on retrouve dans l’alimentation du bétail et des humains.
- 57 % des PGM sont tolérantes à un herbicide, ce qui veut dire que la plante peut se gorger de ROUNDUP sans mourir.
- 16 % des PGM produisent elles-mêmes leurs insecticides.
- 26 % des PGM peuvent produire plusieurs insecticides et être tolérantes à plusieurs herbicides (exemple MAÏS Smartstax = 6 gènes insecticides + 2 de tolérance à herbicides).
- Les évaluations chez l’animal sont faites pour démontrer que tout va bien : consommation par de jeunes rats sur 3 mois et surtout pas vie entière, aucun bilan hormonal alors que tous les pesticides sont des perturbateurs endocriniens dont on commence à connaître les effets délétères sur les enfants (anomalies urogénitales : hypospadias, anomalies utérovaginales ; hypofécondité des hommes…)
- Les études toxicologiques sont réalisées par les producteurs eux-mêmes et sont déclarées « secret industriel » ou « propriété intellectuelle ».
IPSN : N’avons-nous pas un seuil de tolérance ?
HJ : Difficile de répondre, car extrapoler du seuil de tolérance d’un rat ou d’une souris à l’homme n’a aucune valeur scientifique, mais on s’en sert quand même pour nous faire avaler, respirer… des produits toxiques sous le prétexte qu’on va sauver l’humanité et le tiers-monde, ce qui est totalement faux.
IPSN : Voyez-vous les effets des pesticides sur la santé de vos patients ou faut-il plus d’années de recul ?
HJ : Oui, mais il s’agit de causes accumulées et il peut être difficile d’incriminer les seuls pesticides, quand il y a le tabac, le stress, les mauvaises habitudes alimentaires, les hormones exogènes et d’autres perturbateurs endocriniens.
Les localisations cancéreuses les plus fréquemment observées sont au niveau des seins, de la prostate, du tube digestif et du système immunitaire avec les lymphomes.
IPSN : Que faudrait-il changer, selon vous, pour que l’agriculture soit plus respectueuse de la santé des consommateurs ?
HJ : Il faut exiger un étiquetage honnête et non manipulé. Si sur le marché vous avez à choisir entre tomates OGM et tomates nature plein champ de Provence, que choisirez vous ? Mon choix est évident.
Voici un exemple tout récent dans mon service de chirurgie. Une de nos infirmières a sur sa table une bouteille de Coca… Je lui fais remarquer que ce n’est pas bon pour sa santé, qu’il y a de l’aspartame, édulcorant éminemment toxique. Elle me répond que c’est du Zéro ! Je lui demande quel Zéro ? Elle me dit « pas d’aspartame ». Il m’a fallu une loupe pour lui démontrer qu’elle était trompée. Son coca est passé à la poubelle.
Le Professeur Joyeux diffuse une lettre gratuite contenant d'importants conseils de santé pour vous et votre entourage. Je vous invite à vous y inscrire en vous rendant ici.
10:37 Publié dans Environnement-Écologie, Médecine, Nature et santé, Pollution | Tags : pollution, pesticides, agriculture, cancer, cancer du sang, maladie de parkinson, cancer de la prostate, lymphomes, myélomes multiples, santé humaine, agriculture intensive, ogm, pgm | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
26/05/2013
Le nouveau coronavirus
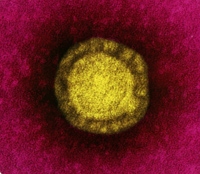 Le nouveau coronavirus ou
Le nouveau coronavirus ou
nCoV-EMC
MERS (Middle-East Respiratory Syndrome)
Depuis le syndrome respiratoire aigu sévère (SRAS) détecté en 2003 (voir image ci-contre), les virologues doivent identifier de nouveaux virus pathogènes et établir leur carte d'identité génétique. Il s'agit de réaliser des tests diagnostiques en urgence et de contrer un éventuel risque de pandémie provoqué par ces maladies totalement nouvelles (maladies dites émergentes), jamais identifiées auparavant dans une zone géographique donnée ou encore affection connue mais dont le virus vient d'être identifié.
En 2003, le coronavirus du SRAS s'est propagé dans 30 pays, responsable de 8098 cas et de 774 décès. Le premier cas a été observé en novembre 2002 dans la province de Guangdong (Chine). Le dernier cas de SRAS a été recensé en Chine le 25 juin 2003.
Le MERS (Middle-East Respiratory Syndrome)
Il a provoqué le décès, le 24 juin 2012, d'un premier patient en Arabie Saoudite. On a rétrospectivement déterminé que les premiers cas étaient apparus en avril 2012 en Jordanie, à l'hôpital de Zarka, à 25 km au nord-est d'Amman. Au 19 juin, on comptait 64 cas, dont 38 décès.
Découvert fin 2012 chez un patient décédé en Arabie Saoudite, ce coronavirus s'est révélé être un "cousin" de celui du SRAS.
Le 26 mars 2013, l'Organisation mondiale de la santé (OMS) annonçait le décès en Allemagne d'un homme de 73 ans infecté par ce "nouveau coronavirus" (appelé "nCoV-EMC" (pour nouveau coronavirus) appelé depuis MERS pour Middle-East Respiratory Syndrome. Le patient, originaire des Émirats arabes unis, avait été transporté d'Abu Dabi à Munich quelques jours auparavant. L'OMS signalait alors qu'un total de 17 cas d'infections par ce virus, dont 11 décès, était recensé.
Bilan en juin 2013 : le MERS s'est montré particulièrement virulent : 64 cas ont été recensés dans le monde, dont 49 en Arabie Saoudite (32 morts), 2 en Jordanie (mortels), 3 au Royaume-Uni (2 morts), 1 aux Émirats arabes unis (mortel), 2 en France (1 mort), 3 en Italie, 2 au Qatar et 2 en Tunisie.
La traque du nouveau virus
La traque du MERS est emblématique de la façon dont les grands laboratoires de virologie, les organisations sanitaires nationales et l'OMS se mobilisent face à ces menaces biologiques. Comment détecte-t-on un virus jusqu'alors inconnu chez un patient atteint d'une maladie pulmonaire grave ? C'est le séquençage qui permet de savoir si le virus est connu ou émergent.
Une série d'examens est d'abord réalisée sur les prélèvements respiratoires du patient hospitalisé, comme cela a été le cas en juin 2012 à l'hôpital de Djedda, en Arabie Saoudite. Les biologistes utilisent pour cela la technique dite RT-PCR (Réaction en chaîne par polymérase) pour détecter la présence du matériel génétique d'une dizaine de virus respiratoires connus.
Lorsque les résultats sont négatifs, un autre outil, la « puce à ADN », va rechercher simultanément la présence d'une centaine de pathogènes ; celle développée par l'Institut Pasteur, à Paris, permet, par exemple, de repérer 126 virus différents. « Pourtant, il arrive que l'on parvienne seulement à identifier un virus de grippe A, sans pouvoir déterminer le sous-type viral, tel que H1N1, H5N1, H9N2... », précise Vincent Enouf, directeur adjoint du Centre national de référence pour la grippe à l'Institut Pasteur (Paris).
C'est alors qu'intervient le séquençage, qui permet d'établir la carte d'identité génétique du virus et de la comparer avec celles des banques de données. On peut ainsi savoir s'il s'agit ou non d'un virus connu.
Cette opération connaît depuis 2005 une accélération considérable grâce au séquençage à haut débit. La première étape consiste à obtenir une énorme quantité de fragments de tailles différentes correspondant a des régions dispersées de façon aléatoire au sein du génome viral. Des programmes bio-informatiques sophistiqués sont alors mis en œuvre pour assembler, dans le bon ordre, les millions de fragments générés et reconstituer la totalité de la séquence génétique du virus recherché.
« En 2003, une équipe canadienne mobilisant de très nombreux chercheurs avait mis une semaine pour séquencer le génome du SRAS. Aujourd'hui, un seul chercheur y parvient en une journée », indique le Pr Lipkin. En septembre 2012, le séquençage à haut débit a ainsi permis à une équipe néerlandaise, qui venait de recevoir des prélèvements respiratoires d'un patient saoudien, de déterminer que l'agent causal était bien un nouveau coronavirus (MERS).
La découverte a pu être annoncée le 20 septembre sur le site Internet ProMED, puis, une semaine plus tard, l'équipe du Pr Christian Drosten, de l'université de Bonn (Allemagne), rapportait la mise au point d'un test de détection moléculaire par « RT-PCR en temps réel » dans la revue en ligne Eurosurveillance. Afin de rapidement valider ce test pour une utilisation à grande échelle, plusieurs laboratoires internationaux ont utilisé un gène synthétique, mimant le vrai virus, mais construit par voie chimique à partir de la séquence génétique publiée. « II nous a servi à vérifier que notre test détectait bien la présence du nouveau virus qu'il est censé rechercher, précise le Pr Jean-Claude Manuguerra, responsable de la Cellule d'intervention biologique d'urgence à l'Institut Pasteur (Paris). Nous avons pu disposer de ce test dès le 20 octobre 2012. Nous étions donc opérationnels lors des premiers cas d'infection par le MERS à Valenciennes et à Lille début mai. Imaginez si nous n'avions pas eu cet outil à temps ! »
L'analyse des deux cas français a aussi montré que la période d'incubation, entre neuf et douze jours, pouvait dépasser celle auparavant observée dans les cas similaires survenus au Royaume-Uni. Cela a d'importantes conséquences en pratique clinique, tant pour évoquer un cas probable que pour exclure un cas suspect. « il a fallu, pour les épidémiologistes de l'Institut de veille sanitaire (InVS), identifier dans l'Hexagone et suivre pendant dix jours 123 personnes ayant été en contact avec le premier patient, mais aussi 39 autres de l'entourage du second patient, qui avait été contaminé par le premier dont il partageait la chambre a l'hôpital », confie le Pr Arnaud Fontanet, chef de l'Unité de recherche et d'expertise épidémiologie des maladies émergentes à l'Institut Pasteur. Autre impératif : affiner la description de la nouvelle maladie dans ses symptômes typiques et atypiques (comme la possible survenue d'une diarrhée isolée avant les signes respiratoires) et ses facteurs de risques (immunosuppression), avec mise à jour régulière sur Internet.
Un cousin du virus du SRAS
Depuis la panique mondiale provoquée par l'épidémie due au coronavirus du SRAS (syndrome respiratoire aigu sévère), tout nouveau coronavirus responsable de maladie sévère est observé avec quelque inquiétude. Cette vaste famille de virus comprend beaucoup de virus bénins, ne déclenchant rien de plus qu'un banal rhume. Mais le "nCoV-EMC" semble pour le moins agressif au vu du nombre de décès survenus parmi les cas recensés. C'est en septembre dernier que la première alerte de l'OMS autour de ce nouveau virus est survenue : un patient de 49 ans, de nationalité qatarie, s'était rendu en Arabie Saoudite peu de temps avant de tomber malade et avait été traité pour une infection respiratoire grave dans un hôpital à Londres. Il avait contracté un virus jusque-là inconnu.
L'agence britannique pour la protection de la santé a comparé le virus de ce patient à un autre virus, isolé en Arabie Saoudite en juin 2012 chez un patient de 60 ans, qui venait d'être séquencé au Centre Médical Erasmus à Rotterdam (Pays-Bas) : il s'agissait du même "nouveau coronavirus".
Comme lui, hCoV-EMC appelé désormais le MERS, entraîne des complications respiratoires majeures, voire des défaillances de certains organes (reins). Fin mars, il n'avait été dépisté que chez quinze patients, mais neuf en étaient morts. On est encore loin de la pandémie, mais le mode de transmission de ce virus préoccupe : si son origine est animale (chauve-souris), il pourrait désormais se transmettre d'homme à homme. De nouveaux cas ont en effet été confirmés en Angleterre en février, chez des personnes n'ayant pas voyagé.
Un homme âgé de 65 ans, avait été hospitalisé à l’hôpital de Valenciennes le 23 avril 2013, après un séjour à Dubai, pour des troubles digestifs puis transféré au CHRU de Lille où l’infection par le MERS a été confirmée le 7 mai. Dans son cas, les praticiens ont mis en évidence ce coronavirus et le patient a été placé mis sous assistance respiratoire. Il est malheureusement décédé fin mai 2013. Durant les trois jours d'observation, il a eu le temps de contaminer son voisin de chambre dont l'état respiratoire s’est rapidement dégradé. Il a dû être placé sous assistance respiratoire par respirateur au même service des urgences à Lille.
La contamination homme/homme est ainsi avérée et tous les voyageurs qui ont pu être en contact avec ce touriste ont été contactés. Fin mai 2013, 38 cas d’infection au nouveau coronavirus ont été rapportés dans le monde ; 21 sont décédés.
En ce qui concerne les autorités, aucune consigne particulière n'a été donnée, si ce n'est de signaler à son médecin traitant ou au centre 15 tout symptôme évocateur (toux, troubles respiratoires, fièvre) dans les jours qui suivent un voyage au Proche ou Moyen-Orient. Et bien entendu, de suivre les mesures d’hygiène classiques comme le lavage des mains plusieurs fois par jour.
Doit-on craindre une épidémie à l'instar de celle qu'avait provoqué le coronavirus du SRAS ? « Le nouveau coronavirus ne semble pas se transmettre facilement entre les individus alors que le virus du SRAS était beaucoup plus transmissible », souligne l'OMS. Si l'organisation ne recommande aucune restriction dans les voyages ou les échanges commerciaux au regard de ce nouveau virus, elle « encourage tous ses États membres à continuer leur surveillance des infections respiratoires aiguës sévères ».
Les recherches se poursuivent à travers le monde pour cerner le nouveau coronavirus proche du Sras, qui sévit actuellement au Moyen-Orient. Est-il vraiment similaire à celui du Sras ? Comment se propage-t-il ? Quel est son réservoir naturel ? Peut-il être rapidement éliminé ? Les premiers éléments de réponse n’incitent pas à l’optimisme.
Le docteur Christian Drosten et son équipe de l’université de Bonn (Allemagne) suivent à la trace ce nouveau coronavirus du MERS répondant au nom de code hCoV-EMC. Le fait que son réservoir n’a pas encore été identifié est particulièrement inquiétant », explique-t-il.
Pour l’heure, les médecins ont constaté que ce coronavirus entraînait une pneumonie sévère, et bien souvent aussi une insuffisance rénale. « Il est effectivement proche du Sras et entraîne le même type d’affections », poursuit Christian Drosten.
Un virus qui passerait de l’animal à l’Homme… et vice-versa
À partir de ce constat, l’enjeu est de trouver la porte d’entrée de ce virus dans l’organisme. Utilise-t-il le même récepteur cellulaire que le Sras, ce qui faciliterait grandement l’approche des chercheurs ? « La réponse est clairement non, poursuit Christian Drosten. Et nous ignorons encore le récepteur en question. »
Les scientifiques allemands sont également en quête du réservoir naturel de ce coronavirus. Comme ce fut le cas pour le Sras, la piste menant aux chauves-souris est suivie de près. « Notre étude montre que le hCoV-EMC peut infecter des cellules de différentes espèces de chauve-souris ce qui est totalement inhabituel pour un coronavirus », précise Christian Drosten. Et ce n’est pas tout : « il peut aussi infecter des porcs, ce qui laisse supposer qu’il existe un récepteur commun à ces animaux ».
Pour Christian Drosten, cette nouvelle n’est pas forcément réjouissante. « Si ce récepteur est présent par exemple à la surface des poumons, il est cohérent de penser que ce virus peut se transmettre de l’animal à l’Homme, et ensuite de l’Homme à l’animal, etc. Voilà qui le rendrait particulièrement difficile à éliminer… »
Un virus encore mystérieux
Aujourd'hui, ce nouveau virus reste encore mystérieux, le faible nombre de cas permettant peu de conclusions. L'infection qu'il provoque se manifeste par une pneumonie, une fièvre, des maux de tête, une toux précédant les complications respiratoires, et dans certains cas une insuffisance rénale aiguë. Ni son origine ni son mode de transmission ne sont connus. Le MERS vient-il du monde animal comme beaucoup de virus émergents ? Il semble assez proche de coronavirus isolés chez des chauves-souris, mais cela reste à étudier. Peut-il être transmis d'une personne à une autre ? Plusieurs membres d'une même famille (dont un avait fait un voyage au Moyen-Orient) ont été touchés au Royaume-Uni, ce qui suggère « la possibilité d'une transmission interhumaine limitée » selon l'OMS, qui précise : « il est possible que les membres de la famille infectés aient été exposés à une même source de l'infection dans leur habitation ou sur le lieu de travail».
L'Institut Pasteur s'est préparé à l'éventualité de l'apparition d'une telle maladie sur le territoire français : le Centre national de référence de la grippe comme la Cellule d'Intervention Biologique d'Urgence sont équipés de tests permettant de détecter le virus dans des prélèvements.
Les chauves-souris soupçonnées de constituer un réservoir de virus émergent
Le contact avec ces mammifères, plus fréquent avec l'extension de l'agriculture, est souvent à la source de flambées épidémiques.
Les chauves-souris, dont on compte plus de 1150 espèces, constituent le « réservoir » d'un grand nombre de virus dont celui de la rage, des fièvres hémorragiques Ébola et de Marburg, du virus Hendra, agent d'un syndrome respiratoire et neurologique mortel, et du virus Nipah, responsable d'une encéphalite ou d'une atteinte respiratoire.
Les activités humaines — comme une intensification agricole — peuvent favoriser un plus grand contact entre les chauves-souris, les animaux domestiques et les hommes. En 2005, lors d'une flambée épidémique due au virus Nipah au Bangladesh, la source était ainsi du jus frais de dattes contaminées par l'urine ou la salive de chauves-souris frugivores.
Dans le cas du SRAS, c'est la Civette palmiste masquée, petit carnivore consommé dans la région de Canton, qui a servi d'hôte intermédiaire entre les mammifères volants et l'homme. Quant au MERS, il est génétiquement proche de deux virus de chauves-souris découverts en 2006 par des chercheurs de Hong Kong chez le Vespertilion du bambou et la Pipistrelle japonaise, minuscules chauves-souris insectivores.
Publiée en mars dans la revue Emerging Infections Diseases, une étude a montré que des coronavirus génétiquement très proches du MERS, mais plus éloignés du SRAS, ont été détectés dans 15 % des échantillons fécaux testés de pipistrelles européennes et 25 % de chauves-souris du Ghana. « Ces données génomiques montrent que des chauves-souris insectivores pourraient constituer un réservoir pour plusieurs coronavirus, qu'il s'agisse de ceux apparentes au MERS, du MERS lui-même et du coronavirus du SRAS ». indique le Pr Christian Drosten (université de Bonn, Allemagne). On ignore comment le MERS a pu passer de la chauve-souris à l'homme, même si les chameaux, les chèvres, et même les chats, ont été suspectés d'être des hôtes intermédiaires.
Ce coronavirus dévoile son mode d'action
Les chercheurs hollandais ont trouvé un indice majeur pour expliquer la transmission de ce redoutable virus. L'équipe du centre médical Erasmus, à Rotterdam, a découvert que sa voie d'entrée pour infecter l'homme est un récepteur appelé DPP4, situé sur la membrane de cellules des voies respiratoires ou du rein. Or, cette protéine est présente chez de nombreuses espèces, dont la chauve-souris.
"Nous cherchons à bloquer l'interaction entre le virus et cette protéine DPP4, et à découvrir si l'homme ne pourrait pas être contaminé par une autre espèce. Le virus pourrait transiter par le cochon, le chien ou le singe ", explique Bart Haagmans, coauteur des travaux.
Pays concernés par les cas confirmés, et pays limitrophes :
Arabie Saoudite, Bahreïn, Émirats Arabes Unis (Dubaï), Irak, Iran, Israël, Jordanie, Koweït, Liban, Oman, Qatar, Syrie, Territoires Palestiniens, Yémen.
Diagnostic :
L’infection à MERS se manifeste par une fièvre et des signes respiratoires (toux, pneumonie) pouvant se compliquer par un syndrome de détresse respiratoire aigüe et une insuffisance rénale aiguë.
La période d’incubation est actuellement estimée à 10 jours.
Donc tout patient revenant d'un pays à risque et présentant moins de 10 jours après son retour un syndrome pseudo grippal doit être considéré comme un cas possible.
De même tout patient contact (ex. famille, soignants) d’un cas possible ou confirmé, ayant présenté une infection respiratoire aiguë quelle que soit sa gravité, dans les 10 jours suivant le dernier contact avec le cas possible/confirmé pendant que ce dernier était malade doit être considéré comme un cas possible.
Organisation de la prise en charge des cas suspects
Il convient de ne pas orienter d’emblée le cas vers les secteurs d’accueil des urgences, mais d’organiser directement sa prise en charge avec le SAMU et mettre en place les mesures d'isolement, afin d’éviter le contact avec d’autres patients. Port d'un masque respiratoire type FFP2, désinfection des mains avec un soluté hydro-alcoolique.
Le coronavirus est sensible à l’hypochlorite de sodium (eau de Javel) et à l’éthanol à 70 %.
Signalement - Déclaration
Tout cas suspect doit être déclaré sans délai à :
-l’ARS de la région où il a été identifié, via la plateforme régionale de recueil des signalements,
-l’InVS par courriel ( alerte@invs.sante.fr)
ou par téléphone (astreinte 24h/24) : 08 20 42 67 15.
En précisant s’il existe des personnes co-exposées ou des contacts étroits à investiguer
Le classement en cas possible sera alors fait par l’InVS en lien avec le clinicien déclarant.
Liste et Coordonnées des « plates-formes régionales de veille et d'urgence sanitaire :
Midi-Pyrénées : ars31-alerte@ars.sante.fr, tel : 08 20 22 61 01
Poitou- Charentes : ars86-alerte@ars.sante.fr, tel : 05 49 42 30 30
Limousin : ars87-alerte@ars.sante.fr, tel : 05 55 11 54 54
Aquitaine : ars33-alerte@ars.sante.fr, tel : 05 57 01 47 90
Rhône-Alpes : ars69-alerte@ars.sante.fr, tel : 0810 22 42 62
Auvergne : ars63-alerte@ars.sante.fr, tel : 04 73 74 48 80
PACA : ars13-alerte@ars.sante.fr, tel : 04 13 55 80 00
Languedoc-Roussillon : ars34-alerte@ars.sante.fr, tel : 04 67 07 20 60
Corse : ars2a-alerte@ars.sante.fr, tel : 04 95 51 99 88
Ile-de-France : ars75-alerte@ars.sante.fr, tel : 0825 811 411
Basse- Normandie : ars14-alerte@ars.sante.fr, tel : 02 31 70 95 10
Centre : ars45-alerte@ars.sante.fr, tel : 02 38 77 32 10
Bretagne : ars35-alerte@ars.sante.fr, tel : 09 74 50 00 09
Haute- Normandie : ars76-alerte@ars.sante.fr, tel : 02 32 18 31 69
Pays de la Loire : ars44-alerte@ars.sante.fr, tel : 0800 277 303
Picardie : ars80-alerte@ars.sante.fr, tel : 03 22 97 09 02
Nord-Pas-de-calais : ars59-alerte@ars.sante.fr, tel : 03 62 72 77 77
Champagne-Ardenne : ars51-alerte@ars.sante.fr, tel : 03 26 66 79 29
Bourgogne : ars21-alerte@ars.sante.fr, tel : 03 80 41 99 99
Franche-Comté : ars25-alerte@ars.sante.fr, tel : 03 81 65 58 18,
hors heures ouvrées : tel : 06 80 92 80 03
Lorraine : ars54-alerte@ars.sante.fr, tel : 03 83 39 28 72
Alsace : ars67-alerte@ars.sante.fr, tel : 03 88 88 93 33
hors heures ouvrées : tel : 06 07 62 87 78
Le numéro vert d’information à destination du grand public 0800 13 00 00 est joignable du lundi au samedi de 9h à 19h.
Sources :
Lettre de l'Institut Pasteur n° 81, mai 2013.
Gozlan M. (2013). - Course de vitesse contre les virus, Sciences et Avenir, n° 797, juillet 2013, pp. 10-13.
NOTA :
Premier cas à Shanghai (Chine), détecté le 19 février 2013, un nouveau virus grippal aviaire vient d'émerger : il s'agit du H7N9. Notification le 31 mars à l'OMS de ce nouveau virus grippal aviaire, après la survenue de trois autres cas. Au 30 mai 2013, on comptait 132 cas et 37 morts.
18:17 Publié dans Actualité des Sciences, Médecine, Nature et santé | Tags : coronavirus | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
04/03/2013
L'Établissement français du sang (EFS)
L'Établissement f rançais du sang (EFS)
rançais du sang (EFS)
Outre son rôle d'opérateur de la transfusion sanguine, l'Établissement français du sang (EFS) recouvre des activités partant de la recherche fondamentale jusqu'à l'élaboration de protocoles de thérapie et l'administration de soins. Au cœur de cette organisation, le département des activités d'ingénierie cellulaire et tissulaire de l'EFS Bourgogne - Franche-Comté met en œuvre les résultats de la recherche, qui elle-même s'adosse à son expertise et à son savoir-faire, en une sorte de cercle vertueux dédié à l'immunologie de la greffe et du cancer.
Recherche et ingénierie cellulaire : des échanges de bons procédés
Les cellules souches hématopoïétiques sont au centre des activités de l'EFS Bourgogne – Franche-Comté. À l'origine des différentes lignées de cellules sanguines, elles se trouvent chez le sujet adulte dans la moelle osseuse, véritable usine à globules rouges, globules blancs et plaquettes.
Lorsque la production est perturbée, voire rendue stérile par certaines attaques cancéreuses ou les traitements, la thérapie cellulaire relance le mécanisme selon différents protocoles pour tirer le patient de son aplasie. L'autogreffe consiste à prélever dans la moelle osseuse d'un patient des cellules réputées saines à la suite de cycles de chimiothérapie. Conservées par congélation, elles seront utilisées pour pallier le déficit cellulaire qui ne manquera pas de se présenter lors de traitements ultérieurs destinés à détruire les cellules cancéreuses résiduelles, puissants au point d'atteindre aussi les cellules indemnes.
À Besançon, la première autogreffe a été réalisée en 1979 sous l'impulsion du professeur Patrick Hervé. Elle est pratiquée en routine depuis les années 1990. L'autogreffe présente des limites dans les cas de myélomes très agressifs ou de leucémies aiguës, pour lesquels les spécialistes ont recours à l'allogreffe, comme à Besançon depuis 1983.
Cherche cellules souches compatibles
Lors de l'allogreffe, le prélèvement de cellules souches hématopoïétiques est effectué sur un donneur présentant une typologie HLA compatible, de préférence de la famille du patient, à défaut inscrit sur des registres de volontaires en France et dans le monde.
Le facteur temps est ici capital pour la réussite de la greffe. Fabienne Pouthier, responsable médicale du département AICT de l'EFS Bourgogne – Franche-Comté raconte combien chaque cas est unique. « Récemment, nous avons trouvé à Washington un donneur compatible pour un patient suivi à Besançon. Le prélèvement de moelle osseuse opéré aux États-Unis est arrivé le lendemain par transport ultrasécurisé, pour une greffe réalisée le soir même au CHRU Jean Minjoz. »
L'alternative du sang placentaire
Plus récentes en France, avec une réelle généralisation depuis 2005, les greffes de cellules souches hématopoïétiques issues de sang placentaire représentent une alternative lorsque la compatibilité avec les donneurs fait défaut. Si les récentes directives internationales encouragent la création de banques de sang placentaire, Besançon s'est montrée pionnière en France avec la création à l'EFS du premier dispositif de ce type en 1995.
Les atouts majeurs du sang placentaire sont sa disponibilité immédiate et la jeunesse de ses cellules souches hématopoïétiques, caractérisées par un potentiel de régénération optimum, un risque de rejet greffon-hôte moindre et une absence de contamination virale. Leur immaturité implique cependant un temps plus long pour se développer dans l'organisme et vaincre l'aplasie.
Aux côtés des banques de cellules souches hématopoïétiques hébergées sur le site bisontin de l'EFS, figure également une banque de tissus, la seule banque EFS pour tout l'Est de la France. Les tissus, recueillis auprès des donneurs selon une démarche similaire à celle du don d'organes, sont essentiellement des cornées, des vaisseaux sanguins et des valves cardiaques, stockés pour être utilisés lors de greffes futures ou à des fins clé recherche.
Il va sans dire que toutes ces activités sont soumises aux règles les plus strictes de contrôle et de sécurité, tant dans le prélèvement et la conservation des cellules et des tissus que dans l'élaboration des produits à des fins de thérapie ou de recherche.
Ainsi l'EFS Bourgogne - Franche-Comté souhaite obtenir prochainement la labellisation de Centre de production de médicaments de thérapies innovantes préparés ponctuellement (MTI PP) répondant, aux normes européennes les plus récentes et donnant une dynamique nouvelle à une activité et un savoir-faire déjà reconnus.
Contact : Fabienne Pouthier - Département des activités ingénierie cellulaire et tissulaire - EPS Bourgogne - Franche-Comté
Tél. (0033/0) 3 81 61 50 27 - fabienne.pouthier@efs.sante.fr

Recherches pionnières en thérapie génique
II n'est pas étonnant qu'avec une production de vingt millions de cellules à la seconde, notre organisme, à la mécanique pourtant bien rodée, présente quelques défaillances. Des erreurs corrigées par le système immunitaire, qui lui, a parfois du mal à faire face à toutes les sollicitations dont il fait l'objet et peut laisser échapper à sa vigilance des cellules dangereuses, à l'origine de tumeurs.
Une armée de lymphocytes T
Lors du contrôle permanent exercé par le système immunitaire, les lymphocytes T occupent un rôle majeur et se mobilisent en masse lorsqu'il s'agit de combattre des corps étrangers comme les virus, les bactéries ou les cellules cancéreuses. Les recherches s'orientent vers l'utilisation de ces lymphocytes, capables de s'immiscer dans tout l'organisme, pour détruire des cellules tumorales résiduelles difficiles à débusquer, complétant ainsi de manière la plus fine possible les traitements réalisés par chirurgie, radiothérapie ou chimiothérapie. L'allogreffe permet d'une part le remplacement de la moelle osseuse défectueuse d'un patient et d'autre part l'implantation de lymphocytes T suffisamment différents de ses propres cellules pour encore mieux détecter et détruire les cellules nuisibles, persistantes (leucémiques ou lymphomateuses), par un processus dit d'alloréactivité.
Cependant, les lymphocytes T reconnaissent également les cellules saines du patient, risquant de provoquer la maladie du greffon contre l'hôte, mortelle dans environ 30 % des cas. Pour parvenir à un point d'équilibre et éviter de franchir cette frontière ténue entre effet et rejet, les chercheurs de l'équipe de Thérapeutique immuno-moléculaire des cancers (TIM-C) de l'unité mixte de recherche Interaction hôte-greffon / tumeur et ingénierie cellulaire et génique travaillent dans deux directions.
Gène suicide et cible idéale
La première, l'immunothérapie allogénique, consiste à programmer les lymphocytes T pour l'autodestruction, une sécurité qui sera déclenchée si leur action se retourne contre l'organisme hôte. Une fonction rendue possible par manipulation génétique, grâce à l'apport d'un gène « suicide » à activer en cas de complications. L'administration d'un médicament entraîne alors le processus de destruction. Au terme d'essais cliniques qu'ils étaient les premiers à démarrer voilà dix-sept ans, les chercheurs bisontins vont continuer à établir la démonstration de ce concept précurseur, en collaboration avec une équipe américaine du Baylor College of Medicine (Houston), dans un nouveau programme de tests menés sur une population de douze patients à partir de l'automne prochain. Guider le système immunitaire de façon très ciblée contre la tumeur est la deuxième voie explorée, sous le nom d'immunothérapie antitumorale. Il s'agit ici de faire en sorte que les lymphocytes détectent uniquement les cellules tumorales visées grâce à une particularité qu'elles possèdent en propre, et qu'ils dirigent leur action contre elles et elles seules. Dès lors, des lymphocytes produits par clonage cellulaire et moléculaire pourront être injectés en grande quantité et à des moments choisis pour un maximum d'efficacité, sans risque d'effet délétère sur les cellules saines de l'organisme qu'ils ne seront plus à même de reconnaître comme potentiellement dangereuses.
Contact : Christophe Ferrand - Unité mixte de recherche Interaction hôte-greffon / tumeur et ingénierie cellulaire et génique EPS Bourgogne - Franche-Comté / Université de Franche-Comté/ INSERM Tél. (0033/0) 3 81 61 56 15 - christophe.ferrand@efs.sante.fr
Produit anti-inflammatoire à visée thérapeutique
Et si le meilleur anti-inflammatoire était produit par notre propre corps ? Partant du processus biologique du renouvellement cellulaire, au cours duquel les cellules indésirables de l'organisme se détruisent par apoptose, des chercheurs en immunologie ont mis au point un produit thérapeutique capable de combattre l'inflammation.
Cinquante à soixante-dix milliards de cellules sont éliminées chaque jour par notre organisme, et de façon efficace car elles sont potentiellement dangereuses. Pour être actif, ce processus s'opère cependant à l'insu de notre système immunitaire dont il « endort » la vigilance en créant un micro-environnement aux effets immuno-modulateurs puissants.
L'idée est d'utiliser ce micro-environnement pour neutraliser ailleurs et dans d'autres circonstances une réponse inflammatoire incontrôlée de la part du système immunitaire. « Dans cet environnement se trouvent tous les éléments permettant de cibler et maîtriser l'ensemble de la réaction inflammatoire, donc tous les facteurs et cellules impliqués. À l'inverse, les médicaments traditionnels tels que les biothérapies ne ciblent généralement qu'un facteur ou une cellule », explique Sylvain Perruche, chercheur INSERM au laboratoire bisontin Interaction hôte-greffon / tumeur et ingénierie cellulaire et génique.
Ce processus biologique a été copié ex vivo et le micro-environnement généré in vitro. Des tests précliniques ont ensuite confirmé, et de façon spectaculaire, le traitement de souris atteintes d'arthrite rhumatoïde aiguë à un stade avancé. Au terme de dix injections, voire moins selon la concentration du produit, chez une cinquantaine de cas étudiés, la courbe indiquant la flambée arthritique s'inverse radicalement : l'inflammation est totalement jugulée et les fonctions originelles des zones touchées sont restaurées.
Action naturelle, efficacité, polyvalence, facilité de conservation... ce PTC (Produit de thérapie cellulaire) sans cellule verra ses performances protégées par un brevet déposé en janvier dernier sous la houlette de INSERM TRANSFERT. Co-inventeur du brevet, Sylvain Perruche entend poursuivre l'aventure en acquérant le moment venu la licence d'exploitation par le biais d'une start up chargée de la commercialisation du produit.
Contact : Sylvain Perruche - Laboratoire Interaction hôte-greffon / tumeur et ingénierie cellulaire et génique EFS Bourgogne - Franche-Comté / Université de Franche-Comté / INSERM - Tél. (0033/0) 3 81 61 56 15 - sylvain.perruche@inserm.fr
Source :
En Direct, le journal de la recherche et du transfert de l'Arc jurassien n° 247 - mars-avril 2013.
23:11 Publié dans Biologie, Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
28/02/2013
Audition et surdités
 L'Oreille,
L'Oreille,
l'Audition
et
les surdités
I. L'audition permet la communication
L'audition est le sens de l'ouïe, c'est-à-dire de la perception des sons.
1. Qu'est-ce que le son ?
Le son est lié à une variation de pression du milieu. Il correspond à la mise en oscillation d'un milieu. Dans le cas de l'homme, il s'agit généralement de l'air, mais l'émission et la conduction sonores peuvent se faire également en milieu liquide ou solide. L'énergie est ensuite transmise, de molécule à molécule, à une vitesse de 340 m.s-1 (dans l'air). Les ondes sonores correspondent à l'alternance de zones de pression élevée et de zones de pression faible. L'amplitude des variations de pression est qualifiée de pression sonore. Elle peut être mesurée à l'aide d'un microphone, qui traduit la variation de pression en une variation de tension électrique.
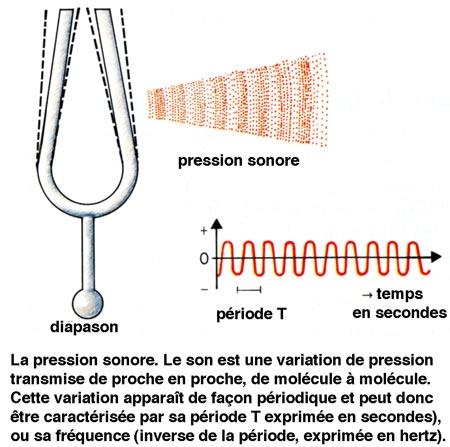
Compte tenu de l'importance de la gamme des niveaux sonores, l'échelle utilisée pour quantifier les pressions sonores est logarithmique. Le niveau de pression de référence PO a été placé légèrement en dessous du seuil de stimulation moyen de l'oreille. Pour une fréquence de 1000 Hz ; il est égal à 2.10-5 N.m-2. Ainsi, le niveau de pression sonore S d'un son donné est égal à :
S = 20 log (P/Po)
L'unité de S est appelée le décibel (dB). À 1 000 Hz, un décibel équivaut à un phone.
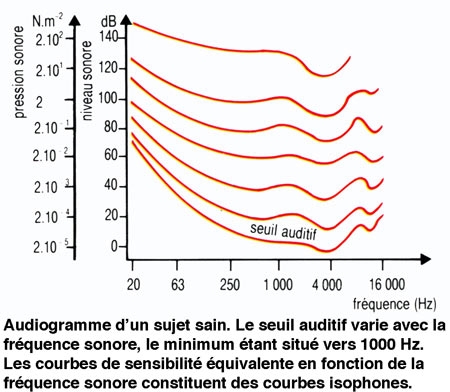
Un second paramètre du son est sa fréquence. Celle-ci est exprimée en cycles par secondes ou herz (Hz). Un son constitué d'une seule fréquence est qualifié de son pur. Cependant, un son est généralement constitué d'un mélange de plusieurs fréquences : une fréquence minimale ou fondamentale et des fréquences multiples de cette fondamentale ou harmoniques. Un son dans lequel toutes les fréquences sont représentées de façon quasi identique est qualifié de bruit blanc.
2. La sensibilité de l'ouïe varie avec la fréquence du son
L'homme est sensible à des vibrations sonores comprises entre 20 Hz et 20 000 Hz (ou 20 kHz). Le seuil d'audition varie en fonction de la fréquence d'un son pur stimulant. Il est minimal pour une fréquence de 1 kHz, et de l'ordre de 4 dB ou 4 phones. Au-delà de ce seuil, la sensibilité varie également en fonction de la fréquence du son stimulant. Ce phénomène peut être représenté sous forme de courbes isophones. À partir d'une valeur d'environ 130 phones, une sensation douloureuse remplace la sensation auditive. De tels sons peuvent endommager l'appareil auditif. Les ondes sonores émises au cours du langage parlé correspondent aux zones de meilleure sensibilité auditive.
3. Des sons graves et des sons aigus
La fréquence sonore est généralement décrite sous forme de hauteur d'un son. Un son grave est un son de basse fréquence, et un son aigu un son de haute fréquence. Dans la musique occidentale, la fréquence sonore est organisée en octaves. Un accroissement de la valeur tonale d'une octave s'obtient en doublant la fréquence d'un son.
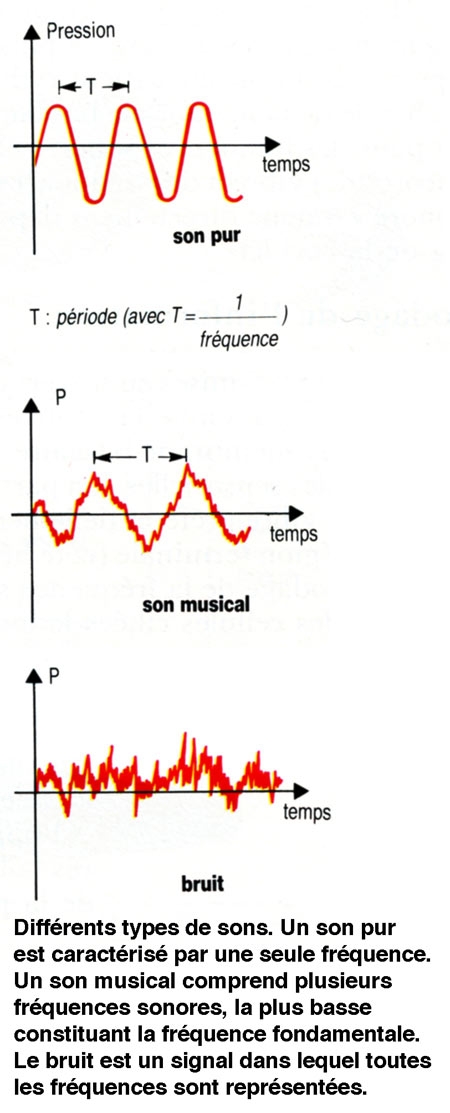
4. Deux oreilles pour faciliter l'orientation auditive dans l'espace
Une écoute à l'aide des deux oreilles permet à un sujet de situer la source sonore dans l'espace. Le son étant conduit à vitesse finie, il ne parvient en même temps au niveau des deux oreilles que si rémission sonore a lieu dans l'axe de la tête. Dans les autres cas, l'onde sonore atteint les deux oreilles avec un décalage temporel qui permet au sujet de détecter la position de l'émetteur sonore.
II. Anatomie de l'oreille et physiologie de l'audition
1. Les sons sont canalisés avant de frapper l'oreille interne
L'oreille représente l'organe de l'audition. En fait, ce que nous avons coutume d'appeler l'oreille n'est que sa partie apparente. L'oreille se compose en réalité de trois parties : externe, moyenne, et interne.. Le conduit entre l'oreille externe et l'oreille moyenne est séparé par une fine membrane : le tympan.
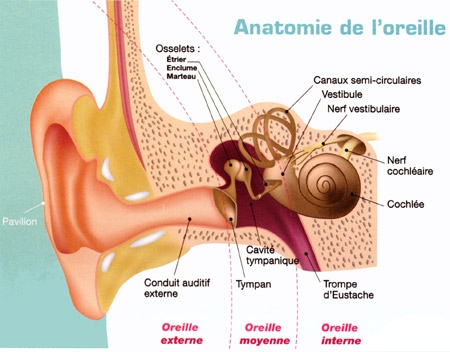
Sa partie visible est l'oreille externe qu'on appelle pavillon, nous sert d'antenne acoustique et de capteur. Les sons pénètrent dans le conduit auditif externe.
Les ondes sonores mettent ensuite en vibration le tympan qui obture l'oreille moyenne, située dans une cavité osseuse du crâne. Dans cette cavité, une chaîne de trois osselets, le marteau, l'enclume et 1'étrier, permet de transmettre les vibrations du tympan vers une structure qui sépare oreille moyenne et oreille interne : la fenêtre ovale. Les trois osselets vont servir d'amplificateurs pour compenser la perte d'énergie liée au passage de l'onde sonore du milieu aérien au milieu liquidien de la cochlée dans l'oreille interne. Saisissant les déplacements du tympan, le marteau transmet son énergie à l'enclume, qui la communique à l'étrier.
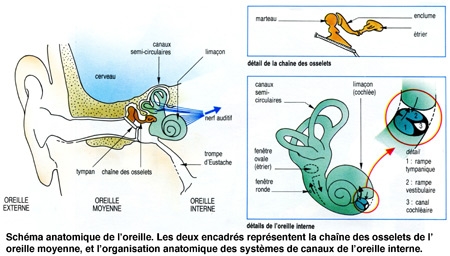
Pour égaliser les pressions de part et d'autres du tympan un conduit, la trompe d'Eustache relie la cavité de l'oreille moyenne au pharynx, une fonction très utile surtout lors du décollage d'un avion par exemple.
L'étrier (le plus petit os du corps humain) est en contact avec la membrane obturant la fenêtre ovale, point d'entrée dans l'oreille interne où se trouve l'organe de l'audition : la cochlée ou limaçon, sorte de long cône composé de trois tubes ou rampes caractérisés par un enroulement hélicoïdal et remplis de liquide.
III. L'oreille interne permet de coder les fréquences sonores
1. La membrane basilaire vibre en fonction de la fréquence sonore
Les vibrations, qui atteignent la fenêtre ovale par l'intermédiaire de la chaîne des osselets, sont transmises au travers des différentes rampes, jusqu'au niveau de la fenêtre ronde. La mise en mouvement du canal cochléaire, et plus particulièrement de la membrane basilaire, provoque un fléchissement rythmique des cils des cellules sensorielles.
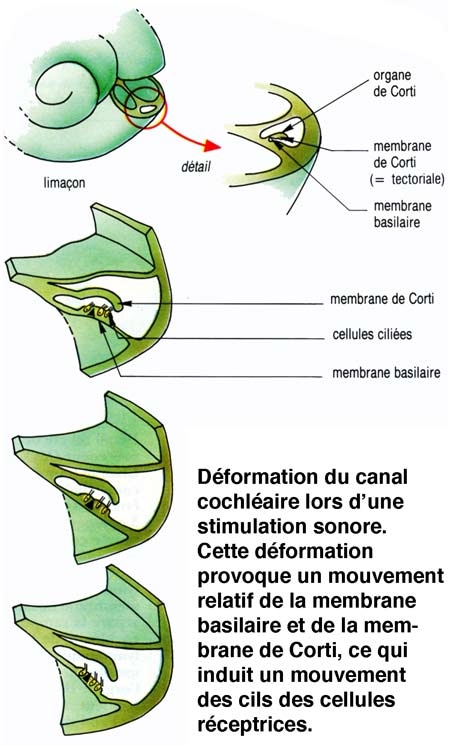
Le canal central contient l'organe sensoriel de l'audition, l'organe de Corti, tapissé des cellules sensorielles auditives : les cellules ciliées (15 000 par cochlée). La rampe vestibulaire et la rampe tympanique contiennent de la périlymphe riche en Na+, et encadrent le canal cochléaire qui, lui, contient de l'endolymphe riche en K+. Les cellules ciliées sont coiffées d'une touffe de stéréocils, qui transforment l'onde sonore en signal électrique. La partie basale de la membrane basilaire, peu large et épaisse, vibre préférentiellement pour des fréquences sonores élevées. À l'opposé, la région terminale (côté hélicotrème) vibre à des fréquences sonores faibles. Le codage de la fréquence sonore est donc directement dépendant de la position des cellules ciliées le long de la cochlée. La rampe tympanique et le canal cochléaire sont séparés par la membrane basilaire qui porte l'organe sensoriel proprement dit, ou organe de Corti. Ce dernier contient des cellules réceptrices ciliées, organisées en trois rangées externes et une rangée interne. L'ensemble est recouvert d'une membrane tectoriale attachée au côté interne de la cochlée.
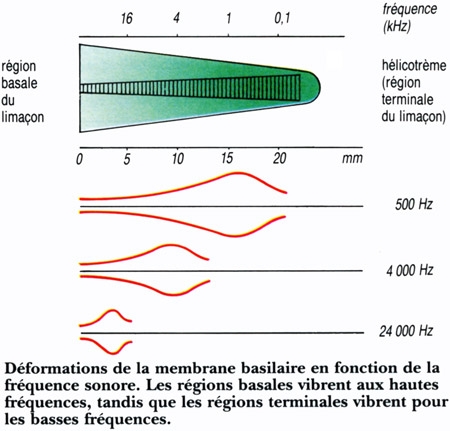
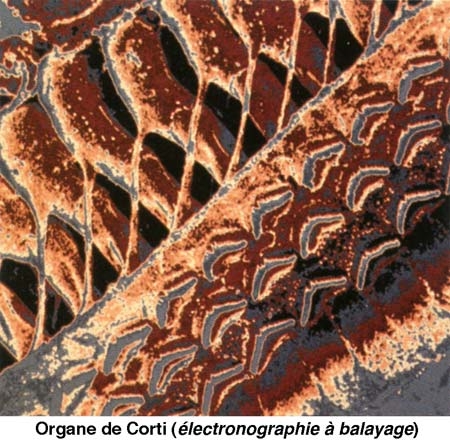
L'onde sonore amplifiée par l'oreille moyenne est en effet transformée en onde liquidienne qui va mettre en vibration la touffe ciliaire des cellules ciliées. Ces cellules sont des transducteurs : elles transforment les mouvements de leurs stéréocils en signal nerveux transmis au nerf auditif. Le long de la cochlée, chaque cellule ciliée répond préférentiellement à une fréquence sonore donnée, pour permettre au cerveau de différencier la hauteur des sons (batterie de résonateurs) : dans la partie basale de la cochlée sont codés les sons aigus, au sommet les sons graves.
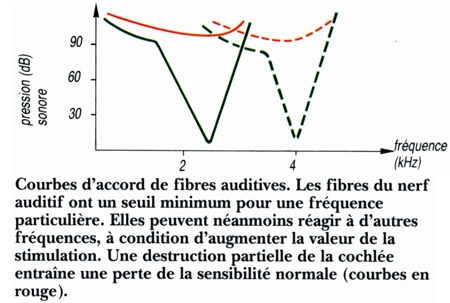
2. Les cellules ciliées assurent le codage de l'information
La différence de potentiel transmembranaire des cellules ciliées varie de façon synchrone avec le mouvement des cils. Au cours du mouvement des cils vers remplacement équivalent du kinocil, la membrane de leur extrémité se déforme, et permet l'ouverture de canaux K+. Les cils baignant dans une endolymphe riche en K+, un courant entrant d'ions positifs (K+) s'établit, provoquant une dépolarisation de la membrane. Cette dépolarisation provoque l'entrée d'ions Ca2+ qui permettent à la fois le mouvement des filaments contractiles de la plaque cuticulaire (ce qui accentue le mouvement des cils) et l'ouverture de canaux K+ situés sur la membrane du corps cellulaire. Ces derniers étant ouverts vers la périlymphe, le courant K+ qui s'établit est un courant sortant, repolarisant la membrane. Le potentiel générateur et les potentiels d'action apparaissent au niveau postsynaptique, dans la fibre sensorielle.
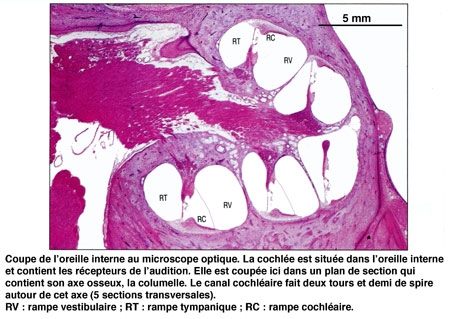
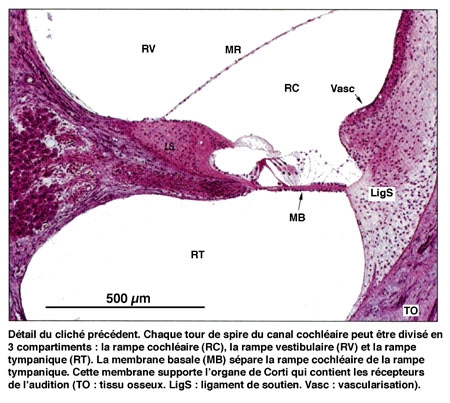
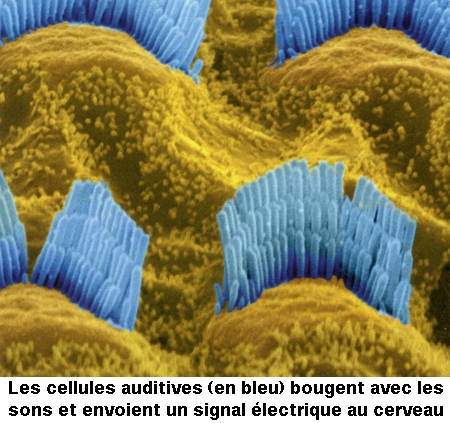
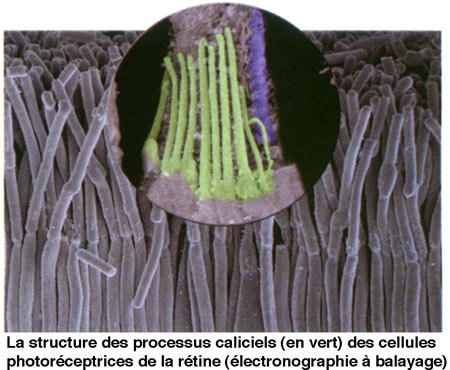
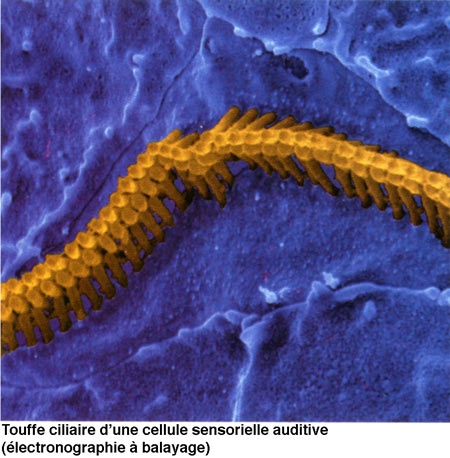
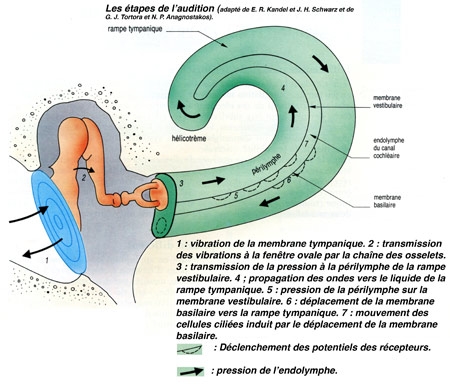
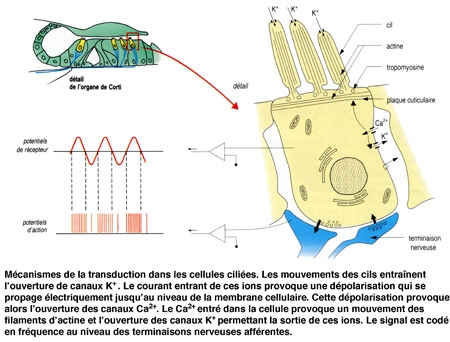
L'oreille interne contient, outre l'organe de l'ouïe, le vestibule, organe de perception de l'équilibre, repérant la position angulaire de la tête et les mouvements d'accélération.
3. Le cerveau traite les signaux
Le cerveau interprète le signal comme un son de la hauteur tonale correspondant au groupe de cellules excitées. L'analyse de l'intensité du son repose, quant à elle, sur divers mécanismes selon la fréquence sonore, le taux de décharges des neurones auditifs et la nature des neurones qui répondent (neurones à haut seuil ou à bas seuil).
Chaque fibre sensorielle est préférentiellement mise enjeu pour une fréquence particulière, mais peut également être mise en jeu par des fréquences différentes. La courbe du seuil de ces fibres en fonction de la fréquence sonore constitue leur courbe d'accord. Au niveau du cortex auditif les cellules sont organisées en colonnes fonctionnelles. Les neurones appartenant à une même colonne ont tous des courbes d'accord semblables. Les informations auditives liées au langage sont ensuite traitées dans des régions corticales particulières. Les aires principales impliquées dans ce traitement sont localisées normalement à l'hémisphère gauche. Ce sont l'aire temporale du langage, encore appelée aire de Wernicke, et l'aire frontale du langage, ou aire de Broca. La première est impliquée dans les processus sensoriels de reconnaissance de la parole, tandis que la seconde est plus directement liée à l'expression orale.
IV. Les surdités
- Origine des surdités
S'il existe quelques rares surdités d'origine centrale (impliquant le cerveau), la grande majorité des surdités est liée à un défaut de l'oreille elle-même.
Les surdités de transmission ont pour origine un défaut de l'oreille externe ou moyenne.
Les surdités neurosensorielles (surdités de perception) ont essentiellement pour origine une atteinte de la cochlée.
Dans ces deux catégories, certaines surdités sont génétiques, d'autres acquises.
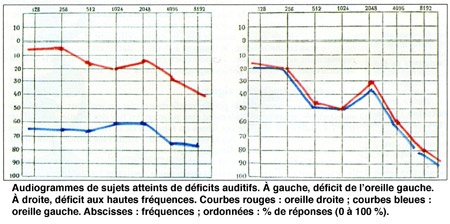
- Surdité : la part des gènes
L'audition est un outil majeur de communication, d'autant plus qu'elle est essentielle à l'acquisition de la parole : l'afflux d'informations auditives vers les «aires cérébrales de traitement du langage » est capital dans le jeune âge (au cours des six premières années de la vie - et tout particulièrement entre 0 et 3 ans) pour qu'un enfant apprenne à parler. Si la perception de la parole ou de la musique est une activité essentiellement cérébrale, la première étape du traitement des signaux sonores est effectuée par le système auditif périphérique. En cas de déficit non corrigé des atteintes auditives, le langage oral ne peut être acquis.
- Un millier d'enfants naît sourd chaque année et 65% des plus de 65 ans sont malentendants
Or en France, la surdité sévère ou profonde touche chaque année près d'un millier de nouveau-nés, avec les conséquences mentionnées sur l'acquisition du langage oral et sur le développement du lien du tout-petit avec ses proches. Un individu sur mille est de plus affecté par la surdité plus tard au cours de l'enfance. Ensuite, le pourcentage de malentendants dans la population ne cesse de progresser : 6% entre 15 et 24 ans, 9% entre 25 et 34 ans, 18% entre 35 et 44 ans et plus de 65% après 65 ans. Au total, la surdité concerne plusieurs millions de Français, à divers degrés de perte auditive, avec des conséquences variables sur leur vie sociale, Au-delà des surdités légères, les surdités moyennes ont, chez l'enfant, un impact négatif sur l'apprentissage scolaire, le développement cognitif et l'adaptation sociale. On l'a vu, les surdités profondes contrarient chez lui l'acquisition du langage oral et ont, chez l'adulte, l'isolement social pour conséquence majeure.
Face à ce problème considérable, la génétique a totalement modifié la donne, permettant une meilleure prise en charge des surdités de l'enfant, préparant pour lui de futures thérapies, et plus récemment, apportant un espoir supplémentaire : celui de prévenir les surdités liées au vieillissement.
- Surdités tardives : des problèmes de perception des fréquences aux acouphènes
« On peut imaginer l'organe sensoriel auditif comme un clavier de piano, où chaque région traite une fréquence qui lui est spécifique », explique Aziz El Amraoui, de l'unité Génétique et physiologie de l'audition, à l'Institut Pasteur. « La cochlée décompose les sons en ses fréquences élémentaires : les sons aigus (hautes fréquences) sont captées à la base de la spirale cochléaire. les sons graves (basses fréquences) dans sa partie haute. Avec le temps, les sons les plus aigus sont moins bien entendus ». La perte de l'audition avec l'âge s'accompagne d'une difficulté à distinguer les sons, à entendre par exemple une conversation dans un brouhaha. De plus, les surdités acquises sont assez fréquemment accompagnées d'acouphènes, des perceptions auditives (battements, grésillements, sifflements) en l'absence de stimulus externe, souvent très invalidantes : en France, près de 5 millions de personnes en souffriraient. Il semble que la perte auditive s'accompagne d'une augmentation de l'activité spontanée le long des voies auditives du cerveau aboutissant à ces perceptions « fantômes ». « Un rétablissement des entrées sensorielles à un niveau similaire à celui qui prévalait avant la perte auditive réduirait le gain central et supprimerait ainsi les acouphènes », avance Arnaud Norena, de l'Université Aix-Marseille, dans la revue Biofutur (novembre 2012). « Cette prédiction est en partie corroborée par la réduction/suppression des acouphènes produites par les aides auditives, les implants cochléaires et la stimulation acoustique ciblée sur les fréquences de la perte auditive. » Une raison de plus, donc, pour améliorer le traitement des surdités...
V. Les appareils auditifs existants
- Les aides auditives
Avec les aides auditives, le son est capté par un ou plusieurs microphones et le signal traité par un microprocesseur, amplifié, puis réémis via un écouteur dans le conduit auditif externe.
- Les aides en conduction osseuse stimulent directement l'oreille interne à travers les os du crâne ; un microphone capte les vibrations sonores, transmises à l'os temporal par un vibrateur placé derrière l'oreille ; les vibrations de la paroi osseuse autour de la cochlée sont ensuite transférées aux cellules sensorielles. Ces aides auditives sont parfois insuffisantes ou inadaptées à certaines formes de surdité. Deux sortes d'implants peuvent alors optimiser une audition résiduelle ou suppléer des structures défaillantes.
- L'implant d'oreille moyenne, fixé sur un osselet ou à proximité de l'oreille interne, capte les vibrations et les transmet à l'oreille interne.
- Avec l'implant cochléaire, un processeur externe transforme les sons en signaux électriques et les transmet par ondes à la partie interne implantée chirurgicalement, composée d'un ensemble d'électrodes. Ces dernières délivrent des impulsions électriques qui stimulent les fibres du nerf auditif.
- Les trois-quarts des surdités de l'enfant sont d'origine génétique
Dans les années 90, on ne connaissait pas la cause du déficit auditif des enfants qui naissaient sourds. Une équipe de généticiens à l'Institut Pasteur (voir Entretien) localisait alors les premiers gènes associés à des surdités sur des chromosomes humains. Ils firent cette découverte grâce à des collaborations avec plusieurs pays du bassin méditerranéen qui leur permirent de regrouper des données sur de nombreux individus appartenant à différentes familles, caractérisées par une forte consanguinité. Après ces premières grandes analyses génétiques, l'équipe contribua à l'identification d'une trentaine de gènes associés à des surdités, et d'autres dans le monde lui emboîtèrent le pas : 70 gènes impliqués dans des surdités héréditaires sont aujourd'hui connus. L'un d'eux, comme l'ont montre les chercheurs pasteuriens dès 1997, est à lui seul responsable de la moitié de ces surdités [le gène de la connexine 26]. Et l'on sait aujourd'hui que les trois-quarts des surdités de l'enfant sont d'origine génétique, le reste étant notamment dû a des traumatismes ou infections pendant la grossesse.
- Détecter le plus tôt possible les surdités néonatales, pour pouvoir appareiller
Cette aventure scientifique a révolutionné la prise en charge des surdités de l'enfant. Aujourd'hui, grâce aux travaux des chercheurs, des tests de diagnostic moléculaire des surdités les plus fréquentes sont utilisés en routine dans de nombreux pays du monde. Il est en effet important de détecter le plus tôt possible les surdités congénitales. Connaître le gène en cause permet de décider s'il faudra appareiller ou non l'enfant (dans certains cas, heureusement rares, l'appareillage ne résoudra rien] : plus l'enfant pourra entendre tôt, plus le retentissement de la surdité sur ses aptitudes linguistiques sera faible. Les chercheurs ont par exemple montré en 2006 que chez les enfants dont la surdité était due à un défaut du gène de l'otoferline, une protéine nécessaire à la transmission du signal par les cellules sensorielles auditives aux neurones auditifs, la pose précoce d'un implant cochléaire était recommandée alors que les caractéristiques de leur perte auditive conduisaient à s'interroger sur le bénéfice possible de l'implant. Parallèlement à ces avancées, ces recherches ont permis de comprendre de façon plus approfondie le fonctionnement de notre appareil auditif, et tout particulièrement celui de la cochlée, l'organe sensoriel de l'audition logé dans l'oreille interne.
- Un espoir majeur : la thérapie par les gènes
Aujourd'hui, beaucoup d'espoirs sont fondés sur la thérapie génique. Il s'agit là de restaurer la fonction auditive à l'aide du transfert du gène normal [«gène-médicament»], afin de compenser la fonction défectueuse de ce même gène chez le malentendant. Les méthodes envisagées sont diverses, combinant par exemple thérapie cellulaire et thérapie génique : certaines passent par l'introduction du « gène-médicament » dans des cellules souches ensuite différenciées en cellules de la cochlée, puis ré-introduites dans l'organe sensoriel. Les premiers résultats expérimentaux encouragent les scientifiques à poursuivre l'exploration de ces voies thérapeutiques nouvelles. Mais le domaine de l'enfance ne sera pas le seul bénéficiaire de la « révolution génétique » des recherches sur les surdités. Il s'agit désormais d'empêcher la dégradation de l'appareil auditif chez l'adulte. Les surdités de l'adulte, acquises au cours de la vie, sont liées à des traumatismes sonores, des infections (environ 20% des cas sont dus à des otites chroniques), des accidents liés à l'hyperpression (plongée) ou encore à une toxicité médicamenteuse. La plupart de ces facteurs contribuent à la destruction progressive des cellules sensorielles de la cochlée, indispensables à l'audition, et non renouvelables. Le vieillissement contribue par lui-même à une perte auditive qui apparaît le plus souvent à partir de 50-60 ans, la presbyacousie, aujourd'hui irréversible.
- De même que nous avons chacun un « capital soleil », nous aurions aussi un « capital son »
Là encore, la génétique joue un rôle : il existe une grande variabilité dans la sensibilité individuelle à l'atteinte auditive par la surexposition au bruit comme au traumatisme acoustique. Ainsi, chacun d'entre nous serait - selon son ADN - plus ou moins sensible au bruit. De même que nous avons chacun un « capital soleil », nous aurions aussi un « capital son ». Des gènes de prédisposition interviennent également dans notre sensibilité aux médicaments toxiques pour le système auditif (médicaments « ototoxiques »). Les scientifiques sont désormais engagés dans une nouvelle voie de recherche : comprendre comment notre oreille s'abîme, comment elle vieillit. La génétique est un outil majeur dans cette quête. Les réponses trouvées par les chercheurs devraient ouvrir la voie à des solutions thérapeutiques, que ce soit par traitements pharmacologique, génique ou cellulaire, associés ou non à des appareillages « classiques » du type implant cochléaire.
À ce jour - où le diagnostic génétique d'une surdité chez l'enfant est désormais une réalité - la perspective de prévenir l'apparition des surdités liées à l'âge n'a plus rien d'utopique...
- Face à un syndrome de surdité-cécité : l'espoir de traiter la cécité
L'équipe du Pr Christine Petit à l'Institut Pasteur étudie depuis quelques années une maladie génétique heureusement rare (elle touche une personne sur 10 000) qui associe surdité et cécité : le syndrome de Usher. Les enfants touchés naissent sourds et leur vision est progressivement altérée en raison du développement d'une rétinite pigmentaire. Parmi les différentes formes de la maladie, le type 1 (40% des cas) est le plus sévère : la surdité est profonde et les troubles de la vision apparaissent précocement. S'il existe une bonne prise en charge des patients concernant les troubles auditifs, - notamment grâce aux travaux des chercheurs et des équipes médicales -, aucun traitement ne permet aujourd'hui de stopper l'issue de la rétinite pigmentaire. Or les travaux du Pr Christine Petit[1], en collaboration avec le Pr José-Alain Sahel (Institut de la Vision), ont récemment permis de découvrir l'origine de la rétinite pigmentaire qui touche les patients atteints. Il s'agit d'un défaut dans l'organisation d'édifices cellulaires indispensables au maintien de la vision, les processus caliciels (voir photo) des cellules photoréceptrices de la rétine, dû au dysfonctionnement de l'une quelconque des cinq protéines impliquées dans cette maladie, et qui, ensemble, assurent la cohésion de ces structures. Ces travaux qui définissent les cibles de la maladie vont guider les approches thérapeutiques, aujourd'hui en cours, de cette cécité.
L'interview du Pr Christine Petit
Christine Petit est professeure au Collège de France et à l'Institut Pasteur, responsable de l'unité de Génétique et physiologie de l'audition.
Notre nouvel objectif est de comprendre les processus défectueux dans la surdité tardive pour en prévenir la survenue et la progression.
"Le domaine des surdités héréditaires de l'enfant a été transformé par les recherches de notre équipe."
Comment est née l'approche génétique de l'audition ? L'audition a été initialement explorée par les physiciens - intrigués par les performances exceptionnelles de l'organe sensoriel, la cochlée, qui se comporte comme un analyseur fréquentiel, transforme les sons, signaux mécaniques, en signaux électriques, les amplifie et aussi les distord... -, puis par les physiologistes, et enfin, par les généticiens. Nous avons mis en œuvre une approche génétique de l'audition pour déchiffrer les bases cellulaires et moléculaires du développement et du fonctionnement de la cochlée, qui échappaient jusque là à toute analyse en raison du tout petit nombre de cellules cochléaires. La cochlée ne comporte en effet que quelques milliers de cellules sensorielles auditives. La rétine, pour comparaison, est dotée d'une centaine de millions de cellules sensorielles photoréceptrices. L'intérêt de rapproche génétique pour identifier les molécules requises pour une fonction cochléaire puis en déchiffrer les mécanismes moléculaires correspondants tient au fait que son efficacité est indépendante du nombre de cellules ou de molécules impliquées dans la fonction explorée.
Qu'avez-vous découvert ?
En localisant les premiers gènes responsables de cette atteinte sensorielle sur les chromosomes humains, dans les années 1990, nous avons ouvert le domaine de l'audition à l'analyse génétique. Puis nous avons développé une approche spécifique pour identifier les gènes dont l'atteinte était susceptible d'être à l'origine de surdité chez l'enfant. Cette démarche nous a conduit à la découverte rapide de plusieurs gènes responsables de surdité précoce. Aujourd'hui, 70 de ces gènes sont connus. Par le développement d'approches pluridisciplinaires, impliquant à côté des généticiens, des biologistes cellulaires, des biochimistes, des électrophysiologistes et des physiciens, nous nous sommes ensuite engagés dans l'étude des mécanismes défectueux dans ces surdités. Nous avons pu en parallèle, déchiffrer les mécanismes moléculaires qui sous-tendent certaines propriétés physiologiques connues de la cochlée et éclairer les rôles de plusieurs structures cochléaires. Un grand nombre de laboratoires à travers le monde se sont ensuite engagés dans ce champ disciplinaire. C'est un domaine scientifique et médical particulièrement dynamique.
Quelles applications ces découvertes ont-elles permis pour les surdités de l'enfant ?
Le développement du diagnostic moléculaire de surdité héréditaire permet d'informer les familles qui le souhaitent sur le risque de récurrence d'une atteinte auditive chez les enfants à venir. La connaissance de la pathogénie des diverses formes de surdité permet, dans certains cas, de recommander l'utilisation d'appareils auditifs, en particulier de l'implantation cochléaire, alors que les caractéristiques audiologiques de la surdité suscitent le doute sur leur efficacité. Elle permet parfois, à l'inverse, de conseiller d'éviter tout appareillage auditif et de s'en remettre à des traitements pharmacologiques, dont la connaissance des mécanismes pathogéniques de ces surdités permet de prédire l'efficacité. Aujourd'hui, fondés sur ces avancées, des espoirs de traitements se profilent. Plusieurs laboratoires à travers le monde sont engagés dans la recherche de traitements des surdités, en particulier par voie génétique.
Vous vous intéressez aussi aux surdités tardives. Que peut-on espérer ?
Notre objectif est de comprendre les processus défectueux dans la surdité tardive pour en prévenir la survenue et la progression. On sait que certains gènes prédisposent à la presbyacousie, et aux atteintes auditives liées à une surexposition au bruit. La plupart d'entre eux restent à découvrir. C'est une étape incontournable pour caractériser les processus pathogéniques en cause. Nous identifions par exemple un nombre croissant d'atteintes auditives liées à des perturbations du métabolisme antioxydant que l'on pourrait vraisemblablement prévenir par des médicaments existants. Dans ce but, nous avons créé au cours des dernières années un réseau national qui comporte plusieurs services d'ORL afin de regrouper des familles atteintes de presbyacousie pour rechercher les gènes impliqués. Une analyse approfondie de leur audition a été mise en place. Elle comporte des tests psychoacoustiques pour nous permettre de reconnaître les atteintes de l'intelligibilité de la parole qui sont souvent, chez ces personnes, beaucoup plus sérieuses que ne le prédit la mesure du seuil de leur perception auditive par l'audiogramme. C'est un effort collectif important. Il nous permet aujourd'hui d'analyser environ 150 familles, auxquelles s'ajoute plus d'un millier d'individus atteints. On imagine aisément que le coût de cette recherche, qui repose sur l'analyse exhaustive des génomes de ces personnes, est très élevé.
Glossaire :
Courbe isophone : courbe reliant, sur un audiogramme, les valeurs de pressions sonores entraînant des sensations d'intensité identique.
Décibel (dB) : n.m., unité de pression sonore relative. 1 dB = 20 log.(P/2.10-5 ), où P est la pression sonore exprimée en newton.m-2.
Phone : n. m., unité sans dimension permettant de graduer l'échelle de sensibilité auditive en fonction de la fréquence des sons. La référence se situe à 1 kHz où 1 phone = 1dB.
Cochlée : n.f., partie de l'oreille interne formée de l'enroulement de trois canaux et dans laquelle sont situées les cellules réceptrices sensibles aux vibrations sonores.
Hélicotrème : n.m., extrémité apicale de la cochlée.
Organe de Corti : partie de la cochlée regroupant les cellules sensorielles.
Tympan : n.m., membrane séparant l'oreille externe de l'oreille moyenne.
[1] Menés avec les Drs Azizi El Amraoui et Iman Sahly.
Sources :
- Surdités La lettre de l'Institut Pasteur, revue trimestrielle février 2013.
- Périlleux E., Anselme B., Richard D. (1995). - Biologie humaine, anatomie, physiologie, santé. Ed. Nathan.
18:20 Publié dans Biologie, Environnement-Écologie, Médecine | Tags : audition, oreille, surdité, institut pasteur | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
26/01/2013
La gale
 La gale
La gale
par André Guyard
Professeur honoraire d'Hydrobiologie et d'Hydroécologie de l'Université de Franche-Comté
En cette fin de janvier 2013, une épidémie de gale frappe le lycée Louis Pergaud, le plus vaste des lycées francs-comtois.
C'est une occasion pour s'intéresser à cette parasitose due à cet acarien.
GÉNÉRALITÉS
Conjointement à la recrudescence des maladies vénériennes constatée au cours de ces dernières années, on observe une augmentation des cas de gale.
Selon Didier Che de l'Agence Nationale de Veille Sanitaire (ANSM), qui a conduit une étude sur le sujet en 2011, le nombre d'épisodes de gale en collectivité serait en augmentation en France. En se basant sur les chiffres des ventes de deux produits antigale, ses travaux plaçaient à plus de 200.000 les cas de gale chaque année en France (de 337 à 352 nouveaux cas en moyenne pour 100.000 habitants entre 2005 et 2009).
Plus réservé, le Pr Chosidow rappelle que la gale n'est pas une maladie à déclaration obligatoire, ce qui rend impossible l'évaluation de la tendance. Le dermatologue appelle à la création d'un centre national de référence pour les parasites (gale, punaises de lits, poux de tête ou poux de corps), qui «ne tuent pas mais peuvent transmettre des maladies infectieuses».
Les voyages dans des pays où l'hygiène est beaucoup moins développée qu'en France, l'afflux des populations immigrantes vivant dans des conditions précaires, la méconnaissance du diagnostic enfin, constituent autant de facteurs favorables à l'extension de la gale.
La gale est la parasitose des téguments de l'Homme par divers acariens de la famille des Sarcoptidés.
LE CYCLE PARASITAIRE
L'espèce la plus fréquemment en cause, l'agent de la gale dite vulgaire est Sarcoptes scabiei, variété hominis.
Image du sarcopte en microscopie électronique à balayage
La femelle de cet arthropode est de forme globuleuse et apparaît comme un gros point blanc à l'œil nu; elle mesure, en effet, 350 μm de long sur 300 μm environ de large.
Elle se compose d'une saillie antérieure triangulaire : la tête, et d'un corps ovoïde auquel sont fixées quatre paires de pattes.
Les téguments du parasite présentent des plis parallèles interrompus sur la face dorsale par un plastron grenu, puis par des aiguilles triangulaires acérées s'étendant sur les côtés du corps. Ce dernier est encore muni de minces épines allongées vers l'arrière.
Le parasite n'a ni yeux, ni trachées.
Les pattes courtes et ventrales débordent de peu le contour du corps, mais elles se prolongent par des soies longues et fines, surtout nettes sur les deux paires de pattes postérieures.
Porteuses de cinq soies, les pattes sont encore pourvues de ventouses de disposition différente selon le sexe. Les deux paires de pattes antérieures encadrent un rostre trapu dont les dents de scie déchirent l'épiderme.
L'orientation générale vers l'arrière de tous les ornements tégumentaires et de ceux des pattes ne permet pas à l'acarien de rebrousser chemin et l'oblige à avancer constamment dans la galerie qu'il creuse dans les téguments de l'Homme.
Le mâle est de plus petite taille que la femelle : 200 μm de long sur 170 μm environ de large. Il vit dans la galerie creusée par la femelle ou bien encore à la surface de la peau enfoui dans les débris épidermiques.
L'accouplement a lieu à la surface de la peau.
La femelle s'enfonce alors dans l'épiderme pour y creuser une galerie dans laquelle s'effectuera la ponte.
Celle-ci commence quelques jours après la fécondation sous forme d'œufs de 150 μm de long sur 100 μm de large.
Les œufs éclosent au bout de quelques jours (3 à 4 jours en moyenne), pour donner naissance à des larves hexapodes (trois paires de pattes) qui gagnent la surface de la peau, en perforant le toit de la galerie dans laquelle elles sont nées.
Les larves grossissent, muent à plusieurs reprises et se transforment en nymphes octopodes (quatre paires de pattes) vers le 16e jour.
Trois semaines environ après l'éclosion apparaissent les adultes des deux sexes.
La contamination, strictement interhumaine, se fait par la transmission, soit de larves ou de nymphes vivant à la surface de la peau, soit par la transmission de femelles récemment fécondées n'ayant pas encore pénétré dans l'épiderme.
Cette transmission peut se faire par un contact direct et ce, d'autant plus aisément que le contaminateur est massivement infesté. Ce contact direct a lieu le plus souvent lors de rapports intimes (en particulier le partage d'un lit avec un sujet parasité), et l'on peut contracter la gale en même temps qu'une maladie vénérienne. Parfois, le contage a lieu lors de contacts moins intimes : danse, certains sports. La gale peut également être transmise par la literie et le linge (draps et sous-vêtements des sujets contaminés).
LA CLINIQUE DE LA GALE
La gale se déclare au terme d'une incubation de durée variable, selon l'intensité de l'infestation (quelques jours lors des infestations massives, trois semaines à 1 mois dans la plupart des cas, ce laps de temps étant nécessaire pour qu'ait lieu une multiplication suffisante des acariens).
Le prurit est le symptôme majeur de la parasitose ; il est à prédominance nocturne, supportable et discret pendant la journée, il s'exacerbe le soir et en particulier au coucher.
La topographie des démangeaisons est essentiellement antérieure, elle prédomine aux aisselles et aux aines, elle s'étend à la face antérieure du tronc et des membres, elle respecte généralement la région dorsale. Le support du prurit est une éruption ayant la même topographie.
Si, en soi, l'éruption est faite apparemment de lésions non évocatrices associant des excoriations banales de grattage et des papules urticariennes recouvertes d'une petite croûte noirâtre, elle revêt dans son ensemble une topographie très particulière hautement évocatrice.
Lésions cutanées dues à la gale sur la main
La localisation au niveau des espaces interdigitaux et de la face antérieure du poignet est classique, mais bien souvent discrète. L'atteinte des aisselles et des aines, celle des flancs et des hanches sont constantes. Les lésions cutanées des seins et tout spécialement des mamelons sont rares bien que très évocatrices. En revanche, l'atteinte de la verge (excoriations du fourreau et du gland) est extrêmement fréquente. Le visage, le cuir chevelu et le dos sont, en règle générale, parfaitement indemnes. La notion de contage constituera un élément d'appoint précieux dans le diagnostic de l'affection.
Très fortement suspecté sur ces symptômes, le diagnostic de gale peut être affirmé par la découverte du classique sillon cutané et par la mise en évidence du parasite dans les lésions cutanées.
Examen direct du produit de raclage des lésions cutanées
(Document CBM25)
L'examen direct entre lame et lamelle du produit de raclage des lésions cutanées au microscope permet de mettre en évidence la présence de l'acarien Sarcoptes scabiei var. hominis (des oeufs de sarcopte sont également observés) permettant d'affirmer le diagnostic de gale.
Le sillon fait par le cheminement cutané du parasite est le véritable signe pathognomonique de la parasitose. Il s'agit d'un trait fin, flexueux, très court, à peine visible bien que parfois souligné de noir. Son extrémité antérieure peut être un peu plus saillante car elle trahit la présence de l'acarien. Une petite goutte d'encre déposée à l'entrée de la galerie va teinter le trajet du parasite. Le caractère principal du sillon est la saillie qu'il fait par rapport à la surface avoisinante. On voit encore apparaître au niveau de l'éruption de la gale des vésicules perlées. Ce sont des petites élévations ayant la taille d'une tête d'épingle qui siègent tout particulièrement au niveau des plis interdigitaux. Ces perles peu saillantes sont limpides et revêtent l'apparence des lésions de dyshidrose. La mise en évidence du parasite se fait au niveau de la partie antérieure d'un sillon.
L'effondrement du toit du sillon à cet emplacement permet de découvrir la femelle dont le corps ovoïde et blanc est aisément reconnaissable, sinon à la loupe, du moins au faible grossissement du microscope.
À côté de la forme que nous venons de décrire, la gale peut revêtir d'autres aspects.
Les formes légères se réduisent à du prurit, bien que parfois fort intense, et à des lésions de grattage restreintes.
Les gales étendues se compliquent souvent de surinfection ou d'eczématisation. La surinfection des sillons et des lésions cutanées de grattage provoque de l'impétigo pouvant évoluer pour son propre compte en envahissant le visage et le dos, régions respectées par la gale, ou encore se généraliser en entraînant des adénopathies et des signes généraux graves.
L'eczématisation est précoce sur les terrains prédisposés ou tardive provoquée parfois par le traitement. Elle s'accompagne de prurit et d'hyperéosinophilie sanguine.
Il faut signaler la possibilité de l'association de la gale avec une maladie vénérienne, comme la syphilis.
Une forme de gale très rarement rencontrée en réalité se présente sous un aspect très différent de celui de la gale classique, c'est la gale dite norvégienne.
Elle est caractérisée par des lésions de type hyperkératosique, jaunâtres ou grisâtres, épaisses, dures, siégeant sur la face dorsale des mains et des doigts, atteignant les ongles, sur les avant-bras, aux coudes et aux genoux. La généralisation de ces croûtes d'hyperkératose est constante, et la face, le cuir chevelu, le dos sont envahis.
En dehors des croûtes, on observe une éruption de type érythrodermique faite de fines squames pityriasiques, ou encore ichtyosiformes sur un fond érythémateux. Le prurit, en revanche, est très discret, souvent absent. L'examen à la loupe des croûtes révèle la présence de très nombreux parasites.
La gale norvégienne s'accompagne d'adénopathies disséminées et d'une hyperéosinophilie pouvant atteindre 50 p. cent.
Le terrain sur lequel se développe la gale norvégienne est très particulier, l'état général est souvent profondément atteint, comme en témoignent la maigreur et la cachexie, conséquences elles-mêmes d'une misère physiologique ou d'une affection grave cachectisante.
Une carence vitaminique A pourrait jouer un rôle dans le développement de cette parasitose.
L'agent pathogène semble bien être le même que celui de la gale classique, et c'est probablement le terrain qui joue le rôle principal dans cette forme de gale.
Sur le plan diagnostique, un certain nombre d'affections dermatologiques peuvent être confondues avec la gale. Il s'agit de l'urticaire, de l'eczéma et de certains prurigos, des pyodermites siégeant aux membres, de la phtiriase corporelle atteignant la face dorsale du tronc avec des lésions de grattage plus marquées.
Enfin, le psoriasis peut ressembler à la gale norvégienne. Il faut savoir évoquer la gale devant tout prurit durable et tout spécialement lorsque la maladie est apparue dans l'entourage familial ou la collectivité. La découverte des sillons caractéristiques assure le diagnostic de gale.
Document ANSM
(Pour zoomer, cliquer sur le document)
LE TRAITEMENT DE LA GALE
N'étant pas médecin, je me garderai d'apoprofondir ce chapitre. Il faut savoir que l'on dispose actuellement de produits spécifiquement actifs contre Sarcoptes scabiei. Un traitement par ivermectine (200µg/kg) par voie orale en dose unique est instauré en association avec un traitement local à base de benzoate de benzyle. Il faudra, le même jour, assurer le traitement spécifique du malade et celui de son entourage.
Actuellement, le traitement de référence est l'Ascabiol, qui se révèle indisponible depuis la fin novembre, est problématique.
La fabrication de l'Ascabiol, qui se présente sous forme de pommade, nécessite du sulfirame. Or le laboratoire Zambon subit des ruptures d'approvisionnement de cette substance active par intermittence depuis mars 2012. Selon l'Agence nationale de sécurité du médicament (ANSM), l'Ascabiol va ainsi rester indisponible pour une durée « indéterminée ».
La suspension de la production du médicament risque de « poser localement des difficultés de gestion lors d'épidémies de gale », estime Didier Che, du département des maladies infectieuses à l'Institut de veille sanitaire (InVS). D'autant que l'autre produit réputé en application cutanée, la perméthrine, n'est toujours pas commercialisé en France, regrette pour sa part Olivier Chosidow, chef du service de dermatologie à l'hôpital Henri-Mondor de Créteil et président de la Société française de dermatologie.
L'ANSM a publié fin décembre un communiqué rappelant qu'il existe des traitements de substitution disponibles en France, le Stromectol (comprimés) et le Spregal (aérosol). Mais ceux-ci sont déconseillés pour certaines catégories de population, notamment les jeunes enfants. Pour cette raison, une importation à titre exceptionnel d'un médicament commercialisé en Allemagne à base de benzoate de benzyle pourrait avoir lieu au cours du premier trimestre 2013 pour répondre aux situations cliniques non couvertes par le Stromectol et le Spregal, précise l'ANSM.
Parallèlement ave ce traitement médicamenteux, il faudra désinfecter de façon préventive l'ensemble de la literie (draps et couvertures, sans oublier les matelas et les sommiers) et des effets personnels.
Quoi qu'il en soit, lorsque la gale est compliquée de surinfection ou d'eczéma, ces complications doivent être traitées avant d'appliquer le traitement spécifique.
Le recours à une antibiothérapie générale est rare.
L'eczématisation requiert des bains d'amidon, des pommades calmantes et des antihistaminiques par voie générale, de façon à calmer le prurit.
Le mode d'application du traitement local spécifique est le suivant : on fait d'abord prendre un bain de 10 à 20 minutes au cours duquel le malade se nettoie soigneusement tout le corps avec du savon blanc.
On pratique ensuite sur la peau encore humide un badigeonnage avec le produit choisi, depuis les orteils jusqu'à la base du cou à l'aide d'un pinceau plat, en insistant particulièrement sur les zones d'élection de la parasitose.
Après séchage à l'air de cette première couche, on en applique une seconde.
Le malade se rhabille après avoir changé de linge et reste 48 heures sans se baigner.
La désinfection de la literie entière et du linge sera très soigneusement effectuée.
On fait bouillir le linge de corps et les draps.
Les vêtements seront repassés et saupoudrés de poudre antiparasitaire, les objets ne pouvant être trempés seront nettoyés et frottés avec de l'essence ou de l'essence de térébenthine.
Le sommier et le matelas seront également soumis à la poudre antiparasitaire.
Sources :
- On pourra consulter le document relatif à la gale et édité par l'ANSM.
- Guyard André, Cours de parasitologie.
15:37 Publié dans Médecine, Parasitologie | Tags : gale, parasitose, acariens, parasites, parasitologie, sarcoptes scabei | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
19/01/2013
Césaire et Marie PHISALIX : deux savants comtois
Césaire et Marie PHISALIX :
deux savants comtois
spécialistes des venins et des serpents
par Claude-Roland Marchand
Professeur des Universités
Membre correspondant de l'Académie des Sciences,
Belles Lettres et Arts de Besançon.
En 2006, la commune de Mouthier-Hautepierre et la Société Herpétologique de France ont honoré la mémoire de Césaire PHISALIX, pour le centenaire de sa mort. Cet enfant du pays s’est illustré, au cours d’une riche et brillante carrière, dans plusieurs domaines de la biologie et de la physiologie ; mais son nom reste surtout attaché à la mise au point d’un sérum antivenimeux. Malgré l’importance de cette découverte, Césaire PHISALIX nous semble injustement tombé dans l’oubli.
Mouthier-Hautepierre a associé à cet hommage, son épouse et collaboratrice, Marie PICOT-PHISALIX, disciple talentueuse qui a prolongé l’œuvre de son époux, pendant trente neuf ans au Muséum d’Histoire Naturelle de Paris.
La ville de Besançon a baptisé une rue de la capitale comtoise du nom de PHISALIX.

Cliché C.R. Marchand
Je voudrais retracer, ici, les principales étapes de leurs vies et les importantes retombées de leurs recherches en m’aidant des nombreux témoignages rassemblés dans différentes revues dont on trouvera les références dans la bilbiographie ci-dessous.
Auguste-Césaire PHISALIX (1852-1906)
Est né le 8 octobre 1852 à Mouthier-Hautepierre (Doubs) dans une modeste famille de vignerons ; c’est un élève brillant qui entame sa scolarité, auprès de son instituteur à Lods, puis au petit Séminaire d’Ornans ; il la poursuit au Collège catholique de Besançon où il obtient ses baccalauréats (en 1872, 1873). Pour alléger les sacrifices consentis par sa famille, il s’engage comme élève au Service de Santé Militaire. En 1877, au Val de Grâce, il termine ses études médicales par la soutenance d’une thèse sur « La néphrite interstitielle ». Parmi ses maîtres se trouve Alphonse LAVERAN, qui découvrira l’Hématozoaire du paludisme (Prix Nobel 1907), et parmi ses camarades il y a Émile ROUX qui fera, comme on sait, une brillante carrière à l’Institut Pasteur (mise au point du sérum anti-diphtérique).
Césaire PHISALIX va occuper différents postes au Val de Grâce, puis revient à Besançon avec le grade de médecin aide-major au 4ème Régiment d’Infanterie.
En 1881, il participe à la campagne de Tunisie, où il tombe gravement malade ; rapatrié il entame sa convalescence à Roscoff où il va assouvir sa passion de naturaliste. C’est là qu’il réunit du matériel qui lui servira à soutenir sa thèse de sciences après l’obtention de sa licence de sciences naturelles en 1882. Sa thèse de doctorat ès sciences est soutenue en 1884 ; elle s’intitule : « L’anatomie et la physiologie de la rate chez les Ichthyopsidés* ». Sa santé ne s’améliorant pas il sera mis à la retraite de l’Armée active à 35 ans, en 1887.
(* Ce sont des Poissons).
En 1884, il est nommé préparateur à la Faculté des sciences de Besançon, puis professeur suppléant de zoologie médicale à l’École de Médecine et de Pharmacie en 1886. Deux ans plus tard il est nommé Chef de travaux de zoologie à la Faculté des sciences de Besançon. Cette même année, à l’âge de 35 ans, sur proposition du Professeur CHAUVEAU (Directeur de l’École vétérinaire de Lyon), il entre au Muséum d’Histoire Naturelle de Paris, en tant qu’Aide-naturaliste ; puis il est promu Assistant en 1892. C’est pendant ce séjour de 18 ans au Muséum, jusqu’à sa mort en 1906, que Césaire PHISALIX fera ses découvertes majeures sur les venins et la sérothérapie.
Plus de 200 articles, publiés dans des revues scientifiques renommées, présentent les résultats de ses essais, de ses protocoles et des applications possibles de ses découvertes.
Malheureusement, sur le même sujet et avec des conclusions similaires, à son corps défendant, il entrera en compétition avec le Dr Albert CALMETTE dont le nom est le seul à être associé à la mise au point des sérums antivenimeux.
Marie-Émilie PICOT-PHISALIX (1861-1946)

Elle est née le 20 novembre 1861 à Besançon (150e anniversaire). Elle est la fille de Camille-Joseph PICOT originaire de Gap (Hautes Alpes) et de Marie-Joséphine DALLOZ née à Saint-Claude (Jura). En 1863 sa maman décède. Son papa élèvera alors seul sa petite famille. Grâce à un milieu aisé elle bénéficie d’une bonne éducation, entre à l’École Normale Supérieure des Jeunes filles de Sèvres en 1882, dans la deuxième promotion de cette école ; elle obtient, et c’est nouveau pour une fille à l’époque, l’agrégation de sciences en 1888.
Marie PICOT a enseigné dans plusieurs établissements : à Besançon, Bourg-en-Bresse, Cambrai. Et c’est à Besançon, qu’elle reprend des études de médecine. En 1895 Marie PICOT épouse Césaire PHISALIX qu’elle avait connu lors d’un stage à la station de Roscoff.
Cette même année, Marie PICOT-PHISALIX quitte l’enseignement et rejoint, au Muséum d’Histoire Naturelle, son mari avec qui elle va travailler, d’abord à une thèse de médecine et ensuite à des recherches approfondies sur les venins, les appareils venimeux dans le règne animal.
En 1900 elle soutient à Paris une thèse de Médecine intitulée : « Recherches histologiques, embryologiques et physiologiques sur les glandes à venin de la salamandre terrestre ». Pour les grandes qualités de ce travail, certes un peu éloigné du domaine médical, elle reçoit la médaille d’argent de la Faculté de Paris ; elle rejoint alors le groupe des premières femmes françaises titrées du grade de docteur en médecine.
De 1900 à 1906, elle travaille auprès de son mari, et l’entoure de ses soins attentifs dans les dernières années de sa vie.
En 1910, elle entre au Laboratoire d’Herpétologie du Muséum d’Histoire Naturelle de Paris où elle travaillera jusqu’à sa mort en 1946, en qualité d’Attachée bénévole. En 2011 son bureau existe toujours dans le pavillon d’Herpétologie.
Nous voulons, ici, en 2011, rendre hommage à « ces deux savants du pays de Courbet », l’année même où est inauguré le Musée du peintre d’Ornans, qui n’a pas pu, évidemment, connaître ses illustres voisins de la vallée de la Loue.
La CARRIÈRE SCIENTIFIQUE de Césaire PHISALIX
Docteur en médecine et docteur ès Sciences naturelles, Césaire PHISALIX s’est intéressé à de nombreux sujets, avec curiosité, rigueur et efficacité.
Son collègue de la Faculté de Médecine de Paris, le Dr DESGREZ, a décrit, quatre ans après sa mort, la puissance de travail et l’opiniâtreté de ce chercheur enthousiasmé aussi bien par l’embryologie et l’anatomie humaines, que par la physiologie, la pathologie générale et la bactériologie.
En effet, ce qui force l’admiration chez Césaire PHISALIX, c’est son total engagement dans chaque sujet abordé, que les circonstances ou ses maîtres lui proposent. Nous nous attarderons sur les venins et la sérothérapie, sans passer sous silence la pertinence de ses observations sur le cerveau de l’embryon humain (que Sigmund FREUD citera dans un de ses articles), la cyclopie, les chromatophores des Mollusques Céphalopodes, la rate des Vertébrés inférieurs (son sujet de thèse), et les glandes venimeuses des Amphibiens. Il a isolé la bufoténine du Crapaud, mais aussi une quinone des Myriapodes Diplopodes. On reste surpris par la dispersion de ses centres d’intérêt, mais ce qui va l’occuper la majeure partie de sa carrière c’est le problème des venins et le traitement de l’envenimation.
Pour comprendre l’origine de son intuition géniale concernant l’obtention d’un sérum neutralisant les venins, il nous paraît important de rappeler les premiers travaux de microbiologie qu’il a effectués sous la conduite du Professeur Auguste CHAUVEAU (1827-1917 ; titulaire de la Chaire de Pathologie comparée qui a mis au point le vaccin contre le charbon) et qui ont trait à la maladie charbonneuse. En effet, à l’instar de nombreux chercheurs, il atténue la virulence du Bacille par la chaleur. Mentionnons par exemple, dans cette période féconde en découvertes, les nombreux travaux convergents des années 1880-1890 : ceux de TOUSSAINT sur le charbon en 1880, de FERRAN* en 1884 et de GAMALEÏA sur le choléra en 1888, ceux de PASTEUR sur la rage en 1885, ceux de ROUX et YERSIN sur la diphtérie en 1888, BEHRING et KITASATO en 1890 sur la diphtérie et le tétanos, et de BABES et LEPP en 1889 sur la rage. C’est une période de recherches animées et parfois conflictuelles procédant d’un même principe : affaiblir un microbe, pour vacciner un animal, et utiliser le sérum de son sang qui a acquis la capacité de neutraliser les toxines microbiennes.
* Jaime FERRAN, prix Bréant 1907, aurait même la priorité sur PASTEUR, puisqu’il a vacciné, en Espagne, 4700 personnes contre le choléra en 1885.
Dès 1889, PHISALIX concentre ses recherches sur les venins, qu’il avait déjà abordés avec la Salamandre et le Crapaud, et qu’il élargit aux Serpents. Il reconnaîtra plus tard comment lui est venue l’idée, auprès de son maître A. CHAUVEAU, d’une analogie entre « les sécrétions cellulaires toxiques et les sécrétions microbiennes… et que les procédés d’atténuation et de vaccination applicables aux unes le sont aussi aux autres. »
Ce paradigme, pourrait-on dire, se confirmera au fil des essais et des ajustements expérimentaux qu’il conduira avec la collaboration d’un jeune pharmacien, Gabriel BERTRAND, dont le nom restera attaché à ses découvertes majeures.
GENÈSE d’une DÉCOUVERTE HISTORIQUE
De tous temps la médecine traditionnelle a proposé différents remèdes contre l’envenimation ; citons parmi les plus anciennes la Thériaque d’Andromachus (cf le texte de Moyse CHARAS 1668), utilisées pendant 17 siècles, ou d’improbables préparations « magiques » à base de plantes, d’insectes, d’extraits divers et variés… souvent inefficaces et à tout le moins dangereux sur des patients en état de choc.
L’accoutumance des montreurs et des chasseurs de serpents, était attribuée à des petites morsures répétées, où de faibles quantités de venin agissaient un peu comme un vaccin (Marie PHISALIX, mordue à plusieurs reprises pourrait en être le plus bel exemple !).
Dans ses travaux de 1886-1888, KAUFMANN signalait déjà l’accoutumance qu’il obtenait chez le chien par des injections répétées de petites quantités de venin entier ou de venin vieilli (travail couronné par l’Académie de Médecine). Mais nous trouvons également dans la littérature du XVIIIe siècle, sous la plume de FONTANA (1780) des essais d’accoutumance par injections de petites quantités de venin. C’est à partir de 1892 que, de son côté déjà, Albert CALMETTE parvient à détruire la « virulence » du venin de Cobra par la chaleur ; mais il reconnaît avoir cherché, en vain, à obtenir l’immunité totale chez les animaux expérimentés . L’ensemble de toutes ces observations sur les venins, l’envenimation et l’accoutumance, sont prises en compte par Césaire PHISALIX qui, à partir de 1892, s’emploie à les utiliser dans des protocoles méthodiques savamment répétés et contrôlés.
Matériels et méthodes utilisés par PHISALIX et BERTRAND
PHISALIX et BERTRAND ont utilisé le venin de Vipera aspis, récoltée dans le Centre de la France et en Franche-Comté (CALMETTE, on l’a dit plus haut, travaillait sur le Cobra mais il a réalisé quelques essais avec des Vipères récoltées autour d’Arbois ). Dans un premier temps ils ont établi que la dose mortelle minima pour un Cobaye de 500 g était de 0,3 mg de venin sec.
Puis ils testent l’effet de températures de plus en plus élevées sur l’atténuation du venin ; ils établissent finalement que c’est un chauffage de 15 mn à 80° qui est le plus efficace. Leurs différents essais les amènent à conclure que la chaleur met en évidence trois substances dans le venin : un composé toxique à effet local : l’ échidnase, un composé qui détermine les effets généraux mortels : l’échidno-toxine et ce qui est obtenu après un chauffage de 15 mn à 80° : l’échidno-vaccin. Cette observation est fondamentale pour l’établissement du protocole rigoureux et reproductible que nos deux chercheurs vont proposer dans leurs publications historiques de 1894.
Le protocole de 1893-1894
In : Comptes Rendus de l’Académie des Sciences vol. 118, 5 février 1894, pp 288-291. C’est le treizième article de PHISALIX sur les venins ; il s’intitule : « Atténuation du venin de vipère par la chaleur et vaccination du cobaye contre ce venin. » note présentée par M. A. Chauveau.
PHISALIX et BERTRAND réalisent une vaccination le 11 janvier sur un cobaye mâle de 510 g, avec 0,3 mg de venin de vipère chauffé à 75° pendant 5 min : l’animal est un peu nauséeux, sans symptôme local. Le 13 janvier inoculation de 0,3 mg de venin entier : quelques nausées, pas de gonflement local, vivacité normale. Le 14 janvier pas d’œdème. Encore vivant le 5 février.
Un résultat identique est obtenu avec 0,6 mg de venin.
Conclusion des auteurs : « Le venin chauffé acquiert des propriétés vaccinantes, soit parce que la chaleur respecte des substances douées de ces propriétés, soit parce qu’elle en fait naître aux dépens de matières toxiques… »
« … Disons toutefois, dès maintenant, qu’il se produit dans le sang des animaux vaccinés des modifications importantes, analogues à celles que l’on a découvertes pour le tétanos ».
Cette communication est suivie le 10 février 1894 par un article complémentaire et fondamental, qui démontre que le sang des animaux vaccinés a des propriétés antitoxiques.
In : Comptes Rendus de la Société de Biologie vol. 46, pp. 111-113. Il s’intitule : « Sur la propriété antitoxique du sang des animaux vaccinés contre le venin de vipère. »
PHISALIX et BERTRAND vaccinent deux cobayes le 21 janvier et les sacrifient le 24 en prélevant leur sang (Notons que ce délai est très court quand on sait que le maximum d’IgG (imunoglobulines G est produit plusieurs semaines après la première injection. Il semblerait que les IgM rapidement produites auraient leur importance ). Ce sang est défibriné, mélangé à la dose de 15 cc avec 0,3 mg de venin sec. Ce mélange est ensuite injecté à un Cobaye qui fait un oedème 2 heures après. Le 10 février l’animal est bien portant. Même résultat avec 0,5 mg dans 12 cc du sang de l’animal vacciné. Confirmation des résultats avec 3 cc de sang mélangé à 0,3 mg de venin.
Conclusion des auteurs :
« Nous espérons obtenir des modifications du sang suffisamment intenses pour qu’il puisse être utilisé comme agent curatif. »
Il nous semble qu’un grand pas est alors franchi dans le traitement des envenimations : le sérum antivenimeux est inventé. Mais une publication contemporaine d’Albert CALMETTE va perturber les retombées de la découverte de PHISALIX et BERTRAND.
Les travaux d’Albert CALMETTE (1863-1933)
Élève de l’École de Médecine navale de Brest, il entre au Service de Santé de la Marine, obtient sa thèse en 1885 et effectue de nombreuses missions en Afrique, St Pierre et Miquelon et en Asie. Dès 1891 Louis PASTEUR le désigne pour fonder une filiale de l’Institut Pasteur à Saïgon ; c’est là qu’il supervise la production de vaccins contre la variole et contre la rage et conduit des recherches sur le choléra, la dysenterie, les fermentations et les venins de serpents.
Placé hors cadre du Corps de Santé des colonies, en 1894, il consacre tout son temps à la préparation d’un sérum antipesteux (avec BORREL et YERSIN) et surtout d’un sérum antivenimeux contre le venin de Cobra. Tout comme CHAUVEAU et PHISALIX il croyait à une analogie entre les composants toxiques du venin et les toxines bactériennes. La chaleur, selon lui, ne modifiant pas le venin de Cobra, il y parvient à l’aide d’hyposulfites alcalins.
En 1892, il publie ses premiers essais d’immunisation sur les Poules ; mais c’est en 1894, le même jour que PHISALIX et BERTRAND, à la Société de Biologie, mais plus tard dans la journée (!), qu’il présente un travail intitulé : « L’immunisation artificielle des animaux contre le venin des serpents et la thérapeutique expérimentale des morsures venimeuses. » Il conclut en affirmant que son protocole effectué sur l’animal pourrait être appliqué à l’Homme.
Notons que dans le traitement de la morsure, il accordait autant d’importance à l’injection locale d’hypochlorite (eau de Javel) qu’au sérum lui-même. Il finira par ne plus préconiser l’injection d’hypochlorite dont PHISALIX et BERTRAND démontrent l’inefficacité en 1895, sans jamais reconnaître explicitement son erreur. De même il mit beaucoup de temps à reconnaître la spécificité des sérums antivenimeux et pensait que son antisérum préparé avec le venin de cobra était efficace contre toutes les envenimations ophidiennes. Pourtant PHISALIX et BERTRAND (1895) notaient que : « le venin des serpents diffère non seulement d’une espèce à l’autre, mais aussi chez la même espèce », en fonction, en particulier, de la saison et du lieu de récolte.
C’est le professeur Max GOYFFON, du Muséum d’Histoire Naturelle, qui résume le mieux en 2009, les tenants et les aboutissants de la querelle de priorité qui oppose pour longtemps les deux découvreurs.
Je le cite :
« Dans une note présentée quelques semaines plus tard, le 27 mars 1894, CALMETTE fait valoir l’action tout à la fois préventive, antitoxique et thérapeutique du sérum antivenimeux qu’il prépare, sans citer le travail antérieur de PHISALIX et BERTRAND. Ceux-ci répliquent aussitôt le mois suivant dans une note où ils rappellent leur antériorité, car ils pensent que des conséquences théoriques et pratiques importantes découleront des faits qu’ils ont établis. »
L’Académie des Sciences donnera raison d’abord à PHISALIX et BERTRAND en leur attribuant le prix MONTHYON en 1894 « pour la découverte d’un sérum antivenimeux », puis à PHISALIX seul avec le prix BRÉANT en 1898 pour « la découverte des sérums antivenimeux. »
La querelle durera longtemps et c’est le nom de CALMETTE que l’Histoire retiendra ; à cela il y a plusieurs raisons :
1 – la rivalité évidente qu’il y avait entre le Muséum et l’Institut Pasteur ;
2 – le mauvais état de santé de Césaire PHISALIX qui ne se déplace plus guère, alors que CALMETTE voyage et présente ses résultats dans le monde entier ;
3 – la stratégie efficace de CALMETTE qui dès 1895, à l’Institut Pasteur de Lille, s’attache à préparer des grandes quantités de sérum antivenimeux contre le venin de Cobra, avec lequel il obtient des guérisons humaines : en 1895 il applique avec succès la première sérothérapie antivenimeuse à un Vietnamien ; pratique que n’a pas pu réaliser PHISALIX, qui n’avait pas accès aux malades.
4 – une certaine « ingratitude » du Pastorien vis à vis de son confrère du Muséum, à laquelle s’ajoute le recrutement de BERTRAND par l’Institut Pasteur en 1900.
Avec le recul, nous sommes en mesure de dire qu’il y a manifestement une différence de tempérament entre les deux découvreurs : PHISALIX est prudent, modeste et élargit ses recherches, jusqu’à sa mort, pour découvrir d’autres antidotes. « À l’opposé, CALMETTE met toute son énergie à faire reconnaître l’intérêt de sa découverte… il vise avant tout l’efficacité… Élève et admirateur de ROUX autant que de PASTEUR, sa foi, son pouvoir de conviction et un dynamisme hors du commun balaieront aisément des approximations et des échecs en fin de compte mineurs, et réussiront à imposer ses opinions et ses résultats. » nous dit Max GOYFFON. Qui conclut : « CALMETTE sera prophète en dehors de son pays comme en son pays… ».
Nous laisserons, à propos de cette querelle, le dernier mot à Édouard R. BRYGOO (1985) qui a travaillé à l’Institut Pasteur et au Muséum d’Histoire Naturelle, je cite : « Même s’il ne s’en fallait que de très peu, PHISALIX et BERTRAND étaient gagnants aussi bien à la Société de Biologie qu’à l’Académie des Sciences, tandis que CALMETTE ne se montrait vraiment pas beau joueur. »
Nous ne pouvons pas quitter Césaire PHISALIX sans mentionner les nombreux travaux qu’il a consacrés à l’immunité naturelle de certains animaux (Mammifères ou Serpents) pouvant laisser espérer découvrir une propriété particulière transposable à l’espèce humaine. D’autres pistes ont été explorées par lui, alors qu’il cherchait des molécules naturelles susceptibles de traiter l’envenimation.
Césaire PHISALIX a été élu Officier de l’Instruction publique en 1899, Officier de l’Ordre du Lion et Soleil de Perse en 1903.
Il a été nommé chevalier de la Légion d’Honneur en 1900.
L’école et une place de Mouthier-Hautepierre ainsi qu’une petite rue de Besançon portent son nom.
Il n’a pas été membre de notre Académie.
Évoquons la carrière scientifique de Marie PICOT-PHISALIX
Elle a publié seule ou en collaboration plus de 270 articles, de vulgarisation ou très spécialisés. Deux ouvrages majeurs sont attachés à son nom : « Animaux venimeux et venins » en 1922 et « Vipères de France » en 1940. On peut y apprécier d’une part ses descriptions anatomiques, physiologiques précises et d’autre part ses talents d’artiste. Les deux volumes de 1922 comptent plus de 1400 pages, 521 figures, 9 planches en noir et blanc, 8 planches en couleurs et une impressionnante bibliographie. Marie PHISALIX observe soit des animaux qu’elle a récoltés elle-même (salamandres ou vipères), soit des spécimens qu’on lui envoie par voie postale dans des boîtes à bonbons (!).




Cinq schémas extraits de « Animaux et venins » 1922
La manipulation des vipères ou du redoutable Heloderma lui vaudra plusieurs morsures, dont une à l’âge de 80 ans qu’elle supporte sans dommages (l’Histoire ne dit pas si elle a utilisé le sérum antivenimeux inventé par son mari). Une anecdote rapportée par F. ANGEL, son aide de laboratoire, illustre le « pragmatisme » de Marie PHISALIX. Citation : « Au moment des plus dures restrictions alimentaires imposés aux Parisiens par l’occupation allemande, au cours des années 1941-1944, nous avons vu bien souvent Mme le Dr Marie Phisalix … emporter chez elle dans un petit récipient les œufs non embryonnés des nombreuses femelles de vipères qu’elle gardait en captivité et qui, dans la journée, avaient été sacrifiées pour servir à ses expériences et à ses études. Ces animaux étaient disséqués, les œufs prélevés soigneusement dans le corps pour servir, disait-elle, « à faire son omelette du soir »… elle ajoutait, en riant : « je prélève également la graisse des mêmes animaux pour remplacer les autres matières grasses absentes ! »…. Par contre elle était navrée de voir sa domestique refuser énergiquement cette nourriture… Ce mode particulier d’alimentation souvent répété, n’altéra jamais sa santé… Il apportait une preuve nouvelle à ses opinions concernant la destruction, par la cuisson, du venin produit par les glandes et le sang des espèces dangereuses. »
Sa filleule, Marie-Louise BOURGEOIS, évoque un souvenir ému de sa marraine, avec qui en 1919, elle chassait les Salamandres à Mouthier-Hautepierre, la lanterne à la main. Même en vacances elle se faisait livrer des vipères du Morvan et « elle les disséquait, surtout la tête. Ensuite elle tannait les peaux pour s’en faire des ceintures et des garnitures. »
Nous avons pu observer, conservés dans le formol ou dans l’alcool de nombreux spécimens entiers préparés et étiquetés par Marie PHISALIX : salamandres, couleuvres, vipères, héloderme, mais également des crânes finement disséqués de vipéridés ou de crotale.
Le Dr Ivan INEICH, actuel curateur des collections du Muséum National d’Histoire Naturelle, à qui nous devons les clichés que nous projetons, nous a autorisé à les regarder de très près et constaté leur bon état de conservation. Nous pouvons faire de même dans le petit Musée Marie Phisalix de Mouthier-Hautepierre, que Christophe CUPILLARD entretient et fait visiter à la demande. Quelques spécimens de couleuvres et de vipères cédés en 1927 par « Mme le Docteur Phisalix » ont été également signalés dans les collections du Musée de la Citadelle et de la Faculté des Sciences de Besançon.
Schéma extrait de « Vipères de France » 1940
Outre ses propres travaux, cette « grande prêtresse des animaux venimeux », a apporté son concours à la relecture, à la finalisation de « La vie des Reptiles de la France centrale », 343 pages écrites et documentées par son ami Raymond Rollinat, décédé au moment où il achevait le manuscrit. Parmi ses disciples signalons notre compatriote naturaliste Charles DOMERGUE (décédé en 2008) qui lui a dédié une espèce de Colubridé découverte à Madagascar et qu’il a nommé Phisalixella.

Schéma extraits du livre de Raymond ROLLINAT
« La vie des Reptiles de France » 1934.
Publié avec le concours de Marie PHISALIX
Les engagements de Marie PHISALIX
En tant que médecin et citoyenne, Marie PICOT-PHISALIX a apporté son aide dans le domaine sanitaire et dans la défense de la cause des femmes : Vice-présidente pour l’amélioration du sort de la Femme en 1935, elle présidera, à 84 ans, une réunion de la Ligue Française pour le Droit des femmes et sur le rôle des électrices dans la reconstruction du pays en 1945. La Présidente parlera du « féminisme souriant d’une grande Dame » ! En tant que médecin elle a procédé à des vaccinations contre la variole et la typhoïde, en 14-18, et a assuré la garde de la Ménagerie du Jardin des Plantes en 39-45.
Marie PHISALIX n’a jamais oublié Mouthier-Hautepierre, à qui elle a fait don d’un important mobilier scolaire en 1912.
Ses distinctions sont nombreuses : Officier d’Académie en 1901, Officier de l’Instruction publique en 1908, deux prix Bréant (1916, 1922), Grand Prix de l’Exposition d’Hygiène de Strasbourg (1923), Diplôme et médaille de l’Exposition vaticane (1925), Grand Prix Lasserre de l’Instruction publique.
Elle a été décorée de la Légion d’Honneur en 1923.
Elle a été élue Présidente d’honneur de la Société d’Histoire Naturelle du Doubs en 1924 et nommée Associée correspondante de notre Académie le 26 janvier 1933. Elue Présidente de la Société Zoologique de France en 1937. Elle a échoué de très peu à l’Académie de Médecine où l’on se souvient que Marie CURIE n’a été admise que très tard, après ses deux prix Nobel !
La tombe des PHISALIX
Dans le cimetière de Mouthier-Hautepierre, tout en haut, la sépulture des deux savants regarde la vallée. On peut y lire cette inscription :
Famille des Docteurs Césaire et Marie PHISALIX
Chevaliers de la Légion d’Honneur
CONCLUSION
La carrière de nos deux compatriotes est admirable.
Leurs travaux dans le domaine des venins, de la sérothérapie et de l’Herpétologie ont eu et ont encore des prolongements et des retombées considérables.
Notre Région peut s’honorer de les avoir formés et côtoyés et s’honorerait de les célébrer avec tout le respect qu’ils méritent.
Lors d’un Colloque consacré à Courbet, en septembre dernier, Madame le Conservateur en chef du Musée du Louvre faisait remarquer à l’auditoire que « la Franche-Comté ne reconnaît pas assez ses enfants ». Même si ce constat est vrai et dérangeant on objectera, tout de même, que Louis PASTEUR et Georges CUVIER ont reçu des hommages à la hauteur de la portée de leurs découvertes qui ont fait « beaucoup d’ombre aux autres savants comtois ! » ; à nous, désormais, de faire une place honorable à ce couple de chercheurs.
Quant à la paternité de la découverte du sérum antivenimeux, nous pensons, en toute objectivité, que Césaire PHISALIX, avec quelques heures d’avance, a bien fait l’annonce décisive.
NB : Ce litige nous rappelle, toutes proportions gardées, les conflits célèbres de DARWIN-WALLACE, ROUX-FLEMING ou PASTEUR-TOUSSAINT… et beaucoup d’autres, où c’est souvent le plus pugnace sinon le plus ambitieux qui a imposé son nom dans les pages de la célébrité !
BIBLIOGRAPHIE
Bochner R. et Goyffon M. 2007. L’œuvre scientifique de Césaire Phisalix (1852-1906), découvreur du sérum antivenimeux. Bull. Soc. Herpét. Fr., 123, pp. 15-46.
Brygoo E. R. 1985. La découverte de la sérothérapie antivenimeuse en 1894. Phisalix et Bertrand ou Calmette, Bull. Soc. Anc. Elèves Inst. Pasteur, 4, pp. 10-21.
Calmette A. 1894. L’immunisation artificielle des animaux contre le venin des serpents et la thérapeutique expérimentale des morsures venimeuses. C. R. Soc. Biol. 46, 10 février, pp. 120-124.
Calmette A. 1896. Le venin des serpents. Physiologie de l’envenimation. Traitement des morsures venimeuses par le sérum des animaux vaccinés. Société d’Editions scientifiques, 72 pages.
Charas M. 1685. Nouvelle expérience sur la Vipère, où l’on verra une description exacte de toutes ses parties, la source de son venin, ses divers effets, et les remèdes exquis que les artistes peuvent retirer de cet animal. In 8°. Paris. Premier livre écrit en langue française se rapportant à la Vipère.
Cupillard C. 2007. Auguste-Césaire Phisalix (1852-1906) : un savant au pays de Courbet. Bull. Soc. Herp. Fr., 123, 9-13.
Cupillard C. et Videlier P-Y. 2007. Césaire et Marie Phisalix. Deux savants au pays de Courbet. 24 pages.
Desgrez A. 1910. Notices biographiques. XVIII – Césaire Phisalix. Archives de Parasitologie. t. XIV, pp. 54-153.
Fontana F. 1781. Traité sur le venin de la vipère, sur les poisons américains, sur le laurier-cerise et sur quelques poisons végétaux. 318 pages.
Goyffon M. et Chippaux J-P. 2008. La découverte du sérum antivenimeux (10 février 1894), pp 32-35.
Lescure J. et Thireau M. 2007. Marie Phisalix (1861-1946), une grande dame de l’Herpétologie. Bull. Soc. Herp. Fr. 124, 9-25.
Phisalix C. et Bertrand G. 1894. Atténuation du venin de vipère par la chaleur et vaccination du cobaye contre ce venin. C. R. Acad. Sc., 5 février, pp. 288-291.
Phisalix C. et Bertrand G. 1894. Sur la propriété antitoxique du sang des animaux vaccinés contre le venin de vipère. C. R. Soc. Biologie. 46, 10 février, pp. 111-113.
Phisalix C. et Bertrand G. 1894. Sur la propriété antitoxique du sang des animaux vaccinés contre le venin de vipère. C. R. Acad. Sciences, 118, 12 février, pp.356-358.
Phisalix-Picot M. 1900. Recherches embryologiques, histologiques et physiologiques sur les glandes à venin de la Salamandre terrestre.Thèse de médecine. 140 p. 7 planches.
Phisalix M. 1922. Animaux venimeux et venins. La fonction venimeuse chez tous les animaux : les appareils venimeux, les venins et leurs propriétés ; les fonctions et usages des venins ; l’envenimation et son traitement. Masson Ed., 2 volumes ; 653 pages + 854 pages ; planches couleurs et noir et blanc.
Phisalix M. 1940. Vipères de France. Editions Stock. 228 pages.
Rollinat R. 1937. La vie des Reptiles de la France centrale. Libr. Delagrave. 343 p.
Professeur Claude-Roland MARCHAND
Membre correspondant, Académie des Sciences, Belles Lettres et Arts de Besançon
26 septembre 2011.
Ajout du 12 décembre 2016
Un lecteur, M. Christian Agnus nous communique la photo d'une chapelle qu'il a découverte dans le cimetière des Chaprais à Besançon. Dans cette chapelle, une épitaphe : "cette chapelle, hommage de pieuse reconnaissance est érigée par les soins du Docteur Phisalix et de Mlle Anna Maire 1895".

Clichés © Christian Agnus
Mais qui est cette mystérieuse personne Anna Maire qui a contribué aux côtés du Dr Phisalix à l'érection de cette chapelle ?
Claude Roland Marchand a contacté Christophe Cupillard, le conservateur du petit musée PHISALIX de Mouthier-Hautepierre qui lui a appris que Anna Maire, artiste, sculptrice (1828-1906) était la marraine de Césaire Phisalix (1852-1906). En fait "Anna Maire" est un pseudonyme et que son nom véritable était Anne Ferret.
Christian Agnus nous a adressé des photographies des deux personnages prises en 1893 par Henri d'Orival de Besançon au château de Lavigny appartenant à la famille Mareschal de Longeville.
Un grand merci à tous ces informateurs.


11:45 Publié dans Actualité des Sciences, Herpétologie, Médecine | Lien permanent | Commentaires (3) | ![]() Facebook | | |
Facebook | | |
18/01/2013
Le ver, la mouche et la souris : trois animaux d'intérêt pour la biologie du développement
Le ver, la mouche et la souris : trois animaux d'intérêt pour la biologie du développement
par
Claude-Roland Marchand
(professeur honoraire de l'Université de Franche-Comté)
La compréhension du vivant ne peut se faire qu'en observant la diversité des espèces ; leurs affinités phénotypiques et reproductrices permettant de les regrouper ; leur physiologie et leur dynamique vitale les rapprochant ou les singularisant. Au cours des siècles, l'intérêt s'est porté sur des animaux de proximité, sauvages ou domestiques, dans divers milieux, et les conclusions qu'on en tirait étaient nourries d'une logique et d'une culture très subjectives, imprégnées de croyances philosophiques ou religieuses (L'Homme faisait l'objet d'une lointaine et prudente approche, car il n'était pas considéré comme un animal !).
Le XXe siècle a vu l'essor de l'embryologie expérimentale qui s'est intéressée au développement animal, depuis la cellule-œuf jusqu'à l'animal différencié et fonctionnel, en utilisant des Invertébrés (Hydre, Planaire, Oursin...) ou des Vertébrés (Grenouille, Poulet, Souris).
Quels sont les intérêts des modèles animaux ?
Les Unicellulaires utilisés en microbiologie nous ont renseignés sur les propriétés et les fonctions de la cellule. Mais le vivant comporte également des animaux complexes, les Métazoaires, étudiés depuis longtemps et de diverses manières. Ils demandent une approche particulière qui a évolué au cours des siècles en fonction des avancées techniques. On les a observés in situ mais également et différemment en laboratoire. Pour mémoire citons les plus célèbres : les Pinsons de Darwin, le Chien de Pavlov ou les Grenouilles de Rostand qui ont modifié notre vision de l'évolution, de la physiologie ou de la tératologie.
Nous évoquerons trois des principaux animaux-modèles utilisés au XXe siècle et encore aujourd'hui : un Ver Nématode Caenorhabditis elegans, un Insecte, la mouche du vinaigre, Drosophila melanogaster et un Mammifère, la souris, Mus musculus.
Nous verrons en quoi leur étude a fait progresser nos connaissances fondamentales et nous évoquerons les applications possibles qui pourraient être envisagées dans de nombreux domaines.
Le ver Nématode CAENORHABDITIS elegans
Les « pères » de ce modèle, utilisé depuis les années 60, Sydney Brenner, John Sulston et Bob Horvitz ont reçu le prix Nobel en 2002.
C'est un Nématode (Ascarides) de 1 mm de longueur. 20 jours de vie, une génération tous les 4 jours. Ce sont habituellement des hermaphrodites autoféconds qui contiennent 959 cellules et 1 fois sur 1000 des mâles formés de 1031 cellules. Les mâles peuvent s'accoupler avec les hermaphrodites, ce qui permet d'obtenir des lignées pures. Le séquençage de son génome, réalisé en 1998 (premier animal à être totalement séquencé) montre qu'il contient 19 099 gènes dont environ 200 peuvent être rendus létaux par mutation.
Le Nématode Caenorhabditis elegans
550 millions d'années séparent l'apparition de ce Ver et celle des Mammifères et pourtant il existe de nombreuses similitudes fonctionnelles au niveau neuronal ou au cours du vieillissement. Ces propriétés accentuent l'intérêt de l'étude de cet animal qui se nourrit d'Escherichia coli, est transparent, facile à observer sous le microscope et aisé à manipuler : ablation de cellules par laser, injection de marqueurs, de séquences d'ADN ou d'ARN antisens pour clarifier la fonction de tel ou tel gène à tel moment du développement.
On a pu établir chez lui le lignage complet de toutes les cellules issues de la fécondation. Sur la carte ainsi dressée, on peut retrouver l'origine de toutes les cellules constitutives de tel ou tel organe et le moment où la lignée germinale est isolée de la lignée somatique. C'était un rêve pour les embryologistes : il s'est réalisé à la fin du siècle dernier !
Outre le criblage génique, on a noté chez Caenorhabditis qu'une cellule sur 8 mourait au cours du développement normal. C'est une mort cellulaire programmée appelée apoptose qui se réalise grâce à l'action de protéines appelées caspases. Elle est contrôlée par les gènes ced3, ced4 qui, lorsqu'ils sont mutés, provoquent un excès de survie cellulaire. L'apoptose est une étape incontournable dans les processus d'organogenèse du vivant ; on en verra un exemple, plus loin, avec le développement des doigts chez les tétrapodes. À l'inverse le gène ced9 favorise la survie des cellules.
L'établissement du plan corporel, la symétrisation et l'organogenèse sont commandés par un jeu complexe et subtil de gènes qui s'expriment dans le temps et dans l'espace en étroite synergie. On a en particulier isolé les gènes egl5 et CePhox2/ceh17 qui participent à rétablissement de l'axe antéro-postérieur du ver, et de la mise en place des cellules nerveuses.
En outre, le séquençage de son génome révèle la présence de gènes homologues de psi, park2 et insr responsables respectivement des maladies d'Alzheimer, de Parkinson et du diabète de type 2 chez l'Homme.
À titre expérimental, 3 millions de Caenorhabditis ont été placés dans une navette spatiale Columbia en 2003 afin d'observer le déroulement des différentes étapes du développement en apesanteur. Après l'accident de cette navette, on a retrouvé des vers vivants parmi les débris, dans leurs boîtes d'élevage, révélant de manière inattendue la relative résistance de ces vers.
Deuxième animal-modèle : La mouche des fruits, DROSOPHILA melanogaster
Tout a commencé, pour cette Mouche aux yeux rouges, avec le naturaliste américain Thomas Morgan (1866-1945), prix Nobel 1933, qui a voulu vérifier avec elle, les lois de Mendel redécouvertes au début du XXe siècle. Elle est très fertile, facile à élever, facile à observer et présente souvent des mutations. Son génome comporte 13 000 gènes dont plus de 75% sont homologues aux gènes humains.

La Mouche des fruits : Drosophila melanogaster
Dès 1927 C. Bridges observe des Drosophiles mutantes présentant quatre paires de pattes, ou deux paires d'ailes. En 1954, E. Lewis observera d'autres mutations. Ces deux chercheurs leur donnent des noms évocateurs : bithoraxoïd, bithorax, postbithorax, ultrabithorax. Et lorsque des antennes sont transformées en pattes Lewis parle d'Antennapedia. Dès lors la notion d'homéose est proposée : elle désigne, selon Bateson, en 1894, la transformation d'un organe en un autre. Lewis et ses collaborateurs parleront désormais de gènes homéotiques, ou homéogènes à l'origine de ces transformations spectaculaires.
Lewis localisera ces homéogènes sur le chromosome 3 de la Drosophile. Chaque homéogène comporte une séquence de 180 paires de bases, l'homéobox, qu'on retrouve également chez le Xénope, la Souris et chez l'Homme.
De 1983 à 1990, E. Lewis et ses collaborateurs, Christiane Nüsslein-Volhard et Eric Wieschaus, affineront leurs découvertes. Ce qui leur valut le Prix Nobel en 1995. Cette découverte montre que des gènes majeurs, conservés au cours de révolution, contrôlent le schéma corporel de base de chaque zootype ; c'est un paradigme qui s'avère valable pour le règne végétal.
Quelques images nous permettent de suivre les différentes étapes du développement de la Drosophile et de localiser les gènes architectes qui contrôlent l'organogenèse, dans l'espace et dans le temps.
1 = Les polarités dorso-ventrale et antéro-postérieure
sont esquissées dans les ovarioles de la femelle et confirmées après la fécondation. Un grand nombre de gènes (dont nous ne donnerons pas la longue liste) participent à rétablissement de l'identité des territoires, comme par exemple dorsal, nanos, toll, torpedo, cactus… dont l'activité produit une combinaison de facteurs de transcription morphogénétiques. Sur ces schémas, on peut noter la répartition, selon un gradient, des produits des gènes bicoid, torso et nanos. Leur mutation conduit à des larves transformées : sans abdomen, sans tête, sans telson... Grâce aux anomalies, on peut localiser le moment et la région où s'expriment les gènes d'intérêts.
2 = L'identité segmentaire se réalise progressivement, en s'affinant peu à peu, pour aboutir à une zonation conforme au plan de l'Insecte : tête, thorax, abdomen. On ne peut manquer d'être surpris par ce qui peut paraître comme une certaine logique dans le déroulement de ces étapes : du simple au complexe et de l'avant vers l'arrière.
Trois groupes de gènes, les gènes gap[1], pair-rule[2], de polarité segmentaire interagissent et construisent le plan corporel segmentaire.
La mise en évidence de leurs interrelations et de leurs domaines d'expression, parfois chevauchants, est le résultat d'un travail minutieux de biologie moléculaire, intéressant pour la Drosophile, mais aussi au plan fondamental.
3 = Les homéogènes : Attardons-nous un peu sur ce que l'étude approfondie des mutations de la Drosophile a apporté à la connaissance des gènes architectes.
Les plus spectaculaires sont des mouches porteuses de 4 ailes (mutation appelée Ultrabithorax) et des mouches dont les antennes sont transformées en pattes (mutation appelée Antennapedia).
Le mérite de Lewis a été de localiser, en 1978, les gènes responsables de ces mutations. Ils se trouvent tous sur le chromosome 3. En 1983 il parvient avec son équipe à isoler et séquencer ces gènes qu'il range désormais dans le groupe des gènes homéotiques. Car, nous le répétons, leur expression ectopique construit un organe conforme, mais qui n'est pas à sa place : des ailes à la place des balanciers ou une patte à la place de l'antenne.
Voici le schéma qu'il propose, sur le même chromosome 3 (colinéarité), de l'avant à l'arrière 8 homéogènes regroupés en deux ensembles :
5 dans l'ensemble ANT : lab, pb, Dfd, Scr, Antp.
3 dans l'ensemble BX : Ubx, abd-A, Abd-B.
Les abréviations correspondent à la caractéristique d'une mutation du gène concerné.
(Abréviations : lab = labial ; pb = proboscipedia ; Dfd = deformed ; Scr = sex comb reduced ; Antp = antennapedia ; Ubx = ultrabithorax ; Abd A = abdominal A ; Abd B = abdominal B).
Si on délimite sur le plan du corps de l'animal les domaines d'expression des principaux gènes identifiés, on s'aperçoit que l'identité segmentaire est souvent, sauf pour l'extrémité antérieure, le résultat d'une action conjuguée de plusieurs produits géniques. Cette synergie notée chez la Drosophile existe également chez les autres métazoaires, y compris les Mammifères comme on le verra plus loin.
Voyons maintenant les mutations concernant les yeux de la Drosophile.
En 1915, M. Hoge observait déjà des mouches sans yeux ou avec des yeux réduits. Cette anomalie provenait d'un gène défaillant appelé Eyeless isolé en 1993, deux ans après qu'un homologue appelé Small Eye / Aniridia eût été identifié chez la Souris. Bien que l'œil simple de Mammifères ait peu de ressemblances morphologiques avec l'œil composé d'un Insecte, il semblerait que sa construction utilise des procédés similaires, avec probablement la mise en jeu de plus de 2000 gènes ! C'est en 1995 que W. J. Gehring et son équipe parviennent à activer Eyeless et à obtenir une mouche avec des yeux sur les pattes et sur les antennes.
Finalement ces différents gènes ont été placés dans le groupe PAX6, en raison de leur structure. Nous n'omettrons pas de mentionner la réussite d'une expérience inattendue : si on introduit le gène PAX6 de la Souris dans une larve de Drosophile on induit la formation d'un œil supplémentaire de type Insecte. Ce qui signifie que le code du gène architecte de la Souris est « compris » par la Mouche et est ensuite « traduit » en organe de mouche. Voici donc levé un tabou qui posait problème à Darwin : il n'osait pas imaginer la construction de l'œil à partir d'un même prototype soumis ensuite à la sélection naturelle. La biologie moléculaire démontre donc l'existence de mécanismes identiques, malgré la distance phylogénétique ; ceci est d'autant plus vrai que l'équipe de Gehring a trouvé des homologues de Eyeless et de Small eye chez un Ver Némerte, une Planaire et le Calmar !
Après ce survol des résultats obtenus en biologie moléculaire expérimentale, nous pressentons qu'au-delà du Ver ou de la Mouche nous allons vers une universalité de certains processus, de certains signaux qui s'accompagnent d'une conservation de leurs patrons d'expression et des mécanismes qui les initient et les régulent.
Voyons avec le troisième animal de laboratoire si nos concepts seront confirmés ou infirmés.
La souris : MUS musculus
Voici le Mammifère le plus facile à élever, véritable « cobaye » de la recherche mondiale : de petite taille, un cycle toutes les six semaines, une gestation courte de 21 jours, 6 à 12 petits par portée. La sélection a permis d'obtenir d'elle des lignées pures qui permettent de réaliser de manière reproductible, des manipulations génétiques comme des transferts, des suppressions, des amplifications de gènes ou une modélisation de maladies humaines. La transgénèse est effectuée sur des œufs prélevés juste après la fécondation. L'ADN injecté peut être inséré dans tous les noyaux et sera exprimé dans la descendance.

La Souris : Mus musculus
La biologie moléculaire a séquencé la totalité des 40 chromosomes de la Souris en 2003 ; il en ressort que 98 % de ses gènes sont homologues à ceux de l'Homme, ce qui constitue un matériel propice à l'étude des maladies génétiques, de certains cancers, mais aussi de la régulation des étapes-clés de l'embryogénèse. Parmi les découvertes spectaculaires dues à cette technique mentionnons le repérage, le séquençage et la localisation de 41 homéogènes répartis sur 4 chromosomes et présentant de nombreuses homologies avec les 8 homéogènes de la Drosophile.
Sur le schéma suivant on peut voir leur position et quelques-uns de leurs domaines d'expression. Ces homéogènes sont désignés par les termes Hox a, Hox b, Hox c, Hox d, suivis d'un numéro qui fait référence à leurs positions respectives sur les chromosomes 6, 11, 15, 4.
Hox a1, Hox b1 et Hox d1 sont des homologues de lab de la Drosophile.
Hox a9, Hox b9, Hox c9 et Hox d9 sont homologues de abd B.
Ils commandent, en synergie, en interactivité, l'identité de certaines portions de l'embryon comme le montre le schéma simplifié d'un jeune fœtus.
Hox a13, Hox b13, Hox c13, Hox d13 sont des gènes paralogues. Ils peuvent agir de manière coordonnée, ou isolément, laissant supposer une certaine redondance, sorte de mémoire-secours.
Au plan évolutif on pense que ces gènes proviennent de plusieurs duplications à partir d'un gène ancestral dont ils ont conservé des séquences pendant des millions d'années.
Mêmes figurés que ceux utilisés dans le schéma de la Drosophile présenté plus haut permettant d'établir les homologies. (N.B. : La transcription se fait toujours de 3' vers 5').
On pourrait présenter la même répartition des homéogènes localisés sur 4 des 46 chromosomes humains :
11 sur le chromosome 7 = HOX A
10 sur le chromosome 17 = HOX B
9 sur le chromosome 12 = HOX C
11 sur le chromosome 2 = HOX D
Ces gènes sont activés à un moment précis du développement embryonnaire par des signaux complexes et multiples ; comme chez la Drosophile les plus antérieurs s'expriment les premiers et s'appliquent à une zone antérieure ; les suivants leur succèdent, chevauchant ou non. Et cette combinatoire a pour résultat un segment, une zone, une ébauche qui se différenciera progressivement par la suite. On notera que les frontières antérieures d'expression sont toujours très nettes et qu'elles s'estompent vers l'arrière (sur la figure projetée on a l'exemple de Hox b1, Hox b4, Hox b5). Logiquement la redondance n'est pas exclue.
Exemple de l'implication des homéogènes dans la morphogénèse du membre : À partir de quatre bourgeons s'édifient les membres de la Souris dont les orientations antéro-postérieure, dorso-ventrale et proximo-distale s'établissent grâce à l'action combinée de plusieurs gènes, qui imposent également la mise en place des ébauches osseuses. La formation des espaces interdigitaux est réalisée grâce à la mort cellulaire programmée (apoptose) qui s'exerce sur des territoires précis de la palette distale.
Examinant les domaines d'expression de Hox d1 à Hox d13 à la fois sur le corps entier du fœtus et sur les bourgeons des pattes, on confirme la hiérarchie de la répartition des gènes et une certaine synergie entre eux. (L'extrémité du membre résulte d'une addition des produits d'au moins cinq gènes).
La mise en évidence de cette combinatoire a constitué un grand pas pour la biologie du développement ; elle a permis d'expliquer l'origine de plusieurs anomalies (amélie, phocomélie... adactylie, acheirie...) et de prendre des mesures de prévention.
Ces avancées moléculaires ouvrent des perspectives intéressantes, dans la mesure où ce qui est possible chez la Souris pourrait bien être, à terme et avec toutes les précautions qui s'imposent, tenté chez l'Homme.
Citons quelques exemples de modifications obtenues chez la Souris par transgénèse : inhiber l'expression d'un gène à la base d'un bourgeon de membre, ajouter des vertèbres cervicales, transformer une vertèbre lombaire en vertèbre thoracique, ajouter une paire de côtes... Dernières images de cette capacité à modifier le vivant : si on empêche l'expression de PAX 6 chez la souris : pas d'œil ou œil atypique.
Si on place Hox d9 dans la mouche : l'antenne est transformée en patte (d'insecte).
*
* * *
Ces résultats illustrent les possibilités de la biologie moléculaire et peuvent éveiller de réels espoirs pour la thérapie génique régulièrement évoquée lorsque des résultats prometteurs sont obtenus sur des souris transgéniques exprimant des maladies humaines comme certains cancers, la maladie d'Alzheimer, de Parkinson, le diabète ou les myopathies.
*
* * *
La lignée de souris Tg2576 constitue un modèle de référence pour la maladie d'Alzheimer, alors que les souris NOD (Non Obèse Diabetic) ou knock out Glut4 le sont pour le diabète.
Nous n'avons pas pu aborder les innombrables recherches effectuées sur les cellules-souches et sur le clonage dont les retombées ouvrent des perspectives prometteuses pour la santé humaine. Cela mériterait un exposé particulier, long et détaillé.
Et si l'on prolonge l'exploration moléculaire chez d'autres Vertébrés on peut comparer chez le Poulet et chez la Couleuvre les domaines d'expression d'Hox c6 (homéogène de Souris !).
Les frontières entre espèces semblent s'estomper et ceci nous amène à conclure.
CONCLUSIONS
Sans l'étude de ces trois animaux, nous n'aurions pas pu accéder à plusieurs processus cellulaires fondamentaux comme l'apoptose ; nous n'aurions pas pu connaître la combinatoire génique qui commande la morphogénèse embryonnaire.
Nous disposons donc de nouveaux concepts applicables à la recherche fondamentale et à la recherche appliquée, compte tenu de l'universalité du fonctionnement cellulaire, et des similitudes des processus de l'organogenèse.
Les homologies structurales et fonctionnelles nous permettent de vérifier que l'ontogenèse rappelle la phylogenèse, et que le génome des espèces a conservé une part de l'héritage d'un ancêtre commun. Du temps de Darwin, il était inconvenant d'imaginer que l'Homme descende du Singe... Qu'en serait-il aujourd'hui si on évoquait une lointaine filiation Homme/Insecte ?
L'étude d'animaux « modèles » nous paraît indispensable à la connaissance du fonctionnement cellulaire et organique, à la mise au point de thérapies innovantes et efficaces, sans oublier le positionnement de chaque espèce dans la chaîne évolutive.
Professeur Claude-Roland MARCHAND
(Communication présentée à l'Académie des Sciences et Belles Lettres de Besançon Franche-Comté le 6 avril 2009 )
09:40 Publié dans Biologie, Médecine | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
17/01/2013
Cancer de la prostate : moins de chirurgie, plus de soins adaptés
par Marie-Christine Colinon le 16 janvier 2013
Que de progrès pour le cancer de la prostate ! Nouveaux médicaments, nouvelles techniques médicales : tous visent à sauvegarder les fonctions urinaires et érectiles avec de réels succès.
Il y a quinze ans, 75% des cancers de la prostate étaient déjà métastasés au moment de leur découverte. Aujourd'hui, huit sur dix sont repérés à un stade précoce. "Quand la maladie est diagnostiquée avant d'avoir franchi la capsule entourant la prostate, ôter celle-ci guérit définitivement", affirme le Dr Xavier Rébillard, de l'Association française d'urologie.
Toutefois, si les séquelles urinaires de l'opération sont devenues rares, récupérer l'érection n'est pas toujours facile. La chirurgie robotisée, utilisée dans un quart des opérations, limite ce risque par un geste chirurgical plus précis. C'est aussi le cas de nouvelles thérapies alternatives à la chirurgie.
• Cinq techniques efficaces et plus douces
Le choix du traitement varie selon le type de tumeur, sa taille, sa localisation, l'âge ou encore les antécédents du malade. Ces techniques sont proposées en priorité aux hommes de plus de 70 ans, en cas de contre-indications à la chirurgie ou de récidive après radiothérapie.
● La radiothérapie externe
En une trentaine de séances, elle offre des résultats équivalant à la chirurgie, en minorant les conséquences sur la sexualité. Un homme sur deux évitera les séquelles, mais parfois au prix de troubles intestinaux (diarrhée, inflammation du rectum...).
● La curiethérapie
Elle mise sur des petits grains radioactifs placés dans la prostate et qui détruisent la tumeur de l'intérieur. Pas de risques d'incontinence, peu de troubles de l'érection (15% des patients), mais un point faible: en cas de récidive, l'opération n'est plus possible.
● Les ultrasons focalisés de haute intensité
Plus récents, ils sont pratiqués à titre d'essai clinique dans une quarantaine de centres. Connue aussi sous le nom d'Ablatherm, la méthode repose sur l'introduction, par l'anus, d'une sonde qui brûle la tumeur. "L'objectif est de cibler l'intervention pour ne détruire que le lobe malade et conserver une bandelette érectile intacte", explique le Dr Hubert Bugel, du CHU de Rouen.
● La photothérapie dynamique
Actuellement en évaluation dans 13 centres en France (45 en Europe), elle détruit la zone malade en combinant des fibres laser et un produit photosensibilisant. Le Pr Abdel-Rahmene Azzouzi, du CHU d'Angers, leader international dans la technique, est enthousiaste: "À court terme, les résultats sont encourageants, avec très peu de séquelles urinaires et érectiles."
● La cryothérapie
Cette méthode détruit la tumeur en la "réfrigérant". Jusqu'ici, l'approche est surtout développée aux États-Unis. En France, seuls deux centres la pratiquent, les autorités estiment manquer de recul pour l'instant.
• Une stratégie de surveillance
Cet éventail de techniques permet de mieux répondre à chaque situation. Et, lorsque la tumeur semble à bas risque, les urologues proposent de ne pas intervenir. "La stratégie de surveillance implique des dosages sanguins et des biopsies rapprochées, au moins au début, pour vérifier l'absence d'évolution du cancer", précise le Dr Rébillard. La découverte de nouveaux marqueurs devrait encore alléger ce suivi. "Certains patients hésitent à accepter cette surveillance qui évite pourtant des traitements inutiles et bien des souffrances", encourage le Dr Michel Lenois, auteur de Mieux connaître le cancer de la prostate (éd. Grancher, 2011).
• Un espoir de vaccin [1]
[1] Voir également l'article de Elsa Abdoun " Vaccin contre le Cancer " dans Science & Vie, n° 1170, mars 2015, pp. 62-76.
Du côté des médicaments aussi, il y a du nouveau. Quand le cancer s'est disséminé dans l'organisme, une hormonothérapie est prescrite pour stopper sa progression. Une molécule ciblée, l'abiratérone, qui limite les effets secondaires, est disponible depuis fin 2011.
Pour les tumeurs résistantes, une nouvelle chimiothérapie (cabazitaxel), moins toxique, augmente la survie des patients.
Enfin, on parle beaucoup d'immunothérapie, qui stimule les défenses de l'organisme. "Un premier vaccin, le Sipuleucel-T, est proposé aux États-Unis depuis 2010", explique le Pr Azzouzi, responsable du Cancéropôle Grand-Ouest. "Il s'agit de prélever et modifier des cellules du malade, qui lui sont re-perfusées ensuite. Les résultats semblent supérieurs à ceux de la chimiothérapie, avec moins d'effets secondaires."
• Un dépistage au cas par cas
Le plus souvent, la maladie avance à pas de tortue: il faut plus de dix ans à la tumeur pour "sortir" de la prostate et devenir menaçante. Exceptionnellement, elle peut se mettre à "galoper", voilà pourquoi, par prudence, les chirurgiens ont longtemps privilégié la chirurgie.Aujourd’hui, ils évaluent mieux la sévérité d’une tumeur et la majorité évite des traitements lourds injustifiés :
sur 70 000 cancers diagnostiqués en 2010, "seules" 22 000 prostates ont été enlevées, les autres bénéficiant d’une surveillance rapprochée.
L’Association française d’urologie recommande un premier dépistage à 55 ans, puis tous les trois ans si les résultats sont bons.
La Haute Autorité de Santé a réaffirmé en avril 2012 son opposition au dosage systématique du PSA (antigène prostatique spécifique), qui, selon elle, n’a pas fait la preuve de ses bénéfices, même chez les hommes à risque. En pratique, la décision se prend au cas par cas, en discutant de sa situation personnelle avec son médecin.
Source :
Magazine Notre temps.com
11:17 Publié dans Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
29/09/2012
Naissance de la fondation “Maison Pasteur”
 Naissance de la fondation “Maison Pasteur”
Naissance de la fondation “Maison Pasteur”
Le 14 septembre à Arbois, les vendanges exceptionnelles au Clos de Rosières, vigne historique de Louis Pasteur ont été l’occasion d’annoncer la naissance de la fondation “Maison Pasteur” en présence de nombreuses personnalités de la communauté scientifique dont Jean-François Bach et Catherine Brechignac, secrétaires perpétuels de l’Académie des Sciences, Jean-Robert Pitte, éminent géographe, membre de l’Académie des Sciences morales et politiques et Président de la mission française du patrimoine et des cultures alimentaires, Jean Saleçon, ancien Président de l’Académie des Sciences ou encore Gérard Orth, membre de l’Académie des Sciences et de l’Institut Pasteur, virologue. Missions de la Fondation “Maison Pasteur” et opérations “Terre de Pasteur”
La Fondation “Maison Louis Pasteur” aura pour mission, en collaboration avec la Bibliothèque Nationale de France, d’inscrire les archives scientifiques de Pasteur à l’Unesco dans le programme “Mémoire du Monde” et de créer un Mémorial Louis-Pasteur, lieu dédié à l’enseignement de la science aux enfants. Le premier conseil d’administration de la fondation s’est tenu sur le domaine Henri Maire à Arbois. Il est composé de six membres de l’Académie des sciences – dont les deux Secrétaires perpétuels, un ancien Président et trois scientifiques de l’Institut Pasteur – et des représentants des collectivités territoriales du Jura (dont Arbois et Dole).
Enfin, en décembre 2012, le “mois Pasteur” permettra de célébrer le grand savant, élu à l’Académie des sciences le 8 décembre 1862. Au début des années 1860, Pasteur avait étendu ses recherches du domaine de la physique et de la chimie à celui de la biologie, multipliant les découvertes sur les germes, la pasteurisation, la vaccination… Le 27 décembre, jour du 190e anniversaire de la naissance de Pasteur, un hommage tout particulier lui sera rendu, à Arbois comme à Dole. À cette occasion, la Fondation “Maison de Louis Pasteur” et ses partenaires lèveront le voile sur le programme des opérations “Terre de Pasteur” en 2013. Arbois et Dole, unies dans le projet Pasteur.
À Arbois, il est question du rachat de la maison Vercel faisant face à la maison Pasteur (qui doit maintenant être rénovée) afin d’étendre le musée Pasteur et de créer un nouveau pôle d’exposition et d’événements culturels. Cette nouvelle dimension touristique est aussi accompagnée d’un axe scientifique (biologie végétale, étude des cépages…) et pédagogique.
À Dole, l’avenir des Ateliers Pasteur semble prometteur avec une nouvelle dynamique autour de la formation des enseignants et de la culture scientifique. Comme l’a indiqué Jean-François Bach, “l’histoire des sciences est capitale pour capter l’attention des enfants et Pasteur en est son digne représentant”. Il s’agit là d’un projet d’ampleur locale, nationale et même internationale. Les Dolois et les Arboisiens sont unis dans ce projet.
A.S. GIRARD Pays Dolois, n° 142, octobre 2012

10:22 Publié dans Actualité des Sciences, Botanique, Médecine | Tags : louis pasteur, maison pasteur | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
28/07/2012
Des cellules souches dans la rétine
 Des cellules souches dans la rétine
Des cellules souches dans la rétine
(Dernière mise à jour : 2/11/2014)
Dans ce même blog, nous avons évoqué l'emploi de cellules souches embryonnaires pour régénérer la rétine. Ces cellules embryonnaires sont pluripotentes car elles sont à l'origine de toutes les cellules de l'organisme (voir dans ce même blog les articles : Cellules souches et rajeunissement et Élaboration d'une rétine à partir de cellules souches embryonnaires).
Une autre technique est utilisée dans le même but de régénération de la rétine par une autre équipe américaine : des cellules souches découvertes dans la rétine d'individus adultes décédés ouvrent une nouvelle piste de traitement de l’une des premières causes de cécité, la dégénérescence maculaire liée à l’âge, ou DMLA.
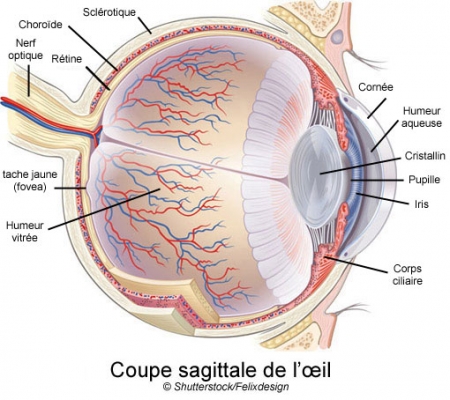
La dégénérescence maculaire liée à l'âge (DMLA) détruit les cellules de l'épithélium pigmentaire de la rétine. Cette couche de cellules qui tapisse le fond de la rétine assure le bon fonctionnement des cellules photoréceptrices de l'œil. Une maladie qui n'est pas négligeable et qui s'aggrave avec l'âge des patients. D'après le journal d'ophtalmologie, 2007, le taux de DMLA dans le monde, s'établit selon l'âge : de 55 à 64 ans à 12,2%, 65 à 74 ans à 18,3%, plus de 74 ans à 29,7% (600 000 patients en France).
Les travaux de l’équipe de Sally Temple, de l’Institut des cellules souches neuronales de Rensselaer, aux États-Unis ouvrent un espoir de remédier à la DMLA. En cultivant sous diverses conditions de telles cellules prélevées sur des donneurs décédés, les biologistes ont mis en évidence, parmi elles, l’existence d’une sous-population de cellules souches multipotentes, c’est-à-dire capables de se différencier en plusieurs types cellulaires – dont les cellules de l’épithélium pigmentaire de la rétine.

La DMLA (dégénérescence maculaire liée à l'âge) entraîne l'apparition d'une ou plusieurs taches noires qui occultent la vision centrale
Cet épithélium est une couche de cellules qui tapisse le fond de la rétine et assure le bon fonctionnement des cellules photoréceptrices de l’œil, les bâtonnets et les cônes. La DMLA, principale cause de malvoyance et de cécité dans les pays industrialisés – elle y touche sept pour cent des personnes de plus de 75 ans –, est due à la disparition progressive de ces cellules. Il n’existe encore aucun traitement pour la forme la plus fréquente, dite DMLA « sèche » ou atrophique.
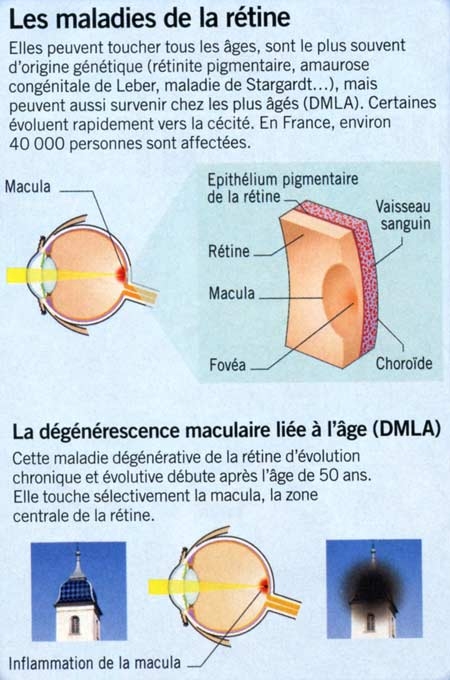
Infographie : Betty Lafon pour Sciences et Avenir
Une piste explorée par plusieurs équipes consiste à greffer dans la rétine des cellules de l’épithélium pigmentaire de la rétine produites en laboratoire à partir de cellules souches embryonnaires (cellules ES) ou de cellules induites à la pluripotence (cellules iPS), c’est-à-dire capables de se différencier en cellules de n'importe lequel des trois feuillets embryonnaires (lors de l’embryogenèse, ces feuillets produisent les organes du futur individu).
La DMLA (dégénérescence maculaire liée à l'âge) se caractérise par une atteinte de la zone centrale de la rétine, la macula (le cercle jaune vu en rétino-angiographie)
© KOKEL/BSIP
En découvrant des cellules souches dans l’épithélium pigmentaire de la rétine humaine adulte, les biologistes américains ouvrent la voie à une nouvelle piste : en culture, sous certaines conditions, ces cellules souches multipotentes se différencient en cellules de l’épithélium pigmentaire. Existerait-il des conditions similaires qui activeraient leur différenciation dans la rétine des personnes atteintes de la maladie, et ainsi la régénération in situ de l’épithélium défectueux ? Certains animaux à sang froid, comme les amphibiens, ont déjà cette capacité de régénérer leur épithélium pigmentaire et d’autres tissus oculaires lorsque ceux-ci sont abîmés. Prochaine étape : décortiquer le mécanisme qui active la différenciation de ces nouvelles cellules souches – une donnée indispensable pour mettre au point les conditions favorables à la régénération de l’épithélium in situ.
« C’est la première fois que l’on met en évidence des cellules souches dans ce tissu chez l’adulte, commente Olivier Goureau, de l’Institut de la vision, à Paris. Cette piste de réparation endogène semble prometteuse. » Celle de la greffe de cellules de l’épithélium pigmentaire dérivées de cellules pluripotentes n’est pas abandonnée pour autant. Son équipe, qui travaille sur la production de différentes cellules rétiniennes à partir de cellules souches pluripotentes humaines, s’apprête, en collaboration avec le laboratoire ISTEM du génopole d’Evry, à effectuer chez la souris des tests de greffe d’un tel épithélium.
Pour en savoir plus
E. Salero et al., Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives, Cell Stem Cell, vol. 10, pp. 88-95, 2012.
C. Delcourt, Les troubles de la vision liés à l'âge, Pour la Science, n° 292, pp. 38-45, 2002.
Les cellules souches embryonnaires humaines tiennent leurs promesses (ajout de janvier 2013)
Des patients ont reçu une greffe de cellules souches embryonnaires humaines. Une première mondiale qui offre un espoir de traitement pour cette maladie incurable.
De gauche à droite, tomographie par cohérence optique de la rétine d'une macula normale, d'une rétine atteinte de DMLA et enfin d'un œdème maculaire, une complication rencontrée souvent chez les diabétiques
(CMCR MAISON ROUGE STRASBOURG)
Pour la première fois, une équipe du prestigieux Jules Stein Eye Institute de Los Angeles (États-Unis) a réalisé avec succès, en mars 2012, une greffe de cellules souches embryonnaires humaines (CSEh) chez deux patientes atteintes de dégénérescence maculaire liée à l'âge (DMLA). L'une des patientes souffrait de la forme dite sèche. L'autre d'une affection proche appelée maladie de Stargardt. Ces CSEh, prélevées sur l'embryon aux premiers stades de développement, ont la particularité de se répliquer indéfiniment avant de se différencier pour former plus de 200 types de tissus humains. 50 000 d'entre elles ont été injectées sous la rétine de patientes très malvoyantes pour reconstituer de la rétine. Six mois après, l'une pouvait à nouveau se déplacer seule, l'autre était capable d'utiliser partiellement un ordinateur. Un succès. Mais ces résultats doivent, bien sûr, être confirmés sur la durée. C'est pourquoi l'étude va se poursuivre pendant encore deux ans et inclure vingt-quatre autres patients.
Les greffes de cellules souches embryonnaires humaines (ci-dessus, vues au microscope) sont peut-être la thérapie de l'avenir. Au dernier stade de leur développement, elles donneront un véritable tissu rétinien, aidant à restaurer la vision du patient
© UC IRVINE
S'ils sont avérés, ces résultats constitueront un immense espoir de traitement pour les deux formes de cette maladie dont les symptômes sont une déformation des lignes droites avec l'apparition progressive d'une ou plusieurs taches noires centrales, les scotomes, traduction de la perte de la vision centrale. Moins fréquente (20 % des cas), la forme dite humide est la plus grave. Elle se caractérise par la formation de néovaisseaux sous la rétine, une prolifération due à une production anormale de facteurs de croissance (VEGF : Vascular Endothelial growth factor). En revanche, il n'existe à ce jour aucun traitement pour la forme sèche sans néovascularisation (dite aussi atrophique, plus lente et plus répandue (80 %), les antiVEGF étant inopérants. L'objectif thérapeutique est dans ce cas de stabiliser la destruction progressive des cellules photoréceptrices de la rétine et de bloquer l'inflammation locale. « Plusieurs molécules sont à l'étude et des essais cliniques vont démarrer dans les mois qui viennent », prévoit le Pr Eric Souied, président de l'Association DMLA*.
Face à une affection dont le nombre de cas pourrait doubler d'ici à 2030 en raison du vieillissement de la population, les chercheurs s'intéressent aussi au dépistage. On sait ainsi de longue date que le risque de développer une DMLA est plus important en cas de tabagisme et de surpoids. Plus récemment, des travaux ont été consacrés à la prédisposition génétique et plusieurs marqueurs ont été identifiés (ARMS2, CFH...). Un test de dépistage à partir d'un simple prélèvement salivaire, Macula Risk, est même déjà fabriqué et commercialisé au Canada et sur Internet par la firme Artic DX. Toutefois, son usage reste controversé et surtout prématuré comme l'a précisé un communiqué spécial émis par l'American Academy of Ophtalmology (AAO) en novembre 2012. « À l'avenir, ces tests pourront probablement aider à mieux traiter les patients à haut risque en permettant des traitements adaptés, a ainsi précisé le Dr Edwin Stone, responsable du groupe de travail de l'AAO sur la prédisposition génétique. « Mais les preuves d'un réel bénéfice pour le patient manquent encore. » Pour l'heure, en France, ce test est depuis peu en cours d'évaluation au centre hospitalier intercommunal de Créteil (Val-de-Marne) selon un protocole rigoureux, et uniquement, auprès de patients présentant des antécédents familiaux. L'équipe de Créteil poursuit par ailleurs un projet de génétique appliquée. « Nous avons identifié des marqueurs génétiques prédictifs de sévérité, détaille le Pr Souied. D'ici à cinq ans, nous espérons pouvoir adapter notre prise en charge au profil de chacun. » Un premier pas de soin personnalisé de la DMLA.
*N° vert 0.800.880.66.
Source :
Sylvie Riou-Millot (2013) . - Bien voir - Sciences et Avenir n° 792, février 2013, pp. 46-57.
Les cellules souches induites adultes (iPS) entrent dans la danse (ajout de mars 2013)
Dans le traitement de la DMLA, les premiers essais cliniques impliquant des cellules iPS devraient démarrer au Japon en 2013 au centre hospitalier de Kobe. Cette opération, qui se pratique déjà avec les CSEh (voir plus haut et également le dossier « Vision », Sciences et Avenir n° 792, février 2013) consistera à injecter des iPS différenciées directement dans l'œil du patient afin de reconstituer les cellules abîmées.
Peut-on envisager de déployer cette technique pour des interventions nécessitant de plus importantes réparations dans des tissus nécrosés ? Dans le cas de la rétine, le nombre de cellules iPS à injecter est relativement faible. Mais s'il est possible d'envisager de greffer en surface de l'œil quelques milliers de cellules rétiniennes au millimètre carré, sera-t-il possible de réparer en profondeur un trouble cardiaque comme l'ischémie qui détruit plusieurs dizaines de milliards de cellules ? Sera t-il possible de produire autant de cellules, et à quel coût ? Autant de questions qui restent sans réponse. Pour toutes ces raisons, il semble illusoire - du moins pour l'heure - d'envisager que les iPS puissent ouvrir la voie à une médecine totalement personnalisée où l'on pourra soigner chaque patient à partir de ses propres cellules expurgées de leurs défauts.
Une greffe relance l'espoir dans la DMLA (ajout du 2 novembre 2014)
Une première mondiale : l'équipe menée par Yasuo Kurimoto, du Kobe City Médical Center Général Hospital au Japon a réalisé un implant de tissu rétinien à partir de cellules souches pluripotentes induites (iPS).
Le 12 septembre 2014, une Japonaise de 70 ans atteinte de DMLA a reçu une greffe d'un tissu rétinien conçu à partir de cellules souches pluripotentes induites (IPS). Une première mondiale.
Même s'il est trop tôt pour évaluer le résultat, la patiente a déclaré, le lendemain, que sa vue était plus "brillante". Les iPS en question étaient des cellules souches obtenues à partir de cellules adultes différenciées — ici de peau de la patiente — puis reprogrammées en cellules de rétine. L'équipe japonaise a implanté un feuillet de 1,3 sur 3 mm d'épithélium rétinien dans l'œil de la patiente.
« Cette excellente équipe a réalisé ce que nous appelons "une preuve de concept" », commente Marc Peschanski, directeur scientifique d'I-Stem au génopôle d'Évry (Essonne). Nous attendons les résultats dans les deux ans. » Un éventuel succès pourrait cependant être difficile à étendre au plus grand nombre. « Le procédé n'étant pas du tout industrialisé, nous allons nous retrouver devant un problème éthique : nous aurons le traitement mais pas les moyens de l'appliquer. »
Source : Article de Sciences et Avenir, n° 813, novembre 2014 p. 28.
Une piste autre que les cellules souches : Un collyre anti-cholestérol pour ralentir la DMLA
Une possibilité de ralentir la maladie vient d'être explorée par une équipe de chercheurs américains dirigée par Rajendra Apte, du département d'ophtalmologie de l'École de médecine de l'université Washington à Saint-Louis (Missouri).
Principale cause de malvoyance chez les personnes âgées, la DMLA pourrait être prévenue par des gouttes oculaires évacuant le cholestérol de l'œil. Un essai prometteur chez le rat.
Les injections dans l'œil utilisées pour traiter localement la DMLA pourraient céder la place à un simple collyre. C'est en effet la piste ouverte par des chercheurs américains qui publient une étude dans Cell Metabolism. Selon ce travail, il serait possible de ralentir la prolifération anormale des vaisseaux qui caractérise cette affection en régulant le métabolisme du cholestérol à l'intérieur de l'œil. L'approche qui n'a encore été testée que chez la souris — consisterait à cibler avec un collyre les cellules chargées d'évacuer le cholestérol. Celui-ci retournerait ainsi dans la circulation sanguine et ne s'accumulerait plus dans l'œil, empêchant la maladie de progresser. Cette idée inédite vient compléter l'arsenal des techniques en développement pour préserver ou restaurer la vision (lire Sciences et Avenir, n° 793, février 2013).
Rappelons que le cholestérol est un lipide impliqué dans de nombreux processus biochimiques. Mais quel rapport peut-il exister entre le cholestérol et le développement de vaisseaux sanguins de la rétine ? Il n'y a pas de lien entre DMLA et taux sanguin de cholestérol. La clef s'appelle en fait macrophages. Cette catégorie de cellules immunitaires joue en effet un rôle primordial dans l'élimination du cholestérol de l'œil. Or, les macrophages deviennent moins performants avec l'âge. Il en résulte des dépôts lipidiques qui entretiennent un foyer inflammatoire. Celui-ci favorise le développement de vaisseaux anormaux sous la rétine, responsables d'altérations sévères de la vision centrale. Pour l'heure, on ignore les mécanismes précis qui conduisent ces « vieux » macrophages à induire cette prolifération vasculaire. En revanche, de récents travaux ont montré qu'ils comptaient moins d'ABCAl, une protéine « transporteuse » permettant d'évacuer le cholestérol. Pour preuve, de « jeunes » macrophages dépourvus de ce même transporteur se comportent effectivement comme de « vieux » macrophages, favorisant une vascularisation anormale. D'où l'idée des chercheurs de « booster » l'expression d'ABCAl dans ces cellules afin qu'elles puissent se débarrasser de leur cholestérol et trouver la capacité à réguler la croissance vasculaire.
Pour ce faire, l'équipe de Rajendra Apte, du département d'ophtalmologie de l'École de médecine de l'université Washington à Saint-Louis (Missouri), a utilisé des gouttes ophtalmiques contenant un agoniste du LXR (Liver X Receptor). Cet agent stimule l'action d'un récepteur initialement découvert dans le foie et impliqué dans le métabolisme des lipides. Des études préalables ont en effet montré qu'il augmente la production du transporteur ABCA1 par les macrophages. Et les résultats des essais ont été encourageants : ainsi « dopées », les « vieilles » cellules se sont remises à fabriquer cet indispensable transporteur dans les mêmes proportions que les « jeunes ».
Restait à évaluer cette stratégie sur des souris chez lesquelles on a induit, sous l'effet d'un laser, une croissance anormale des vaisseaux sous-rétiniens, reproduisant ainsi ce que l'on observe chez les patients souffrant de DMLA. Là encore, les résultats ont été positifs. Administré en collyre, l'agoniste du LXR a permis de réduire significativement la prolifération vasculaire chez les souris traitées, les macrophages défaillants parvenant à nouveau à évacuer efficacement le cholestérol.
Il pourrait s'agir d'un progrès thérapeutique majeur
II faut désormais poursuivre ces recherches pour confirmer ces bons résultats, et surtout les appliquer à l'homme, ce qui prendra encore de longues années. S'ils se révélaient concluants, il s'agirait d'un progrès thérapeutique majeur dans la mesure où la fréquence de la DMLA augmente avec l'âge, représentant la principale cause de malvoyance chez les personnes de plus de 50 ans. Selon les chercheurs, « intervenir avant que la maladie ne soit à un stade avance avec des agents efficaces capables de stimuler la sortie du cholestérol de l'œil pourrait empêcher la progression de la maladie. Cette stratégie pourrait être déployée préventivement ».
Source : Marc Gozian Sciences et Avenir, n° 795, mai 2013, pp. 78-79.
12:29 Publié dans Biologie, Médecine | Tags : cellules souches, cellules souches embryonnaires, médecine régénératrice, rétine, thérapie | Lien permanent | Commentaires (3) | ![]() Facebook | | |
Facebook | | |
Élaboration d'une rétine en culture à partir de cellules souches embryonnaires
 Élaboration d'une rétine en culture
Élaboration d'une rétine en culture
à partir de cellules souches embryonnaires
par Yoshiki Sasai[1]
Lors du développement embryonnaire, dans l'utérus, un petit amas de cellules identiques donne naissance aux divers types de cellules du corps humain. Elles s'arrangent en structures variées et finissent par former les organes. Un "programme" interne dirige cette progression depuis des éléments simples jusqu'à des tissus de forme et de taille appropriées.
Les biologistes aimeraient reproduire le développement embryonnaire en laboratoire, à la fois pour mieux comprendre ses mécanismes et pour élaborer des moyens le réparer et remplacer des tissus endommagés. Le succès est peut-être proche : de récents progrès laissent envisager la "culture d'organes" de remplacement à l'extérieur du corps ; ils pourraient être disponibles pour les opérations chirurgicales d'ici dix ans.
Cellules épithéliales pigmentées de la rétine
Mon optimisme se fonde sur des études sur les cellules souches – des divers types de cellules. Nous avons montré que des cultures de cellules souches peuvent donner naissance à une rétine ; cette structure clef de l'œil traduit la lumière en signaux électriques et chimiques, qui sont ensuite transmis au cerveau. Dans d'autres travaux, nous avons fait pousser du tissu cérébral (cortex) et une partie de l'hypophyse (une petite glande située à la base du cerveau). Pour ce faire, nous avons placé une mince couche de cellules dans une boîte de Pétri, où nous avons ajouté un cocktail de molécules présentes dans l'organisme. Ces cellules se sont développées en une structure tridimensionnelle. Nous espérons que du tissu rétinien produit de la sorte permettra de traiter plusieurs maladies de l'œil, telle la dégénérescence maculaire (la macula est la partie centrale de la rétine.
La formation de la rétine est un phénomène auto-organisé, fondé sur un programme interne des cellules.
À l'origine, nous cherchions à mieux comprendre la formation de la rétine. Nous savions qu'elle provient d'une partie du cerveau embryonnaire nommée diencéphale. Durant les premiers stades du développement embryonnaire, un segment du diencéphale s'étend pour former la vésicule optique, une structure en forme de ballon. Celle-ci s'invagine, formant la "cupule optique", qui deviendra la rétine (voir figure ci-dessous).
Naissance de la rétine chez l'embryon
L'œil se forme à partir d'un petit amas de cellules embryonnaires. Au début, une couche de tissu, le neuroépithélium, se replie vers l'extérieur, donnant naissance à la vésicule optique (jour 9). La paroi de ce bourgeon s'incurve ensuite vers l'intérieur (jour 9,5), et la vésicule du cristallin se développe (jour 10). Une partie de la vésicule optique engendre la cupule optique, à l'origine de la rétine et du nerf optique (jour 10,5). La rétine contient trois couches distinctes de cellules (à l'extrême droite), l'une d'elles étant constituée des photorécepteurs (les bâtonnets et les cônes). La rétine représentée ici, d'une taille de 250 micromètres est celle d'une souris. La rétine humaine est similaire, mais plus grosse, et sa formation est plus longue.
Depuis plus d'un siècle, les biologistes débattent sur le mécanisme de formation de la cupule optique. Une question importante concerne le rôle des structures voisines, telles que le cristallin et la cornée. Certains chercheurs pensent que le cristallin façonne la cupule optique en exerçant une pression sur la vésicule, tandis que d'autres affirment que la cupule peut se former sans lui et sans les autres tissus voisins.
Il est difficile d'observer les mécanismes physiologiques sous-tendant le développement sur des animaux vivants. Il y a environ dix ans, nous avons donc décidé de reproduire le développement de l'œil dans une boîte de Pétri. Pour ce faire, nous avons utilisé des cellules souches embryonnaires, que nous avons exposées à diverses substances chimiques connues pour être impliquées dans la formation de l'œil. Les cellules souches embryonnaires constituent le type le plus immature de cellules souches. Elles sont capables de se différencier en tous les types cellulaires du corps, des neurones jusqu'aux cellules musculaires.
Aucune technique existante ne permettait d'engendrer des organes à partir de cultures de cellules souches. Des essais avaient été réalisés en plaçant les cellules sur une sorte d'échafaudage artificiel, qui imitait la forme de l'organe ciblé (en l'occurrence une vessie ou un œsophage), mais ils n'avaient remporté qu'un succès mitigé. Nous avons donc tenté une approche différente.
En 2000, nous avons élaboré une méthode pour transformer des cellules souches embryonnaires de souris en différents types de neurones. Nous avons ensuite placé une monocouche de ces cellules souches dans une boîte de Pétri, avec des cellules dites nourricières : ces dernières transmettaient des signaux chimiques déclenchant la différenciation des cellules souches embryonnaires. Cette couche mince ne reproduisait pas les organes tridimensionnels réels, mais nous désirions déjà savoir si les molécules sélectionnées suffisaient à obtenir les types particuliers de neurones apparaissant précocement lors du développement de l'œil.
Après des débuts difficiles, nous avons développé une nouvelle méthode en 2005, qui nous a permis de dépasser le stade bidimensionnel : nous avons créé une suspension de cellules souches dans un milieu liquide, qualifiée de culture flottante. L'intérêt d'une telle culture tridimensionnelle est double. Tout d'abord, un agrégat de cellules est mieux à même de prendre la forme des tissus s'il est tridimensionnel que s'il est plat. Ensuite, la formation de structures complexes requiert de multiples communications entre cellules, et ces dernières interagissent plus facilement dans une culture tridimensionnelle.
Nous avons placé des cellules en suspension dans de petits réservoirs - comptant chacun en moyenne 3 000 cellules - au sein d'une boîte de Pétri. Initialement séparées les unes des autres, les cellules se sont liées avec leurs voisines. Nous avons ensuite déclenché la différenciation de ces petits agrégats de cellules en des progéniteurs neuronaux (des cellules neuronales immatures) présents à l'avant du cerveau. Les cellules ont alors commencé à échanger des signaux.
Trois à quatre jours plus tard, elles se sont organisées spontanément en une sphère creuse formée d'une couche cellulaire ; on parle de neuroépithélium. Nous avons nommé SFEBq cette méthode de culture (pour Serum free floating culture of embryoid body-like aggregate with quick reaggregation, littéralement culture sans sérum flottante d'agrégats embryonnaires se réagrégeant rapidement).
Dans l'embryon, les cellules neuroépithéliales forment des structures cérébrales spécifiques, après avoir reçu des signaux chimiques externes. L'un de ces signaux déclenche le développement du diencéphale, qui engendrera la rétine et l'hypothalamus (une aire cérébrale contrôlant l'appétit et de nombreuses fonctions physiologiques fondamentales). Après avoir fait s'agréger les cellules en sphères, nous avons provoqué leur différenciation en progéniteurs rétiniens - les précurseurs des cellules rétiniennes matures. Pour ce faire, nous avons ajouté à notre culture un mélange de protéines, incluant celles qui assurent ce rôle chez l'embryon.
Quelques jours plus tard, des structures semblables à la vésicule optique ont spontanément bourgeonné sur les sphères, avant de changer de forme : la structure finale ressemblait à la cupule optique de l'œil embryonnaire (voir figure ci-dessous). Comme la cupule optique des animaux vivants, cette structure issue de cellules souches embryonnaires se composait de deux parois (deux épithéliums), l'une extérieure et l'autre intérieure ; c'est cette dernière qui est à l'origine de la rétine.
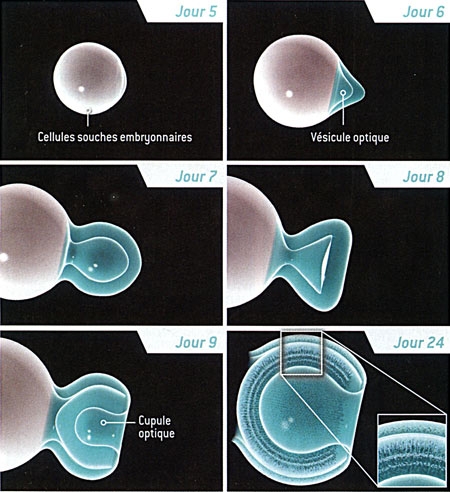
Formation de la rétine à partir d'une cellule souche
La formation d'une rétine à partir d'une culture de cellules souches embryonnaires ressemble à ce qui se produit dans l'utérus. Les cellules s'agrègent et commencent à former la vésicule optique "primitive" environ cinq jours après avoir été mélangées avec des substances nommées facteurs de croissance. Cette vésicule gonfle, puis forme la cupule optique. Le 24e jour, toutes les couches de la rétine sont visibles.
Ainsi, une structure ordonnée est née de la seule agrégation de cellules souches dans un récipient. Contrairement à ce qui se passe chez l'embryon, il ne se formait pas de cristallin ou de lentille au voisinage de la cupule optique. Nos travaux montrent donc qu'aucune force exercée par des tissus voisins (tel le cristallin) n'est nécessaire à la formation de la protorétine. Au moins in vitro, c'est un phénomène auto-organisé, fondé sur un programme interne des cellules. Ce programme est encodé dans leur ADN, et nous travaillons à préciser ses mécanismes d'action.
L'apparition spontanée d'une structure stratifiée
Le développement normal de la rétine, tel qu'on l'observe chez les embryons, s'est poursuivi dans nos cultures. En deux semaines supplémentaires, la cupule optique a grandi jusqu'à environ deux millimètres de diamètre, et l'épithélium monocouche interne est devenu une structure stratifiée, contenant les six catégories de cellules d'une rétine naturelle après la naissance. L'une des couches extérieures de cette structure était constituée de photorécepteurs et l'autre de cellules dites ganglionnaires, qui, dans le corps, relient la rétine au cerveau. Entre les deux se trouvaient plusieurs couches de cellules de liaison, nommées interneurones.
De nombreuses questions demeurent, notamment sur la façon dont une boule de cellules entre dans un programme de différenciation, qui aboutit à des tissus distincts. Tout au long du développement embryonnaire, des formes complexes apparaissent spontanément à partir d'amas de matière homogène - on parle de brisure de symétrie. En l'absence de ce phénomène, les divisions cellulaires de l'œuf fécondé n'engendreraient qu'une masse indifférenciée de cellules. Nos cultures de cellules souches embryonnaires qui s'auto-organisent devraient aider à mieux comprendre les mécanismes en jeu dans les brisures de symétrie.
On cherche également à mieux comprendre comment s'effectue le modelage de la cupule optique à partir d'une simple couche de cellules (l'épithélium rétinien). La force qui s'applique sur les cellules et la rigidité varient dans l'épithélium. En mesurant in vitro la direction de la force et la rigidité du tissu en différents endroits, nous avons découvert que la cupule optique se forme en plusieurs étapes. Tout d'abord, la rigidité de la protorétine diminue, ce qui accroît sa flexibilité. Dans le même temps, les cellules qui se trouvent à la jonction de l'épithélium (la boule dont a bourgeonné la rétine) et de la protorétine adoptent une forme en coin. Finalement, la protorétine commence à se replier vers l'intérieur en raison de sa rapide extension. Nous avons appliqué les conditions mécaniques correspondantes à une simulation sur ordinateur, et la forme de la cupule optique est apparue !
Pour y voir plus clair...
Nos travaux aideront-ils à lutter contre les troubles oculaires humains ? Nous avons progressé dans cette voie. En particulier, mon équipe a récemment recréé une cupule optique et un tissu neuronal à couches multiples à partir de cellules souches embryonnaires humaines. La même méthode de culture devrait être applicable à des cellules souches humaines dites pluripotentes induites - des cellules matures et différenciées dont on a « inversé » le développement pour qu'elles se comportent comme des cellules souches embryonnaires. Nous avons également inventé une méthode fiable de cryoconservation, qui permet de stocker du tissu rétinien issu de cellules embryonnaires humaines dans de l'azote liquide.
Ces travaux promettent des applications médicales. Par exemple, nous pourrions créer des rétines artificielles, qui aideront à étudier les maladies de l'œil et, peut-être, à développer des médicaments et des thérapies géniques pour inverser la dégénérescence rétinienne.
Trois catégories de dégénérescence rétinienne pourraient bénéficier de nos recherches : la dégénérescence maculaire, la rétinopathie pigmentaire et le glaucome. Ces maladies touchent des millions d'individus à travers le monde et altèrent des couches différentes de la rétine.
Dans la dégénérescence maculaire, un tissu nommé épithélium pigmentaire rétinien est endommagé : ce tissu tapisse le fond de la rétine et supporte les photorécepteurs, qui se détériorent également, en particulier dans la région centrale de la rétine.
Dans la rétinopathie pigmentaire, les bâtonnets (un type de photorécepteurs) disparaissent progressivement pendant plusieurs années. La maladie se manifeste d'abord par une cécité nocturne, ou héméralopie, puis le champ visuel se réduit jusqu'à se limiter à une petite zone au centre, avant que le patient ne devienne totalement aveugle.
Enfin, le glaucome endommage les cellules ganglionnaires, qui relient la rétine au cerveau via le nerf optique.
De ces trois maladies, la dégénérescence maculaire semble la plus susceptible d'être traitée par une thérapie cellulaire. Pour obtenir les cellules nécessaires au remplacement de l'épithélium pigmentaire rétinien endommagé, on transforme des cellules souches embryonnaires humaines ou des cellules souches pluripotentes induites, au sein de cultures conventionnelles ou flottantes. Des essais cliniques à petite échelle ont débuté aux États-Unis et sont prévus dans d'autres pays : les cellules d'épithélium pigmentaire issues de cellules souches sont injectées sous la rétine avec une fine aiguille, afin de remplacer au moins une partie du tissu endommagé.
Pour la rétinopathie pigmentaire, la thérapie cellulaire est une perspective plus lointaine. À l'inverse d'une culture classique, notre méthode peut engendrer une couche dense de bâtonnets facilement transplantable. En revanche, ces photorécepteurs doivent s'intégrer dans le circuit neuronal de l'œil - ce qui n'était pas nécessaire pour l'épithélium, simple tissu de soutien. Ainsi, ils doivent se connecter à un autre type de cellules sensorielles, les cellules bipolaires, et nous ne savons pas encore comment réaliser cette connexion.
Le glaucome pourrait être la plus difficile des trois maladies à traiter par thérapie cellulaire. Des cultures de cellules souches embryonnaires peuvent produire les cellules ganglionnaires nécessaires, mais dans l'œil postnatal, le nerf optique ne se reforme pas spontanément. Autrement dit, une fois les cellules ganglionnaires transplantées, on ne sait pas connecter leurs axones (les prolongements des neurones qui forment le nerf optique) aux cellules cérébrales.
Notre méthode a décuplé les possibilités des tissus formés à partir de cellules souches embryonnaires. Reste à découvrir ce qu'elle peut nous apprendre sur les mécanismes qui conduisent d'une cellule unique à un organe aussi complexe que l'œil...
BIBLIOGRAPHIE
Y. Sasai (2013). – Une rétine en culture. Pour la Science, n° 426 avril 1993, pp. 58-63.
T. Nakano et al. (2012). - Self-formation of optic cups and storable stratified neural retina from human ESCs, Cells Stem Cell, vol. 10, pp. 771-785.
D Schwartz et al. (2012). - Embryonic stem cell trials for macular degeneration : a preliminary report, Lancet, vol. 379, pp. 713-720, 2012.
M. Eiraku et al. (2011). - Self-organizing optic-cup morphogenesis in three-dimensional culture, Nature, vol. 472, pp. 51-56.
Les alternatives thérapeutiques aux cellules souches
par Serge Picaud et José Sahel, Institut de la vision, Paris
Si les cellules souches ouvrent de nouvelles perspectives thérapeutiques pour les patients aveugles, une autre technique en est déjà au stade commercial : celle des prothèses rétiniennes. Ces dispositifs visent à stimuler artificiellement une rétine ayant perdu ses photorécepteurs. Les images, filmées par une caméra fixée sur une paire de lunettes, sont d'abord transformées en matrices d'impulsions électriques. Celles-ci sont ensuite transmises à des électrodes implantées sur la rétine résiduelle (voir la figure ci-dessous).
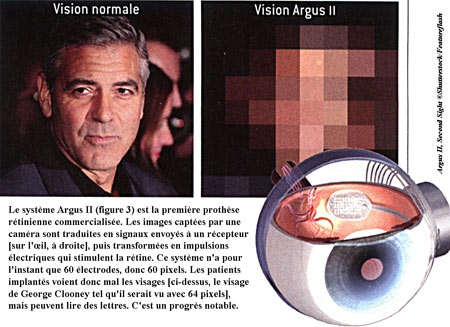
Commercialisée depuis deux ans en Europe, la première prothèse rétinienne opérationnelle a reçu l'autorisation de mise sur le marché aux États-Unis en février 2013. En France, quatre patients aveugles ont participé aux essais cliniques. Cependant, les images perçues ne sont constituées que de 60 points ou pixels, puisque l'implant n'a que 60 électrodes : c'est insuffisant pour bien voir une image complexe, tel un visage, mais suffisant pour une image simple, de sorte que certains patients sont capables de lire des lettres d'environ 10 centimètres de hauteur.
De nombreux chercheurs tentent d'augmenter le nombre de pixels, chaque électrode devant activer une zone disjointe de sa voisine. Ainsi, à l'Institut de la vision, on poursuit plusieurs objectifs : le développement de nouvelles formes tridimensionnelles pour les implants, avec l'ESIEE (École supérieure d'ingénieurs en électrotechnique et électronique) et le CEA; l'utilisation de matériaux semi-conducteurs différents, tels le graphène et le diamant (projet européen NEUROCARE) ; l'amélioration du codage des informations visuelles.
Une piste alternative, la thérapie optogénétique, est inspirée d'algues unicellulaires et de bactéries dotées de protéines photosensibles. Ces protéines sont des canaux ioniques dont l'ouverture est contrôlée par la lumière. L'idée est d'insérer le gène qui les code dans les neurones non photosensibles de la rétine, qui pourraient alors être activés par la lumière.Ainsi, chaque cellule produisant les protéines jouerait le rôle d'un pixel. Ces protéines étant moins performantes que nos pigments visuels, les aveugles devront porter des lunettes rehaussant la luminance.
Ainsi, dans le cadre du projet européen RETICIRC, nous avons rendu la vue à des souris aveugles grâce à une protéine bactérienne. Nous avons ensuite montré que cette protéine permet l'activation de cellules rétiniennes humaines par la lumière, grâce à des cultures de cellules prélevées post mortem. Avant de passer à une application clinique, nous devrons vérifier que la thérapie génique visant à faire exprimer la protéine bactérienne n'entraîne pas d'inflammation ou de rejet chez le primate.
[1] Yoshiki SASAI est directeur du groupe d'organogenèse et de neurogenèse au Centre de biologie du développement du RIKEN, à Kobe, au Japon. Plus d'information sur Y. Sasai et ses recherches.
12:05 Publié dans Biologie, Médecine | Tags : cellules souches embryonnaires, rétine, culture organotypique, macula, dmla, rétinopathie pigmentaire, glaucome, prothèse rétinienne | Lien permanent | Commentaires (2) | ![]() Facebook | | |
Facebook | | |
27/07/2012
Controverse acide sur les cellules souches
 Controverse acide sur les cellules souches
Controverse acide sur les cellules souches
Un article paru dans la revue "Sciences & Vie" de mai 2014 fait état de l'obtention de cellules souches par choc acide à la suite de travaux d'une équipe japonaise, résultats publiés dans "Nature" de janvier 2014. (Nature 01/2014; 505(7485):641-7.)
Dans "Pour la Science" en ligne (avril 2014), un article de Yvan Pandelé[1] fait le point sur cette publication. Ci-dessous la publication in extenso de cet article.
La récente découverte d’une méthode pour fabriquer des cellules souches par choc acide a suscité l’enthousiasme de la communauté scientifique. Avant d’être gravement mise en doute...
La nouvelle avait fait grand bruit. En janvier dernier, des chercheurs japonais et américains annonçaient avoir réussi à transformer des cellules de souris adultes en cellules souches par une nouvelle méthode : la soumission à un choc acide. Nommées STAP (Stimulus-triggered acquisition of pluripotency), les cellules souches obtenues seraient pluripotentes, c'est-à-dire capables de se différencier en de nombreux types cellulaires une fois réinjectées chez l’embryon.
Assez vite cependant, les publications concernées – un article et une lettre parues dans la revue Nature le 30 janvier dernier – ont suscité des doutes. Des chercheurs ont pointé des détails problématiques : incohérence méthodologique, images modifiées ou reprises de la thèse de doctorat du premier auteur… Des observations qui, mises bout à bout, commençaient à faire désordre.
Plus grave, aucune équipe de recherche n’est jusqu’à présent parvenue à répliquer les résultats. On s’est également aperçu que les cellules STAP produites ne provenaient pas de la souche de souris mentionnée dans l’article, mais de deux autres souches. Sur son blog de recherche, Paul Knoepfler, spécialiste des cellules pluripotentes à l’Université de Californie à Davis, a publié une série de sondages informels qui semblent indiquer un scepticisme croissant au sujet de l’existence des cellules STAP.
Une découverte prometteuse
La méthode découverte par Haruko Obokata et ses collègues semblait pourtant très prometteuse, combinant une technique simple – modifier l’acidité du milieu de culture – et des résultats encourageants. En effet, les cellules STAP présenteraient un potentiel de différenciation encore supérieur aux cellules pluripotentes induites (IPS) obtenues par reprogrammation génétique, récompensées par un prix Nobel de médecine en 2012. Les enjeux sont forts : la thérapie cellulaire à base de cellules souches permettra peut-être de traiter de nombreuses maladies, en remplaçant les tissus ou les organes lésés.
Certains des auteurs impliqués dans la découverte des cellules STAP se sont exprimés publiquement. Teruhiko Wakayama, chercheur à l’Université de Yamanashi, s’est prononcé en faveur d’un retrait des articles : le 10 mars dernier, il déclarait avoir perdu confiance dans le travail effectué et préférer approfondir les recherches en vue d’une éventuelle republication. Charles Vacanti, auteur sénior et chercheur à la Faculté de médecine de Harvard, continue pour sa part de défendre la validité de l’étude. Le 20 mars dernier, il mettait à la disposition de la communauté une version détaillée du protocole employé, afin de faciliter d’éventuelles réplications.
Des accusations de fraude
Mais les critiques se focalisent surtout sur le premier auteur, Haruko Obokata, une jeune biologiste (30 ans) responsable d’équipe au Riken, un prestigieux institut de recherche japonais. À la suite des suspicions émises, le Riken a rapidement lancé une enquête interne. Les conclusions, parues à la fin du mois de mars, sont sévères vis-à-vis de Haruko Obokata, qui se voit accusée d’avoir manipulé volontairement certaines données annexes, se rendant coupable de fraude scientifique (scientific misconduct). Dans une conclusion au vitriol, les rapporteurs estiment le protocole expérimental difficile à suivre – donc à reproduire – et vont jusqu’à déplorer « le manque total d’intégrité et d’humilité » de la chercheuse.
Violemment mise en cause par son propre institut et au centre d’un ouragan médiatique, Haruko Obokata a répliqué mercredi 9 avril dans une conférence de presse. Visiblement très éprouvée, elle s’est excusée pour les erreurs commises, mais plaide la bonne foi et maintient la validité des résultats de son équipe. « Le phénomène des cellules STAP est une réalité que j'ai vérifiée à plus de 200 reprises », affirme-t-elle, ajoutant que le protocole a été répliqué par une tierce personne. Le Riken a confirmé cette dernière information tout en minimisant les résultats obtenus, affirmant qu’ils ne constituaient pas une réplication complète. Le chercheur en question, également membre de l'institut japonais, semble vouloir conserver l’anonymat. Jusqu’à ce que ses résultats soient confirmés ?
Un retrait des articles ?
La question de l’existence des cellules STAP reste donc ouverte. Pour l’heure, la revue Nature n’a pas annoncé de retrait des publications mises en cause, et continue de couvrir l’affaire sur son blog d’actualité. Quant aux réactions des institutions de recherche, elles sont contrastées. Si le Riken a joué la transparence et a mis beaucoup d’ardeur à se désolidariser de H. Obokata, l’Université Harvard est pour sa part restée silencieuse. Toujours est-il qu’en l’absence de demande de retrait de la part des institutions scientifiques ou des principaux auteurs, les publications restent, jusqu’à nouvel ordre, valides.
Ces dernières années, on observe une augmentation du nombre de rétractations d’articles scientifiques. Une revue conduite en 2012 sur la base PubMed, qui référence un très grand nombre d’articles dans le champ biomédical, a montré que les deux tiers des rétractations étaient dues à des cas de fraude scientifique, c'est-à-dire du plagiat (ou auto-plagiat) ou de la manipulation volontaire de données. Cette hausse pourrait toutefois révéler, plutôt qu’une intensification des mauvaises pratiques, une plus grande sensibilité du système de détection.
En cas de fraude avérée, le scandale est généralement à la mesure des espoirs suscités. En 2005, dans un article publié dans Science, une équipe de recherche coréenne avait affirmé avoir créé des cellules souches embryonnaires à partir de clones humains… Las, la découverte s’était révélée factice et l’article avait été retiré dans un scandale retentissant. Espérons que l’affaire des cellules STAP ne connaîtra pas la même issue.
© Haruko Obokata
Cette figure, qui présente le résultat d'une électrophorèse sur gel, a été falsifiée (le couloir 3 correspond à un gel différent des autres couloirs). Il s'agit d'un des deux cas de fraude scientifique identifiés par l'institut de recherche où travaille Haruko Obokata.
Pour en savoir plus
M.-N. Cordonnier, Des cellules souches produites par choc acide, Pour la Science, en ligne le 8 février 2014.
H. Obokata et al., Stimulus-triggered fate conversion of somatic cells into pluripotency, Nature, vol. 505, pp. 641-647, 30 janvier 2014.
H. Obokata et al., Bidirectional developmental potential in reprogrammed cells with acquired pluripotency, Nature, vol. 505, pp. 676-680, 30 janvier 2014.
F. C. Fang et al., Misconduct accounts for the majority of retracted scientific publications, PNAS, 109(42), 2012.
D. Fanelli, Why growing retractions are (mostly) a good sign, PLOS Medicine, 10(12), 2013.
[1] Yvan Pandelé est journaliste à Pour la Science.
09:15 Publié dans Actualité des Sciences, Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
21/07/2012
Cellules souches : obtenir des neurones à partir de fibroblastes
 Obtenir des neurones
Obtenir des neurones
à partir de fibroblastes
Les cellules de l'organisme, y compris les neurones possèdent la même information génétique, mais elle n'est pas lue de la même façon selon le type cellulaire. On sait aujourd'hui agir sur cette lecture, notamment à l'aide de facteurs de transcription, des protéines qui se fixent sur l'ADN et régulent sa transcription en ARN. Grâce à un seul de ces facteurs, l'équipe de Karen Ring et Yadong Huan, de l'Université de Californie (San Francisco) a réussi à obtenir des réseaux de neurones à partir de fibroblastes humains et de souris.
Pour transformer les fibroblastes en d'autres cellules, on les place dans un milieu de culture adapté, qui recrée l'environnement physico-chimique des cellules qu'on cherche à obtenir, et l'on provoque la sur-expression des facteurs de transcription responsables de la différenciation visée.
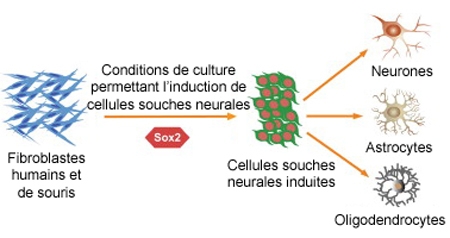
Protocole de l'expérimentation
Cette dernière opération consiste à faire produire en masse ces facteurs de transcription par la cellule. L'équipe de Y. Huang et de Karen Ring n'en a utilisé qu'un seul, nommé Sox2. D'autres équipes avaient également obtenu des neurones, mais elles avaient fait appel à un nombre bien plus important de facteurs de transcription.
En quelques jours, les fibroblastes se sont transformés en cellules souches neurales induites (iNSCs). Celles-ci se sont divisées et se sont différenciées en astrocytes, oligodendrocytes et en neurones fonctionnels. En moins d'un mois, ces neurones se sont associés en réseaux.
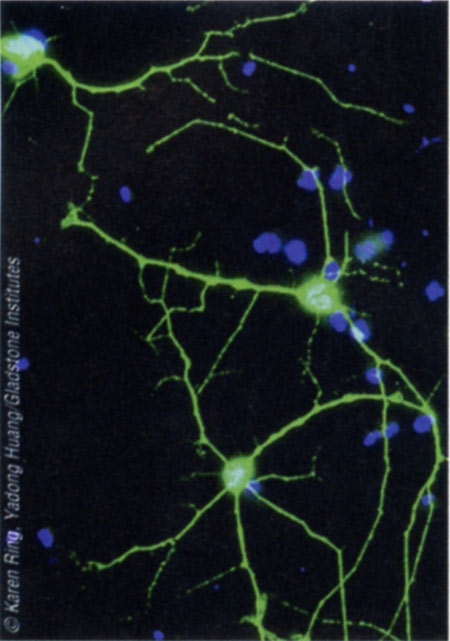
Neurones issus de la transformation de fibroblastes
Pour vérifier que les cellules reprogrammées ne risquaient pas de dégénérer en cellules cancéreuses, l'équipe américiane les a greffées dans le cerveau d'une souris. Elles s'y sont intégrées sans causer de tumeur. Ainsi, par ce type de reprogrammation, les iNSCs auto-renouvelables et multipotentes sans potentiel tumorigène peuvent être générées directement à partir de fibroblastes. Ces cellules seront peut-être utiles dans la lutte contre les maladies neurodégénératives, telles celles d'Alzheimer et de Parkinson ; elles permettront de tester les médicaments élaborés.
Source :
K. King et al. (2012). - Direct Reprogramming of Mouse and Human Fibroblasts into Multipotent Neural Stem Cells with a Single Factor. Cell Stem Cell, 7 juin 2012.
21:47 Publié dans Actualité des Sciences, Biologie, Médecine | Tags : cellules souches, fibroblastes, neurones, astrocytes, oligodendrocytes, cellules souches neurales induites, inscs | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |