28/07/2012
Élaboration d'une rétine en culture à partir de cellules souches embryonnaires
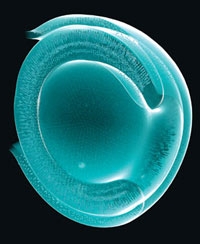 Élaboration d'une rétine en culture
Élaboration d'une rétine en culture
à partir de cellules souches embryonnaires
par Yoshiki Sasai[1]
Lors du développement embryonnaire, dans l'utérus, un petit amas de cellules identiques donne naissance aux divers types de cellules du corps humain. Elles s'arrangent en structures variées et finissent par former les organes. Un "programme" interne dirige cette progression depuis des éléments simples jusqu'à des tissus de forme et de taille appropriées.
Les biologistes aimeraient reproduire le développement embryonnaire en laboratoire, à la fois pour mieux comprendre ses mécanismes et pour élaborer des moyens le réparer et remplacer des tissus endommagés. Le succès est peut-être proche : de récents progrès laissent envisager la "culture d'organes" de remplacement à l'extérieur du corps ; ils pourraient être disponibles pour les opérations chirurgicales d'ici dix ans.
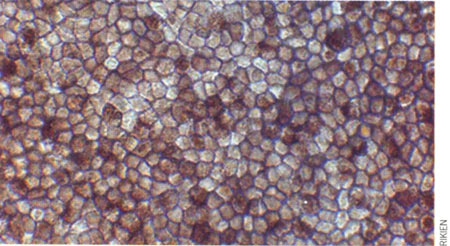
Cellules épithéliales pigmentées de la rétine
Mon optimisme se fonde sur des études sur les cellules souches – des divers types de cellules. Nous avons montré que des cultures de cellules souches peuvent donner naissance à une rétine ; cette structure clef de l'œil traduit la lumière en signaux électriques et chimiques, qui sont ensuite transmis au cerveau. Dans d'autres travaux, nous avons fait pousser du tissu cérébral (cortex) et une partie de l'hypophyse (une petite glande située à la base du cerveau). Pour ce faire, nous avons placé une mince couche de cellules dans une boîte de Pétri, où nous avons ajouté un cocktail de molécules présentes dans l'organisme. Ces cellules se sont développées en une structure tridimensionnelle. Nous espérons que du tissu rétinien produit de la sorte permettra de traiter plusieurs maladies de l'œil, telle la dégénérescence maculaire (la macula est la partie centrale de la rétine.
La formation de la rétine est un phénomène auto-organisé, fondé sur un programme interne des cellules.
À l'origine, nous cherchions à mieux comprendre la formation de la rétine. Nous savions qu'elle provient d'une partie du cerveau embryonnaire nommée diencéphale. Durant les premiers stades du développement embryonnaire, un segment du diencéphale s'étend pour former la vésicule optique, une structure en forme de ballon. Celle-ci s'invagine, formant la "cupule optique", qui deviendra la rétine (voir figure ci-dessous).
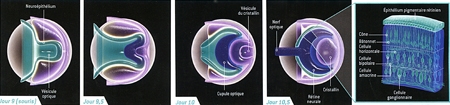
Naissance de la rétine chez l'embryon
L'œil se forme à partir d'un petit amas de cellules embryonnaires. Au début, une couche de tissu, le neuroépithélium, se replie vers l'extérieur, donnant naissance à la vésicule optique (jour 9). La paroi de ce bourgeon s'incurve ensuite vers l'intérieur (jour 9,5), et la vésicule du cristallin se développe (jour 10). Une partie de la vésicule optique engendre la cupule optique, à l'origine de la rétine et du nerf optique (jour 10,5). La rétine contient trois couches distinctes de cellules (à l'extrême droite), l'une d'elles étant constituée des photorécepteurs (les bâtonnets et les cônes). La rétine représentée ici, d'une taille de 250 micromètres est celle d'une souris. La rétine humaine est similaire, mais plus grosse, et sa formation est plus longue.
Depuis plus d'un siècle, les biologistes débattent sur le mécanisme de formation de la cupule optique. Une question importante concerne le rôle des structures voisines, telles que le cristallin et la cornée. Certains chercheurs pensent que le cristallin façonne la cupule optique en exerçant une pression sur la vésicule, tandis que d'autres affirment que la cupule peut se former sans lui et sans les autres tissus voisins.
Il est difficile d'observer les mécanismes physiologiques sous-tendant le développement sur des animaux vivants. Il y a environ dix ans, nous avons donc décidé de reproduire le développement de l'œil dans une boîte de Pétri. Pour ce faire, nous avons utilisé des cellules souches embryonnaires, que nous avons exposées à diverses substances chimiques connues pour être impliquées dans la formation de l'œil. Les cellules souches embryonnaires constituent le type le plus immature de cellules souches. Elles sont capables de se différencier en tous les types cellulaires du corps, des neurones jusqu'aux cellules musculaires.
Aucune technique existante ne permettait d'engendrer des organes à partir de cultures de cellules souches. Des essais avaient été réalisés en plaçant les cellules sur une sorte d'échafaudage artificiel, qui imitait la forme de l'organe ciblé (en l'occurrence une vessie ou un œsophage), mais ils n'avaient remporté qu'un succès mitigé. Nous avons donc tenté une approche différente.
En 2000, nous avons élaboré une méthode pour transformer des cellules souches embryonnaires de souris en différents types de neurones. Nous avons ensuite placé une monocouche de ces cellules souches dans une boîte de Pétri, avec des cellules dites nourricières : ces dernières transmettaient des signaux chimiques déclenchant la différenciation des cellules souches embryonnaires. Cette couche mince ne reproduisait pas les organes tridimensionnels réels, mais nous désirions déjà savoir si les molécules sélectionnées suffisaient à obtenir les types particuliers de neurones apparaissant précocement lors du développement de l'œil.
Après des débuts difficiles, nous avons développé une nouvelle méthode en 2005, qui nous a permis de dépasser le stade bidimensionnel : nous avons créé une suspension de cellules souches dans un milieu liquide, qualifiée de culture flottante. L'intérêt d'une telle culture tridimensionnelle est double. Tout d'abord, un agrégat de cellules est mieux à même de prendre la forme des tissus s'il est tridimensionnel que s'il est plat. Ensuite, la formation de structures complexes requiert de multiples communications entre cellules, et ces dernières interagissent plus facilement dans une culture tridimensionnelle.
Nous avons placé des cellules en suspension dans de petits réservoirs - comptant chacun en moyenne 3 000 cellules - au sein d'une boîte de Pétri. Initialement séparées les unes des autres, les cellules se sont liées avec leurs voisines. Nous avons ensuite déclenché la différenciation de ces petits agrégats de cellules en des progéniteurs neuronaux (des cellules neuronales immatures) présents à l'avant du cerveau. Les cellules ont alors commencé à échanger des signaux.
Trois à quatre jours plus tard, elles se sont organisées spontanément en une sphère creuse formée d'une couche cellulaire ; on parle de neuroépithélium. Nous avons nommé SFEBq cette méthode de culture (pour Serum free floating culture of embryoid body-like aggregate with quick reaggregation, littéralement culture sans sérum flottante d'agrégats embryonnaires se réagrégeant rapidement).
Dans l'embryon, les cellules neuroépithéliales forment des structures cérébrales spécifiques, après avoir reçu des signaux chimiques externes. L'un de ces signaux déclenche le développement du diencéphale, qui engendrera la rétine et l'hypothalamus (une aire cérébrale contrôlant l'appétit et de nombreuses fonctions physiologiques fondamentales). Après avoir fait s'agréger les cellules en sphères, nous avons provoqué leur différenciation en progéniteurs rétiniens - les précurseurs des cellules rétiniennes matures. Pour ce faire, nous avons ajouté à notre culture un mélange de protéines, incluant celles qui assurent ce rôle chez l'embryon.
Quelques jours plus tard, des structures semblables à la vésicule optique ont spontanément bourgeonné sur les sphères, avant de changer de forme : la structure finale ressemblait à la cupule optique de l'œil embryonnaire (voir figure ci-dessous). Comme la cupule optique des animaux vivants, cette structure issue de cellules souches embryonnaires se composait de deux parois (deux épithéliums), l'une extérieure et l'autre intérieure ; c'est cette dernière qui est à l'origine de la rétine.
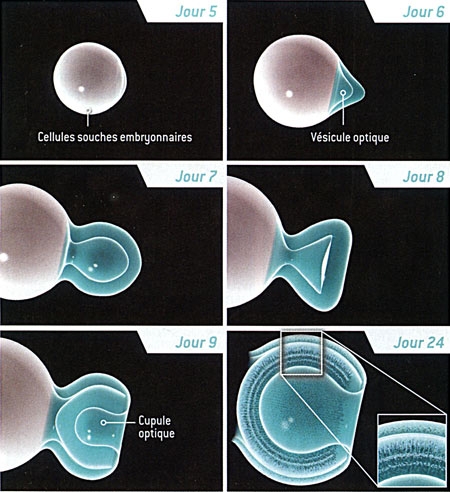
Formation de la rétine à partir d'une cellule souche
La formation d'une rétine à partir d'une culture de cellules souches embryonnaires ressemble à ce qui se produit dans l'utérus. Les cellules s'agrègent et commencent à former la vésicule optique "primitive" environ cinq jours après avoir été mélangées avec des substances nommées facteurs de croissance. Cette vésicule gonfle, puis forme la cupule optique. Le 24e jour, toutes les couches de la rétine sont visibles.
Ainsi, une structure ordonnée est née de la seule agrégation de cellules souches dans un récipient. Contrairement à ce qui se passe chez l'embryon, il ne se formait pas de cristallin ou de lentille au voisinage de la cupule optique. Nos travaux montrent donc qu'aucune force exercée par des tissus voisins (tel le cristallin) n'est nécessaire à la formation de la protorétine. Au moins in vitro, c'est un phénomène auto-organisé, fondé sur un programme interne des cellules. Ce programme est encodé dans leur ADN, et nous travaillons à préciser ses mécanismes d'action.
L'apparition spontanée d'une structure stratifiée
Le développement normal de la rétine, tel qu'on l'observe chez les embryons, s'est poursuivi dans nos cultures. En deux semaines supplémentaires, la cupule optique a grandi jusqu'à environ deux millimètres de diamètre, et l'épithélium monocouche interne est devenu une structure stratifiée, contenant les six catégories de cellules d'une rétine naturelle après la naissance. L'une des couches extérieures de cette structure était constituée de photorécepteurs et l'autre de cellules dites ganglionnaires, qui, dans le corps, relient la rétine au cerveau. Entre les deux se trouvaient plusieurs couches de cellules de liaison, nommées interneurones.
De nombreuses questions demeurent, notamment sur la façon dont une boule de cellules entre dans un programme de différenciation, qui aboutit à des tissus distincts. Tout au long du développement embryonnaire, des formes complexes apparaissent spontanément à partir d'amas de matière homogène - on parle de brisure de symétrie. En l'absence de ce phénomène, les divisions cellulaires de l'œuf fécondé n'engendreraient qu'une masse indifférenciée de cellules. Nos cultures de cellules souches embryonnaires qui s'auto-organisent devraient aider à mieux comprendre les mécanismes en jeu dans les brisures de symétrie.
On cherche également à mieux comprendre comment s'effectue le modelage de la cupule optique à partir d'une simple couche de cellules (l'épithélium rétinien). La force qui s'applique sur les cellules et la rigidité varient dans l'épithélium. En mesurant in vitro la direction de la force et la rigidité du tissu en différents endroits, nous avons découvert que la cupule optique se forme en plusieurs étapes. Tout d'abord, la rigidité de la protorétine diminue, ce qui accroît sa flexibilité. Dans le même temps, les cellules qui se trouvent à la jonction de l'épithélium (la boule dont a bourgeonné la rétine) et de la protorétine adoptent une forme en coin. Finalement, la protorétine commence à se replier vers l'intérieur en raison de sa rapide extension. Nous avons appliqué les conditions mécaniques correspondantes à une simulation sur ordinateur, et la forme de la cupule optique est apparue !
Pour y voir plus clair...
Nos travaux aideront-ils à lutter contre les troubles oculaires humains ? Nous avons progressé dans cette voie. En particulier, mon équipe a récemment recréé une cupule optique et un tissu neuronal à couches multiples à partir de cellules souches embryonnaires humaines. La même méthode de culture devrait être applicable à des cellules souches humaines dites pluripotentes induites - des cellules matures et différenciées dont on a « inversé » le développement pour qu'elles se comportent comme des cellules souches embryonnaires. Nous avons également inventé une méthode fiable de cryoconservation, qui permet de stocker du tissu rétinien issu de cellules embryonnaires humaines dans de l'azote liquide.
Ces travaux promettent des applications médicales. Par exemple, nous pourrions créer des rétines artificielles, qui aideront à étudier les maladies de l'œil et, peut-être, à développer des médicaments et des thérapies géniques pour inverser la dégénérescence rétinienne.
Trois catégories de dégénérescence rétinienne pourraient bénéficier de nos recherches : la dégénérescence maculaire, la rétinopathie pigmentaire et le glaucome. Ces maladies touchent des millions d'individus à travers le monde et altèrent des couches différentes de la rétine.
Dans la dégénérescence maculaire, un tissu nommé épithélium pigmentaire rétinien est endommagé : ce tissu tapisse le fond de la rétine et supporte les photorécepteurs, qui se détériorent également, en particulier dans la région centrale de la rétine.
Dans la rétinopathie pigmentaire, les bâtonnets (un type de photorécepteurs) disparaissent progressivement pendant plusieurs années. La maladie se manifeste d'abord par une cécité nocturne, ou héméralopie, puis le champ visuel se réduit jusqu'à se limiter à une petite zone au centre, avant que le patient ne devienne totalement aveugle.
Enfin, le glaucome endommage les cellules ganglionnaires, qui relient la rétine au cerveau via le nerf optique.
De ces trois maladies, la dégénérescence maculaire semble la plus susceptible d'être traitée par une thérapie cellulaire. Pour obtenir les cellules nécessaires au remplacement de l'épithélium pigmentaire rétinien endommagé, on transforme des cellules souches embryonnaires humaines ou des cellules souches pluripotentes induites, au sein de cultures conventionnelles ou flottantes. Des essais cliniques à petite échelle ont débuté aux États-Unis et sont prévus dans d'autres pays : les cellules d'épithélium pigmentaire issues de cellules souches sont injectées sous la rétine avec une fine aiguille, afin de remplacer au moins une partie du tissu endommagé.
Pour la rétinopathie pigmentaire, la thérapie cellulaire est une perspective plus lointaine. À l'inverse d'une culture classique, notre méthode peut engendrer une couche dense de bâtonnets facilement transplantable. En revanche, ces photorécepteurs doivent s'intégrer dans le circuit neuronal de l'œil - ce qui n'était pas nécessaire pour l'épithélium, simple tissu de soutien. Ainsi, ils doivent se connecter à un autre type de cellules sensorielles, les cellules bipolaires, et nous ne savons pas encore comment réaliser cette connexion.
Le glaucome pourrait être la plus difficile des trois maladies à traiter par thérapie cellulaire. Des cultures de cellules souches embryonnaires peuvent produire les cellules ganglionnaires nécessaires, mais dans l'œil postnatal, le nerf optique ne se reforme pas spontanément. Autrement dit, une fois les cellules ganglionnaires transplantées, on ne sait pas connecter leurs axones (les prolongements des neurones qui forment le nerf optique) aux cellules cérébrales.
Notre méthode a décuplé les possibilités des tissus formés à partir de cellules souches embryonnaires. Reste à découvrir ce qu'elle peut nous apprendre sur les mécanismes qui conduisent d'une cellule unique à un organe aussi complexe que l'œil...
BIBLIOGRAPHIE
Y. Sasai (2013). – Une rétine en culture. Pour la Science, n° 426 avril 1993, pp. 58-63.
T. Nakano et al. (2012). - Self-formation of optic cups and storable stratified neural retina from human ESCs, Cells Stem Cell, vol. 10, pp. 771-785.
D Schwartz et al. (2012). - Embryonic stem cell trials for macular degeneration : a preliminary report, Lancet, vol. 379, pp. 713-720, 2012.
M. Eiraku et al. (2011). - Self-organizing optic-cup morphogenesis in three-dimensional culture, Nature, vol. 472, pp. 51-56.
Les alternatives thérapeutiques aux cellules souches
par Serge Picaud et José Sahel, Institut de la vision, Paris
Si les cellules souches ouvrent de nouvelles perspectives thérapeutiques pour les patients aveugles, une autre technique en est déjà au stade commercial : celle des prothèses rétiniennes. Ces dispositifs visent à stimuler artificiellement une rétine ayant perdu ses photorécepteurs. Les images, filmées par une caméra fixée sur une paire de lunettes, sont d'abord transformées en matrices d'impulsions électriques. Celles-ci sont ensuite transmises à des électrodes implantées sur la rétine résiduelle (voir la figure ci-dessous).
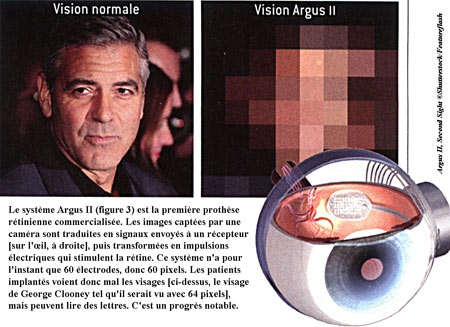
Commercialisée depuis deux ans en Europe, la première prothèse rétinienne opérationnelle a reçu l'autorisation de mise sur le marché aux États-Unis en février 2013. En France, quatre patients aveugles ont participé aux essais cliniques. Cependant, les images perçues ne sont constituées que de 60 points ou pixels, puisque l'implant n'a que 60 électrodes : c'est insuffisant pour bien voir une image complexe, tel un visage, mais suffisant pour une image simple, de sorte que certains patients sont capables de lire des lettres d'environ 10 centimètres de hauteur.
De nombreux chercheurs tentent d'augmenter le nombre de pixels, chaque électrode devant activer une zone disjointe de sa voisine. Ainsi, à l'Institut de la vision, on poursuit plusieurs objectifs : le développement de nouvelles formes tridimensionnelles pour les implants, avec l'ESIEE (École supérieure d'ingénieurs en électrotechnique et électronique) et le CEA; l'utilisation de matériaux semi-conducteurs différents, tels le graphène et le diamant (projet européen NEUROCARE) ; l'amélioration du codage des informations visuelles.
Une piste alternative, la thérapie optogénétique, est inspirée d'algues unicellulaires et de bactéries dotées de protéines photosensibles. Ces protéines sont des canaux ioniques dont l'ouverture est contrôlée par la lumière. L'idée est d'insérer le gène qui les code dans les neurones non photosensibles de la rétine, qui pourraient alors être activés par la lumière.Ainsi, chaque cellule produisant les protéines jouerait le rôle d'un pixel. Ces protéines étant moins performantes que nos pigments visuels, les aveugles devront porter des lunettes rehaussant la luminance.
Ainsi, dans le cadre du projet européen RETICIRC, nous avons rendu la vue à des souris aveugles grâce à une protéine bactérienne. Nous avons ensuite montré que cette protéine permet l'activation de cellules rétiniennes humaines par la lumière, grâce à des cultures de cellules prélevées post mortem. Avant de passer à une application clinique, nous devrons vérifier que la thérapie génique visant à faire exprimer la protéine bactérienne n'entraîne pas d'inflammation ou de rejet chez le primate.
[1] Yoshiki SASAI est directeur du groupe d'organogenèse et de neurogenèse au Centre de biologie du développement du RIKEN, à Kobe, au Japon. Plus d'information sur Y. Sasai et ses recherches.
12:05 Publié dans Biologie, Médecine | Tags : cellules souches embryonnaires, rétine, culture organotypique, macula, dmla, rétinopathie pigmentaire, glaucome, prothèse rétinienne | Lien permanent | Commentaires (2) | ![]() Facebook | | |
Facebook | | |



Commentaires
Écrit par : colubi ersilia | 21/07/2013
Écrit par : colubi ersilia | 21/07/2013
Les commentaires sont fermés.