05/10/2016
CRISPR-Cas9, une technique d'édition génétique : découverte scientifique de l'année 2015
 CRISPR-Cas9,
CRISPR-Cas9,
une technique d'édition génétique :
découverte scientifique de l'année 2015
(Dernière mise à jour 29 janvier 2018)
La prestigieuse revue Science a décerné son prix de la découverte scientifique de l'année 2015 à Crispr-Cas9, une technique d'édition génétique aussi prometteuse qu'inquiétante.
Vue d'artiste de la technique de modification génétique Crispr-Cas9
Infographie Sciences et Avenir ©Stephen Dixon/Fen Zhang
Le scalpel de la génétique, c'est l'un des surnoms donnés à la technique Crispr (prononcer krisper) que la revue Science vient de désigner comme la découverte scientifique de l'année 2015. Et pour cause, ce procédé d'édition génétique simple, dont la précision est à ce jour inégalée, devrait donner un coup d'accélérateur aux recherches en thérapie génique. Avec en ligne de mire, la possibilité de faire disparaître des maladies génétiques héréditaires voire certains cancers pour lesquels la prédisposition génétique est prépondérante. Particulièrement simple d'utilisation, la technique CRISPR-Cas9 tend à rendre les recherches en génie génétique plus accessibles dans les laboratoires du monde entier.
Le "couteau suisse" de la génétique
Apparu dans le radar des laboratoires en 2012 seulement, CRISPR-Cas9, ce petit outil moléculaire est déjà en train de marquer l'histoire. Cet outil regroupe le nom d'une grosse protéine (Cas9) et un acronyme CRISPR (Clustered Regularly interspaced Short Palindromic Repeats, pour "courtes séquences palindromiques répétées, groupées et régulièrement espacées").
Concrètement, la technique permet de neutraliser les propriétés de gènes défaillants dans l’ADN d’un individu. Les CRISPR sont des séquences répétitives d’ADN. La technique utilisant ces CRISPR permet de couper une séquence spécifique d’ADN afin de la remplacer par une autre. Associée à la protéine Cas9, une enzyme spécialisée pour couper l'ADN, l'outil s'apparente alors à un véritable "couteau suisse génétique" ; un ciseau moléculaire qui permet de couper, copier et coller des séquences d'ADN.
Inspirée d'un mécanisme utilisé par les bactéries pour lutter contre les virus, la technique permet de couper l'ADN à des endroits bien définis. Elle couple des ciseaux moléculaires (l'enzyme Cas9) à un "guide" qui va les diriger vers une région bien précise du génome. Ce guide est un petit brin d'ARN que l'on peut changer à l'envi. Si l'on met un brin d'ARN complémentaire à un fragment de gène donné (d'ADN), les ciseaux découperont ce fragment de gène et lui seul. Il s'agit donc d'une technique de détection (de la zone du génome visé) et de découpe de l'ADN. En pratique, il suffit aux chercheurs de fabriquer des ARN "guide" et de les arrimer à l'enzyme Cas9: une préparation beaucoup plus rapide et nettement moins coûteuse que les méthodes classiques. Grâce à cette technique, les chercheurs peuvent très facilement supprimer l'activité de certains gènes (ce qui aide par exemple à découvrir leur fonction), éliminer des gènes néfastes ou déficients, ou en insérer de nouveaux. Déjà de plus en plus utilisée en recherche fondamentale, cette technique pourrait servir des applications médicales. Il a été montré expérimentalement en 2014 qu'on pouvait soigner des maladies génétiques grâce à ces ciseaux moléculaires de dernière génération. Des applications médicales sont donc déjà à l'étude pour la thérapie génique, mais aussi, par exemple, pour la conception de nouveaux antibactériens.
Mais la technique est aussi prometteuse qu'inquiétante. Car si elle laisse entrevoir la possibilité de guérir des maladies en s'attaquant directement à leur origine génétique, elle introduirait par là même une modification du patrimoine héréditaire de l'espèce humaine. Car modifier un embryon humain pour supprimer le ou les gène(s) de telle maladie, c'est aussi modifier toute sa descendance potentielle. Un acte qui fait ressurgir les problèmes éthiques liés à l'eugénisme et qui est à l'heure actuelle interdit par la convention d’Oviedo, ratifiée par la France et 28 autres pays européens en 2011.
Vue d'artiste de la technique de modification génétique Crispr-Cas9
Infographie Sciences et Avenir ©Stephen Dixon/Fen Zhang
Ainsi, les travaux de généticiens chinois publiés en avril 2015 ont-ils rouvert le débat sur la manipulation génétique appliquée aux humains. Ces scientifiques ont en effet testé pour la première fois cet outil d'ingénierie génétique sur des embryons humains afin de faire disparaître une maladie monogénique (due à un seul gène défectueux). La tentative qui portait sur des embryons non viables a certes échoué, mais a fait relancer le débat aux États-Unis. Le retentissement a été moindre en France, notamment en raison de la convention d'Oviedo.
Nous résumions ainsi la montée en puissance de cette technique : "Puissante, précise, peu onéreuse, CRISPR a toutes les qualités... et un défaut inhérent : avec elle, n'importe quel apprenti sorcier pourrait modifier l'être humain"... Prometteur et inquiétant donc.
Une découverte franco-américaine
Si la revue Science désigne aujourd'hui CRISPR-Cas9 comme découverte scientifique de l'année 2015, c'est plus en raison de sa popularité croissante au sein des laboratoires et des débats qu'elle a provoqués suite à l'expérience menée par les chercheurs chinois. Car la technique à proprement parler a été développée en 2012 par la Française Emmanuelle Charpentier et l'Américaine Jennifer Doudna (en photo ci-dessous). Nombreux sont ceux à penser dans la communauté scientifique que ces deux femmes pourraient finir par récolter un prix Nobel pour leurs travaux.

La Française Emmanuelle Charpentier (à gauche) et l'Américaine
Jennifer Doudna sont les co-inventrices de la technique Crispr-Cas9
©MIGUEL RIOPA / AFP
Aller dans l'ADN, trouver un gène, le supprimer, sauvegarder : ce que les traitements de texte font avec la fonction "rechercher-couper", la génétique sait désormais le faire avec CRISPR-Cas9 ! Soit une grosse molécule capable de couper des gènes, associée à un petit ARN qui lui dit où couper dans l'ADN. Grâce à cet outil, tout devient possible : modifier le patrimoine d'une lignée, ressusciter une espèce disparue, doper nos gènes… Déjà, les projets d'édition du vivant se multiplient. Sauf que CRISPR-Cas9 n'est pas seulement un formidable progrès : il ouvre la voie à toutes sortes de "bricolages", d'autant plus qu'il est très facile à utiliser... Animal, végétal, humain... Toutes les branches du vivant pourront être façonnées par un seul et même outil génétique qui agira, non seulement sur le patrimoine d'un seul individu, mais également sur le patrimoine de toute sa descendance.
En trois années à peine, CRISPR-Cas9 a gagné ses galons de d'outil révolutionnaire. Il ne se passe pas une journée sans qu'un article d'un chercheur n'ouvre une nouvelle application dans des domaines aussi divers que la médecine, l'agronomie, l'industrie, etc. Pas un mois sans qu'une grande instance scientifique ne publie un avis sur son utilisation. Car CRISPR-Cas9 va vite, très vite. À tel point que face à ses exploits, les généticiens eux-mêmes sont pris de vertige devant les possibilités qui s'offrent désormais à eux. Un vertige qui risque également d'étreindre chacun d'entre nous...
Un outil "d'édition génétique"
De quoi s'agit-il au juste ? D'un outil "d'édition génétique". Exactement comme les logiciels de traitement de texte (type Word) permettent d'éditer en un tournemain n'importe quel texte, grâce aux touches magiques pour rechercher (ctrl F), couper (ctrl X), coller (ctrl V), etc.
Car c'est exactement ce que permet de faire CRISPR-Cas9, mais transposé à la génétique : il édite le texte qui, pour chaque être vivant, contient le manuel d'instructions à l'origine de sa construction, le livre d'histoire dans lequel figurent les multiples rebondissements de son évolution, ainsi que la fiche médicale qui prédit quelles maladies pourraient le menacer ou décimer son espèce. On l'a compris : ce texte, c'est l'ADN. Pour l'espèce humaine, il équivaut à plus de 3 milliards de lettres. Or, jusqu'à présent, pour travailler sur ce texte, la "barre d'outils" manquait à l'appel. Jusqu'à l'arrivée de CRISPR-Cas9.
"Le monde entier a sauté dessus !", explique Emmanuelle Charpentier (Institut Max-Planck, Allemagne), la microbiologiste française dont la première publication sur le sujet, en juin 2012, est à l'origine de cet engouement planétaire. "C'est un moyen pour les scientifiques d'insérer ou de supprimer des bouts d'ADN avec une précision incroyable, ce qui permet de réaliser des choses jusque-là impossibles...", explique encore, lors d'une conférence, la biochimiste américaine Jennifer Doudna, codécouvreuse avec la Française de la puissance de CRISPR-Cas9. "Tous ceux qui voulaient faire de l'édition localisée l'ont essayé, détaille Anthony Perry (université de Bath, Royaume-Uni), qui l'a expérimenté chez l'embryon de la souris. Et il est vite apparu que ça marchait partout: chez les bactéries, chez les plantes, les levures, les mammifères. .. et maintenant sur l'humain. C'est une technologie incroyablement flexible et adaptable. "
CRISPR-Cas9 : une révolution qui couronne 60 ans de découvertes
Qui aurait pu imaginer cela en 1987 ?
À l'époque, des chercheurs japonais remarquent, sans comprendre à quoi elles servent, que le génome de nombreuses bactéries porte de courtes séquences d'ADN identiques et répétées. Ce sont les CRISPR, à peine découvertes... aussitôt oubliées pendant vingt longues années. Comment en est-on arrivé là ?
1953 : Découverte de la structure en double hélice de l'ADN
1965 : Des ciseaux protéiques capables de couper l'ADN sont révélés chez des bactéries, mais on ne peut pas encore choisir ni intervenir.
1972 : Première transgenèse : un fragment d'ADN de virus est inséré dans celui d'une bactérie.
1982 : naissance du premier animal transgénique.
1991 : premier essai non concluant de thérapie génique.
Années 1990 : Les méganucléases sont développées. Elles coupent l'ADN en des points précis, mais restent difficiles à créer et à utiliser.
2001 : Fin du séquençage du génome humain après treize ans et un investissement de 2,7 milliards d'euros.
2002-2010 : Amélioration des ciseaux coupant l'ADN : nucléases en doigt de zinc (ZFN) et TALE qui restent chères.
Juin 2012 : Découverte du potentiel du système CRISPR-Cas9.
C'est alors qu'en tentant d'améliorer ses ferments lactiques, une entreprise agroalimentaire danoise comprend qu'il s'agit d'un système de défense des bactéries contre les virus. Ces petites séquences d'ADN répétées correspondent en fait à des échantillons du génome de virus ayant attaqué la bactérie par le passé. L'ensemble constitue une sorte d'archivage du profil génétique de ses anciens assaillants.
II faut encore attendre 2012 pour qu'Emmanuelle Charpentier et Jennifer Doudna comprennent les rouages et l'intérêt de ce système. Comme n'importe quel gène, chaque séquence CRISPR — qui contient donc de l'ADN viral — est transcrite an petites molécules intermédiaires, les ARN. Mais plutôt que d'être traduits en protéines, ces ARN sont libérés dans la bactérie et deviennent des sentinelles : chaque ARN patrouille en formant un attelage avec une grosse molécule, appelée Cas9, qui est une sorte de ciseaux à ADN. À eux deux, ils sont redoutables : dès qu'un virus pénètre dans la bactérie, Cas9 se fixe sur son ADN, le parcourt, et si son profil correspond à celui de l'ARN sentinelle, Cas9 s'arrête et le découpe, signant l'arrêt de mort de l'ennemi.
Révélation suprême : les deux chercheuses comprennent que cet outil CRISPR-Cas9 peut être détourné de sa fonction et modelé à l'envi. En laboratoire, il est possible de créer des attelages à foison, en associant la grosse protéine Cas9 à l'ARN de son choix : préalablement repéré, celui-ci peut servir de tête chercheuse, amenant les ciseaux de Cas9 là où on le désire.
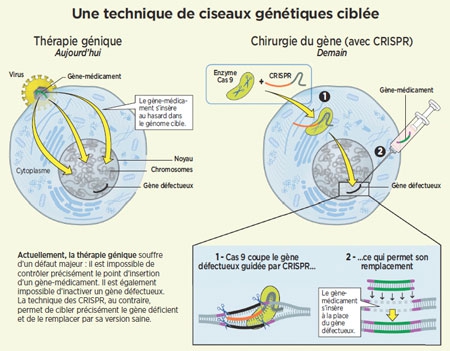
Infographie ©Betty Lafon/Sciences et Avenir
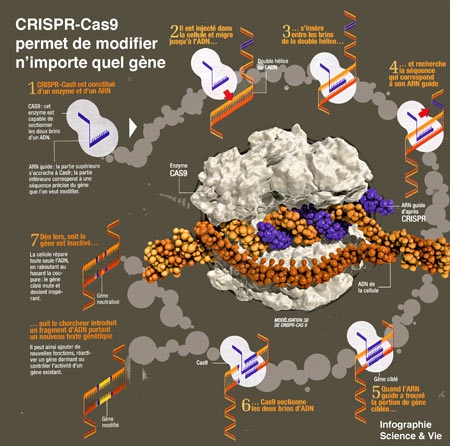
En pratique, une fois injectés dans une cellule, Cas9 et son guide se fixent sur l'ADN local et le parcourent rapidement… Un peu à la manière de la fonction "rechercher" du traitement de texte, qui passe au crible chaque ligne. Une fois que l'ARN a trouvé la séquence qui lui correspond, Cas9 entre en scène pour couper l'ADN de la cellule. Cette coupure, c'est pour sa machinerie interne le signal qu'il faut lancer des réparations : soit elle colmate la brèche en remettant du texte comme elle peut, ce qui interrompt, et du coup neutralise le gène ; soit elle y copie un nouveau texte fourni par le chercheur, corrigeant ainsi une erreur ou lui attribuant une nouvelle fonction (voir l'infographie ci-dessous). Avec cette découverte, tout devient possible : créer des espèces qui résisteront au changement climatique ; empêcher un insecte de transmettre une maladie... Et comme cela fonctionne chez toutes les espèces vivantes, l'outil n'a pas d'autre limite que l'imagination humaine !
Principe de la technique CRISPR-Cas9
(Cliquez sur l'image pour l'agrandir)
On le pressent, les plus merveilleuses découvertes émergeront de cette révolution... Mais dans le même temps, voici ouverte la porte aux apprentis sorciers. Avec CRISPR-Cas9, le pouvoir de l'homme sur le vivant est désormais sans commune mesure, pour le meilleur comme pour le pire. En devenant éditeur de la nature, l'être humain a maintenant les moyens de se prendre pour Dieu... Surtout que la simplicité de construction de ce nouveau venu de la génétique est l'un de ses atouts majeurs : pour un laboratoire, concevoir et fabriquer son CRISPR-Cas9 est l'affaire de quelques jours seulement et de quelques dizaines de dollars ! Quand les outils disponibles jusqu'à présent (les enzymes en doigt de zinc et TALEN) nécessitaient des dizaines de milliers de dollars et des mois, ou même des années de préparation (voir la chronologie ci-dessus).
Légitimement, ce foisonnement commence à faire froncer les sourcils, notamment ceux de Jennifer Doudna. C'est en découvrant l'an dernier les travaux d'un étudiant qui utilisait un virus pour injecter CRISPR-Cas9 chez une souris afin d'y développer un cancer humain, que la biochimiste s'est dit qu'il était temps de prendre le temps de réfléchir à ce qui était en train de se passer...
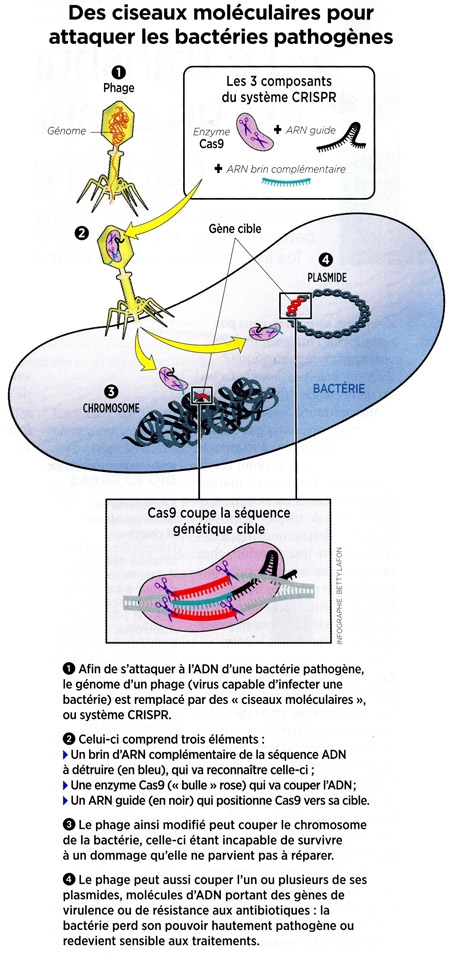
CELA POSE DES QUESTIONS ÉTHIQUES
Le ciblage d'une zone précise de l'ADN est-il toujours aussi parfait qu'attendu ? Intègre-t-on toujours les corrections voulues ? Des dommages collatéraux sont-ils à craindre ? Les généticiens doivent être vigilants car la moindre erreur peut entraîner des cancers ou désactiver des gènes importants. C'est pourquoi la question d'un moratoire est dans l'air... mais tous n'y adhèrent pas.
"Le défi est de montrer que les bénéfices surpassent les risques", note l'emblématique et toujours très provocateur George Church, généticien à Harvard, qui se définit comme un inquiet professionnel, et dont les (nombreux) laboratoires se sont lancés dans une course à l'amélioration de CRISPR-Cas9 (Interview ci-dessous).
L'innovation technologique est la meilleure arme
au service de la biosécurité
par George Church, professeur de génétique à la Harvard Medical School
Science & Vie : Diriez-vous que CRISPR-Cas9 est vraiment une révolution ?
George Church: L'époque est en train de réaliser ce dont je rêvais jeune chercheur ! En deux ans et demi, CRISPR-Cas9 a apporté à la fois un gain de temps et de précision, et un effondrement du coût. À ce niveau-là d'accélération, on peut dire que c'est une révolution !
S&V: Une équipe chinoise vient de corriger des gènes d'embryons humains, faut-il aller plus loin ?
G.C. : Sécurité et éthique sont indissociables : il faudrait d'abord montrer que c'est sûr et efficace sur les embryons d'animaux, ce qui n'a pas été fait. Ensuite, il sera peut-être possible d'intervenir sur l'embryon humain, mais uniquement pour régler un problème insoluble autrement. Comme permettre à des malades de la mucoviscidose d'avoir des enfants ensemble. Quand ces conditions seront réunies, la société devra décider si la science doit aller de l'avant ou pas.
S&V: Et dans le champ de l'environnement ?
G.C. : C'est très prometteur. On peut envisager de réécrire le génome d'espèces menacées, animales et végétales, pour mieux les adapter à l'environnement, leur permettre résister à certaines maladies ou simplement leur redonner de la diversité génétique.
S&V : Une contamination du monde sauvage par des organismes modifiés en laboratoire est-elle à craindre ?
G.C.: Être innovant n'empêche pas d'être prudent. Au contraire même ! Par exemple, si nous créons une bactérie que nous ne voulons pas voir se répandre dans l'environnement, on peut lui mettre une "laisse biologique" très courte, en la rendant génétiquement dépendante d'un composé chimique introuvable dehors du laboratoire. Il lui sera alors impossible de survivre dans la nature. D'une certaine façon, l'innovation technologique est la meilleure arme au service de la biosécurité.
Même chose du côté de Jennifer Doudna, qui s'attelle, elle, à mieux comprendre le fonctionnement de CRISPR-Cas9. Elle vient d'en décrire plusieurs versions issues de différentes bactéries. Quand d'autres équipes sont déjà à la recherche de son successeur et viennent d'annoncer la découverte de nouveaux ciseaux, Cpfl, a priori encore plus faciles à utiliser que Cas9...
"Depuis deux ans et demi, il y a un nouveau joueur dans le secteur, appuie Anthony Perry. Il est incroyablement prometteur, et il serait inconcevable de s'interdire de l'étudier, de rejeter cette promesse. " En témoignent les neuf exemples qui suivent : chacun donnant un aperçu d'un raz de marée où innovation, espoir et questionnement vont de concert...
Les neuf promesses de CRISPR-Cas9
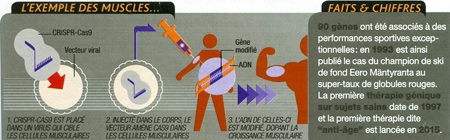
1. Optimiser les gènes pour doper les individus
Ne plus faire avec ce que la nature nous a donné. Ne plus se contenter de la grande loterie génétique, qui dote chacun d'un patrimoine unique, hérité de nos parents et de leurs ancêtres. Qui n'a jamais rêvé de pouvoir un jour rebattre ses propres cartes génétiques pour devenir plus beau, plus intelligent, rester jeune plus longtemps... Une quête d'amélioration millénaire et profondément humaine. Or, jusqu'ici, on s'améliorait soi-même surtout par l'effort ; un coup de pouce extérieur pouvant toutefois venir de la chirurgie ou de diverses pilules offrant ponctuellement de doper mémoire ou endurance...
Éditer le génome d'un adulte
Et si on pouvait faire des modifications de fond ? S'approprier définitive ment les bonnes bases génétiques et les intégrer à certains de nos organes ? C'est la perspective qu'ouvre CRISPR-Cas9 : pouvoir retoucher les paragraphes qui déterminent nos capacités physiques et intellectuelles au sein du texte génétique présent dans chacune de nos cellules.
La plupart d'entre nous possèdent des gènes, certes, tout à fait fonctionnels, mais pas forcément dans leur version la plus "performante", soulignait récemment le généticien George Church. Un constat qui ouvre des perspectives d'optimisation énormes. Éditer le génome d'un adulte ferait alors simplement appel aux techniques mises au point pour la thérapie génique (la promesse n° 2), avec des virus modifiés et des "transporteurs" microscopiques capables de délivrer le gène d'intérêt dans les bonnes populations de cellules, Cas9 se chargeant de l'intégration.
George Church, lui-même à la tête de plusieurs équipes, étudie ainsi le patrimoine génétique des supercentenaires pour y découvrir les secrets d'une jeunesse qui dure. Et il évoque régulièrement une liste de 10 versions rares de gènes aux effets positifs. Dont six augmenteraient la résistance aux maladies cardio-vasculaires (PCSK9), aux cancers (GHR, etc.), aux diabètes (SLC30A8, IFIH1), à Alzheimer (APP) ou aux virus (CCR5, FUT2, etc.)... Soigner c'est bien, mais qui n'aimerait pas bénéficier d'office de protections contre ces fléaux ?
Les possibilités de correction et la facilité d'utilisation de CRISPR-Cas9 peuvent aussi concerner d'autres types de gènes comme ABCC11, qui régule l'odeur corporelle ; SCN9A, qui réduit la sensibilité à la douleur ; LRP5, qui confère une ossature plus dense, et MSTN, une musculature plus robuste ; IGF1 et MGF, qui codent des hormones impliquées dans le développement musculaire ; EPO, qui favorise la production de globules rouges dans le sang, etc. Tous sont déjà étudiés pour des raisons médicales, mais leur usage pourrait largement dépasser ce cadre...
Infographie Sciences & Vie
Pour zoomer, cliquer sur l'image
De nombreux spécialistes ne manquent pourtant pas de rappeler que si CRISPR-Cas9 se révèle un bistouri hors pair, tout n'est pas si simple ! Hormis pour quelques gènes très étudiés dans le cadre de maladies héréditaires, il est aujourd'hui presque impossible de relier clairement un gène à un trait précis : notre connaissance, de l'énorme capharnaüm des interactions génétiques n'en est qu'à ses débuts. Ainsi, même les effets des gènes liés au développement musculaire restent largement inexpliqués. Pour preuve, le bétail chez qui IGF1 avait été amélioré : les bêtes ont d'abord développé une musculature hypertrophiée, qui a ensuite dégénéré sans explication...
Avant de s'aventurer à augmenter notre Q.I. ou notre taille, même si techniquement ils sauraient le faire, les généticiens rappellent qu'il faudra déjà savoir parfaitement "quoi" faire et "où", avec quelles conséquences et quelles garanties... que le mieux ne devienne pas l'ennemi du bien !
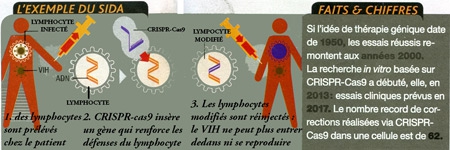
2. Soigner toutes les maladies
Maladies génétiques, cancers, sida... En moins de deux ans, CRISPR-Cas9 a convaincu des dizaines de laboratoires que c'est peut-être lui qui va enfin apporter un avantage décisif contre ces fléaux. Avec cet outil révolutionnaire, les médecins espèrent en effet réussir à réaliser une "chirurgie réparatrice" de l'ADN.
Soigner en corrigeant les gènes ? L'idée n'est pas nouvelle — c'est le concept fondateur de la thérapie génique —, mais sa mise en œuvre reste problématique. Près de 2000 essais cliniques sont pourtant en cours dans le monde, montrant que cette médecine génétique pourrait non seulement traiter des maladies génétiques, mais aussi, et surtout, des maladies dans lesquelles l'implication des gènes paraît moins évidente: cancers, troubles cardiovasculaires ou neurologiques, maladies auto- immunes ou même infectieuses.
Une fascinante polyvalence
De très nombreux domaines de la médecine s'ouvrent donc à CRISPR-Cas9 et s'en trouvent bouleversés. Les équipes qui s'étaient tournées vers les premiers outils d'édition génétique (nucléases en doigt de zinc et TALE) se laissent séduire par ce nouveau venu. Histoire de démultiplier leurs possibilités tout en resserrant drastiquement temps et coûts.
Yuet Wai Kan, de l'université de Californie, tente ainsi de développer la résistance au sida de nos lymphocytes T, acteurs clés de notre système immunitaire. Lors d'une infection, le virus les pénètre en se fixant sur la protéine CCR5, ruinant notre défense. Mais la découverte d'individus chez lesquels CCR5 avait muté, et capables de résister au sida, a fait naître l'espoir de soigner en recréant chez les malades la même "anomalie"...
Infographie Sciences & Vie
Pour zoomer, cliquer sur l'image
Pour ce faire, l'équipe américaine a déjà une idée de protocole. La première étape, presque banale, consiste à prélever des celIules chez le patient pour les transformer en cellules souches. La seconde, elle, est inédite : il s'agit de mimer à l'intérieur la mutation naturelle protectrice et les retransformer en cellules sanguines résistantes au virus. Ce que Yuet Wai Kan vient de réussir grâce à CRISPR-Cas9 !
Prochaine étape ? Obtenir et réinjecter chez un patient ses propres cellules souches réécrites pour qu'il génère lui-même ses lymphocytes T résistants. Le virus du sida, incapable de pénétrer les cellules qui lui servent de base arrière, serait alors bloqué.
Et pour "nettoyer" les cellules qui seraient malgré tout infectées, d'autres équipes envisagent d'utiliser CRISPR-Cas9 pour traquer et détruire l'ADN du virus jusque dans nos cellules T.
Ces pistes fascinantes ne sont pas les seules ! La lutte contre le cancer en est une autre. Le petit outil génétique permettrait de modifier PD-1, une autre protéine de surface des lymphocytes T, pour les pousser à attaquer les cellules tumorales ; ou de transformer des animaux pour qu'ils développent des cancers similaires aux nôtres, permettant de mieux les étudier et tester plus vite des traitements.
Même les bactéries les plus dangereuses pourraient reculer devant la polyvalence de CRISPR-Cas9 : plusieurs équipes cherchent par exemple comment rétablir de force leur sensibilité aux antibiotiques, ou comment s'attaquer directement à leur ADN.
Enfin, sont bien sûr concernées les maladies génétiques, pour lesquelles les premières thérapies géniques furent mises au point. La mutation de cellules intestinales de patients atteints de mucoviscidose a ainsi été corrigée en laboratoire ; et le premier essai de CRISPR-Cas9 contre l'amaurose de Leber (qui entraîne la cécité en quelques années) est prévu en 2017. Le début d'une longue série...
La découverte d'un gène muté résistant au sida fait naître l'espoir de créer la même anomalie chez des malades (ici une cellule T attaquée par le VIH).
3. Éradiquer les espèces nuisibles
Espèces invasives, insectes ravageurs, parasites... Et si on pouvait s'en débarrasser par une simple modification génétique ? La technique de gène drive, adaptée du système CRISPR-CasQ (lire la promesse n° 7, p. 58), permet en effet de répandre très rapidement un nouveau gène dans une population naturelle, "même quand il est délétère pour elle", affirme Austin Burt (Impérial Collège, Londres). "Le crapaud buffle, qui est un ravageur terrible en Australie, pourrait être une cible", propose Owain Edwards, du Centre national de la recherche australien. Kevin Esveit, à Harvard, envisage, lui, "d'éradiquer le parasite responsable de la bilharziose, deuxième maladie tropicale la plus mortelle après le paludisme". Quels gènes tueurs utiliser ? Soit des gènes mutés, qui diminuent la viabilité de l'espèce en retirant, par exemple, au crapaud buffle sa capacité à produire une toxine qui le défend des prédateurs ; soit "un gène qui détruit les spermatozoïdes contenant le chromosome 'femelle', ne provoquant ainsi plus que des "naissances de mâles", propose Austin Burt. Au risque d'éliminer l'espèce même là où il ne faut pas. Une autre solution serait donc de la rendre génétiquement sensible à un produit qui ne serait épandu que là où on veut s'en débarrasser.

Infographie Sciences & Vie
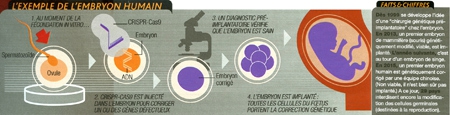
4. Corriger le patrimoine génétique de toute sa descendance
L'annonce par une équipe chinoise, en avril 2015, de la première correction de gène dans un embryon humain a fait l'effet d'une bombe. Voilà l'application de CRISPR-CasQ qui fascine le plus et fait déjà le plus frémir : le "bébé sur commande"... Et si l'on pouvait choisir ? Sélectionner pour nos enfants les gènes les plus efficaces et écarter leurs contreparties faiblardes, voire ceux causant ou risquant de causer des maladies parfois incurables — cancers, mucoviscidose...
Derrière le fantasme, l'espoir est bien réel pour les parents porteurs de graves maladies génétiques, qui pensent enfin tenir là un moyen de s'assurer que leur progéniture, et sa propre descendance, resteront indemnes. Indéniablement, CRISPR-CasQ est venu bouleverser le champ des possibles. Jusqu'à présent, les techniques utilisées en laboratoire pour modifier l'ADN (expérimentées en thérapie génique) ont toujours eu pour limite la manipulation de l'embryon humain. Trop lourdes, elles avaient en effet plus de risques de provoquer sa destruction que de modifier son patrimoine. Avec CRISPRCas9, la technique n'est plus un obstacle insurmontable. C'est désormais l'éthique qui pousse à la prudence, la frontière de l'eugénisme n'étant jamais loin. Déjà, les diagnostics préimplantatoires permettent d'identifier un embryon (issu d'une fécondation in vitro) sain, non porteur d'une maladie génétique, avant de l'implanter dans l'utérus de la mère. Mais avec CRISPR-CasQ, c'est un pas de géant qui est franchi : celui qui, au-delà du simple choix d'un embryon, permettra d'en réécrire le patrimoine génétique à loisir. Avec une possible action à double détente: non seulement l'enfant à venir sera modifié, mais aussi sa future descendance !
Une méthode très polémique...
Cet exploit, la communauté scientifique s'y attendait, mais pas si tôt. Dès 2013, pourtant, des embryons de souris étaient "édités" ; en 2014, c'étaient les macaques qui étaient visés. Cette fois, c'est au tour de notre espèce. Théoriquement, il devient possible de modifier le génome d'un embryon et, en cascade, ceux des générations suivantes...
Sauf que l'emballement médiatique autour de cette possibilité et du premier essai chinois dépasse le cadre de l'étude elle-même. "Attention aux amalgames, prévient Anthony Perry, généticien à l'université de Bath (Royaume-Uni) et spécialiste de l'embryogenèse. L'objectif de l'équipe chinoise n'était pas de réimplanter ces embryons modifiés chez des femmes et donc de modifier une lignée germinale [cellules destinées à la reproduction].
Comme ce fut le cas pour les premiers clonages d'embryons humains, la recherche a ici pour but d'améliorer les connaissances sur le développement et le fonctionnement des organes, et non de faire naître des enfants clones ou modifiés.
... et qu'il faut encore fiabiliser
"Choquante" pour beaucoup, cette étude est néanmoins une réussite. L'équipe de Junjiu Huang, généticien à l'université Sun Yat-sen, a en effet réussi à éditer 28 embryons sur 86 (anormaux et non viables, issus d'avortements) au niveau du gène de la β-globine, dont les mutations sont liées à des maladies sanguines. Pour guider l'enzyme Cas9 dans sa coupe, trois ARN guides, ciblant tous le même gène mais chacun dans une région différente de l'ADN, ont été testés afin d'évaluer leur efficacité respective, le déroulement de la coupure du gène et son taux de réussite. Les résultats montrent que ce dernier n'est pas énorme et que des coupures ont eu lieu... hors du gène visé. Il faut donc souligner que la technique sera encore soumise à des années de recherche pour bannir ces erreurs ainsi que l'"effet mosaïque", par lequel cellules "originelles" et transformées se mêlent.
Infographie Sciences & Vie
Pour zoomer, cliquer sur l'image
Mais déjà, des améliorations s'esquissent: "En injectant, chez la souris, CRISPR-Cas9 en même temps que le sperme dans un ovule, nous avions obtenu une édition beaucoup plus efficace, souligne Anthony Perry. Et cette approche, qui résout une bonne partie du problème de l'effet mosaïque, reprend la même procédure que la fécondation in vitro avec micro-injection du sperme, très courante en procréation assistée." Une avancée qui doit en appeler d'autres afin de fiabiliser définitivement la technique.
Tout ça pour quoi, au final ? Les cas où le recours à une telle technologie s'imposerait pourraient en effet être très rares. Ce sont des couples porteurs de maladies génétiques incurables, même par thérapie génique classique, et pour lesquels le diagnostic préimplantatoire ne permettrait pas de trouver d'embryon sain. Mais ensuite, où s'arrêter ? La réponse sort du domaine de la médecine pour lorgner vers celui de l'amélioration. Outre le fait que la technologie n'est pas prête, à ce niveau-là, ce sera à la société et aux parents de faire leur choix, et non plus à la science.
5. Produire des OGM mais sans ADN étranger
Blé, sorgho, riz, tomates, oranges... mais aussi veaux, vaches, cochons, chèvres ou moutons : ces dernières années, CRISPR-Cas9 a démontré son pouvoir sur d'innombrables espèces agricoles. Et si, pour l'instant, les caractères sur lesquels travaillent industriels et chercheurs ne sont pas nouveaux (résistance à un herbicide ou à une maladie, enrichissement nutritionnel...), à l'avenir, d'importants changements sont à prévoir dans le paysage agricole.
D'abord, il devient possible de modifier plusieurs gènes à la fois, ce qui ouvre la possibilité, bien qu'encore théorique, de conférer aux espèces des caractères plus complexes, comme "améliorer la qualité nutritionnelle des huiles en modifiant leur contenu en différents oméga", imagine Jean-Stéphane Joly (CNRS/Inra).
Ensuite, le lieu d'insertion d'un gène étranger (provenant d'une espèce voisine, d'une bactérie...) n'est plus aléatoire : c'est un endroit précis, ciblé, de l'ADN de la plante ou de l'animal. De quoi diminuer le risque de perturbation accidentelle de l'organisme par insertion délétère dans une zone importante du génome.
Suffisant pour rassurer quant à la consommation d'OGM ? Rien n'est joué : "Nous n'avons aucune preuve de l'innocuité des produits issus de cette technique", alerte Christophe Noisette, membre fondateur de l'association Inf'OGM.
Infographie Sciences & Vie
Pour zoomer, cliquer sur l'image
Le statut d'OGM questionné
Enfin, et surtout, CRISPR-Cas9 permet le développement de nouveaux caractères, non plus seulement en insérant des gènes étrangers, mais aussi, simplement, en inactivant ou modifiant un ou des gènes déjà présents via des mutations ponctuelles.
En 2014, des chercheurs chinois ont ainsi rendu du blé tendre résistant à une maladie, l'oïdium, en inactivant les gènes qui inhibaient les défenses naturelles de la plante.
Cette différence de méthode pourrait avoir une conséquence très importante : les espèces obtenues grâce à ces mutations ponctuelles pourraient ne pas être considérées comme des OGM, car de tels phénomènes peuvent se produire naturellement dans un organisme. Le ministère de ['Agriculture américain a déjà fait le choix de ne pas considérer comme OGM ces plantes ne portant pas d'ADN étranger, tandis que la Commission européenne devait rendre ses conclusions sur la question fin 2015. Si celles-ci allaient dans le même sens, lourds tests sanitaires et traçabilité ne seraient plus exigés. Une perspective qui redouble l'intérêt des industriels et des laboratoires pour cette technique, et qui, si elle se confirme, entraînera un afflux inédit de plantes et surtout d'animaux génétiquement modifiés, dont le statut d'OGM avait jusqu'à présent fortement limité l'essor.
6. Inventer de nouveaux animaux de compagnie
Des croisements organisés pendant des générations, d'interminables livres des origines retraçant ascendants et descendants de chaque représentant... Toutes les races officielles d'animaux domestiques, chiens et chats en tête, sont des bijoux de sélection naturelle, jalousement préservés par les éleveurs. Mais ici comme ailleurs, CRISPR-Cas9 pourrait dynamiter les usages en rendant la modification génétique beaucoup plus aisée.
Une équipe chinoise a par exemple récemment mis au point des beagles à la masse musculaire multipliée par deux, simplement en retirant de leur génome, à l'aide de CRISPR-Cas9, un gène régulant la croissance des muscles. Les petits toutous anglais pourront servir, d'après leurs créateurs, à la police. Mais l'intérêt pour ce physique atypique pourrait aussi pousser les propriétaires avides de nouveautés à les adopter.
Infographie Sciences & Vie
Pour zoomer, cliquer sur l'image
Des chercheurs de l'Institut de génomique de Pékin (BGI) se sont quant à eux lancés dans la mise au point de cochons de compagnie... nains. La commercialisation a été annoncée en septembre dernier. "Nous avons depuis été contactés par des laboratoires pour les aider à produire d'autres types d'animaux de compagnie, comme des moutons", affirme un expert du BGI.
Dernier exemple, sur des plantes cette fois : une équipe de l'université de Tokyo envisagerait de redonner à des œillets bleus, produits par transgenèse il y a environ vingt ans, leur couleur naturelle blanche, en supprimant le gène codant pour le bleu.
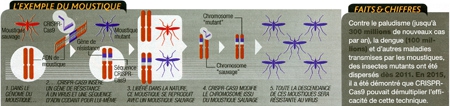
7. Immuniser les animaux vecteurs de maladies
Faire barrage aux maladies infectieuses non plus en vaccinant les humains, mais en immunisant génétiquement les animaux qui transmettent ces maladies. Voilà une des formidables promesses de CRISPR-Cas9. En laboratoire, des premiers tests ont déjà eu lieu sur des moustiques, vecteurs de la dengue, du paludisme, du chikungunya, de la fièvre jaune...
Le secret ? Disséminer rapidement la modification génétique à l'ensemble de la population de moustiques, à l'aide d'une méthode "deux en un" : il s'agit d'insérer dans le génome de l'insecte à la fois le gène qu'on souhaite répandre (par exemple, un gène de résistance au virus de la dengue) et les séquences d'ADN codant pour l'assemblage CRISPR-Cas9.
Lorsque le moustique mutant, libéré dans la nature, se reproduit avec un moustique "sauvage", sa descendance hérite du transgène de résistance au virus, mais aussi de CRISPR-Cas9. Avec une conséquence majeure; juste après la fécondation, le CRISPR-Cas9 hérité du parent mutant va recopier les séquences qui le codent, ainsi que le gène de résistance au virus, sur le chromosome issu du parent sauvage, assurant une transmission à la génération suivante. Et ainsi de suite.
Infographie Sciences & Vie
Pour zoomer, cliquer sur l'image
Efficace à plus de 99 %
Testée en 2015 par des chercheurs de l'université de Californie, sur des mouches puis des moustiques, cette stratégie, appelée gene drive, a permis de transmettre les gènes de résistance à plus de 99% de la descendance, au lieu des 50 % attendus par les lois de la reproduction sexuée. Et elle pourrait s'appliquer à des espèces plus complexes, pour peu qu'elles se reproduisent vite et de manière sexuée. "On pourrait immuniser les souris contre la maladie de Lyme, dont elles sont un vecteur important en Amérique du Nord, ou modifier certains oiseaux qui, en Asie, sont souvent le point de départ des grandes épidémies de grippe", propose Kevin Esveit, à Harvard.
Le gene drive soulève cependant des inquiétudes. Outre les questions d'éthique, la modification irréversible d'espèces sauvages "pourrait avoir des conséquences écologiques imprévues, alerte Owain Edwards, au Centre national de la recherche australien. Il ne faudrait pas que les moustiques s'échappent des laboratoires avant que tous les tests aient été faits".
Certains chercheurs élaborent déjà des systèmes de sécurité. Ainsi, Kevin Esveit a mis au point un gene drive "effaceur", qui, au besoin, pourrait se répandre dans les populations naturelles afin d'effacer les séquences d'ADN d'un précédent gene drive aux conséquences néfastes.
"Des débats de société seront nécessaires, prédit Simon Warner, directeur scientifique chez Oxitec, qui teste une méthode concurrente (le largage de moustiques stériles). Les premières applications ne devraient donc pas arriver avant longtemps."
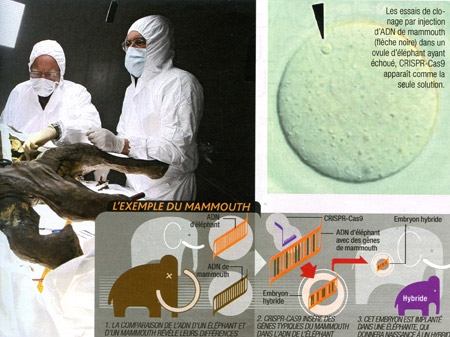
8. Ressusciter des animaux disparus
La question revient pour chaque carcasse tirée de la glace : va-t-on, enfin, disposer d'ADN suffisamment bien conservé pour cloner le mammouth ? La réponse est, invariablement, "non". Qu'à cela ne tienne, CRISPR-Cas9 pourrait être l'outil qui aidera à faire revivre le mastodonte laineux... mais aussi le pigeon voyageur, le tigre de Tasmanie ou même le dodo. Comment ? En mélangeant l'ADN sauvegardé avec celui d'espèces cousines toujours vivantes.
De tous ces candidats involontaires au retour, le mammouth est le plus avancé. En 2015, à Harvard, l'équipe du généticien George Church a obtenu des cellules d'éléphant d'Asie hybrides dans lesquelles 14 gènes de mammouth (liés à la taille des oreilles, la pilosité. ..) ont été insérés grâce à CRISPR-Cas9. Reste à vérifier qu'elles sont capables d'exprimer la part de mammouth qui est en elles...
Au même moment, une autre équipe américaine a annoncé avoir obtenu une séquence fiable du fameux génome et dressé, grâce à elle, un catalogue des différences avec l'éléphant pour 1600 protéines impliquées dans son adaptation au froid. Grâce à toutes ces avancées cumulées, les scientifiques sont aujourd'hui au bord de la réussite.
Cette résurrection ne serait pas de pure forme : elle permettrait aux éléphants d'Asie de s'adapter à un climat plus froid ; ces hybrides pourraient ainsi coloniser de nouveaux territoires.
Infographie Sciences & Vie
Pour zoomer, cliquer sur l'image
Passé ce stade, les chercheurs ne s'interdisent pas de pousser la ressemblance entre les deux éléphantidés au maximum... Un projet dont l'utilité et la faisabilité (notamment l'insémination d'une éléphante) sont, en revanche, plus que discutées.
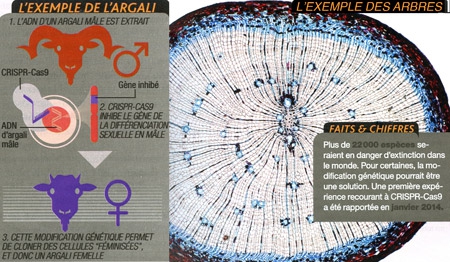
9. Sauver les espèces en danger
Si nous ne sommes pas capables de préserver l'environnement auquel animaux et plantes sont adaptés… pourquoi ne pas les adapter, eux, à leur nouvel environnement ? Une proposition provocante, qui gagne en crédibilité grâce à l'outil génétique CRISPR-Cas9. Zhongde Wang (université de l'Utah) s'est lancé. Avec une idée pour le moins originale : obtenir par modification génétique, à partir de cellules mâles... des animaux femelles. "Parfois, on peut se retrouver avec seulement des mâles à disposition", explique le chercheur. Créer des femelles permettrait alors de repeupler l'espèce. Pour démontrer que c'est possible, il a modifié des cellules de l'argali tibétain (un mouflon classé "quasi menacé"), de manière à inactiver le gène SRY responsable de la différenciation en mâle. Reste ensuite à cloner ces cellules "féminisées" pour obtenir des animaux adultes.
Infographie Sciences & Vie
Pour zoomer, cliquer sur l'image
Un autre de ses projets, plus classique, consiste à conférer à un groupe de mammifères en danger, par de simples mutations induites par CRISPR-Cas9, une résistance à une maladie. Impossible d'en dire plus... Car la perspective d'être le premier laboratoire à conférer, via cet outil, un gène "sauveur" à une espèce en danger fait probablement rêver plus d'un laboratoire. Même si de précédentes techniques ont déjà fait leurs preuves. William Powell (université d'État de New York) a par exemple modifié génétiquement le châtaignier américain afin de le rendre résistant à une maladie qui l'a ravagé. Mais ce projet n'a toujours pas abouti à des plantations, faute d'autorisation. "Si je devais recommencer aujourd'hui, j'utiliserais CRISPR-Cas9 : j'obtiendrais le même caractère sans insérer de gène étranger, ce qui gênerait peut-être moins le public", affirme le chercheur.
Ajout de février 2016 : La myopathie de Duchenne stoppée net par Hugo Jalinière (Sciences et Avenir n° 828 février 2016, p. 76)
L'anomalie génétique à l'origine de cette maladie a pu être corrigée grâce à la technique CRISPR qui reprogramme un virus pour acheminer un médicament.
Guérir la myopathie de Duchenne, tel est l'espoir porté par trois études majeures qui viennent d'être publiées coup sur coup dans la revue Science. Trois équipes indépendantes sont en effet parvenues à stopper, chez des rongeurs, la progression de cette maladie rare qui touche 2500 enfants en France et 30 000 dans le monde — l'une des pathologies pour lesquelles se mobilisent chaque année les participants du téléthon. La myopathie de Duchenne qui affecte un enfant toutes les 3500 naissances est caractérisée par une dégénérescence des muscles squelettiques, lisses et cardiaques. En cause ? Une anomalie génétique sur le chromosome X : une mutation qui empêche le gène DMD de synthétiser la dystrophine, une protéine essentielle à l'architecture cellulaire des fibres musculaires.
La production de la protéine manquante est rétablie
Sans dystrophine, ces fibres s'usent rapidement. Dès l'âge de 3 ans, les enfants atteints peuvent rencontrer des difficultés qui touchent peu à peu tous les muscles (respiratoires, cardiaques, digestifs...). Et le décès survient dans la plupart des cas avant l'âge adulte. C'est ce mécanisme du gène DMD qui a été rétabli par les équipes des universités américaines Duke, Harvard et du Texas. Pour actionner le kit moléculaire CRISPR-Cas9 sur le gène défectueux, au cœur des cellules, les trois équipes ont eu recours à un virus. Inoffensif pour l'homme, il a été reprogrammé pour acheminer un gène médicament remplaçant le gène coupé.
En quelques semaines, les rongeurs testés ont produit de nouveau de la dystrophine en quantités suffisantes pour rétablir les fonctions musculaires. Sans toutefois retrouver le niveau observé chez des sujets sains, ce qui pourrait s'expliquer par le fait que les scientifiques ont supprimé uniquement la partie illisible sans chercher à modifier l'ensemble du gène. De nombreux essais devront encore être menés pour s'assurer de la maîtrise de la technique avant de l'appliquer chez l'Homme.
Sources :
— Site de Sciences et Avenir, janvier 2016
— Abdoun E., Racucher É., Shjiama Y, & Tourbe C. — Bricoleurs du vivant pour soigner, créer, optimiser, ils ont trouvé leur outil. Science & Vie n° 1180 janvier 2016, pp. 44-64.
Ajout du 6 octobre 2016 : Pluie de récompenses pour Emmanuelle Charpentier
Microbiologiste, généticienne et biologiste, Emmanuelle Charpentier, actuellement en poste au Max Planck Institute for Infection biology (Allemagne), est la co-découvreuse avec Jennifer Doudna de l’Université de Berkeley (États-Unis) d’un outil de biologie révolutionnaire : CRISPR-Cas9. Celui-ci permet de modifier à volonté le patrimoine génétique de n'importe quelle cellule végétale, animale ou humaine, ouvrant aussitôt la voie à de multiples applications en cours dans tous les laboratoires du monde. La chercheuse, déjà multi-récompensée depuis cette découverte en 2012 vient de recevoir un doctorat Honoris causa de l’École polytechnique fédérale de Lausanne (EPFL), l’une des écoles les plus cotées d’Europe, après le Breakthrought Prize in Life Sciences (2015) ou encore le prix L’Oréal-Unesco pour les femmes et la science (2015).
Source : www.scienceetavenir.fr du 6 octobre 2016
Ajout du 18 novembre 2016 : Première utilisation de CRISPR/Cas9 pour tenter de combattre le cancer (Sciences et Avenir.fr)
Pour la première fois, la technique CRISPR-Cas9 a été utilisée chez l'Homme pour tenter de lutter contre une forme agressive de cancer du poumon.
Une équipe de chercheurs de la Sichuan University de Chengdu en Chine a injecté le 28 octobre 2016 des cellules génétiquement modifiées pour reconnaître et attaquer les cellules tumorales d'un patient atteint d'un cancer du poumon métastatique. Une première réalisée dans le cadre d'un essai clinique qui devrait inclure au total une dizaine de patients en situation d'échec thérapeutique. L'essai a été autorisé au mois de juillet 2016 par un comité d'éthique chinois. Concrètement, les chercheurs ont prélevé des cellules du système immunitaire — les lymphocytes T —, et ont désactivé un gène spécifique avec Crispr-Cas9.
Le journal Nature qui a révélé l'information sur cet essai clinique en cours se fait l'écho de différentes réactions plutôt enthousiastes dans la communauté scientifique. Mais pour Antonio Russo de l'université de Palerme, en Italie, "c'est une stratégie excitante avec un rationnel solide". Mais "à moins qu'elle ne prouve un gain d'efficacité important, il sera difficile de mener ces tests plus loin", ajoute-t-il, sceptique.
Car les chances pour que ces essais soient concluants restent très faibles au vu du degré de maîtrise de l'outil très largement perfectible. En effet, l'un des problèmes majeurs est ce que les spécialistes appellent le "off-target". Il est certes très facile de cibler un gène spécifique avec Crispr-Cas9, mais cela entraîne systématiquement d'autres modifications non désirées en d'autres endroits du génome. Ainsi, pour une modification souhaitée avec l'enzyme Cas9, les chercheurs se retrouvent généralement avec des dizaines voire des centaines de modifications "off-target". Un obstacle majeur. C'est notamment ce qui était arrivé en 2015 lorsque l'équipe de Junjiu Huang, généticien de l'université Sun Yat-sen dans la province du Guangdong (Chine) avait modifié des embryons humains viables pour supprimer le gène responsable de la bêta-thalassémie, une maladie du sang.
La technique CRISP-Cas9 appliquée à l'embryon humain (24 mars 2017)
Apparemment, ils ont réussi à dominer le phénomène "off-target". Des chercheurs chinois ont « guéri » un embryon en modifiant son génome au premier stade de son développement.
Des embryons humains issus d’une cellule porteuse d’une mutation génétique ont, pour la première fois, pu être génétiquement corrigés, révèle une étude menée par des chercheurs chinois à l’université de médecine de Canton (publié dans Molecular Genetics and Genomics).
Ajout du 6 avril 2018 : Pourquoi CRISPR-Cas9 pourrait ne pas marcher sur l'humain par Camille Gaubert (Sciences et Avenir)
La majorité de la population serait immunisée contre CRISPR-Cas9 par des anticorps ou globules blancs spécifiques, d'après une étude. Conséquences si on ne parvient pas à contourner ce problème : au mieux une inefficacité de la thérapie génique, au pire une réaction inflammatoire dangereuse.
La thérapie génique consiste à modifier l'ADN des malades pour corriger les mutations à l'origine de la pathologie.
De 65 à 79% de la population possèderait des anticorps contre les protéines de type CRISPR-Cas9, ces outils génétiques permettant de découper précisément l'ADN pour en corriger des erreurs. Et 46% de la population possèderait aussi des globules blancs spécifiquement dirigés contre ces protéines. C'est une bien mauvaise nouvelle pour la communauté scientifique qui fonde beaucoup d'espoirs dans cette technique pour corriger certaines mutations génétiques à l'origine de maladies. Elle émane d'une étude pré-publiée en janvier 2018 et conduite par des chercheurs de l'université de Standford.
Bien que l'étude n'ait pas encore été validée par la communauté scientifique, puisqu'elle n'est pas encore publiée, elle a déjà fait l'objet de publications de la revue Nature ou encore de l'université d'Harvard.
CRISPR-Cas9, protéine issue de 2 bactéries contre lesquelles 100% de la population est immunisée
CRISPR-Cas9 est une protéine bactérienne qui sert de système immunitaire rudimentaire. Elle a en effet pour principale caractéristique de pouvoir reconnaitre et couper une séquence d'ADN particulière. Modifiée par les chercheurs pour qu'elle reconnaisse la séquence de leur choix, CRISPR-Cas9 peut ainsi potentiellement supprimer des mutations et devenir le pivot de thérapies géniques pour traiter de nombreuses maladies génétiques.
Seul souci : les deux versions les plus prisées de CRISPR-Cas9 sont extraites des deux espèces bactériennes Staphylococcus aureus et Streptococcus pyogenes, des bactéries commensales humaines (qui vivent à notre contact). Très communes, ces dernières peuvent aussi être pathogènes. Ainsi, d'après les chercheurs, 40% de la population humaine est colonisée par S. aureus et 20% des enfants sont colonisés par S. pyogenes à un moment donné de leur vie. Ainsi, des études ont montré que 100% des adultes humains possèdent des anticorps contre S. aureus et S. pyogenes… Et donc potentiellement à leur version de CRISPR-Cas9, soulèvent les chercheurs. "La présence de réponses immunitaires adaptatives préexistantes chez l'homme" à CRISPR-Cas9 "peut nuire à l'utilisation sûre et efficace" de ce système pour traiter la maladie, "et peut même entraîner une toxicité importante pour les patients", expliquent les auteurs de la publication.
65 à 79% des sujets présenteraient des anticorps, et 46% des globules blancs anti-Cas9
Pour déterminer la présence d'une réponse immunitaire anti-Cas9, les chercheurs ont donc utilisé du sérum humain de donneurs adultes et de sang de cordon ombilical dans lequel ils ont recherché des anticorps et des cellules immunitaires capables de reconnaitre CRISPR-Cas9. Résultat : sur 22 bébés et 12 adultes, 79% des donneurs possédaient des anticorps anti-Cas9 de S. aureus, et 65% possédaient des anticorps anti-Cas9 de S. pyogenes. Les scientifiques ont également détecté des lymphocytes T (globules blancs qui ont pour spécificité de détruire les cellules anormales) spécifiques de Cas9 de S. aureus chez 46% des donneurs (13 adultes, cette fois). Même s'ils n'ont pas détecté de lymphocyte T anti Cas9 de S. pyogenes (l'autre bactérie), les auteurs n'excluent pas qu'elle soit présente à un taux trop faible pour leurs méthodes de détection.
Plus que les anticorps, c'est la présence des lymphocytes anti-Cas9 qui inquiète le plus les chercheurs. Au vu des techniques utilisées, "la protéine Cas9 ne serait pas directement exposée aux anticorps", expliquent-ils. En revanche, une fois la cellule modifiée par CRISPR-Cas9 dans l'organisme, elle pourrait avoir des protéines de surface légèrement différentes et reconnaissables par ces fameux lymphocytes T spécifiques… Qui élimineraient alors les cellules éditées, "rendant la thérapie inefficace". Pire : lorsque les globules blancs reconnaissent une menace, ils produisent des molécules qui activent et attirent leurs homologues, afin de faire face à une menace éventuelle. Face aux cellules modifiées par CRISPR-Cas9, les lymphocytes T pourraient ainsi créer une réponse inflammatoire généralisée qui pourrait se retourner contre le patient.
SOLUTIONS. "Une autre solution possible est de développer un système Cas9 à partir de bactéries qui ne colonisent pas ou n'infectent pas les humains", explique Matthew Porteus, hématologue en pédiatrie à l'Université de Stanford en Californie et un des auteurs de l'étude, dans un communiqué paru dans la revue Nature. Les chercheurs peuvent également être en mesure de modifier les enzymes Cas9 en laboratoire pour concevoir des formes qui vont échapper à des réponses immunitaires préexistantes, note-t-il. " Si nous pouvons trouver la solution, ce système pourrait être l'une des plus grandes percées dans l'histoire médicale", s'enthousiasme Aaron Aker, du département de génétique de l'université d'Harvard dans un communiqué.
Source : Sciences et Avenir
POUR EN SAVOIR PLUS :
En français :
— Conférence Emmanuelle CHARPENTIER - Le CRISPR Cas9 - La révolution de l'ingénierie génomique :
https://www.youtube.com/watch?v=PulYE-yErPU
CRISPR/CAS9 : une méthode révolutionnaire :
https://www.youtube.com/watch?v=RplWR12npqM
— Modifier le génome avec CRISPR — Science étonnante #18 :
https://www.youtube.com/watch?v=bYVE05egjPg
— Crispr Cas9, une méthode révolutionnaire pour faire évoluer la génétique
https://www.youtube.com/watch?v=vVZkQAKN8TQ@
En anglais, vous trouverez sur le net une multitude de vidéos expliquant le système Crispr-Cas9. En voici quelques-unes, mais vous en trouverez beaucoup d'autres… si vous dominez la langue de Shakespeare !
— How CRISPR lets us edit our DNA | Jennifer Doudna
— Jennifer Doudna (UC Berkeley / HHMI): Genome Engineering with CRISPR-Cas9
16:58 Publié dans Actualité des Sciences, Biologie, Médecine | Tags : crispr, crispr-ca9 | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |





Les commentaires sont fermés.