26/12/2013
Cancer : Bactéries intestinales en renfort de la chimiothérapie
Quand les bactéries intestinales viennent en renfort de la chimiothérapie
(Article mis à jour le 5 septembre 2014)
Appelé autrefois "flore microbienne", le microbiote est l'ensemble des microbes (bactéries et champignons essentiellement) qui peuplent notre corps. Ces micro-organismes vivent avec nous, logés à la surface de la peau, dans les cavités buccale et vaginale, et surtout dans notre intestin : celui-ci contient 100 000 milliards de bactéries - soit 10 fois le nombre de nos propres cellules - et leur masse avoisine les deux kilogrammes chez l'adulte !
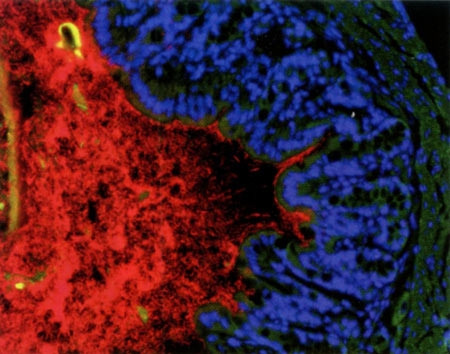
Les bactéries du microbiote apparaissent en rouge
contre la paroi du colon (bleu et vert) © Institut Pasteur
Ce microbiote intestinal est aujourd'hui considéré comme un véritable organe, avec une activité métabolique égale à celle du foie car les espèces bactériennes qui le composent exercent des fonctions cruciales pour notre santé comme l’élimination des substances étrangères à l’organisme (et potentiellement toxiques) ou le maintien à distance de pathogènes qui nous contaminent. Elles assurent également la dégradation des aliments ingérés pour une meilleure absorption intestinale et un métabolisme optimal. Ces milliards de bactéries colonisent l’intestin dès la naissance et jouent un rôle-clef dans la maturation des défenses immunitaires.
Les espèces bactériennes qui composent le microbiote intestinal diffèrent toutefois d'un individu à l'autre et la présence ou l'absence de telle ou telle bactérie semble influencer la survenue de certaines maladies ou au contraire nous protéger. Il nous permet de digérer les sucres complexes et les fibres, intervient dans la biosynthèse des vitamines ou encore dans la détoxification de certaines substances de l'alimentation, et il forme une barrière protectrice contre les pathogènes. Il comprend environ 1000 espèces de bactéries et sa composition varie d'un individu à l'autre. Chacun d'entre nous a donc son propre microbiote intestinal, constitué dans les premières années de la vie à partir des bactéries de notre environnement : seul un tiers des bactéries intestinales est commun à tous.
Ce microbiote intestinal joue un rôle crucial dans le développement du système immunitaire et, sans doute, dans une large gamme de maladies : l'obésité, la résistance à l'insuline et diverses maladies inflammatoires de l'intestin (maladie de Crohn, rectocolite hémorragique...) peuvent résulter d'un déséquilibre du microbiote intestinal. Plus étonnant : il pourrait intervenir dans certaines pathologies de l'humeur comme la dépression. De plus en plus d'études montrent en effet que nos bactéries intestinales envoient des signaux au cerveau et semblent ainsi capables d'influencer le comportement.
Une recherche menée conjointement par des chercheurs de Gustave Roussy, de l'Inserm, de l’Institut Pasteur et de l'Inra a permis une découverte assez étonnante sur la façon dont les traitements de chimiothérapie anticancéreuse agissent plus efficacement grâce à l'aide du microbiote intestinal. Les chercheurs viennent en effet de démontrer que l’efficacité d'une des molécules les plus utilisées en chimiothérapie, repose en partie sur sa capacité à entraîner le passage de certaines bactéries de la flore intestinale vers la circulation sanguine et les ganglions. Une fois dans les ganglions lymphatiques, ces bactéries stimulent de nouvelles défenses immunitaires qui iront aider l'organisme à combattre encore mieux la tumeur cancéreuse.

Arbre phylogénétique bactérien sur fond de muqueuse du côlon d'une souris. La taille des cercles renseigne sur l'importance des populations bactériennes du microbiote. Les points rouges correspondent aux bactéries renforçant l'action d'une immunothérapie anticancéreuse, les verts à celles inhibant la réponse à une chimiothérapie.
Dans le domaine du cancer, l’équipe française* dirigée par le Pr Laurence Zitvogel, à l’Institut Gustave Roussy et directrice de l'Unité Inserm 1015 "Immunologie des tumeurs et immunothérapie", en collaboration étroite avec l’Institut Pasteur (Dr Ivo Gomperts Boneca, Unité "Biologie et génétique de la paroi bactérienne") et des chercheurs de l’INRA (Dr Patricia Lepage et Dr Joël Doré, Unité Micalis "Microbiologie de l'Alimentation au service de la Santé"), vient d'apporter la preuve que la flore intestinale stimule les réponses immunitaires d'un individu pour combattre un cancer lors d'une chimiothérapie.
*Équipe française dirigée par le Pr Laurence Zitvogel, à l'Institut Gustave-Roussy, directrice de l'Unité Inserm 1015 "Immunologie des tumeurs et immunothérapie", en collaboration étroite avec l'Institut Pasteur (Dr Ivo Gomperts Boneca, Unité "Biologie et génétique de la paroi bactérienne") et des chercheurs de l'INRA (Dr Patricia Lepage et Dr Joël Doré), Unité "Microbiologie de l'Alimentation au Service de la Santé Humaine".
Le cyclophosphamide est l’un des médicaments les plus utilisés en chimiothérapie. Comme tout traitement, il entraîne cependant des effets secondaires (inflammation des muqueuses etc.) et perturbe l'équilibre normal du microbiote intestinal. Chez la souris, l'équipe a démontré que le cyclophosphamide modifie la composition du microbiote dans l'intestin grêle et induit la translocation de certaines espèces de bactéries Gram-positives dans les organes lymphoïdes secondaires. Là, ces bactéries stimulent la production d'un sous-ensemble spécifique de "pathogène" T helper(17)" pTH17 cellules mémoire et des réponses immunitaires Th1. La synergie entre le microbiote et le cyclophosphamide débute lorsque le médicament facilite le passage à travers la barrière intestinale des bactéries Gram+ qui vont se retrouver dans la circulation sanguine et les ganglions lymphatiques. Ces bactéries sont considérées comme néfastes et l'organisme déclenche une réponse immunitaire. Une fois dans les ganglions lymphatiques, elles stimulent la production de globules blancs pTH17 qui vont agir comme de nouvelles défenses immunitaires et aider l'organisme à lutter contre la tumeur cancéreuse. "Cette réaction en chaîne, effet secondaire du traitement, va s'avérer en réalité très utile" explique Laurence Zitvogel. "De façon surprenante, la réponse immunitaire dirigée contre ces bactéries va aider le patient à lutter encore mieux contre sa tumeur en stimulant de nouvelles défenses immunitaires."
En détails, l'immunisation anti-bactérienne aboutit au recrutement de lymphocytes effecteurs différents de ceux mobilisés par la chimiothérapie. Leur rôle consiste à aider les lymphocytes anti-tumoraux à endiguer la croissance de tumeurs.
A contrario, des souris dépourvues de tout germe intestinal ou préalablement traitées par des antibiotiques dirigés contre les bactéries Gram+ se révèlent incapables de produire les précieuses cellules pTH17 antitumorales. De plus, leur tumeur est devenue résistante au cyclophosphamide. La situation est toutefois réversible : lorsque les sourisreçoivent une perfusion intraveineuse de pTH17, le médicament retrouve son efficacité antitumorale.
Les chercheurs suggèrent également que certains antibiotiques utilisés au cours d’une chimiothérapie pourraient détruire ces bactéries Gram+ et annuler ainsi leur effet bénéfique. "Maintenant que ces bactéries bénéfiques potentialisant la réponse immunitaire anti-tumorale ont été identifiées, on devrait réussir rapidement à en fournir plus à l'organisme, notamment via des pro- ou pré-biotiques et/ou une alimentation spécifique" conclut la chercheuse.
Ces travaux ont bénéficié du soutien de la Ligue nationale contre le cancer, de l'Institut national du cancer (INCa) (SIRIC SOCRATES) et du LABEX Onco-Immunologie.
Remarque :
Le cyclophosphamide n'est pas le seul traitement à profiter d'un microbiote intestinal performant. Le même numéro de Science fait ainsi part du travail d'une équipe américaine qui aboutit à des conclusions très proches : certains antibiotiques diminueraient l'action de la chimiothérapie.
Parallèlement au travail des chercheurs français, Elizabeth Pennisi, Noriho Lida et al, de l'Institut national du cancer (Frederick, États-Unis), montrent que le microbiote intestinal renforce les effets d'autres traitements anticancéreux, à savoir une immunothérapie ou une chimiothérapie par oxaliplatine (un autre médicament anticancéreux). Ici aussi, comme dans l'étude française, l'efficacité du traitement antitumoral a chuté drastiquement chez des souris débarrassées de leur flore bactérienne intestinale.
Même si ces deux études ont été menées sur la souris, il est vraisemblable que leurs résultats puissent être un jour applicables à l'être humain. Ils suggèrent en tout cas que certains antibiotiques pourraient diminuer l'efficacité d'une chimiothérapie antitumorale mais également qu'une supplémentation en pro- ou pré-biotiques, voire une alimentation spécifique, pourrait renforcer l'action du traitement.
Sources :
Laurence Zitvogel et al (2013). - The Intestinal Microbiota Modulates the Anticancer Immune Effects of Cyclophosphamide, Science22 November 2013, vol 342 n° 6161 pp. 971-976.
Elizabeth Pennisi et al (2013). - Cancer Therapies Use a Little Help From Microbial Friends, Science 22 November 2013 Vol. 342 n° 6161 p. 921.
Marc Gozlan (2013). - La flore intestinale en renfort de la chimiothérapie, Sciences et Avenir, janvier 2014 n° 803, p. 70.
Qu'est-ce que le microbiote ? Lettre de l'Institut Pasteur, septembre 2014 n° 86 p. 9.
11:55 Publié dans Actualité des Sciences, Biologie, Médecine | Tags : cancer, chimiothérapie, microbiote intestinal, flore intestinale | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |


