26/01/2013
La gale
 La gale
La gale
par André Guyard
Professeur honoraire d'Hydrobiologie et d'Hydroécologie de l'Université de Franche-Comté
En cette fin de janvier 2013, une épidémie de gale frappe le lycée Louis Pergaud, le plus vaste des lycées francs-comtois.
C'est une occasion pour s'intéresser à cette parasitose due à cet acarien.
GÉNÉRALITÉS
Conjointement à la recrudescence des maladies vénériennes constatée au cours de ces dernières années, on observe une augmentation des cas de gale.
Selon Didier Che de l'Agence Nationale de Veille Sanitaire (ANSM), qui a conduit une étude sur le sujet en 2011, le nombre d'épisodes de gale en collectivité serait en augmentation en France. En se basant sur les chiffres des ventes de deux produits antigale, ses travaux plaçaient à plus de 200.000 les cas de gale chaque année en France (de 337 à 352 nouveaux cas en moyenne pour 100.000 habitants entre 2005 et 2009).
Plus réservé, le Pr Chosidow rappelle que la gale n'est pas une maladie à déclaration obligatoire, ce qui rend impossible l'évaluation de la tendance. Le dermatologue appelle à la création d'un centre national de référence pour les parasites (gale, punaises de lits, poux de tête ou poux de corps), qui «ne tuent pas mais peuvent transmettre des maladies infectieuses».
Les voyages dans des pays où l'hygiène est beaucoup moins développée qu'en France, l'afflux des populations immigrantes vivant dans des conditions précaires, la méconnaissance du diagnostic enfin, constituent autant de facteurs favorables à l'extension de la gale.
La gale est la parasitose des téguments de l'Homme par divers acariens de la famille des Sarcoptidés.
LE CYCLE PARASITAIRE
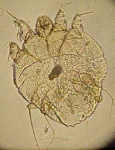
L'espèce la plus fréquemment en cause, l'agent de la gale dite vulgaire est Sarcoptes scabiei, variété hominis.
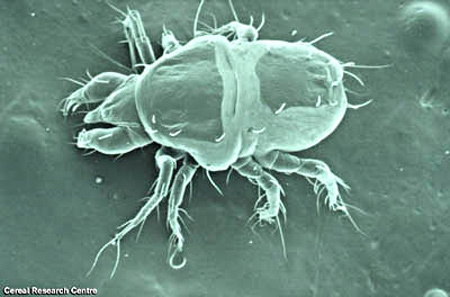
Image du sarcopte en microscopie électronique à balayage
La femelle de cet arthropode est de forme globuleuse et apparaît comme un gros point blanc à l'œil nu; elle mesure, en effet, 350 μm de long sur 300 μm environ de large.
Elle se compose d'une saillie antérieure triangulaire : la tête, et d'un corps ovoïde auquel sont fixées quatre paires de pattes.
Les téguments du parasite présentent des plis parallèles interrompus sur la face dorsale par un plastron grenu, puis par des aiguilles triangulaires acérées s'étendant sur les côtés du corps. Ce dernier est encore muni de minces épines allongées vers l'arrière.
Le parasite n'a ni yeux, ni trachées.
Les pattes courtes et ventrales débordent de peu le contour du corps, mais elles se prolongent par des soies longues et fines, surtout nettes sur les deux paires de pattes postérieures.
Porteuses de cinq soies, les pattes sont encore pourvues de ventouses de disposition différente selon le sexe. Les deux paires de pattes antérieures encadrent un rostre trapu dont les dents de scie déchirent l'épiderme.
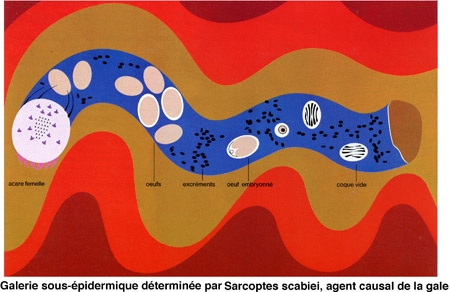
L'orientation générale vers l'arrière de tous les ornements tégumentaires et de ceux des pattes ne permet pas à l'acarien de rebrousser chemin et l'oblige à avancer constamment dans la galerie qu'il creuse dans les téguments de l'Homme.
Le mâle est de plus petite taille que la femelle : 200 μm de long sur 170 μm environ de large. Il vit dans la galerie creusée par la femelle ou bien encore à la surface de la peau enfoui dans les débris épidermiques.
L'accouplement a lieu à la surface de la peau.
La femelle s'enfonce alors dans l'épiderme pour y creuser une galerie dans laquelle s'effectuera la ponte.
Celle-ci commence quelques jours après la fécondation sous forme d'œufs de 150 μm de long sur 100 μm de large.
Les œufs éclosent au bout de quelques jours (3 à 4 jours en moyenne), pour donner naissance à des larves hexapodes (trois paires de pattes) qui gagnent la surface de la peau, en perforant le toit de la galerie dans laquelle elles sont nées.
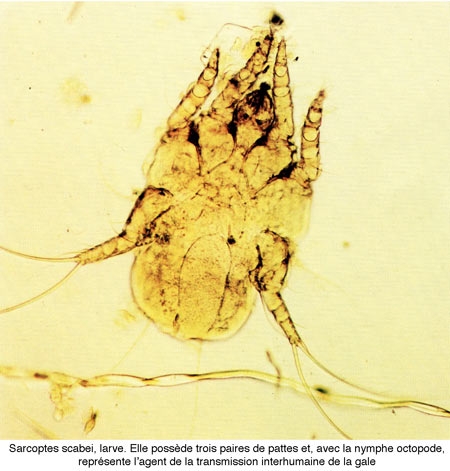
Les larves grossissent, muent à plusieurs reprises et se transforment en nymphes octopodes (quatre paires de pattes) vers le 16e jour.
Trois semaines environ après l'éclosion apparaissent les adultes des deux sexes.
La contamination, strictement interhumaine, se fait par la transmission, soit de larves ou de nymphes vivant à la surface de la peau, soit par la transmission de femelles récemment fécondées n'ayant pas encore pénétré dans l'épiderme.
Cette transmission peut se faire par un contact direct et ce, d'autant plus aisément que le contaminateur est massivement infesté. Ce contact direct a lieu le plus souvent lors de rapports intimes (en particulier le partage d'un lit avec un sujet parasité), et l'on peut contracter la gale en même temps qu'une maladie vénérienne. Parfois, le contage a lieu lors de contacts moins intimes : danse, certains sports. La gale peut également être transmise par la literie et le linge (draps et sous-vêtements des sujets contaminés).
LA CLINIQUE DE LA GALE
La gale se déclare au terme d'une incubation de durée variable, selon l'intensité de l'infestation (quelques jours lors des infestations massives, trois semaines à 1 mois dans la plupart des cas, ce laps de temps étant nécessaire pour qu'ait lieu une multiplication suffisante des acariens).
Le prurit est le symptôme majeur de la parasitose ; il est à prédominance nocturne, supportable et discret pendant la journée, il s'exacerbe le soir et en particulier au coucher.
La topographie des démangeaisons est essentiellement antérieure, elle prédomine aux aisselles et aux aines, elle s'étend à la face antérieure du tronc et des membres, elle respecte généralement la région dorsale. Le support du prurit est une éruption ayant la même topographie.
Si, en soi, l'éruption est faite apparemment de lésions non évocatrices associant des excoriations banales de grattage et des papules urticariennes recouvertes d'une petite croûte noirâtre, elle revêt dans son ensemble une topographie très particulière hautement évocatrice.
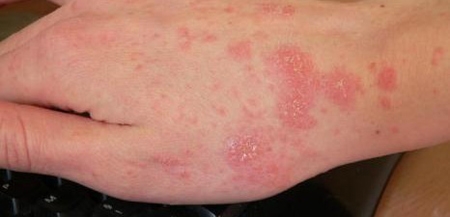
Lésions cutanées dues à la gale sur la main
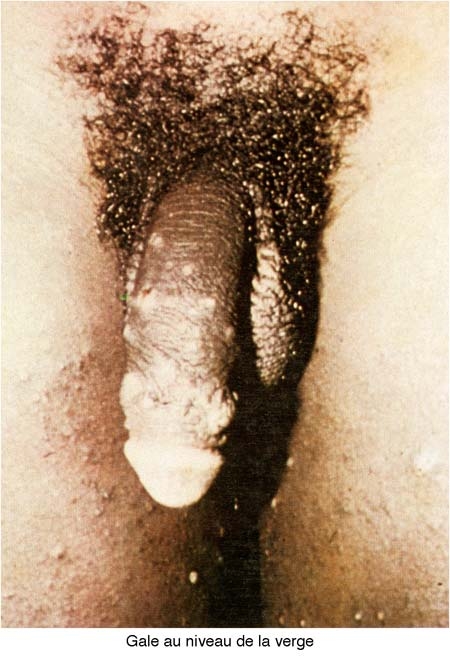
La localisation au niveau des espaces interdigitaux et de la face antérieure du poignet est classique, mais bien souvent discrète. L'atteinte des aisselles et des aines, celle des flancs et des hanches sont constantes. Les lésions cutanées des seins et tout spécialement des mamelons sont rares bien que très évocatrices. En revanche, l'atteinte de la verge (excoriations du fourreau et du gland) est extrêmement fréquente. Le visage, le cuir chevelu et le dos sont, en règle générale, parfaitement indemnes. La notion de contage constituera un élément d'appoint précieux dans le diagnostic de l'affection.
Très fortement suspecté sur ces symptômes, le diagnostic de gale peut être affirmé par la découverte du classique sillon cutané et par la mise en évidence du parasite dans les lésions cutanées.
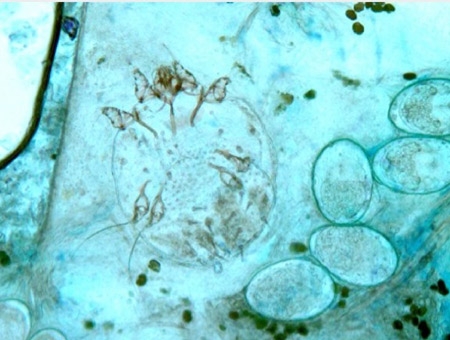
Examen direct du produit de raclage des lésions cutanées
(Document CBM25)
L'examen direct entre lame et lamelle du produit de raclage des lésions cutanées au microscope permet de mettre en évidence la présence de l'acarien Sarcoptes scabiei var. hominis (des oeufs de sarcopte sont également observés) permettant d'affirmer le diagnostic de gale.
Le sillon fait par le cheminement cutané du parasite est le véritable signe pathognomonique de la parasitose. Il s'agit d'un trait fin, flexueux, très court, à peine visible bien que parfois souligné de noir. Son extrémité antérieure peut être un peu plus saillante car elle trahit la présence de l'acarien. Une petite goutte d'encre déposée à l'entrée de la galerie va teinter le trajet du parasite. Le caractère principal du sillon est la saillie qu'il fait par rapport à la surface avoisinante. On voit encore apparaître au niveau de l'éruption de la gale des vésicules perlées. Ce sont des petites élévations ayant la taille d'une tête d'épingle qui siègent tout particulièrement au niveau des plis interdigitaux. Ces perles peu saillantes sont limpides et revêtent l'apparence des lésions de dyshidrose. La mise en évidence du parasite se fait au niveau de la partie antérieure d'un sillon.
L'effondrement du toit du sillon à cet emplacement permet de découvrir la femelle dont le corps ovoïde et blanc est aisément reconnaissable, sinon à la loupe, du moins au faible grossissement du microscope.
À côté de la forme que nous venons de décrire, la gale peut revêtir d'autres aspects.
Les formes légères se réduisent à du prurit, bien que parfois fort intense, et à des lésions de grattage restreintes.
Les gales étendues se compliquent souvent de surinfection ou d'eczématisation. La surinfection des sillons et des lésions cutanées de grattage provoque de l'impétigo pouvant évoluer pour son propre compte en envahissant le visage et le dos, régions respectées par la gale, ou encore se généraliser en entraînant des adénopathies et des signes généraux graves.
L'eczématisation est précoce sur les terrains prédisposés ou tardive provoquée parfois par le traitement. Elle s'accompagne de prurit et d'hyperéosinophilie sanguine.
Il faut signaler la possibilité de l'association de la gale avec une maladie vénérienne, comme la syphilis.
Une forme de gale très rarement rencontrée en réalité se présente sous un aspect très différent de celui de la gale classique, c'est la gale dite norvégienne.
Elle est caractérisée par des lésions de type hyperkératosique, jaunâtres ou grisâtres, épaisses, dures, siégeant sur la face dorsale des mains et des doigts, atteignant les ongles, sur les avant-bras, aux coudes et aux genoux. La généralisation de ces croûtes d'hyperkératose est constante, et la face, le cuir chevelu, le dos sont envahis.
En dehors des croûtes, on observe une éruption de type érythrodermique faite de fines squames pityriasiques, ou encore ichtyosiformes sur un fond érythémateux. Le prurit, en revanche, est très discret, souvent absent. L'examen à la loupe des croûtes révèle la présence de très nombreux parasites.
La gale norvégienne s'accompagne d'adénopathies disséminées et d'une hyperéosinophilie pouvant atteindre 50 p. cent.
Le terrain sur lequel se développe la gale norvégienne est très particulier, l'état général est souvent profondément atteint, comme en témoignent la maigreur et la cachexie, conséquences elles-mêmes d'une misère physiologique ou d'une affection grave cachectisante.
Une carence vitaminique A pourrait jouer un rôle dans le développement de cette parasitose.
L'agent pathogène semble bien être le même que celui de la gale classique, et c'est probablement le terrain qui joue le rôle principal dans cette forme de gale.
Sur le plan diagnostique, un certain nombre d'affections dermatologiques peuvent être confondues avec la gale. Il s'agit de l'urticaire, de l'eczéma et de certains prurigos, des pyodermites siégeant aux membres, de la phtiriase corporelle atteignant la face dorsale du tronc avec des lésions de grattage plus marquées.
Enfin, le psoriasis peut ressembler à la gale norvégienne. Il faut savoir évoquer la gale devant tout prurit durable et tout spécialement lorsque la maladie est apparue dans l'entourage familial ou la collectivité. La découverte des sillons caractéristiques assure le diagnostic de gale.
Document ANSM
(Pour zoomer, cliquer sur le document)
LE TRAITEMENT DE LA GALE
N'étant pas médecin, je me garderai d'apoprofondir ce chapitre. Il faut savoir que l'on dispose actuellement de produits spécifiquement actifs contre Sarcoptes scabiei. Un traitement par ivermectine (200µg/kg) par voie orale en dose unique est instauré en association avec un traitement local à base de benzoate de benzyle. Il faudra, le même jour, assurer le traitement spécifique du malade et celui de son entourage.
Actuellement, le traitement de référence est l'Ascabiol, qui se révèle indisponible depuis la fin novembre, est problématique.
La fabrication de l'Ascabiol, qui se présente sous forme de pommade, nécessite du sulfirame. Or le laboratoire Zambon subit des ruptures d'approvisionnement de cette substance active par intermittence depuis mars 2012. Selon l'Agence nationale de sécurité du médicament (ANSM), l'Ascabiol va ainsi rester indisponible pour une durée « indéterminée ».
La suspension de la production du médicament risque de « poser localement des difficultés de gestion lors d'épidémies de gale », estime Didier Che, du département des maladies infectieuses à l'Institut de veille sanitaire (InVS). D'autant que l'autre produit réputé en application cutanée, la perméthrine, n'est toujours pas commercialisé en France, regrette pour sa part Olivier Chosidow, chef du service de dermatologie à l'hôpital Henri-Mondor de Créteil et président de la Société française de dermatologie.
L'ANSM a publié fin décembre un communiqué rappelant qu'il existe des traitements de substitution disponibles en France, le Stromectol (comprimés) et le Spregal (aérosol). Mais ceux-ci sont déconseillés pour certaines catégories de population, notamment les jeunes enfants. Pour cette raison, une importation à titre exceptionnel d'un médicament commercialisé en Allemagne à base de benzoate de benzyle pourrait avoir lieu au cours du premier trimestre 2013 pour répondre aux situations cliniques non couvertes par le Stromectol et le Spregal, précise l'ANSM.
Parallèlement ave ce traitement médicamenteux, il faudra désinfecter de façon préventive l'ensemble de la literie (draps et couvertures, sans oublier les matelas et les sommiers) et des effets personnels.
Quoi qu'il en soit, lorsque la gale est compliquée de surinfection ou d'eczéma, ces complications doivent être traitées avant d'appliquer le traitement spécifique.
Le recours à une antibiothérapie générale est rare.
L'eczématisation requiert des bains d'amidon, des pommades calmantes et des antihistaminiques par voie générale, de façon à calmer le prurit.
Le mode d'application du traitement local spécifique est le suivant : on fait d'abord prendre un bain de 10 à 20 minutes au cours duquel le malade se nettoie soigneusement tout le corps avec du savon blanc.
On pratique ensuite sur la peau encore humide un badigeonnage avec le produit choisi, depuis les orteils jusqu'à la base du cou à l'aide d'un pinceau plat, en insistant particulièrement sur les zones d'élection de la parasitose.
Après séchage à l'air de cette première couche, on en applique une seconde.
Le malade se rhabille après avoir changé de linge et reste 48 heures sans se baigner.
La désinfection de la literie entière et du linge sera très soigneusement effectuée.
On fait bouillir le linge de corps et les draps.
Les vêtements seront repassés et saupoudrés de poudre antiparasitaire, les objets ne pouvant être trempés seront nettoyés et frottés avec de l'essence ou de l'essence de térébenthine.
Le sommier et le matelas seront également soumis à la poudre antiparasitaire.
Sources :
- On pourra consulter le document relatif à la gale et édité par l'ANSM.
- Guyard André, Cours de parasitologie.
15:37 Publié dans Médecine, Parasitologie | Tags : gale, parasitose, acariens, parasites, parasitologie, sarcoptes scabei | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
03/10/2009
L’échinococcose alvéolaire : une maladie franc-comtoise ? Généralités
 1. Généralités : parasitose et agent de la parasitose
1. Généralités : parasitose et agent de la parasitose
par André Guyard
(Voir la suite de l'article : 2. Le cycle parasitaire de l'échinoccose)
L’échinococcose alvéolaire constitue une parasitose relativement rare en Europe, où elle tend cependant à augmenter, elle se concentre principalement en Franche-Comté (en particulier le Haut-Doubs), en Suisse et en Allemagne.
L’échinococcose alvéolaire (EA) est une parasitose due à un ver plat, Echinococcus multilocularis une espèce de ténia échinocoque appartenant au phylum des Plathelminthes et à la classe des Cestodes.
Les Plathelminthes (Vers plats) sont des Métazoaires (animaux pluricellulaires) à corps aplati dans lequel les différents organes sont inclus au sein d’un tissu mésenchymateux. Leur appareil digestif est nul ou incomplet. Leur appareil excréteur est constitué de cellules à flammes vibratiles et ils sont généralement hermaphrodites.
À côté de la classe des Turbellariés (planaires) dont les espèces sont libres et aquatiques, les autres Plathelminthes sont des parasites possédant des organes de fixation (ventouses ou crochets). Ils se divisent en deux grands groupes :
- les Trématodes au tube digestif incomplet et dont le corps n’est pas segmenté (ex : douves, bilharzies),
- les Cestodes dépourvus de tube digestif et dont le corps est segmenté (ex : ténias).
Le développement dans l’organisme humain ou de certains animaux de la larve d’Echinococcus multilocularis provoque un ensemble de manifestations pathologiques connues comme l’échinococcose alvéolaire (EA), cette entité morbide se différenciant fondamentalement de l’échinococcose hydatique, cette dernière affection étant due à Echinococcus granulosus, un autre ténia échinocoque.

Quand le dernier anneau du parasite est mûr, il se détache, et les œufs ou embryophores qu’il renferme se trouvent éliminés avec les excréments du Renard dans le milieu extérieur.
Les embryophores arrondis mesurent de 30 à 35 μm de diamètre ; à l’intérieur d’une coque épaisse se trouve l’embryon muni de six crochets (embryon hexacanthe).
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
- Guyard A. - Cours de parasitologie. 1980.
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
19:49 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (2) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? Le cycle parasitaire
 2. Le cycle parasitaire de l'échinocoque
2. Le cycle parasitaire de l'échinocoque
par André Guyard
(suite de l'article 1 : l'échinoccose : une maladie franc-comtoise)
Dans la première partie, nous avons vu que c’est le scolex du ver adulte qui bourgeonne les anneaux, le plus jeune anneau étant celui le plus proche de la tête. La longévité du parasite est assez courte puisqu’elle est de l’ordre de 3 à 4 mois.
Quand le dernier anneau du parasite est mûr, il se détache, et les œufs ou embryophores qu’il renferme se trouvent éliminés avec les excréments du Renard dans le milieu extérieur.
Les embryophores arrondis mesurent de 30 à 35 μm de diamètre ; à l’intérieur d’une coque épaisse se trouve l’embryon muni de six crochets (embryon hexacanthe).
Pour poursuivre son cycle biologique, l’embryophore doit être avalé par des rongeurs, essentiellement des microtidés (mulots ou campagnols).

M. arvalis et A. terrestris sont les deux hôtes intermédiaires les plus fréquents de E. multilocularis.
Chez ces hôtes intermédiaires, la morphogenèse larvaire est rapide. La coque de l’embryophore dissoute dans l’estomac, l’embryon hexacanthe est libéré et traverse la paroi intestinale pour gagner le foie par l’intermédiaire du système veineux porte.
La larve d’Echinococcus multilocularis occupe ainsi essentiellement une localisation hépatique, alors que pour la larve d’Echinococcus granulosus, agent de l’échinococcose hydatique, cette localisation est loin d’être exclusive. En 3 à 5 mois, selon le caractère plus ou moins favorable de l’hôte intermédiaire, la larve achève son développement.
Les lésions de l’EA sont très caractéristiques par leur caractère diffus et envahissant, l’absence de formation fibreuse adventicielle ne permettant pas une limitation de l’extension de la tumeur parasitaire comme dans le cas du kyste hydatique.
Le foie, envahi par une multitude de petites vésicules fertiles contenant des protoscolex, présente un aspect dit de "pain bis". Ce bourgeonnement de vésicules correspond à une multiplication larvaire, un véritable clonage.
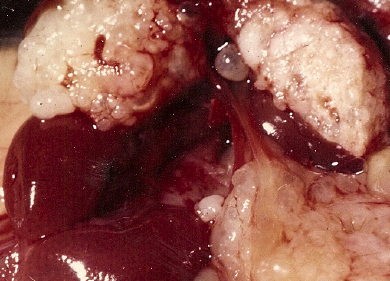
Au-dessus des reins, on observe,
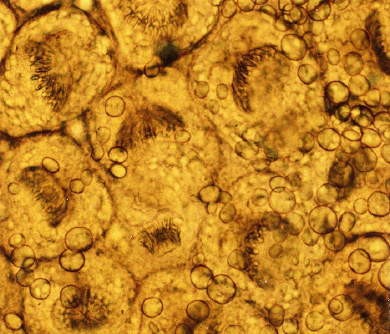
L’intensité de la multiplication des protoscolex est impressionnante (cliché Patrick Giraudoux)
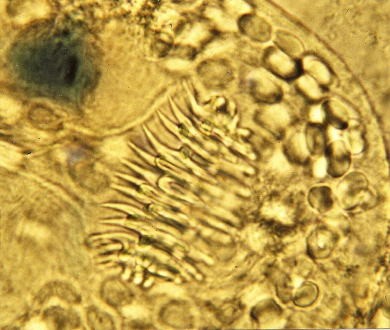


(Document : plaquette de l’Observatoire de l’environnement)
Les renards ne sont pas les uniques responsables de la transmission de l'échinococcose à l'Homme, pas plus que la prairie ou la forêt ne sont ses seuls terrains de prédilection. D'abord, les renards n'hésitent plus à sortir du bois pour trouver de la nourriture facile dans les poubelles, et amènent l'échinocoque jusque dans les villes et les villages. Ensuite, les chats et les chiens peuvent être parasités et transmettre la maladie lors de séances de léchage intempestif ou par l'intermédiaire de leurs excréments infestant la terre. La pratique du jardinage est donc susceptible de favoriser la contamination. Protéger son potager de l'intrusion d'animaux est un impératif. Fermer les bacs à sable des enfants également.

Le Renard est un grand prédateur de campagnols
Cliché DR
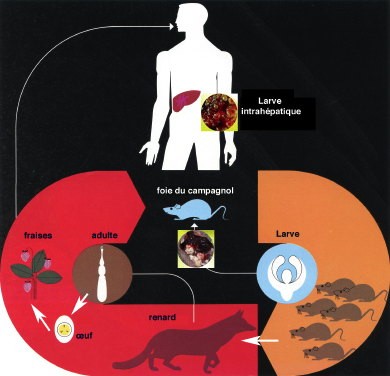
(D’après : Parasitologie, documentation scientifique des laboratoires Roland-Marie)
Bibliographie sommaire :
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr.
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
11:28 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (3) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? La répartition géographique
 3. La répartition géographique de l’échinococcose alvéolaire
3. La répartition géographique de l’échinococcose alvéolaire
par André Guyard
(dernière mise à jour : juillet 2012)
(suite de l'article 2 : le cycle parasitaire)
La répartition géographique d’Echinococcus multilocularis est très particulière. La parasitose ne se rencontre que dans l’hémisphère nord : Eurasie (Sibérie avant tout), Europe centrale (Bulgarie, Pologne, Yougoslavie) et surtout dans la Bavière et le Tyrol. C’est à partir de ce dernier foyer que l’affection s’est propagée vers la Suisse et la France.
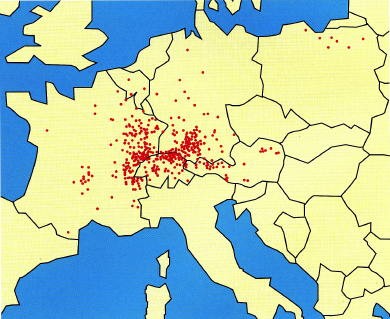
Répartition des cas humains en Europe de 1982 à 2001
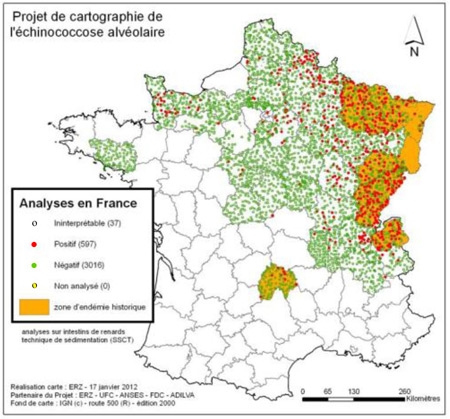
Analyses sur intestins de renards en France (SSCT)
(ERZ, janvier 2012)
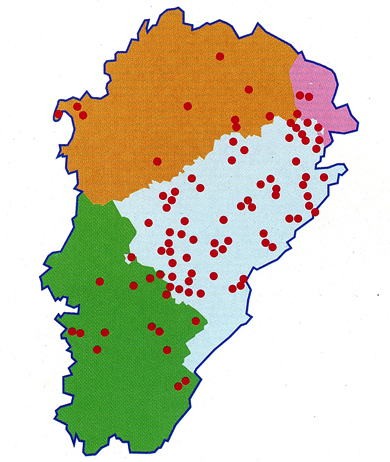
Répartition des 117 cas humains en Franche-Comté
Un réseau européen, constitué en 1997, a permis de répertorier 559 cas d’EA, diagnostiqués entre 1982 et 2000, dont 258 en France (principalement en Franche-Comté, Lorraine, Rhône-Alpes). Depuis 2002, ce réseau est relayé, en France, par le réseau FrancEchino : grâce à un partenariat avec l’Institut de Veille Sanitaire (InVS), tous les nouveaux cas humains d’EA sont enregistrés au CHU de Besançon.
Entre 2001 et 2005, 70 nouveaux cas ont été recensés, avec une incidence annuelle stable : en moyenne 15 nouveaux cas par an. 85 % de ces patients sont originaires des zones d’endémie classique de l’est de la France. Cependant, la localisation de nouveaux patients semble indiquer une extension des foyers de transmission vers le sud (Aveyron, Lozère), l’ouest et le nord (Côte d’Or et Ardennes). L’EA touche essentiellement les personnes ayant un mode de vie rural.
Les études pluridisciplinaires conduites en France et en Chine ont montré que la transmission du parasite et l’exposition humaine sont dues à un ensemble complexe de facteurs écologiques et comportementaux dont l’analyse doit être réalisée à plusieurs échelles spatiales et temporelles.
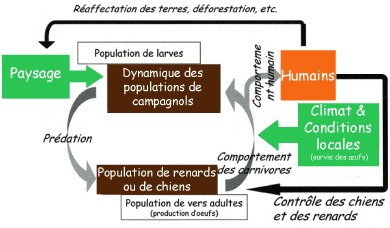
(D'après P. Giraudoux)
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
10:51 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? Évolution épidémiologique et options de contrôle
 4. L’échinococcose alvéolaire : évolution épidémiologique et options de contrôle
4. L’échinococcose alvéolaire : évolution épidémiologique et options de contrôle
par André Guyard
(Suite de l'article 3 : répartition géographique)
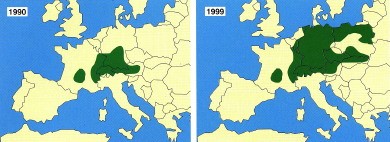
De nombreux éléments indiquent que la situation épidémiologique de l’EA est en train de changer en Europe. On note depuis 1990 une augmentation de la prévalence chez le Renard et l’extension vers le nord de l’aire de distribution du parasite.
À l’heure actuelle, la présence du parasite a été démontrée chez le Renard au Danemark, aux Pays-Bas, en Belgique et de l’ouest au sud de la France (dont les côtes de la Manche et et la région parisienne), jusqu’à la Lithuanie, en passant par la Pologne, la Slovaquie, la Hongrie, et le nord de l’Italie.
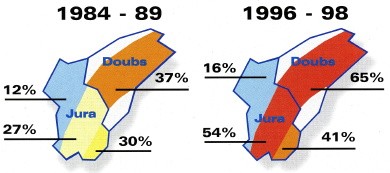
Pour la France, on a pu montrer qu’entre les périodes 1984-1989 et 1996-1999, les prévalences vulpines étaient de 1,4 à 2 fois plus élevées dans les zones d’endémie traditionnelles comme le Haut-Doubs pour atteindre 65 % en hiver, une tendance également constatée dans le sud de l’Allemagne et l’Autriche.

(Document : plaquette de l’Observatoire de l’environnement)
Cette nouvelle situation explique que de fortes prévalences puissent maintenant être observées chez le Renard dans les zones qui ne sont pas connues pour leurs pullulations de rongeurs. C’est le cas par exemple dans les Ardennes, où une prévalence de 53 % a été observé chez le Renard, dans des paysages où les prairies sont fragmentées avec des populations d’hôtes intermédiaires faibles et stables.
Cette augmentation des populations de renards s’est également accompagnée de changements de comportements. Le Renard roux n’est plus seulement rural mais est devenu aussi urbain, ce qui s’est traduit par une implantation du parasite, non seulement aux abords et dans les villages et petites villes des zones traditionnelles d’endémie, mais aussi dans les grandes villes, où elle peut atteindre localement jusqu’à 70 % des animaux dans leur périphérie. L’infestation des renards a été observée à Zurich, Stuttgart, Genève, Copenhague, Nancy et la banlieue parisienne telle qu’en Seine-et-Marne. Quant au cycle urbain entre chats et souris, il est tout à fait exceptionnel.

Par exemple, l’analyse génétique de la population de renards urbains zurichois montre que les échanges avec l’extérieur de la ville sont limités. La présence avérée d’A. terrestris infestés dans les parcs urbains indique que le cycle pourrait y être bouclé. La densité des chiens urbains peut atteindre de 0,5 à 5 individus/ha dans certaines villes, et celle des chats trois fois plus, ce qui rend très probable la prédation de rongeurs infestés.
Dans le contexte rural du canton de Fribourg (Suisse), il a été montré que 7 % des chiens errants et 3 % des chats examinés lors d’un cycle de pullulation d’A. terrestris étaient infestés. Le rôle des chiens et des chats dans l’exposition humaine en Europe, si ce n’est dans le maintien du cycle lui-même, mériterait d’être clarifié notamment dans un contexte urbain.
(Document : plaquette de l’Observatoire de l’environnement)
(Document : plaquette de l’Observatoire de l’environnement)
La régulation par le tir ou le piégeage n’est pas à recommander car, au-delà, des controverses qu’elle peut susciter, elle pourrait conduire à l’effet inverse de celui escompté, en vidant des territoires qui seraient alors très rapidement comblés par des renards ruraux plus infestés, comme ce fut le cas pour la rage.
S’il est évident que l’échinocoque alvéolaire est un parasite qui étend son aire de distribution et augmente l’intensité de sa transmission en Europe, les données qui permettraient de constater un changement de l’épidémiologie humaine sont encore fragmentaires. Ceci peut s’expliquer soit par le fait que ce changement n’entraîne pas, pour des raisons comportementales (hygiène et mode de vie, etc.), une exposition plus forte de la population humaine en ville, soit plus probablement par le fait que l’échinococcose alvéolaire est une maladie longtemps asymptomatique et que les conséquences d’un changement d’exposition ne seront mesurées que plusieurs années après (voir plus bas).
Il serait judicieux que dans l’ensemble des zones européennes concernées, puisse être assuré le meilleur couplage entre un dispositif de surveillance de la parasitose chez les hôtes définitifs (principalement Renard et Chien), seul capable d’anticiper le risque d’exposition, et un dispositif de surveillance de la maladie humaine, qui malheureusement et pour utile qu’il soit en terme d’épidémio-surveillance, ne permet que de constater a posteriori le problème de santé publique posé après que la maladie se soit déjà largement développée.
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
- Guyard A. - Cours de parasitologie. 1980.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
09:03 Publié dans Médecine, Nature et santé, Parasitologie | Tags : parasites | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? La clinique de l'échinococcose alvéolaire
 5. La clinique de l'échinococcose alvéolaire
5. La clinique de l'échinococcose alvéolaire
par André Guyard
(suite de l'article : évolution épidémiologique)
Chez l’Homme, la localisation de l’EA est pratiquement toujours hépatique. Les lésions faites d’une multitude de vésicules communiquant entre elles et donnant à la masse kystique son aspect classique en "pain bis", s’accompagnent chez l’Homme, hôte tout à fait inhabituel des larves, de phénomènes dégénératifs avec nécrose, qui n’empêchent pas le cheminement germinatif ni l’extension des vésicules.
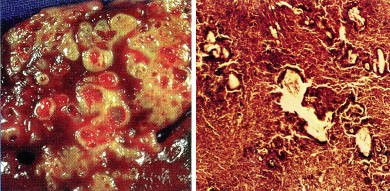
Cependant, dans les quelques rares cas où l’on a constaté de véritables métastases pulmonaires et même cérébrales d’un foyer hépatique initial, on a découvert des scolex au niveau de ces métastases.
D’une façon générale, on pense que ces lésions secondaires sont dues à la mobilisation de petits fragments de membranes issus des vésicules primitives. Entraînés dans le torrent circulatoire, ces fragments finiraient par s’immobiliser dans différents organes et ils y constitueraient le point de départ de nouveaux foyers kystiques.
La biopsie du foie utilisée pour assurer le diagnostic de l’EA, doit par conséquent être faite avec une certaine prudence.
La symptomatologie de l’EA est très discrète au début et cela explique la difficulté d’un diagnostic précoce de l’affection. Ce n’est le plus souvent qu’à un stade plus avancé et tout spécialement lorsque les voies biliaires sont atteintes (cette évolution étant d’ailleurs quasi inéluctable) que la symptomatologie devient expressive.
La parasitose se traduit alors par un ictère de type cholestatique. L’amaigrissement rapide et la constatation à la palpation d’un foie dur et irrégulier évoquent habituellement le cancer du foie métastatique, à moins que les examens biologiques spécifiques ne rétablissent le diagnostic exact.
Dans les autres éventualités cliniques, tout comme au début de l’affection, si l’attention peut être attirée vers le foie par les douleurs de l’hypocondre droit et les troubles dyspeptiques, il est exceptionnel de pouvoir établir le diagnostic d’après la seule clinique.
Il faut savoir ne pas s’arrêter au diagnostic de cancer métastatique du foie et évoquer l’EA. On doit alors s’aider des examens biologiques et d’imagerie médicale adéquats d’autant plus que, lorsque les voies biliaires n’ont pas été manifestement envahies, on peut espérer que les lésions hépatiques sont suffisamment localisées pour permettre de tenter une hépatectomie réglée, capable d’assurer une guérison totale et définitive. La notion d’endémicité dans la région habitée par le malade, celle de contact de ce dernier avec des renards revêtent une grande valeur d’orientation.
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
- Guyard A. - Cours de parasitologie. 1980.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
08:12 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? Le diagnostic
 6. Le diagnostic de l'échinococcose alvéolaire
6. Le diagnostic de l'échinococcose alvéolaire
par André Guyard
(suite de l'article 5 : la clinique de l'échinoccose alvéolaire)
Le diagnostic biologique proprement dit comporte la recherche d’une éosinophilie sanguine, la pratique d’une intradermoréaction spécifique, l’examen anatomopathologique du foie et un certain nombre de réactions sérologiques.
L’éosinophilie sanguine lorsqu’elle existe est très évocatrice d’une étiologie parasitaire ; elle est malheureusement inconstante et non spécifique ; elle peut en outre avoir déjà disparu au moment où la symptomatologie clinique devient patente.
Le test de sensibilisation cutanée pratiqué sous forme d’intradermoréaction à l’aide, non pas d’antigène spécifique, mais d’antigène hydatique, ne possède pas de valeur décisive car, malgré la relative parenté antigénique entre Echinococcus granulosus et Echinococcus multilocularis, la réponse à l’antigène hydatique au cours d’une EA est de faible intensité.
Le risque de déclencher, à l’occasion d’une biopsie hépatique, une échinococcose secondaire, bien que considérablement réduit par rapport à l’hydatidose, existe cependant.
Les méthodes sérologiques classiques de fixation du complément, d’agglutination en utilisant différents supports, d’immunoprécipitation, requièrent un antigène soluble difficile à préparer et à purifier. La plupart du temps, on n’utilise pas un antigène alvéolaire spécifique et on se contente des antigènes hydatiques plus aisément disponibles. On comprend que dans ces conditions, les réactions sérologiques soient entachées d’un manque de sensibilité.
Le meilleur test biologique actuel est constitué par la réaction d’immunofluorescence. Dans cette réaction, on utilise comme antigène figuré des coupes de tumeur d’origine humaine ou animale réalisées par congélation au cryostat. Après la mise en contact de ces coupes avec le sérum du malade suspecté d’EA et l’adjonction du conjugué fluorescent, on procède à une contre coloration à l’aide de bleu Evans.
Lorsque la réaction est positive, les membranes germinatives kystiques présentes sur la coupe congelée montrent une intense fluorescence. En cas de réaction négative, les mêmes membranes germinatives apparaissent en rouge. Mis en présence de coupes de scolex d’Echinococcus granulosus, le sérum de malades atteints d’EA manifeste dans les mêmes conditions expérimentales une réaction d’immunofluorescence positive, mais à un titre inférieur.
Cette différence dans le comportement du sérum vis-à-vis des deux antigènes permet d’envisager de faire le diagnostic différentiel entre les deux échinococcoses.
Les examens par échographie, scanner et IRM sont particulièrement intéressants lors de l’établissement du bilan préopératoire. Leur contribution au diagnostic étiologique n’est cependant pas négligeable.
De nouveaux marqueurs pour pister l'échinococcose humaine (Addition du 05/07/2011)
L'échinococcose soulève encore de nombreuses questions au sein de la communauté scientifique. Si l'on sait détecter la maladie, on ne connaît en revanche pas bien son aspect fonctionnel. Sur des territoires particulièrement touchés par cette parasitose en Europe, l'université de Franche-Comté et l'université de Berne font preuve de recherches très actives. Un projet franco-suisse vient d'obtenir un soutien financier dans le cadre du programme Interreg, visant à améliorer les résultats obtenus grâce à une technique d'imagerie médicale particulièrement adaptée, la tomographie par émission de positons (TEP).
Relativement rare en Europe, où elle tend cependant à augmenter, l'échinococcose, se concentre principalement en Franche-Comté, en Suisse et en Allemagne. Un tiers des patients atteints sont guéris par chirurgie (ablation de la partie de foie infecté), deux tiers doivent supporter un traitement à vie. Une centaine de patients venus de toute la France sont actuellement suivis au CHU de Besançon, centre collaborateur de l'OMS pour toutes les échinococcoses humaines. La tomographie par émissions de positons (TEP) est la technique d'imagerie fonctionnelle employée pour dépister la maladie, à l'aide de traceurs radioactifs introduits dans l'organisme. Le fluoro-deoxyglucose (FDG) est le plus couramment utilisé. Rendu radioactif par un marquage au fluor, ce glucose est détecté par la caméra TEP alors qu'il se concentre autour de la lésion. Car les cellules de défense de l'organisme, très actives à l'endroit précis de l'infection, "attirent" à elles le glucose, énergie qu'elles consomment en grande quantité pour être efficaces. Conclusion : là où se trouve le glucose se trouve aussi la lésion.
La recherche s'oriente vers la mise au point de nouveaux traceurs, des molécules susceptibles d'être consommées directement par le parasite et par lui seul. « On pourra alors directement étudier la maladie et connaître le comportement du parasite pour mieux le détruire » explique Okg Blagoskionov, médecin et enseignant-chercheur en imagerie médicale à l'Université de Franche-Comté. L'espoir de mettre au point un nouveau traitement, permettant d'éradiquer l'échinocoque, est à la clé de ces recherches. Le projet IsotopEchino participe à la réalisation de ces travaux, intègre le financement de thèses, notamment en cotutelle avec des universités en Chine, où la parasitose est très répandue. Les fonds octroyés s'élèvent à 249 905 € pour la participation FEDER et 68 343 € pour les subventions suisses, sur un coût total de 815 972 €.
*Contact : Oleg Blagosklonov – Service de médecine nucléaire - CHU Jean Minjoz de Besançon Tél. (0033/0) 3 8l 66 82 94 - oleg-blagoskIonov.univ-fcomte.fr.
Bibliographie sommaire :
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
- Mantion G. et al – Le traitement de l’échinococcose alvéolaire humaine : une approche multidisciplinaire. Bull. Acad. Natle Méd. 2008, 192, n° 6, 1151-1158.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
07:20 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? Le traitement
 7. Le traitement de l'échinoccose alvéolaire
7. Le traitement de l'échinoccose alvéolaire
par André Guyard
(suite de l'article 6 : le diagnostic de l'échinoccose alvéolaire)
On ne connaît encore aucun traitement médical réellement efficace de l’échinococcose alvéolaire. Cette parasitose est caractérisée par une grande latence clinique mais en l’absence de traitement, la mortalité atteint 80 % dans les dix ans après le diagnostic. Ceci est dû à l’absence de traitement médicamenteux totalement et rapidement efficaces à l’heure actuelle.
Un tiers des patients atteints sont guéris par chirurgie (ablation de la partie de foie infecté), deux tiers doivent supporter un traitement à vie. Une centaine de patients venus de toute la France sont actuellement suivis au CHU de Besançon, centre collaborateur de l’OMS pour toutes les échinococcoses humaines.
La chirurgie d’exérèse est actuellement la seule thérapeutique capable d’apporter la guérison, à la condition qu’elle soit appliquée le plus tôt possible, avant l’extension incontrôlable des lésions. L’hépatectomie réglée segmentaire ou à la rigueur lobaire sur des lésions encore localisées amène ainsi la guérison définitive. La chirurgie demeure le premier choix pour guérir environ 30 % des patients en retirant toute la masse parasitaire avec une marge de sécurité suffisante et dans un certain nombre de cas avec des procédés complexes de reconstruction vasculaire et biliaire.
La transplantation hépatique peut être indiquée si une hépatectomie partielle est insuffisante pour obtenir la guérison chez des patients très sélectionnés présentant des complications sévères menaçant leur vie (environ 5 % des cas).
Les procédures d’endoscopie interventionnelle sont utiles pour drainer les abcès intrahépatiques ou les voies biliaires quand l’exérèse chirurgicale n’est pas possible ou pour préparer celle-ci.
Dans tous les cas, le traitement parasitostatique par les dérivés benzimidazolés, principalement l’albendazole, en administration continue est recommandé pendant deux ans après résection radicale ou à vie pour les patients inopérables.
L’albendazole est une molécule utilisée chez tous les malades.
Ce produit stoppe l’évolution du parasite mais
malheureusement, ne le tue pas. Il doit être pris à vie.

Traitement de l’échinoccose alvéolaire en Franche-Comté
Taux de survie à 5 ans des malades diagnostiqués et traités
(Document : plaquette de l’Observatoire régional de l’environnement).
La tomographie par émissions de positons (TEP) est la technique d’imagerie fonctionnelle employée pour dépister la maladie, à l’aide de traceurs radioactifs introduits dans l’organisme. Le fluoro-deoxyglucose (FDG) est le plus couramment utilisé. Rendu radioactif par un marquage au fluor, ce glucose est détecté par la caméra TEP alors qu’il se concentre autour de la lésion. Car les cellules de défense de l’organisme, très actives à l’endroit précis de l’infection, « attirent » à elles le glucose, énergie qu’elles consomment en grande quantité pour être efficaces. Conclusion : là où se trouve le glucose se trouve aussi la lésion.
L’antigénothérapie aurait, dans les mains de ses promoteurs, apporté des rémissions passagères, sans toutefois modifier de façon radicale le pronostic de l’échinococcose alvéolaire dont l’évolution spontanée est toujours mortelle, bien que parfois extrêmement prolongée.
La recherche s’oriente vers la mise au point de nouveaux traceurs, des molécules susceptibles d’être consommées directement par le parasite et par lui seul. « On pourra alors directement étudier la maladie et connaître le comportement du parasite pour mieux le détruire » explique Oleg Blagosklonov, médecin et enseignant-chercheur en imagerie médicale à l’université de Franche-Comté. L’espoir de mettre au point un nouveau traitement, permettant d'éradiquer l'échinocoque, est à la clé de ces recherches.
Le projet IsotopEchino participe à la réalisation de ces travaux, intègre le financement de thèses, notamment en cotutelle avec des universités en Chine, où la parasitose est très répandue.
Quoi qu’il en soit des chances de la chirurgie d’exérèse et peut-être demain d’une antigénothérapie rénovée, à laquelle la possibilité récemment démontrée de pouvoir cultiver les larves d’Echinococcus multilocularis contribuera sans doute, l’échinococcose alvéolaire reste une affection très grave.
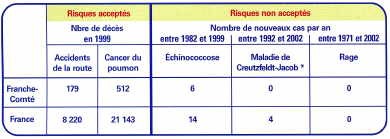
Mais les cas humains restent peu nombreux.
Sur le plan individuel, il faut éviter, dans les régions endémiques, de consommer crus des fruits sauvages et d’être en contact avec les animaux susceptibles d’être porteurs du parasite adulte. Il est bon aussi de vermifuger régulièrement chats et chiens.
Bibliographie sommaire :
Mantion G. et al – Le traitement de l’échinococcose alvéolaire humaine : une approche multidisciplinaire. Bull. Acad. Natle Méd. 2008, 192, n° 6, 1151-1158.
Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
Guyard A. - Cours de parasitologie. 1980.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
07:19 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |