09/09/2015
Le microbiote intestinal
Le microbiote intestinal
(Dernier ajout : mars 2016)
Nous avons plus de bactéries dans notre corps que de nos propres cellules. Sur la peau, les muqueuses, et surtout l'intestin. Au cœur de nos entrailles, quelque 13 000 milliards de microbes vivent en permanence avec nous, nichés à la surface de nos intestins — le désormais fameux microbiote intestinal — une surface de 200 m2, équivalant à celle d'un court de tennis. De sorte que nos bactéries intestinales résidentes (500-1000 sp.) sont plus nombreuses que les cellules somatiques et les cellules germinales humaines (10 000 milliards) et représentent un génome microbien combiné (métagénome) supérieur (x 1,3) au génome humain.

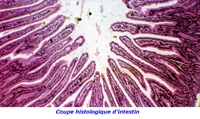
Villosités intestinales
Remarque :
Durant de nombreuses années, on considérait que le microbiote intestinal était composé de 100 000 miliards de microbes. Or en 2015, trois chercheurs de l’Institut des sciences Weizman (Rehovot, Israël) se sont rendu compte que ce chiffre traînait dans la littérature biomédicale depuis 1977 et qu’il avait été lui-même repris d’un article publié en 1972. Bref, depuis tout ce temps, tout se monde se copie, sans que personne n’aille vérifier ce qu’il en est vraiment sur la base des données disponibles les plus fiables et les plus récentes. Les chercheurs israéliens ont alors décidé d'effectuer de nouveaux calculs, et leur résultat bat en brèche ce chiffre de 1014 bactéries. Le rapport bactéries/cellules serait plus proche de 1,3/1. En d’autres termes, il y aurait sensiblement le même nombre de bactéries que de cellules humaines.
Cliché © Institut Pasteur
Pourquoi hébergeons-nous une flore intestinale ?
 Dans la relation symbiotique entre bactéries résidentes et l'hôte eucaryote, les bactéries profitent d'un environnement stable (température, oxygène, pH, nutriments approvisionnement). Ces microbes intestinaux vivent pour la plupart en bonne intelligence avec nous et sont en quelque sorte nos alliés : ils jouent un rôle crucial dans notre nutrition et notre santé. Sans notre microbiote intestinal, nous serions incapables d'assimiler certains aliments que seules les bactéries savent digérer. Elles ont un rôle fondamental dans la conversion des aliments en nutriments et en énergie, et assurent la synthèse de vitamines indispensables à l'organisme. Notre microbiote intestinal constitue de plus une barrière contre les microbes pathogènes, et participe à la maturation de notre système immunitaire. Il assure donc des fonctions essentielles pour celui qui l'héberge. L'hôte y gagne une extension métabolique, une capacité digestive, une inhibition compétitive contre les microbes pathogènes / allogéniques (effet barrière) et la stimulation contrôlée de la muqueuse du système immunitaire / systémique.
Dans la relation symbiotique entre bactéries résidentes et l'hôte eucaryote, les bactéries profitent d'un environnement stable (température, oxygène, pH, nutriments approvisionnement). Ces microbes intestinaux vivent pour la plupart en bonne intelligence avec nous et sont en quelque sorte nos alliés : ils jouent un rôle crucial dans notre nutrition et notre santé. Sans notre microbiote intestinal, nous serions incapables d'assimiler certains aliments que seules les bactéries savent digérer. Elles ont un rôle fondamental dans la conversion des aliments en nutriments et en énergie, et assurent la synthèse de vitamines indispensables à l'organisme. Notre microbiote intestinal constitue de plus une barrière contre les microbes pathogènes, et participe à la maturation de notre système immunitaire. Il assure donc des fonctions essentielles pour celui qui l'héberge. L'hôte y gagne une extension métabolique, une capacité digestive, une inhibition compétitive contre les microbes pathogènes / allogéniques (effet barrière) et la stimulation contrôlée de la muqueuse du système immunitaire / systémique.
La coévolution a créé un "paradoxe immunologique ou "inflammation physiologique" chez les hôtes mammifères qui oblige à conjuguer la tolérance aux bactéries commensales et la reconnaissance rapide et efficace et l'élimination des agents pathogènes bactériens entraînant une inflammation.
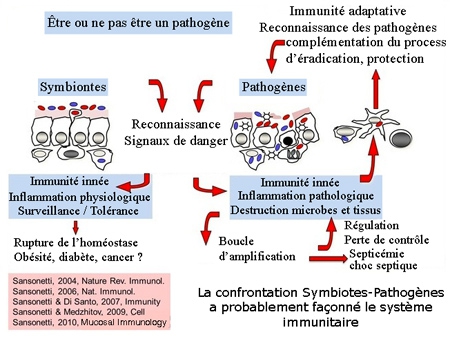
D'après P. Sansonnetti
De sorte que l'on peut considérer le microbiote intestinal comme un organe supplémentaire virtuel à part entière, non palpable mais avoisinant les deux kilogrammes chez l'adulte, un poids supérieur à celui de notre cerveau... La flore intestinale représente une activité métabolique collective équivalente à un organe.
1000 espèces de bactéries
Un peu plus de 1000 espèces bactériennes entrent dans sa composition chez l'Homme. Chacun d'entre nous en héberge près de 200. Chaque individu a donc un microbiote qui lui est propre en termes de combinaison d'espèces.
Ces données ont été révélées par deux grands programmes, l'un aux États-Unis[1], l'autre en Europe[2], visant notamment à identifier l'ensemble des gènes du microbiote, qu'on nomme « microbiome ». Dès 2010, à partir de l'analyse des microbiotes de 124 européens, le consortium MetaHit établissait que le microbiome - notre « autre » génome - comprenait 3,3 millions de gènes (150 fois plus que le génome humain).
Le poids du microbiote intestinal avoisine les deux kilogrammes chez l'adulte, un poids supérieur à celui de notre cerveau... Il est essentiellement constitué de bactéries, mais contient aussi virus, parasites ou champignons microscopiques.
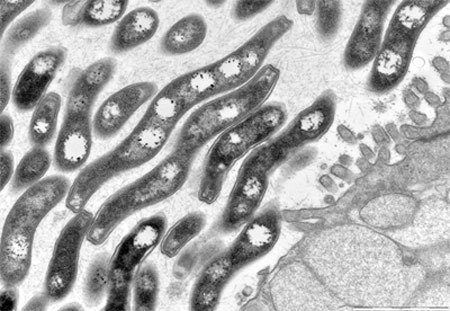
Microbiote et villosités intestinales
(Coupe au microscope électronique)
Le microbiote intestinal humain est dominé par cinq phyla bactériens (Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria et Verrucomicrobia) et un Archaea (Euryarchaeota).
Les groupes bactériens les moins répandus sont distribués parmi les Cyanobacteria, Fusobacteria, Lentisphaerae, spirochaetes et TM7.
Le phylum des Firmicutes comprend les genres Ruminococcus, Clostridium, Lactobacillus (dont plusieurs sont des probiotiques), les producteurs de butyrate Eubacterium, Faecalibacterium et Roseburia.
Le phylum des Bacteroidetes comprend les genres Bacteroides, Prevotella et Xylanibacter dégradant une série de glycanes complexes.
Le phylum des Actinobacteria comprend les genres Coninsella et Bifidobacterium (contenant des souches probiotiques).
Le phylum des Proteobacteria comprend les genres Escherichia (famille des entérobactéries) et desulfovibrio (contenant des bactéries réductrices de sulfates), Verrucomicrobia (récemment découvert) et Akkermanala (specialiste de la dégradation de mucus).
Le phylum des Euryarchaeota contient le genre Methanobrevibacter (impliqué dans la poursuite de la méthanogenèse intestinale).
Cette flore intestinale fait l'objet d'un nombre croissant d'études. Et pour cause : un déséquilibre de ce microbiote a été associé à de très nombreuses maladies — maladies inflammatoires de l'intestin mais aussi obésité, diabète, sclérose en plaques, allergies, cancer du côlon, et même maladies psychiatriques (autisme, dépression...). Contre elles, des traitements radicalement nouveaux sont désormais envisagés.
Comment se constitue ce microbiote intestinal ?
 Presque stérile in utero, l'intestin est colonisé à la naissance. Dès que les membranes fœtales se rompent, la colonisation bactérienne commence. Le mode d'accouchement (les enfants nés par césarienne auraient un microbiote différent de ceux nés par voie vaginale), le type d'alimentation (lait maternel ou lait en bouteille, alimentation de sevrage), le microbiote maternel, l'environnement et l'hygiène de l'environnement néonatal, la prise de médicaments et d'antibiotiques influencent cette colonisation microbienne chez le nouveau-né.
Presque stérile in utero, l'intestin est colonisé à la naissance. Dès que les membranes fœtales se rompent, la colonisation bactérienne commence. Le mode d'accouchement (les enfants nés par césarienne auraient un microbiote différent de ceux nés par voie vaginale), le type d'alimentation (lait maternel ou lait en bouteille, alimentation de sevrage), le microbiote maternel, l'environnement et l'hygiène de l'environnement néonatal, la prise de médicaments et d'antibiotiques influencent cette colonisation microbienne chez le nouveau-né.
Une exposition à une faible diversité bactérienne dans la période néonatale peut empêcher ou retarder la maturation du système immunitaire et favoriser des réponses rnucosales aberrantes à des allergènes ou des auto-antigènes et l'apparition de pathologies associées.
La composition du microbiote intestinal se complexifie ensuite progressivement avec l'âge, mais s'établit principalement au cours des 3 premières années de vie. Cette composition est ensuite relativement stable chez l'adulte, mais peut varier provisoirement en fonction des conditions extérieures : régime alimentaire, infections virales ou bactériennes, prise d'antibiotiques... Le microbiote tend néanmoins à revenir à son état initial en 1 à 2 mois. Mais une succession de déséquilibres transitoires finit par l'altérer, avec des conséquences néfastes sur la santé.
L'appauvrissement du microbiote en question
Ces déséquilibres sont particulièrement cruciaux dans la période critique de 0 à 3 ans. L'administration d'un traitement antibiotique à des nouveau-nés de faible poids entraîne une diminution drastique de leur microbiote intestinal, qui perd en densité et en diversité, ce qui pourrait favoriser la genèse de maladies inflammatoires intestinales, de certaines formes d'obésité ou encore de l'asthme: des études ont par exemple montré que le microbiote intestinal des enfants asthmatiques différait de celui des enfants sains. Chez l'adulte, les études épidémiologiques et expérimentales se multiplient, mettant en cause des déficiences du microbiote intestinal (une perte de sa diversité le plus souvent) dans les maladies inflammatoires de l'intestin (maladie de Crohn, rectocolite hémorragique...), l'obésité, le diabète de type II, la sclérose en plaques, le cancer du côlon, certaines maladies cardiovasculaires (voir plus loin le paragraphe "de l'athérosclérose au cancer du côlon).
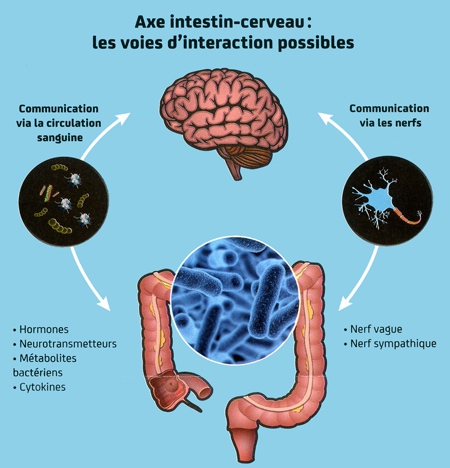
Un axe « intestin-cerveau »
Plus étonnant encore, le microbiote intestinal interviendrait sur les fonctions cérébrales et le comportement. Des expériences sur des modèles expérimentaux ont montré que perturber la composition des populations de bactéries intestinales — avec des antibiotiques par exemple — pouvait induire un comportement anxieux. Des études de plus en plus nombreuses pointent l'influence du microbiote dans l'émergence de pathologies psychiatriques comme les troubles de l'humeur, la dépression, l'autisme ou la schizophrénie. On parle aujourd'hui d'un "axe intestin-cerveau" où s'établirait un "dialogue" entre nos bactéries intestinales et notre cerveau. Comment cette communication a-t-elle lieu ? Les hypothèses sont nombreuses, mais rien n'est aujourd'hui établi.
Des stratégies thérapeutiques nouvelles
De l'obésité à la dépression en passant par l'asthme ou la sclérose en plaques, toutes les études impliquant le microbiote amènent une même interrogation : pourrait-on soigner certaines maladies en modifiant ce microbiote ? De nouvelles stratégies sont envisagées : des interventions nutritionnelles, l'administration de probiotiques - c'est-à-dire de microbes vivants ayant un effet bénéfique sur la santé (voir p. 9) —, de pré biotiques — des composés qui stimulent la croissance de nos « bonnes » bactéries — ou d'antibiotiques. (voir paragraphe suivant : Comment nos bactéries intestinales communiquent-elles avec notre cerveau ?).
L'objectif est de renforcer et favoriser les populations microbiennes bénéfiques. Soigner un jour la dépression ou l'asthme avec des compléments alimentaires semble aujourd'hui du domaine du possible et de nombreuses expérimentations visant à modifier le microbiote intestinal sont en cours.
Une autre thérapie, plus radicale, a le vent en poupe ; la transplantation fécale, qui consiste à remplacer la flore intestinale d'un malade par celle d'un donneur. À l'essai pour diverses maladies, elle a récemment fait ses preuves pour soigner des patients souffrant d'une infection chronique causée par la bactérie Clostridium difficile. Cette bactérie responsable de nausées et de diarrhées sévères pouvant entraîner la mort est de plus en plus résistante à l'antibiothérapie. La greffe de microbiote permet alors de l'éradiquer dans 90% des cas. Quelques milliers de personnes dans le monde, y compris en France, ont déjà bénéficié de cette technique contre Clostridium difficile. Administration de probiotiques ou greffes de microbiotes : des thérapies nouvelles sont en train de naître, mais la manipulation du microbiote — un écosystème complexe s'il en est — n'en est qu'à ses balbutiements. L'exploration de notre monde intérieur ne fait que commencer.
Comment nos bactéries intestinales communiquent-elles avec notre cerveau ?
« Il y a plusieurs façons possibles pour nos bactéries de communiquer avec le cerveau », souligne le neurobiologiste Uwe Maskos. « Certaines bactéries du microbiote intestinal sécrètent par exemple des neurotransmetteurs comme la sérotonine, dont certains pourraient agir sur le nerf vague qui assure une communication bidirectionnelle cerveau-intestin. Des composés microbiens peuvent aussi agir directement sur les autres cellules du tube digestif, comme les neurones qui permettent à l'intestin de se contracter ou les cellules immunitaires qui montent la garde. Ou encore certains produits bactériens issus de la lumière intestinales et accédant à la circulation sanguine agiraient directement sur le cerveau, ce qui pourrait être le cas pour un composé bactérien que nous étudions ici, à l'Institut Pasteur».
Ces trois dernières années en effet, un projet collaboratif entre microbiologistes, immunologistes et neurobiologistes[3] de l'Institut Pasteur a porté sur une molécule de la paroi des bactéries : le "peptidoglycane". «Relargué lors de la division bactérienne, il est sans cesse sécrété par le microbiote intestinal», explique le microbiologiste Ivo Gomperts Boneca. « Et nous avons montré qu'il était capable d'agir à distance sur le cerveau ». Les chercheurs pasteuriens ont mis en évidence que des récepteurs microbiens, les récepteurs "NOD", découverts il y a une quinzaine d'années à l'Institut Pasteur, étaient présents sur certains neurones du cerveau. D'après leurs résultats préliminaires, obtenus dans des modèles expérimentaux, en l'absence de ces récepteurs, des changements de comportement apparaissent et les phases du sommeil paradoxal (le sommeil des rêves) ont tendance à disparaître. Le peptidoglycane passe-t-il la barrière hémato-encéphalique pour agir directement sur ces récepteurs dans le cerveau ou bien existe-t-il des étapes intermédiaires, avec des médiateurs ? C'est ce que les chercheurs essayent de comprendre. Déchiffrer le dialogue moléculaire entre microbiote et cerveau est un enjeu majeur si l'on veut à terme proposer de nouvelles stratégies thérapeutiques pour traiter des maladies psychiatriques.

Cliché © Institut Pasteur
Chimiothérapie : Quand nos bactéries intestinales viennent en renfort
Les traitements de chimiothérapie anticancéreuse agiraient plus efficacement à l'aide de la flore intestinale. C'est l'étonnante découverte de chercheurs de Gustave Roussy, de l'Inserm, de l'Institut Pasteur et de l'Inra[4] : ils ont démontré dès 2013 que l'efficacité d'une des molécules les plus utilisées en chimiothérapie anticancéreuse (la cyclophosphamide) repose en partie sur sa capacité à entraîner le passage de certaines bactéries du microbiote intestinal vers la circulation sanguine et les ganglions. Une fois dans les ganglions lymphatiques, ces bactéries stimulent de nouvelles défenses immunitaires qui vont aider l'organisme à combattre encore mieux la tumeur cancéreuse. Un peu comme un adjuvant pour vaccin. Les chercheurs ont aussi montré qu'à l'inverse, en supprimant certaines bactéries du microbiote intestinal dans des modèles expérimentaux, l'efficacité de la chimiothérapie diminuait. «Maintenant que les bactéries "bénéfiques" potentialisant la réponse immunitaire et tumorale ont été identifiées, on devrait réussir rapidement à en fournir plus à l'organisme, notamment via des pro- ou des pré-biotiques et/ou une alimentation spécifique », explique le Dr Ivo Gomperts Boneca à l'Institut Pasteur. « Nous avons déjà identifié deux souches bactériennes (un entérocoque et un lactobacille) qui améliorent la réponse à un traitement assez classique. »

Cliché © Institut Pasteur
Un grand programme "Microbes et cerveau" lancé à l'Institut Pasteur
Quel est l'impact du microbiote sur l'activité du cerveau ? Comment des micro-organismes — en sécrétant des molécules ou par d'autres mécanismes — peuvent-ils affecter les fonctions cérébrales ? Quel est le lien réel entre microbiote et maladies mentales ?
Pour répondre à de telles questions, l'Institut Pasteur vient de lancer le Grand Programme Fédérateur Microbes et cerveau[5], réunissant des chercheurs de différents départements de l'Institut Pasteur à Paris (Neuroscience, Microbiologie, Immunologie...), des scientifiques du Réseau International des Instituts Pasteur et des collaborateurs extérieurs. Plusieurs projets de recherche sont tancés. L'un vise à comprendre la sensibilité des nouveau-nés aux méningites bactériennes, liée à l'immaturité du microbiote intestinal, en étudiant l'impact de ce microbiote sur la barrière hémato-encéphalique et sur l'immunité du système nerveux central. D'autres concernent par exemple la possible contribution du microbiote intestinal dans la dépendance aux drogues via des récepteurs dans le cerveau (récepteurs nicotiniques à l'acétylcholine), ou bien encore le lien entre microorganismes et schizophrénie (avec l'hôpital Henri Mondor à Créteil), deux projets qui évalueront également, sur des modèles expérimentaux, l'utilisation thérapeutique de probiotiques.
De l'athérosclérose au cancer du colon
« Mon équipe est formée à l'analyse moléculaire des échanges entre les microbes et l'hôte, et nous avons longtemps travaillé sur des microbes pathogènes avant d'adapter nos connaissances à l'étude du microbiote », raconte le Pr Philippe Sansonetti, responsable de l'Unité de Pathogénie microbienne moléculaire à l'Institut Pasteur. « Un de nos projets porte par exemple sur une bactérie intestinale appelée Lactobacillus casei. Nous avons identifié les gènes qui lui permettent de coloniser l'intestin, puis nous avons montré que cette bactérie jouait un rôle sur le métabolisme des lipides et particulièrement sur la façon dont l'épithélium intestinal les perçoit, les absorbe, les métabolise et les transfère dans la circulation. Nous étudions actuellement l'impact de la quantité et la qualité de ces lipides sur l'installation ou l'aggravation éventuelle des plaques d'athérome, dépôts de graisse sur la paroi des vaisseaux sanguins à l'origine de maladies cardio-vasculaires.… »
Ces travaux sont d'ailleurs inscrits dans un programme européen sur l'athérosclérose - Atheroflux - qui vise à identifier des facteurs de risque et des biomarqueurs de l'athérosclérose et à découvrir de nouvelles pistes de recherche sur cette pathologie.
Un autre projet de l'équipe de Philippe Sansonetti concerne les "cryptes intestinales", situées à la base des microvillosités intestinales : y sont stockées les cellules souches de l'épithélium intestinal, qui servent à son renouvellement. Là encore, le microbiote jouerait un rôle. « En collaboration avec le service de gastroentérologie de l'hôpital Henri Mondor à Créteil, nous avons identifié certaines bactéries dans le côlon dont on pense qu'elles stabilisent les conditions intestinales et protègent les cellules souches », précise Philippe Sansonetti. « La rupture de cet équilibre au niveau de la crypte pourrait être en cause dans des maladies inflammatoires de l'intestin et le cancer du côlon. »
Cliché © Institut Pasteur
Nous entrons dans une nouvelle ère thérapeutique
ENTRETIEN avec Gérard Eberl Chef de l'Unité Microenvironnement et immunité à l'Institut Pasteur
 Vous êtes un des scientifiques travaillant sur le Grand Programme Fédérateur "Microbes et cerveau" lancé à l'Institut Pasteur (voir paragraphe précédent : Un grand programme "Microbes et cerveau" lancé à l'Institut Pasteur). Que sait-on aujourd'hui des relations entre nos bactéries intestinales et notre cerveau ?
Vous êtes un des scientifiques travaillant sur le Grand Programme Fédérateur "Microbes et cerveau" lancé à l'Institut Pasteur (voir paragraphe précédent : Un grand programme "Microbes et cerveau" lancé à l'Institut Pasteur). Que sait-on aujourd'hui des relations entre nos bactéries intestinales et notre cerveau ?
On sait encore très peu de choses. Des études épidémiologiques montrent que les maladies mentales, comme l'autisme par exemple, sont associées à des problèmes intestinaux. Et nous savons tous que le stress passe souvent par le ventre. Il existe également une comorbidité entre les maladies gastro-intestinales chroniques et des symptômes psychiatriques. Mais les mécanismes d'interaction entre microbiote et cerveau sont inconnus. Des composés bactériens issus de la lumière intestinale et qui accèdent à la circulation sanguine pourraient agir directement sur la physiologie et le cerveau de l'hôte, comme le suggèrent les premiers résultats d'études que nous menons à l'Institut Pasteur (voir encadré p. 2). Grâce aux techniques modernes de manipulation du microbiote et d'analyse des molécules impliquées dans le dialogue microbe-hôte, l'impact du microbiote sur le cerveau est un champ d'investigation qui connaît un nouvel essor. À l'Institut Pasteur, nous avons la chance d'avoir des chercheurs de disciplines très variées. Un atout majeur du nouveau programme "Microbes et cerveau" vient précisément de la synergie entre différentes expertises, en associant notamment des microbiologistes, des immunologistes et des neurobiologistes.
Plus globalement, en tant qu'immunologiste, comment abordez-vous l'étude du microbiote ?
Je vois le système immunitaire comme une interface entre le microbiote et l'hôte. Le système immunitaire produit des récepteurs programmés pour percevoir des bactéries ou des virus, et génère des millions de nouveaux récepteurs tous les jours. En ce sens, il est essentiellement un système de reconnaissance qui perçoit l'environnement et traduit ce qu'il voit à son hôte. De plus, on s'aperçoit aujourd'hui qu'il y a une période très importante après la naissance, pendant laquelle le système immunitaire continue à se développer. Si l'on altère le microbiote pendant cette période, on observe des déviations du système immunitaire à long terme. Par exemple, les enfants traités tôt avec des antibiotiques auront une tendance à développer des allergies. Le microbiote joue donc un rôle très important dans sa maturation. Un des projets de mon laboratoire est d'identifier les bactéries qui influencent le développement du système immunitaire pendant cette période critique, de comprendre comment se fait cette interaction et quelles sont les conséquences si cette interaction est altérée.
Quid des applications thérapeutiques ? Sont-elles encore lointaines ?
Non, nous n'en sommes pas loin, il y a déjà des données très intéressantes. Comme le transfert de microbiote chez des patients quasiment inguérissables auparavant car infectés par une bactérie très résistante aux antibiotiques, Clostridium difficile. Un transfert de microbiote à partir de gens sains permet de chasser le pathogène. Comment ça marche ? Des bactéries du microbiote vont prendre sa place et créer un environnement défavorable au pathogène. Chaque microbe a sa petite niche, son petit chez soi. D'ailleurs, Clostridium difficile a des cousins Clostridium dans le microbiote, mais qui ne sont pas pathogènes et vont entrer en compétition pour la même niche. Nous entrons donc dans une nouvelle ère thérapeutique. Avec l'antibiotique, on tue de nombreuses bactéries ; avec les nouvelles thérapies agissant sur le microbiote comme les probiotiques, on amène une bonne bactérie qui chasse la mauvaise.
[1] The Human Microbiome Project
[2] The Metagenomics of the Human Intestinal Tract (MetaHIT) en Europe
[3] Équipes d'Ivo Gomperts Boneca lUnirô Biologie et génétique de la paroi bactérienne), de Gérard Eberl (Unité Microenvironnement et Immunité) avec Grégoire Chevalier, de Pierre-Marie iledo (Unité Perception et mémoire) avec Gabriel Lepousez, et d'Uwe Maskos (Unité Neurobiologie intégrative des systèmes cholinergiques) avec Morgane Besson.
[4] Équipe dirigée par le Pr Laurence Zitvogel, à l'Institut Gustave Roussy et directrice de l'Unité Inserm 1015 Immunologie des tumeurs et immunothérapie, en collaboration avec l'Institut Pasteur (Dr Ivo Gomperts Boneca, unité Biologie et génétique de la paroi bactérienne) et des chercheurs del'INRA (Dr Patricia Lepage et Dr Joël Doré, Unité Micalis Microbiologie de l'alimentation au service de la Santé).
[5] Ce programme a reçu le soutien de la Fondation Daniel & Nina Caressa
Source : La lettre de l'Institut Pasteur n° 90 septembre 2015.
Voir aussi le blog de Max Gozlan.
En savoir plus :
Le magazine Science & Vie consacre un dossier complet sur le microbiote intestinal dans son numéro d'avril 2016
Science & Vie, Les super-pouvoirs du ventre n° 1183 avril 2016 pp 48-66.
08:55 Publié dans Médecine | Tags : microbiote intestinal, microbiome, institut pasteur | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
03/10/2013
Les bactéries font et défont les espèces
 Les bactéries font et défont les espèces
Les bactéries font et défont les espèces
par Émilie Rauscher
(Science & Vie n° 1152, septembre 2013, pp. 106-111)
Les bactéries logées à l'intérieur de tout organisme vivant, y compris celles de la flore intestinale, influencent son évolution… Au point, parfois, de créer de nouvelles espèces. L'hypothèse avait été formulée il y a quelque temps déjà... En 1927, le microbiologiste américain Ivan Wallin notait :
"C'est une proposition pour le moins étonnante de dire que les bactéries, communément associées à la maladie, pourraient en fait être un facteur fondamental dans l'apparition de nouvelles espèces..."
Tellement étonnante, d'ailleurs, qu'elle fut rapidement oubliée, d'autant que les arguments pour la démontrer n'existaient pas... Ou plutôt pas encore. Car aujourd'hui, alors qu'ils mesurent encore à peine à quel point les bactéries sont partout – des abysses à nos cellules – ; alors qu'ils commencent à réaliser l'importance des relations ultimes et durables (symbioses) qu'elles ont tissées avec tout ce qui vit ; alors qu'ils découvrent enfin tout ce dont elles sont capables... finalement, les scientifiques en viennent à se dire qu'il y avait peut-être du vrai dans cette vieille idée folle !
Selon Bordenstein, professeur de biologie à l'université Vanderbilt (Nashville, EtatsUnis), lui, en est convaincu depuis plus de dix ans déjà : "Une nouvelle espèce pourrait bien apparaître, non seulement parce que ses gènes mutent au sein de ses propres cellules, mais aussi parce que les communautés microbiennes qu'elle héberge (dans ses intestins, etc.) changent ! " Et il a désormais de quoi étayer cette hypothèse, qui non seulement renouvelle notre compréhension de la complexe mécanique de l'évolution, mais fait des bactéries l'un des maîtres, aussi majeur que méconnu, du destin des espèces...
NOUS SOMMES TOUS DES ÉCOSYSTÈMES
Inspiré par Ivan Wallin, mais aussi par d'autres prédécesseurs visionnaires comme la biologiste américaine Lynn Margulis, qui avait perçu dès les années 1970 l'importance de la symbiose, Seth Bordenstein a patiemment réuni cas ambigus et phénomènes étranges, comme autant d'indices de l'influence des bactéries. Il mène des recherches, compile et dissèque les travaux dans lesquels des micro-organismes semblent être à l'origine d'une nouvelle espèce... Une gageure tant ce phénomène, la "spéciation", est discuté par les scientifiques : ses influences sont innombrables et ses causes multiples et difficiles à distinguer de ses conséquences.
Déjà se pose la question de ce qu'est une espèce. Cela semble simple si on regarde la chose d'un œil presbyte : de loin, les espèces se distinguent bien. De près, beaucoup moins. La faute à l'évolution et à la sélection naturelle qui poussent le vivant à changer en permanence, si bien qu'il est difficile de faire la part des choses quand une espèce se transforme ou que deux populations proches semblent s'hybrider. Par conséquent, depuis deux cent cinquante ans qu'ils travaillent dessus, les naturalistes, puis les biologistes ne se sont toujours pas accordés sur une définition claire... Retenons juste que des individus appartiennent à des espèces différentes s'ils ne peuvent pas se reproduire ensemble. Les raisons d'une telle barrière ? Soit l'acte est impossible entre eux, soit leurs hybrides sont condamnés ou stériles. Dans tous les cas, les ponts ont été coupés entre les partenaires et entre leurs espèces respectives — qui pouvaient n'en faire qu'une au départ. Incapables d'échanger des gènes, elles vont suivre chacune leur chemin évolutif et multiplier les différences. C'est ainsi qu'en partant d'un cousin de Velociraptor, on se retrouve quelques millions d'années plus tard avec des canards et des autruches. D'où viennent ces différences ? Comme le rappelle Seth Bordenstein, "les biologistes considèrent que l'apparition de nouvelles espèces est principalement dirigée par les changements qui se produisent dans nos gènes. Nous, nous démontrons que pour comprendre de façon globale comment se passe la spéciation, il faut certes considérer notre génome, mais aussi celui des micro-organismes qui sont en nous !" Pour le biologiste américain, la "cause première" de la séparation des espèces peut être, aussi, microbienne. Rappelons-nous que nous sommes de vrais écosystèmes, peuplés de nuées de bactéries. Tout comme deux populations appartenant à une même espèce peuvent être séparées physiquement par une montagne, ou génétiquement par un bouleversement chromosomique, elles peuvent l'être par ces mini-résidents !
Le chercheur a regroupé une collection inédite de cas où des bactéries ont sorti une artillerie lourde capable d'imposer cette ségrégation...
UN STRATAGÈME PARFAIT
Wolbachia est, à ce titre, exemplaire : cette bactérie infecte près de 60 % des arthropodes, l'immense groupe des insectes, acariens, araignées et crustacés. Parasite incontournable, elle s'insinue dans les cellules de son hôte et colonise la descendance des femelles. Pour favoriser sa transmission, elle réalise des prodiges.
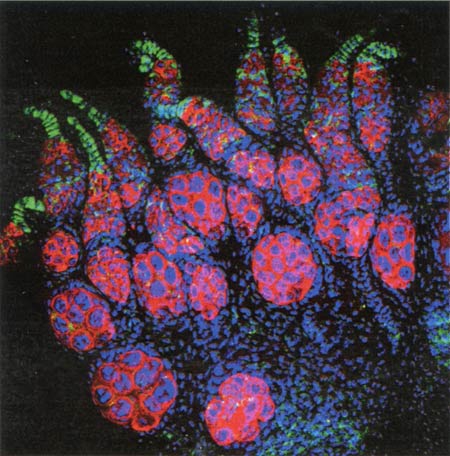
En infectant les cellules souches des organes reproducteurs de la Drosophile, la bactérie Wolbachia (en vert) modifie en sa faveur l'évolution de son hôte.
Ainsi, elle est capable d'imposer à ses hôtes une "spéciation asexuelle" : les femelles qu'elle infecte produisent sous sa houlette des ovules qui se développeront sans être fécondés par les mâles (qui deviennent ainsi inutiles). Chez des guêpes ou des acariens par exemple, on voit ainsi apparaître des lignées entièrement féminines et autonomes. "Ce cas est emblématique car immédiat, pointe Olivier Duron, spécialiste de l'évolution des symbioses à l'université de Montpellier 2. Dès l'arrivée de la bactérie, on a un isolement reproducteur, c'est-à-dire que l'individu infecté ne peut plus se reproduire avec les autres." Et qui dit isolement dit début de divergence entre les populations séparées.
Wolbachia a une seconde technique : elle sait influer sur les possibilités de reproduction de son hôte. Seules les femelles qu'elle infecte peuvent se croiser avec tous les mâles, transmettant ainsi le parasite à sa descendance. Une femelle non infectée est limitée aux mâles également non infectés, sous peine de voir ses œufs mourir. En quelques générations, près de 100 % de la population est parasitée. Ce procédé prend toute sa force quand on sait qu'il existe plusieurs types incompatibles de Wolbachia : ainsi, dans une même espèce d'arthropodes, on peut voir apparaître des groupes infectés par l'une ou l'autre souche bactérienne qui ne pourront plus se croiser !
DES ESPÈCES NAÎTRAIENT D'UN SIMPLE CHANGEMENT DE LEUR FLORE INTESTINALE
Preuve supplémentaire de la responsabilité de la bactérie : l'utilisation d'antibiotiques, en la tuant, fait tomber les barrières qu'elle dressait entre ses hôtes... À moins de s'y prendre trop tard, alors que l'évolution a déjà créé des lignées isolées. Séparées à l'origine par la bactérie, ces populations sont devenues trop différentes pour se croiser, même après sa disparition.
Ces exemples, Seth Bordenstein en connaissait l'importance, mais aussi les limites. Après tout, qu'un parasite niché au cœur même des cellules de son hôte ait un tel effet sur lui n'est sans doute pas si surprenant. Et si Wolbachia et ses consœurs sont courantes chez les arthropodes, on n'en connaît guère chez les mammifères, pour ne citer qu'eux. Ce qui limite leur impact à des groupes animaux, certes nombreux, mais bien particuliers...
Sauf que les bactéries n'ont pas besoin de s'incruster dans les cellules de leur hôte pour bouleverser sa vie. Partout dans le vivant, on observe des symbioses au cours desquelles elles se contentent de s'installer dans certains organes ! Pour rester chez les arthropodes, elles leur permettent de diversifier leur nourriture ou de s'adapter à un autre milieu, et donc de coloniser des zones interdites à leurs congénères. Grâce à elles, le termite mange du bois, le puceron conquiert de nouveaux végétaux, etc. "Puisqu'elle ouvre l'accès à une niche particulière, et donc facilite la divergence avec la population d'origine, la symbiose soutient la spéciation", souligne Olivier Duron. Voilà qui démultiplie les cas possibles !
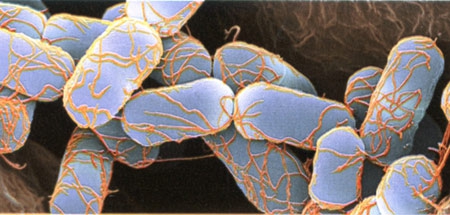
Escherichia coli
Pourtant, Seth Bordenstein avait l'ambition d'aller encore plus loin. Pour ce défi, il reçoit en 2008 le soutien de son collègue Robert Brucker. Dans leur dernière étude, tout juste publiée, les deux biologistes soutiennent cette fois que même des bactéries banales, non symbiotiques, telles celles qui pullulent dans nos intestins, peuvent provoquer la spéciation ! "Ces dernières années, il est devenu clair que chaque animal avait des hôtes bactériens spécifiques, dont les gènes réunis (le microbiome) sont impliqués dans sa digestion comme dans son bon développement cérébral, rappelle le chercheur. Mais personne n'avait prouvé leur rôle dans la spéciation..."
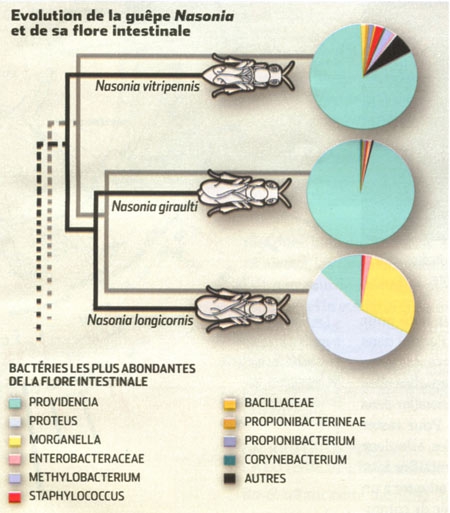
Embryon hybride de Nasonia
Leurs bactéries créent une divergence entre les guêpes qui les empêche de se reproduire. Un traitement antibiotique a mis en valeur l'influence de la flore bactérienne de 3 guêpes du genre Nasonia qui les empêche de se reproduire. Sans traitement, leurs embryons hybrides ne survivraient pas, leurs flores étant incompatibles.
Avec l'aide de trois petites guêpes du genre Nasonia, d'une bonne dose d'antibiotiques et de logique, c'est désormais chose faite. Les chercheurs savaient que lorsque ces trois espèces se croisaient, leurs hybrides étaient condamnés. Ils prédirent, en s'inspirant des expériences avec Wolbachia, qu'un traitement antibiotique aurait un effet drastique... Ils ne se sont pas trompés : près de 90 % des hybrides furent sauvés ! L'incompatibilité entre les guêpes venait donc bien des bactéries. Et réinjecter les microbes restaurait leur lourde mortalité précédente. Un scénario qui a un air de déjà-vu... Sauf que, différence fondamentale, les microbes visés étaient, cette fois, simplement ceux de la flore intestinale !
UN JOUEUR DE PLUS À LA LOTERIE DE L'ÉVOLUTION
En étudiant cette dernière de plus près, Seth Bordenstein remarqua d'ailleurs que les hybrides survivant sans traitement étaient ceux qui avaient reçu une flore proche de celle d'un de leurs parents, au lieu d'un mélange chaotique. C'est donc bien cette flore qui détermine qui vit ou meurt et, ce faisant, imperméabilise les frontières entre les espèces concernées. "Cette étude est solide et l'idée qu'elle présente est séduisante. On savait que les bactéries intracellulaires pouvaient jouer sur l'isolement de populations... Mais que les bactéries intestinales en soient également capables est nouveau ! ", s'enthousiasme Olivier Duron. Ainsi, les espèces - et l'homme ne ferait pas exception - pourraient naître et prospérer par le fait de mutations dans leur génome mais aussi, simplement, par des changements dans leur flore intestinale.
Voilà une découverte qui ajoute un joueur particulièrement riche à la grande loterie de l'évolution... Et qui dit partenaire supplémentaire dit nouveaux gènes à prendre en compte : "Notre expérience donne ainsi une bonne raison de regarder 1'hologénome, c'est-à-dire la combinaison de l'ADN de l'hôte et de ses communautés de micro-organismes résidents, souligne Seth Bordenstein. L'objet de la sélection naturelle ne serait donc pas l'individu seul, mais lui et les communautés bactériennes associées." Pour le chercheur, nous étions jusqu'ici passés à côté de la plus grande part de l'information qui constitue chaque être vivant : les bactéries, ces marionnettistes invisibles et inconscients derrière l'évolution des espèces !
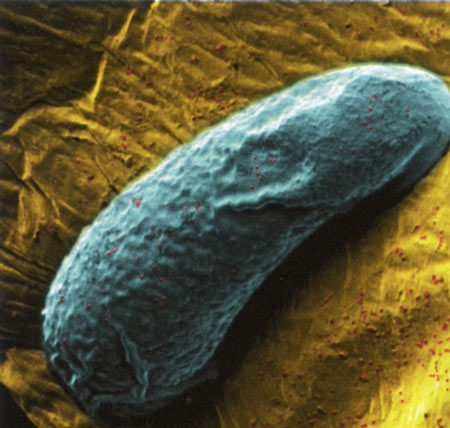
Proteus vulgaris
ET CHEZ L'HOMME ?
Notre part bactérienne est plus importante qu'on ne le croit : pour dix cellules humaines, nous abritons quatorze bactéries et pour dix gènes humains, nos microbes en comptent quatorze. Outre nos quelque vingt milliers de gènes, nous en comptons donc quelque trente milliers d'origine microbienne : deux patrimoines génétiques qui doivent fonctionner "en réseau".
Le rôle des bactéries dans l'évolution des insectes décrypté, on peut se demander ce qu'il en est des mammifères ou des poissons. Seth Bordenstein et Robert Brucker se posent bien sûr la question : "Nous espérons montrer que la flore intestinale et les gènes des microbes qui la composent, le microbiome, sont importants pour la spéciation animale. Une étude récente vient d'ailleurs de montrer que l'Homme et ses plus proches parents chez les primates ont des microbiomes spécifiques à chaque espèce, qui évoluent en même temps que l'ADN nucléaire (dans le noyau des cellules)." Cette coévolution plaide pour un lien fort entre notre génome et celui de notre flore. Les études se multiplient d'ailleurs pour recenser les bactéries que nous hébergeons et mieux comprendre le microbiome riche de plusieurs millions de gènes qu'elles constituent. On sait déjà qu'il existe trois "groupes bactériens" intestinaux, comme il y a des groupes sanguins, et que les perturber a des conséquences sur notre santé.
20:16 Publié dans Biologie, Médecine | Tags : spéciation, génomique, bactéries, flore bactérienne, microbiome | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |


