07/03/2016
De nouvelles armes contre les bactéries résistantes
 De nouvelles armes contre les bactéries résistantes
De nouvelles armes contre les bactéries résistantes
Pneumonies, bronchites, otites, méningites, angines, infections urinaires, panaris, septicémies... de très nombreuses infections sont provoquées par des bactéries.
Nos médecins nous ont alors prescrit des antibiotiques. Ces "armes" de référence contre les bactéries ont sauvé et sauvent encore des millions de vies. Mais leur utilisation et leur emploi abusif chez l'homme comme chez les animaux a conduit à accélérer l'émergence de bactéries résistantes à ces médicaments. L'efficacité des antibiotiques est aujourd'hui sérieusement menacée. Il y a urgence à en trouver de nouveaux ou à développer des alternatives pour lutter contre les bactéries pathogènes.
Des infections transitoirement maîtrisées redeviennent graves
« On risque à l'avenir de ne plus disposer d'antibiotiques permettant de soigner les infections bactériennes courantes », s'alarme l'Organisation mondiale de la santé. Déjà, chaque année en Europe, 400 000 personnes sont infectées par des bactéries multirésistantes aux antibiotiques, dont 158 000 en France. Quand de telles bactéries sont en cause, on peut aujourd'hui mourir d'une infection jugée "banale" — car traitée facilement il y a quelques années (12 500 décès annuels surviennent ainsi en France). Les médecins se retrouvent de plus en plus souvent en situation d'impasse thérapeutique face à certains patients, aucun antibiotique n'ayant plus le moindre effet sur leur infection. Les chiffres parlent d'eux-mêmes : la résistance des pneumocoques à la pénicilline G était quasiment nulle il y a vingt ans ; 27% des souches de cette bactérie en France y sont désormais insensibles ; dans un cas sur cinq, les infections par le staphylocoque doré acquises à l'hôpital (infections nosocomiales) sont résistantes à l'antibiotique de référence. L'antibiorésistance croissante depuis 10 ans d'une autre bactérie, Escherichia coli, est aussi source d'inquiétude : elle provoque par exemple des infections urinaires — autrefois qualifiées de bénignes — dont beaucoup de patients n'arrivent plus à se débarrasser.
La recherche de nouveaux antibactériens, un défi majeur
L'Institut de Veille Sanitaire soulignait en novembre dernier à propos de la consommation antibiotique en ville (hors hôpital) : « La France se situe parmi les pays les plus consommateurs en Europe, juste derrière la Grèce. Elle consomme 30 % de plus que la moyenne européenne, trois fois plus que les pays les plus vertueux. » Or la pression médicamenteuse accélère la sélection de bactéries résistantes. Les autorités de santé tentent donc de diminuer cette consommation pour contenir l'évolution de l'antibiorésistance. Pour freiner la dissémination de ces bactéries à l'hôpital et la contamination des malades, les mesures d'hygiène ont été considérablement intensifiées ces dernières années. Mais ces initiatives, bien qu'essentielles, ne peuvent que limiter le problème. Les bactéries multi-résistantes sont là.
Un des défis majeurs de la recherche biomédicale est de trouver de nouvelles solutions thérapeutiques pour les combattre. Dans les laboratoires, plusieurs pistes sont en cours d'investigation : criblage de nouveaux antibiotiques, conception de nanomédicaments (voir ci-dessous : Nouveaux antibiotiques et nanomédicaments), thérapie par des "virus de bactéries" (voir ci-dessous Phagothérapie : utiliser les ennemis naturels des bactéries), élaboration d'antibactériens "intelligents" (voir ci-dessous : Vers des antibiotiques "intelligents")... De plus, les bactéries pathogènes, même si elles sont individuellement sensibles aux antibiotiques, sont capables d'échapper à leur action lorsqu'elles s'organisent en communauté : elles forment des biofilms à la surface de certains tissus de l'organisme (voir ci-dessous : Lutter contre les biofilms), mais aussi sur des matériaux médicaux comme les cathéters ou les prothèses implantables (voir plus loin : Des chambres implantables aux prothèses). L'arsenal antibiotique actuel ne parvient pas à détruire ces biofilms et des solutions spécifiques sont à l'étude.
Nouveaux antibiotiques et nanomédicaments
Face au problème croissant de l'antibiorésistance, si la recherche de nouveaux antibiotiques est indispensable, des initiatives visent également à les administrer différemment, par exemple en les enrobant dans des nanoparticules, un assemblage de lipides ou de sucres. Cette formulation aurait l'avantage de délivrer les antibiotiques à des doses inférieures, ce qui freinerait l'apparition des résistances et permettrait d'utiliser des molécules aujourd'hui délaissées car mal tolérées. Le projet NAREB[1] lancé en février 2014 et coordonné à l'Institut Pasteur, associe 15 laboratoires dans 8 pays d'Europe autour d'un objectif commun : développer des nanomédicaments contre deux types d'infections très préoccupantes, celles dues au staphylocoque doré résistant à la méthicilline (SARM) et la tuberculose multirésistante. Les SARM sont des causes fréquentes d'infections nosocomiales sévères : les personnes touchées ont un risque de décès supérieur de 64% à celui des personnes atteintes d'une forme non résistante de l'infection. Quant à la tuberculose multirésistante, près de 480 000 personnes l'ont développée en 2014, et presque un dizième de ces cas seraient des infections "ultrarésistantes" signalées dans une centaine de pays et contre lesquelles même les antibiotiques de deuxième intention sont inefficaces.
Phagothérapie : utiliser les ennemis naturels des bactéries
De plus en plus de chercheurs se penchent, avec des méthodes d'investigation modernes, sur une thérapie lancée au début du XXe siècle, avant la découverte des premiers antibiotiques. Elle consiste à attaquer et détruire les bactéries avec leurs ennemis naturels : des "virus de bactéries" appelés bactériophages, qui sont chacun spécifique d'une bactérie donnée, n'infectant donc que la bactérie hôte sans détruire, par exemple, la flore microbienne.
Dès 1917 à l'Institut Pasteur, Félix d'Hérelle décrit pour la première fois le phénomène de destruction des bactéries par les bactériophages et rapporte le premier essai expérimental de "phagothérapie".
Deux ans plus tard cette nouvelle thérapie est appliquée à l'Homme alors qu'on ne dispose d'aucune arme contre les bactéries, responsables de nombreuses maladies infectieuses et d'innombrables décès. Des solutions de bactériophages sont commercialisées et la phagothérapie connaît un âge d'or jusqu'à l'arrivée des antibiotiques en médecine du début des années 1940, des molécules chimiques que l'industrie peut facilement standardiser. Seuls certains pays de l'Est ont continué à l'utiliser jusqu'à nos jours. Mais le standard des études cliniques actuel ne correspond plus à celui des années passées et il faut donc réévaluer l'efficacité thérapeutique de ces "virus guérisseurs".
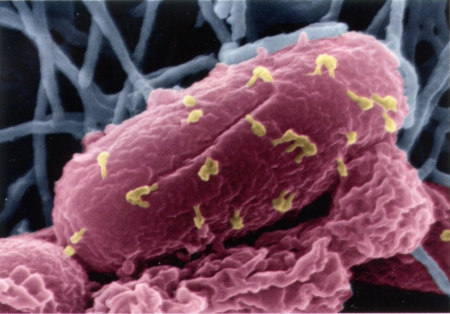
Bactériophages, en jaune, sur la bactérie Escherichia coli.
Vers des antibiotiques "intelligents"
Au-delà du problème de l'antibiorésistance, les antibiotiques ont un défaut majeur: ils s'attaquent sans distinction aux bonnes et aux mauvaises bactéries. On sait notamment qu'ils détruisent en partie les bactéries de notre microbiote, essentielles au bon fonctionnement de notre organisme. De récentes avancées biotechnologiques ont permis la conception d'armes totalement nouvelles qui cibleraient uniquement les bactéries néfastes.
Des "robots" biologiques
Pour cela, les chercheurs utilisent des bactériophages, ces "virus de bactéries" à l'origine d'une thérapie alternative aux antibiotiques, la phagothérapie (voir ci-dessus Phagothérapie : utiliser les ennemis naturels des bactéries). Mais il ne s'agit pas ici d'administrer ces virus antibactériens tels quels. Grâce à l'ingénierie génétique, les chercheurs sont capables de les transformer en véritables petits robots biologiques tueurs de bactéries bien précises. Comment ? Seule l'enveloppe du bactériophage — la "capside" — est utilisée. L'intérêt est qu'elle peut injecter de l'ADN dans des bactéries, mais pas dans les cellules humaines. Cette capside va donc servir à délivrer un "circuit génétique" aux bactéries néfastes : il comprend des ciseaux moléculaires couplés à un "guide" (voir l'article sur ce même blog) qui va cibler exclusivement un petit morceau d'ADN défini de la bactérie visée, au sein d'un gène de résistance ou de virulence. Le bactériophage a été transformé en cheval de Troie : il injecte le circuit dans la bactérie, le programme génétique se met en marche. Le ciseau "scanne" l'ADN. S'il trouve le fragment de gène, il coupe. La bactérie meurt. S'il ne le trouve pas, il n'y a rien à couper. La bactérie survit.
Lutter contre les biofilms
Quand les bactéries vivent en communauté, il est encore plus difficile de s'en débarrasser. Or sur nos tissus, sur des cathéters, sur des prothèses, les bactéries peuvent former des "biofilms": elles adhèrent à la surface, sécrètent une — la matrice —, se multiplient et s'agrègent les unes aux autres pour former une masse pouvant contenir des millions de milliards de bactéries. Comme l'union fait la force, ces biofilms bactériens deviennent "tolérants" aux antibiotiques : même si individuellement les bactéries qui les composent sont sensibles aux antibiotiques, ces médicaments n'ont plus d'effet contre elles lorsqu'elles sont organisées en biofilm (le problème est bien sûr amplifié si un biofilm est composé de bactéries résistantes). La médecine est aujourd'hui démunie face à ces communautés bactériennes et la lutte contre les biofilms est devenue un enjeu de taille pour la recherche biomédicale. Surtout quand on sait qu'ils seraient impliqués dans 60% des infections acquises à l'hôpital (infections nosocomiales).
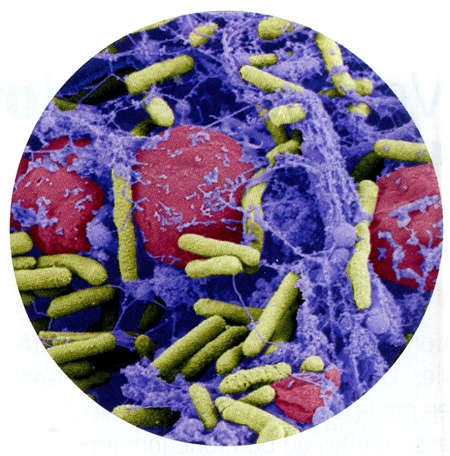
Biofilm sur un cathéter.
En jaune : les bactéries. En violet : La matrice du biofilm. En rouge : des cellules immunitaires.
Des chambres implantables aux prothèses par Jean-Marc Ghigo
Responsable de l'unité Génétique des biofilms à l'Institut Pasteur.
L'équipe de Jean-Marc Ghigo à l'Institut Pasteur est spécialisée dans l'étude des biofilms, analysant leur formation et les différents aspects du mode de vie en communauté des bactéries. Le chercheur nous précise le mécanisme qui empêche les antibiotiques d'être efficaces : « si un antibiotique agit sur un biofilm, beaucoup de bactéries vont être tuées, mais certaines bactéries qu'on nomme "persistantes" vont survivre au traitement, et permettre la reformation du biofilm ». Heureusement, des solutions se profilent. L'équipe pasteurienne a mené en collaboration avec des cliniciens[2] une étude sur les chambres implantables, ces petits boîtiers installés sous la peau qui permettent l'administration de médicaments, notamment en cas de chimiothérapie anticancéreuse. « Ces chambres sont infectées par des biofilms dans 4 à 5% des cas », explique Jean-Marc Ghigo. « Quand une infection est suspectée, elles doivent être retirées, ce qui n'est pas un acte anodin, surtout chez des patients fragilisés ».
Aujourd'hui, entre deux utilisations de la chambre, un "verrou" antibiotique est appliqué pour limiter le phénomène de formation des biofilms ; il consiste à injecter dans la chambre un faible volume d'antibiotiques. « Nous souhaitons mettre au point un verrou "curatif" capable de supprimer efficacement d'éventuels biofilms dans ces chambres implantables. Pour cela, nous couplons un antibiotique classiquement utilisé à une molécule qui s'attaque à la matrice des biofilms tout en augmentant la pénétration de l'antibiotique dsns les bactéries persistantes. Nous avons prouvé au laboratoire l'efficacité de ce mélange ». Ce nouveau "verrou " antibactérien est actuellement en fabrication par la pharmacie des Hospices Civils de Lyon en vue de futurs essais cliniques. Une autre piste est à l'étude dans l'unité : il s'agit cette fois de prévenir la formation des biofilms.
« On "greffe" sur des surfaces une molécule qui les rend "glissantes" et empêche ainsi les bactéries d'adhérer, de s'attacher à ces surfaces », explique le chercheur Christophe Beloin, qui mène toutes ces expérimentations avec Jean-Marc Ghigo. « Pour l'instant, il est difficile d'avoir un effet à long terme avec cette stratégie. Mais elle pourrait être utilisée sur le court terme, lors de la pose d'une prothèse par exemple.

Unité de Génétique des biofilms
Source : La Lettre de l'Institut Pasteur, n° 92 - février 2016.
[1] Nanotherapeutics for antibiotic résistant émergent bacterial pathogens.
[2] L'unité de Génétique des biofilms collabore avec David Lebeaux de l'hopital Necker et de l'hopitai George Pompidou à Paris, et avec des cliniciens de l'hopitai Dupuytren à Limoges.
15:58 Publié dans Médecine | Tags : bactéries, résistance aux antibiotiques, nouvaus antibiotiques, nanomédicaments, phagothérapie, bactériophes, antibiotiques intelligents, éligobitiques, biofilms | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
03/10/2013
Les bactéries font et défont les espèces
 Les bactéries font et défont les espèces
Les bactéries font et défont les espèces
par Émilie Rauscher
(Science & Vie n° 1152, septembre 2013, pp. 106-111)
Les bactéries logées à l'intérieur de tout organisme vivant, y compris celles de la flore intestinale, influencent son évolution… Au point, parfois, de créer de nouvelles espèces. L'hypothèse avait été formulée il y a quelque temps déjà... En 1927, le microbiologiste américain Ivan Wallin notait :
"C'est une proposition pour le moins étonnante de dire que les bactéries, communément associées à la maladie, pourraient en fait être un facteur fondamental dans l'apparition de nouvelles espèces..."
Tellement étonnante, d'ailleurs, qu'elle fut rapidement oubliée, d'autant que les arguments pour la démontrer n'existaient pas... Ou plutôt pas encore. Car aujourd'hui, alors qu'ils mesurent encore à peine à quel point les bactéries sont partout – des abysses à nos cellules – ; alors qu'ils commencent à réaliser l'importance des relations ultimes et durables (symbioses) qu'elles ont tissées avec tout ce qui vit ; alors qu'ils découvrent enfin tout ce dont elles sont capables... finalement, les scientifiques en viennent à se dire qu'il y avait peut-être du vrai dans cette vieille idée folle !
Selon Bordenstein, professeur de biologie à l'université Vanderbilt (Nashville, EtatsUnis), lui, en est convaincu depuis plus de dix ans déjà : "Une nouvelle espèce pourrait bien apparaître, non seulement parce que ses gènes mutent au sein de ses propres cellules, mais aussi parce que les communautés microbiennes qu'elle héberge (dans ses intestins, etc.) changent ! " Et il a désormais de quoi étayer cette hypothèse, qui non seulement renouvelle notre compréhension de la complexe mécanique de l'évolution, mais fait des bactéries l'un des maîtres, aussi majeur que méconnu, du destin des espèces...
NOUS SOMMES TOUS DES ÉCOSYSTÈMES
Inspiré par Ivan Wallin, mais aussi par d'autres prédécesseurs visionnaires comme la biologiste américaine Lynn Margulis, qui avait perçu dès les années 1970 l'importance de la symbiose, Seth Bordenstein a patiemment réuni cas ambigus et phénomènes étranges, comme autant d'indices de l'influence des bactéries. Il mène des recherches, compile et dissèque les travaux dans lesquels des micro-organismes semblent être à l'origine d'une nouvelle espèce... Une gageure tant ce phénomène, la "spéciation", est discuté par les scientifiques : ses influences sont innombrables et ses causes multiples et difficiles à distinguer de ses conséquences.
Déjà se pose la question de ce qu'est une espèce. Cela semble simple si on regarde la chose d'un œil presbyte : de loin, les espèces se distinguent bien. De près, beaucoup moins. La faute à l'évolution et à la sélection naturelle qui poussent le vivant à changer en permanence, si bien qu'il est difficile de faire la part des choses quand une espèce se transforme ou que deux populations proches semblent s'hybrider. Par conséquent, depuis deux cent cinquante ans qu'ils travaillent dessus, les naturalistes, puis les biologistes ne se sont toujours pas accordés sur une définition claire... Retenons juste que des individus appartiennent à des espèces différentes s'ils ne peuvent pas se reproduire ensemble. Les raisons d'une telle barrière ? Soit l'acte est impossible entre eux, soit leurs hybrides sont condamnés ou stériles. Dans tous les cas, les ponts ont été coupés entre les partenaires et entre leurs espèces respectives — qui pouvaient n'en faire qu'une au départ. Incapables d'échanger des gènes, elles vont suivre chacune leur chemin évolutif et multiplier les différences. C'est ainsi qu'en partant d'un cousin de Velociraptor, on se retrouve quelques millions d'années plus tard avec des canards et des autruches. D'où viennent ces différences ? Comme le rappelle Seth Bordenstein, "les biologistes considèrent que l'apparition de nouvelles espèces est principalement dirigée par les changements qui se produisent dans nos gènes. Nous, nous démontrons que pour comprendre de façon globale comment se passe la spéciation, il faut certes considérer notre génome, mais aussi celui des micro-organismes qui sont en nous !" Pour le biologiste américain, la "cause première" de la séparation des espèces peut être, aussi, microbienne. Rappelons-nous que nous sommes de vrais écosystèmes, peuplés de nuées de bactéries. Tout comme deux populations appartenant à une même espèce peuvent être séparées physiquement par une montagne, ou génétiquement par un bouleversement chromosomique, elles peuvent l'être par ces mini-résidents !
Le chercheur a regroupé une collection inédite de cas où des bactéries ont sorti une artillerie lourde capable d'imposer cette ségrégation...
UN STRATAGÈME PARFAIT
Wolbachia est, à ce titre, exemplaire : cette bactérie infecte près de 60 % des arthropodes, l'immense groupe des insectes, acariens, araignées et crustacés. Parasite incontournable, elle s'insinue dans les cellules de son hôte et colonise la descendance des femelles. Pour favoriser sa transmission, elle réalise des prodiges.
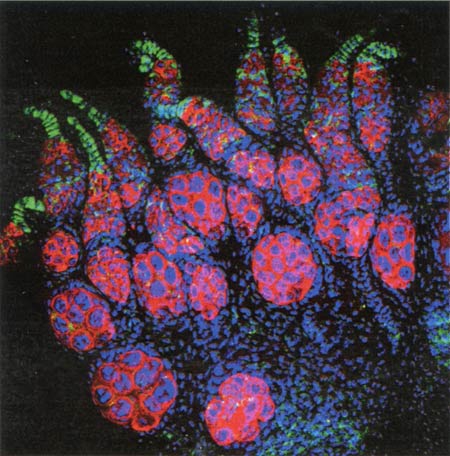
En infectant les cellules souches des organes reproducteurs de la Drosophile, la bactérie Wolbachia (en vert) modifie en sa faveur l'évolution de son hôte.
Ainsi, elle est capable d'imposer à ses hôtes une "spéciation asexuelle" : les femelles qu'elle infecte produisent sous sa houlette des ovules qui se développeront sans être fécondés par les mâles (qui deviennent ainsi inutiles). Chez des guêpes ou des acariens par exemple, on voit ainsi apparaître des lignées entièrement féminines et autonomes. "Ce cas est emblématique car immédiat, pointe Olivier Duron, spécialiste de l'évolution des symbioses à l'université de Montpellier 2. Dès l'arrivée de la bactérie, on a un isolement reproducteur, c'est-à-dire que l'individu infecté ne peut plus se reproduire avec les autres." Et qui dit isolement dit début de divergence entre les populations séparées.
Wolbachia a une seconde technique : elle sait influer sur les possibilités de reproduction de son hôte. Seules les femelles qu'elle infecte peuvent se croiser avec tous les mâles, transmettant ainsi le parasite à sa descendance. Une femelle non infectée est limitée aux mâles également non infectés, sous peine de voir ses œufs mourir. En quelques générations, près de 100 % de la population est parasitée. Ce procédé prend toute sa force quand on sait qu'il existe plusieurs types incompatibles de Wolbachia : ainsi, dans une même espèce d'arthropodes, on peut voir apparaître des groupes infectés par l'une ou l'autre souche bactérienne qui ne pourront plus se croiser !
DES ESPÈCES NAÎTRAIENT D'UN SIMPLE CHANGEMENT DE LEUR FLORE INTESTINALE
Preuve supplémentaire de la responsabilité de la bactérie : l'utilisation d'antibiotiques, en la tuant, fait tomber les barrières qu'elle dressait entre ses hôtes... À moins de s'y prendre trop tard, alors que l'évolution a déjà créé des lignées isolées. Séparées à l'origine par la bactérie, ces populations sont devenues trop différentes pour se croiser, même après sa disparition.
Ces exemples, Seth Bordenstein en connaissait l'importance, mais aussi les limites. Après tout, qu'un parasite niché au cœur même des cellules de son hôte ait un tel effet sur lui n'est sans doute pas si surprenant. Et si Wolbachia et ses consœurs sont courantes chez les arthropodes, on n'en connaît guère chez les mammifères, pour ne citer qu'eux. Ce qui limite leur impact à des groupes animaux, certes nombreux, mais bien particuliers...
Sauf que les bactéries n'ont pas besoin de s'incruster dans les cellules de leur hôte pour bouleverser sa vie. Partout dans le vivant, on observe des symbioses au cours desquelles elles se contentent de s'installer dans certains organes ! Pour rester chez les arthropodes, elles leur permettent de diversifier leur nourriture ou de s'adapter à un autre milieu, et donc de coloniser des zones interdites à leurs congénères. Grâce à elles, le termite mange du bois, le puceron conquiert de nouveaux végétaux, etc. "Puisqu'elle ouvre l'accès à une niche particulière, et donc facilite la divergence avec la population d'origine, la symbiose soutient la spéciation", souligne Olivier Duron. Voilà qui démultiplie les cas possibles !
Escherichia coli
Pourtant, Seth Bordenstein avait l'ambition d'aller encore plus loin. Pour ce défi, il reçoit en 2008 le soutien de son collègue Robert Brucker. Dans leur dernière étude, tout juste publiée, les deux biologistes soutiennent cette fois que même des bactéries banales, non symbiotiques, telles celles qui pullulent dans nos intestins, peuvent provoquer la spéciation ! "Ces dernières années, il est devenu clair que chaque animal avait des hôtes bactériens spécifiques, dont les gènes réunis (le microbiome) sont impliqués dans sa digestion comme dans son bon développement cérébral, rappelle le chercheur. Mais personne n'avait prouvé leur rôle dans la spéciation..."
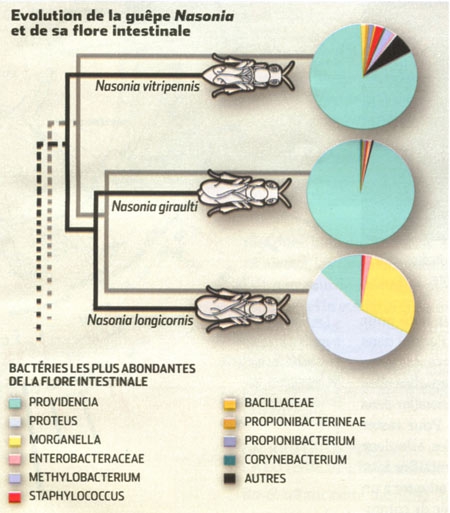
Embryon hybride de Nasonia
Leurs bactéries créent une divergence entre les guêpes qui les empêche de se reproduire. Un traitement antibiotique a mis en valeur l'influence de la flore bactérienne de 3 guêpes du genre Nasonia qui les empêche de se reproduire. Sans traitement, leurs embryons hybrides ne survivraient pas, leurs flores étant incompatibles.
Avec l'aide de trois petites guêpes du genre Nasonia, d'une bonne dose d'antibiotiques et de logique, c'est désormais chose faite. Les chercheurs savaient que lorsque ces trois espèces se croisaient, leurs hybrides étaient condamnés. Ils prédirent, en s'inspirant des expériences avec Wolbachia, qu'un traitement antibiotique aurait un effet drastique... Ils ne se sont pas trompés : près de 90 % des hybrides furent sauvés ! L'incompatibilité entre les guêpes venait donc bien des bactéries. Et réinjecter les microbes restaurait leur lourde mortalité précédente. Un scénario qui a un air de déjà-vu... Sauf que, différence fondamentale, les microbes visés étaient, cette fois, simplement ceux de la flore intestinale !
UN JOUEUR DE PLUS À LA LOTERIE DE L'ÉVOLUTION
En étudiant cette dernière de plus près, Seth Bordenstein remarqua d'ailleurs que les hybrides survivant sans traitement étaient ceux qui avaient reçu une flore proche de celle d'un de leurs parents, au lieu d'un mélange chaotique. C'est donc bien cette flore qui détermine qui vit ou meurt et, ce faisant, imperméabilise les frontières entre les espèces concernées. "Cette étude est solide et l'idée qu'elle présente est séduisante. On savait que les bactéries intracellulaires pouvaient jouer sur l'isolement de populations... Mais que les bactéries intestinales en soient également capables est nouveau ! ", s'enthousiasme Olivier Duron. Ainsi, les espèces - et l'homme ne ferait pas exception - pourraient naître et prospérer par le fait de mutations dans leur génome mais aussi, simplement, par des changements dans leur flore intestinale.
Voilà une découverte qui ajoute un joueur particulièrement riche à la grande loterie de l'évolution... Et qui dit partenaire supplémentaire dit nouveaux gènes à prendre en compte : "Notre expérience donne ainsi une bonne raison de regarder 1'hologénome, c'est-à-dire la combinaison de l'ADN de l'hôte et de ses communautés de micro-organismes résidents, souligne Seth Bordenstein. L'objet de la sélection naturelle ne serait donc pas l'individu seul, mais lui et les communautés bactériennes associées." Pour le chercheur, nous étions jusqu'ici passés à côté de la plus grande part de l'information qui constitue chaque être vivant : les bactéries, ces marionnettistes invisibles et inconscients derrière l'évolution des espèces !
Proteus vulgaris
ET CHEZ L'HOMME ?
Notre part bactérienne est plus importante qu'on ne le croit : pour dix cellules humaines, nous abritons quatorze bactéries et pour dix gènes humains, nos microbes en comptent quatorze. Outre nos quelque vingt milliers de gènes, nous en comptons donc quelque trente milliers d'origine microbienne : deux patrimoines génétiques qui doivent fonctionner "en réseau".
Le rôle des bactéries dans l'évolution des insectes décrypté, on peut se demander ce qu'il en est des mammifères ou des poissons. Seth Bordenstein et Robert Brucker se posent bien sûr la question : "Nous espérons montrer que la flore intestinale et les gènes des microbes qui la composent, le microbiome, sont importants pour la spéciation animale. Une étude récente vient d'ailleurs de montrer que l'Homme et ses plus proches parents chez les primates ont des microbiomes spécifiques à chaque espèce, qui évoluent en même temps que l'ADN nucléaire (dans le noyau des cellules)." Cette coévolution plaide pour un lien fort entre notre génome et celui de notre flore. Les études se multiplient d'ailleurs pour recenser les bactéries que nous hébergeons et mieux comprendre le microbiome riche de plusieurs millions de gènes qu'elles constituent. On sait déjà qu'il existe trois "groupes bactériens" intestinaux, comme il y a des groupes sanguins, et que les perturber a des conséquences sur notre santé.
20:16 Publié dans Biologie, Médecine | Tags : spéciation, génomique, bactéries, flore bactérienne, microbiome | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |


