18/01/2013
Le ver, la mouche et la souris : trois animaux d'intérêt pour la biologie du développement
Le ver, la mouche et la souris : trois animaux d'intérêt pour la biologie du développement
par
Claude-Roland Marchand
(professeur honoraire de l'Université de Franche-Comté)
La compréhension du vivant ne peut se faire qu'en observant la diversité des espèces ; leurs affinités phénotypiques et reproductrices permettant de les regrouper ; leur physiologie et leur dynamique vitale les rapprochant ou les singularisant. Au cours des siècles, l'intérêt s'est porté sur des animaux de proximité, sauvages ou domestiques, dans divers milieux, et les conclusions qu'on en tirait étaient nourries d'une logique et d'une culture très subjectives, imprégnées de croyances philosophiques ou religieuses (L'Homme faisait l'objet d'une lointaine et prudente approche, car il n'était pas considéré comme un animal !).
Le XXe siècle a vu l'essor de l'embryologie expérimentale qui s'est intéressée au développement animal, depuis la cellule-œuf jusqu'à l'animal différencié et fonctionnel, en utilisant des Invertébrés (Hydre, Planaire, Oursin...) ou des Vertébrés (Grenouille, Poulet, Souris).
Quels sont les intérêts des modèles animaux ?
Les Unicellulaires utilisés en microbiologie nous ont renseignés sur les propriétés et les fonctions de la cellule. Mais le vivant comporte également des animaux complexes, les Métazoaires, étudiés depuis longtemps et de diverses manières. Ils demandent une approche particulière qui a évolué au cours des siècles en fonction des avancées techniques. On les a observés in situ mais également et différemment en laboratoire. Pour mémoire citons les plus célèbres : les Pinsons de Darwin, le Chien de Pavlov ou les Grenouilles de Rostand qui ont modifié notre vision de l'évolution, de la physiologie ou de la tératologie.
Nous évoquerons trois des principaux animaux-modèles utilisés au XXe siècle et encore aujourd'hui : un Ver Nématode Caenorhabditis elegans, un Insecte, la mouche du vinaigre, Drosophila melanogaster et un Mammifère, la souris, Mus musculus.
Nous verrons en quoi leur étude a fait progresser nos connaissances fondamentales et nous évoquerons les applications possibles qui pourraient être envisagées dans de nombreux domaines.
Le ver Nématode CAENORHABDITIS elegans
Les « pères » de ce modèle, utilisé depuis les années 60, Sydney Brenner, John Sulston et Bob Horvitz ont reçu le prix Nobel en 2002.
C'est un Nématode (Ascarides) de 1 mm de longueur. 20 jours de vie, une génération tous les 4 jours. Ce sont habituellement des hermaphrodites autoféconds qui contiennent 959 cellules et 1 fois sur 1000 des mâles formés de 1031 cellules. Les mâles peuvent s'accoupler avec les hermaphrodites, ce qui permet d'obtenir des lignées pures. Le séquençage de son génome, réalisé en 1998 (premier animal à être totalement séquencé) montre qu'il contient 19 099 gènes dont environ 200 peuvent être rendus létaux par mutation.
Le Nématode Caenorhabditis elegans
550 millions d'années séparent l'apparition de ce Ver et celle des Mammifères et pourtant il existe de nombreuses similitudes fonctionnelles au niveau neuronal ou au cours du vieillissement. Ces propriétés accentuent l'intérêt de l'étude de cet animal qui se nourrit d'Escherichia coli, est transparent, facile à observer sous le microscope et aisé à manipuler : ablation de cellules par laser, injection de marqueurs, de séquences d'ADN ou d'ARN antisens pour clarifier la fonction de tel ou tel gène à tel moment du développement.
On a pu établir chez lui le lignage complet de toutes les cellules issues de la fécondation. Sur la carte ainsi dressée, on peut retrouver l'origine de toutes les cellules constitutives de tel ou tel organe et le moment où la lignée germinale est isolée de la lignée somatique. C'était un rêve pour les embryologistes : il s'est réalisé à la fin du siècle dernier !
Outre le criblage génique, on a noté chez Caenorhabditis qu'une cellule sur 8 mourait au cours du développement normal. C'est une mort cellulaire programmée appelée apoptose qui se réalise grâce à l'action de protéines appelées caspases. Elle est contrôlée par les gènes ced3, ced4 qui, lorsqu'ils sont mutés, provoquent un excès de survie cellulaire. L'apoptose est une étape incontournable dans les processus d'organogenèse du vivant ; on en verra un exemple, plus loin, avec le développement des doigts chez les tétrapodes. À l'inverse le gène ced9 favorise la survie des cellules.
L'établissement du plan corporel, la symétrisation et l'organogenèse sont commandés par un jeu complexe et subtil de gènes qui s'expriment dans le temps et dans l'espace en étroite synergie. On a en particulier isolé les gènes egl5 et CePhox2/ceh17 qui participent à rétablissement de l'axe antéro-postérieur du ver, et de la mise en place des cellules nerveuses.
En outre, le séquençage de son génome révèle la présence de gènes homologues de psi, park2 et insr responsables respectivement des maladies d'Alzheimer, de Parkinson et du diabète de type 2 chez l'Homme.
À titre expérimental, 3 millions de Caenorhabditis ont été placés dans une navette spatiale Columbia en 2003 afin d'observer le déroulement des différentes étapes du développement en apesanteur. Après l'accident de cette navette, on a retrouvé des vers vivants parmi les débris, dans leurs boîtes d'élevage, révélant de manière inattendue la relative résistance de ces vers.
Deuxième animal-modèle : La mouche des fruits, DROSOPHILA melanogaster
Tout a commencé, pour cette Mouche aux yeux rouges, avec le naturaliste américain Thomas Morgan (1866-1945), prix Nobel 1933, qui a voulu vérifier avec elle, les lois de Mendel redécouvertes au début du XXe siècle. Elle est très fertile, facile à élever, facile à observer et présente souvent des mutations. Son génome comporte 13 000 gènes dont plus de 75% sont homologues aux gènes humains.

La Mouche des fruits : Drosophila melanogaster
Dès 1927 C. Bridges observe des Drosophiles mutantes présentant quatre paires de pattes, ou deux paires d'ailes. En 1954, E. Lewis observera d'autres mutations. Ces deux chercheurs leur donnent des noms évocateurs : bithoraxoïd, bithorax, postbithorax, ultrabithorax. Et lorsque des antennes sont transformées en pattes Lewis parle d'Antennapedia. Dès lors la notion d'homéose est proposée : elle désigne, selon Bateson, en 1894, la transformation d'un organe en un autre. Lewis et ses collaborateurs parleront désormais de gènes homéotiques, ou homéogènes à l'origine de ces transformations spectaculaires.
Lewis localisera ces homéogènes sur le chromosome 3 de la Drosophile. Chaque homéogène comporte une séquence de 180 paires de bases, l'homéobox, qu'on retrouve également chez le Xénope, la Souris et chez l'Homme.
De 1983 à 1990, E. Lewis et ses collaborateurs, Christiane Nüsslein-Volhard et Eric Wieschaus, affineront leurs découvertes. Ce qui leur valut le Prix Nobel en 1995. Cette découverte montre que des gènes majeurs, conservés au cours de révolution, contrôlent le schéma corporel de base de chaque zootype ; c'est un paradigme qui s'avère valable pour le règne végétal.
Quelques images nous permettent de suivre les différentes étapes du développement de la Drosophile et de localiser les gènes architectes qui contrôlent l'organogenèse, dans l'espace et dans le temps.
1 = Les polarités dorso-ventrale et antéro-postérieure
sont esquissées dans les ovarioles de la femelle et confirmées après la fécondation. Un grand nombre de gènes (dont nous ne donnerons pas la longue liste) participent à rétablissement de l'identité des territoires, comme par exemple dorsal, nanos, toll, torpedo, cactus… dont l'activité produit une combinaison de facteurs de transcription morphogénétiques. Sur ces schémas, on peut noter la répartition, selon un gradient, des produits des gènes bicoid, torso et nanos. Leur mutation conduit à des larves transformées : sans abdomen, sans tête, sans telson... Grâce aux anomalies, on peut localiser le moment et la région où s'expriment les gènes d'intérêts.
2 = L'identité segmentaire se réalise progressivement, en s'affinant peu à peu, pour aboutir à une zonation conforme au plan de l'Insecte : tête, thorax, abdomen. On ne peut manquer d'être surpris par ce qui peut paraître comme une certaine logique dans le déroulement de ces étapes : du simple au complexe et de l'avant vers l'arrière.
Trois groupes de gènes, les gènes gap[1], pair-rule[2], de polarité segmentaire interagissent et construisent le plan corporel segmentaire.
La mise en évidence de leurs interrelations et de leurs domaines d'expression, parfois chevauchants, est le résultat d'un travail minutieux de biologie moléculaire, intéressant pour la Drosophile, mais aussi au plan fondamental.
3 = Les homéogènes : Attardons-nous un peu sur ce que l'étude approfondie des mutations de la Drosophile a apporté à la connaissance des gènes architectes.
Les plus spectaculaires sont des mouches porteuses de 4 ailes (mutation appelée Ultrabithorax) et des mouches dont les antennes sont transformées en pattes (mutation appelée Antennapedia).
Le mérite de Lewis a été de localiser, en 1978, les gènes responsables de ces mutations. Ils se trouvent tous sur le chromosome 3. En 1983 il parvient avec son équipe à isoler et séquencer ces gènes qu'il range désormais dans le groupe des gènes homéotiques. Car, nous le répétons, leur expression ectopique construit un organe conforme, mais qui n'est pas à sa place : des ailes à la place des balanciers ou une patte à la place de l'antenne.
Voici le schéma qu'il propose, sur le même chromosome 3 (colinéarité), de l'avant à l'arrière 8 homéogènes regroupés en deux ensembles :
5 dans l'ensemble ANT : lab, pb, Dfd, Scr, Antp.
3 dans l'ensemble BX : Ubx, abd-A, Abd-B.
Les abréviations correspondent à la caractéristique d'une mutation du gène concerné.
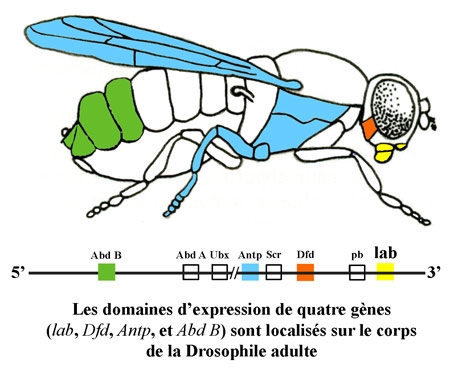
(Abréviations : lab = labial ; pb = proboscipedia ; Dfd = deformed ; Scr = sex comb reduced ; Antp = antennapedia ; Ubx = ultrabithorax ; Abd A = abdominal A ; Abd B = abdominal B).
Si on délimite sur le plan du corps de l'animal les domaines d'expression des principaux gènes identifiés, on s'aperçoit que l'identité segmentaire est souvent, sauf pour l'extrémité antérieure, le résultat d'une action conjuguée de plusieurs produits géniques. Cette synergie notée chez la Drosophile existe également chez les autres métazoaires, y compris les Mammifères comme on le verra plus loin.
Voyons maintenant les mutations concernant les yeux de la Drosophile.
En 1915, M. Hoge observait déjà des mouches sans yeux ou avec des yeux réduits. Cette anomalie provenait d'un gène défaillant appelé Eyeless isolé en 1993, deux ans après qu'un homologue appelé Small Eye / Aniridia eût été identifié chez la Souris. Bien que l'œil simple de Mammifères ait peu de ressemblances morphologiques avec l'œil composé d'un Insecte, il semblerait que sa construction utilise des procédés similaires, avec probablement la mise en jeu de plus de 2000 gènes ! C'est en 1995 que W. J. Gehring et son équipe parviennent à activer Eyeless et à obtenir une mouche avec des yeux sur les pattes et sur les antennes.
Finalement ces différents gènes ont été placés dans le groupe PAX6, en raison de leur structure. Nous n'omettrons pas de mentionner la réussite d'une expérience inattendue : si on introduit le gène PAX6 de la Souris dans une larve de Drosophile on induit la formation d'un œil supplémentaire de type Insecte. Ce qui signifie que le code du gène architecte de la Souris est « compris » par la Mouche et est ensuite « traduit » en organe de mouche. Voici donc levé un tabou qui posait problème à Darwin : il n'osait pas imaginer la construction de l'œil à partir d'un même prototype soumis ensuite à la sélection naturelle. La biologie moléculaire démontre donc l'existence de mécanismes identiques, malgré la distance phylogénétique ; ceci est d'autant plus vrai que l'équipe de Gehring a trouvé des homologues de Eyeless et de Small eye chez un Ver Némerte, une Planaire et le Calmar !
Après ce survol des résultats obtenus en biologie moléculaire expérimentale, nous pressentons qu'au-delà du Ver ou de la Mouche nous allons vers une universalité de certains processus, de certains signaux qui s'accompagnent d'une conservation de leurs patrons d'expression et des mécanismes qui les initient et les régulent.
Voyons avec le troisième animal de laboratoire si nos concepts seront confirmés ou infirmés.
La souris : MUS musculus
Voici le Mammifère le plus facile à élever, véritable « cobaye » de la recherche mondiale : de petite taille, un cycle toutes les six semaines, une gestation courte de 21 jours, 6 à 12 petits par portée. La sélection a permis d'obtenir d'elle des lignées pures qui permettent de réaliser de manière reproductible, des manipulations génétiques comme des transferts, des suppressions, des amplifications de gènes ou une modélisation de maladies humaines. La transgénèse est effectuée sur des œufs prélevés juste après la fécondation. L'ADN injecté peut être inséré dans tous les noyaux et sera exprimé dans la descendance.

La Souris : Mus musculus
La biologie moléculaire a séquencé la totalité des 40 chromosomes de la Souris en 2003 ; il en ressort que 98 % de ses gènes sont homologues à ceux de l'Homme, ce qui constitue un matériel propice à l'étude des maladies génétiques, de certains cancers, mais aussi de la régulation des étapes-clés de l'embryogénèse. Parmi les découvertes spectaculaires dues à cette technique mentionnons le repérage, le séquençage et la localisation de 41 homéogènes répartis sur 4 chromosomes et présentant de nombreuses homologies avec les 8 homéogènes de la Drosophile.
Sur le schéma suivant on peut voir leur position et quelques-uns de leurs domaines d'expression. Ces homéogènes sont désignés par les termes Hox a, Hox b, Hox c, Hox d, suivis d'un numéro qui fait référence à leurs positions respectives sur les chromosomes 6, 11, 15, 4.
Hox a1, Hox b1 et Hox d1 sont des homologues de lab de la Drosophile.
Hox a9, Hox b9, Hox c9 et Hox d9 sont homologues de abd B.
Ils commandent, en synergie, en interactivité, l'identité de certaines portions de l'embryon comme le montre le schéma simplifié d'un jeune fœtus.
Hox a13, Hox b13, Hox c13, Hox d13 sont des gènes paralogues. Ils peuvent agir de manière coordonnée, ou isolément, laissant supposer une certaine redondance, sorte de mémoire-secours.
Au plan évolutif on pense que ces gènes proviennent de plusieurs duplications à partir d'un gène ancestral dont ils ont conservé des séquences pendant des millions d'années.
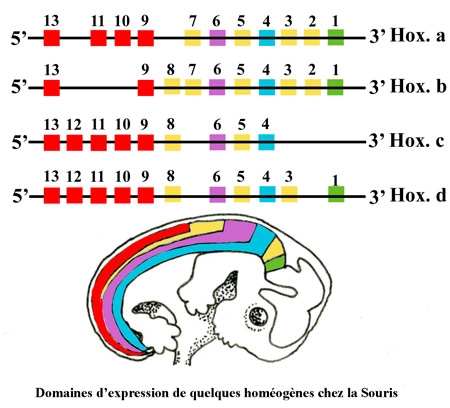
Mêmes figurés que ceux utilisés dans le schéma de la Drosophile présenté plus haut permettant d'établir les homologies. (N.B. : La transcription se fait toujours de 3' vers 5').
On pourrait présenter la même répartition des homéogènes localisés sur 4 des 46 chromosomes humains :
11 sur le chromosome 7 = HOX A
10 sur le chromosome 17 = HOX B
9 sur le chromosome 12 = HOX C
11 sur le chromosome 2 = HOX D
Ces gènes sont activés à un moment précis du développement embryonnaire par des signaux complexes et multiples ; comme chez la Drosophile les plus antérieurs s'expriment les premiers et s'appliquent à une zone antérieure ; les suivants leur succèdent, chevauchant ou non. Et cette combinatoire a pour résultat un segment, une zone, une ébauche qui se différenciera progressivement par la suite. On notera que les frontières antérieures d'expression sont toujours très nettes et qu'elles s'estompent vers l'arrière (sur la figure projetée on a l'exemple de Hox b1, Hox b4, Hox b5). Logiquement la redondance n'est pas exclue.
Exemple de l'implication des homéogènes dans la morphogénèse du membre : À partir de quatre bourgeons s'édifient les membres de la Souris dont les orientations antéro-postérieure, dorso-ventrale et proximo-distale s'établissent grâce à l'action combinée de plusieurs gènes, qui imposent également la mise en place des ébauches osseuses. La formation des espaces interdigitaux est réalisée grâce à la mort cellulaire programmée (apoptose) qui s'exerce sur des territoires précis de la palette distale.
Examinant les domaines d'expression de Hox d1 à Hox d13 à la fois sur le corps entier du fœtus et sur les bourgeons des pattes, on confirme la hiérarchie de la répartition des gènes et une certaine synergie entre eux. (L'extrémité du membre résulte d'une addition des produits d'au moins cinq gènes).
La mise en évidence de cette combinatoire a constitué un grand pas pour la biologie du développement ; elle a permis d'expliquer l'origine de plusieurs anomalies (amélie, phocomélie... adactylie, acheirie...) et de prendre des mesures de prévention.
Ces avancées moléculaires ouvrent des perspectives intéressantes, dans la mesure où ce qui est possible chez la Souris pourrait bien être, à terme et avec toutes les précautions qui s'imposent, tenté chez l'Homme.
Citons quelques exemples de modifications obtenues chez la Souris par transgénèse : inhiber l'expression d'un gène à la base d'un bourgeon de membre, ajouter des vertèbres cervicales, transformer une vertèbre lombaire en vertèbre thoracique, ajouter une paire de côtes... Dernières images de cette capacité à modifier le vivant : si on empêche l'expression de PAX 6 chez la souris : pas d'œil ou œil atypique.
Si on place Hox d9 dans la mouche : l'antenne est transformée en patte (d'insecte).
*
* * *
Ces résultats illustrent les possibilités de la biologie moléculaire et peuvent éveiller de réels espoirs pour la thérapie génique régulièrement évoquée lorsque des résultats prometteurs sont obtenus sur des souris transgéniques exprimant des maladies humaines comme certains cancers, la maladie d'Alzheimer, de Parkinson, le diabète ou les myopathies.
*
* * *
La lignée de souris Tg2576 constitue un modèle de référence pour la maladie d'Alzheimer, alors que les souris NOD (Non Obèse Diabetic) ou knock out Glut4 le sont pour le diabète.
Nous n'avons pas pu aborder les innombrables recherches effectuées sur les cellules-souches et sur le clonage dont les retombées ouvrent des perspectives prometteuses pour la santé humaine. Cela mériterait un exposé particulier, long et détaillé.
Et si l'on prolonge l'exploration moléculaire chez d'autres Vertébrés on peut comparer chez le Poulet et chez la Couleuvre les domaines d'expression d'Hox c6 (homéogène de Souris !).
Les frontières entre espèces semblent s'estomper et ceci nous amène à conclure.
CONCLUSIONS
Sans l'étude de ces trois animaux, nous n'aurions pas pu accéder à plusieurs processus cellulaires fondamentaux comme l'apoptose ; nous n'aurions pas pu connaître la combinatoire génique qui commande la morphogénèse embryonnaire.
Nous disposons donc de nouveaux concepts applicables à la recherche fondamentale et à la recherche appliquée, compte tenu de l'universalité du fonctionnement cellulaire, et des similitudes des processus de l'organogenèse.
Les homologies structurales et fonctionnelles nous permettent de vérifier que l'ontogenèse rappelle la phylogenèse, et que le génome des espèces a conservé une part de l'héritage d'un ancêtre commun. Du temps de Darwin, il était inconvenant d'imaginer que l'Homme descende du Singe... Qu'en serait-il aujourd'hui si on évoquait une lointaine filiation Homme/Insecte ?
L'étude d'animaux « modèles » nous paraît indispensable à la connaissance du fonctionnement cellulaire et organique, à la mise au point de thérapies innovantes et efficaces, sans oublier le positionnement de chaque espèce dans la chaîne évolutive.
Professeur Claude-Roland MARCHAND
(Communication présentée à l'Académie des Sciences et Belles Lettres de Besançon Franche-Comté le 6 avril 2009 )
09:40 Publié dans Biologie, Médecine | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |



Commentaires
je suis doctorante en biologie, mon thème de recherche est d'étudier le pouvoir pathogène des micromycètes isolés du sable de plages sur les éstivants. Je vx utiliser des souris blanches "cobayes" comme model expérimental en injectant mes souches isolées dans les souris. Que pensez vous?
Écrit par : Nadjet | 19/02/2013
Les commentaires sont fermés.