13/09/2019
Balades naturalistes : fréquentation
Objectifs de ce blog
Statistiques de fréquentation
Si tu sais méditer, observer et connaître,
Sans jamais devenir sceptique ou destructeur,
Rêver, mais sans laisser ton rêve être ton maître,
Penser sans n'être qu'un penseur…
If, Rudyard Kipling, 1896.
CLASSEMENT INTERNATIONAL DE
"BALADES NATURALISTES"
Blog distingué par Golden Blogs Awards 2014
et classé troisième dans la catégorie "Biodiversité"
12:30 Publié dans Actualité des Sciences, Biologie, Environnement-Écologie, Géologie-hydrogéologie-Climatologie, Limnologie-hydrobiologie, Médecine, Paléontologie - archéologie, Photographes naturalistes et scientifiques, Sexualité-embryologie, Sorties terrain | Tags : nature, naturaliste, sciences de la vie, sciences de la terre, géologie, biologie | Lien permanent | Commentaires (16) | ![]() Facebook | | |
Facebook | | |
06/01/2018
Greffe de tissu ovarien : les espoirs se confirment
Greffe de tissu ovarien :
les espoirs se confirment
(Article publié dans le numéro 274 de janvier 2018 de "En Direct"
le journal de la recherche et du transfert de l'Arc jurassien
par Clotilde Amiot)
La greffe de tissu ovarien représente une formidable avancée pour les femmes ayant à subir des traitements impliquant la perte de leur fertilité. L’espoir d’une grossesse après la maladie se concrétise aujourd’hui grâce au programme national de recherche clinique DATOR, placé sous la responsabilité du CHU de Besançon.
Nécessitant le recours à des molécules et/ou à des dosages particulièrement toxiques, certains traitements, notamment de chimiothérapie, sont à l’origine d’insuffisances ovariennes conduisant parfois à la stérilité. Parmi les mesures de préservation de la fertilité proposées, la congélation de tissu ovarien est la seule technique s’adressant à la fois aux femmes et aux fillettes prépubères ; elle peut être réalisée rapidement sans que la chimiothérapie soit différée. En France, le programme de recherche clinique DATOR(1), lancé en 2013, est piloté par le service de biologie et médecine de la reproduction, cryobiologie, du CHU de Besançon, qui dès 2009 avait fait la preuve de son excellence dans le domaine : c’est là que le premier bébé français naissait après conservation et greffe de tissu ovarien chez une patiente. Trois enfants sont nés depuis à Besançon grâce à cette technique.
« Le protocole, auquel dix-sept centres participent, a relancé l’activité de la greffe en France, après que la loi de 2008 a imposé un cadre très strict aux protocoles de recherche clinique ayant recours à du tissu ovarien congelé », raconte le Dr Clotilde Amiot, responsable de l’Unité de conservation des tissus germinaux, thérapie cellulaire et tissulaire au CHU de Besançon, et coordinatrice du programme DATOR.

Faire-part de naissances
Le tissu ovarien prélevé est congelé puis conservé dans de l’azote liquide, sous forme de fragments qui seront greffés par cœlioscopie le moment venu. Le recul n’est pas encore suffisant pour arrêter des chiffres définitifs, mais les premiers résultats sont encourageants : sur les trente-six patientes incluses dans le protocole, vingt-trois ont pu bénéficier d’une greffe, ayant donné lieu à douze grossesses, dont quatre sont en cours, et à la naissance de sept enfants. La mise en œuvre de DATOR suppose de nombreuses études périphériques concernant notamment le suivi des patientes. Elle va aussi de pair avec des recherches fondamentales, comme celle menée au sein du laboratoire Interactions hôte-greffon-tumeur & ingénierie cellulaire et génique, sur la qualification des tissus ovariens. « La qualification fonctionnelle établit si le tissu est viable et sa vascularisation ultérieure possible ; elle estime si la greffe est envisageable, explique Clotilde Amiot. La qualification carcinologique vérifie l’absence ou la présence de cellules cancéreuses dans le greffon ». Sur cet aspect, une technique novatrice de cytométrie en flux a été mise au point au laboratoire pour détecter les cellules cancéreuses à partir de marqueurs présents à leur surface, et peut s’appliquer à toutes les formes de leucémies, ce qui n’est pas le cas des méthodes de biologie moléculaire habituellement employées.
La présence de cellules cancéreuses interdit la greffe. Pour contourner cet obstacle, les chercheurs tentent aujourd’hui de dissocier les composants du tissu ovarien pour en isoler les follicules, qui sont des précurseurs des ovocytes. La réimplantation de ces seuls follicules pourrait constituer une alternative à la reconstruction d’un tissu permettant en toute sécurité de restaurer la fonction ovarienne chez les patientes concernées.
(1) Développement de l’autogreffe de tissu ovarien dans le but de restaurer la fonction ovarienne.
Contact : Clotilde Amiot - Laboratoire Interactions hôte-greffon-tumeur & ingénierie cellulaire et génique - EFS / UFC / INSERM - Tél. 03 81 21 86 98.
11:32 Publié dans Actualité des Sciences, Médecine, Sexualité-embryologie | Tags : clotilde amiot, établissement français du sang, université de franche-comté, inserm, labo interactions hôte-greffon-tumeur, greffe de tissu ovarien, ingénierie cellulaire et génique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
15/11/2017
ÉTIENNE WOLFF (1904-1996) Pionnier de la tératologie et de l'embryologie expérimentales

ÉTIENNE WOLFF
(1904-1996)
Pionnier de la tératologie
et de l'embryologie expérimentale
par M. le Professeur Claude-Roland Marchand.
Membre de l'Académie des Sciences, Belles lettres et Arts de Besançon
(Séance publique du 15 juin 2016)

Étienne Wolff est né en Bourgogne, à Auxerre ; il a fait sa carrière à Strasbourg et à Paris.
D'abord orienté vers la philosophie, il se prit de passion pour la biologie où, grâce à des maîtres enthousiastes, il a pu s'engager, exprimer sa rigueur, ses intuitions, ses audaces et actualiser certains paradigmes de 1925 à 1970. Cela fait vingt ans qu'il nous a quittés.
Ses résultats et leurs applications en recherches fondamentale et appliquée lui ont valu les plus hautes distinctions : il fut élu dans les trois Académies de l'Institut (Sciences en 1963, Médecine en 1966, Française en 1971), comme le furent Claude Bernard et Louis Pasteur au XIXe siècle.
Il a formé de nombreux élèves et disciples qui ont prolongé et approfondi les thèmes des recherches qu'il avait abordés, et en particulier la tératologie, les changements de sexe, les cultures d'organes et les chimères. Il a été, en outre, le créateur d'un laboratoire d'embryologie de renommée internationale et administrateur du Collège de France.
Son parcours fut tragiquement interrompu par la deuxième guerre mondiale, où il fut, en tant qu'officier, interné pendant cinq ans dans des Oflags, en Autriche et en Allemagne.
C'est là qu'il rédigea la matière de deux ouvrages qui furent complétés et édités après la Libération.
Nous voulons rendre un hommage à cet immense chercheur, modeste, discret très attaché aux valeurs humanistes et toujours soucieux de partager ses connaissances.
Depuis l'époque des cavernes, les monstres ont fasciné, inquiété nos ancêtres. Les anomalies et les bizarreries observées sur les animaux ou les hommes étaient souvent expliquées de manière irrationnelle, superstitieuse ou religieuse.
Au fil des siècles, de nombreux anatomistes et des médecins ont rassemblé des spécimens dans des musées et classé les anomalies selon leur degré ou leur nature. Sans pouvoir les expliquer rationnellement. Mais ce qui est certain, toutefois, c'est qu'on ne voit jamais de chimères ou de centaures ; pas de moutons à tête de chien, ni d'hommes-singes.
Parmi les anatomistes les plus illustres nous mentionnerons : Claude Galien (131-201 après J-C.), Andreas Vesalius (1514-1564), Ambroise Paré (1510-1590) et, au XIXe siècle, Étienne Geoffroy-Saint-Hilaire (1772-1844), contemporain de Georges Cuvier, son fils Isidore (1805-1861), et Camille Dareste (1822-1899). Les schémas qu'ils nous ont laissés sont précieux pour établir des comparaisons et tenter d'établir l'origine des anomalies.
Après une brève recherche en protistologie — sur l'Amibe — sous l'autorité du Professeur Édouard Chatton à Strasbourg (ou travaillait un futur Prix Nobel, André L. Wolff, Étienne Wolff s'est vu confier un travail en embryologie dans le laboratoire du Professeur Paul Ancel, alors orienté vers la recherche des « centres organisateurs et des inducteurs » qui déterminent les symétries et les polarités de l'embryon chez les Amphibiens ou chez les Oiseaux.
Sujet immense et d'actualité, à l'époque, où la concurrence internationale était forte, et où la France accusait un certain retard.
En bref, Paul Ancel suggérait à Étienne Wolff de générer des monstres afin que «l'anormal permette de comprendre et/ou d'expliquer le normal». Et pour cela il disposait d'œufs de Poule et d'un appareil à rayons X.
La mise au point d'une technique ad hoc :
L'accès au disque embryonnaire de l'œuf de poule n'est pas aisé. En ménageant une fenêtre dans la coquille, en la recouvrant d'une plaque de mica et en enlevant un peu d'albumine, Étienne Wolff a pu bombarder de rayons X différents territoires de l'embryon à différents stades et observer les résultats sans le tuer.
Cette technique originale lui a permis, nous dit-il : « d'obtenir en quelques semaines et sans coup férir presque toutes les grandes malformations connues chez les Vertébrés et en particulier chez l'Homme ». Et il ajoutait:« un cyclope est un monstre, un bec de lièvre est une anomalie. »
Les monstres simples :
Le premier monstre qu'il a obtenu, suite à une irradiation précoce et bien ciblée, fut un omphalocéphale : (fig.1).
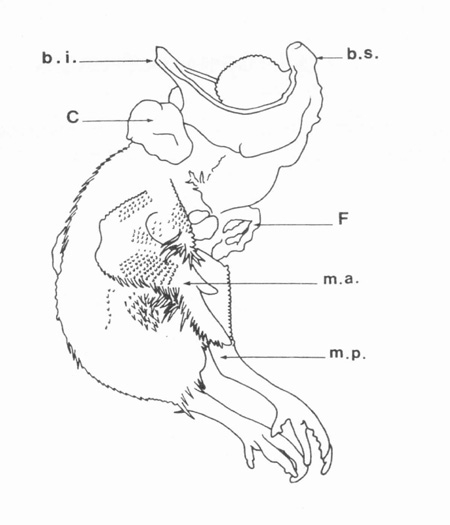
fig. 1 Poulet omphalocéphale à 12 jours d'incubation ; tête réduite, deux becs b.i., b.s.; C = cœur ; F = foie ; m.a. = aile ; m.p. = patte.
Il obtint ensuite toute une variété de malformations auxquelles il a donné des noms évocateurs : cyclocéphalie, cyclopie (fig. 2, 3, 4), otocéphalie (fig. 5), symélie (fig. 6, 7), ectomélie, phocomélie... en se servant de la classification établie par Étienne Geoffrey-Saint-Hilaire au XIXe siècle. (voir lexique en fin de texte).
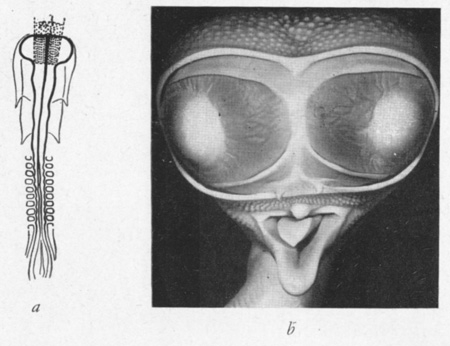
fig. 2 : Poulet cyclocéphale à deux yeux (b) Zone irradiée (a). (E. W. 1948)
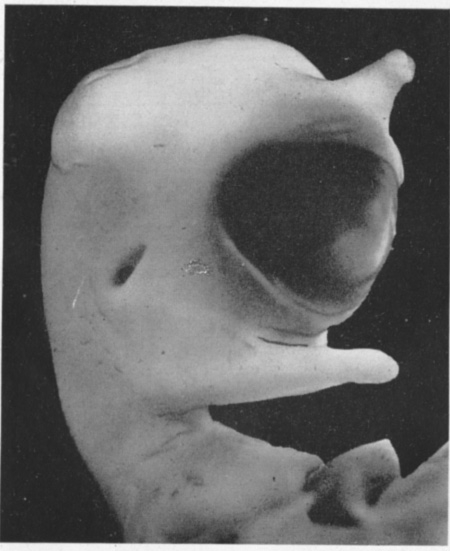
fig. 3 : Poulet cyclope. (E. W. 1948).
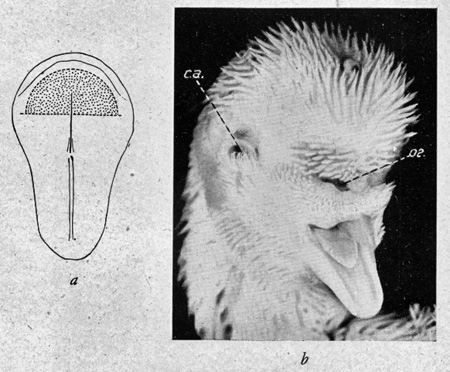
fig. 4 : Poulet cyclope (b) Zone irradiée (a)
(E. W. 1948). ca = conduit auditif ; œ = œil
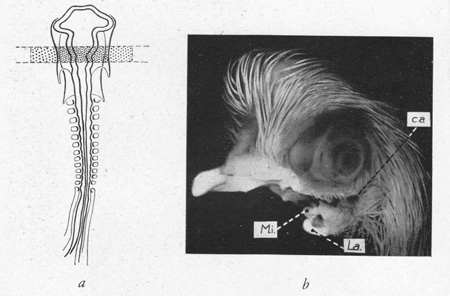
fig. 5 : Poulet otocéphale (b). Zone irradiée (a)
(E.W. 1948) Mi = maxillaire inf.;
ca = conduit auditif ; la = langue
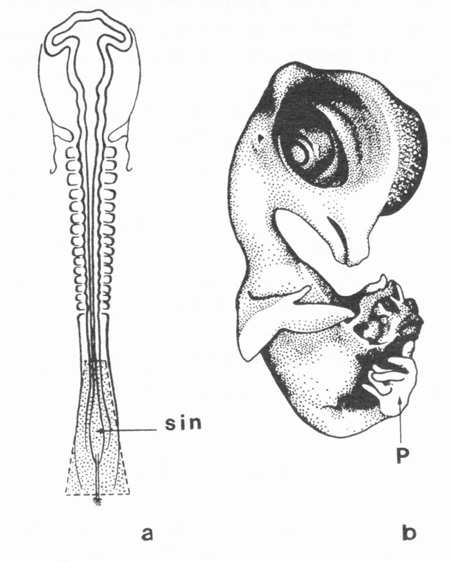
fig. 6 : Poulet symèle. (E. W. 1948).
a : sin. = zone irradiée
b : P = patte unique avec 6 orteils
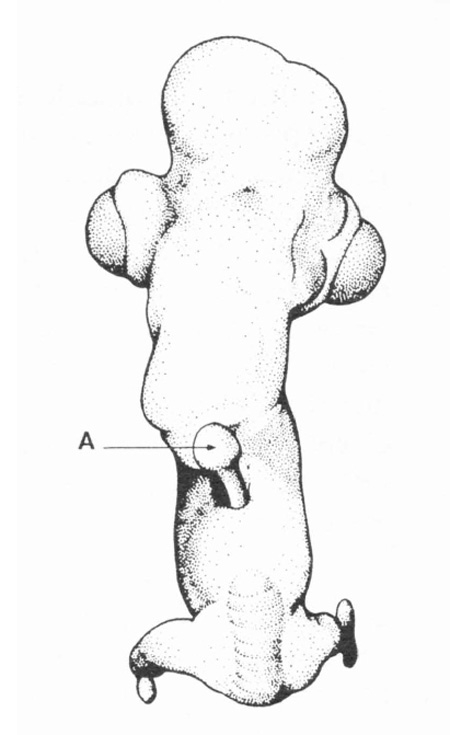
fig. 7 : Poulet symèle (E. W. 1948). A = bourgeon alaire
Analyse des anomalies :
L'irradiation altère souvent et détruit parfois des zones embryonnaires à l'origine des organes et des tissus normaux ; le développement se poursuit pourtant, avec des constructions compensatrices inattendues et pas toujours viables. Étienne Wolff a obtenu une grande variété d'anomalies, qui, pour la plupart, avaient été observées chez les fœtus humains et animaux. Cette tératologie expérimentale l'engageait à conclure que plusieurs causes mécaniques ou chimiques étaient à l'origine de malformations létales ou non. Avec Hiroshima, Tchernobyl, Minamata, Seveso, la dioxine, le diéthylstilboestrol, la thalidomide, le virus Zika... L'Histoire lui a hélas, donné raison et la communauté scientifique le redoutait depuis longtemps.
En outre, ces travaux répondaient en partie à la localisation de « centres organisateurs » qui seront, des décennies plus tard, mis en évidence avec la découverte des homéogènes, véritables architectes d'une organisation harmonieuse et conforme au programme génétique de l'espèce.
Ainsi, avec le poulet, Étienne Wolff contribuait, à l'instar de ses collègues sur les Amphibiens, à la connaissance de la dynamique du développement embryonnaire, grâce aux anomalies qu'il avait provoquées. L'ensemble de ses résultats fut consigné dans sa thèse qu'il intitula : « Les bases de la tératogenèse expérimentale des Vertébrés Amniotes par des méthodes directes ».
Les monstres doubles :
La ligature d'un œuf d'Amphibien est aisée et permet d'obtenir des jumeaux.
Il n'en est pas de même avec l'œuf de poule, mais Étienne Wolff a pensé que cela était possible. C'est Hubert Lutz, l'un de ses élèves, qui y est parvenu sur des œufs de cane. Pour cela il a fissuré le blastodisque germinal avec une fine aiguille de verre. Lorsque la fissuration est totale, il a obtenu des jumeaux séparés côte à côte ou en file indienne ; et lorsque la fissuration est partielle, il a obtenu des jumeaux soudés par l'arrière (fig. 8) ou par l'avant (fig. 9). La littérature tératologique signale des cas similaires dans l'espèce humaine, qui sont conservés dans les collections de la Faculté de Strasbourg (clichés E. Wolff 1948) (fig. 10 et 11) ou dans le Musée Dupuytren de la Faculté de Médecine de Paris.
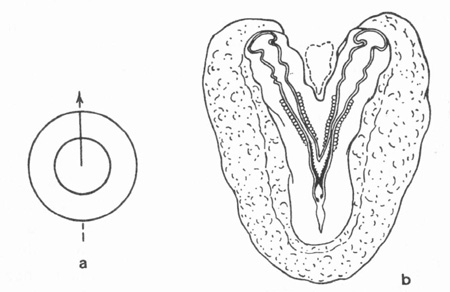
fig. 8 : Monstre double à deux têtes (b).
Fissuration partielle antérieure (a)
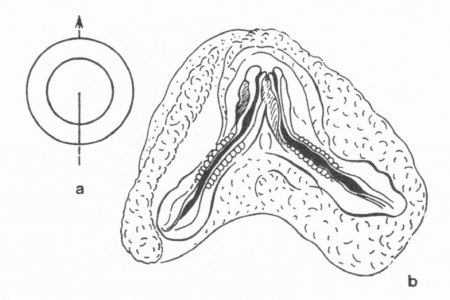
fig. 9 : Monstre double à deux troncs (b). Fissuration partielle postérieure (a)
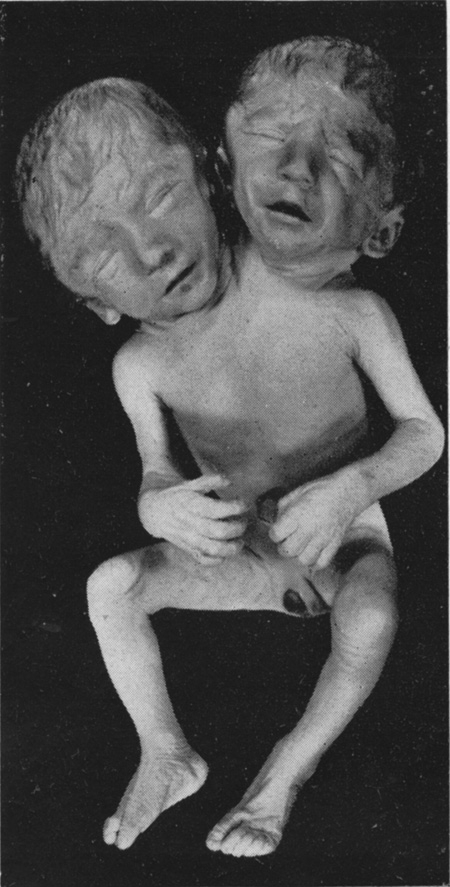
fig. 10 : Monstre humain dérodyme. (Wolff 1948)
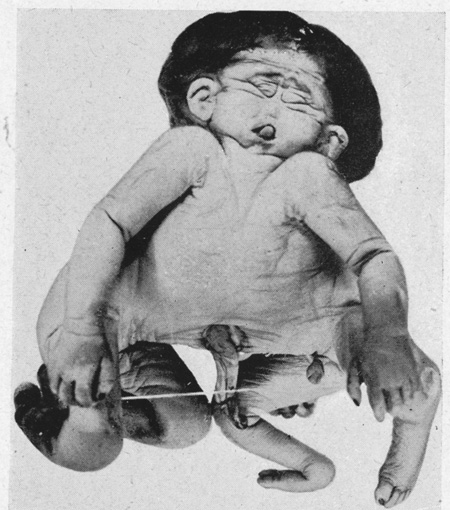
fig. 11 : Monstre humain « janiceps »
(Wolff 1948)
Ainsi, l'école Wolff, sur un matériel délicat, apportait une large contribution à la tératologie expérimentale et faisait la démonstration que les mêmes causes pouvaient engendrer les mêmes effets dans différentes classes de Vertébrés.
LES CHANGEMENTS DE SEXE
De même que la maîtrise des rayons X lui a permis d'intervenir sur les jeunes stades de l'embryon de Poulet, la purification et la synthèse des hormones sexuelles lui ont ouvert des perspectives expérimentales prometteuses.
L'enjeu : dans les années 1930, la différenciation sexuelle réalisée en conformité avec le génome, n'était pas totalement expliquée, mais on soupçonnait fort l'action morphogène des hormones sexuelles aboutissant à la mise en place des caractères sexuels primaires et secondaires.
Il faut toutefois rappeler les particularités aviaires:
— la femelle est hétérogamétique : ZW ; le mâle est homogamétique : ZZ.
— l'appareil génital femelle est dissymétrique : seuls l'ovaire et l'oviducte gauches se développent et sont fonctionnels (sauf chez les Rapaces).
La différenciation sexuelle se fait progressivement à partir d'un stade indifférencié comportant les ébauches mâles et femelles tant au niveau des canaux sexuels (Wolff et Müller) qu'au niveau des territoires gonadiques (cortex et médulla). Après 10 jours d'incubation, chez le poulet, la dissymétrie est nettement visible chez la femelle.
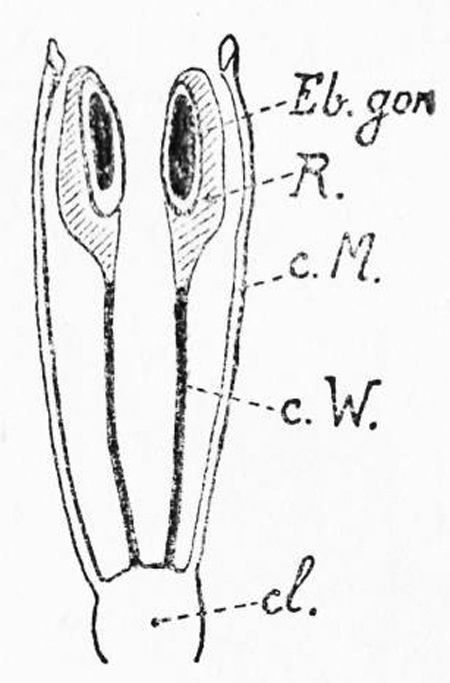
fig. 12 : Appareil génital de l'embryon de poulet au stade indifférencié.
Eb. gon. = ébauche gonade : en noir, partie mâle (médulla) ; en clair : partie femelle (cortex). cl. = cloaque ; c.M. = canal de Müller (femelle) futur oviducte ; cW. = canal de Wolff (mâle) futur canal déférent ; R. = rein embryonnaire transitoire, (mésonéphros).
La production expérimentale de mâles intersexués :
En injectant, à partir du 5e jour de l'incubation, de l'œstrone en solution aqueuse ou du benzoate d'œstradiol en solution huileuse, Étienne Wolff et Albert Ginglinger ont « transformé infailliblement 100 % des embryons de poulets mâles en intersexués ».
Différents degrés d'intersexualité ont été obtenus selon la dose d'hormone injectée et suivant le stade d'intervention.
N.B. des résultats identiques sont publiés en avril 1935 par B. H. Willier et en juin 1935 par Vera Dantchakoff 14 jours avant eux. Mais leurs travaux originaux plus approfondis leur ont reconnu une certaine priorité dans la bibliographie.
Résultats : 4 types d'intersexués sont obtenus (fig. 13) :
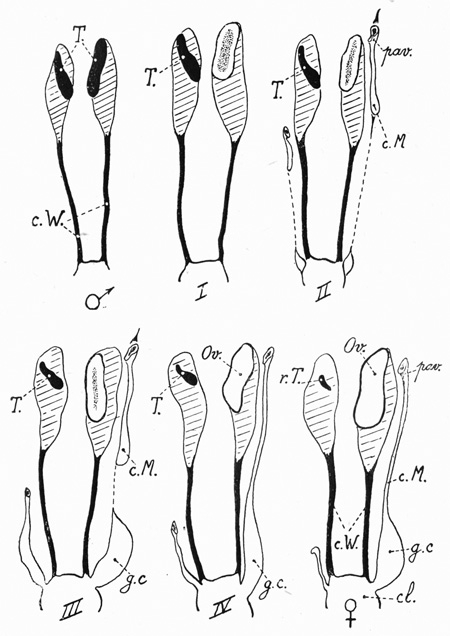
fig. 13 : d'après Étienne Wolff et Albert GINGLINGER (1935)
En haut à gauche : mâle normal = pas de canaux de Müller ; deux canaux de Wolff (c. W.) ; deux testicules (T).
En bas à droite : femelle normale = ovaire (Ov.) et canal de Müller gauches développés (c. M.) ; oviducte avec son pavillon (pav.) et sa glande coquillière (g. c.); cloaque (cl.)
I, II, III, IV: quatre degrés d'intersexualité :
I : testicule à droite non modifié (T) ; ovotestis à gauche ; pas de canaux de Müller.
II : testicule réduit à droite (T); ovotestis à gauche ; vestiges de canaux de Müller r (c.M.).
III : testicule réduit à droite (T) ; ovotestis à gauche : canal de Müller gauche presque complet (c. M.) ; vestigial, à droite.
IV: testicule réduit à droite (T) ; ovaire à gauche (Ov.) ; canal de Müller gauche complet (c. M.).
Étienne Wolff reconnaît qu'il lui a été difficile de distinguer les mâles intersexués de type IV des femelles. Seule la taille plus importante du testicule droit désignait un mâle.
Expérimentant le diéthylstilboestrol* (D.E.S.), une autre hormone artificielle féminisante, Étienne Wolff a obtenu des effets comparables**.
*J'ai pu obtenir, avec mes étudiants, en travaux pratiques dirigés, des intersexués en immergeant 20 secondes des œufs de poule, au 4e jour d'incubation, dans une solution alcoolique de D.E.S. (100 mg dans 100 ml). Dans la plupart des cas, les canaux de Müller étaient hypertrophiés.
** Cette hormone, prescrite, dans les années 1950 à 1970, à des femmes enceintes, sujettes à des fausses-couches, a été la source de tumeurs ou de stérilité chez leurs filles après la puberté. Elle a été interdite en France en 1977.
Ainsi étaient démontrées les principales et les plus spectaculaires propriétés morphogènes des hormones femelles. Pourtant la régression des canaux de Müller (oviductes) chez le mâle et la dissymétrie chez les femelles n'étaient pas expliquées.
Des décennies plus tard, en 1953, Alfred Jost a mis en évidence une hormone anti-Müllérienne synthétisée par les cellules de Sertoli chez le mâle ; cette glycoprotéine fait régresser les canaux de Müller. Les canaux de Wolff, futurs canaux déférents, quant à eux, sont sous le contrôle de la testostérone.
Évolution des intersexués après l'éclosion :
— Les glandes génitales reprennent une structure testiculaire ;
— Les conduits génitaux modifiés n'évoluent pas.
Effets paradoxaux des hormones mâles :
Sous l'action de l'androstènedione, on constate une forte régression des canaux de Müller chez les embryons femelles et une dilatation des canaux de Wolff dans les deux sexes.
Chez les mâles, l'androstènedione transforme le testicule gauche en ovotestis, et maintient une partie des canaux de Müller.
On en conclut, sans en comprendre la cause, à une action paradoxale des hormones mâles : elles masculinisent les femelles et féminisent les mâles.
Étienne Wolff, dubitatif, pense que les hormones mâles d'oiseaux diffèrent légèrement de celles utilisées dans les expériences.
LES CULTURES D'ORGANES IN VITRO
Étienne Wolff et son école ont obtenu in vitro, dans des milieux nutritifs appropriés, la survie et le développement d'ébauches d'organes prélevées sur de jeunes embryons de poulet. « C'est en quelque sorte la contrepartie des expériences sur les monstruosités » nous dit-il. Ainsi furent « cultivés » des glandes génitales, des spermiductes, des oviductes, des gonades, et même la syrinx (l'équivalent du larynx des Mammifères).
Dans chaque situation, le rôle des hormones sexuelles est confirmé.
C'est avec la culture d'ébauches embryonnaires de membres de poulet intactes, partielles ou greffées qu'Étienne Wolff démontre d'une part, la régulation des excédents et d'autre part, l'expression de potentialités ancestrales présentes, par exemple, chez l'Archaeopteryx. Ce qu'Étienne Wolff traduit par un accès inattendu à «la paléontologie expérimentale » car « in vitro veritas !».
Nous n'oublierons pas de mentionner l'intérêt qu'il a porté sur le cancer en cultivant des tumeurs et en confiant, pour l'approfondir, ce sujet à ses collaborateurs.
D'autres disciples de l'école Wolff, à Clermont-Ferrand et à Besançon par exemple, ont étudié in vitro, les interactions entre l'ectoderme et le mésoderme lors de la différenciation de la glande uropygienne (croupion) du canard (Lucien Gomot 1959) ou de la glande mammaire du lapin (Alain Propper 1969). La différenciation de bourgeons mammaires a même été obtenue par Propper (1973) dans de l'épiderme de poulet associé à du mésenchyme mammaire de lapin, prouvant ainsi le puissant pouvoir inducteur de ce tissu. [Des esprits malicieux parlaient même d'une possibilité de « lait de poule » !]
LES CHIMÈRES
Parmi ses essais spectaculaires, nous devons mentionner « les trois pattes pour un canard », monstruosité obtenue par Étienne Wolff à l'aide d'une greffe, qui lui a inspiré, en 1990, le titre de son ouvrage-testament.
C'est la sérendipité « au détour d'un travail sur le foie » qui a procuré à Nicole Le Douarin, sa collaboratrice, un marqueur naturel facile à repérer dans les cellules de caille : la présence d'un volumineux nucléole. Dans les chimères associant des cellules de caille et de poulet, provenant de différents territoires, ce marqueur assure la traçabilité des migrations cellulaires. Nicole Le Douarin* a obtenu des résultats de première importance dans l'organogenèse embryonnaire et sur les cellules souches qui l'ont placée récemment parmi les nobélisables. On lui doit, entre autres, des chimères de poulet avec des ailes de caille. Son ouvrage chez Robert Laffont « Dans le secret des êtres vivants. Itinéraire d'une biologiste » nous fait revivre son cheminement et la portée de ses travaux, qu'elle est venue présenter à l'Académie des Sciences, Belles lettres et Arts de Besançon en 2012. C'est le plus bel hommage qu'elle pouvait rendre à son maître, le professeur Wolff.
Par ses travaux originaux, ses innovations techniques, ses résultats obtenus sur les embryons de poulet, le professeur Étienne Wolff a inscrit son nom parmi les embryologistes de premier plan du XXe siècle.
Dans des circonstances tragiques parfois, il a maintenu le cap, assumant l'héritage de ses maîtres, se l'appropriant, l'enrichissant et le transmettant à ses disciples.
Dans l'éloge funèbre qu'il a prononcé lors des obsèques d'Étienne Wolff, le professeur David soulignait combien il « était animé par le désir de pénétrer le vivant par l'expérimentation », mais en tant que naturaliste « qu'il n'a cessé de demander le respect du vivant ». Jean Rostand rappelait, sous la coupole, la sagesse de ce nouvel Académicien, qui, doté du redoutable pouvoir de modifier le vivant, confiait, désabusé : « il est permis d'espérer un peu et de craindre beaucoup. »
Nous avons voulu rappeler les principaux résultats de ses recherches innovantes et les perspectives qu'elles ont ouvertes. Son laboratoire, ses élèves, ses disciples bénéficient de l'exemple qu'il a donné, et ont, à leur manière, avec les techniques modernes, prolongé, complété, les paradigmes qu'il avait pressentis ou définis.
En dernier lieu, nous dirons, comme Jean Rostand, qu'Étienne Wolff, « s'est toujours tenu à égale distance d'un finalisme désuet et d'un mécanisme systématique » écartant la tentation de la téléonomie et de l'entéléchie aristotélicienne.
Sa rigueur, sa détermination, sa modestie ont inspiré le respect et devraient nous servir encore d'exemple, vingt ans après sa disparition.
Dans un commentaire confidentiel, il exprimait son doute permanent qui traduit le sentiment qu'il avait de l'immense mystère qu'il n'avait fait qu'effleurer : « Il nous semble qu'il restera toujours, derrière les solutions acquises, une part d'inexpliqué qui tient à la nature même du problème, et qui ne peut être résolu sur le plan matériel.»
Lexique : Liste de la plupart des termes employés
en tératologie animale et humaine :
|
anencéphale = pas de tête ; bec-de-lièvre = fissures faciales et palatines ; cyclocéphale = yeux rapprochés ; cyclope : un œil impair ; déradelphe = une tête, deux troncs, quatre paires de membres ; dérodyme = deux têtes, deux colonnes vertébrales, deux jambes ; ectromèle = absence de un ou plusieurs membres ; hétéradelphe = une tête, huit membres ; janiceps = fusion de jumeaux face à face ; omphalocéphale = viscères dans la tête réduite ; opodyme = une tête, deux nez, quatre yeux ; otocéphale = oreilles au niveau du menton ; phocomèle = ni bras, ni avant-bras ; sternopage = soudure de jumeaux par le sternum ; symèle = un seul membre postérieur, dix doigts ; thoracopage = soudure de jumeaux par le thorax. |
BIBLIOGRAPHIE :
GOMOT Lucien : « Interaction ectoderme-mésoderme dans la formation des invaginations uropygiennes des Oiseaux. » J. Embryol. exp. Morph., vol. 6, pp 162-170, 1958.
LE DOUARIN Nicole : « Des chimères, des clones et des gènes. » Éd. Odile Jacob, 2000.
LE DOUARIN Nicole : « Dans le secret des êtres vivants. Itinéraire d'une biologiste. » Éd. Robert Laffont, 488 p., 2012.
LUTZ Hubert : « Sur la production expérimentale de la polyembryonie et de la monstruosité double chez les Oiseaux. » Arch. Anat. micr., 79, pp 79-144, 1949.
PROPPER Alain and GOMOT Lucien : « Control of chick epidermis differentiation by rabbit mammary mesenchyme." Experientia, vol. 29, Issue 12, pp 1543-1544, 1973.
WOLFF Étienne et GINGLINGER Albert : « Sur la production expérimentale d'intersexués par l'injection de folliculine à l'embryon de Poulet.» C.R. Acad. Sc. t. 200, p. 2118,1935.
WOLFF Étienne : « Les bases de la tératogenèse expérimentale des Vertébrés Amniotes d'après les résultats des méthodes directes. » Arch. Anat. Hist. Embr. t. 22, pp. 1-382 p., 1936.
WOLFF Étienne : « Les changements de sexe. », L'avenir de la science, n° 23, Éd. Gallimard, 306 p., 1946.
WOLFF Étienne : « La science des monstres. », L'avenir de la science, n° 27, Éd. Gallimard, 265 p., 1948.
WOLFF Étienne : « Trois pattes pour un canard. Souvenirs d'un biologiste ». Éd. de la Fondation Singer-Polignac. 201 p. 1990.
10:05 Publié dans Biologie, Médecine, Sexualité-embryologie | Tags : étienne wolff, scientifique, monstres, poulet, embryon de poulet, tératologie, embryologie expérimentale, acaémicien des sciences, académicien des lettres, académie de médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
08/06/2017
Les potentialités infinies des cellules souches
 Les potentialités infinies des cellules souches
Les potentialités infinies des cellules souches
(Dernière mise à jour : 27 juin 2018)
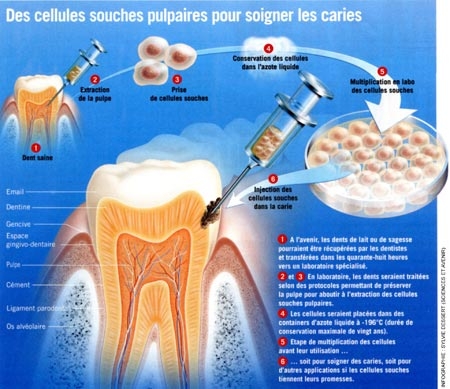
La médecine régénératrice tend à développer des techniques permettant la réparation des tissus à partir de cellules souches. Au début des années 2000, des chercheurs de l'INSERM de Montpellier ont réussi à déprogrammer des cellules adultes différenciées pour les transformer en cellules souches démontrant ainsi que le processus du vieillissement est réversible et annonçant une thérapeutique pour en corriger les pathologies.
Le corps humain représente un assemblage de 100 000 milliards de cellules, toutes dérivées d'une cellule unique l'ovule fécondé par le spermatozoïde. D'une façon schématique, chez les animaux pluricellulaires, cette cellule originelle se divise plusieurs fois donnant une masse sphérique de cellules ou blastomères (la morula) qui va se creuser d'une cavité, le blastocèle se transformant une sphère creuse (la blastula). Cette blastula va s'invaginer comme une balle de caoutchouc crevée. C'est la gastrulation qui ébauche le tube digestif. Ce germe à deux feuillets, l'un externe l'ectoderme et l'autre interne l'endoderme va se compliquer l'apparition d'un feuillet intercalé : le mésoderme. Ces trois feuillets cellulaires seront à l'origine des cellules des différents tissus et organes.
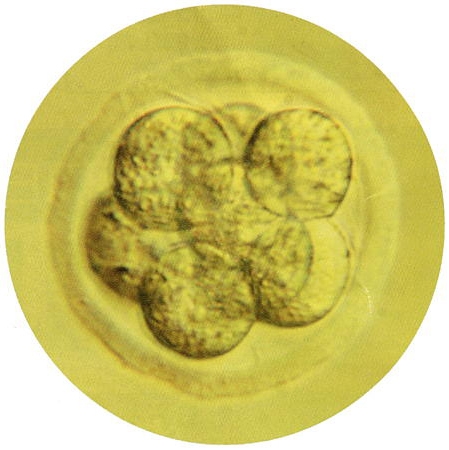
Embryon humain au début de
la segmentation (8 blastomères)
Cliché © Institut Pasteur
Trouver ICI une vidéo de l'Institut Pasteur sur les cellules souches
D'où proviennent les cellules souches iPS ?
Que se passe-t-il juste après la fécondation d'un ovule par un spermatozoïde ? Dans un article publié en septembre 2015 dans la revue "Nature communications", des généticiens de l'Institut Karolinska de Stockholm viennent d'éclairer cette étape fondamentale, et pourtant méconnue, du développement en identifiant les gènes exprimés par l'œuf fécondé lors de ses toutes premières divisions. Ils ont pour cela étudié des ovules humains tout juste fécondés et congelés, mais ne faisant plus l'objet d'un projet parental. Deux jours après la fécondation (l'embryon est alors formé de 4 cellules), seuls 32 gènes s'activent sur les quelque 23 000 de notre génome. Au troisième jour (embryon de 8 cellules), 129 gènes sont exprimés.
Parmi ces 32 gènes, certains codent directement pour des protéines, tandis que d'autres sont impliqués dans la régulation de l'expression d'autres gènes. Par exemple, le gène ZSCAN4 est fortement exprimé lorsque l'embryon ne se compose encore que de 4 cellules. On ne sera donc pas surpris lorsqu'on sait que ce gène intervient dans la mise au point des cellules souches pluripotentes induites (iPS), capables de se multiplier à l'infini et de se différencier en tout type de cellule. Cette découverte pourrait permettre d'améliorer les procédés de fabrication des iPS et de remédier aux problèmes de fertilité.
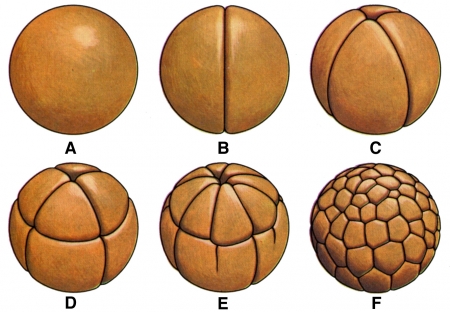
Premiers stades de la division d'un œuf d'amphibien
Schéma © Encyclopedia Universalis
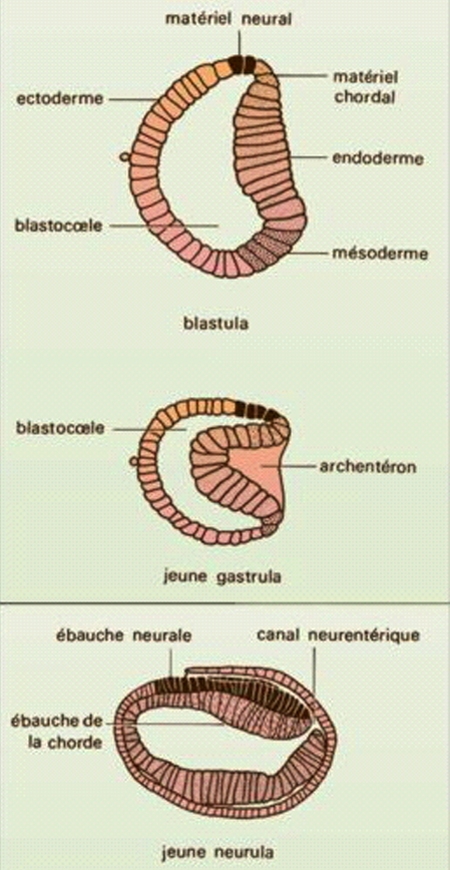
Gastrulation et neurulation chez l'Amphioxus (Procordés)
Schéma © Encyclopedia Universalis
— Le feuillet externe ou ectoderme va engendrer les cellules de l'épiderme et du système nerveux.
— Le feuillet interne ou endoderme va engendrer les cellules du tube digestif.
— Le feuillet intermédiaire ou mésoderme va engendrer toutes les autres cellules des autres organes et appareils circulatoire, respiratoire, musculaire, squelettique, cellules sanguines, etc.
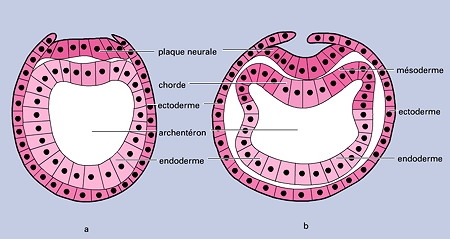
Coupes transversales d'une gastrula avec la mise en place
du mésoderme chez un vertébré
Schéma © Encyclopedia Universalis
Au total, notre corps est constitué de quelque deux cents types cellulaires différents, et ce dès la naissance. Cependant, au cours de notre vie, nos cellules vont se renouveler. De sorte que, quel que soit notre âge, la plupart de nos cellules sont plus jeunes que nous : nombre d'entre elles ont une durée de vie limitée et sont régulièrement remplacées à l'exception de certains neurones du cortex occipital. Ainsi, certaines cellules intestinales ont une durée de vie de 16 ans alors que les cellules de la paroi ne vivent que quelques heures. Le squelette est totalement renouvelé en 10 ans, un globule rouge vit quatre mois, une cellule du foie 300 à 500 jours, une cellule de l'épiderme deux semaines et une cellule de la cornée sept jours.
Qu'est-ce qu'une cellule souche ?
Il s'agit d'une cellule non différenciée et qui est apte à engendrer n'importe quelle cellule de n'importe quel tissu. Selon leur potentialité, on distingue trois types de cellules souches :
- cellules totipotentes
Cellules de l'embryon humain jusqu'à 4 jours. Les seules capables de produire un individu complet. En ce qui concerne les premiers stades embryonnaires, chaque blastomère peut être considéré comme une cellule souche embryonnaire, puisque isolément, il est capable de redonner un organisme complet.
- cellules pluripluripotentes
Présentes dans l'embryon humain entre le 5e et le 7e jour. Capables de se différencier en tous les types de cellules de l'organisme. En médecine régénératrice, elles peuvent être utilisées telles quelles (CSE). Mais on peut les produire à partir de cellules adultes reprogrammées (CSPi), soit in vitro, soit in vivo.
- cellules multipotentes
Présentes tout au long de la vie et capables de se différencier en certains types (par exemple, les cellules de moelle osseuse donnent les cellules sanguines). Chaque organe va conserver quelques cellules souches susceptibles de procéder à des renouvellements de cellules, régénérant ainsi les organes différenciés.
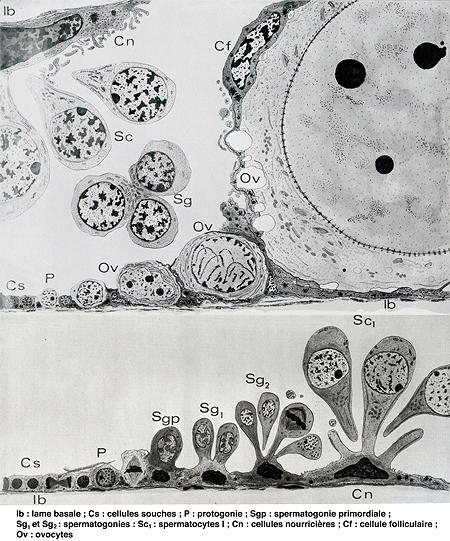
Les cellules souches de la glande hermaphrodite
d'escargot évoluent soit en spermatozoïdes soit en ovules
Schéma © André Guyard
Nichées dans différents tissus ou organes de notre corps, ces cellules souches présentent deux caractéristiques fondamentales : elles sont capables de s'autorenouveler (ainsi, notre stock de cellules souches reste constant au fil du temps) et de se différencier, c'est-à-dire de se transformer en cellules spécialisées. Et l'exploitation des potentialités de ces cellules souches ouvrent un grand espoir à la médecine dite régénératrice en palliant la disparition ou la déficience de certaines cellules du corps. Ces cellules souches adultes sont dites pluripotentes (PSC = Pluripotent Stem Cells).
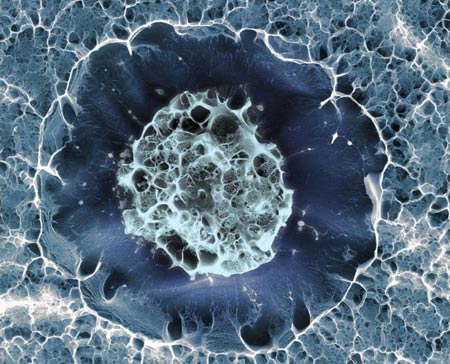
Cellule souche humaine
©Sílvia A Ferreira, Cristina Lopo and Eileen Gentleman
King’s College London
Image primée aux "plus belles photos du Wellcome Image Awards 2016"
L'image ci-dessus est celle d'une cellule souche humaine issue de l'os de hanche d'un donneur de moelle osseuse. Le diamètre de la cellule est d'environ 15 micromètres (0,015 mm).
Si l'on pouvait greffer aux diabétiques des cellules pancréatiques sécrétrices d'insuline, à un homme au cœur abîmé par un infarctus des cellules cardiaques, à un malade de Parkinson des neurones dopaminergiques, à un accidenté de la route des cellules pouvant reconstituer sa moelle épinière et lui éviter la paralysie ? C'est l'espoir d'une médecine régénératrice dopée ces dernières années par le spectaculaire développement des recherches sur les cellules souches. Et les chercheurs de l'Institut Pasteur s'emploient à explorer différentes voies thérapeutiques utilisant les cellules souches.
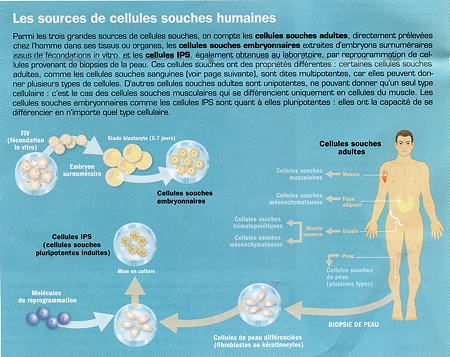
Sources de cellules souches humaines (hESC, PSC et iPSC)
Infogramme © Institut Pasteur
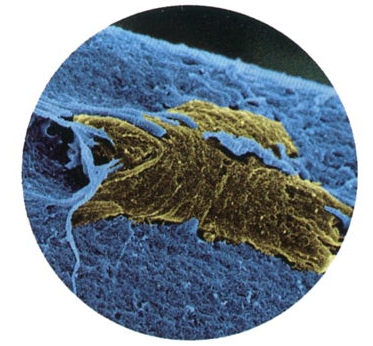
Cellule souche de muscle sur une fibre musculaire
Document © Institut Pasteur
Voir avec profit présentée par Fabrice Chrétien une vidéo définissant les cellules souches et leurs potentialités filmée à TEDxParis le 6 octobre 2012 à l'Olympia.
Issu d'un parcours à la fois scientifique et médical, Fabrice Chrétien est neuropathologiste à l'Hôpital Raymond Poincaré à Garches, Professeur d'histologie (étude des tissus biologiques) à l'Université Versailles Saint-Quentin et responsable à l'Institut Pasteur de l'unité Histopathologie humaine et modèles animaux. Ses travaux ont permis de mettre en évidence la résistance des cellules souches adultes en démontrant qu'elles pouvaient survivre chez l'homme jusqu'à 17 jours après la mort.
Voir également présentée par Laurent Alexandre cette vidéo sur l'espérance de vie filmée à TEDxParis le 6 octobre 2012 à l'Olympia.
Chirurgien et urologue de formation, Laurent Alexandre est également diplômé de Science Po, d'HEC et de l'ENA. Hyperactif et pionnier d'internet, ce coureur de marathon est le co-fondateur, dans les années 90, de Doctissimo.fr. Auteur en 2011 d'un essai intitulé « La mort de la mort », il s'intéresse aujourd'hui aux bouleversements que va connaître l'humanité conjointement aux progrès de la science en biotechnologie.
Comment déclencher la différenciation cellulaire d'une cellule souche ?
Pour amener une cellule souche à se différencier en tel ou tel type cellulaire, il faut ajouter à la culture certains facteurs comme des molécules de signalisation, c'est-à-dire en mimant les signaux moléculaires reçus par la cellule souche au cours du développement de l'organisme. Mais la nature est complexe : la différenciation d'une cellule souche implique souvent des interactions avec d'autres types cellulaires, qui, en plus, évoluent au cours du temps. Reproduire ces événements en culture est un autre grand défi. Nous ne savons pas encore, par exemple, différencier efficacement une cellule pluripotente, comme une cellule souche embryonnaire, en cellule musculaire. Des protocoles pour obtenir des cellules neuronales ou cardiaques sont en revanche mieux définis. Les défis scientifiques concernent désormais le rein, la peau, les muscles... Les expériences en cours visent à récapituler la succession des molécules de signalisation que les cellules souches pluripotentes rencontrent chez l'embryon, afin de pouvoir mimer ces événements au laboratoire.
Au-delà des cellules souches adultes
Mais pour beaucoup d'applications, la biologie des cellules souches adultes est peu connue et il reste difficile de les identifier, de les manipuler et d'obtenir leur multiplication sans qu'elles ne perdent leur caractère "souche". Il faut pouvoir les cultiver en grande quantité, chaque thérapie cellulaire nécessitant des millions de cellules. Et, s'ils sont moindres qu'en cas de greffes d'organes, les problèmes de compatibilité existent pour les transplantations de cellules d'une personne à une autre. Plusieurs alternatives sont envisagées.
— Une première méthode est l'utilisation de cellules souches prélevées sur des embryons surnuméraires de 5 jours issus de la fécondation in vitro (hESC).
Leur masse interne est alors constituée d'une centaine de cellules souches "pluripotentes" : elles ont la capacité de se différencier en tous les types cellulaires. On peut ensuite les cultiver indéfiniment et constituer des banques de cellules, dont le développement permettrait de disposer de lignées cellulaires compatibles avec de nombreux individus. Depuis l'obtention des premières cellules souches embryonnaires humaines en 1998, les recherches, très réglementées, ont permis d'apprendre à les spécialiser en cellules de la peau, du cœur, en neurones, en photorécepteurs de la rétine... mais les scientifiques n'ont pas réussi à les différencier en plusieurs autres types cellulaires. C'est l'un des grands défis du futur. Malgré ces obstacles, leur maîtrise est devenue suffisamment fiable dans certains cas pour que trois essais cliniques aient été autorisés aux États-Unis : l'un vise à utiliser chez des accidentés des précurseurs d'oligodendrocytes (cellules intervenant dans la remyélinisation de la moelle épinière) dérivés de cellules souches embryonnaires : le premier patient a déjà commencé à être traité, en octobre dernier. Deux autres essais à venir ont pour objectif la réparation de la rétine, pour une maladie rare et pour la dégénérescence maculaire liée à l'âge (un million de patients en France). Des essais se préparent aussi en France, comme celui porté par le Pr Menasché[1] (hôpital européen Georges Pompidou, Paris), qui prévoit d'utiliser des précurseurs de cellules cardiaques dérivés de cellules souches embryonnaires en vue de réparer le cœur.
— Une deuxième méthode est l'utilisation de cellules souches humaines adultes (PSC et iPSC).
Transformer une cellule de votre peau en cellule cardiaque ou en neurone est désormais possible grâce à la technologie des cellules souches pluripotentes induites (iPSC). Cette technique procède d'une véritable révolution scientifique : en 2005, le Japonais Shinya Yamanaka a réussi à "reprogrammer" une cellule spécialisée de la peau adulte, un fibroblaste, pour la faire revenir à l'état de cellule souche pluripotente, tout comme une cellule souche embryonnaire. On peut dès lors orienter de nouveau son devenir. Autrement dit, une cellule de notre peau pourrait être transformée en cellule de foie, de cœur, etc. Des chercheurs français de l'Institut de génomique fonctionnelle (Inserm/CNRS/université de Montpellier) ont réussi à redonner leur jeunesse à des cellules de donneurs âgés de plus de 100 ans, en les reprogrammant au stade de cellules souches, démontrant ainsi que le processus du vieillissement est réversible (voir plus bas). Ces cellules souches pluripotentes induites (iPSC) sont un formidable espoir pour la médecine régénératrice, et peut-être pour une médecine "personnalisée". À court terme, elles devraient déjà être très utiles comme modèles de maladies et pour tester des médicaments.
Cellules souches adultes (PSC), cellules souches embryonnaires (hESC) et cellules souches pluripotentes induites (iPSC), sont au cœur d'une recherche en pleine effervescence. Au vu des limites des greffes d'organes (manque de greffons, problèmes de compatibilité), de l'impossibilité de transplanter certains organes qui pourraient néanmoins être traités avec des cellules souches et de la possibilité, au-delà de la médecine régénératrice, d'utiliser ces cellules pour le criblage de médicaments, elles semblent les candidates idéales pour la médecine de demain.
— Une troisième méthode est la xéno-transplantation, c'est-à-dire la greffe d'organes animaux chez l'Homme. (Sciences et Avenir, n° 806 avril 2014, p. 11).
Les cellules souches pluripotentes iPs seront sources de greffes cellulaires ou même d'organes reconstitués in vitro. À l'Institut de transplantation urologie-néphrologie (Itun) de l'INSERM UMR 1064 de Nantes, un protocole clinique avec ces iPs est en cours pour le traitement de maladies héréditaires du foie. L'équipe du Pr Ignacio Anegon travaille également aussi sur la xéno-transplantation, c'est-à-dire la greffe d'organes animaux chez l'Homme.
Quels animaux pourraient nous donner leurs organes ?
Les primates sont porteurs de rétrovirus pouvant sauter la barrière des espèces. Par ailleurs, il serait éthiquement peu acceptable de disposer de fermes de primates comme réserves de greffons. Les donneurs les plus probables demeurent donc les cochons. Il y a déjà des élevages et la taille de leurs organes est compatible avec celle des nôtres. Cependant, ils ont aussi des rétrovirus endogènes (PERV), capables d'infecter les cellules humaines in vitro. C'est pourquoi, en janvier 1999, le Conseil de l'Europe avait voté un moratoire sur la xénotransplantation. Celui-ci est aujourd'hui remis en question. Car, lors d'un essai clinique néo-zélandais mené à la fin des années 1990, des centaines de patients ont reçu des cellules pancréatiques sécrétrices d'insuline porcines comme traitement du diabète de type 1 et, à ce jour, aucun signe d'infection par les PERV n'a été détecté.
Une greffe d'organes de porc ne nécessiterait-elle pas des traitements antirejet colossaux ?
En effet. notamment pour des organes très vascularisés (rein, cœur ou foie). Car les cellules endothéliales qui en tapissent les vaisseaux expriment des antigènes contre lesquels nous possédons des anticorps très actifs, provoquant un rejet hyperaigu. L'Itun a conçu des porcs transgéniques qui n'expriment pas quatre de ces antigènes. Malgré cela, il y a quand même rejet (car ce ne sont pas les seuls), mais atténué. En attendant que la recherche progresse, on peut envisager de greffer des cellules ou des tissus non vascularisés. Les résultats de l'essai en Nouvelle-Zélande sont très encourageants. La cornée ou les neurones sont aussi de bons candidats, dans cinq à dix ans.
Quelle est l'autre greffe d'avenir ?
Les chimères inter-espèces. Chez des animaux, on inactive des gènes indispensables à la génération d'un organe (on dit qu'ils sont knock-out ou KO). Puis, dans les embryons KO, on injecte des cellules souches d'une autre espèce qui vont générer l'organe. L'université de Tokyo a ainsi obtenu en 2010 des souris dotées d'un pancréas de rat et vient de produire des verrats blancs porteurs de pancréas de cochons noirs. L'Itun peut donc envisager demain des porcs générateurs de pancréas humain.
Le premier consortium français de recherche sur les cellules souches
Nommé Laboratoire d'Excellence, REVIVE, premier consortium français de recherche sur les cellules souches, regroupe quinze laboratoires de l'Institut Pasteur, une dizaine d'autres équipes (Inserm, INRA, Paris 5, Paris 6...), des cliniciens, et cinq partenaires industriels. " Grâce aux synergies qui existent entre toutes les équipes fédérées, nous espérons donner une impulsion importante à la recherche dans ce domaine», souligne Philip Avner, Directeur du département de Biologie du développement de l'Institut Pasteur, d'où a émergé REVIVE. Recherche fondamentale, médecine régénératrice, criblage de molécules d'intérêt thérapeutique, mais aussi enseignement et réflexion éthique sont au cœur du projet.
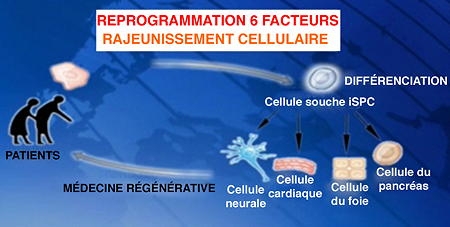
Reprogrammer les cellules différenciées en iPSC
Redonner leur jeunesse à des cellules de donneurs âgés de plus de 100 ans, en les reprogrammant au stade de cellules souches, démontre ainsi que le processus du vieillissement est réversible. Ces travaux sur la possibilité d'effacer les marques de vieillissement des cellules, publiés dans la revue spécialisée "Genes & Development" du 1er novembre 2011, marquent une nouvelle étape vers la médecine régénérative pour corriger une pathologie, note Jean-Marc Lemaître, responsable de ces recherches. Autre débouché important : mieux comprendre le vieillissement et corriger ses aspects pathologiques, selon le chercheur de l'Inserm.
Les cellules âgées ont été reprogrammées in vitro en cellules souches pluripotentes induites (iPSC) et ont ainsi retrouvé leur jeunesse et les caractéristiques des cellules souches embryonnaires (hESC) qui peuvent se différencier à nouveau en cellules de tous types après la cure de jouvence concoctée par les chercheurs.
Depuis 2007, on sait reprogrammer des cellules adultes humaines en cellules souches pluripotentes (iPSC) dont les propriétés sont similaires à celles des cellules souches embryonnaires (hESC). Mais jusqu'alors, la reprogrammation de cellules adultes se heurtait à une limite, la sénescence, point ultime du vieillissement cellulaire. L'équipe de Jean-Marc Lemaître vient de franchir cette limite.
En culture cellulaire, l'équipe de Montpellier a multiplié des cellules de la peau (fibroblastes) d'un donneur de 74 ans pour atteindre la sénescence caractérisée par l'arrêt de la prolifération des cellules. Les chercheurs ont ensuite procédé à la reprogrammation in vitro de ces cellules en ajoutant à la culture un cocktail de quatre facteurs génétiques (OCT4, SOX2, C MYC et KLF4) enrichi de deux facteurs supplémentaires (NANOG et LIN28).
Infogramme Inserm/CNRS/université de Montpellier
Grâce à ces six ingrédients, les cellules sénescentes ont retrouvé des caractéristiques de cellules souches pluripotentes de type embryonnaire.
"Les marqueurs de l'âge des cellules ont été effacés, et les cellules souches iPSC que nous avons obtenues peuvent produire des cellules fonctionnelles, de tous types avec une capacité de prolifération et une longévité accrues", explique Jean-Marc Lemaître.
Par la suite, l'équipe a testé ce cocktail sur des cellules plus âgées de 92, 94, 96 jusqu'à 101 ans.
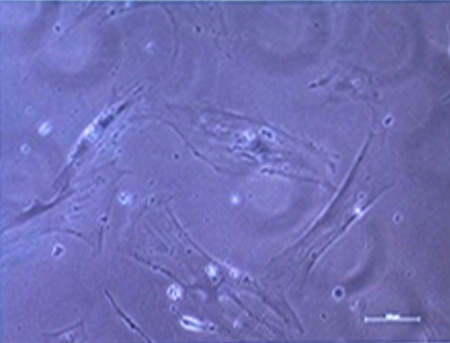
Cellules sénescentes avant reprogrammation
Cliché © Inserm/CNRS/université de Montpellier
Ces travaux ouvrent la voie à terme à l'utilisation des cellules reprogrammées iPSC comme source idéale de cellules adultes tolérées par le système immunitaire, pour réparer des organes ou des tissus chez des patients âgés, ajoute le chercheur.
Des risques à contrôler
La propriété d'autorenouvellement - caractéristique des cellules souches - peut être dangereuse si elle n'est pas contrôlée. Le risque serait alors l'apparition de cellules souches cancéreuses. Un défi majeur pour les scientifiques aujourd'hui est de s'assurer que des cellules souches transplantées ne dérivent pas vers une prolifération anormale. Ce problème ne se pose pas avec les cellules souches isolées de l'adulte, déjà déterminées, mais avec les cellules souches pluripotentes (soit induites - les iPSC -, soit embryonnaires - les hESC-) : leur différenciation, si elle est incomplète, pourrait déclencher un mécanisme de cancérisation. De nombreux travaux visent donc à mieux maîtriser ce phénomène afin d'écarter les risques.
Sources :
La lettre de l'Institut Pasteur n° 74 sept 2011.
Lemaître J.-M. et al (2011) Genes & Development 1er nov 2011.
Cellules souches : premier essai européen
(Sciences et Avenir, janvier 2012 n° 779 p. 43).
Le premier essai clinique européen réalisé à partir de cellules souches embryonnaires humaines (hESC) sera mené en 2012 à Londres au Moorfields Eye Hospital.
Le 22 septembre 2011, l'agence du médicament du Royaume-Uni (MHRA) a en effet donné son feu vert à la compagnie américaine de biotechnologie, Advanced Cell Technology (ACT), pour tester un traitement expérimental visant à corriger une pathologie rare de la vue, la dégénérescence maculaire de Stargardt. Liée à une altération progressive de la région centrale de la rétine, cette affection de l'œil est d'origine génétique et atteint les personnes avant l'âge de 20 ans, essentiellement entre 7 et 12 ans, filles comme garçons. On estime qu'elle touche un individu sur 30 000.
Outre-Atlantique, deux essais d'ACT sont déjà en cours. L'un pour cette même affection, l'autre pour la dégénérescence maculaire liée à l'âge (DMLA). À ce jour, un seul patient a bénéficié du traitement mis au point par ACT pour la maladie de Stargardt et qui consiste en une greffe de cellules de l'épithélium pigmentaire de la rétine obtenues par dérivation de hESC. La société ACT a annoncé avoir entamé des discussions avec d'autres centres de recherche européens en vue de mener de nouveaux essais cliniques. Mais, pas en France qui interdit toujours, sauf dérogations, la recherche sur l'embryon et les hESC.
Désormais, de nombreux laboratoires travaillent pour mettre au point des thérapeutiques fondées sur les cellules souches dans tous les domaines de la médecine. Ci-dessous, un panorama remis à jour qui explore les premiers résultats obtenus.
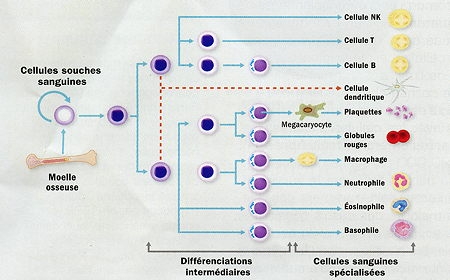
La greffe de moelle osseuse, pionnière des thérapies cellulaire
L'utilisation de cellules souches en médecine existe déjà depuis... une quarantaine d'années. En effet, la greffe de moelle osseuse permet la transplantation de cellules souches sanguines, capables de se spécialiser en une dizaine de types de cellules du sang : globules rouges, plaquettes, différents types de globules blancs.
Potentialités des cellules souches de la moelle osseuse
Infogramme © Institut Pasteur
Leucémies, lymphomes, myélomes, anémies, immunodéficience sévère de patients cancéreux après des chimio ou radiothérapies intensives... plus de 26 000 personnes bénéficieraient chaque année en Europe d'une telle greffe. Pionnière des thérapies cellulaires, elle a cependant une limite majeure : le risque de rejet du greffon en cas de mauvaise compatibilité avec le donneur. D'où l'espoir des recherches en cours sur les cellules souches sanguines.
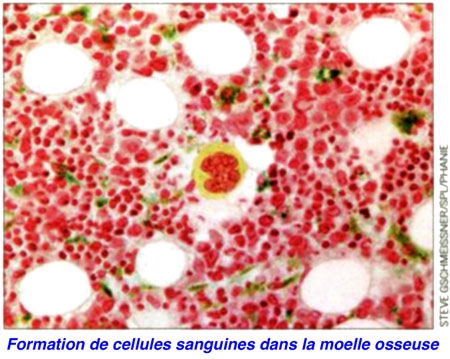
Les cellules souches sanguines permettent déjà de traiter de nombreuses maladies par greffe de moelle osseuse, et les recherches en cours pourraient rendre plus utiles encore. Ana Cumano, responsable de l'unité de Lymphopoièse à l'Institut Pasteur, a découvert leur lieu originel en 2001 chez la souris : l'artère aorte, où apparaissent au cours du développement des cellules souches sanguines immatures semblant dériver des cellules de la paroi du vaisseau. Pour Philippe Herbomel et Karima Kissa (unité Macrophages et développement de l'immunité) qui ont pu visualiser ce phénomène en 2010 dans l'embryon transparent du poisson zèbre, « il serait peut-être possible de générer des cellules souches sanguines au laboratoire à partir d'une biopsie prélevée sur les propres vaisseaux sanguins des malades ».
Cellules souches de poisson zèbre
Document © Institut Pasteur
À ce stade, les chercheurs doivent encore apprendre comment induire à partir de cellules vasculaires de l'adulte la transformation en cellules souches sanguines qui a lieu naturellement chez l'embryon. Puis à orienter leur évolution vers telle ou telle catégorie de cellule spécialisée du sang : globule rouge, globule blanc, plaquette.
Ana Cumano et son équipe s'intéressent à la production de certains globules blancs, les lymphocytes. «Déficients chez les personnes âgées - ce qui les rend plus fragiles face aux infections et mauvais répondants vis-à-vis de la vaccination -, ils ne se multiplient pas assez vite après une greffe de moelle chez les leucémiques, d'où une longue période de "lymphopénie", de six mois à un an, qui les rend extrêmement sensibles aux infections. Connaître ce qui détermine la production des lymphocytes permettrait de trouver des traitements palliant ces problèmes de déficit », explique la chercheuse. D'autres équipes tentent quant à elles de produire des globules rouges en grande quantité pour la transfusion sanguine... Les cellules souches sanguines ont incontestablement un immense potentiel médical.
Voir également sur ce même blog le myélome multiple et son traitement par autogreffe de cellules souches de la moelle osseuse.
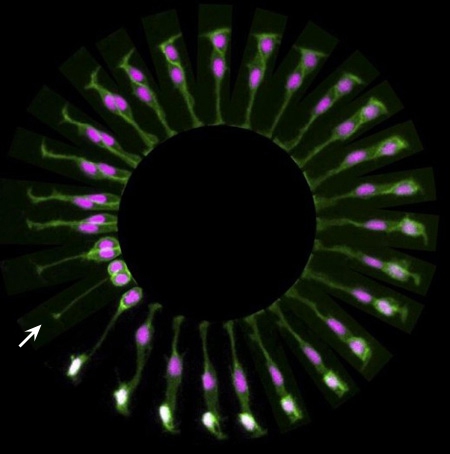
Division d'une cellule souche dans
le cerveau d'un poisson zèbre
©Sílvia A Ferreira, Cristina Lopo and Eileen Gentleman
King’s College London
Image primée aux plus belles photos du Wellcome Image Awards 2016
Le point de départ est situé à 8h (flèche blanche). Petit à petit la cellule se divise pour créer deux cellules différentes : une cellule nerveuse qui va passer du violet au blanc, et une autre cellule souche qui a la possibilité de se diviser elle-même pour produire de nouvelles cellules spécialisées. La séquence, observée en une seule image ici, dure en réalité 9 heures.
Utilisation de cellules souches sanguines en cardiologie
- Greffes de cellules souches hématopoiétiques dans les maladies coronariennes
-
Pourquoi avoir recours aux cellules souches ?
Lors d’un infarctus, des millions de cellules cardiaques meurent, privées d’oxygène parce qu’une artère s’est brusquement bouchée. En France, plus de 1,2 million de personnes souffrent d'insuffisance cardiaque, dont 250 000 à un stade avancé. Selon l’atteinte, le cœur peut finir par s’épuiser : le muscle cardiaque ne peut alors plus assurer correctement son rôle de pompe, c’est l’insuffisance cardiaque. Si elle est sévère, le seul remède est la greffe de cœur. Cette intervention lourde, et relativement rare compte tenu du manque de greffon, implique des traitements antirejet à vie. C’est pourquoi les chercheurs évaluent d’autres stratégies de prise en charge. Ils essaient notamment de remplacer les cellules cardiaques mortes par des cellules souches : des cellules indifférenciées capables de s’autorenouveler et de donner naissance à des cellules spécialisées, ici des cellules cardiaques.
L'intérêt de la greffe de cellules souches hématopoiétiques dans les maladies coronariennes se confirme grâce à une méta-analyse de 50 études regroupant au total plus de 2600 patients. C'est pour une insuffisance coronarienne chronique ou un infarctus du myocarde que ces malades ont reçu des injections intracardiaques ou intracoronariennes de cellules mononuclées de la moelle osseuse ou d'autres types de cellules. (CD 34 ou CD 133). Comparativement aux sujets non greffés, les patients traités ont une fonction ventriculaire gauche améliorée de façon prolongée (24 mois). Le risque de récidive d'infarctus du myocarde est significativement diminué ainsi que la mortalité , que celle-ci soit de cause cardiaque ou pas.
- Réparer le cœur en fabriquant un pansement cellulaire à partir de cellules souches (Science & Vie n° 1153 octobre 2013, p. 37-38)
En 2013, des chercheurs de l'université américaine de Pittsburgh ont réussi à faire pousser des cellules cardiaques humaines sur la charpente d'un cœur de souris.
Le cœur du rongeur est traité au détergent pour le débarrasser de ses cellules. N'en subsiste qu'un moule translucide composé de protéines de structure comme le collagène. Cette armature est ensuite ensemencée avec des cellules humaines préparées à partir de cellules souches, capables de donner naissance aux principaux types de cellules cardiaques. En quelques semaines, ces cellules souches recouvrent la charpente, reconstruisant le cœur dans ses moindres détails. Et ce n'est pas tout, ce cœur chimérique peut même se contracter... Sous perfusion de liquide nutritif, il bat in vitro, au rythme de 40 à 50 pulsations par minute !
Ces battements, désynchronisés, sont encore trop faibles pour pomper le sang dans les vaisseaux. Mais il s'agit d'un premier pas avant de tester cette technique pour fabriquer des pansements ou patchs cardiaques, à partir de matrices de collagène humaines repeuplées par les propres cellules des malades.
Se développe ainsi l'espoir qu'un jour, un cœur malade soit réparé par de simples rustines de muscle cardiaque cultivées in vitro, capables d'assurer localement les contractions normales de l'organe défectueux.
Recouvert de cellules humaines, un cœur de souris réduit à
une charpente de collagène s'est remis à battre.
- Cellules souches en thérapie régénératrice du muscle cardiaque
(par Guillaume Bayre - le 29/01/2014 Le Figaro.fr SANTÉ)
La mise sur le marché d'un traitement à l'horizon 2016 pour réparer un cœur fragilisé semble se préciser.
Des cellules souches intelligentes pour réparer un cœur fragilisé par une attaque cardiaque. Cette piste, poursuivie depuis plus d'une décennie, s'éclaircit de jour en jour avec en ligne de mire la mise sur le marché d'un traitement à l'horizon 2016.
L'autorité américaine de santé, la FDA, vient de donner son feu vert à Cardio3 BioSciences, une société biopharmaceutique belge, pour tester sur 240 patients son traitement baptisé C-Cure. Il s'agit d'un remède à l'insuffisance cardiaque d'origine ischémique, autrement dit un affaiblissement du cœur consécutif à un infarctus.
Cet essai dit de phase III représente les travaux les plus avancés dans le domaine des thérapies cellulaires pour les maladies cardiaques, qui permettraient d'éviter le recours à une transplantation. En France, le Pr Ménasché de l'Hôpital européen Georges-Pompidou ou encore la société CellProthera mènent des recherches comparables, mais à un stade un peu plus précoce.
Cardio3 a déjà débuté des tests dans plusieurs pays européens. Au total, les données concernant 500 patients seront ainsi recueillies dans l'espoir de confirmer les résultats obtenus lors d'un test à plus petite échelle, présentés l'an dernier dans la revue scientifique de l'American College of Cardiology. En phase II, une seule administration de C-Cure a conduit à une amélioration de la fonction cardiaque mesurée par la fraction d'éjection ventriculaire, qui traduit la capacité du muscle cardiaque à se contracter. La condition physique des patients s'est aussi améliorée: ils ont parcouru une distance supérieure de 20 % (+ 77 mètres) au test de marche des six minutes par rapport au groupe témoin.
C-Cure s'appuie sur une technologie, dite cardiopoïétique, issue de recherches menées à la Mayo Clinic (Minnesota) par les professeurs André Terzic et Atta Behfar. Premier avantage, il s'agit d'une thérapie dite autologue, qui élimine les risques de rejet immunitaire. Des cellules souches adultes sont prélevées dans la propre moelle osseuse du patient au niveau de la hanche, puis programmées in vitro pour devenir des cellules de lignée cardiaque. Schématiquement, les chercheurs reproduisent les signaux protéiniques qui, dans l'embryon, permettent aux cellules de se différencier en cellules d'un organe particulier. Les cellules cardioréparatrices (600 millions par administration) sont ensuite injectées dans le myocarde au moyen d'un cathéter spécialement développé. Cette opération ne nécessite aucune chirurgie cardiaque. Manipulable par un seul intervenant, le cathéter guidé par échographie est inséré via l'artère fémorale, depuis l'aine, sous légère anesthésie.
Les cellules injectées ne forment pas un matériau pour colmater les lésions cardiaques, mais elles sont capables d'induire véritablement une régénération du tissu nécrosé. « On envoie les cellules à l'école, et à la sortie elles ont appris comment remplir la fonction réparatrice cardiaque », résume le Pr Terzic, directeur du Centre de médecine régénérative de la Mayo Clinic.
- Ajout du 23 février 2015 : Des cellules souches pour le cœur
(Sciences et Avenir, mars 2015, n° 817, p. 22)
L'opération s'est déroulée en octobre 2014 mais n'a été révélée qu'en janvier 2015 : Philippe Ménasché, de l'hôpital européen Georges-Pompidou, à Paris, a essayé pour la première fois au monde d'utiliser des cellules souches cardiaques pour réparer les régions lésées du cœur chez une patiente. L'opération s'est accompagnée d'un pontage coronarien.
(Sciences & Vie, mars 2015, n° 1170, p. 33)
Pour la première fois, des médecins ont utilisé des cellules souches d'origine embryonnaire pour réparer le cœur d'une patiente souffrant d'une grave insuffisance cardiaque. L'équipe de Philippe Menasché (hôpital européen Georges-Pompidou, Paris) a déposé, au niveau de la cicatrice laissée par un infarctus, un patch couvert de cellules. Depuis l'opération, l'état de santé de la patiente s'est nettement amélioré et la zone du muscle cardiaque traitée a recommencé à battre, comme le prouve l'échographie. Cette opération inouïe a nécessité dix ans de préparation. Le temps nécessaire à Jérôme Larghero et son équipe (hôpital Saint-Louis, Paris) pour réussir à transformer les cellules souches embryonnaires en une lignée de toutes jeunes cellules cardiaques (des cardiomyocytes progéniteurs). La mise au point du patch de fibrine (sorte de colle biologique) a également nécessité de longs essais pour s'assurer de la bonne cohésion des cellules une fois posées et de leur survie. "Pour l'instant, rien ne permet de conclure que ce sont bien les cellules qui réparent le cœur, précise le Pr. Menasché. Il se peut que ce soient les substances qu'elles sécrètent". Ce qui ouvre une piste thérapeutique plus simple : administrer directement dans le cœur ce cocktail de substances.
Des greffes cellulaires pour traiter les infarctus — Le Figaro.fr SANTÉ (12 avril 2017)
Une équipe canadienne espère, grâce à des cellules-souches, pouvoir «effacer» la cicatrice laissée par un accident cardiaque.
Sous l’œil du microscope, les cellules battent la mesure dans leur boîte de Petri. Ce sont des cardiomyocytes, les cellules qui forment le muscle cardiaque. Nous sommes dans le laboratoire du Pr Gordon Keller, au McEwen Center for Regenerative Medicine, à Toronto (Canada). Ces cellules sont obtenues à partir de cellules-souches embryonnaires humaines capables de se transformer en n’importe quel type de cellules, sur commande. Il faut tout de même trouver à chaque fois la bonne "recette" pour obtenir le type désiré: mettre les bons facteurs de croissance, au bon moment, dans les bonnes conditions.
Les équipes de Gordon Keller sont particulièrement douées dans la "programmation" de cellules cardiaques. Les chercheurs parviennent à créer des lignées très "pures", c’est-à-dire présentant un type cellulaire très particulier en grande majorité. Mais à quoi servent ces cellules ? L’idée poursuivie par le Pr Michael Laflamme, venu rejoindre le laboratoire en juillet 2015, est de les injecter chez des patients victimes de crises cardiaques pour repeupler les tissus morts et limiter le risque d’insuffisance cardiaque. Pr Michael Laflamme : "Nous avons montré chez le rat, le cochon d’Inde, puis le singe que les cellules transplantées dans des cicatrices d’infarctus battaient correctement et vieillissaient bien".
Une crise cardiaque survient lorsqu’une artère alimentant le cœur se bouche. Privées d’oxygène, les cellules touchées meurent. Comme le cœur ne se régénère pas, cette cicatrice reste à vie et la zone morte ne battant plus, elle induit des contraintes plus importantes sur la déformation des parois voisines (qui doivent "se tordre" plus), provoquant leur dégradation accélérée. La cicatrice a tendance à s’agrandir. À terme, les patients victimes d'infarctus importants finissent par avoir besoin d’une transplantation.
Des travaux prometteurs
Injecter des cellules cardiaques suffirait-il à repeupler la cicatrice et prévenir le risque d’insuffisance? Les travaux chez l’animal se montrent prometteurs. « Nous avons montré chez le rat, le cochon d’Inde, puis le singe que les cellules transplantées dans des cicatrices d’infarctus battaient correctement et vieillissaient bien, détaille Michael Laflamme. Nous n’avons pas non plus observé de tumeur après un an chez le rat ou trois mois chez le singe. Mais le cœur de ces animaux bat plus vite. Nous nous tournons maintenant vers le porc, dont le cœur est plus similaire au nôtre, pour confirmer ces résultats préliminaires. »
Les premières injections chez le porc ont fait apparaître un problème: les cellules transplantées ne battent pas exactement au même rythme que les autres. « Cette arythmie est très gênante, reconnaît Michael Laflamme. Nous pensons que c’est parce que les lignées que nous avons injectées n’étaient pas assez pures et contenaient des cellules “pacemaker” qui commandent la contraction du muscle cardiaque. Je pense que c’est un problème que nous pourrons régler facilement. Mais il reste à démontrer que la “greffe” de quelques milliards de cellules (soit une seringue de 6 ml, NDLR) est suffisante pour observer des effets fonctionnels. » Il faudra encore au moins une douzaine d’essais chez le porc avant de pouvoir envisager un essai clinique chez l’homme. « Pas avant 4 à 5 ans », pronostique le chercheur. Bayer et VersantVentures ont investi 225 millions de dollars dans une nouvelle entreprise, BlueRock Therapeutics, qui vise à tester ce genre de nouvelles approches en médecine régénérative, en partenariat avec six instituts, dont le Centre Mc Ewen.
« Ce sont des travaux très intéressants, mais sur le plan clinique, je ne sais pas quel sera leur avenir », prévient le Pr Philippe Ménasché, chirurgien cardiaque à l’hôpital européen Georges Pompidou, qui a lui-même déjà greffé sur six patients des « patchs » de cellules cardiaques dérivés de cellules-souches embryonnaires. « Il faut fournir un traitement immunosuppresseur à vie aux patients pour éviter le rejet, c’est très lourd pour des personnes souvent âgées et qui présentent d’autres pathologies. » De son côté, les bénéfices des cellules greffées semblent plutôt provenir des substances qu’elles sécrètent et libèrent dans le cœur. « Nous allons donc nous contenter de libérer ces molécules lors d’un prochain essai. » Il s’agira donc plutôt d’un médicament biologique que d’une greffe cellulaire.
À Toronto, les chercheurs ont deux pistes pour lutter contre le risque de rejet. La première consiste à prélever des cellules chez le patient, de peau par exemple, à les faire « redevenir » cellules souches (on parle de cellules souches induites) avant de les cultiver pour en faire des cellules cardiaques. Le procédé est néanmoins très coûteux et complexe à encadrer sur le plan juridique. La deuxième solution consisterait à manipuler génétiquement les cellules souches embryonnaires pour les rendre « invisibles » au système immunitaire. Ce qui s’annonce aussi compliqué.
- Ajout du 8 juin 2017 :
Cellules souches : une nouvelle jeunesse pour le cœur : article de la Fondation pour la Recherche Médicale
-
Article réalisé avec le Pr Philippe Menasché, service de chirurgie cardiovasculaire de l’Hôpital européen Georges-Pompidou (AP-HP, Paris) et souvent cité dans cette note sur les cellules souches.
Une première mondiale française !
Les cellules souches embryonnaires ont la particularité d’être faciles à manipuler, qu’il s’agisse de leur culture au laboratoire ou leur transformation en cellules cardiaques. Ces cellules, issues d’un embryon, sont capables de s’autorenouveler et de donner naissance à tous les types de cellules spécialisées (peau, muscle, cœur, etc.).
Avec ces cellules souches embryonnaires, le Pr Menasché en 2014 a réalisé une première mondiale au sein du service de chirurgie cardiovasculaire de l’Hôpital européen Georges-Pompidou (Paris). Elles ont d’abord été transformées en « jeunes » cellules cardiaques (iPCS), purifiées et incorporées dans un patch selon une procédure mise au point par l’équipe Inserm du Pr Larghero de l’hôpital Saint-Louis (Paris). En octobre 2014, un tel patch a été greffé à une patiente de 68 ans atteinte d’insuffisance cardiaque sévère, à l’endroit précis où l’infarctus avait eu lieu. Un an plus tard, l’état de la patiente s’est considérablement amélioré. Quatre autres personnes devraient recevoir le même traitement, en 2016, dans le cadre d’un essai clinique. Toutefois, il existe un risque de rejet de la greffe de cellules souches embryonnaires car elles sont étrangères à l’organisme. Pour l’éviter, le patient doit prendre des traitements immunosuppresseurs (qui visent à réduire ou à supprimer la réaction immunitaire) très lourds.
D’autres travaux pour éviter le risque de rejet
Des équipes testent des greffes de cellules souches, prélevées chez le patient lui-même (greffes dites « autologues »), de sorte qu’il n’y ait aucun risque de rejet et pas de traitements immunosuppresseurs.
Greffe de cellules souches mésenchymateuses
Pour régénérer le muscle cardiaque de patients atteints d’insuffisance cardiaque sévère, le Dr Roncalli et son équipe du CHU de Toulouse réalisent des injections locales de cellules souches mésenchymateuses, prélevées dans la propre moelle osseuse des patients. Ces cellules sont capables de se différencier en cellules osseuses, cartilagineuses ou adipeuses, et probablement de participer à la formation de nouveaux vaisseaux sanguins. Chez les 10 personnes déjà traitées, les symptômes se sont améliorés : on a constaté une meilleure expulsion du sang par le cœur. Une seconde phase d’essai clinique devrait bientôt être lancée par le Dr Roncalli, incluant 90 patients dans plusieurs hôpitaux en France.
Greffe de cellules souches hématopoïétiques
En 2016, un protocole utilisant des cellules souches hématopoïétiques sera évalué chez une quarantaine de patients par l’entreprise française CellProthera. Les cellules souches hématopoïétiques sont présentes dans la moelle osseuse mais aussi dans le sang, et sont à l’origine de toutes les cellules sanguines (globules rouges, globules blancs, plaquettes). La start-up a mis au point une sorte d’automate-incubateur qui multiplie et purifie ces cellules souches, prélevées par une simple prise de sang chez le patient lui-même. Quelques semaines plus tard, elles sont réinjectées directement dans le cœur, via un cathéter passant par une artère. Ces cellules ont déjà fait l’objet d’une étude clinique préliminaire menée entre 2002 et 2005 sur sept patients, qui ont tous retrouvé « une fonction cardiaque quasi normale compatible avec une vie active » selon la start-up.
Des questions en suspens…
Durant certains essais cliniques, comme celui de l’équipe du Pr Menasché ou celui de CellProthera, un pontage est réalisé en même temps que la greffe de cellules souches. Le pontage permet de rétablir une bonne circulation sanguine grâce à une dérivation, et la greffe de cellules souches est réalisée dans l’espoir de réparer le muscle cardiaque. À l’heure actuelle, il est difficile d’évaluer la part respective de ces deux interventions dans la réparation du muscle cardiaque. Les cellules souches sont-elles directement impliquées dans la réparation du muscle cardiaque ? Pas si sûr. « Il semble que les bénéfices des cellules sont principalement liés aux substances qu’elles sécrètent. L’administration directe de ces substances, sans passer par une greffe de cellules, est donc une piste à explorer », selon le Pr Menasché.
Aussi enthousiasmantes soient ces pistes de recherche sur la réparation du myocarde, les scientifiques sont loin d’avoir fini de les défricher.
Sepsis : réparer les séquelles musculaires (ajout du 7 mars 2016)
Une greffe de cellules souches pourrait permettre de restaurer des capacités musculaires altérées à la suite d'une septicémie.
Tissu musculaire après sepsis.
Les espaces clairs entre les fibres musculaires, en rose, correspondent aux défauts de régénération du muscle.
La septicémie ou sepsis est une réponse inflammatoire généralisée de l'organisme en réaction à une infection sévère, qui touche 28 millions de personnes par an dans le monde (dont 8 millions décèdent), et laisse de graves séquelles, notamment neurologiques et musculaires. Des chercheurs de l'Institut Pasteur[1] viennent de montrer comment les cellules souches des muscles squelettiques — dites cellules satellites — sont altérées durablement après un sepsis, ce qui empêche la restauration des fonctions musculaires et conduit à un déficit musculaire persistant. Ils ont réussi à contrer ce phénomène dans des modèles expérimentaux en effectuant une greffe en intramusculaire de cellules souches dites "mésenchymateuses": ces cellules viennent assister les cellules satellites en souffrance (sans s'y substituer), qui récupèrent leur capacité à se diviser. Les chercheurs espèrent maintenant pouvoir poursuivre leurs investigations sur cette nouvelle thérapie cellulaire chez l'Homme.
[1] Unité d'Histopathologie humaine de l'Institut Pasteur, dirigée par le Pr Fabrice Chrétien, en collaboration avec le groupe de Miria Ricchetti dans l'unité Cellules souches et développement à l'Institut Pasteur, avec l'Université Paris-Descartes et le Centre hospitalier Sainte-Anne (Paris).
La thyroïde recréée à partir de cellules souches embryonnaires
(Pierre Kaldy , Sciences et Avenir n° 790, décembre 2012, p. 36.)
Une thyroïde fonctionnelle a été produite à partir de cellules souches embryonnaires par une équipe de l'Université libre de Bruxelles. Depuis la découverte de ces cellules en 1981, les chercheurs ont réussi à les faire se différencier en un grand nombre de types cellulaires différents, mais ils n'avaient pas encoure trouvé le moyen de reconstituer un organe entier et fonctionnel. La thyroïde était un candidat de choix. Cette glande, qui produit des hormones indispensables au développement et au métabolisme de l'organisme, a en effet une structure relativement simple, en forme de grappe.
L'équipe dirigée par Sabine Coslagliola ne s'est pas contentée d'induire la différenciation de cellules souches embryonnaires en cellules thyroïdiennes : elle a aussi découvert que l'addition d'une hormone, la TSH, provoquait leur regroupement en structures arrondies comparables à celles de la thyroïde. Lorsque des souris à la thyroïde déficiente ont été greffées, les taux d'hormones thyroïdiennes dans le sang sont revenus à la normale. Preuve que le greffon s'était bien substitué à l'organe défaillant pour produire une hormone fonctionnelle. Ce résultat publié dans la revue Nature ranime un espoir de traitement de l'hypothyroïdie congénitale, maladie dépistée chez près d'un nouveau-sur 3500 et dont le seul traitement est la prise à vie de l'hormone thyroïdienne.
Diabète et cellules souches (décembre 2013)
Plusieurs laboratoires se sont lancés dans la production de cellules insulinosécrétrices humaines à partir de cellules souches embryonnaires. Cela revient à recréer des îlots de Langerhans pour pallier une fonction pancréatique déficiente dans le cas du diabète de type 1. "Cela simplifierait considérablement la greffe mais le traitement antirejet resterait de mise", souligne François Pattou, chirurgien au CHRU de Lille.
Îlot de Langerhans avec des cellules β sécrétrices d'insuline
Reconstruire la peau brûlée
Une autre utilisation médicale des cellules souches s'est développée depuis les années 80 : la reconstitution d'épiderme à partir de cellules souches de la peau pour les grands brûlés, bien maîtrisée dans certains laboratoires spécialisés.
Culture de cellules souches destinées
à la régénération d'un épiderme humain
« À 80 ans, une cellule souche ne va pas avoir les mêmes propriétés qu'à 20 ans, mais elle peut avoir gardé suffisamment de capacités régénératrices. Les avancées les plus importantes en médecine régénératrice, historiquement parlant, ont concerné les cellules souches du sang, puis d'autres cellules souches ont été identifiées et utilisées comme celles de la peau. Mais une grande partie des tissus et organes n'a pas été analysée de manière assez approfondie. Dans chaque organe ou tissu, la population des cellules souches est hétérogène. Il nous faut creuser davantage, trouver d'autres marqueurs pour isoler et caractériser les cellules souches les plus intéressantes, puis les amplifier en culture sans qu'elles ne perdent leurs caractéristiques, car pour la thérapie chez l'homme, des millions, voire des milliards, de cellules sont souvent nécessaires ».
Réparer le cerveau
L'espoir de compenser les pertes de neurones liées à des maladies neurodégénératives (Alzheimer, Parkinson...) ou à des accidents vasculaires cérébraux (AVC) motive de nombreuses recherches, d'autant que deux régions du cerveau contenant des cellules souches neuronales ont été identifiées : dans l'hippocampe, en ISSB, par une équipe américaine, puis dans la "zone sous-ventriculaire", en 2003, par celle de Pierre-Marie Lledo (unité Perception et mémoire à l'Institut Pasteur). « Contrairement au dogme central de la neurobiologie, il y a donc production de nouveaux neurones dans le cerveau, et ceci quel que soit l'âge du sujet», souligne ce chercheur. « Par ailleurs, lors d'un AVC ou d'un traumatisme, de nouvelles cellules nerveuses ont été observées dans le cortex - siège de nos capacités cognitives, de notre conscience, de notre mémoire -, sans que leur origine soit établie ; le cerveau a donc des capacités d'autoréparation. » Si quelques essais de greffes de cellules souches ont été réalisés, notamment pour la maladie de Parkinson, « les résultats ont été peu probants jusqu'ici et beaucoup de scientifiques s'orientent vers d'autres pistes », ajoute Pierre-Marie Lledo. Son équipe espère pour sa part pouvoir utiliser les propres cellules souches neuronales du malade, en les déroutant et en les attirant vers les zones lésées du cerveau grâce à une "molécule-aimant". La méthode fonctionne bien dans des modèles expérimentaux, mais les neurones nouvellement implantés ne survivent que quelques semaines. Un protocole consistant à rendre les néo-neurones sensibles à la lumière - les flashs lumineux semblant alors augmenter leur durée de vie - est à l'étude.
Les cellules souches aident le cerveau à récupérer d'un AVC
(Sciences et Avenir n° 833, juillet 2016, p. 28).
Avec cette technique, sept patients sur 18 ont connu une amélioration significative de la fonction motrice.
Améliorer la rééducation de personnes victimes d'un accident vasculaire cérébral (AVC) en greffant des cellules souches dans le cerveau : c'est ce qu'a réussi une équipe de l'université Stanford (États-Unis). Dix-huit malades atteints de troubles de la motricité, sans réel espoir d'amélioration, se sont vu proposer une opération audacieuse : ouvrir le crâne pour injecter à même le cerveau, sur les zones lésées, un cocktail de leurs cellules souches. Sept d'entre eux ont connu une amélioration significative de la fonction motrice. Un patient de 71 ans a même pu se lever de son fauteuil.
« Ces résultats sont très encourageants et livrés par une équipe connue pour son sérieux. Le nombre réduit de sujets invite à la prudence, mais la stratégie est bonne », confirme Olivier Detante, neurologue au CHU de Grenoble. Il dirigera à partir de 2017 un essai européen sur 400 malades, pour mieux évaluer l'efficacité des cellules souches dans la régénération des tissus cérébraux.
Soigner les séquelles d'AVC avec des cellules souches mésenchymateuses
Source : Science & Vie n° 1187, août 2016, p. 28.
Injecter des cellules souches dans le cerveau après un accident vasculaire cérébral (AVC), pour aider le patient à récupérer ? L'idée n'est pas neuve. Depuis les années 2000, différents types de cellules ont été testés, mais sans résultat chez l'Homme. Placées dans un environnement cérébral auquel elles ne sont pas adaptées, ces cellules manquaient en effet de résistance. Une équipe américaine de l'université Stanford a peut-être trouvé la parade en utilisant des cellules souches mésenchymateuses (faciles à obtenir dans la moelle osseuse ou le tissu adipeux), qu'elle a modifiées génétiquement.
Testé sur dix-huit volontaires souffrant de troubles moteurs après un AVC, le traitement n'a provoqué aucun effet indésirable grave. Surtout, un an après l'opération, certains patients ont vu leur état s'améliorer : l'un a retrouvé l'usage d'une jambe, un autre une élocution claire. Des bénéfices qui seraient liés à la libération de substances réparatrices par les cellules souches plus qu'à un remplacement des cellules endommagées. Ces améliorations se confirmeront-elles sur d'autres patients et persisteront-elles ? Un nouvel essai sur 156 personnes démarre aux États-Unis, pour tester différentes doses de cellules souches.
Cultiver le cerveau humain ?
Un véritable exploit réalisé par une équipe autrichienne et qui a fait la une des revues scientifiques en 2013 : à partir de quelques cellules de peau prélevées sur un donneur et génétiquement "reprogrammées" au stade de cellules souches, les chercheurs ont obtenu, deux mois et demi plus tard, la réplique quasi parfaite du cerveau du donneur... tel qu'il devait être aux prémices de son développement embryonnaire, après neuf semaines de gestation. La "fabrication" in vitro de l'organe le plus complexe du corps humain, même à un stade primaire, repousse les frontières du possible. En même temps qu'elle interroge les limites de la culture d'organes (voir l'article de Aude Rambaud paru dans Science & Vie de novembre 2013 et rapporté sur ce blog).
Cellules souches et vieillissement
Avec le vieillissement de la population, on voit se développer certaines atteintes des tissus, comme la sarcopénie, une dégradation des muscles squelettiques qui a pour conséquence une perte de mobilité. Comment l'empêcher ? On peut imaginer stimuler les cellules souches des muscles du malade pour pouvoir régénérer ou réparer le tissu en dégradation. D'après Shahragim Tajbakhsh, responsable de l'Unité Cellules souches et Développement et co-coordinateur du consortium REVIVE : « À 80 ans, une cellule souche ne va pas avoir les mêmes propriétés qu'à 20 ans, mais elle peut avoir gardé suffisamment de capacités régénératrices ». L'idée est de stimuler ces cellules souches endogènes dans un contexte de maladie grave, chronique, ou lors du vieillissement, ou de reconstruire une partie du tissu en culture et d'effectuer ensuite une transplantation chez le patient. De nombreux programmes ont été lancés dans ce sens. « On sait relativement bien obtenir des cellules neuronales ou cardiaques, par exemple, à partir de cellules pluripotentes. Les défis concernent l'utilisation thérapeutique de ces cellules et l'obtention d'autres types cellulaires. »
Toujours à l'Institut Pasteur, le groupe de Delphine Bohl (Unité des Rétrovirus & Transfert Génétique, dirigée par Jean-Michel Heard) a ainsi obtenu des neurones modèles d'une pathologie neurodégénérative de l'enfant, la maladie de Sanfilippo, par mise en culture de cellules de peau de jeunes patients, modification de l'expression de trois de leurs gènes pour induire le retour à l'état de cellules souches - d'IPS -, puis ajout de molécules "d'Induction" à la culture pour provoquer la différenciation des IPS en neurones. « Ces "neurones de Sanfilippo" vont nous servir à mieux comprendre cette maladie et pourront aider au screening de molécules thérapeutiques », précise Delphine Bohl. Son groupe a également obtenu des cellules modèles de sclérose latérale amyotrophique (SLA ou maladie de Charcot), une maladie aujourd'hui incurable, aussi fréquente que la sclérose en plaques. « À partir de cellules de peau de malades, nous avons des cultures de motoneurones, cellules touchées par la SLA, qui vont permettre de classer les différentes formes de maladies, génétiques ou sporadiques, pour bien orienter le criblage de médicaments», explique la chercheuse.
Des essais en cours pour des dizaines de maladies
Aujourd'hui, les essais d'utilisation de cellules souches adultes chez l'homme, pour régénérer la cornée, l'os, le pancréas (diabète de type 1), le foie, les muscles (certaines myopathies), le cœur... concernent des dizaines de pathologies. Les succès les plus évidents ont été obtenus par une équipe italienne chez des patients atteints de brûlure de la cornée, cause de cécité. L'utilisation de leurs propres cellules souches "limbales", situées à la base de l'œil, a permis une régénération efficace de la cornée chez les trois-quarts d'entre eux, avec un recul de 10 ans.
Près de la moitié des essais cliniques avec les cellules souches vise à régénérer le muscle cardiaque partiellement détruit après un infarctus (qui touche chaque année 120 000 personnes en France). L'infarctus provoque une insuffisance cardiaque parfois telle que la survie du patient nécessite la transplantation d'un cœur sain, rarement possible pour cause de pénurie de greffons. La majorité des essais consiste à injecter dans le myocarde des cellules souches de la moelle osseuse dites "mésenchymateuses", souvent prélevées chez le malade lui-même : sans remplacer les cellules cardiaques détruites, elles semblent stimuler la réparation du cœur.
Des cellules souches contre la sclérose en plaques
Le premier essai thérapeutique à base de cellules souches prélevées sur les patients pourrait ouvrir une voie prometteuse pour soigner cette maladie neurologique très invalidante.
Le 29 mai 2013, à Gênes, lors de la 5e édition de la journée mondiale sera consacrée à la sclérose en plaques (SEP), cette maladie neurologique encore bien énigmatique. C'est en effet d'Italie que va être piloté le premier essai thérapeutique à base de cellules souches adultes. Baptisé Mesems (Mesenchymatal Stem Cells for Multiple Sclerosis), l'essai européen démarre ce printemps dans le service d'Antonio Uccelli, au département de Neurosciences de l'université de Gênes, avant de s'étendre à la France, à l'Allemagne, au Danemark, au Royaume-Uni et à l'Espagne. L'étude concernera 160 patients au total, dont 12 Français répartis dans plusieurs centres (Lille, Marseille. Toulouse, Bordeaux). Un espoir de traitement immense face à une maladie représentant la première cause de handicap non traumatique en France, avec plus de 80 000 personnes touchées, dont deux tiers de femmes, sans que cette particularité soit expliquée.
La SEP affecte les neurones, les cellules du système nerveux central, en détruisant la myéline, membrane biologique qui isole et protège les fibres nerveuses. Constituée de graisses et de protéines, cette gaine protectrice est, pour des raisons inconnues, le lieu d'une réaction inflammatoire due à une attaque par les propres cellules immunitaires du malade, les lymphocytes B et T. Cette destruction entraîne une moins bonne conduction de l'influx nerveux.
Le principal mystère que les chercheurs aimeraient lever dans cette affection auto-immune est de comprendre pourquoi le système immunitaire des malades s'emballe pour attaquer ses propres cellules nerveuses. En l'occurrence, ce sont les lymphocytes T et B — les cellules censées défendre l'organisme contre les agressions — qui détruisent peu à peu la myéline, une gaine graisseuse qui entoure les fibres nerveuses et assure la bonne propagation de l'influx nerveux. Résultat : une moins bonne transmission des messages en provenance ou à destination du cerveau, d'où une paralysie.
Ce qu'il faudrait, c'est réinitialiser le système immunitaire par une greffe de cellules souches, pour lutter contre la sclérose en plaques : des chercheurs américains de l'école de médecine de Chicago ont appliqué ce protocole début 2015, avec des résultats encourageants. Les signes cliniques de la maladie ont diminué ; un avant-goût de ce qui se profile en matière de médecine régénératrice. Demain, il sera en effet possible de réaliser des greffes sur mesure. Totalement compatibles avec l'organisme receveur, les pansements tissulaires seront constitués de cellules souches mises en différenciation en fonction de l'organe malade — un patch de cellules cardiaques, artérielles, hépatiques... — et ce, sans risque de rejet. La méthode n'a qu'un inconvénient : son prix. Car un trouble cardiaque comme l'ischémie détruit plusieurs dizaines de milliards de cellules. Combien coûterait la fabrication d'un « patch cellulaire » personnalisé d'une telle taille ? Personne pour le moment ne se risque à le chiffrer. Tout porte à penser que les greffes de cellules souches seront réservées aux plus fortunés.
Les hormones thyroïdiennes régulent les cellules souches neurales (mai 2012)
L'équipe de Barbara Demeneix, du laboratoire « Évolution des régulations endocriniennes » (Muséum national d'Histoire naturelle/CNRS), vient de mettre en évidence un nouveau rôle des hormones thyroïdiennes dans la régulation des cellules souches neurales chez la souris adulte.
Ces résultats montrent l'importance de la régulation endocrinienne dans l'homéostasie de la niche neurogénique. Essentielles pour le développement du cerveau, les hormones thyroïdiennes peuvent causer le crétinisme chez l'enfant si elles sont produites en quantités insuffisantes. Les chercheurs ont étudié le lien entre les hormones thyroïdiennes et la neurogenèse chez la souris adulte. Leurs résultats montrent que l'expression de Sox2, gène clé impliqué dans la physiologie des cellules souches neurales, est directement régulée par les hormones thyroïdiennes dans une des niches neurogéniques du cerveau adulte. Ces travaux parus dans la revue Cell Stem Cell., devraient à terme permettre de mieux comprendre certains troubles neurologiques associés à l'hypothyroïdie chez l'adulte ou la personne âgée.
Cellules souches post-mortem : un état dormant pour mieux revivre... plus tard (juin 2012)
Des chercheurs de l'Institut Pasteur, de l'université de Versailles Saint-Quentin-en- Yvelines, de l'AP-HP et du CNRS, dirigés par Fabrice Chrétien en collaboration avec Shahragim Tajbakhsh ont démontré pour la première fois, chez l'Homme et chez la Souris, la faculté qu'ont des cellules souches de demeurer dans un état de dormance quand leur environnement devient hostile, y compris plusieurs jours après la mort de l'individu. Cette capacité à considérablement réduire leur activité métabolique leur permet de préserver leur potentiel de division cellulaire pour favoriser la réparation et la croissance d'un organe ou d'un tissu quand les conditions du milieu redeviennent favorables. Cette découverte laisse envisager des perspectives thérapeutiques pour de nombreuses maladies. Cette publication est parue dans la revue Nature communications.
Des cellules souches pour réparer l'os
En 2012, l'Inserm a mis au point une technique qui est actuellement testée sur des patients souffrant de fractures non consolidées. De la moelle osseuse est prélevée, puis les cellules souches qu'elle contient sont mises en culture. Elles sont ensuite déposées sur une prothèse en céramique, greffée au niveau de la fracture. Résultats de l'essai dans un à deux ans. Une autre technique prometteuse : voir ci-dessous.
Le projet Reborne : cellules souches pour réparer les fractures osseuses (2 septembre 2014)
En injectant au niveau de la fracture un mélange de granulés de phosphate de calcium et des cellules souches adultes provenant du patient lui-même, Pierre Layrolle directeur de recherche au Laboratoire de physiopathologie de la résorption osseuse (université de Nante/Inserm), a réussi à consolider l'os réfractaire à une simple greffe de tissu osseux. C'est l'objet du projet Reborne.
Les cellules souches choisies sont des cellules souches mésenchymateuses présentes dans la moelle osseuse. Leur concentration étant trop faible à l'état naturel (environ 100 000 cellules souches dans une ponction de 10 à 30 ml de moelle osseuse), elles sont cultivées en laboratoire. Au bout de vingt et un jours, elles sont alors 400 millions, prêtes à être injectées au cœur de la fracture.
Les granulés de phosphate de calcium constitue un biomatériau qui va former une matrice, un échafaudage qui facilite la colonisation cellulaire. Il comble le vide puis, au fur et à mesure que les cellules souches s'installent, il se résorbe pour laisser place à un os tout à fait naturel.
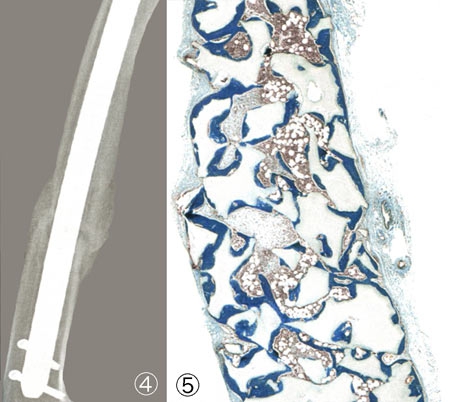
Consolidation d'une fracture par cellules souches
Fracture non consolidée (1) traitée par un mélange de cellules souches (2) et d'un biomatériau à base de granulés de phosphate de calcium (3). Six mois après, l'os est réparé (4) : il s'est régénéré (5) : os coloré en bleu-vert, moelle osseuse colorée en rose.
Dans le cadre du projet Reborne, les chercheurs testent également cette association cellules souches-biomatériau en chirurgie maxillo-faciale. "Chaque année en France, entre 200 000 et 400 000 patients reçoivent un implant dentaire. Or, dans 30 % des cas, le capital osseux n'est pas suffisant pour supporter cet implant. Cela nécessite alors une greffe osseuse qui n'est pas toujours possible, notamment chez les patients âgés ", indique Pierre Layrolle.
Un autre essai clinique teste l'injection de cellules souches, cette fois sans le biomatériau, dans le traitement de la nécrose de la tête fémorale. Un problème qui touche 50 000 Français par an. Déjà, pour soigner ces patients, la moelle osseuse est appelée en renfort. "Mais il s'agit simplement de la prélever, puis d'en injecter directement les cellules souches dans la tête de fémur du patient ", détaille le biologiste.
Évidemment, cette procédure ne permet d'obtenir qu'un nombre limité de cellules. Avec sa technique de mise en culture et de multiplication cellulaire en laboratoire, Pierre Layrolle espère donc offrir aux patients de meilleures chances de guérison.
Avant de commencer leurs essais, les chercheurs ont franchi un premier obstacle de taille. "Dès lors que la moelle osseuse sort du bloc opératoire pour rejoindre le laboratoire où elle est amplifiée, les cellules souches deviennent un médicament. Elles sont alors soumises à un ensemble de réglementations très strictes auxquelles le projet Reborne a dû se conformer ", explique Pierre Layrolle.
Cette conformité aux règles européennes est aujourd'hui l'une des forces du projet. En effet, d'autres essais associant cellules souches et biomatériaux ont déjà eu lieu dans le monde - le premier dans les années 1990 en ex-URSS. Mais chaque fois, les grands espoirs nés des expériences en laboratoire se sont fracassés sur la réalité du bloc opératoire... et des exigences de sécurité et de reproductibilité. Même si certaines équipes ont publié des résultats positifs, leurs procédures n'ont jamais pu être reproduites. Depuis, elles ont d'ailleurs jeté l'éponge.
Reste la question du coût. Guy Dacuisi, spécialiste des biomatériaux et des substituts osseux à l'université de Nantes, le reconnaît, la technique coûte cher. "Environ 20 000 euros par patient", précise-t-il. Un coût qui pourrait toutefois diminuer, selon Pierre Layrolle, si l'on utilisait non plus les cellules du patient, mais celles d'un donneur. "A l'avenir, on pourrait disposer de banques de cellules dans lesquelles on puiserait à l'envi pour soigner les patients", imagine-t-il.
Cela complique la procédure, et plus encore les dispositions réglementaires à prendre. Mais demain, appeler sa banque de cellules pour un déficit osseux sera peut-être la règle.
Quant aux cellules souches mésenchymateuses du projet Reborne, elles ont déjà servi à traiter, avec succès, une dizaine de patients victimes de graves brûlures cutanées induites par des rayonnements ionisants. Des accidents rares, mais qui conduisent souvent à l'amputation.
Source :
Hancok Coralie (2014).- Cellules souches : elles réparent même les fractures., Science & Vie n° 1164, septembre 2014, pp. 102-105.
À consulter : le site du projet Reborne (financé par la Commission européenne)
Des cellules souches créées à partir d'urine (Sciences et Avenir n° 792, février 2013, p. 38.)
Fabriquer des cellules souches à partir d'échantillons d'urine, c'est possible ! Des biologistes chinois de l'Institute of Biomedicine and Health de Canton avaient publié le concept en 2011 ; aujourd'hui, ils dévoilent le détail de leur méthode dans Nature. L'équipe a prélevé dans les urines de trois donneurs des cellules epithéliales d'urètre et de rein. Puis, après les avoir mises eu culture deux semaines durant, elle les a infectées avec des rétrovirus chargés de les reprogrammer, s'inspirant des travaux du Japonais Shinya Yamanaka, prix Nobel 2012 de physiologie.
Les cellules se sont alors « dédifférenciées » pour devenir des cellules souches pluripotentes induites (Induced Pluripotent Stem cells ou iPS, capables de donner de nouveau tous les types cellulaires. L'équipe chinoise a ensuite démontré que ces iPSc pouvaient se transformer en cellules du système nerveux, du foie ou du cœur. « L'intérêt de cette méthode est de ne pas êtreinvasive, commente Mathilde Girard, chargée de recherche à l'Institut des cellules souches (Evry). Elle est plus simple à mettre en œuvre que les méthodes actuelles (prélèvement de peau, sang ou cheveux...).»
Reste à vérifier que ces cellules, pour leur utilisation médicale, ne présentent pas d'anomalies. « Celles-ci peuventêtre chromosomiques, épigénétiques ou ou ponctuelles. Il semble que les méthodes de reprogrammation anciennes - par rétrovirus - engendrent davantage d'anomalies que les techniques plus récentes. » Les chercheurs devront apporter la preuve de l'innocuité de la reprogrammation.
Cellules neuronales en culture dérivées de cellules prélevées dans l'urine humaine
Cellules souches et greffe de trachée (ajout du 5 mai 2013)
La première personne à avoir reçu une trachée artificielle recouverte de cellules souches, dans un hôpital suédois en juin 2011, se porte bien et d'autres greffes du même type ont été réalisées avec succès.
Le receveur, un Erythréen de 36 ans, "se porte très bien depuis quatre mois et a pu reprendre une vie normale", a expliqué le professeur Tomas Gudbjartsson, un des coauteurs de l'étude dans la revue britannique. A l'issue d'une opération de douze heures et après deux mois de séjour à l'hôpital puis dans un centre de réhabilitation, cet homme marié et père de deux enfants a pu reprendre ses études en géophysique à l'université de Reykjavik en Islande.
Une autre greffe de même type vient d'être réalisée par le Pr Paolo Macchiarini et son équipe de l'hôpital universitaire Karolinska de Huddinge, près de Stockholm, sur un Américain de 30 ans qui souffrait, comme dans le premier cas, d'un cancer des voies respiratoires. La deuxième greffe utilise une structure composée de nanofibres et par conséquent "représente une avancée supplémentaire" par rapport à la première intervention, a déclaré le Pr Macchiarini, cité par The Lancet. La trachée artificielle est fabriquée sur mesure avec des fibres de plastique recouvertes de cellules souches extraites de la moelle osseuse du patient. La même technique peut être adaptée pour concevoir des bronches artificielles.
Une troisième greffe avec la même technique a permis de traiter en avril 2013 un bébé sud-coréen âgé de treize mois seulement. "Nous allons continuer à améliorer la technique en médecine régénérative pour les greffes de trachées et allons l'étendre aux poumons, au cœur et à l'œsophage", commente le Pr Macchiarini.
La petite coréenne Hannah Waren après son opération
© 2013 OSF Saint Francis Medical Center, Peoria, Illinois. Jim Carlson, Photographer.
Ce procédé repose sur une structure synthétique faite sur mesure dans laquelle sont "insérées" des cellules souches du patient. Il a l'avantage de ne pas dépendre d'un don d'organe et, grâce aux cellules souches du malade, permet d'éviter le phénomène de rejet. Cette technique est radicalement différente de celle également innovante, dévoilée fin 2010 par une équipe de chirurgiens français, qui utilise des morceaux de peau et fragments de côtes des malades pour reconstruire la trachée.
Cellules souches et cartilage
Le premier implant destiné à régénérer à la fois le cartilage et l'os, réparant ainsi l'ensemble de l'articulation, est en passé d'être testé en France par l'Inserm juillet 2016). II est composé d'une membrane dotée de nanoréservoirs remplis de facteurs de croissance et d'une couche d'hydrogène renfermant des cellules souches destinées à se différencier en cellules du cartilage.
Cellules souches et rein
Le rein artificiel n'existe pas encore, mais, en 2015, des chercheurs de l'université Jikey, à Tokyo (Japon), ont réussi à réaliser des reins à partir de cellules souches humaines capables de filtrer le sang et d'excréter de l'urine. Ils ont été testés chez la souris et le cochon. Le passage à l'homme prendra encore des années.
Métastases : des cellules souches impliquées (Sciences et Avenir n° 787, septembre 2012)
Des cellules souches cancéreuses ont récemment été identifiées dans plusieurs tumeurs solides (cancer du cerveau, du sein, du colon, de l’intestin…) et dans les leucémies. Elles sont à l’origine de la transformation de cellules saines en cellules tumorales et elles semblent aussi être à l’origine des métastases et de la récidive de certains cancers.
En effet, des travaux récents ont montré que seul un petit groupe de cellules était responsable de la croissance d'une tumeur (elles représentent moins de 0.1% de la population totale des cellules qui composent une tumeur). Ces cellules souches cancéreuses sont capables comme les cellules souches saines, de s’auto-renouveler, mais elles sont aussi capables de générer des cellules tumorales. Elles pourraient donc jouer un rôle direct dans le développement des cancers.
Certaines tumeurs, si ce n’est toutes, seraient donc composées à la fois de cellules tumorales qui se divisent de manière anarchique et de cellules souches cancéreuses. Ces dernières sont présentes en de très faibles proportions dans les tissus ce qui rend difficile leur étude et sont le plus souvent au repos. Elles échappent donc aux traitements anticancéreux qui ciblent les cellules qui se divisent rapidement, ce qui expliquerait la récidive de certains types de cancers à arrêt du traitement.
Les thérapies actuelles traitent toutes les cellules cancéreuses de la même façon. Le défi des prochaines années, sera de mettre au point des traitements capables d’éliminer les cellules souches cancéreuses sans toucher aux cellules souches normales de l’organisme.
Comprendre comment fonctionnent ces cellules souches cancéreuses est essentiel, et permettra de mettre au point des traitements plus efficaces.
Une étape très importante dans la compréhension de la formation des cancers vient d'être franchie : trois études indépendantes, publiées dans les revues Nature et Science, accusent de concert un même responsable dans la genèse de la croissance tumorale : les cellules souches cancéreuses (CSC). Celles-ci seraient non seulement à l'origine de la croissance d'une tumeur, mais permettraient aussi d'expliquer l'apparition de métastases. Autrement dit, la survie passée inaperçue de quelques cellules malignes pourrait à elle seule entraîner la résurgence d'un cancer.
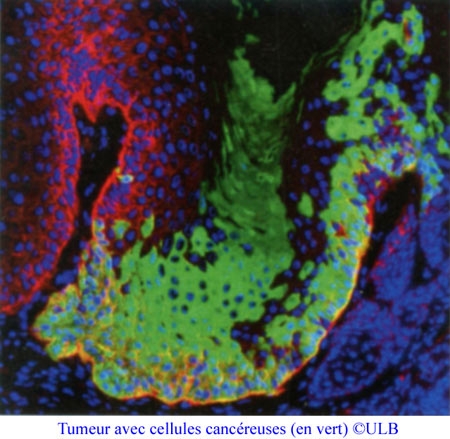
Les trois études, menées chez la souris, ont permis d'identifier des cellules souches cancéreuses dans des tissus tumoraux de l'intestin, du cerveau et de la peau. Trois preuves qui valident l'existence des CSC. Les chercheurs supposent que de telles cellules seront découvertes dans tous les types de tumeurs.
Les perspectives sont immenses : si l'on parvenait à bloquer la prolifération de ces cellules, on bloquerait de facto le développement des tumeurs. Surtout l'enjeu ultime sera de prévenir métastases et récidives en s'assurant, quelle que soit la stratégie thérapeutique retenue (chirurgie, rayonnements, chimiothérapie), que l'on débarrasse le patient de ces cellules cancéreuses particulières.
Avant cela, les chercheurs doivent mettre au point des techniques pour cibler facilement les CSC. Car en les identifiant, ils se sont aussi aperçus qu'elles présentent un défaut de taille : elles ressemblent beaucoup aux cellules souches saines qui permettent aux tissus humains de se régénérer. Un traitement insuffisamment ciblé risquerait donc d'éliminer simultanément les deux lignées.
Le premier foie cultivé fonctionne (Science & Vie, n° 1152, septembre 2013, p. 40.)
Des cellules souches obtenues à partir d'un échantillon de peau humaine cultivées en présence de cellules prélevées sur un cordon ombilical sur un milieu de culture approprié ont abouti à la formation au bout de quelques jours d'un mini-foie capable d'assurer quelques quelques-unes des fonctions majeures de cet organe complexe ! Plus qu'une simple recette, c'est un véritable exploit qu'a réalisé le département de médecine régénérative de l'Université de Yokohama (Japon).
Génération de bourgeons de foie humain à partir de
différents types de cellules souches (en vert et en rouge)
C'est la première fois qu'un tissu hépatique vascularisé, fonctionnel et organisé en trois dimensions est fabriqué en laboratoire. Cette association de plusieurs types de cellules a recréé l'environnement propice à la genèse des organes chez l'embryon. Transplantés chez la souris, ces bourgeons de foie humain d'environ 5 millimètres se connectent au système vasculaire en moins de quarante-huit heures, puis continuent de croître et de se transformer pendant au moins deux mois. Comme l'organe naturel, ils sont capables de synthétiser des protéines et de pallier une insuffisance hépatique induite. Ces résultats obtenus chez la Souris sont très prometteurs. Mais il faudra encore une dizaine d'années avant de pouvoir passer aux études sur l'Homme. Un espoir lointain, mais réel, pour les patients.
Réparer l'oreille interne (Science & Vie, n°1152, septembre 2013 p. 44)
Une fois endommagés par un traumatisme sonore ou par certains médicaments, les composants de l'oreille interne ne se régénèrent pas spontanément, provoquant ainsi des troubles irréversibles de l'équilibre ou de l'audition. Jusqu'à présent, les tentatives de recréer ces cellules avaient toutes échoué. Mais les neuroscientifiques s'en approchent grâce aux cellules souches. À l'école de médecine de l'université d'Indiana, Etats-Unis), une équipe de chercheurs a réussi à recréer en laboratoire une oreille interne de souris ouvrant ainsi la voie à de potentiels futurs traitements sur l'Homme.
Pour cela, ils ont transformé des cellules souches embryonnaires de l'animal en cellules ciliées de l'oreille interne, responsables de la détection des sons et du sens de l'équilibre. "Nous avons observé les mécanismes qui forment les cellules ciliées chez l'animal, et exposé nos cellules souches aux mêmes contraintes chimiques, explique la chercheuse Eri Hashino, qui a dirigé les recherches. Les résultats ont été bien au-delà de nos espérances, puisque les cellules ciliées créées ont d'elles-mêmes évolué pour former différents types de cellules de l'oreille interne." Enfin une piste pour une toute première thérapie.
[1] L'équipe du Pr Philippe Menasché fait partie du consortium REVIVE
Pour en savoir plus :
Un livre :
Nicole le Douarin (2007). - Les cellules souches porteuses d'immortalité, Odile Jacob Sciences Ed.
Un article récent :
Jean François Haït (2013). - Cellules souches : le corps réparé ? Sciences et Avenir hors série octobre-novembre 2013 pp 26-29.
10:00 Publié dans Biologie, Nature et santé, Sexualité-embryologie | Tags : cellules souches, cellules souches adultes induites, cellules souches embryonnaires, ectoderme, endoderme, mésoderme, œuf, cellules germinales, gonocytes, cellule totipotente, cellule souche embryonnaire, cellule souche adulte, cellule souche multipotente, pluripotent stem cells, pst, cellules souches pluripotentes induites, ipsc, hesc | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
18/09/2016
Comment le spermatozoïde déclenche la fécondation de l'ovule
Comment le spermatozoïde déclenche la fécondation de l'ovule
par Damien Mascret, Figaro.fr Santé du 29/08/2016
Drivée par Christine Gourier, une équipe de physiciens du laboratoire de Physique Statistique (LPS) de l'École normale supérieure de Paris (ENS-CNRS) a pu récemment mettre en évidence que c'est un mode particulier de battements du flagelle du spermatozoïde qui déclenche la fécondation.
C'est l'instant crucial où le spermatozoïde atteint enfin sa cible puis fusionne avec elle. Le début d'une nouvelle vie. Une délicate prise de contact entre le gamète mâle et le gamète femelle, avant que la fusion des deux ne se produise. Deux étapes que les spécialistes de la reproduction résument en une appellation, l'« interaction gamétique ». Un moment complexe, car il ne suffit pas de mettre en contact un spermatozoïde fécondant avec un ovocyte fécondable pour que la fusion se produise.
« Il se passe deux à trois minutes entre le contact et la fusion, mais ce moment a été très peu étudié jusqu'ici, principalement en raison de difficultés techniques », explique Christine Gourier. Et de façon inattendue, ce sont les mouvements de la queue du spermatozoïde, le flagelle, qui jouent un rôle déterminant.
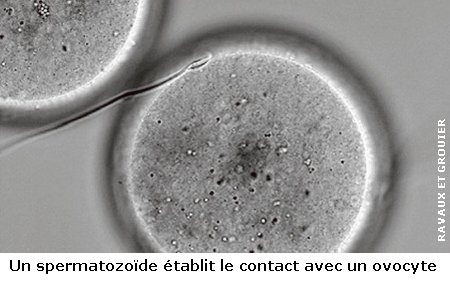
Un ingénieux dispositif pour observer in vivo l'instant crucial de la fécondation
L'équipe de l'ENS a tout d'abord imaginé un ingénieux dispositif pour que la fécondation se produise sous l'œil du microscope optique confocal. « En théorie, chez l'humain le contact peut se faire à n'importe quel endroit de l'ovocyte (et sur 80 % de la surface chez la souris, utilisée dans ce travail). Pour pouvoir observer les deux ou trois minutes qui précèdent la fusion, il fallait être sûr du site de l'ovocyte où le spermatozoïde allait établir le contact », explique Christine Gourier. Les chercheurs ont donc placé l'ovocyte dans un coquetier microscopique qui n'en exposait que 2 % de la surface, sur lesquels aboutissait un canal micro-fluidique (sorte de paille de 30 micromètres de diamètre). Dans ce canal, était introduit un spermatozoïde fécondant.
Un certain type de battement déclenche la fécondation
Benjamin Ravaux, le doctorant de l'équipe, s'est chargé des centaines de manipulations qui ont permis les découvertes. Et le spermatozoïde a fait son œuvre. « Contrairement à ce que l'on pensait du battement du flagelle, celui-ci ne sert pas seulement à conduire le spermatozoïde jusqu'à l'ovocyte, mais il sert aussi à déclencher la fécondation, détaille Christine Gourier. Et encore, seulement s'il bat selon un mode bien précis. » Les biologistes avaient déjà observé que le flagelle du spermatozoïde cessait ses battements dans les deux minutes qui suivaient le contact avec l'ovocyte, mais personne n'avait imaginé que ces deux minutes étaient cruciales. « Si on empêche ce battement, cela bloque la fécondation », explique Christine Gourier.
Pour la première fois, les chercheurs ont pu observer finement des centaines d'interactions gamétiques et identifié trois types de battements, dont un seul s'est avéré efficace pour que la fécondation s'enclenche. « C'est un battement oscillatoire assez rapide (environ 2 battements par seconde) du flagelle qui pendant deux minutes va faire osciller la tête du spermatozoïde en la plaquant sur l'ovocyte pour induire la fusion », explique Éric Perez, un des membres de l'équipe. Les mouvements amples en coup de fouet (1 par seconde) ou ceux plus réduits et très rapides (3/sec) ne permettent pas la fécondation.
Le dispositif mis au point par les chercheurs de l'ENS a ensuite permis de visualiser précisément la plongée de la tête du spermatozoïde, porteur de l'ADN issu du père, dans l'ovocyte. « Lorsqu'elle arrive à une profondeur suffisante, la masse de l'ADN paternel enfle, indiquant que celui-ci se décondense (se débobine), 50 minutes après l'entrée en contact, explique Éric Perez. Ces travaux éclairent d'un jour nouveau les trois premières minutes de la fécondation et ouvrent la porte à de nouvelles méthodes d'assistance à la procréation. »
Article original :
Benjamin Ravaux, Nabil Garroum, Eric Perez, Hervé Willaime, Christine Gourier, (2016). — A specific flagellum beating mode for inducing fusion in mammalian fertilization and kinetics of sperm internalization Scientific Reports, Nature Publishing Group, 2016, 6, pp.31886.
07:01 Publié dans Actualité des Sciences, Biologie, Sexualité-embryologie | Tags : fécondation in vitro, flagelle du spermatozoïde, déclenchement de la fécondation | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
15/02/2016
La fabrique de micro-organes humains
La fabrique de micro-organes humains
Une équipe viennoise de l’Institut de biologie moléculaire de l’Académie des sciences d’Autriche a réussi à cultiver in vitro, à partir de cellules souches humaines, un mini-cerveau de 4 mm dont l'architecture intérieure reproduit, en effet, certaines caractéristiques propres au cerveau humain.
Coupe transversale d'un mini-cerveau
obtenu par culture de cellules souches
Ainsi, ces cellules sont parvenues, au bout de 20 à 30 jours, à reproduire des tissus ressemblant à un organe humain en récapitulant les mêmes processus que lors de la formation d’un embryon : elles se sont spontanément associées avant de se différencier puis de s’agencer au sein du tissu en formation.
Des cellules souches à l'organoïde
Cliquez sur l'infographie pour l'agrandir (©Betty Lafon / Sciences et Avenir)
Objectif de ces recherches : tester des médicaments, servir de modèles de maladies, notamment des cancers, ou être utilisés comme thérapie cellulaire.
Source : Gozlan M. (2016) La fabrique de micro-organes humains Sciences et Avenir n° 828 — février 2016, pp. 70-72.
15:12 Publié dans Actualité des Sciences, Biologie, Médecine, Sexualité-embryologie | Tags : cellules souches, cellule souche adulte, ips, culture organotypique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
06/07/2012
Créer des dents biologiques grâce à des cellules souches
 Créer des dents biologiques
Créer des dents biologiques
grâce à des cellules souches
par Sylvie Riou-Milliot
Encore un autre espoir de la médecine régénérative : cette technique est capable aujourd'hui de créer des dents biologiques grâce à des cellules souches (voir l'article sur ce blog concernant les potentialités des cellules souches). Plusieurs équipes de chercheurs dans le monde y sont déjà parvenues sur la souris. Des essais vont bientôt démarrer chez l'Homme. Et à terme cette technique remplacera la pose d'implants.
Or, un implant n'est finalement qu'une vis, le plus souvent en titane, fixée dans de l'os avec lequel elle fait bon ménage en raison de facteurs de biocompatibilité. Une technique qui se révèle en fait incomplète. « Si cette nouvelle architecture artificielle rétablit la fonction masticatoire, elle ne restaure en rien la fonction biologique, poursuit le spécialiste. Car un implant ne compense pas l'absence de pulpe dentaire, cette zone qui confère à la dent sa vitalité, ni celle du ligament alvéolodentaire, un élément essentiel qui assure un rôle d'amortisseur des forces masticatoires. Régénérer des dents serait donc nettement plus physiologique ! Grâce au développement de l'ingénierietissulaire et des biotechnologies, nous savons aujourd'hui que d'ici à quelques années à peine, cela sera possible. »
Recréer une biodent
D'après le Pr Henry Magloire, président de l'Institut français pour la recherche en odontologie (Ifro), enseignant à la faculté d'odontologie de Lyon et chercheur à l'Institut de génomique de Lyon : « Recréer une "biodent" est un véritable challenge pour les chercheurs. Quelques rares équipes dans le monde y sont déjà parvenues chezl'animal. Pour l'Homme, ce sera évidemment plus difficile car la dent est un organe complexe dont on n'arrive pas encore à contrôler ni la forme ni la taille, encore moins la couleur ou la direction dans laquelle la "néodent" va se former. »
C'est à Strasbourg, dans l'unité Inserm UMR 977, que l'équipe d'Hervé Lesot a réussi à générer in vitro une dent à partir de cellules embryonnaires de souris. Au Japon, d'autres chercheurs sont allés plus loin. « L'équipe du Pr EtsukoIkeda, de l'université des sciences de Tokyo, a elle aussi créé un germe dentaire, mais elle l'a ensuite réimplanté dans une mâchoire de rongeur », détaille le Dr Simon. Trente-cinq jours après, une dent entière avait poussé ! Son analyse histologique a prouvé que tous les tissus dentaires – dentine mais aussi émail, cément et pulpe – étaient bien présents dans cette nouvelle architecture. Cette dent s'est même révélée parfaitement intégrée à son milieu, sensible au chaud, au froid, à la douleur et de plus entièrement fonctionnelle. Depuis, toujours à Tokyo, en 2011, une autre équipe a trouvé une astuce pour gagner dix jours sur le temps de formation de la nouvelle dent. Les chercheurs ont fait se multiplier les cellules embryonnaires, les ont déposées sur un support en plastique, servant en quelque sorte de moule, qu'ils ont implanté au niveau du rein d'une souris. Cette zone, très bien vascularisée, a permis une croissance accélérée. Une fois développée, la dent a été incluse dans une mâchoire de souris. Et là encore, la fonctionnalité était au rendez-vous. Une stratégie qui augure, pour l'avenir, de la création de néodents pour réparer celles manquantes...
En France, à Paris, où un travail de régénération pionnier, a été réalisé en 2011 à la faculté d'odontologie de l'université Paris-Descartes. Les équipes des Prs Anne Poliard (EA2496) et Michel Goldberg (UMR 747) ont, grâce à l'implantation de cellules souches pulpaires, réussi à produire de la dentine, un tissu minéralisé de la dent sécrété par des cellules, les odontoblastes. « II s'agit là d'une approche très novatrice qui trouvera ses applications futures notamment dans le traitement des caries », salue le Pr Magloire. Un véritable espoir pour venir à bout d'un fléau qui représente la principale cause d'extraction dentaire (60 %) avant les maladies dites du parodonte (40 %).
"Nous avons d'abord établi des lignées cellulaires à partir de la pulpe des molaires d'embryons de souris en privilégiant celles de type A4 qui présentaient un potentiel de différenciation important pour former de la dentine », détaille Yassine Harichane, l'un des chercheurs ayant consacre une partie de sa thèse à ce sujet. Puis, munis d'une microfraise, les chercheurs ont ensuite creusé un minuscule trou dans la molaire de rongeurs de façon a provoquer une lésion pulpaire et l'ont comblée avec ou sans les fameuses cellules A4. « Trois semaines après environ, il y avait une néoformation dedentine dans le groupe traité ", précise le chercheur. « Le choix de la stratégie réparatrice dépendra en fait du degré d'atteinte de la lésion initiale, détaille le Pr Poliard. Si l'atteinte est modérée, et s'il subsiste de la pulpe saine, on pourra se contenter de stimuler les cellulessouches vivantes résiduelles par des facteurs de croissance. En revanche, si la lésion est très importante, quand la pulpe est totalement détruite, par exemple sur une dent cassée, il faudra utiliser un substitut de pulpe, c'est-à-dire un biomatériau dans lequel on aura inoculé des cellules souches qui reformeront du tissu. » Plusieurs équipes dans le monde y travaillent, comme celle du Pr Catherine Chaussain (EA 2496), toujours à l'université Paris-Descartes.
Supports dotés de nanoréservoirs actifs
Une autre approche de nanomédecine régénérative, baptisée NanoRegMed, est, elle, actuellement suivie par une équipe Inserm à l'université de Strasbourg. « Nous avons développé une stratégie innovante avec des supports dotés de nanoréservoirs actifs, explique la coordonnatrice du projet, le Dr Nadia Benkirane-Jessel, directrice de recherches Inserm l'UMR 977. Nous travaillons plus particulièrement sur un peptide de contrôle de l'inflammationpulpaire que nous avons incorporé à unematrice qui a la consistance d'un gel ». Un gel qui permettrait non pas la prévention des caries – le brossage régulier demeure incontournable – mais leur traitement Comment ? En évitant de recourir à la dévitalisation de la dent et en régénérant la pulpe à partir du gel. Une start-up a même été créée, ARTiOSnanomed. Une phase de tests chez l'animal ayant obtenu des résultats encourageants, des essais sont maintenant prévus chez l'Homme et la start-up a entamé des négociations avec un poids lourd du secteur, la firme américaine Colgate-Palmolive.
Mais l'équipe voit déjà plus loin. Car de la dent à l'os, il n'y a qu'un pas. Aussi, à Strasbourg, orthopédistes et rhumatologues travaillent-ils en collaboration avec les dentistes et les biologistes. Objectif : développer des implants hybrides « intelligents » à base de nanoréservoirs de principes actifs et de cellules osseuses et cartilagineuses issues de cellules souches pour un jour, être en mesure de proposer des greffes d'os et de cartilage aux patients victimes de pathologies ostéoarticulaires, comme l'arthrose. D'ailleurs, créer aussi de l'os, des muscles, des nerfs..., c'est le rêve de tous ceux qui ont foi dans les promesses des cellules souches (lire Sciences et Avenir n° 722, avril 2007).
Biobanques dentaires
Une autre idée fait son chemin : congeler et stocker des cellules souches pulpaires obtenues à partir des dents de lait et des dents de sagesse, comme on le fait déjà avec les cellules issues du sang de cordon ombilical, des muscles, des nerfs..., c'est le rêve de tous ceux qui ont foi dans les promesses des cellules souches (lire Sciences et Avenir n° 739, septembre 2008).
La première biobanque dentaire est née au Texas (États-Unis) avec la société BioEden. Depuis, d'autres ont suivi, comme la société Stemsave qui, dans le Colorado, rétribue même les dentistes (90 dollars) qui acceptent de récupérer les dents de leurs patients... Le concept a également fait récemment son apparition au Royaume-Uni et en Suisse avec Future Health Biobank, autorisant le stockage privé et payant. La voie semblait donc toute tracée pour que la France se dote à son tour d'une telle structure. En juin 2011, l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) avait même donné son feu vert à l'institut Clinident Bio-Pharma qui proposait le stockage d'une dent pendant vingt ans pour environ 120 € par an. Avant de revenir sur sa décision à l'automne, estimant que les travaux étaient trop préliminaires et contraires au principe de non-patrimonialité du corps humain reposant sur l'anonymat et la gratuité. Une exception française qui a enclenché une bataille judiciaire, toujours en cours.
Source :
Sylvie Riou-Milliot (2012). - Quand les dents repousseront,Sciences et Avenir n° 783, mai 2012, pp.72-75.
Les dents cachent une source inattendue de cellules souches (ajout d'octobre 2014)
Nous avons vu plus haut que la pulpe dentaire renferme une petite quantité de cellules souches. Durant l'été 2014, l'origine de ces cellules souches a été décelée par des chercheurs suédois : elles proviennent des nerfs de la dent.
Des cellules nerveuses migrent en effet régulièrement vers la pulpe, pour retourner à l'état de cellules indifférenciées. Une vraie surprise pour les scientifiques. Comprendre le mécanisme de ce processus pourrait ouvrir la voie à un nouveau mode de fabrication de ces cellules souches très utiles, non seulement pour recréer des dents, mais également pour soigner de nombreuses maladies (voir l'article sur ce blog concernant les potentialités des cellules souches).
Dans la pulpe de la dent (en orange), des cellules nerveuses redeviennent des cellules souches (Science & Vie n° 1165, octobre 2014, p. 36).
09:22 Publié dans Médecine, Sexualité-embryologie | Tags : odontologie, cellules souches, implant, sciences et avenir | Lien permanent | Commentaires (10) | ![]() Facebook | | |
Facebook | | |
09/03/2012
Régénération de la rétine par cellules souches embryonnaires
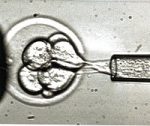 Régénération de la rétine humaine
Régénération de la rétine humaine
par cellules souches embryonnaires
(mise à jour du 25/01/2015)
Dans leurs livraisons de mars 2012, les revues Sciences & Vie (n° 1134) et Sciences et Avenir (n° 781) se sont fait l'écho d'une avancée thérapeutique fondamentale : pour la première fois, une thérapie a été mise au point à partir de cellules souches humaines : les rétines de deux patients ont été traitées par des cellules souches embryonnaires humaines (CSEh) par une équipe américaine. Encadrée par l'agence sanitaire américaine, l'opération réalisée le 12 juillet 2011 à l'Institut ophtalmologique Jules-Stein de Los Angeles dépasse de très loin la simple réparation de deux rétines et concerne la régénération des organes humains.
Ce sont les premiers blastomères issus de la segmentation des embryons surnuméraires après 5 ou 6 jours de développement non utilisés par les couples pour une fécondation in vitro. Contrairement aux cellules souches que l'on trouve dans certains organes adultes qui ont un pouvoir de différenciation limité, les cellules souches embryonnaires(CSEh) sont des cellules pluripotentes car elles sont à l'origine de toutes les cellules de l'organisme (voir dans ce même blog l'article : Cellules souches et rajeunissement).
Ces cellules pluripotentes possèdent le plus enviable de tous les pouvoirs, celui de générer la totalité des organes humains. Cerveau, muscles, cœur, poumons… Rien ne leur est impossible. Depuis leur découverte en 1998 à l'intérieur d'embryons de cinq ou six jours, les cellules souches embryonnaires (CSEh) ont fait l'objet de vastes programmes de recherches. Mais elles n'étaient pas encore sorties des laboratoires malgré quelques effets d'annonce jamais vérifiés.
L'opération américaine de de la rétine
Sous la rétine (1), 50 000 cellules pigmentaires (obtenues à partir de cellules souches embryonnaires (CSEh)) ont été injectées. Seule une petite zone a été traitée pour limiter les risques en cas d'effets secondaires, l'imagerie médicale permet d'observer, en coupe, le fond de la rétine (2). La petite surépaisseur visible avec un fort grossissement (3), correspond au point d'injection et témoigne que les cellules ont bien survécu et colonisé la zone. Même si la surface réparée est peu étendue, les patients estiment que leur vision s'est améliorée.
D'après Jean-Pierre Hubschman, un ophtalmologiste d'origine française de l'équipe, la manipulation était très simple : "Il s'agissait de légèrement soulever la rétine du patient, puis d'injecter quelques gouttes de liquide ". Mais ce liquide contient plus de 50 000 cellules pigmentaires, indispensables à la bonne réception de la lumière dans l'œil.
Ces cellules rétiniennes ont été obtenues grâce à la transformation d'environ 2 000 cellules souches embryonnaires (CSEh) mises en culture et différenciée par une méthode mise au point par la firme américaine de biotechnologie Advanced Cell Technology (ACT). Ainsi, injectées en un point précis, les cellules cultivées ont pu coloniser et retapisser, en partie du moins, le fond de la rétine des deux patients, une septuagénaire atteinte par une forme de dégénérescence maculaire liée à l'âge (DMLA), et un homme touché par la maladie de Stargardt, une dégénérescence maculaire héréditaire.
Quelques mois plus tard, les techniques d'imagerie de la rétine montrent que les cellules injectées sont toujours visibles dans la zone traitée et les deux patients estiment avoir bénéficié d'une amélioration de la vue, même s'ils continuent de souffrir de formes très avancées de leur maladie. Jean-Pierre Hubschman reste particulièrement prudent : "L'immense espoir suscité par l'annonce d'une thérapie contre ces deux maladies incurables ne doit pas faire croire au miracle. Avec seulement deux patients opérés, c'est encore trop tôt pour affirmer que nous avons réussi. Même si les résultats semblent très encourageants." Depuis, d'ailleurs, d'autres malades ont été opérés aux États-Unis et en Angleterre. La totalité des résultats est attendue pour 2014. Et, dans le même temps, d'autres essais sur des organes aussi divers que le cœur, le cerveau ou le pancréas pourraient très vite débuter. Cette fois, pas de doute, l'aventure des cellules souches embryonnaires est bien partie.
Une crainte subsiste car le pouvoir de différenciation des cellules souches embryonnaires (CSEh) a un revers : on les suspecte de pouvoir engendrer des tumeurs complexes à croissance rapide, les tératomes. Et c'est pour limiter ce risque qu'ACT a préféré miser sur une implantation dans l'œil, un organe non vital. Un choix d'autant plus judicieux que les réactions de rejets immunitaires y sont également très limitées. Les deux opérations pionnières de la rétine se devaient donc déjà de démontrer, avant même l'efficacité de la thérapie, l'innocuité des cellules souches embryonnaires.
"C'est une annonce très enthousiasmante", confirme Marc Peschanski, de l'unité I-Stem de l'Inserm au Génopole d'Évry (Essonne), l'un des 21 centres autorisés en France à mener des recherches sur ces cellules, "l'objectif intitial de l'étude a déjà été atteint. Six mois après l'opération, les cellules greffées semblent s'être parfaitement intégrées dans la rétine".
La DMLA« sèche» dans le viseur
Par ailleurs, la piste de la greffe de cellules rétiniennes dérivées de cellules souches embryonnaires humaines semble se confirmer (Sciences et Avenir, n° 816, février 2015, p. 96). Publiés en octobre dernier dans The Lancet, les derniers résultats d'une étude américaine dirigée par le Pr. Robert Lanza de la firme Advanced Cell Technology, montrent en effet une amélioration globale de la vision des patients greffés atteints de DMLA, et ce sans apparition d'effets indésirables irréversibles au bout de 22 mois.
Dans le même article, le magazine pose la question : Le Lampalizumab : un médicament efficace ? Capables de réduire de 20 % la progression des lésions causées par la forme « sèche » et avancée de la dégénérescence maculaire liée à l'âge (DMLA) — plus courante que sa forme « humide » et jusqu'ici sans traitement —, les injections de Lampalizumab « constituent un nouvel espoir », soutient le Dr Jean-François Girmens, ophtalmologiste à l'hôpital des Quinze-Vingts à Paris. Tout juste entré en phase III de tests dans 24 pays, cet inhibiteur d'une partie du complément (ensemble de protéines agissant sur notre réponse immunitaire) ne devrait toutefois pas être vendu avant 2017, prévient le laboratoire Roche.
La voie japonaise avec l'uilisation de cellules iPS (cellules souches adultes)
Devenues célèbres en octobre 2012 grâce au prix Nobel de médecine décerne à leur découvreur, le Pr Shinya Yamanaka, les cellules souches pluripotentes induites (ou cellules iPS) occuperont à nouveau le haut de l'affiche en 2013. Des chercheurs japonais du centre Riken lanceront en effet le premier essai thérapeutique sur l'homme faisant appel à ces cellules dans le traitement de la DMLA.
Les iPS se positionnent ainsi comme une alternative concrète aux cellules souches embryonnaires humaines (CSEh), celles-là mêmes qui laissent entrevoir depuis des années l'avènement d'une médecine régénératrice, mais dont l'utilisation se heurte aux problèmes éthiques posés par la question du statut de l'embryon. Les iPS peuvent être vues comme de « fausses » cellules embryonnaires : elles auraient les mêmes capacités de multiplication et de différenciation, mais sans provenir d'embryons. Car il s'agit de cellules différenciées adultes - par exemple de banales cellules de peau - « rajeunies » jusqu'au stade embryonnaire sous l'action d'un cocktail de jouvence mis au point par Shinya Yamanaka. Outre le traitement de la DMLA, le Japonais fonde de grands espoirs sur l'utilisation des iPS pour réparer les lésions de la moelle épinière.
L'espoir d'une thérapie
De nombreux organes sont potentiellement concernés par le pouvoir réparateur des cellules souches embryonnaires. Ainsi, Michel Pucé (Inserm) pourrait bien être le premier à se lancer dans des essais sur l'insuffisance cardiaque. "Les protocoles sont en phase de finalisation, explique le chercheur. Nous attendons le feu vert des agences sanitaires." Ces essais sur le cœur sont d'autant plus attendus qu'aucun résultat n'a pu encore être obtenu jusqu'à présent lors des nombreux essais de thérapies cellulaires.
Autre projet en cours : des tests sur des cellules pancréatiques pour traiter le diabète. Reste que, en dehors des essais menés sur la rétine, un seul autre projet a été homologué dans le monde: le laboratoire américain Neuralstem s'intéresse au potentiel réparateur des cellules souches contre la sclérose latérale amyotrophique, une maladie neurovégétative. Et les premières injections ont eu lieu. Quoiqu'il en soit, l'absence d'effets secondaires officiellement constatés dans l'essai d'ACT devrait rassurer les agences sanitaires encore prudentes.
Sources :
Tourbe C. (2012). - Cellules souches embryonnaires Sciences & Vie, mars 2012 n° 1134, pp.68-72.
Kaldy P. (2012). - Les cellules souches peuvent rendre la vue, Sciences et Avenir, mars 2012, n° 781, p. 34.
10:28 Publié dans Biologie, Médecine, Sexualité-embryologie | Tags : cellules souches, cellules souches embryonnaires, médecine régénératrice, moelle osseuse, greffe d'organe, rétine, thérapie | Lien permanent | Commentaires (6) | ![]() Facebook | | |
Facebook | | |
18/11/2009
L'Escargot (1) : Morphologie externe
L'Escargot, cet animal hermaphrodite, est un excellent modèle pour l'étude de la sexualité et le déterminisme du sexe. En effet, les cellules souches de sa gonade évoluent soit en ovules, soit en spermatozoïdes. Voici toute une série d'articles sur cet animal fabuleux. Ce premier chapitre traite l'étude de la morphologie de l'animal.
10:22 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, mollusques, morphologie | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
17/11/2009
L'Escargot (2) : La coquille
Dans ce deuxième chapitre consacré à l'Escargot, intéressons-nous à la structure de la coquille, à sa régénération en cas de fracture et ses applications en cosmétologie
10:42 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : escargot, coquille, mollusques, gastéropodes | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
16/11/2009
L'Escargot (3) : Locomotion
Entre autres particularités, l'Escargot a un mode de locomotion tout particulier : il se déplace grâce à un unique pied, escaladant n'importe quelle surface et déclivité, et en avançant sans déraper ni rester collé au substrat : tout ça grâce à la thixotropie de son mucus.
18:26 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, mollusques, locomotion | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
15/11/2009
L'escargot (4) : Anatomie
Les Gastéropodes sont vraiment des animaux "tordus". Au cours de leur embryogenèse, ils subissent flexion et torsion, voire enroulement dans une coquille spiralée… Et en plus, un appareil génital à tout faire : spermatozoïdes et ovules.
08:55 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, mollusques, anatomie | Lien permanent | Commentaires (17) | ![]() Facebook | | |
Facebook | | |
14/11/2009
L'escargot (5) : Biologie et développement
Bien qu'ils soient hermaphrodites et et que leur gonade produise les deux sexes gamétiques, il n'y a pas autofécondation chez les escargots. L'accouplement est réciproque avec échanges de spermatophores mis en réserve chez le partenaire, en attente de la maturation des ovocytes.
09:01 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, mollusques, biologie, développement | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
13/11/2009
L'Escargot (6) : L'hermaphrodisme
Étude en microscopie photonique et électronique de la glande hermaphrodite de l'Escargot : les gamètes mâles et femelles sont produits dans chaque tubule de la gonade où l'on trouve simultanément les ovocytes sur la paroi et les gonocytes mâles en évolution dans la lumière des tubules.
14:56 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, mollusques, gamétogenèse | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
12/11/2009
L'Escargot (7) : L'ovotestis adulte
Quelle que soit la lignée gamétique mâle ou femelle, le cycle de la glande hermaphrodite montre que les gamètes naissent des mêmes cellules souches situées sur la paroi des tubules.
09:43 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, mollusques, gamétogenèse | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
11/11/2009
L'Escargot (8) : la spermatogenèse
Nés de cellules souches pariétales, les gonocytes mâles se multiplient dans la lumière des tubules pour donner finalement des spermatozoïdes. Pendant ce temps, les ovocytes ne se multiplient plus sur la paroi mais prennent de l'embonpoint.
12:04 Publié dans Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, spermatogenèse | Lien permanent | Commentaires (2) | ![]() Facebook | | |
Facebook | | |
10/11/2009
L'Escargot (9) : l'ovogenèse
Nés de cellules souches pariétales, les ovocytes vont subir un accroissement considérable de leur volume par la constitution de réserves mettant en jeu toute une machinerie cellulaire.
17:19 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, ovogenèse | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
09/11/2009
L'Escargot (10) : genèse de la gonade
La genèse de la gonade permet de confirmer que les gamètes des deux sexes proviennent des mêmes cellules souches présentant une morphologie semblable à celle des cellules somatiques.
14:41 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
08/11/2009
L'Escargot (11) : Organes présumés endocrines
La différenciation des gamètes dans le sens mâle ou dans le sens femelle est sans doute due à des interactions hormonales. Il faut donc rechercher des organes endocrines susceptibles d'agir sur la gamétogenèse.
09:46 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, organes endocrines | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
07/11/2009
L'Escargot (12) : culture organotypique de la gonade isolée sur milieu anhormonal
Pour s'affranchir de l'influence de l'organisme sur la gonade, il faut l'isoler sur des milieux de culture dépourvus de toute hormone et de tester ainsi les potentialités intrinsèques des cellules souches à l'origine de la gamétogenèse. On montre ainsi que le sexe fondamental est le sexe femelle qui se manifeste spontanément en l'absence d'hormones : c'est l'autodifférenciation ovocytaire.
09:26 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, culture organotypique | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
06/11/2009
L'Escargot (13) : culture de la gonade sur milieux enrichis
En culture d'organes sur milieu anhormonal, les gonocytes évoluent spontanément en ovocytes. Pour obtenir des spermatozoïdes, il faut ajouter au milieu de culture du sang d'escargot en phase mâle. Le schéma de la sexualisation des gonocytes est le suivant : pas d'hormones : sexe femelle ; hormones : sexe mâle.
08:39 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, culture organotypique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
05/11/2009
L'Escargot (14) : association de la gonade avec d'autres organes
L'ajout de sang d'escargot a montré que la spermatogenèse était induite par des facteurs humoraux. Il faut rechercher les organes effecteurs de ces facteurs masculinisants. On les trouvera dans le cerveau et le tentacule oculaire.
10:09 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : escargot, hermaphrodisme, sexualité, culture organotypique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
04/11/2009
L'Escargot (15) Conclusion générale
 L'Escargot (15) : Interprétation de l'hermaphrodisme chez Helix aspersa
L'Escargot (15) : Interprétation de l'hermaphrodisme chez Helix aspersa
par André Guyard
(suite de l'Escargot 14)
Le présent article constitue une conclusion aux 14 articles précédents consacrés à l'Escargot et au déterminisme du sexe chez cet animal hermaphrodite.
Le comportement de la gonade d'Escargot en culture organotypique autorise à penser que la différenciation sexuelle des gonocytes est sous la dépendance d'une séquence hormonale. La confrontation des résultats de l'analyse du cycle in vivo et de l'étude expérimentale in vitro permet de mieux comprendre certaines modalités de l'expression de l'hermaphrodisme.
1) La culture de l'ébauche gonadique isolée démontre que non seulement chaque cellule-souche morphologiquement identique à une cellule somatique est sexuellement bivalente mais qu'elle est potentiellement une cellule femelle. Chez cette espèce hermaphrodite, le sexe femelle se réalise dans des conditions anhormonales. Il s'agit d'une autodifférenciation femelle.
2) Comment interpréter la protandrie ? Il faut supposer que la phase germinative qui débouche in vivo sur la spermatogenèse est déclenchée par un facteur masculinisant. L'expérimentation nous apprend que ce facteur présumé est humoral. Il est présent dans l'hémolymphe d'animaux en phase mâle et il permet l'accomplissement de la spermatogenèse in vitro. La sécrétion de cet agent est discontinue puisque sa présence dans l'hémolymphe est épisodique.
Le primum movens de l'action androgène siège au niveau du ganglion cérébroïde d'animaux d'âge postembryonnaire puisque cet organe favorise la multiplication spermatogoniale et, conjointement avec le tentacule oculaire, empêche la manifestation de l'autodifférenciation ovocytaire. Un fonctionnement endocrine discontinu du cerveau expliquerait les démarrages de spermatogenèses abortives au cours du premier mois de la vie postembryonnaire.
3) L'apparition des ovocytes un mois après l'éclosion correspondrait à un épuisement corrélatif des hormones masculinisantes cérébrales. La différenciation des protogonies dans le sens femelle coïncide dans un tubule donné avec l'arrêt de la multiplication spermatogoniale. In vitro, c'est l'époque où la seule présence des ganglions cérébroïdes ne permet plus d'assumer le contrôle de la spermatogenèse et de refréner l'autodifférenciation ovocytaire. Le taux de facteur masculinisant serait insuffisant pour imposer le sexe mâle à toute la gonade puisqu'il s'établit une espèce de gradient de sexualité dans la culture. La partie la plus proche du tissu nerveux est occupée par des spermatogonies en multiplication alors que dans la partie la plus éloignée, des gonocytes échappant probablement à l'action du facteur masculinisant s'autodifférencient en ovocytes.
4) Plus tard, au cours du cycle annuel de la gonade mature, le démarrage de la spermatogenèse puis l'apparition des ovocytes sur les parois peuvent s'expliquer de la même façon par l'intervention puis l'épuisement du facteur androgène. Or, chez les Crustacés, le cerveau qui contrôle le fonctionnement de la glande androgène a lui-même le même effet directement sur les gonocytes (J. Berreur-Bonnenfant, 1968). L'association in vitro des ganglions cérébroïdes d'animaux en spermatogenèse avec la gonade ne permet jamais la réalisation d'une spermatogenèse comparable à celle réalisée par l'adjonction d'hémolymphe d'hiver. Peut-être que cette expérience ne met en évidence que la stimuline contrôlant le fonctionnement d'un hypothétique tissu androgène.
5) En outre, après accomplissement de la spermatogenèse, la lignée femelle poursuit son évolution. Or in vitro, le cerveau extirpé d'animaux en ovogenèse ne permet que la seule manifestation de la lignée femelle. C'est une nouvelle preuve de la labilité du facteur cérébral masculinisant. En sa présence en un taux suffisant, la lignée mâle entre en multiplications spermatogoniale ; en son absence ou en sa présence en quantité insuffisante, la lignée femelle se manifeste et amorce son auxocytose.
6) On peut se demander quel est le mécanisme responsable du déclenchement et de la modulation de la sécrétion de ce facteur masculinisant. D'une façon générale, il est certain que le système nerveux intervenant aussi bien dans le contrôle de la vie de nutrition et de reproduction que dans la vie de relation de l'organisme, la sécrétion des neurohormones est sousmise à l'influence des facteurs exogènes trophiques, climatiques ou psychiques, les récepteurs sensoriels (notamment le tentacule oculaire des Gastéropodes) pouvant jouer le rôle de relais. Ces considérations expliqueraient l'intervention des facteurs externes dans l'expression du phénotype cytosexuel chez les espèces hermaphrodites.
On peut également envisager que le signal du virage sexuel au niveau du cerveau provienne de l'ovotestis lui-même qui, par une sorte de feed-back déclenché par exemple par l'état de réplétion des tubules gonadiques dû à l'abondance des spermatogonies, avertisse le système nerveux central par voie humorale.
7) La participation d'autres facteurs humoraux contrôlant la physiologie de l'une ou l'autre des gamétogenèses doit être supposée pour expliquer la coexistence des deux lignées gamétiques.
Ainsi, pendant que se déroule la spermiogenèse in vivo ou en culture en présence d'hémolymphe d'hiver, l'accroissement ovocytaire est réprimé. C'est alors qu'on peut supposer l'intervention d'une inhibition de l'ovogenèse parallèlement à l'action d'un facteur spermiogénétique d'origine inconnue. Le fait que le tentacule montre un rôle constamment répressif sur l'ovogenèse est un indice en faveur de l'intervention de cet organe dans l'inhibition de l'accroissement ovocytaire.
D'autre part, un facteur cérébral semble, contrôler l'auxocytose. En culture, le ganglion cérébroïde prélevé sur des animaux en ovogenèse a une influence bénéfique sur l'accroissement ovocytaire sans qu'on puisse préjuger d'un rôle sur la vitellogenèse.
On peut soupçonner l'intervention de multiples facteurs dont les interactions constituent un jeu subtil permettant l'évolution en parallèle des deux lignées sexuelles ; ainsi la préméiose au sein des ovocytes débute fréquemment en même temps que s'amorcent les divisions réductionnelles des spermatocytes. Peut-être y a-t-il là une indication de l'intervention d'un facteur méiotique non sexualisé ?
Le schéma de la sexualisation des cellules germinales au sein de la gonade paraît plus simple. Les protogonies ou gonies indifférenciées sont sexuellement bivalentes. Elles reçoivent de la part du soma l'impulsion qui les orientera vers un sexe ou vers l'autre. C'est la nature et le cheminement de cette impulsion qui sont en cause.
Chez Helix aspersa, la culture organotypique a permis de mettre en évidence le phénomène d'autodifférenciation femelle.
Le schéma de la séquence hormonale qui contrôle la différenciation dans le sens mâle, évoqué par les résultats de l'association de la gonade avec le ganglion cérébroïde demande à être confirmé. S'agit-il de facteurs qualitativement distincts ou simplement de la modulation d'un unique facteur stimulateur de la gamétogenèse ?
Il ne faut pas perdre de vue que ces résultats ont été obtenus avec la seule technique des cultures organotypiques. La mise en évidence d'actions endocrines ne pourra être résolue qu'avec le concours d'expériences complémentaires. Injections d'extrait cérébral et/ou tentaculaire, ablation sélective de cellules nerveuses, greffes ou implantations de ganglions, observation de la différenciation fine au niveau des organites des cellules germinales, identification chimique des substances actives constituent autant de techniques à exploiter pour poursuivre la discussion sur le contrôle de l'hermaphrodisme chez l'Escargot.
RÉSUMÉ
Helix aspersa Müll. est une espèce d'Hélicidés hermaphrodite protandre. L'étude histologique et ultrastructurale complétée par la mise en culture organotypique de la gonade a permis d'apporter quelques précisions quant aux mécanismes qui régissent la sexualisation des gonocytes.
La mise en place de la gonade est caractérisée par une période d'indifférenciation qui se prolonge jusqu'à dix jours après l'éclosion. Il n'existe qu'une seule souche cellulaire à l'origine des deux lignées germinales.
La protandrie semble due à une induction mâle d'origine cérébrale qui se manifeste en réprimant une tendance spontanée à l'autodifférenciation femelle et par un effet mitogène favorisant la multiplication spermatogoniale qui envahit la lumière gonadique consacrant ainsi l'orientation définitive du gonocyte dans le sens mâle.
Un mois après l'éclosion, l'hermaphrodisme se manifeste par la différenciation d'ovocytes en position pariétale. Ce phénomène réalité de l'autodifférenciation ovocytaire non refrénée par le cerveau dont l'action modulée selon l'âge ou la saison déterminera les phases du cycle sexuel.
D'autres facteurs complémentaires interviennent dans la réalisation de la gamétogenèse : un facteur d'origine tentaculaire dont l'effet principal est d'inhiber la tendance spontanée des gonocytes à l'autodifférenciation ovocytaire ; un facteur dont le siège est le ganglion cérébroïde qui favorise l'accroissement de la cellule femelle avec le concours de facteurs trophiques.
09:59 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : escargot, sexualité, hermaphrodisme | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |