07/11/2009
L'Escargot (12) : culture organotypique de la gonade isolée sur milieu anhormonal
Pour s'affranchir de l'influence de l'organisme sur la gonade, il faut l'isoler sur des milieux de culture dépourvus de toute hormone et de tester ainsi les potentialités intrinsèques des cellules souches à l'origine de la gamétogenèse. On montre ainsi que le sexe fondamental est le sexe femelle qui se manifeste spontanément en l'absence d'hormones : c'est l'autodifférenciation ovocytaire.
 L'Escargot (12) : culture organotypique de la gonade isolée sur milieu anhormonal
L'Escargot (12) : culture organotypique de la gonade isolée sur milieu anhormonal
par André Guyard
(suite de l'Escargot 11)
(Dernière mise à jour : 2 novembre 2013)
1. La culture organotypique
La culture organotypique de la gonade qui permet de soustraire l'organe à toute influence humorale en l'isolant radicalement de l'organisme apparaît comme le meilleur test pour révéler les potentialités du tissu germinal.
Il s'agit d'une méthode qui permet de cultiver non seulement des cellules (culture cellulaire) ou des tissus (culture histiotypique), mais un organe tout entier sans que la structure de ce dernier soit altérée.
Pour permettre des manipulations faciles, la méthode doit répondre à plusieurs critères :
- Le milieu de culture doit être très accessible sans risquer de briser la stérilité qu'impose l'isolement de l'organe cultivé.
- La respiration tissulaire doit être assurée.
- La méthode doit permettre l'observation constante de l'explant sans perturber sa survie.
C'est pourquoi nous avons choisi la méthode de culture sur milieu gélosé mise au point par E. Wolff et K. Haffen et appliquée à l'étude des Invertébrés et qui répond à ces impératifs. En effet les organes posés directement sur le milieu gélosé respirent directement l'oxygène ambiant et utilisent par diffusion les substances nutritives du support. En outre, les récipients de type salière employés permettent l'observation par transparence sans rompre la stérilité.

Choix du milieu de culture :
Le milieu gélosé doit satisfaire à un certain nombre de conditions :
- Il doit comporter tous les éléments nutritionnels indispensable à la survie de l'organe. Sinon la culture dépérira. En revanche, une trop grande richesses du milieu risque de désorganiser l'explant et favoriser la migration cellulaire.
- La composition du milieu nutritif doit refléter autant que possible la composition du milieu intérieur de l'organisme. De même la pression osmotique et le pH du milieu doivent correspondre à ceux de l'hémolymphe (sang de l'escargot).
- Destiné à des recherches endocrinologiques, le milieu doit être neutre. Il ne doit pas intervenir dans la différenciation de l'organe ni contenir des substances hormonales ou hormono-mimétiques susceptibles d'interférer avec les organes ou substances éprouvés. On trouvera dans ma thèse la composition des différents milieux de culture expérimentés.
Protocole expérimental :
En cabine de culture stérile, alimentée en air stérilisée par UV, on procède au prélèvement des organes par dissection. La stérilisation de la paillasse est assurée par un nettoyage à l'éther-alcool. Les instruments de dissection ont été stérilisés en étuve sèche alors que les liquides servant la confection des milieux sont stérilisés à l'autoclave.
Sur le milieu gélosé disposé au fond de la salière, on dépose l'organe prélevé stérilement. Une plaquette de verre lutée à la paraffine ferme le récipient de façon étanche. La survie de l'organe pourra être ainsi surveillée de jour en jour. D'ailleurs, il réagit par des mouvements superficiels à la chaleur de la lampe d'observation.
Remarque : (ajout de novembre 2013)
Cette technique paraît aujourd'hui quelque peu archaïque. Depuis la décennie 1960, la culture organotypique a su utiliser d'autres techniques plus performantes comme celle utilisée en 2012-2013 par des chercheurs autrichiens pour obtenir en culture l'ébauche d'un cerveau humain.
Des cellules souches humaines classiquement obtenues et mises en culture, se sont notamment différenciées en neuroectoderme, le tissu à l'origine du cerveau. Jusqu'ici, rien de vraiment neuf. Puis, les chercheurs ont découpé des fragments de ce tissu, qu'ils ont encapsulés dans des microbilles de gel nutritif contenant toutes les substances nécessaires à la croissance et au développement des cellules en culture. Voilà l'une des premières astuces : L'utilisation de microbilles à la place d'une couche de gel au fond d'une boîte a amélioré l'adhérence entre les cellules.
Ensuite, et c'est là qu'est la véritable clé du succès, l'équipe autrichienne a utilisé un bioréacteur tournant, une sorte d'incubateur qui a placé les microbilles en état de suspension permanente. C'est la grande nouveauté du dispositif. Les billes en suspension contournent le problème de la gravité. Lorsque les cellules commencent à former un amas au sein de la capsule de gel, elles ne se déforment pas et ne retombent pas comme dans une boîte de Pétri. En outre, cette mobilité permet d'améliorer l'oxygénation des cellules. Autrement dit, c'est en se rapprochant des forces mécaniques exercées sur ces cellules durant une grossesse que les chercheurs ont triomphé.
Frottements, gravité, mouvement... Le résultat de cette modification de l'environnement est étonnant. Dans leurs microbilles, les cellules se multiplient, se différencient et s'organisent de façon totalement autonome. Comme si les cellules avaient en mémoire le plan à respecter pour aboutir à un cerveau, avec des régions cérébrales bien distinctes : cavités remplies de liquide qui donneront les ventricules et le liquide céphalo-rachidien, couches internes du cortex cérébral avec neurones différenciés, plexus choroïdes produisant le liquide céphalo-rachidien, ou encore tissu rétinien chez environ 10 % des embryons de cerveau. Autant de structures présentes in vivo et qui montrent même des traces d'activité électrique identiques... Certaines étapes du développement sont tout à fait semblables à ce qui se passe in vivo. Néanmoins, l'organisation spatiale au sein de ces régions, anarchique, ne reproduit pas l'architecture réelle d'un cerveau. En outre, le développement du cerveau sera stoppé à 9 semaines par l'absence d'irrigation sanguine.
Cette même technique inventée quelque cinquante ans plus tôt nous aurait permis d'améliorer notre technique de culture d'organe, d'en prolonger la durée en facilitant la survie des explants.
2. Culture de l'ébauche gonadique
[Le prélèvement de l'ébauche gonadique constitue un exploit technique. Après ouverture de la coque de l'œuf, il s'agit d'opérer un animal de 3,5 à 4 mm de diamètre pour en extirper un organe mesurant 0,5 mm de long, transparent donc invisible, mais enclavé dans la future glande digestive. L'opération ne peut être réalisée que sous loupe binoculaire (grossissement 40 fois), avec des instruments en verre noir fabriqués à la microforge. En effet, les instruments métalliques sont suffisamment poreux pour assécher l'explant. Inconvénient : l'extrémité des instruments en verre perd sa couleur noire pour devenir rose pâle.
La stérilité de l'explant est obtenue par une dizaine de lavages successifs dans du liquide physiologique dont les paramètres s'approchent de ceux de l'hémolymphe de l'escargot.]
On se rappelle que, in vivo, les protogonies se différencient d'abord en spermatogonies avant que l'apparition des ovocytes sur les sujet âgés d'un mois marque le début de l'hermaphrodisme.
Il en va autrement lorsque la gonade est isolée en culture in vitro. Les cellules souches génèrent d'emblée des ovocytes. 24 heures après la mise en culture, l'aspect ovocytaire est déjà reconnaissable.
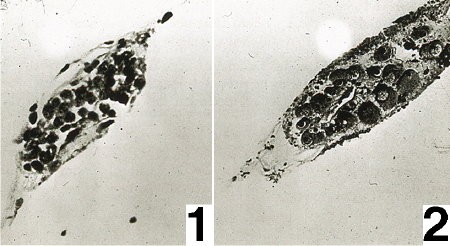
Ebauche gonadique. Fig 1 : à la mise en culture ;
Fig. 2 : après 24 heures de culture
Le phénomène se manifeste d'abord aux dépens des cellules pariétales puis se propage à la quasi totalité des cellules gonadiques. Le noyau se dilate en vésicule germinative au sein de laquelle se disperse la chromatine après disparition des figures pré-méiotiques. Aucune polarité ne se manifeste dans la répartition des organites cytoplasmiques. Tous ces caractères sont spécifiquement ovocytaires.
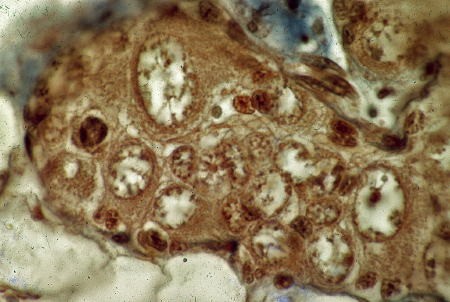
Ébauche gonadique après 8 jours de culture
Tous les gonocytes évoluent en ovocytes
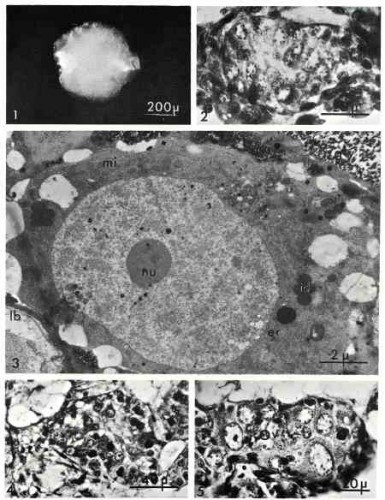
Si l'on met en culture des gonades juvéniles, on obtient le même résultat : priorité à l'orientation ovocytaire. Une gonade déjà engagée dans le sens mâle (Fig. 4) montre que la voie mâle est abortive au profit de la voie femelle. Après 8 jours de culture, seuls les ovocytes sont présents dans la gonade (Fig. 5). La phase mâle ne s'installe pas même après 50 jours de culture. La gonade devient un véritable ovaire bourré d'ovocytes. Mais en l'absence de cellules folliculeuses, la vitellogenèse ne s'installe pas et le diamètre ovocytaire ne dépasse jamais 20 µm.

Ainsi la protogonie issue de la cellule souche qui in situ aurait évolué en spermatogonie se différencie en ovocyte dès qu'elle se trouve isolée de l'organisme. Cette observation apporte la preuve que la cellule souche est sexuellement indifférenciée puisqu'une même cellule-souche est capable d'engendrer soit une spermatogonie, soit un ovocyte. En outre, la différenciation dans le sens femelle peut se produire sans le secours d'aucune influence humorale extra-gonadique. On peut en conclure que la gonade isolée est capable d'autodifférenciation femelle. Autrement dit, cette potentialité montre que chez les Gastéropodes Pulmonés hermaphrodites, le sexe fondamental est le sexe femelle qui se manifeste spontanément sans intervention hormonale.
Cette autodifférenciation femelle a été également constatée chez d'autres Mollusques et d'autres invertébrés. Prenons le cas des Crustacés. Les Amphipodes comme Orchestia gammarella, espèce étudiée par H. Charniaux-Cotton ou les Décapodes comme les crabes sont à sexes séparés. Or les mâles sont munis d'une glande androgène. Si l'on procède à l'ablation de cette glande, à la prochaine mue, le mâle va changer de sexe. Réciproquement, si l'on greffe une glande androgène à une femelle, elle va se transformer en mâle.
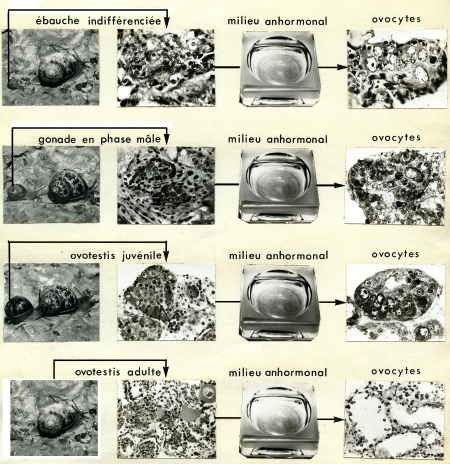
3. Cultures de la gonade en phase mâle, de la gonade juvénile et de la gonade adulte
Si l'on pratique le culture organotypique de l'ébauche gonadique engagée dans la spermatogenèse, on assiste toujours à une autodifférenciation ovocytaire et à une dégénérescence de la lignée mâle.
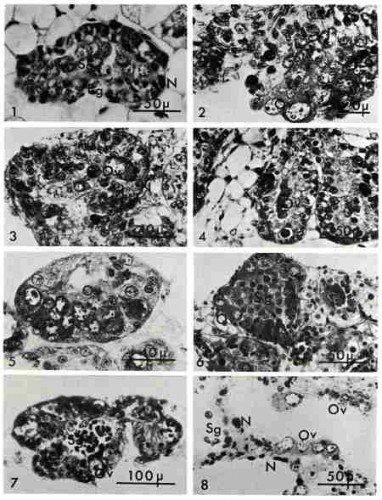
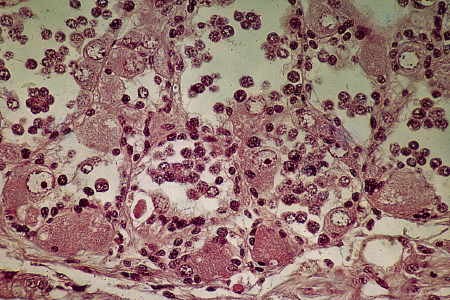
- Culture de la gonade en phase mâle
Fig. 1. Aspect de la gonade d'un jeune escargot âgé d'un mois. Les spermatogonies primordiales (Sg) ont quitte l'épithélium germinatif (Eg). Sur la paroi demeurent des cellules nourricières (N) et des protogonies.
Fig. 2. Gonade d'un jeune âgé de 35 jours après cinq jours de culture. On note l'apparition d'ovocytes longuement pédonculés (Ov).
Fig. 3. Gonade d'un jeune âgé de 34 jours après 12 jours de culture. Les ovocytes (Ov) en position atypique semblent provenir de l'auxocytose de spermatogonies primordiales comme le prouvent la position marginale du nucléole et la présence d'une cellule nourricière (N) à la base de ces ovocytes.
Fig. 4. Gonade d'un jeune âgé de 34 jours après 15 jours de culture. Les ovocytes en position atypique (Ov) dégénèrent.
Fig. 5. Gonade d'un jeune âgé de 40 jours après 48 jours de culture. Ne subsiste plus dans la gonade qu'une couronne d'ovocytes dans chaque tubule.
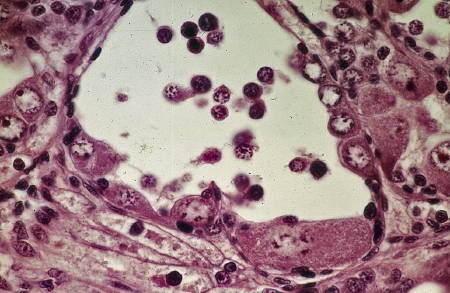
- Culture de l'ovotestis juvénile et adulte
Fig. 6. Fragment témoin d'un ovotestis juvénile. La paroi gonadique se couvre d'ovocytes (Ov) alors que la lumière est remplie de spermatogonies (Sg).
Fig. 7. Gonade d'un jeune âgé de 45 jours après 11 jours de culture. Les spermatogonies se nécrosent dans la lumière alors que sur les parois subsistent les ovocytes préexistants (Ov) ou se différencient de jeunes cellules femelles.
Fig. 8. Ovotestis adulte après 7 jours de culture. Les cellules mâles (Sg) disparaissent totalement. Sur les parois où les cellules nourricières (N) marquent remplacement des cellules souches mères des spermatogonies, la présence de jeunes ovocytes (Ov) en préméiose montre que le phénomène de l'autodifférenciation ovocytaire est permanent tant que la gonade contient des cellules indifférenciées.

09:26 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, culture organotypique | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |



Commentaires
Écrit par : bruno | 11/09/2011
Les commentaires sont fermés.