17/03/2011
OMS et AEIA
Lettre ouverte à l'OMS
Avenue Appia - CH – 1211 - GENEVE 27 - le 17 mars 2011
par Claudine LE TALLEC
Madame, Monsieur,
C'est une supplication que j'adresse à chaque personne parmi les milliers qui travaillent à l'OMS.
Des doutes sont émis à l'encontre de l'OMS quant à sa connivence avec des laboratoires pharmaceutiques, des firmes chimiques et agroalimentaires à propos de nuisances causées par des médicaments, vaccins et pesticides.
Aujourd'hui, c'est de FAITS RÉELS RECONNUS QUI EXISTENT DEPUIS PLUS DE 50 ANS dont je veux vous entretenir.
Il s'agit de l'ACCORD signé le 28 mai 1959 (WHA 12-40) entre l'OMS et l'AIEA (Agence Internationale à l'Energie Atomique). Accord par lequel aucune de ces 2 agences de l'ONU ne peut prendre de positions publiques qui puissent nuire aux intérêts de l'autre.
Or,
. garante de la santé de la population mondiale et faisant autorité auprès des Etats, l'OMS, conformément à sa Constitution, doit être indépendante de tout intérêt commercial,
. l'AIEA, elle, s'est constituée en 1957 pour faire la promotion du nucléaire civil.
Que se passe-t-il lorsqu'il y a conflit d'intérêt entre l'information et la prise en charge de la santé des populations par l'OMS, et les intérêts de l'AIEA qui, au demeurant, dépend du Conseil de Sécurité de l'ONU ?
Presque rien, si ce n'est que l'OMS minimise les faits alors que son rôle est de nous informer, de protéger notre santé et celle de nos enfants à travers le monde, notamment de l'irradiation interne par les faibles doses continues des radionucléides ingérés par les aliments, l'eau, l'air, restant actifs pendant des périodes allant de quelques décennies à des milliers d'années : partout sur Terre sachant quelle tourne, que les vents soufflent et les eaux circulent, vu les multiples activités nucléaires civiles et militaires du passé et du présent et du futur.
Depuis plus de 50 ans, l'on sait donc qu'il y a danger accru avec la radioactivité artificielle. Celle qui engendre, qui concentre, qui enrichit de nouveaux éléments hautement radioactifs qui n'existaient pas spontanément sur terre auparavant...
Et l'on voudrait que je sois complice ? NON. J'ai besoin pour vivre dignement, pour regarder mes enfants droit dans les yeux sans qu'ils m'accusent, de dénoncer cet accord monstrueux et de demander qu'il soit annulé. Penser : tu savais et tu n'as rien fait, m'est intolérable.
J'ose espérer qu'il en sera de même pour vous, par exemple, en vous réunissant près de votre grande « maison » tout en convoquant la presse internationale afin de dire à la face du Monde l'existence de cet accord et de le remettre en cause catégoriquement.
Vous aurez alors droit à notre reconnaissance infinie et à nos remerciements du fond du coeur. »
Envoi de : Claudine LE TALLEC, 4, rue de la Côte 25390 – ORCHAMPS-VENNES claudine51@voila.fr
15:56 Publié dans Environnement-Écologie, Nature et santé, Pollution | Tags : oms, aeia | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
14/03/2011
Catastrophe de Fukushima : les premières mesures indépendantes de radioactivité sont alarmantes
Catastrophe de Fukushima :
les premières mesures indépendantes de radioactivité sont alarmantes
Réseau "Sortir du nucléaire"
Fédération de 875 associations agréée pour la protection de l'environnement
http://www.sortirdunucleaire.org/
(Dernière mise à jour du 11 août 2016)
Le Réseau "Sortir du nucléaire" révèle que six journalistes indépendants de l'association JVJA (Japan Visual Journalist Association), dont le directeur du magazine Days Japan, Ryuichi HIROKAWA, se sont rendus près de la mairie de Futaba, à 2 km de la centrale de Fukushima Daiichi, pour mesurer la radioactivité avec trois compteurs Geiger, ce dimanche 13 mars à 10h20. Il s'agit à notre connaissance de la première mesure faite de façon indépendante des autorités, par des journalistes japonais que nous saluons pour leur courage et les risques qu'ils ont pris pour faire leur métier.
À la mairie de Futaba, située à 2 km de la centrale de Fukushima Daiichi, la radioactivité dépasse la capacité de mesure de certains des compteurs Geiger (BEIGER COUNTR DZX2, VICTOREEN 209-SI, et MYRate PRD-10) employés par les journalistes japonais.
À l'aide d'un compteur VICTOREEN 209-SI, le débit de dose a été mesuré à 10 milli-Röntgen/h (soit 0,1 mSv/h, ce qui signifie qu'un citoyen japonais reçoit la dose annuelle tolérée en France en l'espace de 10 heures). Le journaliste ayant effectué la mesure, Ryuichi Hirokawa, déclare : "Quand j'ai fait un reportage fin février 2011 à Tchernobyl, le taux de radioactivité était de 4 milli-Röntgen/h (0,04 mSv/h) à 200 m du réacteur accidenté. Dans la ville de Pripyat, à 4 km du réacteur de Tchernobyl, le niveau était de 0,4 milli-Röntgen/h." (1)
Les mesures relevées avec les 2 autres appareils varient dans une fourchette de 20 à 1000 micro-sievert par heure (0,02 à 1 mSv/h). Explication : 1 mSv représente le niveau de la limite annuelle autorisée en France pour l'exposition de la population aux rayonnements radioactifs artificiels en France. En seulement 1 heure, un citoyen japonais reçoit la dose annuelle.
De telles informations accréditent un niveau de radioactivité dramatiquement élevé dans un périmètre étendu autour de la centrale, dont les conséquences sanitaires ne pourront être que très graves.
Rappelons que la radioactivité atteignait ce matin un niveau 400 fois supérieur à la normale à la préfecture de Miyagi, distante de 80 km de la centrale de Fukushima Daiishi (2).
Les autorités japonaises sont en train de perdre tout contrôle sur la situation. Le Réseau "Sortir du nucléaire" alerte les citoyens : le gouvernement japonais cherche à minimiser autant que possible la gravité de la catastrophe nucléaire en cours et du relâchement de radioactivité dans l'environnement. Avec la réunion ministérielle de ce samedi 12 mars et la tentative de désinformation du ministre de l'industrie Éric Besson, la machine à étouffer l'information s'est déjà mise en marche, en France aussi.
La catastrophe nucléaire japonaise démontre s'il en était encore besoin la gravité du danger que le nucléaire fait courir aux populations. La seule décision politique responsable, pour le Japon comme pour la France, est de sortir du nucléaire.
Notes :
(1) http://mphoto.sblo.jp/article/43820834.html en japonais
Contact au Japon de l'association JVJA ayant effectué les mesures : JVJA Mobile: 090-6101 -6113
(2) http://english.kyodonews.jp/news/
Pour en savoir plus : le site de la CRIIRAD (16 mars 2011 - 10 H) :
http://www.criirad.org/actualites/dossier2011/japon/commu...
Ajout fin avril 2012 (Sciences et Avenir, n°783, mai 2012).
Fukushima: une pollution maritime sans précédent
La catastrophe nucléaire de Fukushima constitue bien le plus important déversement de radioactivité dans les océans de toute l'histoire. Mais au-delà de 30 kms des réacteurs détruits, les radionucléides ont été dispersés par les courants si bien que les poissons pourraient être consommés sans danger. Tels sont les deux enseignements de la campagne de mesures menée par une équipe internationale et publiée dans
les Comptes Rendus de l'Académie des Sciences (Pnas) américaine, le 2 avril 2012.
A bord du navire scientifique Ka'imikaio-kanaloa affrété en juin 2011, soit trois mois après le tsunami, les chercheurs ont récolté des échantillons d'eau de mer, de plancton et de petits poissons entre la surface et 100O mètres de profondeur, de 30 à 600 kilomètres des côtes. Les chercheurs ont bien trouvé des teneurs élevées de césium mais aucun résultat n'excède les normes de santé humaine. Le Kuroshio courant plus large et plus rapide que le Gulf Stream, qui remonte vers le nord de l'archipel avant de partir plein est dans le Pacifique, a dispersé les radionucléides.
Les chercheurs avertissent cependant du risque d'une exposition à long terme si la centrale continue à déverser des radionucléides et s'il se confirme que les sédiments marins ont été notablement contaminés.
Ajout fin janvier 2013 : du poisson super radioactif pêché à Fukushima
De tristes individus tentent de faire croire que Fukushima fait déjà partie du passé et qu'il ne faut pas remettre en cause le nucléaire pour « si peu ». En réalité, la catastrophe ne fait que commencer : les coeurs des réacteurs sont toujours en fusion, et refroidis en continu pour éviter une reprise des réactions nucléaires.
D'autre part, environ 200 000 personnes ont été évacuées et, pour elles, le drame n'en est qu'au début. Sans oublier que des millions de personnes vivent dans des zones plus ou moins contaminées, avec des conséquences inévitables sur la santé, en particulier celle des enfants. Quant à la faune, elle se porte mal comme le prouve la découverte, deux ans après le début de la catastrophe, d'un poisson 2500 fois plus radioactif que les « normes », pourtant déjà terriblement laxistes. Il est bien évident que ce poisson n'est qu'un parmi d'innombrables autres.
Comme chacun le sait, les petits poissons sont mangés par les plus gros, etc : la chaîne alimentaire entière est touchée. Le drame de Fukushima ne fait que commencer, le nucléaire est bien une calamité qui répand la désolation sur cette planète.
Mars 2013 : deux ans plus tard, à Fukushima, c'est encore l'enfer !
Pour avoir une idée de la situation de la contamination à Fukushima en mars 2013, on se reportera aux articles :
- Science & Vie : Fukushima, la catastrophe à tous les niveaux par Rafaële Brillaud, Science et Vie, n° 1146, mars 2013, pp.78-93.
- Sciences et Avenir : Fukushima 2 ans après, la sécurité encore en chantier par Rachel Mulot, Sciences et Avenir, mars 2013, n° 793, pp. 10-14.
Ajout du 16 août 2014 : Article de Univers Nature qui fait le point sur la situation à Fukushima.
Dernière mise à jour du 11 août 2016
Pour suivre toute l'actualité du traitement du site de Fukushima, rendez-vous sur le site suivant :
L'ACROnique de Fukushima : Voir Fukushima : le problème sans fin des déchets radioactifs
11:08 Publié dans Actualité des Sciences, Environnement-Écologie, Nature et santé, Pollution | Tags : nucléaire, japon, fukushima | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Catastrophe nucléaire : agir rapidement sur la sécurité et la politique énergétique
Catastrophe nucléaire : agir rapidement sur la sécurité et la politique énergétique !
(17/03/2011)
Inutile de dire que les réactions sont nombreuses depuis l'annonce des accidents survenus sur les centrales nucléaires au Japon.
Si RSN (Réseau Sortir du Nucléaire) estime que c'est bien une véritable catastrophe qui se déroule et que son issue ne peut être évaluée, Éric Besson (Ministre de l'énergie) parle d'un « accident nucléaire grave » mais que l'on ne peut qualifier de « catastrophe ». Ce discours n'étonne pas FNE puisque c'est un « discours normal de la part d'un ministre qui nous a déjà dit qu'il soutenait totalement le nucléaire ».
Cette situation renvoie bien entendu au débat sur le Grenelle de l'environnement où les associations n'ont pu faire entendre leurs voix : le nucléaire a donc été exclu de la loi Grenelle 1 et par conséquence de la loi Grenelle 2.
Contrairement aux affirmations au plus haut niveau, le Japon n'est pas le seul à avoir pris des risques en ce domaine. La France peut aussi être concernée et il y a déjà eu des alertes. En effet, si les technologies diffèrent, c'est la question du refroidissement du réacteur qui est l'élément essentiel. Greenpeace rappelle que « la centrale de Saint Laurent, au bord de la Loire, a déjà subi deux accidents de niveau 4, avec fusion partielle du cœur en 1969 et 1980 ».
L'eurodéputée Michèle Rivasi indique pour sa part que RSN avait déjà révélé que les centrales nucléaires n'étaient pas aux normes sismiques. FNE évoque aussi la fragilité des centrales en bord de mer puisque « fin 1999 on a évité une catastrophe de justesse pour celle de Blayais en Gironde ».
En ce qui concerne notre région, rappelons-nous que la centrale du Bugey se trouve à la merci d'un séisme détruisant le barrage de Vouglans et que Fessenheim est menacée par une crue catastrophique du Rhin.
Mais au-delà du risque, cela pose la question de la politique énergétique. Car si l'on estime que le seul moyen d'éviter ce risque, c'est de refuser le nucléaire, il faut d'abord réduire la consommation énergétique de manière drastique... surtout si l'on prône dans le même temps le véhicule électrique !
Et en seconde priorité, la substitution par d'autres énergies renouvelables est à promouvoir de façon « plus énergique » mais cela demande quelques années.
En attendant, les combustibles fossiles (charbon, gaz, pétrole) vont continuer de produire les deux tiers de l'énergie mondiale avec un autre risque, celui du changement climatique !
Dans ce contexte compliqué car il n'y a eu aucune anticipation de pouvoirs publics, Nicolas Sarkozy envisagerait une réunion du G20 dédiée à l'énergie et à la sécurité nucléaire. Par ailleurs, les ONG appellent à organiser au plus vite un nouveau « Grenelle de l'énergie »...
Pour en savoir plus sur la gestion de cette catastrophe nucléaire, visitez périodiquement les sites de la CRIIRAD et de l'ACRO et du réseau "Sortir du nucléaire".
10:00 Publié dans Environnement-Écologie, Nature et santé, Pollution | Tags : rsn, michèle rivasi, fne | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
05/03/2011
Cancers détectés par des chiens
Cancer de la prostate et cancers colorectaux détectés par des chiens
Étonnant : dans sa livraison de mars 2011, le mensuel Sciences et Avenir révèle que le flair du chien serait le meilleur outil à disposition des chercheurs pour progresser dans le dépistage de certains cancers. Dans le cas du cancer de la prostate, l'étude a été proposée à l'armée française par Olivier Cussenot, urologue à l'hôpital Tenon (Paris) et son équipe. Aspirant, un berger malinois de 2 ans et demi a été capable de détecter 30 malades sur 33 d'après leurs échantillons d'urine, soit un taux de réussite de 91 %. À comparer avec celui du test sanguin PSA appliqué à l'heure actuelle qui plafonne à 20 %... Deux ans d'apprentissage auront été nécessaires pour former Aspirant.
En ce qui concerne le cancer de la prostate, le test PSA (qui cible une protéine, la PSA, sécrétée par l'organe lors d'une inflammation) est tellement faillible qu'un dépistage systématique ne peut être envisagé. D'où l'intérêt d'un test plus spécifique. Les chercheurs ont engrangé plusieurs centaines de molécules candidates dans les urines de patients malades. « Tout l'intérêt de cette approche, explique Olivier Cussenot, consiste à accélérer l'identificalion. D'ici à deux ans, je pense qu'Aspirant nous aura permis de mettre la main sur plusieurs molécules nous conduisant à la mise au point d'un bien meilleur test. »
Ainsi, le chien se révèle un auxiliaire précieux en cancérologie. Une étude japonaise, parue Le British Médical Journal, publie une étude japonaise qui montre que le flair d'un labrador est plus efficace que la coloscopie pour la détection de cancers colorectaux dans les échantillons de selles de malades.
Source : Sciences et Avenir, n° 769 mars 2011 p. 39.
16:26 Publié dans Biologie, Médecine, Nature et santé, Poissons, Pollution | Tags : cancer de la prostate, cancer colorectal, détection, psa, détection par le chien | Lien permanent | Commentaires (3) | ![]() Facebook | | |
Facebook | | |
08/02/2011
Kokopelli fait appel à la Cour de Justice Européenne
Nouvelles de Kokopelli : Septembre 2014
Kokopelli fait appel à la Cour de Justice Européenne !
Dans le cadre du procès qui nous oppose à la société Graines Baumaux, nous avons demandé à la Cour d’Appel de Nancy de saisir la Cour de Justice de l’Union Européenne d’une question portant sur la validité de la législation européenne sur le commerce des semences potagères au regard de certains principes fondamentaux de l’Union Européenne et du Traité International sur les Ressources Phytogénétiques pour l’Alimentation et l’Agriculture (TIRPAA).
Alors que la société Graines Baumaux s’opposait fortement à cette demande, qu’elle qualifiait de « cheval de Troie », la Cour d’Appel, par une Ordonnance du 4 février 2011, a fait droit à notre demande.
Les questions fondamentales, que nous soulevons depuis le début de notre existence, seront enfin posées à la juridiction suprême de l’Union Européenne. Les enjeux, en termes d’appropriation du vivant et de sauvegarde de la biodiversité, sont immenses et nous espérons que la Justice, ultime recours des opprimés, saura les mesurer.
Nous appelons tous les opérateurs européens de la semence ancienne à se joindre à nous pour témoigner, dans le cadre de ce procès historique, de l’absurdité de la législation actuelle sur le commerce des semences.
Contacts :
Association Kokopelli
communication@kokopelli.asso.fr
Blanche MAGARINOS-REY, Avocate de Kokopelli
contact@avocat-magarinos-rey.com
Nouvelles spéciales du 18 septembre 2014
Procès Kokopelli c. Graines Baumaux :
Après presque 10 ans de procédure, la Cour d’Appel de Nancy donne enfin raison à Kokopelli !
Dans l’affaire nous opposant, depuis près de 10 ans, à la société Graines Baumaux, le délibéré de la Cour d’Appel de Nancy a été prononcé le 9 septembre dernier et l’arrêt, dans son entier, vient de nous être communiqué.
A notre grande satisfaction, la Cour rejette l’essentiel des demandes de la société Graines Baumaux, et en particulier celle fondée sur une prétendue faute de concurrence déloyale liée à l’absence d’enregistrement des variétés distribuées par Kokopelli.
Le jugement de 1e instance, qui condamnait Kokopelli, est donc infirmé !!!
La Cour considère en effet que la société Graines Baumaux, qui reprochait à l’association de proposer à la vente une gamme plus élargie de variétés anciennes que la sienne, « ne se trouve aucunement empêchée de proposer à la vente les mêmes produits que l’association KOKOPELLI et donc d’offrir la même gamme élargie de semences à sa clientèle de jardiniers amateurs à la seule condition d’inscrire les variétés qu’elle entend commercialiser sur liste officielle de « variétés dont la récolte est principalement destinée à l’autoconsommation » sur laquelle l’inscription est libre et d’un coût modique par rapport à l’enjeu commercial, soit un montant de 125 euros par variété comme elle l’indique elle-même. Il lui est également loisible d’étoffer son catalogue en commercialisant davantage de variétés de graines sélectionnées parmi les 14 500 variétés que compte selon elle le catalogue officiel européen ».
C’est l’argument que nous lui avions suggéré. La société Graines Baumaux, qui prétendait que l’enregistrement au Catalogue était simple et peu coûteux, et que la biodiversité se trouvait déjà fort bien protégée et représentée par celui-ci, se trouve ainsi prise au piège de ses propres affirmations.
Toutefois, cela ne signifie pas que l’activité de Kokopelli se trouve officiellement avalisée par la Cour d’Appel. Bien au contraire. En effet, l’argument selon lequel la vente de semences à des jardiniers amateurs ne faisant pas une exploitation commerciale de celles-ci ne serait pas soumise aux exigences d’enregistrement au Catalogue, a été rejeté par la Cour.
Cet argument peu ambitieux – car ne faisant aucune place à l’agriculture professionnelle dans la lutte pour la sauvegarde de la biodiversité – avait été avancé, en dernier recours, après la décision défavorable prise par la Cour de Justice de l’Union Européenne en juillet 2012. Bien qu’il soit abondamment utilisé par de nombreuses associations de préservation des semences en Europe, il n’avait jamais été soumis à l’examen d’une juridiction.
C’est maintenant chose faite, mais la décision de la Cour d’Appel de Nancy, sur ce point, est très décevante. En effet, la Cour considère, à l’issue d’une leçon de grammaire particulièrement byzantine, que « la formulation de l’article 2 de la directive permet de retenir que sont soumises à ses prescriptions la vente ou l’offre de vente de semences ainsi que les autres formes de cession réalisées dans le cadre d’une exploitation commerciale, ce qui exclut les cessions de semences à des tiers dans un but autre, comme de réaliser des expérimentations et permet d’écarter du champ d’application du texte les échanges de graines entre particuliers amateurs de jardinage qui ne font pas commerce de leurs semences potagères. »
La Cour n’exclut donc du champ d’application de la législation que les échanges de semences entre jardiniers amateurs. Tout transfert de semences, à titre onéreux ou gratuit, réalisé non pas « en vue d’une exploitation commerciale », comme le dit le texte, mais « dans le cadre d’une exploitation commerciale », comme le dit la Cour, tombe sous le coup de la loi et son obligation d’enregistrement des variétés.
Cette interprétation, pour le moins aventureuse, aura vraisemblablement des répercussions dans toute l’Europe et nous espérons qu’elle sera corrigée par le législateur européen lorsqu’il devra voter sur le projet de réforme de la législation actuelle.
En tout état de cause, dans le litige particulier nous opposant à la société Graines Baumaux, la décision de la Cour d’Appel de Nancy signifie donc que s’il est vrai que Kokopelli commet des actes illicites par la vente de variétés non inscrites au Catalogue officiel, ces agissements ne sont pas générateurs de responsabilité vis-à-vis de la société Graines Baumaux et « n’ont pas pour effet de fausser le jeu de la concurrence ». Ces considérations nous mettent hors de danger vis-à-vis de Graines Baumaux et de l’industrie semencière, et c’est évidemment l’essentiel.
Quant aux accusations réciproques de dénigrement, la Cour renvoie les parties l'une contre l'autre et chacune est condamnée à payer 5 000 € de dommages-intérêts à l’autre. Si, par ce volet de sa décision, la Cour semble vouloir ménager la chèvre et le choux, il ne faut toutefois pas oublier que c'est bien la société Graines Baumaux qui poursuit Kokopelli depuis presque 10 ans et qu'elle souhaitait voir ordonnée la cessation pure et simple de nos activités. On peut donc dire que son initiative a simplement échoué... A l’évidence, l’association Kokopelli sort gagnante de ce long combat.
Si enfin l’on se souvient que la Cour de Justice de l’Union Européenne, statuant contre l’avis de son Avocat Général, avait désavoué Kokopelli et considéré que la législation européenne sur le commerce des semences, permettant supposément une augmentation de la productivité agricole, n’était pas critiquable, il faut saluer un exploit dans notre défense et une victoire inespérée de Kokopelli, qui maintient le cap de la biodiversité, contre vents et marées…!
Contacts :
Ananda Guillet, Directeur :
semences@kokopelli-semences.fr
Notre avocate, Blanche Magarinos-Rey :
contact@avocat-magarinos-rey.com
07:50 Publié dans Botanique, Environnement-Écologie, Nature et santé | Tags : kokopelli | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
25/11/2010
Lobbys pro-OGM
Titre initial :
Un demi milliard de dollars
pour influencer
la politique en matière d’OGM

Selon un rapport publié en novembre 2010 par Food & Water Watch, c’est 572 millions de dollars qui ont été dépensés depuis 1999 par les 50 plus grandes entreprises, qui possèdent des brevets sur l’agriculture et l’alimentation - comme Syngenta, Monsanto, BASF, Bayer - et deux associations professionnelles impliquées dans les biotechnologies et l’agriculture - Biotechnology Industry Organization (Bio) et CropLife America - pour mener des campagnes ou organiser du lobby auprès du Congrès en vue de favoriser l’introduction des biotechnologies végétales.
Cette somme est répartie ainsi : 547 millions de dollars ont été dépensés pour du lobby directement auprès du Congrès et 22 millions de dollars ont été donnés à des candidats au Congrès.
Le rapport note aussi une augmentation des dépenses au cours de la dernière décennie. Ainsi, les dons représentaient 2,4 millions de dollars en 2000, et 5,3 millions de dollars en 2008.
Une part importante de cet argent a servi à éviter que la nourriture issue d’OGM puisse être étiquetée comme le réclame une majorité d’étatsuniens, ou à faire pression sur des gouvernements étrangers pour qu’ils ne limitent (voire n’interdisent) pas les cultures transgéniques.
Le rapport donne de nombreux exemples. Ainsi BIO a dépensé plus de 4 millions de dollars au cours du premier semestre 2010 pour que la FDA autorise les animaux transgéniques et qu’elle fasse pression sur l’Union européenne pour qu’elle revienne sur sa décision d’interdire la viande issue d’animaux clonés.
Par ailleurs, cette organisation s’est mobilisée financièrement en 2004 pour défendre le projet de loi HR 4561 dont le but était de promouvoir les biotechnologies agricoles à l’extérieur des États-Unis ou pour faire accepter la résolution n°252 qui visait à utiliser l’OMC pour attaquer les réglementations européennes sur les OGM.
Le rapport précise aussi que ces entreprises emploient plus de 300 anciens membres du personnel du Congrès ou de la Maison Blanche.
Parmi eux, John Bradley Holsclaw qui, après avoir été onze ans conseiller du Sénateur Bob Dole, a créé sa propre agence de lobby, Tongour Simpson Holsclaw, laquelle a eu comme client Monsanto, Bio et Aventis.
La connaissance précise des rouages de l’administration américaine lui a permis d’opérer un lobby efficace.
Auteur : Rédaction infogm.org
Source : www.infogm.org
15:14 Publié dans Actualité des Sciences, Environnement-Écologie, Nature et santé, Pollution | Tags : ogm, lobbys, lobbys pro-ogm, monsanto, syngenta, basf, bayer, food & water watch, croplife america, fda | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
La riposte des lanceurs d'alerte
La riposte des lanceurs d'alerte
par Corinne Lepage
Le procès qu’intente Gilles-Eric Séralini, soutenu par le Comité de recherche et d'information indépendantes sur le génie génétique (CRIIGEN), contre Marc Fellous et son association de défense des OGM est une grande première.
C’est la première fois, en effet, que des scientifiques, lanceurs d’alerte, décident de faire juger le caractère diffamatoire du dénigrement personnel et systématique dont ils sont l’objet.
D’habitude, ce sont les lobbys qui assignent les lanceurs d'alerte pour dénigrement de leurs produits: Mouvement pour le droit et le respect des générations futures (MDRGF) pour les pesticides, Robin des Toits pour les ondes électro-magnétiques, Pierre Menneton pour le sel, ou qui obtiennent leur mise à l’écart (Christian Vélot pour les OGM ou hier André Cicollela pour les éthers de glycol).
Cette pratique du dénigrement des scientifiques qui ont, par leurs études, mis en lumière des risques associés à des produits ou des technologies n’est pas nouvelle.
Dans son rapport de 2000 intitulé "Signaux Précoces, leçons tardives, le principe de précaution 1896-2000", l’Agence Européenne pour l’Environnement avait décrit de manière détaillée et étayée par de nombreuses notes comment, depuis l’amiante (c’est-à-dire les dernières années du XIXe siècle) les lobbys s’étaient organisés –de mieux en mieux– pour faire taire ceux qui soulignaient des risques potentiels, en les marginalisant et en s’attaquant personnellement à eux plutôt que discuter du bien fondé de leurs thèses.
Avec les cigarettiers, la manière de faire s’est perfectionnée: des scientifiques de renom comme Fred Singer étaient embauchés par les industriels de la cigarette pour défendre la thèse de l’absence de preuve de la nocivité du tabac et le caractère peu sérieux des scientifiques qui démontraient le contraire.
Cette pratique est passée aujourd’hui à un stade industriel avec les climato-sceptiques, dont les liens au moins, aux États-Unis, avec certains pétroliers –et en particulier Exxon– ne sont plus à démontrer.
Il est du reste piquant de noter que les organisateurs du faux débat sur l’absence de cause anthropique au changement climatique sont précisément... les mêmes que ceux qui auparavant avaient durant 20 ans entretenu le faux débat sur la dangerosité du tabac.
Nous assistons aujourd’hui au même phénomène pour les OGM.
L’association qui dénigre le professeur Gilles-Eric Séralini est composée de personnes qui ont des liens avec l’agrosemence.
Le conseil de Gilles-Eric Séralini a établi, preuves à l’appui, que 14 membres de cette association avaient déposé des brevets auprès des agrosemenciers~ et que 12 d’entre eux administraient ou étaient employés par une firme agrosemencière.
Quant à Marc Fellous , il omet dans son CV de préciser qu’il a déposé 2 brevets pour la société YEDA qui est la partie commerciale de l’institut Weismann.
Il n’y a rien de déshonorant à travailler pour les organismes fabricant des OGM et à déposer des brevets.
En revanche, il est tout à fait anormal de se prétendre expert défenseur d’une science qui serait désincarnée, désintéressée et détachée de toutes considérations mercantiles en omettant soigneusement de préciser son activité réelle.
Il est encore plus anormal de bâtir une stratégie de défense des groupes ou intérêts pour lesquels on travaille en dénigrant des chercheurs dont le seul tort est de gêner ces groupes.
Il est enfin purement scandaleux d’avoir ce type de comportement pour éviter qu’un sujet de santé publique ne vienne sur la table et pour tenter de dissimuler une vérité qui dérange. Or, c’est précisément le sujet.
L’étude que Monsanto et l’Association française des biotechnologies végétales (AFBV) reprochent au professeur Séralini est celle qui démontre la potentialité de conséquences sanitaires des OGM.
La bataille consiste à éviter, comme dans le cas de l’amiante, que des études, indépendantes des agrosemenciers, soient menées à bien, car elles risqueraient de faire éclater le problème au grand jour et de permettre la mise en cause des industriels qui aujourd’hui évitent leur responsabilité grâce au risque de développement.
Celui-ci permet de ne pas mettre en cause la responsabilité d’une firme quand l’état des connaissances, au moment de la mise sur le marché, ne permet pas de connaître un risque.
Donc, ne pas chercher, c’est être sûr de ne pas trouver et par conséquent de ne pas être responsable des conséquences futures. Donc haro sur tous ceux qui essaieraient de faire de la recherche, a fortiori qui trouveraient des effets sanitaires aux OGM.
Ainsi, seule la justice peut se prononcer pour faire en sorte que la controverse scientifique puisse se dérouler normalement et pas par invective et que les études indispensables à la sécurité sanitaire de nos concitoyens soient enfin réalisées.
Source : www.mediapart.fr
14:57 Publié dans Actualité des Sciences, Nature et santé | Tags : ogm, lanceur d'alerte, génie génétique, lobbys | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
06/10/2010
La France radioactive
 La France radioactive
La France radioactive
par René-Jean Monneret
Dans la plus grande discrétion, les autorités françaises, sous la pression des lobbies industriels, le tout avec la bienveillance habituelle de Sarko l'américano, a arrêté le 14 mai 2009 une dérogation à l'article de loi prévoyant l'interdiction d'insérer volontairement des éléments radioactifs dans les biens de consommation.
En termes concrets, le but est de permettre de réutiliser les matériaux faiblement radioactifs issus des centrales nucléaires françaises dans les matériaux de tous les jours, dont par exemple le ciment, les véhicules, et j'en passe. Seuls sont exclus de cete dérogation quelques articles dont les bijoux et les jouets.
Avec l'application de ce texte, tous les Français pourraient demain se retrouver exposés en permanence à des taux de radioactivité, qui pris isolément, resteraient sous les normes (ce qui ne veut pas dire sans riques), mais qui, cumulés une fois le procédé généralisé, deviendraient sources manifestes de cancers en tout genre. Le tout évidemment dans l'ignorance totale. La pollution qui en résulterait serait permanente mais surtout irréversible, il ne serait jamais plus possible de revenir en arrière niveau pollution radioactive.
La "maison qui tue" deviendrait donc une primauté française, voici de quoi régler efficacement le déficit prévu des caisses de pension, tout en ramenant de précieux euros dans les caisses de sociétés privées gestionnaires des centrales, et bien connues pour leur grande humanité, leur conscience sans faille, et leur grand respect de l'environnement.
La nouvelle publicité pour la Clio sera peut-être demain "La nouvelle Clio écolo, encore moins radioactive cette année", restera à construire des garages en plomb et à vous protéger les bijoux de famille.
C'est la "CRIIRAD" (vous pouvez suivre actuellement la page "Pétitions en cours") qui a découvert cette dérogation dans le cadre de ses activités de contrôle. Évidemment, comme d'habitude, le citoyen français a été maintenu dans l'ignorance totale de cette ignominie, et on voit bien, après les différents scandales à la santé concernant la France, que la tendance n'est pas prête de s'inverser.
Alors, faudra-t-il bientôt un compteur Geiger pour acheter Français ? La nouvelle législation, en tout cas, risque de rendre cet outil aussi commun qu'une calculette.
http://www.criirad.org/mobilisation/img/Arretedu5mai2009....
René-Jean Monneret
Paysan Jurassien Expert de 1ère classe.
10:39 Publié dans Environnement-Écologie, Nature et santé | Tags : radioactivité, criidad, déchets radioactifs | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
21/06/2010
La pomme de terre OGM "Amflora" interdite au Luxembourg
Le Luxembourg interdit la pomme de terre OGM "Amflora" !
par Greenpeace Luxembourg
Le 16 juin 2010, lors du colloque "La sécurité dans mon assiette" sur la sécurité de la chaîne alimentaire, le Ministre de la Santé luxembourgeois Mars Di Bartolomeo, en présence de Romain Schneider ministre de l’Agriculture, a interdit la culture de la pomme de terre OGM Amflora de BASF au Luxembourg.

L’interdiction de la pomme de terre OGM au Luxembourg a été annoncée quelques mois à peine après son autorisation par la Commission européenne et ceci devant des hauts représentants de l’autorité en charge de la sécurité alimentaire en Europe (EFSA).
C’est d’ailleurs au même endroit (Centre Culturel de rencontre Abbaye de Neumünster) que le Luxembourg avait déjà interdit le maïs transgénique MON810 en 2009.
Le message politique est courageux et sans appel possible : Le Luxembourg clame haut et fort qu’il n’est pas prêt à se laisser dicter un menu OGM par la Commission européenne. Après l’Autriche, c’est le deuxième état membre de l’Union européenne à prendre la décision de protéger les consommateurs et l’agriculture des conséquences négatives d’Amflora.
Greenpeace et les organisations partenaires de l’Initiative Luxembourg sans OGM (1) félicitent le Ministre de la Santé d’avoir pris ses responsabilités dans l’intérêt du consommateur et encouragent le Gouvernement à continuer de s’opposer résolument à la politique pro-OGM de la Commission européenne.
Une procédure d’évaluation qui doit être profondément réformée en Europe
Le 2 mars 2010, la Commission européenne avait autorisé la culture, l’utilisation dans les matières fourragères et la présence jusqu’à 0,9% dans l’alimentation humaine de la pomme de terre OGM Amflora développée par le géant allemand de la chimie BASF. Cette décision avait été prise malgré les évidences scientifiques relatives au risque de résistances aux antibiotiques.
Greenpeace et les organisations de l’initiative Luxembourg sans OGM tiennent à rappeler que procédure d’évaluation et d’autorisation des OGM dans l’Union européenne est défaillante et doit être réformée.
Les effets à long terme des OGM sur l’environnement et sur la santé, ainsi que leurs coûts socio-économiques pour toute la filière agricole ne sont actuellement pas pris en compte. « Nous demandons au Gouvernement luxembourgeois de continuer son engagement en faveur réforme de la une procédure d’évaluation et d’autorisation des OGM qui protège directement au niveau européen les consommateurs, l’environnement et l’agriculture des effets négatifs des OGM », déclare Maurice Losch de Greenpeace Luxembourg.
(1) : Les 29 organisations de l’Initative "Luxembourg sans OGM" :
Aide à l’Enfance de l’Inde, Association Solidarité Luxembourg Nicaragua, ASTM, Attac Luxembourg, Bauerenallianz, bioLABEL Lëtzebuerg, BIONA, Caritas Luxembourg, Demeter Bond Lëtzebuerg, Église Catholique de Luxembourg, Ëmweltberodung Lëtzebuerg asbl. (EBL), FCPT – SYPROLUX, FNCTTFEL – Landesverband, Fondation Hëllef fir d’Natur, Frères des Hommes, GREENPEACE Luxembourg, Haus vun der Natur, Initiativ Liewensufank, LCGB, Lëtzebuerger Natur- a Vulleschutzliga, Lëtzebuerger Landesverband fir Beienzuucht, Life asbl., Mouvement Écologique, OGBL, Slow Food Lëtzebuerg, SOS Faim Luxembourg, Stroossekanner Sao Paulo a.s.b.l., TransFair – Minka a.s.b.l., Union Luxembourgeoise des Consommateurs (ULC).
17:22 Publié dans Biologie, Environnement-Écologie, Nature et santé | Tags : greenpeace, ogm, santé, pomme de terre, luxembourg | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
17/06/2010
Un coton OGM favorise l'invasion de punaises
Un coton OGM favorise l'invasion de punaises
Dans les champs de coton transgénique chinois, les punaises ont remplacé les chenilles. Résultat : on a à nouveau recours aux pesticides.
La culture d'un coton transgénique en Chine, depuis 1997, était censée faire chuter l'usage d'insecticides. C'est raté ! Une étude menée entre 1992 et 2008 dans huit provinces du nord du pays par Yanhui Lu, de l'Institut pour la protection des plantes de Pékin, rapporte en effet que les populations de punaises ont considérablement augmenté avec l'expansion des surfaces de coton OGM.
Car, contrairement au coton conventionnel, aspergé d'un insecticide tuant à la fois des chenilles ravageuses et les larves de ces punaises, le coton génétiquement modifié pour produire la toxine Bt ne cible que les chenilles... Les punaises sont donc libres de proliférer dans les champs de coton, mais aussi dans d'autres cultures. Ainsi, 3 millions d'hectares de coton, et 26 millions d'hectares de cultures adjacentes sont concernés par ces infestations ! "Les exploitations de pommes, de jujubes ou de raisin sont aussi touchées", expliquent les chercheurs, qui estiment que l'utilisation du coton transgénique a inversé le rôle écologique de cette culture.
"Depuis, les champs de coton sont devenus des sources de punaises." Ce qui explique que d'autres insecticides, ciblant cette fois les punaises, soient "de plus en plus utilisés depuis 1997..." soulignant l'urgence, pour les auteurs, "d'estimer les risques d'impact des OGM sur les écosystèmes avant d'en cultiver".
Source : Science et Vie, n° 1114, juillet 2010
12:50 Publié dans Environnement-Écologie, Nature et santé | Tags : ogm, coton, chenilles, punaises, lépidoptères, hémiptères, insectes parasites, coton transgénique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
07/06/2010
Proliférations algales dans la haute vallée du Doubs
Les récentes constatations de la pollution de la Loue par une efflorescence de Cyanobactéries (ou Algues Bleues) a semé l'émoi dans la population, les pêcheurs et les touristes. Pourtant les épisodes estivaux de prolifération algale ne sont pas rares dans la région.
16:07 Publié dans Environnement-Écologie, Limnologie-hydrobiologie, Nature et santé | Tags : proliférations algales, hydrobiologie | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Proliférations de Cyanobactéries dans la Loue
Une pollution de la Loue a entraîné une prolifération de Cyanobactéries toxiques. Ces organismes émettent des toxines mettant en danger la vie aquatique et notamment les populations de truites
13:40 Publié dans Environnement-Écologie, Limnologie-hydrobiologie, Nature et santé, Poissons | Tags : loue, poissons, pollution, cyanobactéries, algues bleues, bloom, efflorescence, oscillatoria | Lien permanent | Commentaires (5) | ![]() Facebook | | |
Facebook | | |
15/03/2010
La Ciguatera aux Antilles françaises
 La Ciguatera aux Antilles françaises
La Ciguatera aux Antilles françaises
par André Guyard
Les touristes qui se rendent en bord de mer en zone intertropicale ignorent pour la plupart l'existence d'un risque encouru en consommant du poisson de mer. Dans certains cas, tout comme la population locale, ils peuvent subir une intoxication alimentaire : c'est la Ciguatera.
1. Historique
La Ciguatera est une maladie singulière provoquée par l'absorption de la chair de plus de quatre cents espèces de Poissons et d'Invertébrés marins. L'intoxication ciguatérique ou ichtyosarcotoxisme fait partie des toxi-infections alimentaires collectives (TIAC). Le nom de Ciguatera viendrait de "Cigua", un petit Mollusque vivant à Cuba et provoquant des troubles analogues.
Cette maladie est connue depuis fort longtemps ; le premier auteur l'ayant signalée fut Martyr en 1555. Christophe Colomb, Vasco de Gama, Magellan l'ont rencontrée dans les Caraïbes au XVIe siècle. Harmensen l'a signalée dans l'Océan Indien en 1601. Les marins de Fernandez de Quiros ont été intoxiqués en 1606 aux Nouvelles Hébrides : l'équipage avait pêché de nombreux poissons dont des "Pargos" (Lutjanidés) ; les matelots qui en mangèrent furent rapidement à toute extrémité. En 1675, John Locke (philosophe anglais) donna une description clinique et épidémiologique de la maladie aux îles Bahamas.
Plus récemment, le 8 mai 1949, 57 Philippins mangèrent aux îles Mariannes une très grosse murène. Tous furent très malades, onze entrèrent dans le coma et deux moururent.
Le 11 juillet 1951 à Terre de Bas (Saintes), 12 personnes de deux familles furent empoisonnées en mangeant une grosse bécune (barracuda). Les malades souffrirent beaucoup. Trois moururent et un autre devint fou trois mois plus tard.
En 1959, la Martinique a eu à déplorer quelques cas graves d'empoisonnement par des poissons pêchés à St Barthélémy.
Le 7 octobre 1960, 58 malades de l'hôpital de Pointe-à-Pitre ont été victimes d'une intoxication collective après avoir mangé de la "Vieille" en court-bouillon et en friture.
Ainsi chaque année dans les îles volcaniques et coralliennes tropicales des trois océans, plusieurs milliers de personnes sont victimes de la Ciguatera. Les Antilles françaises ne sont bien sûr pas épargnées.
Depuis 1992, la DDASS de Guadeloupe recueille, de façon hebdomadaire, les cas de TIAC par l'intermédiaire d'un réseau de surveillance sanitaire, le réseau Sentinelle.
De 1997 à 1999, 28 incidents ciguatériques impliquant 90 personnes ont été déclarés par l'intermédiaire du réseau Sentinelle. L'endémie est variable selon l'année et touche toutes les classes d'âge (46 % des cas recensés concernent les adultes de 30 à 49 ans).
2. Symptômes de la maladie
Les premiers signes d'intoxication surviennent généralement dans les 12 h qui suivent l'ingestion d'un poisson toxique. La Ciguatera est caractérisée par des effets digestifs précoces, cardio-vasculaires transitoires et neurologiques persistants. Le tableau du syndrome ciguatérique en Guadeloupe est similaire à celui observé dans d'autres îles de la Caraïbe ou en Floride avec une prédominance des signes digestifs, de l'asthénie et des paresthésies des extrémités.
Les symptômes cliniques de la Ciguatera apparaissent dans les heures suivant l'ingestion des poissons. Ils sont aussi bien gastro-intestinaux que neurologiques. Le début est marqué par des vomissements, diarrhées, crampes intestinales ; ensuite viennent des sensations alternatives de chaud et de froid, un goût amer dans la bouche, l'engourdissement de la langue et des lèvres, l'endolorissement des mâchoires avec sensation de perdre les dents, des douleurs dans les articulations, de fortes démangeaisons dans les membres et une fatigue musculaire très nette. On observe de plus une baisse de la tension artérielle, un ralentissement et une irrégularité du rythme cardiaque, une dilatation de la pupille.
Les atteintes cardio-vasculaires, (hypotension et bradycardie) ainsi que les troubles de la sensibilité comme l'inversion de la sensation de chaud et de froid interviennent également mais dans des proportions moindres. Certains signes comme le prurit et les signes neurologiques, peuvent se déclarer plusieurs jours après l'ingestion du poisson.
Dans les formes graves, on peut observer une incoordination des mouvements, des difficultés respiratoires ou urinaires, des troubles visuels. Les cas mortels sont exceptionnels et consécutifs à un état de choc cardiovasculaire.
En général l'évolution est favorable en une semaine environ, mais il n'est pas rare que les troubles de la sensibilité, les douleurs et les démangeaisons persistent plusieurs semaines et soient ravivées par toute nouvelle consommation trop hâtive de poisson même sain (hypersensibilisation). Des malaises neurodigestifs chroniques et des lésions de grattage subsistent d'où le nom de "gratte" donné parfois à l'affection. La durée moyenne de rétablissement paraît être de six mois environ.
Remarque : L'empoisonnement par la Ciguatera diffère dans ses origines comme par ses symptômes des autres sortes d'empoisonnements dus à des poissons comme les Tetraodontidae (Tetrodon sphaeroïdes), les Scombridae (thazards) ou des empoisonnements alimentaires causés par une contamination bactérienne (poissons avariés).
3. Traitements
Dans toutes les îles où sévit la Ciguatera existent des traitements locaux utilisant les propriétés de certaines plantes. Bien souvent ces médications empiriques soulagent les malades et aident à leur guérison.
Aux Antilles françaises et aux îles Vierges on utilise des infusions faites avec des feuilles de Passiflora foetida (Passifloracées), de Rhizophora mangle (Rhizophoracées), de Conocarpus erectus (Combrétacées).
Henri Stéhlé signale également des plantes efficaces comme Bontia daphnoïdes (Myoporacées), Annona muricata (Annonacées), Ricinus communis (Euphorbiacées).
La patate douce râpée crue mélangée à du lait frais et le jus de papaye donneraient aussi de bons résultats.
Pour le docteur Bagnis, chef de l'Unité Océanographique Médicale à l'institut Louis Malardé de Tahiti, les médicaments les plus efficaces sont les sels de calcium, l'atropine, les vitamines du groupe B, les antihistaminiques de synthèse et les corticoïdes dont l'indication respective est fonction des symptômes.
4. Quelques observations faites à propos de la Ciguatera
La Ciguatera est inconnue dans les zones tempérées. Les zones où l'on trouve des espèces toxiques sont nombreuses et très diversifiées (bancs coralliens, récifs barrières, lagons, etc.) mais elles sont souvent limitées.
Aux Bahamas, aux îles de la Société, les poissons de l'un des versants des îles sont beaucoup plus dangereux que ceux de l'autre côté. Les zones accores (à pente rapide) situées au vent ou à l'Est sont plus dangereuses que les zones sous le vent et peu profondes. Une zone toxique peut devenir saine après une longue période de toxicité et inversement.
La phase aiguë d'une recrudescence de Ciguatera classique couvre une période de dix à quinze ans. Les poissons toxiques sont des poissons de récif ou des poissons prédateurs de ces derniers. Les plus dangereux sont les grands prédateurs. À l'intérieur d'une même espèce, plus le poisson est gros, plus il a de chance d'être toxique. Toutes les parties du poisson n'ont pas la même toxicité, le foie et les viscères sont toujours plus toxiques que la musculature. Un poisson très frais peut être toxique. Un poisson peut être toxique à n'importe quelle époque de l'année. Le mode de préparation ou de cuisson ne modifie pas la toxicité.
5. Causes de la Ciguatera
Pendant très longtemps les causes de la maladie sont restées mystérieuses et de nombreuses croyances ont essayé de les expliquer. Certaines sont totalement fantaisistes comme celle affirmant que les vertus toxiques se développent si les poissons ont été exposés au clair de lune. Une autre, encore persistante, suppose qu'une substance chimique contamine le milieu ; le cuivre est le plus souvent impliquée probablement parce que des navires à coque doublée de ce métal ont coulé et parce que des dépôts naturels de cuivre ont été associés à des poissons vénéneux. Cette hypothèse n'explique pas pourquoi des poissons toxiques sont trouvés très loin de ces sources chimiques et pourquoi tous les poissons de la zone ne sont pas dangereux.
Ce n'est que vers 1958 que l'on a commencé à entrevoir la solution en impliquant des toxines sécrétées par des microalgues microscopiques. Les symptômes de la Ciguatera sont dus à l'imbrication plus ou moins marquée d'un mécanisme pharmacologique et d'un mécanisme immunologique résultant de l'action isolée ou conjuguée de toxines ; trois principales ont été mises en évidence.
- La ciguatoxine (C.T.X.) isolée à Hawaï dans les muscles d'une grosse murène et trouvée ensuite chez de nombreux autres poissons. Elle est très active et une dose de 0,1 pg produit des troubles chez l'Homme ;
- La scaritoxine (S.T.X.) isolée à Tahiti en 1976 chez un poisson perroquet (Scarus) est également très toxique ;
- La maitotoxine (M.T.X.) isolée en 1975 au Japon dans les viscères d'un poisson chirurgien. On ne la trouve que dans les viscères des poissons herbivores. Il semble qu'elle puisse se transformer en C.T.X.
Gambierdiscus toxicus Adachi and Fukuyo, 1979 (microalgue dinoflagellée) est l'agent causal principal de la Ciguatera dans la province caraïbe et en Polynésie française. Il a été découvert par T. Yasumoto et R. Bagnis aux îles Gambier à la fin des années 1970. Pour cette raison, les auteurs l'ont appelée Gambierdiscus toxicus.
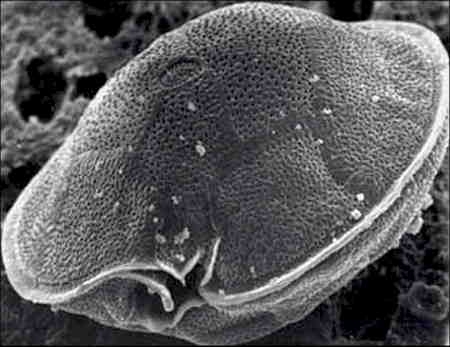
Il s'agit d'un Dinoflagellé appartenant à la classe des Dinophyceae ordre des Péridiniales, famille des Heterolacaceae. Cette microalgue était autrefois rattachée au genre Diplopsalis. D'un diamètre moyen de 80 µm, elle est enveloppée d'une thèque armée et possède une "bouche" profondément échancrée en forme d'encoche oblique, (voir photos). Les auteurs ont pu démontrer que cette microalgue était capable de fabriquer tant en milieu naturel qu'en milieu artificiel les deux toxines (CTX et MTX) responsables de la maladie. Cette microalgue unicellulaire testacée se trouve généralement attachée à des macrophytes qui prolifèrent sur les substrats coralliens morts.
À l'état endémique, l'algue existe dans la plupart des écosystèmes récifaux du Pacifique, de l'Océan indien et des Antilles, mais avec une très faible densité. Le genre Gambierdiscus est caractérisé par une circumdistribution entre 35° N et 35° S. il prolifère sur les coraux morts et les algues brunes en particulier du genre Turbinaria. Remarquons à ce propos que l'espèce Turbinaria turbinata ne se trouve aux Antilles que de la Guadeloupe à la Floride. Elle n'existe pas au Sud et ceci explique peut-être que les accidents ciguatoxiques soient plus fréquents en Guadeloupe et dans les îles du Nord qu'à la Martinique par exemple.
Gambierdiscus est endémique dans des densités relativement faibles dans la plupart des zones de Tahiti. Toutefois, des efflorescences épisodiques de ce dinoflagellé peuvent se produire, et les densités de cellules jusqu'à 10.000 cellules/g de microalgues ont été rapportées occasionnellement. Chacune de ces efflorescences contribue à maintenir un réservoir toxique riche en poison et peut être suivie par des flambées de ciguatera. Les facteurs précis de démarrage de ces efflorescences ont fait l'objet d'une enquête à long terme des populations de Gambierdiscus à Tahiti, de 1993 à 1997. La température joue un rôle important dans le cycle saisonnier de ce dinoflagellé car les populations de Gambierdiscus tendent à atteindre l'abondance maximale pendant la saison chaude (septembre à mars). La morbidité du corail, résultant soit d'événements cycloniques, des épisodes de blanchissement du corail, la pollution marine ou des activités anthropomorphiques, constitue un autre facteur critique dans la genèse naturelle des proliférations de ce dinoflagellé en créant des zones aussitôt colonisées par des macroalgues opportunistes qui sont des hôtes de choix pour les cellules de Gambierdiscus.
En revanche, Gambierdiscus toxicus prolifère énormément dans certaines circonstances, au sein des gazons recouvrant des zones coralliennes mortes. Ainsi après des tempêtes, cyclones, séismes ou par suite de travaux sous-marins en tous genres, de vastes zones de coraux morts peuvent se constituer et permettre la prolifération soudaine de la microalgue. La chaîne alimentaire de la Ciguatera est essentiellement inféodée aux poissons. Il peut cependant arriver que les Mollusques, les Crustacés, les Échinodermes soient touchés.
La toxicité des efflorescences de Gambierdiscus - exprimées en MU/1000 cellules - varie considérablement. Aucune corrélation directe n'a été établie entre cette toxicité et l'efflorescence de la biomasse cellulaire et le caractère saisonnier de divers paramètres environnementaux (température, salinité...).
Le responsable de l'intoxication est donc Gambierdiscus qui constitue la source des puissantes toxines marines vues plus haut. Le problème est que ces composés toxiques vont s'accumuler dans la chaîne alimentaire, depuis les herbivores se nourrissant sur les récifs coralliens jusqu'aux prédateurs de ces herbivores.
La consommation de poissons de récifs qui ont accumulé les divers ciguatoxines induit en quelques heures après le repas toxique, un large éventail de symptômes gastro-intestinaux, neurologiques et cardio-vasculaires. La gravité des symptômes dépend de l'espèce de poisson, du taux de ciguatoxine ingérée et de la susceptibilité individuelle. La physiopathologie est caractérisée par un ensemble de symptômes neurologiques pour lesquels les signes déterminants sont essentiellement des modifications de la sensibilité sensorielle cutanée telles que paresthésies (sur les extrémités et/ou de la zone péri-orale) et dysesthésie (inversion de la perception de chaleur et la froideur). En outre, l'ataxie, arthralgie, myalgie, vertiges, hypersalivation, des démangeaisons et une asthénie plus ou moins durables dans le temps sont des symptômes très fréquents. [Institut Malardé, Tahiti, Site Web, 2002]. Ces efflorescences de Gambierdiscus peuvent être comparées aux marées rouges entraînées par la pullulation de certains dinoflagellés planctoniques des zones tempérées qui fabriquent une variété de toxines connexes, tels que la saxitoxine et la brévétoxine.
Les toxines sont introduites dans la chaîne alimentaire par les poissons herbivores. Si la MTX reste localisée aux contenus digestifs (pour des raisons d'ailleurs inconnues), la CTX se retrouve aussi bien dans le tube digestif que le foie et les muscles des herbivores. La toxine va se concentrer par le jeu de la chaîne alimentaire : on retrouvera donc cette toxine principalement dans les poissons carnivores benthiques et pélagiques. Plus le prédateur sera gros, plus son organisme contiendra de toxines accumulées et plus il sera dangereux. On a en effet démontré qu'un poisson toxique n'éliminait pas ses toxines même si artificiellement en aquarium, on le nourrit plusieurs mois avec de la nourriture privée de substances ciguatoxiques. Ainsi, une "Bécune" (Barracuda) qui mange un "Chirurgien" absorbe dans un seul repas toute l'accumulation de toxines qu'à reçu cet herbivore pendant sa vie.
6. Précautions à prendre pour lutter contre la Ciguatera
- Protéger le milieu marin
Les agressions naturelles du milieu généralement saisonnières ou cycliques entraînent des perturbations écologiques diffuses et passagères responsables de "flambées" épisodiques de Ciguatera. En temps normal donc, seules les espèces de poissons carnivores de très grande taille ont accumulé suffisamment de toxines dans leurs tissus pour être dangereuses à consommer.
En revanche, les agressions anthropiques du milieu marin perturbent considérablement les écosystèmes coralliens. L'aménagement de ports, de marinas, de zones urbanisées, les dragages, la pollution chimique, thermique ou organique croissante, risquent à brève échéance de multiplier les zones où la microalgue toxique pourra pulluler.
- Éviter de consommer les espèces risquant d'être toxiques
D'après I. Pottier (2002), les spécimens toxiques appartiennent à quatre familles de poissons carnivores et de haut niveau trophique : carangues, pagres, mérous et barracudas. Les pourcentages de poissons toxiques pour l'homme s'élèvent à 29 % chez la Carangue gros yeux, 27 % chez la Carangue jaune, et 33 % chez la Carangue noire. Une corrélation positive entre le poids et la toxicité a été trouvée pour l'espèce Carangue gros yeux et pour les pagres toutes espèces confondues. Les poissons carnivores de petite taille appartenant à différentes espèces de Mérous ont montré une toxicité moyenne tandis que les espèces atoxiques sont
- des poissons pélagiques (les Dorades Coryphènes, les Bonites blanches et les Thons rélés),
- des petits mangeurs d'invertébrés ou des microphages,
- les bourses blanches et les vives,
- des poissons appartenant à des espèces à risque mais de petite taille,
- des poissons appartenant à des familles habituellement comestibles.

Dorade coryphène
L'arrêté préfectoral du 22 novembre 1960 interdit la consommation aux Antilles françaises des espèces suivantes :
Sphyraena barracuda : Bécune ou Barracuda.

Sphyraena barracuda
Seriola dumerili : Badiane ou fausse Carangue.

Seriola dumerili
Caranx latus : Carangue gros yeux,"Mayol".

Caranx latus
Caranx bartolomaei : Carangue jaune.

Gymnothorax funebris : Murène verte "Congre vert".

Gymnothorax funebris
Sphaeroïdes greeleyi : "Tchouf Tchouf" "Pelpète".

Sphaeroïdes greeleyi
Les espèces suivantes sont toxiques à Saint Martin et Saint Barthélémy :
Espèces déjà citées ci-dessus.
Mulloidichtys martinicus : "Barbarin blanc" "Souris".

Mulloidichtys martinicus
Scomberomorus regalis : "Thazard".

Scomberomorus regalis
Caranx ruber : Carangue à Pisquette. Carangue franche.

Caranx ruber
Caranx lugubris: Carangue noire.

Caranx lugubris
Malacanthus plumieri : "Vive".

Malacanthus plumieri
Les espèces suivantes sont parfois toxiques à Saint Martin et Saint Barthélémy :
Epinephelus morio : "Nègre" - "Vieille" - "Couronné" - "Tanche".

Epinephelus morio
Epinephelus guttatus : "Vieille rouge".

Epinephelus guttatus
Mycteroperca bonaci : "Vieille".

Mycteroperca bonaci
Mycteroperca venenosa : "Vieille à carreaux".

Mycteroperca venenosa
Echeneis naucrates : "Sucet" ou Rémora. Le rémora est ce poisson qui, grâce à sa ventouse céphalique, se fixe sur un poisson plus gros, notamment un requin.

Echeneis naucrates
Lactophrys bicaudalis : Coffre.

Lactophrys bicaudalis
Lactophrys triqueter : Coffre.

Lactophrys triqueter
Lachnolainus maximus : "Capitaine" "Aigrette".

Lachnolainus maximus
Balistes vetula : "Bourse".

Balistes vetula
- Ne jamais donner suite aux affirmations empiriques supposées distinguer les poissons toxiques des poissons sains
On ne connaît pas à l'heure actuelle aucun test simple et rapide pour détecter la toxicité des poissons ni d'ailleurs de moyens de protection efficaces des consommateurs. Les seules techniques biochimiques que l'on peut utiliser sont incompatibles avec les impératifs d'une commercialisation du poisson.
Il est toujours possible de faire un test sur un chat, mais celui-ci vomit souvent le poisson vénéneux. Par contre Banner et Boroughs ont remarqué que la mangouste est très sensible à la Ciguatera ; elle ne vomit jamais le poisson et montre des symptômes caractéristiques tels que la perte de certains réflexes et l'incoordination des membres postérieurs puis antérieurs. Un coma précède la mort de l'animal.
Quant aux moyens empiriques qui permettraient de détecter une éventuelle toxicité, ils sont très nombreux, plus ou moins fantaisistes et ne doivent pas être pris au sérieux. Citons-en quelques-uns pour mémoire.
On place un objet argenté avec le poisson pendant sa cuisson : si l'objet noircit, le poisson est toxique.
Les mouches évitent les poissons vénéneux ; si les mouches viennent, elles volent de manière désordonnée et meurent.
Si l'on incise la chair du poisson avec un couteau et que l'on arrose la partie incisée avec du jus de citron, la chair noircit si le poisson est vénéneux ; elle blanchit dans le cas contraire.
Si l'on respire profondément au niveau des ouïes du poisson, on doit éternuer si celui-ci est toxique.
- Informer les scolaires, les pêcheurs et la population en général
Les professeurs de SVT ont une mission importante à accomplir vis-à-vis de leurs élèves. En effet à propos de l'étude de la nutrition et des chaînes alimentaires, ils peuvent aisément expliquer les causes de la Ciguatera et les moyens de l'éviter en faisant reconnaître les principales espèces dangereuses grâce à des montages audio-visuels. Un rôle d'information que pourraient reprendre périodiquement les médias : presse écrite et surtout télévision.
Conclusion
Si l'on connaît maintenant l'origine et la transmission de la Ciguatera dans la nature, tous les problèmes sont loin d'être pour autant résolus et on explique encore mal la manière dont l'affection agit sur l'Homme. Les objectifs scientifiques à atteindre sont donc :
- la découverte d'un diagnostic simple, rapide et fiable de la toxicité des poissons avant leur commercialisation ;
- la mise au point d'une méthode de traitement spécifique de la maladie ;
- la prévention de l'intoxication humaine. C'est à la recherche active de ces objectifs, que s'appliquent les équipes travaillant actuellement sur la Ciguatera à Hawaï, au Japon et à Tahiti.
Bibliographie
Adachi R., and Y. Fukuyo. 1979. The thecal structure of the marine toxic dinoflagellate Gambierdiscus toxicus gen. et sp. nov. collected in the ciguatera-endemic area. Bull. J. Soc. Sci. Fish. 45:67-71.
Anderson D.M., and P.S. Lobel. 1987. The continuing enigma of ciguatera. Biol. Bull. 172:89-107.
Baden D., L.A. Fleming, and J.A. Bean. 1994. Marine toxins. In Handbook of Clinical Neurology 21:1-34.
Baden D. G., K.S. Rein, M. Kinoshita, and R.E. Gawley. 1990. Computational modeling of the polyether ladder toxins brevetoxins and ciguatoxin. In T.R.Tosteson (Ed.). Ciguatera. Polyscience Publishing, Quebec.
Bagnis R. 1972. Quand le corail se venge in Science et Vie, septembre 1980.
Bagnis R., A.M. Legrand, and A. Inoue. 1990. Follow-up of a bloom of the toxic dinoflagellate Gambierdiscus toxicus on a ringing reef in Tahiti. Pp. 98-103 in E. Graneli, B. Sundstrom, L. Edler, and D.M. Anderson (Eds.). Toxic Marine Phytoplankton. Elsevier, Amsterdam.
Ballentine, D.L., T.R. Tosteson, and A.T. Bardales. 1988. Population dynamics and toxicity of natural populations of benthic dinoflagellates in southwestern Puerto Rico. Journal of Experimental Marine Biology and Ecology 119:201-212.
Bomber, J.W., M.G Rubio, and D.R. Norris. 1989. Epiphytism of dinoflagellates associated with the disease ciguatera: substrate specificity and nutrition. Phycologia 28:360-368.
Bomber, J.W., R.R.L. Guillard, and W. G. Nelson. 1988. Roles of temperature, salinity and light in seasonality, growth and toxicity of ciguatera-causing Gambierdiscus toxicus Adachi et Fukuyo (Dinophyceae). Journal of Experimental Marine Biology and Ecology 115: 53-65.
Bomber, J.W., D.R. Norris, and L.E. Mitchell. 1985. Benthic dinoflagellates associated with ciguatera from the Florida Keys II. Temporal, spatial and substrate heterogeniety of Prorocentrum lima. Pp. 45-50 in D.M. Anderson, A. White, and D.G. Baden (Eds.). Toxic Dinoflagellates. Elsevier, New York.
De Sylva, D. 1994. Distribution and ecology of ciguatera poisoning in Florida, with emphasis on the Florida Keys. Bulletin of Marine Science 54: 944-954.
Durand-Clement, M. 1986. A study of toxin production by Gambierdiscus toxicus in culture. Toxicon 24:153-1157.
Ébroin A. 1972. Poissons venimeux et vénéneux des Antilles Françaises. Ed. Désormeaux Fort-de-France.
Faust, M.A. 1996. Dinoflagellates in a mangrove ecosystem, Twin Cays, Belize. Nova Hedwiga 112:445-458.
Gillespie, N.C., M.J. Holmes, J.B. Burke, and J. Doley. 1985. Distribution and periodicity of Gambierdiscus toxicus in Queensland, Australia. Pp. 183-188 in D.M. Anderson, A. White, and D.G. Baden (Eds.). Toxic Dinoflagellates. Elsevier, New York.
Holmes, M.J., R.J. Lewis, M.A. Poli, and N.C. Gillespie. 1991. Strain dependent production of ciguatoxin precursors (gambiertoxins) by Gambierdiscus toxicus (Dinophyceae) in culture. Toxicon 29:761-775.
Landsberg, J.H. 1995. Tropical reef-fish disease outbreaks and mass mortalities in Florida, USA: What is the role of dietary biological toxins ? Dis. aquat. org. 22:83-100.
Lawrence, D. N., R.M. Enriquez, A. Lumesh, and A. Maceo. 1980. Ciguatera fish poisoning in Miami. Journal of the American Medical Association 224:224-254.
Lewis S.J. 1992. Ciguatoxins are potent ichthyotoxins. Toxicon 30:207-211.
Morice J. 1961 Liste préliminaire des poissons vénéneux côtiers de l'île de St Barthélémy. Institut des pêches maritimes. Gustavia St Barth.
Palafax, N., L. Jain, A.Z. Pinano, T.M. Gulick, R.K. Williams, and I.J. Schatz. 1988. Successful treatment of ciguatera fish poisoning with intravenous mannitol. Journal of the American Medical Association 259:2740-2742.
Pottier I. (2002). La ciguatera aux Antilles : épidémiologie, analyse de la C-CTX-1 et étude de la diversité des ciguatoxines dans les poissons toxicophores. Université de Caen.
Randall J. 1961. Empoisonnement par des poissons tropicaux. University of Miami Florida.
Renoux G. 1982. La Ciguatera. Bull. APBG Guadeloupe 9:68-75.
Shimizu Y. 1987. Dinoflagellate toxins. In F.J.R. Taylor (Ed.). The Biology of Dinoflagellates. Blackwell Scientific Publications, Oxford.
Stauch A. 1981. La Ciguatera. Une maladie causée par l'absorption d'aliments d'origine marine. F.A.0. Port au Prince Haïti.
Steidinger, K.A. 1993. Some taxonomic and biologic aspects of toxic dinoflagellates. In I. Falconer (Ed.). Algal Toxins in Seafood and Drinking Water. Academic Press, New York.
Tindall, D.R., and S.L. Morton. 1998. Community dynamics and physiology of epiphytic/benthic dinoflagellates associated with ciguatera. In D.M. Anderson, A.D. Cembella, and G.M. Hallegraeff (Eds.). Physiological Ecology of Harmful Algal Blooms. Springer-Verlag, Berlin.
Tomas, C. 1996. An overview of toxic episodes in the Western Hemisphere. In D. Baden (Ed.). Proceedings of the Workshop Conference on Seafood Intoxications: Pan American Implications of Natural Toxins in Seafood.
Pour en savoir plus sur le web
http://www.ilm.pf/ : la page de l'Institut Louis Malardé de Papeete
http://www.com.univ-mrs.fr/IRD/atollpol/glossaire/cigua.htm
http://www.tahiti1.com/fishing/ciguatera-fr.htm
18:03 Publié dans Nature et santé, Pollution | Tags : ciguatera, poissons toxiques, ichtyosarcotoxisme, poissons tropicaux, gambierdiscus, polynésie, pacifique, atlantique | Lien permanent | Commentaires (4) | ![]() Facebook | | |
Facebook | | |
20/12/2009
Le campagnol terrestre - Prévention et contrôle des populations
Le campagnol terrestre : une lutte raisonnée
Vient de paraître :

L'attaque exclusivement chimique, notamment par la bromadiolone, contre le campagnol terrestre qui pullule cycliquement en engendrant des dégâts dans les prairies, n'est pas la seule alternative.
L'ouvrage de Patrick Giraudoux, professeur d'écologie au laboratoire Chrono-environnement de l'université de Franche-Comté, et de Pierre Delattre, ancien directeur de recherche de l'INRA, en fait la preuve. Il relate comment la compréhension des dynamiques des populations en fonction des modifications des environnements et des pratiques agricoles peut faire naître des outils professionnels de lutte contre les pullulations respectueux de la nature et de la santé de l'homme.
En ce sens, il dépasse largement le cadre du campagnol et milite pour la mise en place d'un dispositif d'intelligence environnementale prenant en compte le questionnement écologique dans une réflexion globale relative au fonctionnement des systèmes agronomiques.
Delattre P., Giraudoux P. : Le campagnol terrestre - Prévention et contrôle des populations.
Editeur : Quae éditions, Collection : Savoir faire ISBN : 978-2-7592-0386- EAN : 9782759203864 263 pages. 38 €.
Contact : Patrick Giraudoux, Laboratoire Chrono-environnement, Université de Franche-Comté.
Tél. (0033/0) 3 81 66 57 45.
Voir également :
Les ravageurs de pâture en Franche-Comté
Lutte contre le Campagnol terrestre en Franche-Comté
04:36 Publié dans Livres, Mammifères, Médecine, Nature et santé | Tags : campagnol terrestre, giraudoux, delattre | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
08/12/2009
Les CHU de Besançon et de Dijon renforcent leur coopération
Les CHU de Besançon et de Dijon renforcent leur coopération

Le CHU de Besançon
Le 14 mai 2009, les CHU de Dijon et Besançon, auxquels se sont jointes les deux universités de Bourgogne et de Franche-Comté qui leur sont intimement liées dans les domaines de la recherche et de l'enseignement, signaient un accord cadre de partenariat. Cet accord intervient dans un contexte législatif et réglementaire en pleine évolution, dont l'objectif est de créer des synergies hospitalo-universitaires pour optimiser renseignement et développer la recherche loi relative aux libertés et responsabilités des universités (LRU), loi Hôpital patient santé territoire (HPST). Il intervient également alors que tout engage à se positionner au niveau européen (constitution du réseau Métropolitain Rhin-Rhône, réflexion en cours sur la redéfinition des circonscriptions administratives et territoriales).
Ensemble, les deux CHU desservent une population de 3 790 000 habitants et représentent un poids économique important (12 000 salariés et un budget de 1 milliard d'euros). Grâce à ce partenariat, ils constituent :
- un axe hospitalier de premier plan avec 2 300 lits de court séjour, plus de 76 000 séjours et 118 000 passages aux urgences
- une offre de formation qui s'adresse à 4 600 étudiants en médecine et 1160 en pharmacie auxquels s'ajoutent quelque 1 500 étudiants fréquentant les écoles attachées aux deux établissements
- un potentiel de recherche prometteur avec des centres d'investigation clinique (CIC) sur les deux sites, un centre de ressources biologiques commun, plus de 150 personnes (hors personnel médical) dédiées à la recherche...
Des liens étroits unissent les universités de Bourgogne et de Franche-Comté qui, en mai 2007, ont constitué un pôle de recherche et d'enseignement supérieur (PRES). De même, il existe déjà de nombreuses collaborations entre les deux CHU. L'objectif de cet accord est de les formaliser tout en invitant les équipes à en faire émerger de nouvelles. En matière de soin, cela permettra à la population des deux régions de bénéficier des derniers acquis du progrès médical, de conforter les domaines d'excellence des deux établissements et de faire émerger de nouvelles modalités de prise en charge. Cette collaboration sera pilotée par un bureau inter CHU réunissant les responsables hospitaliers et universitaires.
Le Pôle interrégional de gérontologie
Implanté à Besançon, le Pôle interrégional de gérontologie Bourgogne Franche-Comté est destiné à améliorer de la qualité de vie des personnes âgées. La structure a une quadruple mission : développer la recherche dans les domaines de la nutrition, de la motricité ou encore la psychogériatrie, valoriser ces travaux auprès des industriels comme dans le secteur du biomédical, développer la formation au niveau de la prise en charge des personnes âgées et participer au développement des soins aux aînés.

08:50 Publié dans Médecine, Nature et santé | Tags : santé, chu, franche-comté | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
11/10/2009
Alzheimer : ça se précise
Alzheimer : ça se précise
par Jean-Jacques Perrier (journaliste à "Pour la Science")
Deux études génétiques de grande envergure précisent le mécanisme hypothétique de la maladie d'Alzheimer.
Pour mieux comprendre les causes de la maladie d'Alzheimer, les chercheurs réalisent des études génétiques dites d'association. Ils comparent des milliers de mutations ponctuelles d'ADN variant entre individus, des marqueurs nommés SNP, chez un grand nombre de malades et de personnes en bonne santé. Dans la forme sporadique de la maladie d'Alzheimer, qui représente 97 pour cent des cas, le seul facteur génétique de prédisposition confirmé dans toutes les études a été découvert en 1993 : il s'agit d'une forme du gène codant l'apoliprotéine E (ApoE), l'allèle epsilon 4. Depuis, rien n'a vraiment émergé de concluant… jusque récemment.
Grâce à des études dites pangénomiques, qui analysent les 23 paires de chromosomes dans leur ensemble, deux consortiums internationaux ont analysé et comparé près de 600 000 marqueurs chez plus de 20 000 personnes. Le travail coordonné par Philippe Amouyel, à l'Institut Pasteur de Lille (Inserm U744), révèle l'implication de deux gènes, celui de la clusterine et celui codant une protéine contribuant au système immunitaire, CR1 (récepteur 1 du composant 3b/4b du complément). Et l'étude coordonnée par Julie Williams, à l'Université de Cardiff, montre une association avec le gène de la clusterine, là encore, et avec le gène codant la protéine PICALM (phosphatidylinositol-binding clathrin assembly protein).
Des résultats précédents, et d'autres en cours de publication, suggèrent que les deux premières protéines (la clusterine et CR1) interviennent, avec l'ApoE, dans l'élimination du peptide bêta-amyloïde (PICALM est quant à elle impliquée dans le fonctionnement des synapses, les connexions entre neurones). Or, selon l'explication la plus commune de la maladie, l'accumulation du peptide bêta-amyloïde provoque l'une des lésions cérébrales caractéristiques : les plaques séniles (voir Pour oublier la maladie d'Alzheimer, Pour la Science, août 2006). La forme tardive d'Alzheimer serait ainsi associée à une élimination insuffisante de cette molécule du cerveau, tandis que les formes héréditaires, plus précoces, seraient liées à sa surproduction.
22:40 Publié dans Médecine, Nature et santé | Tags : santé, alzheimer | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
03/10/2009
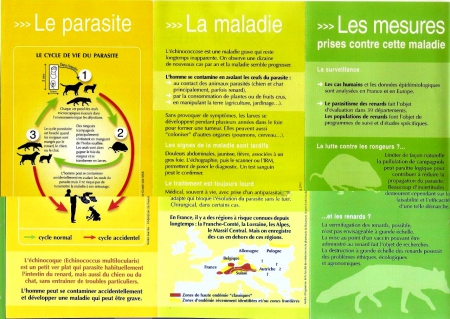
L’échinococcose alvéolaire : une maladie franc-comtoise ? Généralités
 1. Généralités : parasitose et agent de la parasitose
1. Généralités : parasitose et agent de la parasitose
par André Guyard
(Voir la suite de l'article : 2. Le cycle parasitaire de l'échinoccose)
L’échinococcose alvéolaire constitue une parasitose relativement rare en Europe, où elle tend cependant à augmenter, elle se concentre principalement en Franche-Comté (en particulier le Haut-Doubs), en Suisse et en Allemagne.
L’échinococcose alvéolaire (EA) est une parasitose due à un ver plat, Echinococcus multilocularis une espèce de ténia échinocoque appartenant au phylum des Plathelminthes et à la classe des Cestodes.
Les Plathelminthes (Vers plats) sont des Métazoaires (animaux pluricellulaires) à corps aplati dans lequel les différents organes sont inclus au sein d’un tissu mésenchymateux. Leur appareil digestif est nul ou incomplet. Leur appareil excréteur est constitué de cellules à flammes vibratiles et ils sont généralement hermaphrodites.
À côté de la classe des Turbellariés (planaires) dont les espèces sont libres et aquatiques, les autres Plathelminthes sont des parasites possédant des organes de fixation (ventouses ou crochets). Ils se divisent en deux grands groupes :
- les Trématodes au tube digestif incomplet et dont le corps n’est pas segmenté (ex : douves, bilharzies),
- les Cestodes dépourvus de tube digestif et dont le corps est segmenté (ex : ténias).
Le développement dans l’organisme humain ou de certains animaux de la larve d’Echinococcus multilocularis provoque un ensemble de manifestations pathologiques connues comme l’échinococcose alvéolaire (EA), cette entité morbide se différenciant fondamentalement de l’échinococcose hydatique, cette dernière affection étant due à Echinococcus granulosus, un autre ténia échinocoque.

Quand le dernier anneau du parasite est mûr, il se détache, et les œufs ou embryophores qu’il renferme se trouvent éliminés avec les excréments du Renard dans le milieu extérieur.
Les embryophores arrondis mesurent de 30 à 35 μm de diamètre ; à l’intérieur d’une coque épaisse se trouve l’embryon muni de six crochets (embryon hexacanthe).
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
- Guyard A. - Cours de parasitologie. 1980.
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
19:49 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (2) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? Le cycle parasitaire
 2. Le cycle parasitaire de l'échinocoque
2. Le cycle parasitaire de l'échinocoque
par André Guyard
(suite de l'article 1 : l'échinoccose : une maladie franc-comtoise)
Dans la première partie, nous avons vu que c’est le scolex du ver adulte qui bourgeonne les anneaux, le plus jeune anneau étant celui le plus proche de la tête. La longévité du parasite est assez courte puisqu’elle est de l’ordre de 3 à 4 mois.
Quand le dernier anneau du parasite est mûr, il se détache, et les œufs ou embryophores qu’il renferme se trouvent éliminés avec les excréments du Renard dans le milieu extérieur.
Les embryophores arrondis mesurent de 30 à 35 μm de diamètre ; à l’intérieur d’une coque épaisse se trouve l’embryon muni de six crochets (embryon hexacanthe).
Pour poursuivre son cycle biologique, l’embryophore doit être avalé par des rongeurs, essentiellement des microtidés (mulots ou campagnols).

M. arvalis et A. terrestris sont les deux hôtes intermédiaires les plus fréquents de E. multilocularis.
Chez ces hôtes intermédiaires, la morphogenèse larvaire est rapide. La coque de l’embryophore dissoute dans l’estomac, l’embryon hexacanthe est libéré et traverse la paroi intestinale pour gagner le foie par l’intermédiaire du système veineux porte.
La larve d’Echinococcus multilocularis occupe ainsi essentiellement une localisation hépatique, alors que pour la larve d’Echinococcus granulosus, agent de l’échinococcose hydatique, cette localisation est loin d’être exclusive. En 3 à 5 mois, selon le caractère plus ou moins favorable de l’hôte intermédiaire, la larve achève son développement.
Les lésions de l’EA sont très caractéristiques par leur caractère diffus et envahissant, l’absence de formation fibreuse adventicielle ne permettant pas une limitation de l’extension de la tumeur parasitaire comme dans le cas du kyste hydatique.
Le foie, envahi par une multitude de petites vésicules fertiles contenant des protoscolex, présente un aspect dit de "pain bis". Ce bourgeonnement de vésicules correspond à une multiplication larvaire, un véritable clonage.
Au-dessus des reins, on observe,
L’intensité de la multiplication des protoscolex est impressionnante (cliché Patrick Giraudoux)
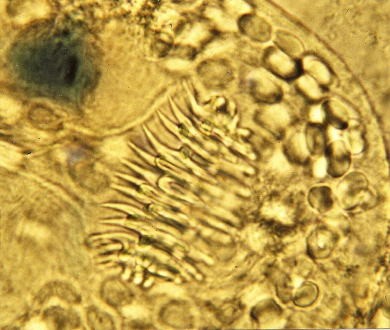


(Document : plaquette de l’Observatoire de l’environnement)
Les renards ne sont pas les uniques responsables de la transmission de l'échinococcose à l'Homme, pas plus que la prairie ou la forêt ne sont ses seuls terrains de prédilection. D'abord, les renards n'hésitent plus à sortir du bois pour trouver de la nourriture facile dans les poubelles, et amènent l'échinocoque jusque dans les villes et les villages. Ensuite, les chats et les chiens peuvent être parasités et transmettre la maladie lors de séances de léchage intempestif ou par l'intermédiaire de leurs excréments infestant la terre. La pratique du jardinage est donc susceptible de favoriser la contamination. Protéger son potager de l'intrusion d'animaux est un impératif. Fermer les bacs à sable des enfants également.

Le Renard est un grand prédateur de campagnols
Cliché DR
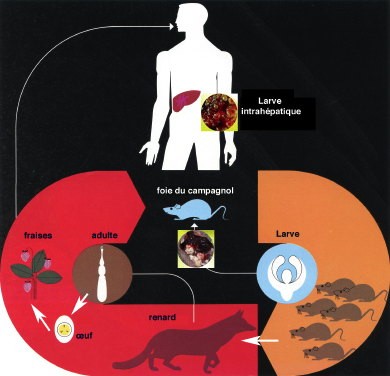
(D’après : Parasitologie, documentation scientifique des laboratoires Roland-Marie)
Bibliographie sommaire :
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr.
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
11:28 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (3) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? La répartition géographique
 3. La répartition géographique de l’échinococcose alvéolaire
3. La répartition géographique de l’échinococcose alvéolaire
par André Guyard
(dernière mise à jour : juillet 2012)
(suite de l'article 2 : le cycle parasitaire)
La répartition géographique d’Echinococcus multilocularis est très particulière. La parasitose ne se rencontre que dans l’hémisphère nord : Eurasie (Sibérie avant tout), Europe centrale (Bulgarie, Pologne, Yougoslavie) et surtout dans la Bavière et le Tyrol. C’est à partir de ce dernier foyer que l’affection s’est propagée vers la Suisse et la France.
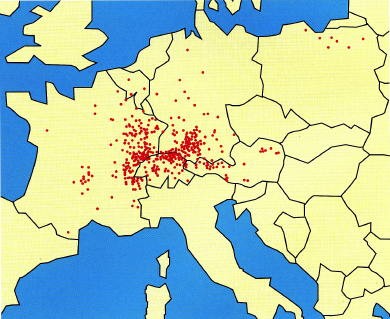
Répartition des cas humains en Europe de 1982 à 2001
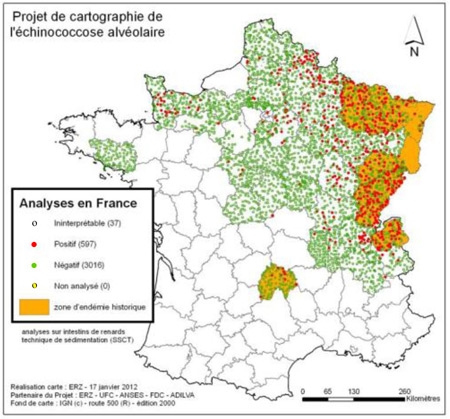
Analyses sur intestins de renards en France (SSCT)
(ERZ, janvier 2012)
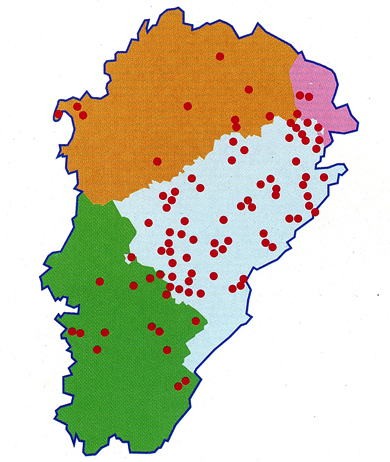
Répartition des 117 cas humains en Franche-Comté
Un réseau européen, constitué en 1997, a permis de répertorier 559 cas d’EA, diagnostiqués entre 1982 et 2000, dont 258 en France (principalement en Franche-Comté, Lorraine, Rhône-Alpes). Depuis 2002, ce réseau est relayé, en France, par le réseau FrancEchino : grâce à un partenariat avec l’Institut de Veille Sanitaire (InVS), tous les nouveaux cas humains d’EA sont enregistrés au CHU de Besançon.
Entre 2001 et 2005, 70 nouveaux cas ont été recensés, avec une incidence annuelle stable : en moyenne 15 nouveaux cas par an. 85 % de ces patients sont originaires des zones d’endémie classique de l’est de la France. Cependant, la localisation de nouveaux patients semble indiquer une extension des foyers de transmission vers le sud (Aveyron, Lozère), l’ouest et le nord (Côte d’Or et Ardennes). L’EA touche essentiellement les personnes ayant un mode de vie rural.
Les études pluridisciplinaires conduites en France et en Chine ont montré que la transmission du parasite et l’exposition humaine sont dues à un ensemble complexe de facteurs écologiques et comportementaux dont l’analyse doit être réalisée à plusieurs échelles spatiales et temporelles.
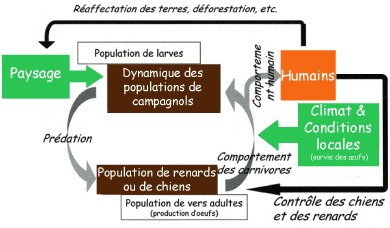
(D'après P. Giraudoux)
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
10:51 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? Évolution épidémiologique et options de contrôle
 4. L’échinococcose alvéolaire : évolution épidémiologique et options de contrôle
4. L’échinococcose alvéolaire : évolution épidémiologique et options de contrôle
par André Guyard
(Suite de l'article 3 : répartition géographique)
De nombreux éléments indiquent que la situation épidémiologique de l’EA est en train de changer en Europe. On note depuis 1990 une augmentation de la prévalence chez le Renard et l’extension vers le nord de l’aire de distribution du parasite.
À l’heure actuelle, la présence du parasite a été démontrée chez le Renard au Danemark, aux Pays-Bas, en Belgique et de l’ouest au sud de la France (dont les côtes de la Manche et et la région parisienne), jusqu’à la Lithuanie, en passant par la Pologne, la Slovaquie, la Hongrie, et le nord de l’Italie.
Pour la France, on a pu montrer qu’entre les périodes 1984-1989 et 1996-1999, les prévalences vulpines étaient de 1,4 à 2 fois plus élevées dans les zones d’endémie traditionnelles comme le Haut-Doubs pour atteindre 65 % en hiver, une tendance également constatée dans le sud de l’Allemagne et l’Autriche.

(Document : plaquette de l’Observatoire de l’environnement)
Cette nouvelle situation explique que de fortes prévalences puissent maintenant être observées chez le Renard dans les zones qui ne sont pas connues pour leurs pullulations de rongeurs. C’est le cas par exemple dans les Ardennes, où une prévalence de 53 % a été observé chez le Renard, dans des paysages où les prairies sont fragmentées avec des populations d’hôtes intermédiaires faibles et stables.
Cette augmentation des populations de renards s’est également accompagnée de changements de comportements. Le Renard roux n’est plus seulement rural mais est devenu aussi urbain, ce qui s’est traduit par une implantation du parasite, non seulement aux abords et dans les villages et petites villes des zones traditionnelles d’endémie, mais aussi dans les grandes villes, où elle peut atteindre localement jusqu’à 70 % des animaux dans leur périphérie. L’infestation des renards a été observée à Zurich, Stuttgart, Genève, Copenhague, Nancy et la banlieue parisienne telle qu’en Seine-et-Marne. Quant au cycle urbain entre chats et souris, il est tout à fait exceptionnel.

Par exemple, l’analyse génétique de la population de renards urbains zurichois montre que les échanges avec l’extérieur de la ville sont limités. La présence avérée d’A. terrestris infestés dans les parcs urbains indique que le cycle pourrait y être bouclé. La densité des chiens urbains peut atteindre de 0,5 à 5 individus/ha dans certaines villes, et celle des chats trois fois plus, ce qui rend très probable la prédation de rongeurs infestés.
Dans le contexte rural du canton de Fribourg (Suisse), il a été montré que 7 % des chiens errants et 3 % des chats examinés lors d’un cycle de pullulation d’A. terrestris étaient infestés. Le rôle des chiens et des chats dans l’exposition humaine en Europe, si ce n’est dans le maintien du cycle lui-même, mériterait d’être clarifié notamment dans un contexte urbain.
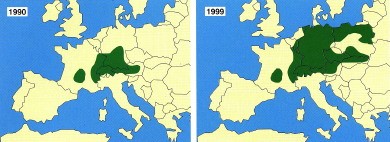
(Document : plaquette de l’Observatoire de l’environnement)
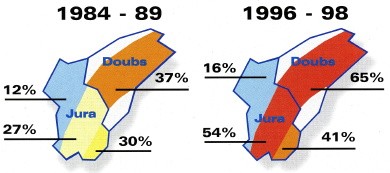
(Document : plaquette de l’Observatoire de l’environnement)
La régulation par le tir ou le piégeage n’est pas à recommander car, au-delà, des controverses qu’elle peut susciter, elle pourrait conduire à l’effet inverse de celui escompté, en vidant des territoires qui seraient alors très rapidement comblés par des renards ruraux plus infestés, comme ce fut le cas pour la rage.
S’il est évident que l’échinocoque alvéolaire est un parasite qui étend son aire de distribution et augmente l’intensité de sa transmission en Europe, les données qui permettraient de constater un changement de l’épidémiologie humaine sont encore fragmentaires. Ceci peut s’expliquer soit par le fait que ce changement n’entraîne pas, pour des raisons comportementales (hygiène et mode de vie, etc.), une exposition plus forte de la population humaine en ville, soit plus probablement par le fait que l’échinococcose alvéolaire est une maladie longtemps asymptomatique et que les conséquences d’un changement d’exposition ne seront mesurées que plusieurs années après (voir plus bas).
Il serait judicieux que dans l’ensemble des zones européennes concernées, puisse être assuré le meilleur couplage entre un dispositif de surveillance de la parasitose chez les hôtes définitifs (principalement Renard et Chien), seul capable d’anticiper le risque d’exposition, et un dispositif de surveillance de la maladie humaine, qui malheureusement et pour utile qu’il soit en terme d’épidémio-surveillance, ne permet que de constater a posteriori le problème de santé publique posé après que la maladie se soit déjà largement développée.
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
- Guyard A. - Cours de parasitologie. 1980.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
09:03 Publié dans Médecine, Nature et santé, Parasitologie | Tags : parasites | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? La clinique de l'échinococcose alvéolaire
 5. La clinique de l'échinococcose alvéolaire
5. La clinique de l'échinococcose alvéolaire
par André Guyard
(suite de l'article : évolution épidémiologique)
Chez l’Homme, la localisation de l’EA est pratiquement toujours hépatique. Les lésions faites d’une multitude de vésicules communiquant entre elles et donnant à la masse kystique son aspect classique en "pain bis", s’accompagnent chez l’Homme, hôte tout à fait inhabituel des larves, de phénomènes dégénératifs avec nécrose, qui n’empêchent pas le cheminement germinatif ni l’extension des vésicules.
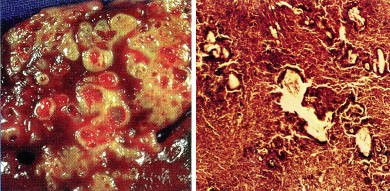
Cependant, dans les quelques rares cas où l’on a constaté de véritables métastases pulmonaires et même cérébrales d’un foyer hépatique initial, on a découvert des scolex au niveau de ces métastases.
D’une façon générale, on pense que ces lésions secondaires sont dues à la mobilisation de petits fragments de membranes issus des vésicules primitives. Entraînés dans le torrent circulatoire, ces fragments finiraient par s’immobiliser dans différents organes et ils y constitueraient le point de départ de nouveaux foyers kystiques.
La biopsie du foie utilisée pour assurer le diagnostic de l’EA, doit par conséquent être faite avec une certaine prudence.
La symptomatologie de l’EA est très discrète au début et cela explique la difficulté d’un diagnostic précoce de l’affection. Ce n’est le plus souvent qu’à un stade plus avancé et tout spécialement lorsque les voies biliaires sont atteintes (cette évolution étant d’ailleurs quasi inéluctable) que la symptomatologie devient expressive.
La parasitose se traduit alors par un ictère de type cholestatique. L’amaigrissement rapide et la constatation à la palpation d’un foie dur et irrégulier évoquent habituellement le cancer du foie métastatique, à moins que les examens biologiques spécifiques ne rétablissent le diagnostic exact.
Dans les autres éventualités cliniques, tout comme au début de l’affection, si l’attention peut être attirée vers le foie par les douleurs de l’hypocondre droit et les troubles dyspeptiques, il est exceptionnel de pouvoir établir le diagnostic d’après la seule clinique.
Il faut savoir ne pas s’arrêter au diagnostic de cancer métastatique du foie et évoquer l’EA. On doit alors s’aider des examens biologiques et d’imagerie médicale adéquats d’autant plus que, lorsque les voies biliaires n’ont pas été manifestement envahies, on peut espérer que les lésions hépatiques sont suffisamment localisées pour permettre de tenter une hépatectomie réglée, capable d’assurer une guérison totale et définitive. La notion d’endémicité dans la région habitée par le malade, celle de contact de ce dernier avec des renards revêtent une grande valeur d’orientation.
- Giraudoux P. et al – Où l’échinoccose sévit-elle ? Bull. Acad. Natle Méd. 2008, 192, n° 6, 1119-1130.
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
- Guyard A. - Cours de parasitologie. 1980.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
08:12 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? Le diagnostic
 6. Le diagnostic de l'échinococcose alvéolaire
6. Le diagnostic de l'échinococcose alvéolaire
par André Guyard
(suite de l'article 5 : la clinique de l'échinoccose alvéolaire)
Le diagnostic biologique proprement dit comporte la recherche d’une éosinophilie sanguine, la pratique d’une intradermoréaction spécifique, l’examen anatomopathologique du foie et un certain nombre de réactions sérologiques.
L’éosinophilie sanguine lorsqu’elle existe est très évocatrice d’une étiologie parasitaire ; elle est malheureusement inconstante et non spécifique ; elle peut en outre avoir déjà disparu au moment où la symptomatologie clinique devient patente.
Le test de sensibilisation cutanée pratiqué sous forme d’intradermoréaction à l’aide, non pas d’antigène spécifique, mais d’antigène hydatique, ne possède pas de valeur décisive car, malgré la relative parenté antigénique entre Echinococcus granulosus et Echinococcus multilocularis, la réponse à l’antigène hydatique au cours d’une EA est de faible intensité.
Le risque de déclencher, à l’occasion d’une biopsie hépatique, une échinococcose secondaire, bien que considérablement réduit par rapport à l’hydatidose, existe cependant.
Les méthodes sérologiques classiques de fixation du complément, d’agglutination en utilisant différents supports, d’immunoprécipitation, requièrent un antigène soluble difficile à préparer et à purifier. La plupart du temps, on n’utilise pas un antigène alvéolaire spécifique et on se contente des antigènes hydatiques plus aisément disponibles. On comprend que dans ces conditions, les réactions sérologiques soient entachées d’un manque de sensibilité.
Le meilleur test biologique actuel est constitué par la réaction d’immunofluorescence. Dans cette réaction, on utilise comme antigène figuré des coupes de tumeur d’origine humaine ou animale réalisées par congélation au cryostat. Après la mise en contact de ces coupes avec le sérum du malade suspecté d’EA et l’adjonction du conjugué fluorescent, on procède à une contre coloration à l’aide de bleu Evans.
Lorsque la réaction est positive, les membranes germinatives kystiques présentes sur la coupe congelée montrent une intense fluorescence. En cas de réaction négative, les mêmes membranes germinatives apparaissent en rouge. Mis en présence de coupes de scolex d’Echinococcus granulosus, le sérum de malades atteints d’EA manifeste dans les mêmes conditions expérimentales une réaction d’immunofluorescence positive, mais à un titre inférieur.
Cette différence dans le comportement du sérum vis-à-vis des deux antigènes permet d’envisager de faire le diagnostic différentiel entre les deux échinococcoses.
Les examens par échographie, scanner et IRM sont particulièrement intéressants lors de l’établissement du bilan préopératoire. Leur contribution au diagnostic étiologique n’est cependant pas négligeable.
De nouveaux marqueurs pour pister l'échinococcose humaine (Addition du 05/07/2011)
L'échinococcose soulève encore de nombreuses questions au sein de la communauté scientifique. Si l'on sait détecter la maladie, on ne connaît en revanche pas bien son aspect fonctionnel. Sur des territoires particulièrement touchés par cette parasitose en Europe, l'université de Franche-Comté et l'université de Berne font preuve de recherches très actives. Un projet franco-suisse vient d'obtenir un soutien financier dans le cadre du programme Interreg, visant à améliorer les résultats obtenus grâce à une technique d'imagerie médicale particulièrement adaptée, la tomographie par émission de positons (TEP).
Relativement rare en Europe, où elle tend cependant à augmenter, l'échinococcose, se concentre principalement en Franche-Comté, en Suisse et en Allemagne. Un tiers des patients atteints sont guéris par chirurgie (ablation de la partie de foie infecté), deux tiers doivent supporter un traitement à vie. Une centaine de patients venus de toute la France sont actuellement suivis au CHU de Besançon, centre collaborateur de l'OMS pour toutes les échinococcoses humaines. La tomographie par émissions de positons (TEP) est la technique d'imagerie fonctionnelle employée pour dépister la maladie, à l'aide de traceurs radioactifs introduits dans l'organisme. Le fluoro-deoxyglucose (FDG) est le plus couramment utilisé. Rendu radioactif par un marquage au fluor, ce glucose est détecté par la caméra TEP alors qu'il se concentre autour de la lésion. Car les cellules de défense de l'organisme, très actives à l'endroit précis de l'infection, "attirent" à elles le glucose, énergie qu'elles consomment en grande quantité pour être efficaces. Conclusion : là où se trouve le glucose se trouve aussi la lésion.
La recherche s'oriente vers la mise au point de nouveaux traceurs, des molécules susceptibles d'être consommées directement par le parasite et par lui seul. « On pourra alors directement étudier la maladie et connaître le comportement du parasite pour mieux le détruire » explique Okg Blagoskionov, médecin et enseignant-chercheur en imagerie médicale à l'Université de Franche-Comté. L'espoir de mettre au point un nouveau traitement, permettant d'éradiquer l'échinocoque, est à la clé de ces recherches. Le projet IsotopEchino participe à la réalisation de ces travaux, intègre le financement de thèses, notamment en cotutelle avec des universités en Chine, où la parasitose est très répandue. Les fonds octroyés s'élèvent à 249 905 € pour la participation FEDER et 68 343 € pour les subventions suisses, sur un coût total de 815 972 €.
*Contact : Oleg Blagosklonov – Service de médecine nucléaire - CHU Jean Minjoz de Besançon Tél. (0033/0) 3 8l 66 82 94 - oleg-blagoskIonov.univ-fcomte.fr.
Bibliographie sommaire :
- Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
- Mantion G. et al – Le traitement de l’échinococcose alvéolaire humaine : une approche multidisciplinaire. Bull. Acad. Natle Méd. 2008, 192, n° 6, 1151-1158.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
07:20 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
L’échinococcose alvéolaire : une maladie franc-comtoise ? Le traitement
 7. Le traitement de l'échinoccose alvéolaire
7. Le traitement de l'échinoccose alvéolaire
par André Guyard
(suite de l'article 6 : le diagnostic de l'échinoccose alvéolaire)
On ne connaît encore aucun traitement médical réellement efficace de l’échinococcose alvéolaire. Cette parasitose est caractérisée par une grande latence clinique mais en l’absence de traitement, la mortalité atteint 80 % dans les dix ans après le diagnostic. Ceci est dû à l’absence de traitement médicamenteux totalement et rapidement efficaces à l’heure actuelle.
Un tiers des patients atteints sont guéris par chirurgie (ablation de la partie de foie infecté), deux tiers doivent supporter un traitement à vie. Une centaine de patients venus de toute la France sont actuellement suivis au CHU de Besançon, centre collaborateur de l’OMS pour toutes les échinococcoses humaines.
La chirurgie d’exérèse est actuellement la seule thérapeutique capable d’apporter la guérison, à la condition qu’elle soit appliquée le plus tôt possible, avant l’extension incontrôlable des lésions. L’hépatectomie réglée segmentaire ou à la rigueur lobaire sur des lésions encore localisées amène ainsi la guérison définitive. La chirurgie demeure le premier choix pour guérir environ 30 % des patients en retirant toute la masse parasitaire avec une marge de sécurité suffisante et dans un certain nombre de cas avec des procédés complexes de reconstruction vasculaire et biliaire.
La transplantation hépatique peut être indiquée si une hépatectomie partielle est insuffisante pour obtenir la guérison chez des patients très sélectionnés présentant des complications sévères menaçant leur vie (environ 5 % des cas).
Les procédures d’endoscopie interventionnelle sont utiles pour drainer les abcès intrahépatiques ou les voies biliaires quand l’exérèse chirurgicale n’est pas possible ou pour préparer celle-ci.
Dans tous les cas, le traitement parasitostatique par les dérivés benzimidazolés, principalement l’albendazole, en administration continue est recommandé pendant deux ans après résection radicale ou à vie pour les patients inopérables.
L’albendazole est une molécule utilisée chez tous les malades.
Ce produit stoppe l’évolution du parasite mais
malheureusement, ne le tue pas. Il doit être pris à vie.

Traitement de l’échinoccose alvéolaire en Franche-Comté
Taux de survie à 5 ans des malades diagnostiqués et traités
(Document : plaquette de l’Observatoire régional de l’environnement).
La tomographie par émissions de positons (TEP) est la technique d’imagerie fonctionnelle employée pour dépister la maladie, à l’aide de traceurs radioactifs introduits dans l’organisme. Le fluoro-deoxyglucose (FDG) est le plus couramment utilisé. Rendu radioactif par un marquage au fluor, ce glucose est détecté par la caméra TEP alors qu’il se concentre autour de la lésion. Car les cellules de défense de l’organisme, très actives à l’endroit précis de l’infection, « attirent » à elles le glucose, énergie qu’elles consomment en grande quantité pour être efficaces. Conclusion : là où se trouve le glucose se trouve aussi la lésion.
L’antigénothérapie aurait, dans les mains de ses promoteurs, apporté des rémissions passagères, sans toutefois modifier de façon radicale le pronostic de l’échinococcose alvéolaire dont l’évolution spontanée est toujours mortelle, bien que parfois extrêmement prolongée.
La recherche s’oriente vers la mise au point de nouveaux traceurs, des molécules susceptibles d’être consommées directement par le parasite et par lui seul. « On pourra alors directement étudier la maladie et connaître le comportement du parasite pour mieux le détruire » explique Oleg Blagosklonov, médecin et enseignant-chercheur en imagerie médicale à l’université de Franche-Comté. L’espoir de mettre au point un nouveau traitement, permettant d'éradiquer l'échinocoque, est à la clé de ces recherches.
Le projet IsotopEchino participe à la réalisation de ces travaux, intègre le financement de thèses, notamment en cotutelle avec des universités en Chine, où la parasitose est très répandue.
Quoi qu’il en soit des chances de la chirurgie d’exérèse et peut-être demain d’une antigénothérapie rénovée, à laquelle la possibilité récemment démontrée de pouvoir cultiver les larves d’Echinococcus multilocularis contribuera sans doute, l’échinococcose alvéolaire reste une affection très grave.
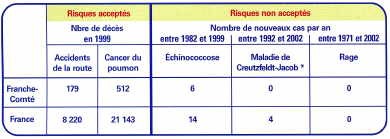
Mais les cas humains restent peu nombreux.
Sur le plan individuel, il faut éviter, dans les régions endémiques, de consommer crus des fruits sauvages et d’être en contact avec les animaux susceptibles d’être porteurs du parasite adulte. Il est bon aussi de vermifuger régulièrement chats et chiens.
Bibliographie sommaire :
Mantion G. et al – Le traitement de l’échinococcose alvéolaire humaine : une approche multidisciplinaire. Bull. Acad. Natle Méd. 2008, 192, n° 6, 1151-1158.
Observatoire régional de l’environnement Besançon – Du renard au pissenlit, l’échinoqui ? Du pissenlit au campagnol, l’échinoquoi ? Plaquette d’information de l’Observatoire régional de l’environnement. 2004, 12 p.
Guyard A. - Cours de parasitologie. 1980.
Contacts :
• Centre Collaborateur OMS pour la Prévention et le Traitement des Echinococcoses humaines, Centre hospitalier universitaire et Université de Franche-Comté, patrick.giraudoux@univ-fcomte.fr
• Laboratoire d’études et de recherches sur la rage et la pathologie des animaux sauvages, AFSSA, Domaine de Pixérécourt. B.P. 43. 54 220 Maizeville.
• Observatoire régional de l’environnement, Conseil régional de Franche-Comté, 4 square Castan – 25031 Besançon cedex.
07:19 Publié dans Médecine, Nature et santé, Parasitologie | Tags : santé, parasites, plathelminthes, ténia échinocoque, échinoccose alvéolaire, franche-comté, campagnol, renard, chien, chat | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |