31/07/2012
Charles Beauquier, l'homme qui protégeait la nature
 Charles Beauquier,
Charles Beauquier,
l'homme qui protégeait la nature
Loi Beauquier : la protection des paysages
· L’homme politique
"Oublié de la République" selon Jean-Louis Debré, Charles Beauquier compte parmi les hommes politiques français ayant exercé une certaine influence sous la IIIe République. Il est successivement sous-préfet de Pontarlier (1870 à 1871), entre au Conseil général du Doubs en 1871 et devient conseiller municipal de Besançon en 1873. Le 25 avril 1880, il est élu député du Doubs et occupa cette fonction jusqu’en 1914.
· L’homme de culture
Diplômé de l’École de Droit à Paris et de l’École des Chartes en 1857, son attention se porte d’abord sur la critique musicale et les traditions populaires. Parallèlement à sa carrière politique, il s’adonne au journalisme en fondant des journaux comme Le Doubs (1868) ou La Fraternité (1875). Il est également rédacteur en chef, à Besançon, du Républicain de l’Est (1871). Homme de culture et d’héritage, ethnologue avant l’heure, on lui doit de nombreux ouvrages sur la musique et sur le patrimoine et le folklore comtois, qui font encore autorité. Engagé pour la préservation de la nature, il est l’un des fondateurs de la Société pour la protection des paysages et de l’esthétique de la France. Porteur d’un nouveau rapport au paysage, cet engagement donne lieu à la loi du 21 avril 1906, première loi de protection de l’environnement, dite loi Beauquier.
· L’élaboration de la loi Beauquier
De 1901 à 1906 Marqué par la notion de pittoresque, le XIXe siècle considère le paysage comme patrimoine culturel relevant d’intérêts artistiques, géologiques ou historiques. Dans un contexte de progrès scientifiques et industriels, Charles Beauquier propose le 23 mars 1901 à la Chambre des députés une première proposition de loi "ayant pour objet la protection des sites pittoresques". Opposant farouche à l’industrialisation, Beauquier accuse l’État de "laisser commettre des actes de vandalismes dans nos musées naturels, dans cette splendide collection de sites pittoresques que renferme la France ! Étrange contradiction ! L’État veillera avec un soin religieux sur un tableau de maître qui représentera un paysage et il en laissera détruire, sans s’émouvoir, le magnifique et irréparable original !".
Parallèlement à cette proposition de loi, son confrère Louis Dubuisson, député du Finistère, présente le 17 mai 1901 un autre projet de loi sur le même thème.
Le 5 février 1903, Beauquier et de nombreux députés, tels que Ferdinand Buisson, Jaurès, Georges Leygues, Poincaré, Marcel Sembat, proposent une deuxième loi beaucoup plus courte. Malgré la création de la Société pour la protection des paysages de France en 1901, la deuxième révolution industrielle s’oppose plus que jamais à la préservation de la beauté des paysages. À ce titre, Beauquier attire l’attention de la Chambre des députés sur l’urgence d’une législation "car dans toutes les parties de la France on arrache des arbres, on brise des rochers, on capte des torrents, on couvre les campagnes d’affiches et de réclames et l’on saccage des sites merveilleux, consacrés par l’admiration des poètes, des artistes et des foules".
Il faut attendre 1906 pour que le texte soit adopté par la Chambre des députés. Le débat du 27 mars 1906 au Sénat permet au rapporteur, Maurice Faure, d’attribuer la paternité de la loi à Charles Beauquier et à Louis Dubuisson. D’après lui, il donne une résonance patriotique marquée à cette loi, qui a pour but de "protéger ces richesses vraiment nationales contre l’effet destructeur du temps et contre le vandalisme des hommes, peut-être plus destructeur encore". L’alignement est marqué sur la législation en matière de monuments historiques, sauf sur l’aspect financier : "Il n’est prévu, au point de vue financier, aucune participation de l’État. Notre loi est très franchement décentralisatrice".
La loi de protection des paysages est définitivement adoptée le 21 avril 1906, décidant de la création "d’une commission des sites et monuments naturels de caractère artistique" dans chaque département. La commission se chargera de dresser "une liste des propriétés foncières dans la conservation peut avoir, au point de vue artistique ou pittoresque, un intérêt général" ; le classement n’est décidé que si le propriétaire donne son accord. Le Doubs est, semble-t-il, l’un des premiers départements à l’avoir mise en œuvre, en 1912.
Les premiers classements dans le Doubs
(Source : Archives départementales du Doubs, 4T 51 et 52.)
La commission des sites se réunit pour la première fois dès le 12 décembre 1906. Charles Beauquier assiste à ses séances de travail jusqu’à son décès en 1916.
Sur la base d’une liste établie dès 1906 par l’ingénieur ordinaire des Ponts-et-Chaussées, les sites suivants, essentiellement des grottes, glacières, cascades ou sources, sont classés en 1912.
Le 2 mai 1912 :
- Source du Lison, creux Billard et grotte Sarrazine (Nans-sous-Sainte-Anne) ;
- Pont du Diable (Sainte-Anne et Crouzet-Migette) ;
- grottes d’Osselle (Rozet-Fluans) ;
- grottes de Plaisirfontaine (Bonnevaux) ;
- cascades du Bout-du-Monde (Beure) ;
- sources d’Arcier, propriété de la Ville de Besançon.
Le 23 mai 1912 :
- pont Sarrazin de Vandoncourt ;
- ruisseau et vallée de Fontaine-Ronde à Touillon-et-Loutelet, Montperreux et Les Hôpitaux-Vieux ;
- grottes et château de la Roche à Saint-Hippolyte ;
- rocher dit « Dames des Entreportes » à Pierrefontaine ;
- théâtre romain de Mandeure ;
- saut du Doubs et col des Roches à Lac-ou-Villers [Villers-le-Lac] ;
- cascades du Doubs à Fourcatier-et-Maison-Neuve ;
- gorges du Remonot à Les Combes ;
- grottes de Chenecey-Buillon ;
- glacière de Chaux-lès-Passavant ;
- grottes de la Baume à Bournois.
Au cours de l'année 2012, une série de manifestations a salué sa mémoire.




09:03 Publié dans Actualité des Sciences, Environnement-Écologie, Géologie-hydrogéologie-Climatologie, Nature & philosophie | Tags : charles beauquier, protection de la nature, protection des paysages, sites classés, sites protégés, sites protégés de franche-comté | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Le Lézard ocellé (Timon lepidus)
 Le Lézard ocellé (Timon lepidus)
Le Lézard ocellé (Timon lepidus)
par André Guyard
Morphologie externe
Le Lézard ocellé (Timon lepidus ou Lacerta lepida) est le plus grand lézard rencontré en France. Le corps trapu et massif atteint 600 à 650 mm queue comprise.

La robe du Lézard ocellé se caractérise par la présence de taches bleues cerclées de noir (ocelles)
sur les flancs de l'animal
(Cliché de Stéphanie Leblond)
D'une façon générale, le corps des lézards, très grossièrement serpentiforme présente une tête, un tronc pourvu de deux paires de membres et une queue.
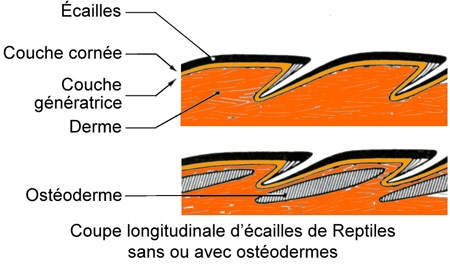
Chez le Lézard ocellé et la majorité des Lacertiliens, la peau présente des écailles épidermiques, se recouvrant partiellement. Ce n'est que chez les Amphisbénidés que les écailles peuvent être absentes.
Entièrement cornées, ces écailles forment de grandes plaques[1]sur la tête et la mâchoire inférieure, de petites plaques sur le reste du corps. Cette couche épidermique se renouvelle périodiquement par lambeaux, sauf chez les Orvets où elle tombe tout d'une pièce. Chez certains Lacertiliens, il existe sous les écailles des plaques osseuses, ou ostéodermes qui, sur la tête, s'unissent aux os sous-jacents.
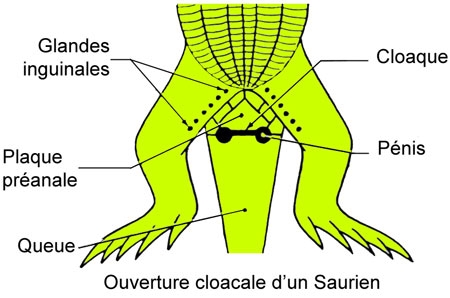
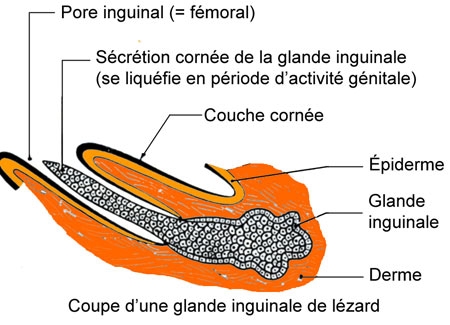
Les écailles sont granuleuses ; sur la face ventrale du tronc, elles sont carrées et disposées en plusieurs rangées obliques. Imbriquées les unes dans les autres de l'avant à l'arrière, les écailles tombent tous les ans, au cours d'une mue, par petits lambeaux. Le tégument, ainsi protège, est très pauvre en glandes : il n'en existe que sur la face interne des cuisses ; ce sont les glandes inguinales ou fémorales dont les orifices sont bien visibles (pores fémoraux). Il en résulte que la peau est sèche. La sécrétion des glandes fémorales favorise l'adhérence des sexes pendant l'accouplement.
La tête de forme triangulaire est grosse, avec de fortes joues et un museau arrondi. Elle montre une bouche antérieure, largement fendue, deux narines petites, deux yeux placés latéralement avec paupières supérieure et inférieure mobile, et, en arrière des yeux, deux tympans situés au fond d'une petite dépression qui correspond au conduit auditif externe de l'Homme.
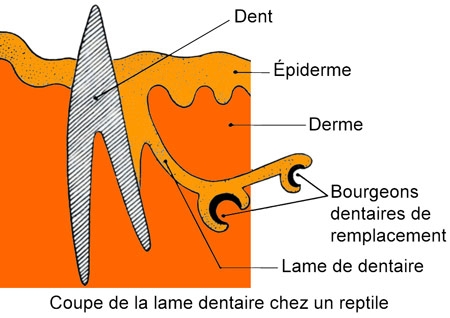
Dans la cavité buccale, les dents sont petites et coniques. Elles sont soudées aux maxillaires et non pas implantées dans des alvéoles : elles servent à la rétention des proies.
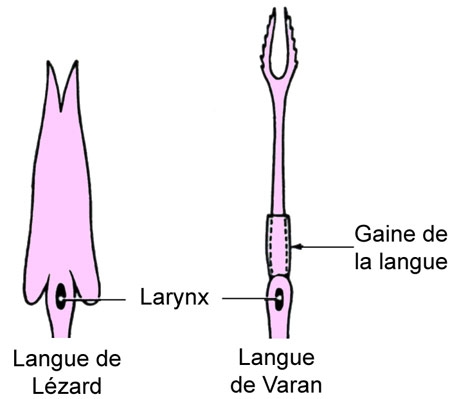
La langue est bifide, très mobile, pouvant sortir[1]de la cavité buccale par une échancrure de la lèvre inférieure, donc sans que la bouche soit ouverte.

La langue du Lézard ocellé lui sert également
à se pourlécher après un bon repas
(Cliché de Stéphanie Leblond)

La tête du Lézard ocellé est protégée
par de grandes plaques dorsales
(Cliché de Stéphanie Leblond)

Le museau est arrondi et les joues sont proéminentes
(Cliché de Stéphanie Leblond)
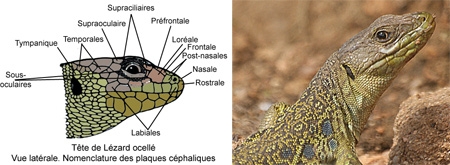
Nomenclature des plaques céphaliques en vue latérale
(Cliché de Stéphanie Leblond)
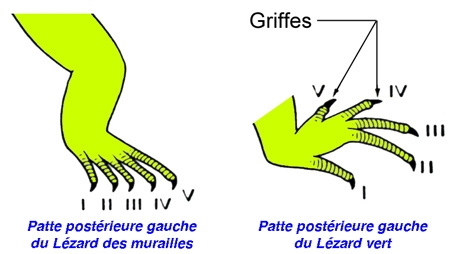
Le tronc, allongé et aplati dorso-ventralement, est séparé de la queue, ventralement, par un orifice transversal, la fente cloacale que précède une large écaille ou plaque préanale. Les pattes antérieures, comme les postérieures, s'insèrent latéralement au tronc et se terminent, par cinq doigts munis chacun d'une griffe.

Les pattes à cinq doigts du Lézard ocellé montre un doigt opposable aux quatre autres
(Cliché de Stéphanie Leblond)
La queue très épaisse à la base se rétrécit pour former une longue pointe fine. Elle est plus épaisse à la base chez le mâle que chez la femelle. Chez les lézards, elle se brise si l'on saisit le Lézard par cet appendice et elle continue ensuite à s'agiter pendant un temps assez long. Il s'agit d'un phénomène d'autotomie (autos : soi-même; tome, coupure). L'une des vertèbres basales présente une fissure transversale[1] et est entourée de muscles spéciaux. Si le Lézard est saisi, il contracte ces muscles et la vertèbre se brise : la queue se détache alors et il n'y a pas d'hémorragie, car les vaisseaux sanguins sont étranglés par la contraction musculaire. Par la suite, la queue régénère et il en pousse parfois deux. Brisée une seconde fois (au niveau du régénérat), elle ne repousse pas. La queue régénérée ne présente qu'un tube de cartilage fibreux et les écailles sur la partie régénérée sont différentes de ce qu'elles étaient auparavant.

La queue est longue et effilée
(Cliché de Stéphanie Leblond)
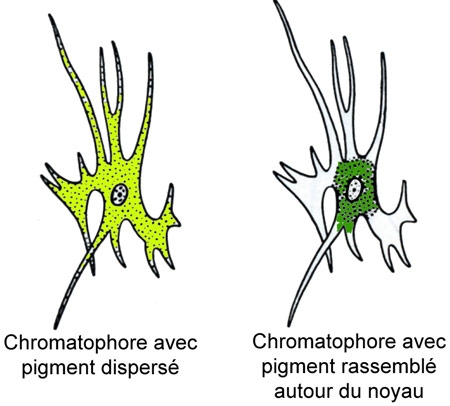
La peau renferme des pigments. Chez les Lacertiliens, ces pigments permettent souvent à l'animal de changer de coloration et de se confondre avec le milieu (homochromie). Ils se localisent dans le derme, sous l'épiderme, dans des chromatophores. Ces chromatophores contiennent généralement des pigments mélaniques qui peuvent se disperser dans le cytoplasme cellulaire ou bien se rassembler autour du noyau, ce qui rend la coloration plus foncée ou plus claire. Chez certains Lacertiliens, dont les Caméléons, il existe également des chromatophores chargés de pigments caroténoïdes et associés à la couche pigmentaire jaune sous-épidermique et à des cristaux de guanine : d'où une grande variation de coloration de la peau (grâce à la guanine, elle peut même passer au bleu ou au vert).
La coloration du Lézard ocellé est variable mais toujours caractérisée par des taches bleues (ocelles) sur les flancs. La face dorsale, couverte de petites écailles perlées, est généralement verte, rarement brun olivâtre, avec un dessin très fin plus ou moins réticulé s'estompant vers les flancs généralement verts et ornés de trois à quatre rangées d'ocelles bleus bordées de noir. Les membres et la base de la queue sont verts avec des taches noires, et le ventre presque toujours blanchâtre à jaunâtre, rarement blanc verdâtre.
Les jeunes présentent une coloration dorsale typique : sur un fond vert olive ou sombre s'alignent des ocelles noirs à centre jaunâtre qui forment des barres transversales.

Coloration dorsale du jeune lézard ocellé
Le squelette
Le crâne est complètement ossifié et très solide. Les orbites sont séparées par un septum cartilagineux, la cloison interorbitaire, traversée par les nerfs olfactifs. Il n'y a ni alisphénoïdes, ni orbitosphénoïdes, ni parasphénoïdes. L'arcade zygomatique inférieure n'existe pas, du fait de la réduction du jugal et de l'absence du quadrato-jugal. La voûte du crâne est formée d'os de membrane[1],la base d'os de cartilage. Les condyles occipitaux se sont fusionnés en un seul condyle impair.
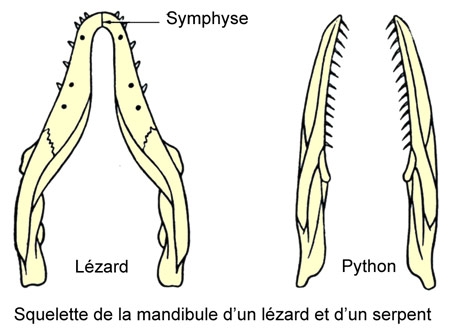
Les deux branches de la mandibule sont soudées ; l'os carré est mobile sur le crâne, mais assez court et il ne permet qu'une ouverture relativement faible de la cavité buccale. Alors que chez les serpents, les deux branches de la mandibule ne sont pas soudées et peuvent s'écarter durant la déglutition, permettant le passage de grosses proies.
La colonne vertébrale est munie, chez les Lézards, de vertèbres procœles, sauf chez la plupart des Geckos, où elles sont amphicœles avec persistance d'un reste de la corde dorsale. À la base de la queue existent des os en chevrons, fixés aux centres vertébraux. On compte six ou huit vertèbres cervicales (suivant l'espèce), des vertèbres dorsales en nombre variable, deux vertèbres lombaires et deux vertèbres sacrées.
Les côtes n'ont qu'une tête, le tuberculum n'étant représenté que par un ligament.
On distingue des côtes cervicales, quatre paires de vraies côtes dorsales unies à un sternum ventral et des côtes dorsales libres ou fausses cotes. Le sternum est losangique.
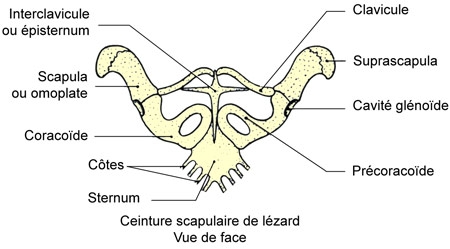
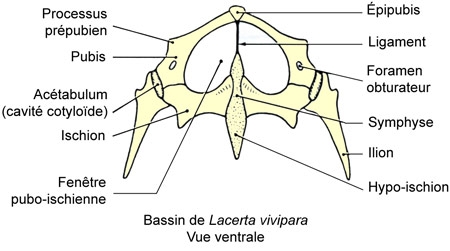
La ceinture scapulaire présente une interclavicule ou épisternum en forme de T, deux clavicules s'appuyant sur les deux omoplates[2] souvent fenestrées. De part et d'autre, existe un précoracoïde suivi d'un coracoïde, fenestrés également.
Le membre antérieur possède un carpe qui compte une première rangée de deux os, un os central et une seconde rangée de cinq os. La formule des phalanges des doigts est deux, trois, quatre, cinq et trois.
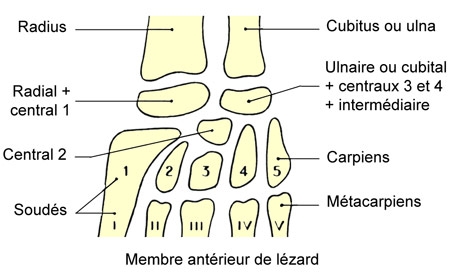
À la ceinture pelvienne, les ilions s'articulent sur deux vertèbres sacrées, les pubis et les ischions se réunissent en une symphyse ventrale ou symphyse ischiatique, qui se continue en arrière par un cartilage supportant portant le cloaque. Chaque pubis se continue en avant par un épipubis cartilagineux.
Le tarse possède une première rangée de deux os et une seconde de cinq os. La formule des phalanges des orteils est deux, trois, quatre, cinq, quatre.
[1] Et, entre les deux pariétaux, existe un orifice, le trou pariétal.
[2] Ou scapula.
Le système nerveux et les organes des sens
L'encéphale montre deux lobes olfactifs très allongés, deux hémisphères cérébraux lisses et assez volumineux, une épiphyse, deux tubercules bijumeaux, un cervelet petit, à allure de lame mince, qui recouvre en partie le bulbe rachidien.
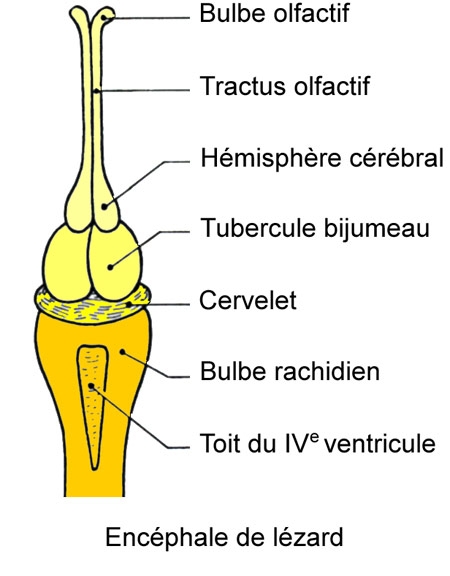
Des corpuscules tactiles sont répandus sur toute la surface du corps. Ils sont situés au bord des écailles. Le tympan est nettement distinct de la peau. L'oreille moyenne communique largement avec le pharynx.
Les organes olfactifs sont deux simples conduits, sans communication avec deux organes bien développés, les organes de Jacobson qui s'ouvrent dans la cavité buccale.
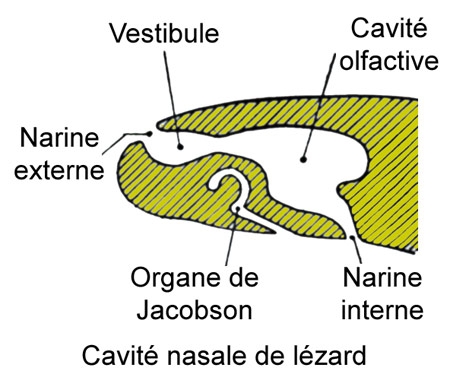
L'œil possède un peigne et la sclérotique a un anneau osseux. Les paupières sont normales avec glande lacrymale et glande de Harder.
Remarque : chez les Caméléons, les paupières se soudent en ne laissant subsister qu'un orifice vertical, et les deux yeux peuvent se mouvoir indépendamment l'un de l'autre, si bien que l'animal peut guetter une proie dans toutes les directions.
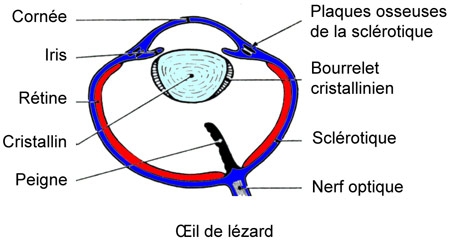
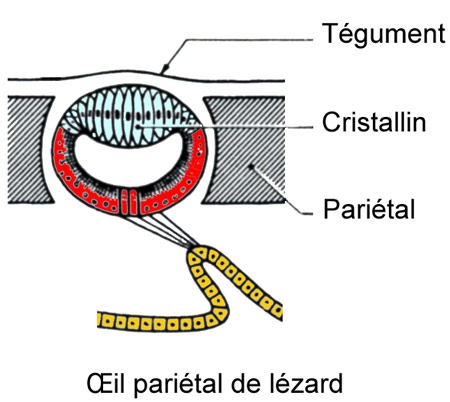
Chez le Lézard ocellé, l'épiphyse est un simple cul-de-sac. Mais le ganglion droit de l'habenula se continue par un nerf qui se termine par un œil pariétal placé sous la peau, dans le trou pariétal du crâne : c'est une vésicule que limitent un cristallin et une rétine à bâtonnets internes. Il s'agit du vestige d'un œil qui a dû être fonctionnel chez certains Vertébrés fossiles.
On trouve des corpuscules gustatifs sur les parois de la cavité buccale et surtout sur la langue.
L'appareil digestif
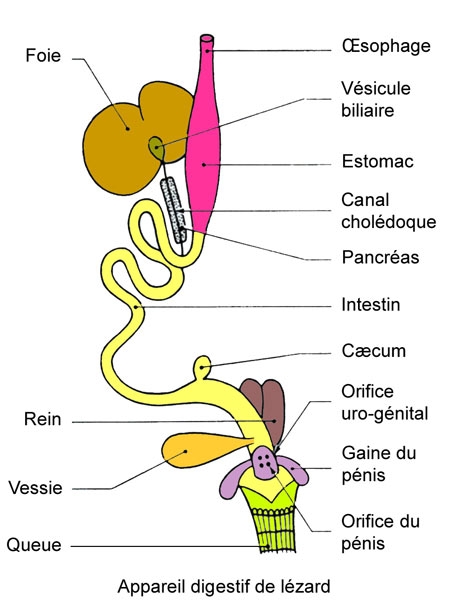
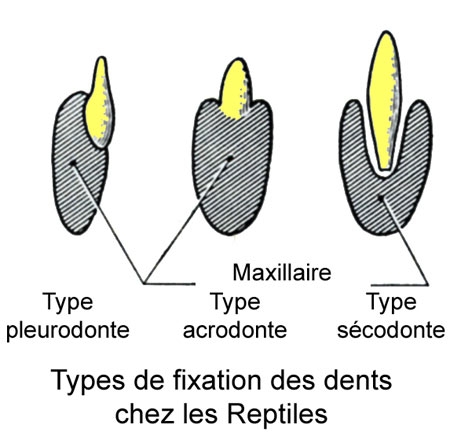
La cavité buccale n'est pas séparée des fosses nasales par une cloison complète. Assez en arrière, les fosses nasales y débouchent par leurs orifices internes ou choanes, visibles de chaque côté d'une crête médiane du palais[1] . Le bord des maxillaires présente une saillie sur laquelle sont fixées les nombreuses dents coniques (dites pleurodontes).
À la base de la langue, longue et bifide, s'ouvre le pharynx que continue l'œsophage. Ce dernier, placé sous le cœur et les poumons, passe insensiblement à l'estomac.
Disposé longitudinalement, l'estomac présente une légère courbure dans sa région postérieure. Il est entièrement caché par un foie volumineux et massif qui montre une grosse vésicule biliaire. La bile atteint l'intestin par un canal cholédoque et plusieurs canaux hépatiques qui traversent le pancréas. L'intestin est assez court et s'achève par le rectum qui débute par un cæcum et qui débouche dans un cloaque, après avoir longé le bassin.
L'appareil respiratoire
Le larynx est pourvu d'un cartilage cricoïde et de deux cartilages aryténoïdes. Chez certains Lacertiliens, le larynx est muni d'une épiglotte. Les Geckos et les Caméléons possèdent des cordes vocales et peuvent émettre des sons.
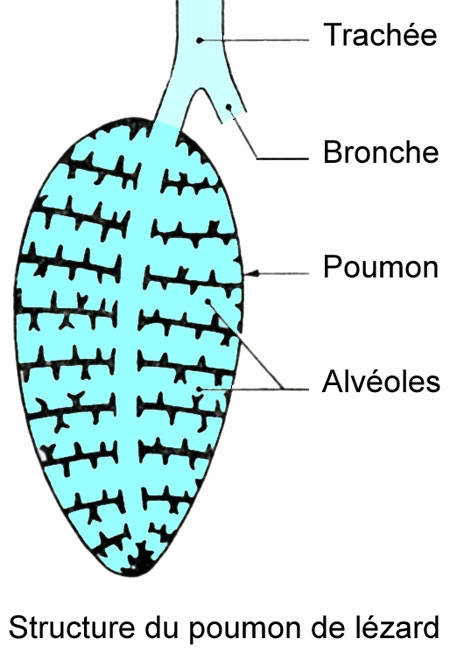
La trachée est courte et a des anneaux cartilagineux complets.
De courtes bronches conduisent à deux poumons peu alvéolés. Chez divers Geckos et chez les Caméléons, les poumons sont prolongés à l'arrière par des diverticules, les sacs aériens, qui s'insinuent entre les viscères et produisent un gonflement du corps de l'animal.
Chez les Lacertiliens serpentiformes, les deux poumons, comme chez les Ophidiens, sont souvent de grandeur différente.
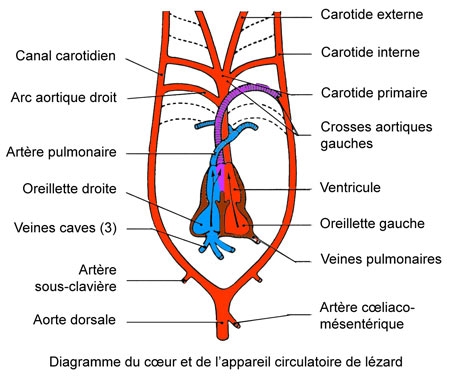
L'appareil circulatoire
Le cœur possède deux oreillettes et un ventricule[1] Du ventricule partent l'artère pulmonaire (qui se divise pour se rendre aux poumons) et deux aortes ventrales,qui s'entrecroisent sans communication et se continuent l'une et l'autre par deux arcs aortiques[2]. Les deux paires d'arcs aortiques se réunissent en arrière et dorsalement pour former l'aorte commune. L'oreillette droite reçoit, dans un sinus, une veine cave inférieure et deux veines caves supérieures. L'oreillette gauche reçoit les deux veines pulmonaires droite et gauche.
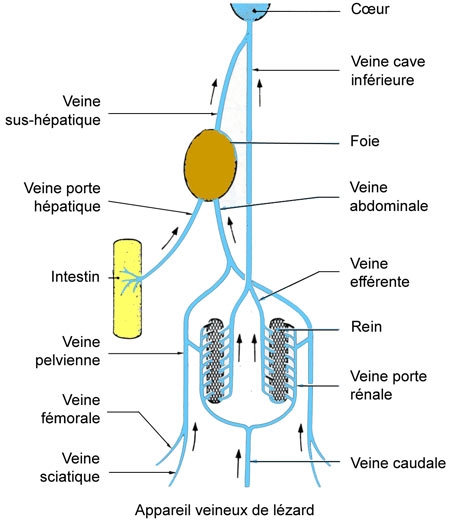
L'appareil veineux présente un système porte hépatique et un système porte rénal.
Le sang a des hématies ovales, biconvexes et nucléées.
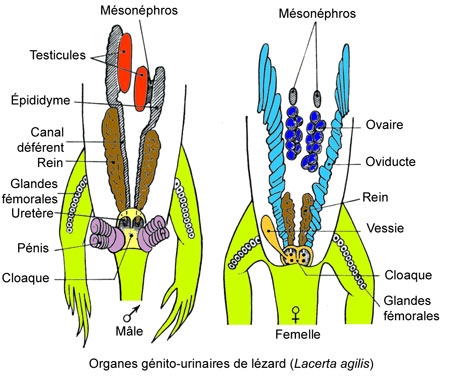
L'appareil génito-urinaire
Appareil excréteur
Les reins sont situés dans la partie postérieure de l'abdomen et plus ou moins lobés : ce sont des reins tertiaires ou métanéphros, symétriques par rapport à la colonne vertébrale. Leurs conduits excréteurs, les uretères, se rendent directement au cloaque chez la femelle. Chez le mâle, chaque uretère se réunit au canal déférent (spermiducte) du même côté et les deux conduits s'ouvrent par un orifice commun dans la partie latérale du cloaque, au niveau d'une vessie urinaire ventrale.
Appareil génital
Le mâle possède deux testicules ovoïdes, situés symétriquement de part et d'autre de la colonne vertébrale, en avant des reins. Un vestige de canal de Müller est visible en avant de chaque testicule. Les canaux déférents, qui partent de ces testicules, forment un tube en apparence rectiligne, mais dont le canal est très sinueux. L'orifice de chaque canal déférent (en fait orifice génito-urinaire) se continue par un sillon sur un des deux pénis (ou hémipénis). L'animal a, en effet, deux organes copulateurs, dévaginables, à parois formées de tissu érectile et pouvant faire saillie hors de l'orifice cloacal lors de la copulation. Chacun de ces pénis fonctionne séparément. Au repos, ils peuvent être perceptibles sous forme de saillie près de l'orifice cloacal.
La femelle a deux ovaires. Deux oviductes, dérivés des canaux de Müller embryonnaires s'ouvrent très en avant d'eux dans la cavité générale. Ces oviductes qui débutent par une sorte de pavillon, la trompe de Fallope, sont des tubes à parois très plissées, dont le diamètre, d'abord assez faible, augmente lorsqu'ils se rapprochent du cloaque. Ils y débouchent par deux orifices situés en avant des orifices urinaires.
Reproduction
Le mâle semble atteindre la maturité sexuelle à 2 ans, la femelle à 3 ans.
Pour la reconnaissance des sexes, l'odorat semble jouer un rôle important : on a même constaté que le mâle s'assure que la femelle est en rut en passant la langue sur son cloaque.
Les femelles désirant s'accoupler recherchent la compagnie des mâles qui se livrent à des combats symboliques n'entraînant généralement aucune blessure.
L'accouplement a lieu au début du printemps et la ponte s'effectue, entre avril et juin, dans un trou creusé par la femelle dans un talus de terre friable. Une ponte peut compter une vingtaine d'œufs et même plus. La femelle enterre ses œufs, qui éclosent au bout de 3 mois environ. Les petits mesurent 105 à 120 mm à la naissance.
Les parents se désintéressent des œufs après la ponte.
L'œuf pondu est formé par le jaune, cellule géante chargée de vitellus et par des enveloppes successives déposées autour de lui au cours de sa descente dans l'oviducte : albumen[1] ou blanc, membrane coquillière et coquille, cette dernière formée par une protéine analogue au collagène.
À l'un des pôles du jaune ou cellule-œuf (pôle animal) se trouve le germe ou cicatricule, qui est dépourvu de vitellus et où se localise, avant la segmentation, le noyau de fécondation. La membrane coquillière est formée de deux feuillets qui son constitués par des fibres microscopiques entremêlées.
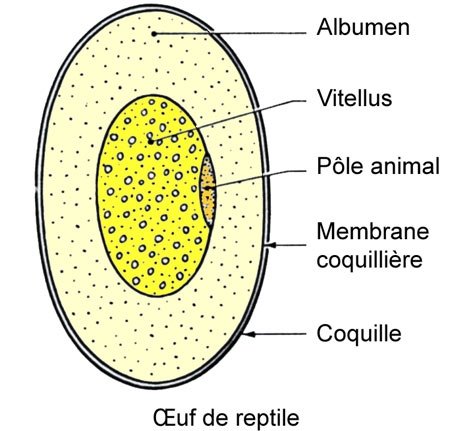
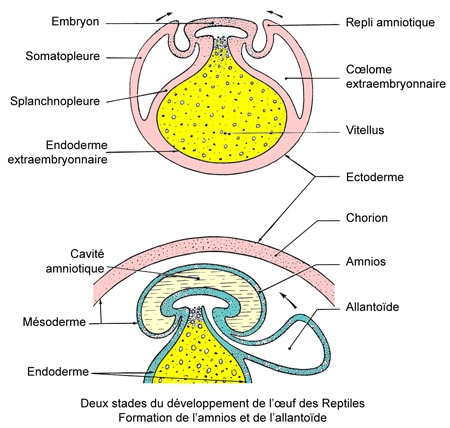
Cet œuf est donc semblable à celui des Oiseaux et son développement est identique (œuf méroblastique à segmentation partielle et discoïdale, apparition d'une cavité amniotique, et d'une allantoïde à rôle respiratoire et excréteur) les excréta de l'embryon consistent essentiellement en acide urique précipité.
Chez le Lézard ocellé et chez tous les Lacertiliens et les Ophidiens dont les œufs ont une coque membraneuse, le jeune à l'éclosion possède au bout du museau une petite dent cornée, dite dent de rupture, différenciée avec une pointe ou un bord coupant ; généralement impaire, rarement paire (Geckos), elle prend naissance peu avant l'éclosion à l'extrémité de la mâchoire inférieure sur l'intermaxillaire. Elle a pour rôle de percer ou d'inciser la coque de l'œuf au moment de la naissance, puis elle disparaît quelques heures ou quelques jours après l'éclosion.
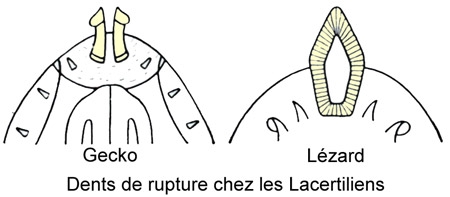
Cette "dent de l'œuf" est très réduite ou même indistincte chez les espèces ovovivipares. Chez les Reptiles dont l'œuf a une coque dure (Sphenodon, Tortues, Crocodiles), à la dent de l'œuf correspond un épaississement corné de l'épiderme, le diamant ou caroncule, apparaissant à l'extrémité du museau.
Dans la nature, le développement des œufs déposés par les femelles est plus ou moins influencé par les conditions de température et d'hygrométrie, et, de ce fait, sa durée est variable : neuf à onze semaines.
Pendant l'incubation, les œufs grossissent, par le fait de l'humidité et de la croissance de l'embryon.
[1] On dit encore albumine. C'est une matière protidique riche en eau, peu abondante, le jaune remplissant presque complètement l'œuf.
Le développement des Reptiles
Le développement est direct, sans métamorphose et, des leur naissance, les jeunes ont le même comportement que les adultes. Tout de suite très vigoureux et agiles, ces jeunes lézards, qui naissent entre la fin de juillet et le début de septembre et qui mesurent de 5 à 7 centimètres, se nourrissent de Pucerons et d'autres Insectes minuscules.
À l'âge d'un an, ils atteignent la taille de 14 à 15 centimètres. Les mâles étant généralement un peu plus grands que les femelles. Celles-ci sont capables de se reproduire dès leur deuxième année.
Répartition du Lézard ocellé
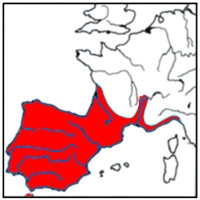
Répartition du lézard ocellé en Europe
On le rencontre dans la péninsule ibérique, au sud de la France, dans le nord-ouest de l'Italie et le nord-ouest de l'Afrique, jusqu'à 2100 m d'altitude. Les clichés qui illustrent cet article ont été réalisés en mai et juin 2012 dans le Bas-Vivarais (Ardèche).
Biologie du Lézard ocellé
Le Lézard ocellé fréquente des terrains secs, très ensoleillés, recelant de nombreuses cachettes et portant une végétation éparse. Il affectionne les terres cultivées : plantations, vignes ainsi que les sols rocheux ou sablonneux.

Le Lézard ocellé fréquente des
biotopes ensoleillés et pierreux
(Cliché de Stéphanie Leblond)
Le Lézard ocellé recherche le soleil au printemps, lorsqu'il sort de l'hivernage, et en automne. Il passe alors de nombreuses heures chaque jour à prendre un bain de soleil. En plein été quand la température extérieure est élevée, la durée d'exposition au soleil est raccourcie au profit du temps d'activité.
Le Lézard ocellé parcourt généralement son territoire lentement en furetant. En cas de danger ou de conflit, il peut courir rapidement, en décollant son ventre et sa queue du sol. En cas d'agression, il se plante devant son ennemi, crachant la gueule grande ouverte et il peut même sauter sur son adversaire.
Pour se protéger de ses ennemis, le Lézard ocellé creuse un terrier ou s'installe dans une cachette naturelle (terrier de rongeur, tas de pierres, tronc d'arbre creux…). Il reste de préférence à proximité de cette retraite, qu'il regagne pour se reposer.
Le Lézard ocellé se nourrit principalement de grands insectes qu'il débusque lors de ses rondes sur son territoire. Il capture surtout coléoptères, grillons et sauterelles, limaces, mille-pattes ou scorpions, exceptionnellement de petits vertébrés.

Lézard ocellé ayant capturé une larve d'insecte
(Cliché de Stéphanie Leblond)

Le Lézard ocellé mue à la fin du printemps
(Cliché de Stéphanie Leblond)
Si le biotope est adéquat, la densité de peuplement peut être importante, mais certains individus vivent seuls. Malgré sa taille et en dépit de sa combativité, l'espèce a de nombreux prédateurs. Le Lézard ocellé est chassé par des rapaces diurnes (Milan, Aigle botté et Autour des palombes) et la Couleuvre de Montpellier. Son habitat est réduit dans certaines régions par la généralisation de l'agriculture intensive.
Sources :
- H. Boué & R. Chanton (1959). - Zoologie II. Procordés et Vertébrés, pp. 292-398. Doin & Cie, Ed.
- G. Diesener & J. Reichholf (1986). – Batraciens et Reptiles, Ed. Solar.
Pour plus de détails, consulter l'article de Wikipedia consacré au Lézard ocellé.
Remerciements à Stéphanie Leblond qui m'a fourni quelque 500 clichés des lézards ocellés qui fréquentent sa propriété des Chanels à Paysac (Ardèche).
09:03 Publié dans Herpétologie | Tags : reptiles, sauriens, lacertidés, lézard ocellé | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
28/07/2012
Des cellules souches dans la rétine
 Des cellules souches dans la rétine
Des cellules souches dans la rétine
(Dernière mise à jour : 2/11/2014)
Dans ce même blog, nous avons évoqué l'emploi de cellules souches embryonnaires pour régénérer la rétine. Ces cellules embryonnaires sont pluripotentes car elles sont à l'origine de toutes les cellules de l'organisme (voir dans ce même blog les articles : Cellules souches et rajeunissement et Élaboration d'une rétine à partir de cellules souches embryonnaires).
Une autre technique est utilisée dans le même but de régénération de la rétine par une autre équipe américaine : des cellules souches découvertes dans la rétine d'individus adultes décédés ouvrent une nouvelle piste de traitement de l’une des premières causes de cécité, la dégénérescence maculaire liée à l’âge, ou DMLA.
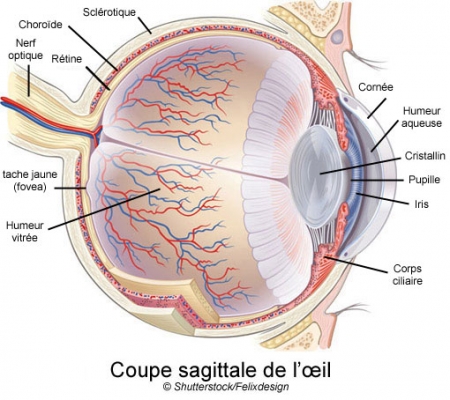
La dégénérescence maculaire liée à l'âge (DMLA) détruit les cellules de l'épithélium pigmentaire de la rétine. Cette couche de cellules qui tapisse le fond de la rétine assure le bon fonctionnement des cellules photoréceptrices de l'œil. Une maladie qui n'est pas négligeable et qui s'aggrave avec l'âge des patients. D'après le journal d'ophtalmologie, 2007, le taux de DMLA dans le monde, s'établit selon l'âge : de 55 à 64 ans à 12,2%, 65 à 74 ans à 18,3%, plus de 74 ans à 29,7% (600 000 patients en France).
Les travaux de l’équipe de Sally Temple, de l’Institut des cellules souches neuronales de Rensselaer, aux États-Unis ouvrent un espoir de remédier à la DMLA. En cultivant sous diverses conditions de telles cellules prélevées sur des donneurs décédés, les biologistes ont mis en évidence, parmi elles, l’existence d’une sous-population de cellules souches multipotentes, c’est-à-dire capables de se différencier en plusieurs types cellulaires – dont les cellules de l’épithélium pigmentaire de la rétine.

La DMLA (dégénérescence maculaire liée à l'âge) entraîne l'apparition d'une ou plusieurs taches noires qui occultent la vision centrale
Cet épithélium est une couche de cellules qui tapisse le fond de la rétine et assure le bon fonctionnement des cellules photoréceptrices de l’œil, les bâtonnets et les cônes. La DMLA, principale cause de malvoyance et de cécité dans les pays industrialisés – elle y touche sept pour cent des personnes de plus de 75 ans –, est due à la disparition progressive de ces cellules. Il n’existe encore aucun traitement pour la forme la plus fréquente, dite DMLA « sèche » ou atrophique.
Infographie : Betty Lafon pour Sciences et Avenir
Une piste explorée par plusieurs équipes consiste à greffer dans la rétine des cellules de l’épithélium pigmentaire de la rétine produites en laboratoire à partir de cellules souches embryonnaires (cellules ES) ou de cellules induites à la pluripotence (cellules iPS), c’est-à-dire capables de se différencier en cellules de n'importe lequel des trois feuillets embryonnaires (lors de l’embryogenèse, ces feuillets produisent les organes du futur individu).
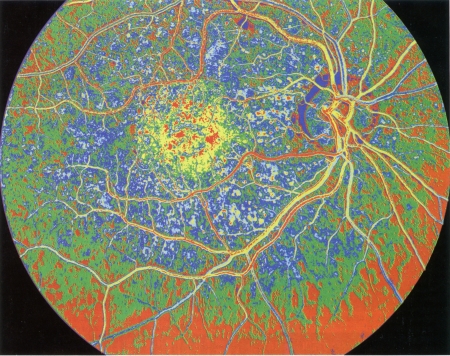
La DMLA (dégénérescence maculaire liée à l'âge) se caractérise par une atteinte de la zone centrale de la rétine, la macula (le cercle jaune vu en rétino-angiographie)
© KOKEL/BSIP
En découvrant des cellules souches dans l’épithélium pigmentaire de la rétine humaine adulte, les biologistes américains ouvrent la voie à une nouvelle piste : en culture, sous certaines conditions, ces cellules souches multipotentes se différencient en cellules de l’épithélium pigmentaire. Existerait-il des conditions similaires qui activeraient leur différenciation dans la rétine des personnes atteintes de la maladie, et ainsi la régénération in situ de l’épithélium défectueux ? Certains animaux à sang froid, comme les amphibiens, ont déjà cette capacité de régénérer leur épithélium pigmentaire et d’autres tissus oculaires lorsque ceux-ci sont abîmés. Prochaine étape : décortiquer le mécanisme qui active la différenciation de ces nouvelles cellules souches – une donnée indispensable pour mettre au point les conditions favorables à la régénération de l’épithélium in situ.
« C’est la première fois que l’on met en évidence des cellules souches dans ce tissu chez l’adulte, commente Olivier Goureau, de l’Institut de la vision, à Paris. Cette piste de réparation endogène semble prometteuse. » Celle de la greffe de cellules de l’épithélium pigmentaire dérivées de cellules pluripotentes n’est pas abandonnée pour autant. Son équipe, qui travaille sur la production de différentes cellules rétiniennes à partir de cellules souches pluripotentes humaines, s’apprête, en collaboration avec le laboratoire ISTEM du génopole d’Evry, à effectuer chez la souris des tests de greffe d’un tel épithélium.
Pour en savoir plus
E. Salero et al., Adult human RPE can be activated into a multipotent stem cell that produces mesenchymal derivatives, Cell Stem Cell, vol. 10, pp. 88-95, 2012.
C. Delcourt, Les troubles de la vision liés à l'âge, Pour la Science, n° 292, pp. 38-45, 2002.
Les cellules souches embryonnaires humaines tiennent leurs promesses (ajout de janvier 2013)
Des patients ont reçu une greffe de cellules souches embryonnaires humaines. Une première mondiale qui offre un espoir de traitement pour cette maladie incurable.
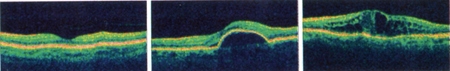
De gauche à droite, tomographie par cohérence optique de la rétine d'une macula normale, d'une rétine atteinte de DMLA et enfin d'un œdème maculaire, une complication rencontrée souvent chez les diabétiques
(CMCR MAISON ROUGE STRASBOURG)
Pour la première fois, une équipe du prestigieux Jules Stein Eye Institute de Los Angeles (États-Unis) a réalisé avec succès, en mars 2012, une greffe de cellules souches embryonnaires humaines (CSEh) chez deux patientes atteintes de dégénérescence maculaire liée à l'âge (DMLA). L'une des patientes souffrait de la forme dite sèche. L'autre d'une affection proche appelée maladie de Stargardt. Ces CSEh, prélevées sur l'embryon aux premiers stades de développement, ont la particularité de se répliquer indéfiniment avant de se différencier pour former plus de 200 types de tissus humains. 50 000 d'entre elles ont été injectées sous la rétine de patientes très malvoyantes pour reconstituer de la rétine. Six mois après, l'une pouvait à nouveau se déplacer seule, l'autre était capable d'utiliser partiellement un ordinateur. Un succès. Mais ces résultats doivent, bien sûr, être confirmés sur la durée. C'est pourquoi l'étude va se poursuivre pendant encore deux ans et inclure vingt-quatre autres patients.
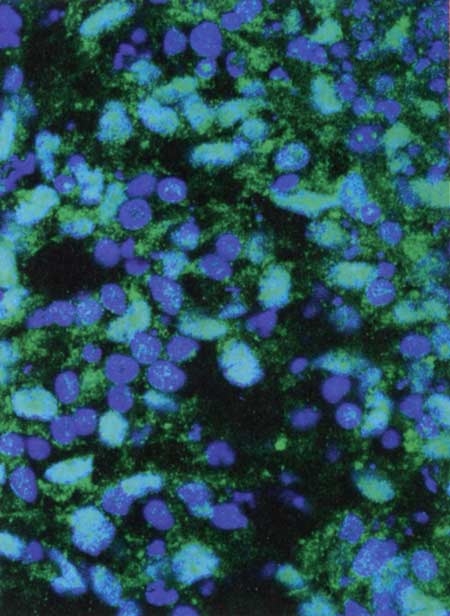
Les greffes de cellules souches embryonnaires humaines (ci-dessus, vues au microscope) sont peut-être la thérapie de l'avenir. Au dernier stade de leur développement, elles donneront un véritable tissu rétinien, aidant à restaurer la vision du patient
© UC IRVINE
S'ils sont avérés, ces résultats constitueront un immense espoir de traitement pour les deux formes de cette maladie dont les symptômes sont une déformation des lignes droites avec l'apparition progressive d'une ou plusieurs taches noires centrales, les scotomes, traduction de la perte de la vision centrale. Moins fréquente (20 % des cas), la forme dite humide est la plus grave. Elle se caractérise par la formation de néovaisseaux sous la rétine, une prolifération due à une production anormale de facteurs de croissance (VEGF : Vascular Endothelial growth factor). En revanche, il n'existe à ce jour aucun traitement pour la forme sèche sans néovascularisation (dite aussi atrophique, plus lente et plus répandue (80 %), les antiVEGF étant inopérants. L'objectif thérapeutique est dans ce cas de stabiliser la destruction progressive des cellules photoréceptrices de la rétine et de bloquer l'inflammation locale. « Plusieurs molécules sont à l'étude et des essais cliniques vont démarrer dans les mois qui viennent », prévoit le Pr Eric Souied, président de l'Association DMLA*.
Face à une affection dont le nombre de cas pourrait doubler d'ici à 2030 en raison du vieillissement de la population, les chercheurs s'intéressent aussi au dépistage. On sait ainsi de longue date que le risque de développer une DMLA est plus important en cas de tabagisme et de surpoids. Plus récemment, des travaux ont été consacrés à la prédisposition génétique et plusieurs marqueurs ont été identifiés (ARMS2, CFH...). Un test de dépistage à partir d'un simple prélèvement salivaire, Macula Risk, est même déjà fabriqué et commercialisé au Canada et sur Internet par la firme Artic DX. Toutefois, son usage reste controversé et surtout prématuré comme l'a précisé un communiqué spécial émis par l'American Academy of Ophtalmology (AAO) en novembre 2012. « À l'avenir, ces tests pourront probablement aider à mieux traiter les patients à haut risque en permettant des traitements adaptés, a ainsi précisé le Dr Edwin Stone, responsable du groupe de travail de l'AAO sur la prédisposition génétique. « Mais les preuves d'un réel bénéfice pour le patient manquent encore. » Pour l'heure, en France, ce test est depuis peu en cours d'évaluation au centre hospitalier intercommunal de Créteil (Val-de-Marne) selon un protocole rigoureux, et uniquement, auprès de patients présentant des antécédents familiaux. L'équipe de Créteil poursuit par ailleurs un projet de génétique appliquée. « Nous avons identifié des marqueurs génétiques prédictifs de sévérité, détaille le Pr Souied. D'ici à cinq ans, nous espérons pouvoir adapter notre prise en charge au profil de chacun. » Un premier pas de soin personnalisé de la DMLA.
*N° vert 0.800.880.66.
Source :
Sylvie Riou-Millot (2013) . - Bien voir - Sciences et Avenir n° 792, février 2013, pp. 46-57.
Les cellules souches induites adultes (iPS) entrent dans la danse (ajout de mars 2013)
Dans le traitement de la DMLA, les premiers essais cliniques impliquant des cellules iPS devraient démarrer au Japon en 2013 au centre hospitalier de Kobe. Cette opération, qui se pratique déjà avec les CSEh (voir plus haut et également le dossier « Vision », Sciences et Avenir n° 792, février 2013) consistera à injecter des iPS différenciées directement dans l'œil du patient afin de reconstituer les cellules abîmées.
Peut-on envisager de déployer cette technique pour des interventions nécessitant de plus importantes réparations dans des tissus nécrosés ? Dans le cas de la rétine, le nombre de cellules iPS à injecter est relativement faible. Mais s'il est possible d'envisager de greffer en surface de l'œil quelques milliers de cellules rétiniennes au millimètre carré, sera-t-il possible de réparer en profondeur un trouble cardiaque comme l'ischémie qui détruit plusieurs dizaines de milliards de cellules ? Sera t-il possible de produire autant de cellules, et à quel coût ? Autant de questions qui restent sans réponse. Pour toutes ces raisons, il semble illusoire - du moins pour l'heure - d'envisager que les iPS puissent ouvrir la voie à une médecine totalement personnalisée où l'on pourra soigner chaque patient à partir de ses propres cellules expurgées de leurs défauts.
Une greffe relance l'espoir dans la DMLA (ajout du 2 novembre 2014)
Une première mondiale : l'équipe menée par Yasuo Kurimoto, du Kobe City Médical Center Général Hospital au Japon a réalisé un implant de tissu rétinien à partir de cellules souches pluripotentes induites (iPS).
Le 12 septembre 2014, une Japonaise de 70 ans atteinte de DMLA a reçu une greffe d'un tissu rétinien conçu à partir de cellules souches pluripotentes induites (IPS). Une première mondiale.
Même s'il est trop tôt pour évaluer le résultat, la patiente a déclaré, le lendemain, que sa vue était plus "brillante". Les iPS en question étaient des cellules souches obtenues à partir de cellules adultes différenciées — ici de peau de la patiente — puis reprogrammées en cellules de rétine. L'équipe japonaise a implanté un feuillet de 1,3 sur 3 mm d'épithélium rétinien dans l'œil de la patiente.
« Cette excellente équipe a réalisé ce que nous appelons "une preuve de concept" », commente Marc Peschanski, directeur scientifique d'I-Stem au génopôle d'Évry (Essonne). Nous attendons les résultats dans les deux ans. » Un éventuel succès pourrait cependant être difficile à étendre au plus grand nombre. « Le procédé n'étant pas du tout industrialisé, nous allons nous retrouver devant un problème éthique : nous aurons le traitement mais pas les moyens de l'appliquer. »
Source : Article de Sciences et Avenir, n° 813, novembre 2014 p. 28.
Une piste autre que les cellules souches : Un collyre anti-cholestérol pour ralentir la DMLA
Une possibilité de ralentir la maladie vient d'être explorée par une équipe de chercheurs américains dirigée par Rajendra Apte, du département d'ophtalmologie de l'École de médecine de l'université Washington à Saint-Louis (Missouri).
Principale cause de malvoyance chez les personnes âgées, la DMLA pourrait être prévenue par des gouttes oculaires évacuant le cholestérol de l'œil. Un essai prometteur chez le rat.
Les injections dans l'œil utilisées pour traiter localement la DMLA pourraient céder la place à un simple collyre. C'est en effet la piste ouverte par des chercheurs américains qui publient une étude dans Cell Metabolism. Selon ce travail, il serait possible de ralentir la prolifération anormale des vaisseaux qui caractérise cette affection en régulant le métabolisme du cholestérol à l'intérieur de l'œil. L'approche qui n'a encore été testée que chez la souris — consisterait à cibler avec un collyre les cellules chargées d'évacuer le cholestérol. Celui-ci retournerait ainsi dans la circulation sanguine et ne s'accumulerait plus dans l'œil, empêchant la maladie de progresser. Cette idée inédite vient compléter l'arsenal des techniques en développement pour préserver ou restaurer la vision (lire Sciences et Avenir, n° 793, février 2013).
Rappelons que le cholestérol est un lipide impliqué dans de nombreux processus biochimiques. Mais quel rapport peut-il exister entre le cholestérol et le développement de vaisseaux sanguins de la rétine ? Il n'y a pas de lien entre DMLA et taux sanguin de cholestérol. La clef s'appelle en fait macrophages. Cette catégorie de cellules immunitaires joue en effet un rôle primordial dans l'élimination du cholestérol de l'œil. Or, les macrophages deviennent moins performants avec l'âge. Il en résulte des dépôts lipidiques qui entretiennent un foyer inflammatoire. Celui-ci favorise le développement de vaisseaux anormaux sous la rétine, responsables d'altérations sévères de la vision centrale. Pour l'heure, on ignore les mécanismes précis qui conduisent ces « vieux » macrophages à induire cette prolifération vasculaire. En revanche, de récents travaux ont montré qu'ils comptaient moins d'ABCAl, une protéine « transporteuse » permettant d'évacuer le cholestérol. Pour preuve, de « jeunes » macrophages dépourvus de ce même transporteur se comportent effectivement comme de « vieux » macrophages, favorisant une vascularisation anormale. D'où l'idée des chercheurs de « booster » l'expression d'ABCAl dans ces cellules afin qu'elles puissent se débarrasser de leur cholestérol et trouver la capacité à réguler la croissance vasculaire.
Pour ce faire, l'équipe de Rajendra Apte, du département d'ophtalmologie de l'École de médecine de l'université Washington à Saint-Louis (Missouri), a utilisé des gouttes ophtalmiques contenant un agoniste du LXR (Liver X Receptor). Cet agent stimule l'action d'un récepteur initialement découvert dans le foie et impliqué dans le métabolisme des lipides. Des études préalables ont en effet montré qu'il augmente la production du transporteur ABCA1 par les macrophages. Et les résultats des essais ont été encourageants : ainsi « dopées », les « vieilles » cellules se sont remises à fabriquer cet indispensable transporteur dans les mêmes proportions que les « jeunes ».
Restait à évaluer cette stratégie sur des souris chez lesquelles on a induit, sous l'effet d'un laser, une croissance anormale des vaisseaux sous-rétiniens, reproduisant ainsi ce que l'on observe chez les patients souffrant de DMLA. Là encore, les résultats ont été positifs. Administré en collyre, l'agoniste du LXR a permis de réduire significativement la prolifération vasculaire chez les souris traitées, les macrophages défaillants parvenant à nouveau à évacuer efficacement le cholestérol.
Il pourrait s'agir d'un progrès thérapeutique majeur
II faut désormais poursuivre ces recherches pour confirmer ces bons résultats, et surtout les appliquer à l'homme, ce qui prendra encore de longues années. S'ils se révélaient concluants, il s'agirait d'un progrès thérapeutique majeur dans la mesure où la fréquence de la DMLA augmente avec l'âge, représentant la principale cause de malvoyance chez les personnes de plus de 50 ans. Selon les chercheurs, « intervenir avant que la maladie ne soit à un stade avance avec des agents efficaces capables de stimuler la sortie du cholestérol de l'œil pourrait empêcher la progression de la maladie. Cette stratégie pourrait être déployée préventivement ».
Source : Marc Gozian Sciences et Avenir, n° 795, mai 2013, pp. 78-79.
12:29 Publié dans Biologie, Médecine | Tags : cellules souches, cellules souches embryonnaires, médecine régénératrice, rétine, thérapie | Lien permanent | Commentaires (3) | ![]() Facebook | | |
Facebook | | |
Élaboration d'une rétine en culture à partir de cellules souches embryonnaires
 Élaboration d'une rétine en culture
Élaboration d'une rétine en culture
à partir de cellules souches embryonnaires
par Yoshiki Sasai[1]
Lors du développement embryonnaire, dans l'utérus, un petit amas de cellules identiques donne naissance aux divers types de cellules du corps humain. Elles s'arrangent en structures variées et finissent par former les organes. Un "programme" interne dirige cette progression depuis des éléments simples jusqu'à des tissus de forme et de taille appropriées.
Les biologistes aimeraient reproduire le développement embryonnaire en laboratoire, à la fois pour mieux comprendre ses mécanismes et pour élaborer des moyens le réparer et remplacer des tissus endommagés. Le succès est peut-être proche : de récents progrès laissent envisager la "culture d'organes" de remplacement à l'extérieur du corps ; ils pourraient être disponibles pour les opérations chirurgicales d'ici dix ans.
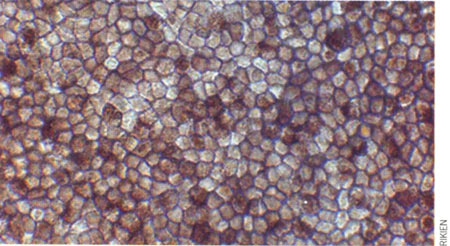
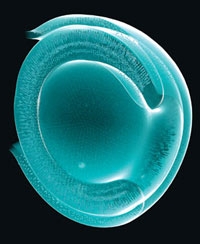
Cellules épithéliales pigmentées de la rétine
Mon optimisme se fonde sur des études sur les cellules souches – des divers types de cellules. Nous avons montré que des cultures de cellules souches peuvent donner naissance à une rétine ; cette structure clef de l'œil traduit la lumière en signaux électriques et chimiques, qui sont ensuite transmis au cerveau. Dans d'autres travaux, nous avons fait pousser du tissu cérébral (cortex) et une partie de l'hypophyse (une petite glande située à la base du cerveau). Pour ce faire, nous avons placé une mince couche de cellules dans une boîte de Pétri, où nous avons ajouté un cocktail de molécules présentes dans l'organisme. Ces cellules se sont développées en une structure tridimensionnelle. Nous espérons que du tissu rétinien produit de la sorte permettra de traiter plusieurs maladies de l'œil, telle la dégénérescence maculaire (la macula est la partie centrale de la rétine.
La formation de la rétine est un phénomène auto-organisé, fondé sur un programme interne des cellules.
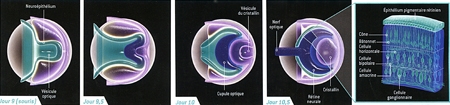
À l'origine, nous cherchions à mieux comprendre la formation de la rétine. Nous savions qu'elle provient d'une partie du cerveau embryonnaire nommée diencéphale. Durant les premiers stades du développement embryonnaire, un segment du diencéphale s'étend pour former la vésicule optique, une structure en forme de ballon. Celle-ci s'invagine, formant la "cupule optique", qui deviendra la rétine (voir figure ci-dessous).
Naissance de la rétine chez l'embryon
L'œil se forme à partir d'un petit amas de cellules embryonnaires. Au début, une couche de tissu, le neuroépithélium, se replie vers l'extérieur, donnant naissance à la vésicule optique (jour 9). La paroi de ce bourgeon s'incurve ensuite vers l'intérieur (jour 9,5), et la vésicule du cristallin se développe (jour 10). Une partie de la vésicule optique engendre la cupule optique, à l'origine de la rétine et du nerf optique (jour 10,5). La rétine contient trois couches distinctes de cellules (à l'extrême droite), l'une d'elles étant constituée des photorécepteurs (les bâtonnets et les cônes). La rétine représentée ici, d'une taille de 250 micromètres est celle d'une souris. La rétine humaine est similaire, mais plus grosse, et sa formation est plus longue.
Depuis plus d'un siècle, les biologistes débattent sur le mécanisme de formation de la cupule optique. Une question importante concerne le rôle des structures voisines, telles que le cristallin et la cornée. Certains chercheurs pensent que le cristallin façonne la cupule optique en exerçant une pression sur la vésicule, tandis que d'autres affirment que la cupule peut se former sans lui et sans les autres tissus voisins.
Il est difficile d'observer les mécanismes physiologiques sous-tendant le développement sur des animaux vivants. Il y a environ dix ans, nous avons donc décidé de reproduire le développement de l'œil dans une boîte de Pétri. Pour ce faire, nous avons utilisé des cellules souches embryonnaires, que nous avons exposées à diverses substances chimiques connues pour être impliquées dans la formation de l'œil. Les cellules souches embryonnaires constituent le type le plus immature de cellules souches. Elles sont capables de se différencier en tous les types cellulaires du corps, des neurones jusqu'aux cellules musculaires.
Aucune technique existante ne permettait d'engendrer des organes à partir de cultures de cellules souches. Des essais avaient été réalisés en plaçant les cellules sur une sorte d'échafaudage artificiel, qui imitait la forme de l'organe ciblé (en l'occurrence une vessie ou un œsophage), mais ils n'avaient remporté qu'un succès mitigé. Nous avons donc tenté une approche différente.
En 2000, nous avons élaboré une méthode pour transformer des cellules souches embryonnaires de souris en différents types de neurones. Nous avons ensuite placé une monocouche de ces cellules souches dans une boîte de Pétri, avec des cellules dites nourricières : ces dernières transmettaient des signaux chimiques déclenchant la différenciation des cellules souches embryonnaires. Cette couche mince ne reproduisait pas les organes tridimensionnels réels, mais nous désirions déjà savoir si les molécules sélectionnées suffisaient à obtenir les types particuliers de neurones apparaissant précocement lors du développement de l'œil.
Après des débuts difficiles, nous avons développé une nouvelle méthode en 2005, qui nous a permis de dépasser le stade bidimensionnel : nous avons créé une suspension de cellules souches dans un milieu liquide, qualifiée de culture flottante. L'intérêt d'une telle culture tridimensionnelle est double. Tout d'abord, un agrégat de cellules est mieux à même de prendre la forme des tissus s'il est tridimensionnel que s'il est plat. Ensuite, la formation de structures complexes requiert de multiples communications entre cellules, et ces dernières interagissent plus facilement dans une culture tridimensionnelle.
Nous avons placé des cellules en suspension dans de petits réservoirs - comptant chacun en moyenne 3 000 cellules - au sein d'une boîte de Pétri. Initialement séparées les unes des autres, les cellules se sont liées avec leurs voisines. Nous avons ensuite déclenché la différenciation de ces petits agrégats de cellules en des progéniteurs neuronaux (des cellules neuronales immatures) présents à l'avant du cerveau. Les cellules ont alors commencé à échanger des signaux.
Trois à quatre jours plus tard, elles se sont organisées spontanément en une sphère creuse formée d'une couche cellulaire ; on parle de neuroépithélium. Nous avons nommé SFEBq cette méthode de culture (pour Serum free floating culture of embryoid body-like aggregate with quick reaggregation, littéralement culture sans sérum flottante d'agrégats embryonnaires se réagrégeant rapidement).
Dans l'embryon, les cellules neuroépithéliales forment des structures cérébrales spécifiques, après avoir reçu des signaux chimiques externes. L'un de ces signaux déclenche le développement du diencéphale, qui engendrera la rétine et l'hypothalamus (une aire cérébrale contrôlant l'appétit et de nombreuses fonctions physiologiques fondamentales). Après avoir fait s'agréger les cellules en sphères, nous avons provoqué leur différenciation en progéniteurs rétiniens - les précurseurs des cellules rétiniennes matures. Pour ce faire, nous avons ajouté à notre culture un mélange de protéines, incluant celles qui assurent ce rôle chez l'embryon.
Quelques jours plus tard, des structures semblables à la vésicule optique ont spontanément bourgeonné sur les sphères, avant de changer de forme : la structure finale ressemblait à la cupule optique de l'œil embryonnaire (voir figure ci-dessous). Comme la cupule optique des animaux vivants, cette structure issue de cellules souches embryonnaires se composait de deux parois (deux épithéliums), l'une extérieure et l'autre intérieure ; c'est cette dernière qui est à l'origine de la rétine.
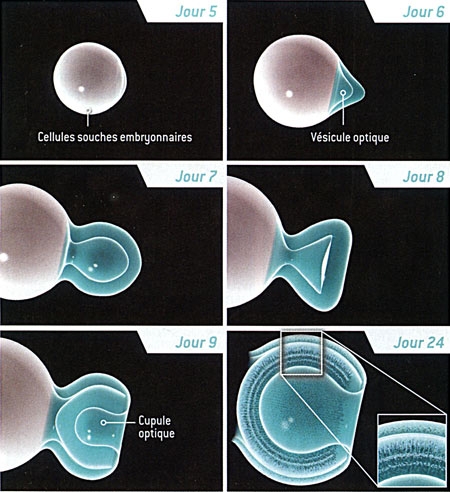
Formation de la rétine à partir d'une cellule souche
La formation d'une rétine à partir d'une culture de cellules souches embryonnaires ressemble à ce qui se produit dans l'utérus. Les cellules s'agrègent et commencent à former la vésicule optique "primitive" environ cinq jours après avoir été mélangées avec des substances nommées facteurs de croissance. Cette vésicule gonfle, puis forme la cupule optique. Le 24e jour, toutes les couches de la rétine sont visibles.
Ainsi, une structure ordonnée est née de la seule agrégation de cellules souches dans un récipient. Contrairement à ce qui se passe chez l'embryon, il ne se formait pas de cristallin ou de lentille au voisinage de la cupule optique. Nos travaux montrent donc qu'aucune force exercée par des tissus voisins (tel le cristallin) n'est nécessaire à la formation de la protorétine. Au moins in vitro, c'est un phénomène auto-organisé, fondé sur un programme interne des cellules. Ce programme est encodé dans leur ADN, et nous travaillons à préciser ses mécanismes d'action.
L'apparition spontanée d'une structure stratifiée
Le développement normal de la rétine, tel qu'on l'observe chez les embryons, s'est poursuivi dans nos cultures. En deux semaines supplémentaires, la cupule optique a grandi jusqu'à environ deux millimètres de diamètre, et l'épithélium monocouche interne est devenu une structure stratifiée, contenant les six catégories de cellules d'une rétine naturelle après la naissance. L'une des couches extérieures de cette structure était constituée de photorécepteurs et l'autre de cellules dites ganglionnaires, qui, dans le corps, relient la rétine au cerveau. Entre les deux se trouvaient plusieurs couches de cellules de liaison, nommées interneurones.
De nombreuses questions demeurent, notamment sur la façon dont une boule de cellules entre dans un programme de différenciation, qui aboutit à des tissus distincts. Tout au long du développement embryonnaire, des formes complexes apparaissent spontanément à partir d'amas de matière homogène - on parle de brisure de symétrie. En l'absence de ce phénomène, les divisions cellulaires de l'œuf fécondé n'engendreraient qu'une masse indifférenciée de cellules. Nos cultures de cellules souches embryonnaires qui s'auto-organisent devraient aider à mieux comprendre les mécanismes en jeu dans les brisures de symétrie.
On cherche également à mieux comprendre comment s'effectue le modelage de la cupule optique à partir d'une simple couche de cellules (l'épithélium rétinien). La force qui s'applique sur les cellules et la rigidité varient dans l'épithélium. En mesurant in vitro la direction de la force et la rigidité du tissu en différents endroits, nous avons découvert que la cupule optique se forme en plusieurs étapes. Tout d'abord, la rigidité de la protorétine diminue, ce qui accroît sa flexibilité. Dans le même temps, les cellules qui se trouvent à la jonction de l'épithélium (la boule dont a bourgeonné la rétine) et de la protorétine adoptent une forme en coin. Finalement, la protorétine commence à se replier vers l'intérieur en raison de sa rapide extension. Nous avons appliqué les conditions mécaniques correspondantes à une simulation sur ordinateur, et la forme de la cupule optique est apparue !
Pour y voir plus clair...
Nos travaux aideront-ils à lutter contre les troubles oculaires humains ? Nous avons progressé dans cette voie. En particulier, mon équipe a récemment recréé une cupule optique et un tissu neuronal à couches multiples à partir de cellules souches embryonnaires humaines. La même méthode de culture devrait être applicable à des cellules souches humaines dites pluripotentes induites - des cellules matures et différenciées dont on a « inversé » le développement pour qu'elles se comportent comme des cellules souches embryonnaires. Nous avons également inventé une méthode fiable de cryoconservation, qui permet de stocker du tissu rétinien issu de cellules embryonnaires humaines dans de l'azote liquide.
Ces travaux promettent des applications médicales. Par exemple, nous pourrions créer des rétines artificielles, qui aideront à étudier les maladies de l'œil et, peut-être, à développer des médicaments et des thérapies géniques pour inverser la dégénérescence rétinienne.
Trois catégories de dégénérescence rétinienne pourraient bénéficier de nos recherches : la dégénérescence maculaire, la rétinopathie pigmentaire et le glaucome. Ces maladies touchent des millions d'individus à travers le monde et altèrent des couches différentes de la rétine.
Dans la dégénérescence maculaire, un tissu nommé épithélium pigmentaire rétinien est endommagé : ce tissu tapisse le fond de la rétine et supporte les photorécepteurs, qui se détériorent également, en particulier dans la région centrale de la rétine.
Dans la rétinopathie pigmentaire, les bâtonnets (un type de photorécepteurs) disparaissent progressivement pendant plusieurs années. La maladie se manifeste d'abord par une cécité nocturne, ou héméralopie, puis le champ visuel se réduit jusqu'à se limiter à une petite zone au centre, avant que le patient ne devienne totalement aveugle.
Enfin, le glaucome endommage les cellules ganglionnaires, qui relient la rétine au cerveau via le nerf optique.
De ces trois maladies, la dégénérescence maculaire semble la plus susceptible d'être traitée par une thérapie cellulaire. Pour obtenir les cellules nécessaires au remplacement de l'épithélium pigmentaire rétinien endommagé, on transforme des cellules souches embryonnaires humaines ou des cellules souches pluripotentes induites, au sein de cultures conventionnelles ou flottantes. Des essais cliniques à petite échelle ont débuté aux États-Unis et sont prévus dans d'autres pays : les cellules d'épithélium pigmentaire issues de cellules souches sont injectées sous la rétine avec une fine aiguille, afin de remplacer au moins une partie du tissu endommagé.
Pour la rétinopathie pigmentaire, la thérapie cellulaire est une perspective plus lointaine. À l'inverse d'une culture classique, notre méthode peut engendrer une couche dense de bâtonnets facilement transplantable. En revanche, ces photorécepteurs doivent s'intégrer dans le circuit neuronal de l'œil - ce qui n'était pas nécessaire pour l'épithélium, simple tissu de soutien. Ainsi, ils doivent se connecter à un autre type de cellules sensorielles, les cellules bipolaires, et nous ne savons pas encore comment réaliser cette connexion.
Le glaucome pourrait être la plus difficile des trois maladies à traiter par thérapie cellulaire. Des cultures de cellules souches embryonnaires peuvent produire les cellules ganglionnaires nécessaires, mais dans l'œil postnatal, le nerf optique ne se reforme pas spontanément. Autrement dit, une fois les cellules ganglionnaires transplantées, on ne sait pas connecter leurs axones (les prolongements des neurones qui forment le nerf optique) aux cellules cérébrales.
Notre méthode a décuplé les possibilités des tissus formés à partir de cellules souches embryonnaires. Reste à découvrir ce qu'elle peut nous apprendre sur les mécanismes qui conduisent d'une cellule unique à un organe aussi complexe que l'œil...
BIBLIOGRAPHIE
Y. Sasai (2013). – Une rétine en culture. Pour la Science, n° 426 avril 1993, pp. 58-63.
T. Nakano et al. (2012). - Self-formation of optic cups and storable stratified neural retina from human ESCs, Cells Stem Cell, vol. 10, pp. 771-785.
D Schwartz et al. (2012). - Embryonic stem cell trials for macular degeneration : a preliminary report, Lancet, vol. 379, pp. 713-720, 2012.
M. Eiraku et al. (2011). - Self-organizing optic-cup morphogenesis in three-dimensional culture, Nature, vol. 472, pp. 51-56.
Les alternatives thérapeutiques aux cellules souches
par Serge Picaud et José Sahel, Institut de la vision, Paris
Si les cellules souches ouvrent de nouvelles perspectives thérapeutiques pour les patients aveugles, une autre technique en est déjà au stade commercial : celle des prothèses rétiniennes. Ces dispositifs visent à stimuler artificiellement une rétine ayant perdu ses photorécepteurs. Les images, filmées par une caméra fixée sur une paire de lunettes, sont d'abord transformées en matrices d'impulsions électriques. Celles-ci sont ensuite transmises à des électrodes implantées sur la rétine résiduelle (voir la figure ci-dessous).
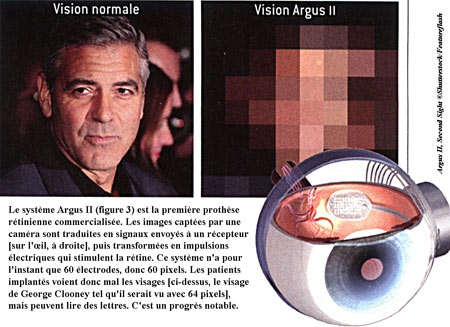
Commercialisée depuis deux ans en Europe, la première prothèse rétinienne opérationnelle a reçu l'autorisation de mise sur le marché aux États-Unis en février 2013. En France, quatre patients aveugles ont participé aux essais cliniques. Cependant, les images perçues ne sont constituées que de 60 points ou pixels, puisque l'implant n'a que 60 électrodes : c'est insuffisant pour bien voir une image complexe, tel un visage, mais suffisant pour une image simple, de sorte que certains patients sont capables de lire des lettres d'environ 10 centimètres de hauteur.
De nombreux chercheurs tentent d'augmenter le nombre de pixels, chaque électrode devant activer une zone disjointe de sa voisine. Ainsi, à l'Institut de la vision, on poursuit plusieurs objectifs : le développement de nouvelles formes tridimensionnelles pour les implants, avec l'ESIEE (École supérieure d'ingénieurs en électrotechnique et électronique) et le CEA; l'utilisation de matériaux semi-conducteurs différents, tels le graphène et le diamant (projet européen NEUROCARE) ; l'amélioration du codage des informations visuelles.
Une piste alternative, la thérapie optogénétique, est inspirée d'algues unicellulaires et de bactéries dotées de protéines photosensibles. Ces protéines sont des canaux ioniques dont l'ouverture est contrôlée par la lumière. L'idée est d'insérer le gène qui les code dans les neurones non photosensibles de la rétine, qui pourraient alors être activés par la lumière.Ainsi, chaque cellule produisant les protéines jouerait le rôle d'un pixel. Ces protéines étant moins performantes que nos pigments visuels, les aveugles devront porter des lunettes rehaussant la luminance.
Ainsi, dans le cadre du projet européen RETICIRC, nous avons rendu la vue à des souris aveugles grâce à une protéine bactérienne. Nous avons ensuite montré que cette protéine permet l'activation de cellules rétiniennes humaines par la lumière, grâce à des cultures de cellules prélevées post mortem. Avant de passer à une application clinique, nous devrons vérifier que la thérapie génique visant à faire exprimer la protéine bactérienne n'entraîne pas d'inflammation ou de rejet chez le primate.
[1] Yoshiki SASAI est directeur du groupe d'organogenèse et de neurogenèse au Centre de biologie du développement du RIKEN, à Kobe, au Japon. Plus d'information sur Y. Sasai et ses recherches.
12:05 Publié dans Biologie, Médecine | Tags : cellules souches embryonnaires, rétine, culture organotypique, macula, dmla, rétinopathie pigmentaire, glaucome, prothèse rétinienne | Lien permanent | Commentaires (2) | ![]() Facebook | | |
Facebook | | |
27/07/2012
Controverse acide sur les cellules souches
 Controverse acide sur les cellules souches
Controverse acide sur les cellules souches
Un article paru dans la revue "Sciences & Vie" de mai 2014 fait état de l'obtention de cellules souches par choc acide à la suite de travaux d'une équipe japonaise, résultats publiés dans "Nature" de janvier 2014. (Nature 01/2014; 505(7485):641-7.)
Dans "Pour la Science" en ligne (avril 2014), un article de Yvan Pandelé[1] fait le point sur cette publication. Ci-dessous la publication in extenso de cet article.
La récente découverte d’une méthode pour fabriquer des cellules souches par choc acide a suscité l’enthousiasme de la communauté scientifique. Avant d’être gravement mise en doute...
La nouvelle avait fait grand bruit. En janvier dernier, des chercheurs japonais et américains annonçaient avoir réussi à transformer des cellules de souris adultes en cellules souches par une nouvelle méthode : la soumission à un choc acide. Nommées STAP (Stimulus-triggered acquisition of pluripotency), les cellules souches obtenues seraient pluripotentes, c'est-à-dire capables de se différencier en de nombreux types cellulaires une fois réinjectées chez l’embryon.
Assez vite cependant, les publications concernées – un article et une lettre parues dans la revue Nature le 30 janvier dernier – ont suscité des doutes. Des chercheurs ont pointé des détails problématiques : incohérence méthodologique, images modifiées ou reprises de la thèse de doctorat du premier auteur… Des observations qui, mises bout à bout, commençaient à faire désordre.
Plus grave, aucune équipe de recherche n’est jusqu’à présent parvenue à répliquer les résultats. On s’est également aperçu que les cellules STAP produites ne provenaient pas de la souche de souris mentionnée dans l’article, mais de deux autres souches. Sur son blog de recherche, Paul Knoepfler, spécialiste des cellules pluripotentes à l’Université de Californie à Davis, a publié une série de sondages informels qui semblent indiquer un scepticisme croissant au sujet de l’existence des cellules STAP.
Une découverte prometteuse
La méthode découverte par Haruko Obokata et ses collègues semblait pourtant très prometteuse, combinant une technique simple – modifier l’acidité du milieu de culture – et des résultats encourageants. En effet, les cellules STAP présenteraient un potentiel de différenciation encore supérieur aux cellules pluripotentes induites (IPS) obtenues par reprogrammation génétique, récompensées par un prix Nobel de médecine en 2012. Les enjeux sont forts : la thérapie cellulaire à base de cellules souches permettra peut-être de traiter de nombreuses maladies, en remplaçant les tissus ou les organes lésés.
Certains des auteurs impliqués dans la découverte des cellules STAP se sont exprimés publiquement. Teruhiko Wakayama, chercheur à l’Université de Yamanashi, s’est prononcé en faveur d’un retrait des articles : le 10 mars dernier, il déclarait avoir perdu confiance dans le travail effectué et préférer approfondir les recherches en vue d’une éventuelle republication. Charles Vacanti, auteur sénior et chercheur à la Faculté de médecine de Harvard, continue pour sa part de défendre la validité de l’étude. Le 20 mars dernier, il mettait à la disposition de la communauté une version détaillée du protocole employé, afin de faciliter d’éventuelles réplications.
Des accusations de fraude
Mais les critiques se focalisent surtout sur le premier auteur, Haruko Obokata, une jeune biologiste (30 ans) responsable d’équipe au Riken, un prestigieux institut de recherche japonais. À la suite des suspicions émises, le Riken a rapidement lancé une enquête interne. Les conclusions, parues à la fin du mois de mars, sont sévères vis-à-vis de Haruko Obokata, qui se voit accusée d’avoir manipulé volontairement certaines données annexes, se rendant coupable de fraude scientifique (scientific misconduct). Dans une conclusion au vitriol, les rapporteurs estiment le protocole expérimental difficile à suivre – donc à reproduire – et vont jusqu’à déplorer « le manque total d’intégrité et d’humilité » de la chercheuse.
Violemment mise en cause par son propre institut et au centre d’un ouragan médiatique, Haruko Obokata a répliqué mercredi 9 avril dans une conférence de presse. Visiblement très éprouvée, elle s’est excusée pour les erreurs commises, mais plaide la bonne foi et maintient la validité des résultats de son équipe. « Le phénomène des cellules STAP est une réalité que j'ai vérifiée à plus de 200 reprises », affirme-t-elle, ajoutant que le protocole a été répliqué par une tierce personne. Le Riken a confirmé cette dernière information tout en minimisant les résultats obtenus, affirmant qu’ils ne constituaient pas une réplication complète. Le chercheur en question, également membre de l'institut japonais, semble vouloir conserver l’anonymat. Jusqu’à ce que ses résultats soient confirmés ?
Un retrait des articles ?
La question de l’existence des cellules STAP reste donc ouverte. Pour l’heure, la revue Nature n’a pas annoncé de retrait des publications mises en cause, et continue de couvrir l’affaire sur son blog d’actualité. Quant aux réactions des institutions de recherche, elles sont contrastées. Si le Riken a joué la transparence et a mis beaucoup d’ardeur à se désolidariser de H. Obokata, l’Université Harvard est pour sa part restée silencieuse. Toujours est-il qu’en l’absence de demande de retrait de la part des institutions scientifiques ou des principaux auteurs, les publications restent, jusqu’à nouvel ordre, valides.
Ces dernières années, on observe une augmentation du nombre de rétractations d’articles scientifiques. Une revue conduite en 2012 sur la base PubMed, qui référence un très grand nombre d’articles dans le champ biomédical, a montré que les deux tiers des rétractations étaient dues à des cas de fraude scientifique, c'est-à-dire du plagiat (ou auto-plagiat) ou de la manipulation volontaire de données. Cette hausse pourrait toutefois révéler, plutôt qu’une intensification des mauvaises pratiques, une plus grande sensibilité du système de détection.
En cas de fraude avérée, le scandale est généralement à la mesure des espoirs suscités. En 2005, dans un article publié dans Science, une équipe de recherche coréenne avait affirmé avoir créé des cellules souches embryonnaires à partir de clones humains… Las, la découverte s’était révélée factice et l’article avait été retiré dans un scandale retentissant. Espérons que l’affaire des cellules STAP ne connaîtra pas la même issue.
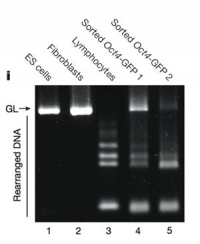
© Haruko Obokata
Cette figure, qui présente le résultat d'une électrophorèse sur gel, a été falsifiée (le couloir 3 correspond à un gel différent des autres couloirs). Il s'agit d'un des deux cas de fraude scientifique identifiés par l'institut de recherche où travaille Haruko Obokata.
Pour en savoir plus
M.-N. Cordonnier, Des cellules souches produites par choc acide, Pour la Science, en ligne le 8 février 2014.
H. Obokata et al., Stimulus-triggered fate conversion of somatic cells into pluripotency, Nature, vol. 505, pp. 641-647, 30 janvier 2014.
H. Obokata et al., Bidirectional developmental potential in reprogrammed cells with acquired pluripotency, Nature, vol. 505, pp. 676-680, 30 janvier 2014.
F. C. Fang et al., Misconduct accounts for the majority of retracted scientific publications, PNAS, 109(42), 2012.
D. Fanelli, Why growing retractions are (mostly) a good sign, PLOS Medicine, 10(12), 2013.
[1] Yvan Pandelé est journaliste à Pour la Science.
09:15 Publié dans Actualité des Sciences, Médecine | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
24/07/2012
L'agroterrorisme dans nos assiettes
Alerte à tous les futurs cancéreux
que nous sommes !

« J'ai autrefois craché le sang à la suite de traitements chimiques avec lesquels j'empoisonnais moi-même les autres… Tout le monde sait que les produits chimiques sont cancérigènes. » 30 juillet 1972, 20 h, première chaîne de télévision, le présentateur Philippe Gildas relate le congrès international de la défense de la Nature, tenu à Fleurance (Gers), dont le maire était alors l'illustre Maurice Mességué.
Chaque jour, chaque fois que vous ingérez un aliment, une boisson, vous risquez de contracter un cancer. L'agriculture et son complice capitaliste l'agro-alimentaire nous tuent à petit feu. C'est probablement le plus grand scandale du troisième millénaire.
Ne serait-il pas judicieux d'étendre le délit de risque causé à autrui (articles 223-1 & 2 du code pénal) aux atteintes sanitaires des consommateurs, victimes involontaires, et non seulement des exploitants volontaires ?
http://www.wat.tv/video/son-cancer-aux-pesticides-50ch5_2...
Morts de kamikazes, et nous ? Car ce n'est pas QUE la dose qui fait le poison, mais aussi la durée de l'empoisonnement :
http://videos.tf1.fr/infos/2010/agriculteurs-victimes-du-...
http://www.dailymotion.com/video/xqdpak_la-mort-est-dans-...
Alors qu'il est déjà trop tard parce que tous les sols et bien des corps sont irréversiblement contaminés, ici et là, le combat ne fait que commencer
Comme en Inde :
http://www.youtube.com/watch?v=Tq4EjQDiPIw
Ou en Argentine :
http://www.lapresse.ca/international/amerique-latine/2012...
Et en Europe : ?

Contre toutes censures, un livre aborde pour la première fois l'agriculture et sa logique de mort, il s'annonce comme un best-seller :
L’AGROTERRORISME DANS NOS ASSIETTES
Michel Tarrier, 256 pages, Éditions LME
http://www.amazon.fr/Agroterrorisme-dans-assiettes-Michel...
Consultez aussi :
http://www.notre-planete.info/actualites/com.php?id=2122
Et pour en parler, vous pouvez rejoindre ce réseau :
http://www.facebook.com/groups/paysansvoyous/
19:14 Publié dans Environnement-Écologie, Pollution | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
23/07/2012
Kokopelli : Biodiversité sacrifiée sur l'autel de la productivité
La Biodiversité sacrifiée
sur l'autel de la productivité
La Cour de Justice de l'Union Européenne désavoue Kokopelli et son propre avocat général
Suite au jugement scandaleux de la Cour Européenne de Justice — qui prouve une fois de plus que ces institutions Européennes sont complètement corrompues et à la botte des banskters, du Cartel de la Chimie, des multinationales biocidaires et autres marionnettes politiques — certains amis de Kokopelli ont pensé qu'il était adéquat de relancer des énièmes pétitions pour la défense des semences libres.
(Pour plus de détails, voir l'article correspondant sur le site de Kokopelli.)
10:09 Publié dans Actualité des Sciences, Pollution | Tags : kokopelli, semences, cour européenne de justice | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
21/07/2012
Cellules souches : obtenir des neurones à partir de fibroblastes
 Obtenir des neurones
Obtenir des neurones
à partir de fibroblastes
Les cellules de l'organisme, y compris les neurones possèdent la même information génétique, mais elle n'est pas lue de la même façon selon le type cellulaire. On sait aujourd'hui agir sur cette lecture, notamment à l'aide de facteurs de transcription, des protéines qui se fixent sur l'ADN et régulent sa transcription en ARN. Grâce à un seul de ces facteurs, l'équipe de Karen Ring et Yadong Huan, de l'Université de Californie (San Francisco) a réussi à obtenir des réseaux de neurones à partir de fibroblastes humains et de souris.
Pour transformer les fibroblastes en d'autres cellules, on les place dans un milieu de culture adapté, qui recrée l'environnement physico-chimique des cellules qu'on cherche à obtenir, et l'on provoque la sur-expression des facteurs de transcription responsables de la différenciation visée.
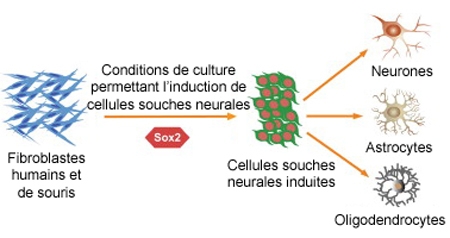
Protocole de l'expérimentation
Cette dernière opération consiste à faire produire en masse ces facteurs de transcription par la cellule. L'équipe de Y. Huang et de Karen Ring n'en a utilisé qu'un seul, nommé Sox2. D'autres équipes avaient également obtenu des neurones, mais elles avaient fait appel à un nombre bien plus important de facteurs de transcription.
En quelques jours, les fibroblastes se sont transformés en cellules souches neurales induites (iNSCs). Celles-ci se sont divisées et se sont différenciées en astrocytes, oligodendrocytes et en neurones fonctionnels. En moins d'un mois, ces neurones se sont associés en réseaux.
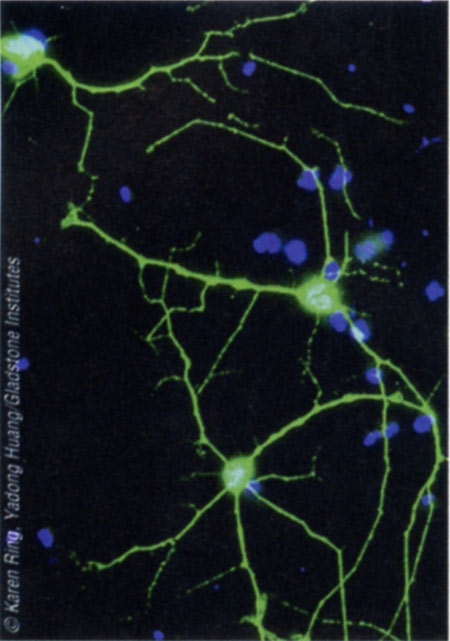
Neurones issus de la transformation de fibroblastes
Pour vérifier que les cellules reprogrammées ne risquaient pas de dégénérer en cellules cancéreuses, l'équipe américiane les a greffées dans le cerveau d'une souris. Elles s'y sont intégrées sans causer de tumeur. Ainsi, par ce type de reprogrammation, les iNSCs auto-renouvelables et multipotentes sans potentiel tumorigène peuvent être générées directement à partir de fibroblastes. Ces cellules seront peut-être utiles dans la lutte contre les maladies neurodégénératives, telles celles d'Alzheimer et de Parkinson ; elles permettront de tester les médicaments élaborés.
Source :
K. King et al. (2012). - Direct Reprogramming of Mouse and Human Fibroblasts into Multipotent Neural Stem Cells with a Single Factor. Cell Stem Cell, 7 juin 2012.
21:47 Publié dans Actualité des Sciences, Biologie, Médecine | Tags : cellules souches, fibroblastes, neurones, astrocytes, oligodendrocytes, cellules souches neurales induites, inscs | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
20/07/2012
L’Université de Franche-Comté et la fédération de pêche du Doubs au chevet de la Loue
L’Université de Franche-Comté
et la fédération de pêche du Doubs
au chevet de la Loue
(18/07/2012)
Classée comme l'une des plus belles rivières d'Europe pour la pêche à la mouche, la Loue se fraie dans le massif du Jura une reculée creusant d'abruptes falaises calcaires, au pied desquelles moucheurs locaux et touristes aiment venir titiller la truite et l'ombre.
"La vallée a connu un tourisme de masse lié à la pêche à la mouche, avec des personnes qui avaient les moyens et venaient de toute l'Europe. Mais depuis le début des années 2000, les pêcheurs fuient cette rivière dans un état lamentable, où ils voient les poissons mourir", constate Alexandre Cheval, garde-pêche dans la Vallée de la Loue. "Aujourd'hui, ils préfèrent aller en Slovénie ou en Roumanie sur des cours d'eau comparables à la Loue il y a 30 ans", ajoute-t-il. Le nombre des cartes de pêche enregistrées par la fédération sur le secteur de la Loue est passé de 2000 il y a dix ans à près 400 l'année dernière.
Mais depuis 1973 "la population piscicole a diminué de 70 à 80% sur certains secteurs de la Loue" qui s'écoule d'Ouhans dans le Doubs à Parcey dans le Jura, affirme Thomas Groubatch, chargé de mission à la Fédération de pêche du Doubs. Néanmoins, il pense qu'il "reste quelques secteurs refuges, mais ils sont rares. Il faut agir vite pendant que ces zones existent encore".
Des polluants d'origines diverses (population humaine, agriculture ou industrie), ainsi que l'aménagement des rivières (seuils et barrages) sont notamment mis en cause.
"Ce n'est pas une pollution ponctuelle, mais chronique. La rivière se dégrade de plus en plus et les milieux naturels ont de plus en plus de mal à supporter la pollution. La situation est plus qu'alarmante", s'inquiète Alexandre Cheval, qui redoute qu'un "point de non-retour" ait été atteint.
Pour lutter contre cette pollution, les services de l'État ont engagé une série d'actions comme le renforcement des règles d'épandage du lisier, l'installation de passes à poissons ou un effort de sensibilisation des industriels.
La Loue va être auscultée sous toutes les coutures. Les chercheurs du Laboratoire de Chrono-environnement viennent de commencer leurs travaux. Annoncée depuis au moins un an, cette vaste étude prévue sur cinq ans a enfin commencé dernièrement. D'après François Degiorgi, l’un des coordinateurs de cette étude, “Il s’agit d’un travail pluridisciplinaire qui porte aussi bien sur le bassin versant que sur la rivière. L’objectif est de localiser les causes du mauvais état de la Loue puis de chercher à les relier à une spacialisation des effets dans la rivière”.
Pendant une première phase de trois ans, une quinzaine de chercheurs va travailler sur le terrain pour cette étude. Une équipe pluridisciplinaire formée de chimistes, biologistes, géologues, pédologues. La plupart d’entre eux sont rattachés au laboratoire de chrono-environnement mais le laboratoire de géographie Théma, le Muséum d’Histoire naturelle de Besançon, l’Université de Neuchâtel, le laboratoire d’analyses de Poligny prêteront également main-forte à l’équipe.
Déjà des universitaires ont prélevé des larves et des insectes adultes au bord de la Loue pour pouvoir évaluer la qualité du milieu de façon beaucoup plus précise que les indicateurs utilisés habituellement pour classer les rivières.
Autre partenaire de taille, la Fédération de Pêche du Doubs. Dès lundi, une soixantaine de pêcheurs est mobilisée chaque jour de la semaine pour réaliser des pêches électriques afin d’effectuer de nouveaux inventaires piscicoles sur au moins huit stations de la Loue. Toutes les associations de pêche de la vallée, les fédérations de pêche des départements de Bourgogne et de Franche-Comté, le département de l’Ain ainsi que des bénévoles sont mobilisés la semaine prochaine.
Tout les amoureux de la Loue ont encore en tête les images des relevés piscicoles effectués, eux aussi à grand renfort de moyens et de médias par l’Onema en 2010. Alors, pourquoi recommencer et ne vaudrait-il pas commencer à agir concrètement pour diminuer les sources de pollution ?
« Pour que les politiques se bougent encore plus, il faut des preuves sur les origines de la pollution, explique Alexandre Cheval, garde pêche de la fédération du Doubs, cette étude va permettre d’affiner le tir, il nous faut des connaissances les plus fines possibles pour réajuster le tir. En 2010, l’Onema n’avait travaillé que sur quatre stations ».
Les politiques se sont déjà bougés en finançant cette étude qui coûte 360 000 euros pour la première phase. Environ 80% de cette somme est prise en charge par l’Agence de l’Eau, le conseil général du Doubs et le conseil régional de Franche-Comté ; le reste étant financé par l’Université de Franche-Comté.
De nombreuses études ont été réalisées ces vingt dernières années, pas forcément coordonnées. Tout l’enjeu de ce travail va être de savoir capitaliser les résultats déjà publiés et surtout d’identifier beaucoup plus précisément l’impact des activités humaines sur le bassin versant de la Loue. En 2015, la directive européenne sur l’eau devra être renouvelée. Les premiers résultats de cette étude sur la Loue pourraient bien être examinés de près. De ses malheurs, la Loue pourrait ainsi en tirer un petit bénéfice. La rivière, connue dans toute l’Europe par les pêcheurs à la mouche, pourrait se faire aussi une réputation auprès des milieux scientifiques en étant devenue un véritable laboratoire à ciel ouvert.
En Franche-Comté, le Doubs franco-suisse, dont la Loue est à la fois un affluent et une résurgence, le Dessoubre et le Cusancin sont confrontés à un même problème de pollution et de mortalité piscicole.
Isabelle Brunarius
(France 3 Franche-Comté)
Source :
Blog.france3.fr/vallee-de-la-loue
Voir également dans ce même blog :
- Ces Saprolegnia qui parasitent les poissons
- La santé du Doubs mise à prix
- Mortalité des poissons dans le Doubs
- l'alerte lancée par Pascal P.
- Menaces sur le Doubs franco-suisse
- Proliférations algales dans la Haute vallée du Doubs
- Prolifération de Cyanobactéries dans la Loue
- Pathologie des poissons d'eau douce

14:53 Publié dans Environnement-Écologie, Géologie-hydrogéologie-Climatologie, Limnologie-hydrobiologie, Nature et santé, Poissons, Pollution | Tags : poissons, maladies, saprolegnia parasitica, pathologie des poissons, doubs, loue, dessoubre, saprolegnia, état sanitaire, faune halieutique, doubs franco-suisse, montbéliard | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
06/07/2012
Créer des dents biologiques grâce à des cellules souches
 Créer des dents biologiques
Créer des dents biologiques
grâce à des cellules souches
par Sylvie Riou-Milliot
Encore un autre espoir de la médecine régénérative : cette technique est capable aujourd'hui de créer des dents biologiques grâce à des cellules souches (voir l'article sur ce blog concernant les potentialités des cellules souches). Plusieurs équipes de chercheurs dans le monde y sont déjà parvenues sur la souris. Des essais vont bientôt démarrer chez l'Homme. Et à terme cette technique remplacera la pose d'implants.
Or, un implant n'est finalement qu'une vis, le plus souvent en titane, fixée dans de l'os avec lequel elle fait bon ménage en raison de facteurs de biocompatibilité. Une technique qui se révèle en fait incomplète. « Si cette nouvelle architecture artificielle rétablit la fonction masticatoire, elle ne restaure en rien la fonction biologique, poursuit le spécialiste. Car un implant ne compense pas l'absence de pulpe dentaire, cette zone qui confère à la dent sa vitalité, ni celle du ligament alvéolodentaire, un élément essentiel qui assure un rôle d'amortisseur des forces masticatoires. Régénérer des dents serait donc nettement plus physiologique ! Grâce au développement de l'ingénierietissulaire et des biotechnologies, nous savons aujourd'hui que d'ici à quelques années à peine, cela sera possible. »
Recréer une biodent
D'après le Pr Henry Magloire, président de l'Institut français pour la recherche en odontologie (Ifro), enseignant à la faculté d'odontologie de Lyon et chercheur à l'Institut de génomique de Lyon : « Recréer une "biodent" est un véritable challenge pour les chercheurs. Quelques rares équipes dans le monde y sont déjà parvenues chezl'animal. Pour l'Homme, ce sera évidemment plus difficile car la dent est un organe complexe dont on n'arrive pas encore à contrôler ni la forme ni la taille, encore moins la couleur ou la direction dans laquelle la "néodent" va se former. »
C'est à Strasbourg, dans l'unité Inserm UMR 977, que l'équipe d'Hervé Lesot a réussi à générer in vitro une dent à partir de cellules embryonnaires de souris. Au Japon, d'autres chercheurs sont allés plus loin. « L'équipe du Pr EtsukoIkeda, de l'université des sciences de Tokyo, a elle aussi créé un germe dentaire, mais elle l'a ensuite réimplanté dans une mâchoire de rongeur », détaille le Dr Simon. Trente-cinq jours après, une dent entière avait poussé ! Son analyse histologique a prouvé que tous les tissus dentaires – dentine mais aussi émail, cément et pulpe – étaient bien présents dans cette nouvelle architecture. Cette dent s'est même révélée parfaitement intégrée à son milieu, sensible au chaud, au froid, à la douleur et de plus entièrement fonctionnelle. Depuis, toujours à Tokyo, en 2011, une autre équipe a trouvé une astuce pour gagner dix jours sur le temps de formation de la nouvelle dent. Les chercheurs ont fait se multiplier les cellules embryonnaires, les ont déposées sur un support en plastique, servant en quelque sorte de moule, qu'ils ont implanté au niveau du rein d'une souris. Cette zone, très bien vascularisée, a permis une croissance accélérée. Une fois développée, la dent a été incluse dans une mâchoire de souris. Et là encore, la fonctionnalité était au rendez-vous. Une stratégie qui augure, pour l'avenir, de la création de néodents pour réparer celles manquantes...
En France, à Paris, où un travail de régénération pionnier, a été réalisé en 2011 à la faculté d'odontologie de l'université Paris-Descartes. Les équipes des Prs Anne Poliard (EA2496) et Michel Goldberg (UMR 747) ont, grâce à l'implantation de cellules souches pulpaires, réussi à produire de la dentine, un tissu minéralisé de la dent sécrété par des cellules, les odontoblastes. « II s'agit là d'une approche très novatrice qui trouvera ses applications futures notamment dans le traitement des caries », salue le Pr Magloire. Un véritable espoir pour venir à bout d'un fléau qui représente la principale cause d'extraction dentaire (60 %) avant les maladies dites du parodonte (40 %).
"Nous avons d'abord établi des lignées cellulaires à partir de la pulpe des molaires d'embryons de souris en privilégiant celles de type A4 qui présentaient un potentiel de différenciation important pour former de la dentine », détaille Yassine Harichane, l'un des chercheurs ayant consacre une partie de sa thèse à ce sujet. Puis, munis d'une microfraise, les chercheurs ont ensuite creusé un minuscule trou dans la molaire de rongeurs de façon a provoquer une lésion pulpaire et l'ont comblée avec ou sans les fameuses cellules A4. « Trois semaines après environ, il y avait une néoformation dedentine dans le groupe traité ", précise le chercheur. « Le choix de la stratégie réparatrice dépendra en fait du degré d'atteinte de la lésion initiale, détaille le Pr Poliard. Si l'atteinte est modérée, et s'il subsiste de la pulpe saine, on pourra se contenter de stimuler les cellulessouches vivantes résiduelles par des facteurs de croissance. En revanche, si la lésion est très importante, quand la pulpe est totalement détruite, par exemple sur une dent cassée, il faudra utiliser un substitut de pulpe, c'est-à-dire un biomatériau dans lequel on aura inoculé des cellules souches qui reformeront du tissu. » Plusieurs équipes dans le monde y travaillent, comme celle du Pr Catherine Chaussain (EA 2496), toujours à l'université Paris-Descartes.
Supports dotés de nanoréservoirs actifs
Une autre approche de nanomédecine régénérative, baptisée NanoRegMed, est, elle, actuellement suivie par une équipe Inserm à l'université de Strasbourg. « Nous avons développé une stratégie innovante avec des supports dotés de nanoréservoirs actifs, explique la coordonnatrice du projet, le Dr Nadia Benkirane-Jessel, directrice de recherches Inserm l'UMR 977. Nous travaillons plus particulièrement sur un peptide de contrôle de l'inflammationpulpaire que nous avons incorporé à unematrice qui a la consistance d'un gel ». Un gel qui permettrait non pas la prévention des caries – le brossage régulier demeure incontournable – mais leur traitement Comment ? En évitant de recourir à la dévitalisation de la dent et en régénérant la pulpe à partir du gel. Une start-up a même été créée, ARTiOSnanomed. Une phase de tests chez l'animal ayant obtenu des résultats encourageants, des essais sont maintenant prévus chez l'Homme et la start-up a entamé des négociations avec un poids lourd du secteur, la firme américaine Colgate-Palmolive.
Mais l'équipe voit déjà plus loin. Car de la dent à l'os, il n'y a qu'un pas. Aussi, à Strasbourg, orthopédistes et rhumatologues travaillent-ils en collaboration avec les dentistes et les biologistes. Objectif : développer des implants hybrides « intelligents » à base de nanoréservoirs de principes actifs et de cellules osseuses et cartilagineuses issues de cellules souches pour un jour, être en mesure de proposer des greffes d'os et de cartilage aux patients victimes de pathologies ostéoarticulaires, comme l'arthrose. D'ailleurs, créer aussi de l'os, des muscles, des nerfs..., c'est le rêve de tous ceux qui ont foi dans les promesses des cellules souches (lire Sciences et Avenir n° 722, avril 2007).
Biobanques dentaires
Une autre idée fait son chemin : congeler et stocker des cellules souches pulpaires obtenues à partir des dents de lait et des dents de sagesse, comme on le fait déjà avec les cellules issues du sang de cordon ombilical, des muscles, des nerfs..., c'est le rêve de tous ceux qui ont foi dans les promesses des cellules souches (lire Sciences et Avenir n° 739, septembre 2008).
La première biobanque dentaire est née au Texas (États-Unis) avec la société BioEden. Depuis, d'autres ont suivi, comme la société Stemsave qui, dans le Colorado, rétribue même les dentistes (90 dollars) qui acceptent de récupérer les dents de leurs patients... Le concept a également fait récemment son apparition au Royaume-Uni et en Suisse avec Future Health Biobank, autorisant le stockage privé et payant. La voie semblait donc toute tracée pour que la France se dote à son tour d'une telle structure. En juin 2011, l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) avait même donné son feu vert à l'institut Clinident Bio-Pharma qui proposait le stockage d'une dent pendant vingt ans pour environ 120 € par an. Avant de revenir sur sa décision à l'automne, estimant que les travaux étaient trop préliminaires et contraires au principe de non-patrimonialité du corps humain reposant sur l'anonymat et la gratuité. Une exception française qui a enclenché une bataille judiciaire, toujours en cours.
Source :
Sylvie Riou-Milliot (2012). - Quand les dents repousseront,Sciences et Avenir n° 783, mai 2012, pp.72-75.
Les dents cachent une source inattendue de cellules souches (ajout d'octobre 2014)
Nous avons vu plus haut que la pulpe dentaire renferme une petite quantité de cellules souches. Durant l'été 2014, l'origine de ces cellules souches a été décelée par des chercheurs suédois : elles proviennent des nerfs de la dent.
Des cellules nerveuses migrent en effet régulièrement vers la pulpe, pour retourner à l'état de cellules indifférenciées. Une vraie surprise pour les scientifiques. Comprendre le mécanisme de ce processus pourrait ouvrir la voie à un nouveau mode de fabrication de ces cellules souches très utiles, non seulement pour recréer des dents, mais également pour soigner de nombreuses maladies (voir l'article sur ce blog concernant les potentialités des cellules souches).
Dans la pulpe de la dent (en orange), des cellules nerveuses redeviennent des cellules souches (Science & Vie n° 1165, octobre 2014, p. 36).
09:22 Publié dans Médecine, Sexualité-embryologie | Tags : odontologie, cellules souches, implant, sciences et avenir | Lien permanent | Commentaires (10) | ![]() Facebook | | |
Facebook | | |