11/10/2013
Mine claire. Des paysages, des techniques et des hommes.
Des paysages, des techniques et des hommes.
Les techniques de préparation mécaniques des minerais en Franche-Comté, 1500-1850.
Hélène Morin-Hamon nous invite à découvrir la complexité de ces ateliers où les ouvriers utilisaient des machines hydrauliques comme le "patouillet" dont la fonction était de transformer le minerai de fer en "MINE CLAIRE".
Abondamment illustré et documenté, ce livre rend compte d'un programme inédit de recherche en archéologie et histoire des techniques. Il démontre que loin d'être une activité annexe, le traitement des minerais de fer constituait une industrie à part entière, grande dévoreuse d'eau et source d'innovations.
Au fil des pages, cet ouvrage dévoile d'étonnants paysages multiformes témoins de ces activités ancienne et nous convie à comprendre comment la préparation mécanique des "mines" s'est enrichie dans l'espace et dans le temps aussi bien en Europe que dans d'autres régions françaises.
L'auteur, qui a soutenu en 2003 une thèse sur cette thématique à l'Université de Franche-Comté, nous offre en fin d'ouvrage un glossaire de termes glanés au cours de ses nombreuses années de recherche.



05:15 Publié dans Actualité des Sciences, Géologie-hydrogéologie-Climatologie, Livres | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
10/10/2013
Nicole Le Douarin : Les cellules souches, porteuses d’immortalité
Nicole Le Douarin : Les cellules souches, porteuses d’immortalité
Livre présenté par Alain Prochiantz lors de la Séance publique de l’Académie des sciences du 13 novembre 2007.

Le livre s’ouvre sur l’immortalité, celle des hydres, métazoaires à 2 feuillets embryonnaires. La figure d’Abraham Trembley est évoquée, celle de Charles Bonnet aussi. Les hydres sont-elles des plantes pour se multiplier par bourgeonnement ? Non, elles bougent et ont un système nerveux, les animaux aussi peuvent bourgeonner ; bourgeonner et régénérer. C’est ainsi que la réflexion sur les cellules souches se place d’emblée du côté de la régénération, d’une régénération naturelle. La vie c’est la mort, la destruction de la vie, c’est aussi la création de vie, en parallèle, comme le disait Claude Bernard dans Les phénomènes communs aux animaux et aux végétaux, déjà ! Car la régénération n’est pas réservée aux métazoaires inférieurs, on la trouve aussi chez les vertébrés. Dramatique parfois, comme chez les salamandres qui reconstruisent des fragments entiers de la moelle épinière ou du cerveau, significative chez le poisson qui régénère ses nageoires, silencieuse mais réelle chez tous les organismes vivant qui renouvellent la peau, les cellules sanguines, tous les tissus à vrai dire, jusqu’à certaines populations cellulaires du bulbe olfactif ou de l’hippocampe, dans le cerveau.
C’est à travers cette étude comparée, comme on parle d’anatomie comparée, de la régénération, donc en faisant appel à tous les organismes des plus modestes, l’hydre ou le ver, C. elegans, jusqu’à l’homme que Nicole Le Douarin pose, avec son extraordinaire, à vrai dire unique, connaissance de la physiologie, du développement, et de l’histoire de la biologie, la question des cellules souches. Avec sérieux, aussi ; ceux qui cherchent le spectaculaire et le fracassant peuvent se passer de lire l’ouvrage, ceux qui veulent s’instruire et comprendre ce que sont les cellules souches doivent prendre le temps de le lire. Ce que sont les cellules souches est, en effet, en soi, une question importante aux solutions fragmentées. Sont-ce des cellules totipotentes restées quiescentes ? Sont-ce des cellules différenciés qui se dédifférencient pour réacquérir de la totipotence ? Chaque organe au sens large, a-t-il son contingent de cellules souches spécifiques capables de reconstituer cet organe, ou des parties de cet organe : cellules souches hématopoïétiques ou cellules souches neurales ? Autant de questions abordées par l’auteur avec précision mais aussi honnêteté, c’est un livre qui sait écrire, « on ne sait pas ». Même si parfois on pense savoir, mais la grâce l’emporte toujours, laissant à une équipe qui s’est probablement fourvoyée, le bénéfice du doute. Peu probable, en effet, que, par exemple, des cellules souches hématopoïétiques donnent du tissu nerveux, ou l’inverse. Mais pas de condamnation, juste la reconnaissance d’une marche difficile dans un contexte qui, parfois, pousse à prendre ses désirs pour la réalité, le plus souvent en toute bonne foi. Ce qui, Nicole Le Douarin, nous le rappelle ne remet pas en cause les cas de trans-différenciation, mais, jusqu’à nouvel ordre, au sein d’un même tissu. De même qu’il n’y a pas une physique pour construire les ponts et une autre pour rendre compte de leur affaissement, la connaissance des fonctions normales des cellules souches ouvre la voie à une compréhension des pathologies associées à leur dérèglement. Un exemple, un seul, car le livre est si riche, que je suis obligé de conduire une opération « tapas », celui du cancer et de l’ouverture vers une origine possible de certaines tumeurs, à trouver dans la transformation de cellules souches. Le concept de cellules souches tumorales, à cibler pour toute guérison définitive, est devenu central en cancérologie. Au-delà, les cellules souches sont, évidemment, des outils extraordinaires pour traiter nombre de pathologies. On sait, et Nicole Le Douarin nous le rappelle, comment les travaux initiés par Howard Green, permettent, à partir de fragments restés épargnés, de fabriquer suffisamment de peau en culture pour sauver la vie des grands brûlés.
Et l’espoir existe d’utiliser ces mêmes stratégies pour combattre nombre de maladies encore sans remèdes, y compris les maladies neurologiques. Ce qui ne va pas sans se poser la question de la source de ces cellules. Et il faut dire que cette partie de l’ouvrage est sans égale dans sa capacité à faire le point sur les approches les plus contemporaines qui permettent de fabriquer des tissus différenciés à partir de cellules embryonnaires totipotentes, ou de cellules souches germinales, voire de fibroblastes adultes transformés en cellules souches par l’introduction d’une petite série de gènes qui portent la signature des cellules totipotentes. Par-delà un intérêt évident pour les pathologies, Nicole Le Douarin nous livre un éloge émouvant de la recherche fondamentale, de la liberté des chercheurs, du droit à l’erreur qui accompagne toute recherche à visée cognitive. Et elle multiplie les exemples, à commencer par la découverte des gènes de la mort programmée chez un ver ou des ARN interférants chez le pétunia, qui démontrent que des travaux à mille lieux de considérations sociétales peuvent déboucher, parfois rapidement, sur des applications médicales, ou autres. Enfin, il faudra bien boucler sur cette affaire d’immortalité sur lequel le livre s’est ouvert. Nicole Le Douarin, même si elle ne veut en rien fermer la porte à l’avenir, nous décrit bien comment le clonage, si indispensable quand il s’agit de sa version thérapeutique, reste illusoire quand il s’agit non de reproduction, mais d’individuation.
Oui la lignée germinale s’est séparée, hommage rendu à August Weismann, de la lignée somatique et l’invention de la sexualité fait bien de chacun un être génétiquement unique. Mais, chez l’homme, cette lignée somatique est, du fait d’un cerveau sans égal chez aucune autre espèce animale, le lieu d’une individuation extrême. On ne peut cloner cette individuation, car on ne peut cloner l’histoire des individus, même si la science de l’épigénétique a fait des progrès décisifs. Des page fortes y sont consacrées. Ce en quoi ce livre qui porte un sous-titre où figure le mot d’immortalité est aussi un hommage non seulement à la vie, et à sa transmission par la lignée germinale, mais aussi, par-delà une individuation qui se poursuit tout au long de notre brève existence, à son indissociable part de mort.
17:10 Publié dans Livres | Tags : livres, nicole le douarin, cellule souche adulte, cellules souches | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Les cellules souches pluripotentes induites (iPS)
 Les cellules souches pluripotentes induites (iPS)
Les cellules souches pluripotentes induites (iPS)
par Hervé Ratel
journaliste scientifique
(Sciences et Avenir n° 794, avril 2013, pp. 66-68)
(dernière mise à jour : 28 février 2014)
Le sigle iPS désigne les cellules souches pluripotentes induites, c'est-à-dire des cellules adultes rajeunies au stade embryonnaire. Un stade où elles sont capables de donner n'importe quel type de cellule de l'organisme (pluripotence). Les iPS ouvrent des perspectives majeures dans le traitement de nombreuses maladies incurables. Les premiers essais vont commencer au Japon.
Rajeunir les cellules, c'est la prouesse annoncée par ce simple sigle : iPS. Ce terme désigne les cellules souches pluripotentes induites, soit des cellules adultes reprogrammées jusqu'au stade primitif de cellules embryonnaires. Pour nombre de scientifiques, la révolution annoncée est comparable à celle des vaccins ou des antibiotiques en leur temps. Mise sous les projecteurs en octobre 2012 avec le prix Nobel décerné à leur découvreur, le Japonais Shinya Yamanaka (voir Sciences et Avenir n° 789, novembre 2012), ces cellules iPS sont en effet susceptibles de rendre d'immenses services dans le domaine des greffes de tissus, de faciliter la mise au point de médicaments pour des maladies génétiques et d'élucider certains mécanismes du cancer. Un comité d'éthique japonais a d'ailleurs donné son feu vert pour de premiers essais cliniques qui devraient débuter dès le mois d'avril 2013.
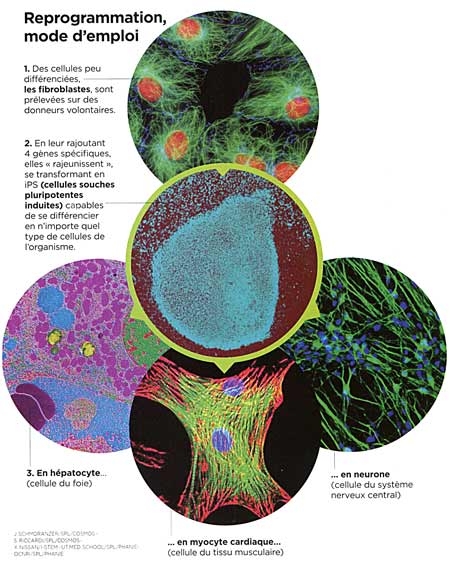
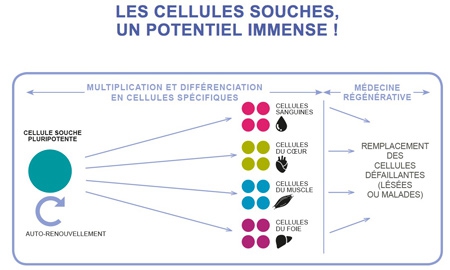
Diagramme © Institut Pasteur
Dans la course mondiale qui démarre, la France est bien placée. "Elle pourrait prendre la tête d'un consortium chargé de piloter un projet de banque européenne de cellules iPS. Celui-ci sera finalisé d'ici à la fm de cette année", pronostique Annelise Bennaceur-Griscelli (Inserm), qui coordonne la plate-forme nationale de cellules souches Ingestem, rassemblant plusieurs laboratoires de l'Hexagone.
Pourtant, les chercheurs français reviennent de loin ! En cause : la loi de bioéthique de 1994 - révisée en 2004 - qui interdit toute recherche sur les cellules souches embryonnaires humaines (CSEh). Ces dernières - qui ne sont pas des iPS - nécessitent en effet d'avoir directement recours à des embryons surnuméraires issus de fécondations in vitro. « Pour obtenir une dérogation les autorisant à travailler sur les CSEh, les chercheurs devaient remplir des documents faisant plusieurs dizaines de pages, raconte Frank Yates, enseignant-chercheur à l'école Sup'Biotech de Paris. Il fallait par exemple décrire à l'avance - exercice impossible et absurde les progrès médicaux attendus des expériences envisagées... Certains baissaient les bras ou s'exilaient à l'étranger devant ce cauchemar bureaucratique.» D'autres pays comme le Royaume-Uni, ont une réglementation moins restrictive, plus en phase avec la recherche fondamentale.

Les scientifiques abasourdis par ces résultats
La découverte des iPS en 2006 est donc venue bouleverser la donne puisque ces cellules ne nécessitent comme matériel de départ que des cellules adultes déjà différenciées, prélevées sur des donneurs consentants. Lors de leur découverte annoncée en 2006 dans la revue Cell c'est pourtant le scepticisme qui avait dominé parmi la communauté scientifique. « J'ai eu la chance d'assister à la première conférence du PrYamanaka sur le sujet, se remémore Frank Yates. Quand il a présente ses résultats, tout le monde était abasourdi. Parvenir à reprogrammer une cellule paraissait totalement improbable. » Improbable parce que cette découverte réduisait à néant l'un des dogmes majeurs de la biologie : une cellule différenciée, comme une cellule musculaire, ne pouvait pas se transformer en une cellule d'un autre type, une cellule hépatique par exemple. Pourtant, il n'a pas fallu longtemps pour que les résultats du chercheur japonais soient reproduits et confirmés par d'autres équipes de biologistes cellulaires à travers le monde. Les cellules iPS étaient bel et bien une réalité.
Pour comprendre, il faut revenir à l'intuition de génie de Shinya Yamanaka : le chercheur a voulu savoir ce qui se passerait si on transférait des gènes actifs uniquement au stade embryonnaire, dans une cellule différenciée adulte. Pour mener l'expérience, il a, avec son équipe, identifié dans un premier temps 24 gènes de ce type, avant de restreindre la sélection à 4 d'entre eux (Oct4, Sox2, Klf4 et c-Myc). Et ça a marché ! Les cellules adultes ont "remonté le temps" jusqu'à redevenir des cellules indifférenciées. Mais cette recette est évidemment bien plus délicate à mettre en œuvre. Et elle ne fonctionne pas à tous les coups : « Dans le meilleur des cas, le taux de conversion de cellules adultes en iPSn'excède pas 5 % », précise Jean-Marc Lemaitre (Inserm, Montpellier). De très nombreux obstacles restent donc à franchir avant de trouver des applications directes aux iPS.
Un travail de culture astreignant fait à la main
La première difficulté consiste à obtenir ces fameuses iPS en quantités suffisantes. Car développer une lignée, c'est un peu comme réussir un soufflé : les ingrédients sont peu nombreux, mais rien n'est possible sans un bon tour de main, du doigté et de la patience. Une fois une iPS obtenue au bout de quelques jours, il faut en effet absolument éviter qu'elle ne se différencie à nouveau et ne redevienne une cellule adulte. Comment ? En veillant en permanence à séparer les iPS nouvellement créées du reste de leurs consœurs encore à l'état différencié dans la boîte de Pétri, ces récipients où l'on cultive les cellules en laboratoire. Un travail astreignant qui, aujourd'hui, se fait encore manuellement. Trois semaines de culture sont nécessaires pour obtenir une colonie et il faut plusieurs mois avant que cette colonie compte quelques milliers de spécimens. « De plus, les cellules iPS sont très sensibles et capricieuses. Il faut les surveiller 24 h/24 », explique Lina El Kassar. Tous les trois mois, cette biologiste de l'I-Stem au Génopole d'Evry, dans l'Essonne, accueille ainsi des chercheurs dans son atelier pour leur transmettre son savoir-faire. À l'issue du stage, chacun repart avec ses propres lignées d'iPS sur lesquelles il peut poursuivre ses travaux de recherche. Une initiative fructueuse qui a permis de former rapidement à la culture des iPS quantité de biologistes français, contribuant au bon positionnement de la France.
Autre difficulté : les iPS souffrent de défauts épigénétiques. En effet, la cure de jouvence qu'elles subissent ne parvient pas à remettre parfaitement tous les compteurs biologiques à zéro. Ainsi, les iPS - à l'inverse des CSEh, les cellules souches embryonnaires humaines - conservent de petites « étiquettes » à la surface de leurs gènes indiquant toujours leur signature de cellules adultes. Autrement dit, vues sous l'angle épigénétique, les iPS n'ont que l'apparence de cellules embryonnaires. En profondeur, elles demeurent de "vieilles" cellules. « Que ce soit pour unefuturemédecine régénératrice ou comme modèle in vitro d'une pathologie, ces désordres épigénétiques doivent êtrepris en compte, explique Marc Peschanski, directeur scientifique de l'I-Stem. Il faudra vérifier au préalable qu'ils ne constituent pas une nuisance.» Car le risque que des iPS souffrant de tels défauts deviennent cancéreuses n'est pas à écarter.
Obtenir des cellules souches pluripotentes par balnéation acide ? (janvier 2014) (Sciences et Avenir n° 805, mars 2014, p. 23)
Plonger des cellules dans un bain légèrement acide est-il de nature à les stresser suffisamment pour les transformer en cellules souches comme le proclame l'équipe de Haruku Obokata, du centre Riken, à Kobe ?
Depuis la publication fin janvier dans les colonnes de Nature du travail des Japonais, des critiques n'ont pas tardé à apparaître sur Internet, et plusieurs équipes dans le monde ont tenté de reproduire ces résultats, pour l'instant, la moisson n'est pas fameuse.
Selon le décompte du site Ipscell, sur dix tentatives, une seule s'est révélée fructueuse, et encore avec une production très modeste. « J'aurais tendance à classer ce résultat des Japonais dans les artefacts de culture, avoue Frank Yates, enseignant-chercheur à Sup'Biotech. Intuitivement, nous sommes beaucoup à penser que s'il était aussi simple d'obtenir des cellules souches, nous y serions arrivés bien avant par accident... »
Irrégularités méthodologiques, fraude délibérée, erreurs de manipulation ou travail scientifique révolutionnaire de nature à changer la face des biotechnologies ? La réponse définitive viendra sous peu, à la fin des investigations scientifiques de rigueur.
Des champs d'application très larges
Étudier une maladie.
En prélevant des cellules sur un malade, les iPS permettent de suivre le développement d'une cellule affectée d'une mutation. Ce qui était impossible avec les CSEh, car il faut disposer d'embryons porteurs de la pathologie.
Mieux comprendre le cancer.
En suivant le devenir d'une cellule à partir de son stade embryonnaire, les chercheurs espèrent élucider les mécanismes conduisant aux processus tumoraux et notamment les métastases.
Concevoir de nouveaux médicaments.
Les iPS doivent permettre à terme détester facilement l'effet de molécules potentiellement intéressantes pour bon nombre de maladies. Cette recherche est actuellement au point mort.
Élaborer une médecine régénératrice.
C'est l'objectif ultime : pouvoir remplacer des neurones, des cellules musculaires, un épiderme, etc. à partir de cellules suffisamment proches du système immunitaire du malade. Voir également sur ce même blog les articles : cellules souches et rajeunissement, des cellules souches dans la rétine, régénération de la rétine humaine, élaboration d'une rétine humaine en culture à partir de cellules souches, obtenir des neurones à l'aide de fibroblastes, créer des dents biologiques grâce à des cellules souches,
L'industrie pharmaceutique n'est pas prête à investir
Les espoirs se tournent plutôt vers la constitution de banques de cellules iPS qui seraient immunologiquement compatibles avec la majeure partie d'une population donnée : Européens, Asiatiques, etc. Soit des banques ethniques qui risquent de faire grincer bien des dents... D'autant que les firmes pharmaceutiques ne semblent pas décidées à participer à la constitution de telles banques. « Culturellement, les industriels de la pharmacie sont des chimistes, pas des biologistes, justifie Marc Peschanski. Ils ont encore du mal à travailler avec du matériel vivant. » Un avis partagé par Laurence Daheron, responsable de la plate-forme iPS/CSEh à l'université Harvard (Cambridge. États-Unis) : « L'industrie pharmaceutique commence tout juste à entrevoir le potentiel des iPS. Elle est loin d'être prête à s'investir dans la thérapie cellulaire. Il n'y a aucun changement radical à attendre de sa part pour les années à venir. Elle se contentera d'utiliser les iPS pour rester des médicaments classiques, rien de plus. »
Pourtant, tout porte à croire que le jour où la recherche publique aura prouvé le potentiel thérapeutique des iPS, la demande de millions de patients en attente d'un traitement sera suffisamment pressante pour forcer la main des industriels. Il reste juste à espérer que ces derniers auront alors la capacité de prendre le train en marche...
S'affranchir des manipulations fastidieuses in vitro en produisant in vivo des cellules souches pluripotentes induites (iPS)
Dans un article de Nature paru le 11 septembre 2013, des chercheurs espagnols sont parvenus à reprogrammer « in vivo » des cellules adultes de souris. Cette technique permet donc de s'affranchir des fastidieuses et coûteuses mises en culture des cellules adultes !
Le premier défi pour les chercheurs du Centre national de recherche sur le cancer (CNIO, Madrid) était de reproduire l'expérience de Yamanaka chez un être vivant. Ils ont choisi la souris comme organisme modèle. En utilisant des techniques de manipulation génétique, les chercheurs ont créé des souris dans lesquelles quatre gènes de Yamanaka pouvaient être activés à volonté. Lorsque ces gènes sont activés, les chercheurs ont observé que les cellules adultes étaient capables de régresser dans leur développement évolutif pour devenir des cellules souches embryonnaires dans plusieurs tissus et organes
En outre, l'équipe de Manuel Serrano a ainsi obtenu des cellules souches de meilleure qualité que celles produites in vitro. C'est un résultat spectaculaire : faire en sorte que des souris fabriquent des cellules souches pluripotentes induites, capables de fournir quasiment n'importe quelle cellule spécialisée de l'organisme. Autrement dit, qu'au sein d'un animal vivant des cellules adultes redeviennent des cellules souches embryonnaires ! Reprogrammer in vivo des cellules est désormais possible. La démonstration chez l'animal de la faisabilité d'un tel concept pourrait bouleverser la pratique de la future médecine régénératrice.
Les chercheurs espagnols ont ainsi franchi une nouvelle étape, en obtenant les mêmes résultats que Yamanaka, mais cette fois au sein du même organisme, chez la souris, sans avoir besoin de passer à travers dans des boîtes de culture in vitro. La génération de ces cellules dans un organisme apporte cette technologie encore plus proche de la médecine régénérative.
L'étape du laboratoire sera ainsi supprimée. Jusqu'à présent, on imaginait que pour greffer ces cellules iPS à un malade souffrant de diabète insuline-dépendant, d'insuffisance cardiaque ou de la maladie de Parkinson, il fallait au préalable les produire en passant par des manipulations sophistiquées et coûteuses en laboratoire. Le travail réalisé par l'équipe de Manuel Serrano bouleverse ce protocole : il sera possible d'induire la production de ces précieuses cellules souches au sein même du tissu ou de l'organe à réparer sans passer par l'étape du laboratoire. Une fois ces iPS produites par le patient, elles seraient amenées à se différencier en un type cellulaire particulier, en cellule du pancréas, du cœur, en neurone, par exemple.
Comme indiqué au début de cet article, pour reprogrammer des cellules adultes (de peau notamment) en cellules souches, il faut y introduire quatre gènes clés (Oct4, Sox2, Kfl4 et c-Myc). Ceux-ci produisent quatre facteurs de croissance jouant un rôle dans les premiers temps du développement embryonnaire. Les cellules adultes ainsi reprogrammées, dénommées iPS, sont capables de « remonter le temps » jusqu'au stade embryonnaire.
Cette technique de production, mise au point en 2006, a d'ailleurs valu le prix Nobel de médecine en 2012 au Japonais Shinya Yamanaka. Les chercheurs espagnols sont allés plus loin : l'organisme de leurs souris transgéniques fabrique lui-même ces quatre facteurs de croissance. Pour activer les quatre gènes, ils ont fait boire aux rongeurs de l'eau contenant de faibles doses d'un antibiotique : la doxycycline. Résultat : au bout de deux semaines et demie, les rongeurs ont développé des tumeurs (tératomes,) issues de cellules souches pluripotentes et contenant plusieurs types cellulaires adultes. Preuve manifeste pour les chercheurs que des cellules adultes de ces rongeurs avaient bien été reprogrammées en iPS avant qu'elles ne se transforment, à leur tour, et en divers endroits, en plusieurs types cellulaires. Par ailleurs, l'analyse de tissus de l'estomac, de l'intestin, du pancréas et des reins des rongeurs a montré la présence disséminée d'une reprogrammation cellulaire in vivo. De même, les chercheurs ont détecté la présence d'iPS dans le sang des souris qui avaient été reprogrammées pour en fabriquer.
Ces cellules iPS sont d'une qualité supérieure
Une autre surprise attendait les chercheurs : les cellules iPS produites chez ces souris et obtenues directement à partir de l'intérieur de l'organisme, ont une plus grande capacité de différenciation que ceux obtenus par culture in vitro. Plus précisément,ces ceklules ont les caractéristiques des cellules totipotentes, un état primitif jamais obtenu dans un laboratoire.
En effet, outre leur capacité à se transformer en n'importe quel type de cellule d'un embryon, elles ont pu se différencier en placenta. Ce résultat étonnant fait dire aux chercheurs que ces iPS obtenues in vivo sont à un stade encore plus précoce que les iPS produites en laboratoire. Il est évidemment hors de question d'utiliser une procédure semblable chez l'Homme, dans la mesure où les cellules reprogrammées risqueraient de former des tumeurs. En revanche, une stratégie de régénération in vivo pourrait, dans l'avenir, consister à administrer au malade, localement et pendant un temps limité, des gènes synthétiques codant les quatre facteurs de croissance identifiés par le prix Nobel Shinya Yamanaka.
D'autres pistes sont à l'étude comme administrer, au sein d'un organe ou d'un tissu malade, un cocktail de petites molécules capables d'activer le programme génétique de production de cellules iPS ou utiliser des virus rendus inoffensifs pour délivrer les quatre fameux gènes clés.
María Abad, le principal auteur de l'article et chercheur dans le groupe de Serrano, a déclaré: "Ce changement de direction dans le développement n'a jamais été observé dans la nature, nous avons démontré que nous pouvons également obtenir des cellules souches embryonnaires dans les organismes adultes et pas seulement en. le laboratoire ".
"Nous pouvons maintenant commencer à penser à des méthodes pour induire la régénération localement et de manière transitoire pour un tissu endommagé particulier.", précise Manuel Serrano.
Les cellules souches obtenues chez la souris montrent également des caractéristiques totipotentes jamais produites dans un laboratoire, équivalentes à celles présentes dans les embryons humains au stade de 72 heures de développement, quand ils sont composés de seulement 16 cellules.
En comparaison avec les cellules obtenues avec la technique développée par Yamanaka, les cellules souches obtenues par le CNIO représentent donc un état encore embryonnaire plus précoce, avec une plus grande capacité de différenciation.
Les auteurs ont même été capables d'induire la formation de structures pseudo-embryonnaires dans les cavités thoracique et abdominale des souris. Ces pseudo-embryons affichaient les trois couches typiques des embryons (ectoderme, mésoderme et endoderme), et des structures extra-embryonnaires tels que la membrane vitelline et même l'ébauche de cellules sanguines.
"Ces données nous disent que nos cellules souches sont beaucoup plus polyvalentes que les cellules iPS obtenues in vitro par Yamanaka, qui génèrent les différentes couches de l'embryon mais jamais les annexes embryonnaires, comme le placenta", a déclaré Manuel Serrano.
Les auteurs soulignent que les applications thérapeutiques possibles de leurs travaux restent lointaines, mais ils admettent que, sans doute, cela pourrait signifier une réorientation de la recherche sur les cellules souches, la médecine régénérative et l'ingénierie tissulaire.
"Nos cellules souches survivent aussi en culture, permettant ainsi de les manipuler dans un laboratoire. L'étape suivante est d'étudier si ces nouvelles cellules souches sont capables de produire efficacement différents tissus tels que ceux du pancréas, du foie ou du rein. ", a déclaré Abad.
Sources :
- María Abad, Lluc Mosteiro, Cristina Pantoja,Marta Cañamero, Teresa Rayon,Inmaculada Ors, Osvaldo Graña, Diego Megías, Orlando Domínguez,Dolores Martínez, Miguel Manzanares,Sagrario Ortega & Manuel Serrano. (2013). Reprogramming in vivo produces teratomas and iPS cells with totipotency features Nature : 10.1038/nature12586.
- Marc Gozian (2013) Des souris vivantes ont produit des cellules souches (Sciences et Avenir, n° 800, octobre 2013, pp. 78-79).
Voir également dans ce blog, l'article : Les-potentialités infinies des cellules souches.
16:50 Publié dans Biologie, Médecine | Tags : cellules souches, cellules souches adultes induites, ips, cseh, rétine, cancer | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
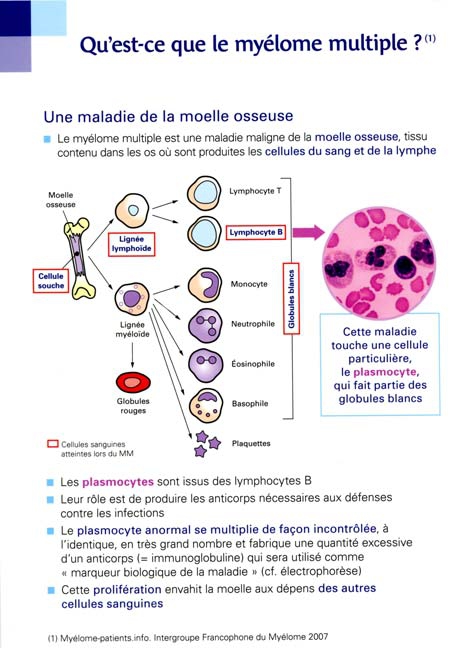
Le myélome multiple
Le myélome multiple
Mise à jour 02/07/2014
par Violette DELARUELLE [1], Gisèle HOARAU [2], Nicole MOREL [3] Dr Madalina UZUNOV [4], Dr Sylvain CHOQUET [5]
[1] Membre du CA de l'AFITCH-OR
[2] Membre du CA de l'AFITCH-OR
[3] Membre du CA de l'AFITCH-OR
[4] Hématologue
[5] Hématologue

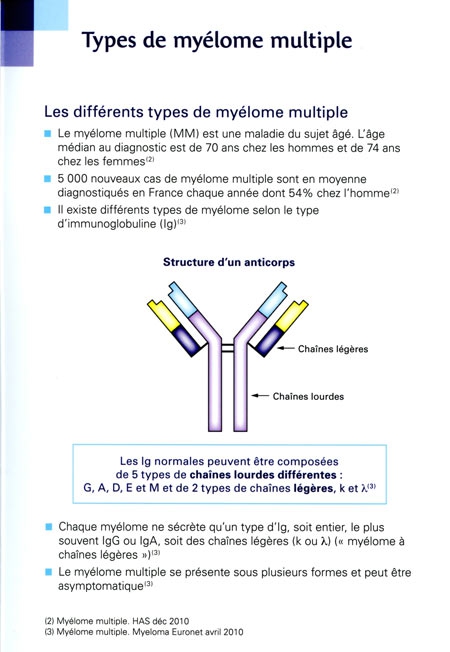
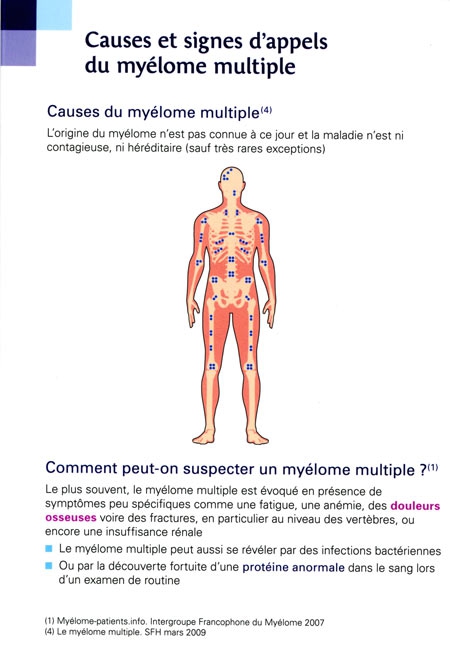
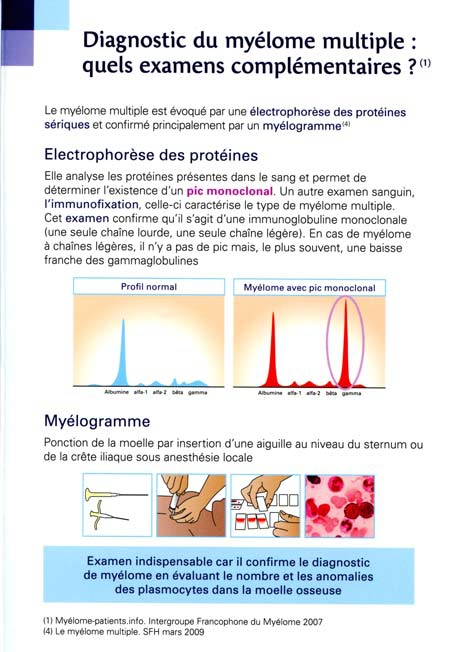
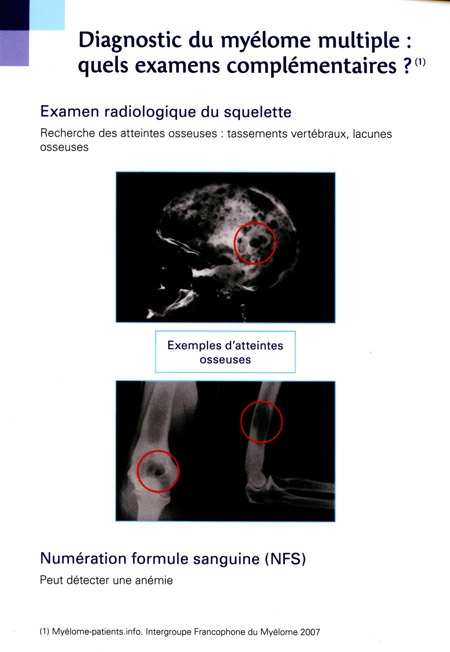
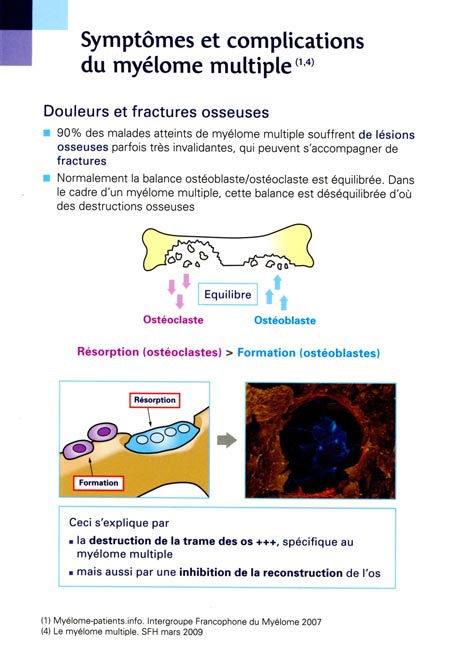





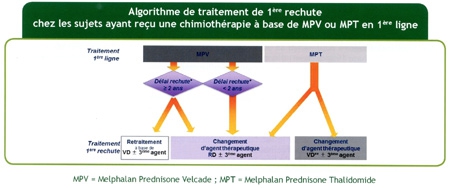
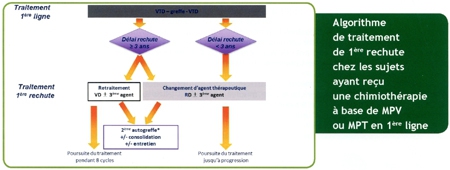
Rougeole et myélome : ajout du 16/05/2014.
Que faut-il en penser ? Voir l'article de Science et Avenir à ce propos.
Sites internet de référence :
Pour un premier contact : http://fr.wikipedia.org/wiki/My%C3%A9lome_multiple
Site d'information de l'Association des Malades du Myélome Multiple : www.af3m.org
Site d'information des malades sur le myélome : www.myelome.patients.info
16:49 Publié dans Médecine | Tags : myélome multiple | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
Intensification thérapeutique avec support de cellules souches dans le traitement des myélomes multiples
Intensification thérapeutique avec support de cellules souches dans le traitement des myélomes multiples
(Dernière mise à jour : mars 2015)
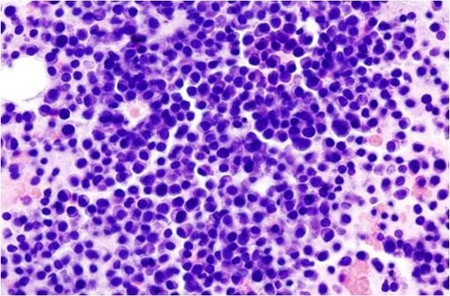
Myélome multiple : image histopathologique d'un extrait de la moelle osseuse. Coloration à l'hématoxyline et à l'éosine (illustration @Wikimedia).
Introduction
La Chimiothérapie à haute dose avec support de cellules souches est une option thérapeutique importante pour les patients éligibles, atteints de myélome multiple. Qu'elle soit réalisée dans le cadre du traitement de première ligne ou au moment de la rechute de la maladie, elle peut donner des réponses d'excellente qualité et un avantage de survie. Le traitement à haute dose avec support de cellules souches, ou greffe de cellules souches, comme on rappelle parfois, est l'étape 5 des 10 étapes pour de meilleurs soins de l'IMF. Cette note explique le rationnel et le côté pratique de la chimiothérapie à haute dose avec greffe de cellules souches en tant qu'option thérapeutique dans le myélome. Les questions abordées seront les suivantes :
• Que sont les cellules souches hématopoïétiques ?
• Pourquoi les cellules souches sont-elles recueillies et utilisées pour une greffe ?
• Quels sont les avantages et les risques de la chimiothérapie à haute dose avec greffe de cellules souches dans le cadre du traitement du myélome ?
• Quel est le rôle de la chimiothérapie à haute dose depuis l'introduction de nouvelles drogues ces dix dernières années? Peuvent-elles être associées ?
Tous les mots qui apparaissent en caractères gras, ainsi que les autres termes pertinents sont définis à la fin de cette note.
Rationnel pour l'utilisation de la chimiothérapie à haute dose avec greffe ou support de cellules souches hématopoïétiques
Les cellules myélomateuses et les cellules souches normales ou cellules souches hématopoïétiques cohabitent dans le même microenvironnement au niveau de la moelle osseuse. Comme les cellules myélomateuses s'accumulent dans la moelle osseuse, elles se mélangent avec les cellules souches normales responsables de la production des globules rouges et blancs et des plaquettes. Tous les médicaments anti-myélome atteignant le microenvironnement de la moelle osseuse peuvent donc endommager à la fois les cellules myélomateuses et les cellules souches normales.
Le melphalan, un agent de chimiothérapie appartenant à la famille des alkylants, est un traitement très efficace dans le myélome, mais il peut aussi endommager les cellules souches normales. De fortes doses de melphalan peuvent être particulièrement utiles pour éradiquer les cellules myélomateuses dans la moelle osseuse. Pour contourner le problème des dommages collatéraux sur les cellules souches normales, ces cellules souches sont collectées et congelées avant que le melphalan ne soit administré à forte dose.
Les cellules souches normales sont collectées ou recueillies chez le patient ou un donneur par un processus appelé cytaphérèse. Les cellules souches recueillies sont ensuite congelées à -80 degrés. Elles peuvent être conservées indéfiniment à cette température. Lorsque le patient recevra les fortes doses de melphalan, les cellules souches seront alors décongelées et réinjectées dans la circulation sanguine du patient par un procédé analogue à celui d'une transfusion sanguine. Les cellules souches sont ensuite capables de retourner dans la moelle osseuse, où elles vont se diviser et croître pour repeupler la moelle osseuse. Environ 36 à 48 heures après son administration, les concentrations sanguines et tissulaires de melphalan sont très faibles et ne nuisent pas à la croissance des cellules souches. L'ensemble du processus de collecte et de réinjection est appelée greffe de cellules souches, ou support de cellules souches, parce que les cellules souches "sauvent" la moelle osseuse des effets de la chimiothérapie à haute dose.
Les différents types de greffe de cellules souches
• Autogreffe de cellules souches, ou, plus exactement, intensification thérapeutique avec autogreffe de cellules souches.
Les cellules souches sont recueillies chez le patient atteint de myélome après le traitement initial et réinjectées après un traitement par melphalan à haute dose. Il s'agit du type de greffe de cellules souches le plus courant. La procédure peut être effectuée une fois (autogreffe simple) ou deux fois (double transplantation ou en tandem) voire plusieurs fois.
• Greffe Syngénique de cellules souches
Les cellules souches sont recueillies chez un vrai jumeau. Dans ce cas, les cellules souches du vrai jumeau sont réinjectées après une chimiothérapie à haute dose par melphalan ou par d'autres agents.
• Allogreffe de cellules souches
Les cellules souches sont recueillies chez un membre de la famille qui n'est pas un jumeau identique, mais parfaitement compatible par typage tissulaire (système HLA). Habituellement, le meilleur donneur est un frère ou une sœur. Encore une fois, les cellules souches sont réinjectées après la chimiothérapie à haute dose. Les effets anti-cancer de ce type de greffe découlent en partie de la chimiothérapie à haute dose, et en partie de l'effet des cellules greffées, ou transplantées, sur la maladie. Les cellules transplantées reconnaissent les cellules cancéreuses comme étrangères, les attaquent et les tuent. C'est ce qu'on appelle l'effet du greffon contre le myélome. Le problème avec les cellules souches du donneur, c'est qu'elles peuvent aussi reconnaître certaines cellules normales du receveur comme étrangères, et donc les attaquer, provoquant la maladie du greffon contre l'hôte, ou GVH. Certains cas de GVH sont contrôlables, et certains ne le sont pas. Lorsque la GVH ne peut pas être contrôlée, elle peut être mortelle. Cette procédure est rarement utilisée chez les patients atteints de myélome, avec une chimiothérapie à très forte dose parce que le risque de décès par GVH est d'environ 45%. La greffe allogénique à pleine dose a été largement abandonnée pour les patients atteints du myélome au début des années 1990.
• "Mini"allogreffe ou non myéloablative
Il s'agit d'une procédure plus sûre que l'allogreffe complète ou standard. Elle utilise une chimiothérapie d'intensité réduite en association avec une greffe de cellules souches d'un donneur compatible. Une autogreffe est le plus souvent effectuée en premier, afin de réduire la charge tumorale du myélome, puis, dans les 180 jours, une dose réduite de la chimiothérapie est administrée avant que le patient ne reçoive les cellules souches du donneur. Bien que la GVH et l'effet du greffon contre le myélome puissent encore se produire, ils ne sont généralement pas aussi graves que dans l'allogreffe standard.
• Allogreffe de cellules souches de donneur non apparenté
Les cellules souches sont recueillies chez un donneur extrafamilial. Dans ce cas, les cellules souches sont plus rarement compatibles à 100%. D'où le terme de "mismatch" fréquemment utilisé dans cette situation. Une greffe non apparentée comporte un risque beaucoup plus élevé de GVH et est une procédure globalement plus risquée.
Comment l'intensification thérapeutique avec greffe de cellules souches est intégrée dans le traitement du myélome ?
- Généralités
La chimiothérapie à haute dose avec greffe de cellules souches est utilisée dans le traitement du myélome depuis plus de deux décennies. Les médecins tentent de tuer autant de cellules myélomateuses que possible pour "réduire la masse tumorale" avant de recueillir les cellules souches puis d'administrer la chimiothérapie à forte dose (HDT). Les patients doivent donc recevoir une induction ou traitement de "première ligne" avec divers médicaments avant de commencer le processus d'intensification thérapeutique. Même en cas de réponse minimale à l'induction, les patients peuvent procéder à la collecte, au traitement à haute dose avec greffe de cellules souches ; ils ont encore d'excellents résultats. La réponse après l'HDT est beaucoup plus importante que la réponse avant, et ce tant que la maladie n'est pas progressive.
- Les options de première ligne
Plusieurs options sont disponibles comme traitement d'induction ou de première ligne. Les traitements de première ligne les plus couramment utilisés sont :
•Velcade® (bortezomib) plus dexamethasone avec une troisième drogue comme le Thalidomide (T) voire le Revlimid® (lenalidomide) (R) ou l'Endoxan (C).
Les acronymes pour ces régimes d'induction sont : VTD, VRD et VCD ou CyBorD aux USA.
• Dans d'autres pays, l'association d'un des 2 IMiDs (agents immunomodulateurs) Thalidomide ou Revlimid à la dexamethasone peut être proposée aux patients candidats à l'intensification avec un recueil des cellules souches organisé après 4 cycles.
Options de première ligne à considérer et à éviter
Généralement, la greffe de cellules souches est une option pour tous les patients atteints du myélome à la fin du traitement d'induction. Toutefois, la greffe étant une approche intensive, les patients âgés de plus de 65 ans et/ou ceux atteints d'autres pathologies médicales peuvent ne pas être en mesure de tolérer la procédure et/ou peuvent courir le risque de graves complications. Si la greffe de cellules souches est envisagée comme une option, il est important d'éviter l'usage du melphalan avant le prélèvement des cellules souches, puisque cela peut les endommager. Ainsi, la stratégie la plus souvent recommandée consiste à éviter de prime abord l'usage du melphalan. Toutefois, si la greffe de cellules souches s'avère impossible ou n'est pas souhaitée, quelle qu'en soit la raison, le melphalan par voie orale (comprimés), utilisé dans le cadre du traitement initial, peut s'avérer un traitement simple et très efficace.
En résumé
Les cellules souches sont prélevées, la chimiothérapie à forte dose est ensuite administrée et la greffe est réalisée, tout cela à la suite du traitement d'induction ou de première ligne. Les deux points majeurs du traitement d'induction sont :
• Le traitement d'induction, pour une durée de 3 à 6 mois, doit préserver les cellules souches normales.
• Théoriquement, une réponse au traitement d'induction devrait entraîner une baisse de >50% de la protéine monoclonale et/ou d'autres indicateurs de myélome actif avant le prélèvement des cellules souches. Toutefois, un taux de réponse inférieur peut suffire pour réaliser dans de bonnes conditions un prélèvement de cellules souches (qui ne sont pas malades).
Quels sont les avantages de la chimiothérapie à forte dose avec support de cellules souches ?
Amélioration de la profondeur de la réponse
L'augmentation du taux de réponse obtenu dans le cadre du traitement de première ligne est un avantage important de l'intensification thérapeutique avec greffe de cellules souches. Dans plus de la moitié des cas, les réponses s'améliorent de façon considérable avec des réponses partielles qui deviennent une TBRP (très bonne réponse partielle, baisse de 90 % de la protéine monoclonale) voire une RC (réponse complète, disparition du composant monoclonal).
Amélioration de la survie
L'introduction des nouvelles drogues dans les régimes d'induction a permis d'augmenter considérablement les taux de TBRP ou RC et, l'avantage supplémentaire du traitement à haute dose dans ce contexte est étudié spécifiquement. La chimiothérapie à haute dose a démontré un bénéfice statistiquement significatif après chimiothérapie d'induction classique (par opposition aux nouvelles associations) utilisant anciennement le VAD. Toutefois, les nouvelles combinaisons thérapeutiques peuvent produire des niveaux plus élevés de TBRP et RC que la chimiothérapie classique. Les résultats de deux études comparant les nouvelles combinaisons seules contre nouvelles combinaisons plus HDT avec greffe de cellules souches ont été présentées au congrès de la AmericanSocietyofHematology (ASH) en décembre 2011. Les données préliminaires suggèrent que, malgré des effets toxiques accrus, les nouvelles combinaisons thérapeutiques suivies de fortes doses de melphalan avec greffe de cellules souches peuvent améliorer non seulement la survie sans progression, mais aussi la survie globale. D'autres études et un suivi à plus long terme sont nécessaires pour confirmer ces données préliminaires.
Rôle de la Consolidation et de la Maintenance
Un avantage particulier de l'intensification thérapeutique est que la réponse peut se compléter dans les semaines et les mois qui suivent la procédure. Si une RC ou une TBRP sont obtenues, alors ces patients peuvent être suivis sans devoir avoir recours à un traitement d'entretien ou de maintenance. On leur proposera certainement un traitement de consolidation. Les patients qui bénéficient de l'intensification thérapeutique sont souvent en rémission plus longtemps et donc profitent de périodes plus longues avant qu'un nouveau traitement soit requis. Toutefois, selon les caractéristiques initiales de la maladie, y compris l'analyse chromosomique, le traitement d'entretien et/ou autre traitement (consolidation) peuvent être recommandés après la greffe.
Rôle d'une seconde greffe
Si une RC ou au moins une TBRP ne sont pas obtenues après une première autogreffe, une seconde autogreffe ou une autre greffe, comme la "mini-allogreffe" voir ci-dessus, peuvent être effectuées. Poursuivre les efforts pour atteindre au moins une TBRP avec une seconde greffe ne semble pas conférer un avantage aux patients.
Facteurs influençant le devenir
II est généralement admis que les patients qui obtiennent une très bonne réponse comme une RC ou une TBRP ont un meilleur devenir (en comparaison, par exemple, à une réponse partielle [RP]). Toutefois, d'autres études s'imposent. Obtenir une réponse durable, que ce soit avec une simple RP (⩾ 50% d'amélioration), TBRP (⩾ 90%) ou RC (100%), est plus important que le niveau de réponse en soi. Une réponse qui dure au moins deux ans est bien plus avantageuse. Le bénéfice d'une maladie stable, quel que soit le niveau de réponse (RP, TBRP ou RC) fait actuellement l'objet d'une étude.
Étapes importantes avant de considérer l'intensification thérapeutique avec support de cellules souches comme une option de traitement
I.
• Confirmer le diagnostic de myélome multiple actif ou symptomatique, nécessitant un traitement spécifique.
• S'il y a le moindre doute quant au diagnostic ou la prise en charge thérapeutique, cela peut être le moment opportun pour demander un second avis avant de débuter le traitement de première ligne.
II.
• Débuter le traitement de première ligne ou d'induction afin de contrôler le myélome et d'obtenir une réponse initiale.
• Éviter le melphalan ou tout autre traitement qui pourraient affecter la qualité des collectes de cellules souches. Une radiothérapie étendue sur le basin peut diminuer les réserves de cellules souches et devrait être évitée si possible.
III.
• Évaluer la réponse au traitement à chaque cycle (habituellement toutes les 3 à 4 semaines).
• Après 3 à 4 cycles, une évaluation plus complète est souvent nécessaire, comprenant un examen de la moelle osseuse et de l'imagerie afin de déterminer le niveau de réponse.
IV.
• Revoir avec votre médecin les avantages et les inconvénients d'une intensification avec greffe de cellules souches (et/ou discuter d'un prélèvement de cellules souches sans greffe immédiate).
• Si une réponse de ⩾ 50% est atteinte (RP : baisse de ⩾ 50% de la concentration de protéine liée au myélome dans le sang et/ou l'urine), la collecte de cellules souches peut être organisée si le patient et le médecin pensent que c'est la meilleure option. S'il n'est pas prévu de procéder au prélèvement et/ou à une greffe, un nouveau plan de traitement et de suivi doit être proposé.
• Si la réponse est < 50%, alors un autre traitement peut être envisagé avant de réaliser la greffe.
Comment les cellules souches sont-elles recueillies ?
Les cellules souches sont situées dans la moelle osseuse. Jusqu'à il y a environ 20 ans, le patient ou le donneur devaient être sous anesthésie générale et subir de 50 à 100 ponctions de la moelle osseuse sur la partie postérieure de l'os iliaque du bassin afin de prélever suffisamment de moelle osseuse et de cellules souches pour une greffe ultérieure. Cette procédure était évidemment douloureuse, angoissante et incommodante. Il va sans dire que ce fut une avancée majeure que de découvrir que les cellules souches pouvaient être prélevées dans la circulation sanguine en administrant au patient ou au donneur des injections de facteurs de croissance ("facteurs stimulants les colonies ou CSF") tels que le Neupogen®, le Granocyte®, le Neulasta®.... pour déclencher la libération de cellules souches médullaires dans la circulation sanguine. Améliorée au fil des années, cette procédure constitue aujourd'hui la méthode standard. Il est rarement nécessaire d'utiliser l'ancienne méthode de prélèvement dans le bassin.
Comment prélever les cellules souches dans le sang périphérique (CSP) ?
Il existe trois méthodes de prélèvement de cellules souches périphériques :
1) sous facteurs de croissance seuls, 2) sous facteurs de croissance, combinés à une chimiothérapie, 3) sous facteurs de croissance, combinés à un autre agent mobilisateur.
1. Donner des facteurs de croissance seuls
Les facteurs de croissance sont des médicaments qui stimulent la croissance et la libération des cellules souches dans le sang. Ces traitements sont administrés par voie sous-cutanée (sous la peau). Les facteurs de croissance des globules blancs (Neupogen®, Neulasta®, Granocyte®...) sont utilisés pour le recueil de cellules souches. Ce processus s'appelle la "mobilisation". Les injections sont administrées quotidiennement durant une période minimale de cinq jours. Les cellules souches sont habituellement prélevées le cinquième jour après le début des injections. Les prélèvements et les injections se poursuivent de façon quotidienne jusqu'à l'obtention d'un nombre suffisant de cellules souches. Généralement, il est programmé de collecter assez de cellules souches pour au moins 2 greffes, c'est-à-dire au moins 2-3 millions de cellules souches par kg de poids du patients par greffe (soit 4-6 million/kg au total).
2. Facteurs de croissances combinés à la chimiothérapie
L'Endoxan (ou cyclophosphamide) est la chimiothérapie la plus souvent utilisée dans ce contexte pour augmenter la libération des cellules souches dans le sang. Bien évidemment, d'autres chimiothérapies peuvent être utilisées. Votre médecin vous expliquera pourquoi, selon le cas, il peut être ou non approprié d'avoir recours à une chimiothérapie, comme l'Endoxan, en combinaison avec des facteurs de croissance. Il vous expliquera également quels sont les effets positifs et négatifs de l'Endoxan s'il est utilisé pour mobiliser les cellules souches sanguines.
En premier lieu, l'Endoxan est utilisé pour augmenter le rendement des cellules souches et est donc recommandé si l'on craint que la collecte des cellules souches soit faible. L'Endoxan a l'avantage supplémentaire d'être également un traitement pour le myélome. L'inconvénient de l'Endoxan est qu'il est administré le plus souvent en hospitalisation pour la mobilisation. Qui plus est, il peut entraîner une aplasie et, lorsque les globules blancs (système immunitaire de l'organisme) sont à des niveaux très bas, une infection peut se déclarer, nécessitant éventuellement une autre hospitalisation.
Après la chimiothérapie de mobilisation, un facteur de croissance de la lignée granulocytaire (globules blancs) sera administré par injection sous la peau quotidiennement pendant environ 10 jours. Cette procédure est donc plus longue et beaucoup plus intensive que l'utilisation de facteurs de croissance seuls. Le patient ou son entourage peuvent être éduqués pour réaliser les injections eux même à la maison. Sinon, les patients peuvent recevoir les injections de facteur de croissance avec infirmière à domicile. Une fois le nombre de cellules souches dans le sang suffisamment élevé, elles seront collectées sur 2 à 5 jours, alors que le patient continue de recevoir des injections de facteurs de croissance.
3. Autre agent mobilisateur combiné à la chimiothérapie
Le Mozobil® (plérixafor) a été approuvé par la FDA en 2008 comme un agent supplémentaire pour la mobilisation des cellules souches. Le Mozobil® est utilisé en association avec des facteurs de croissance pour libérer les cellules souches dans le sang afin qu'elles puissent être collectées et utilisées pour la greffe chez les patients atteints de myélome (ainsi que les patients atteints de lymphome non hodgkinien). Les patients sont traités avec des facteurs de croissance pendant 4 jours avant de recevoir le Mozobil. Ce dernier est injecté en sous-cutanée environ 11 heures avant la collecte de cellules souches prévue pour un maximum de 4 jours consécutifs. Le Mozobil augmente le nombre de cellules souches qui peuvent être recueillies et est particulièrement utile pour les patients qui, pour diverses raisons (telles que l'âge ou des régimes de traitements antérieurs intensifs), ont du mal à générer des cellules souches pour le recueil.
Les essais cliniques ont démontré plusieurs avantages à utiliser le Mozobil en plus des facteurs de croissance par rapport aux facteurs de croissance seuls pour la mobilisation des cellules souches. Les avantages du Mozobil sont les suivants :
• Taux de réussite plus élevés pour la mobilisation de cellules souches. Plus de patients atteignent le nombre minimum et le nombre cible de cellules souches, et sont en mesure ainsi d'avoir à la greffe. La réinjection de plus de cellules souches au patient peut se traduire par une récupération de globules blancs, de globules rouges et de plaquettes de plus longue durée (ou "durable").
• Moins de procédures de cytaphérèses nécessaires, avec donc un nombre réduit de passage sur la machine.
• Pratiquement tous les patients atteints de myélome et de lymphome non hodgkiniens ayant reçu une mobilisation par Mozobil en combinaison avec des facteurs de croissance ont été greffes avec succès.
• Une présentation durant l'ASH 2011 par Adel et al du Mémorial Sloan Kettering a démontré que l'utilisation dès le départ du Mozobil serait plus rentable que l'approche actuelle largement utilisée employant l'Endoxan, non seulement parce que le Mozobil nécessite moins de jours de cytaphérèse, mais parce que les patients qui utilisent le Mozobil ne nécessite pas d'hospitalisation.
Le recueil ou la procédure de collecte
Dans le jargon médical, le prélèvement est dénommé cytaphérèse - c'est-à-dire l'extraction des globules blancs de la circulation sanguine. La cytaphérèse est une procédure grâce à laquelle le sang du patient ou du donneur circule à travers un appareil spécial qui sépare (par une technique de centrifugation) puis extrait les cellules souches. Le reste du sang est immédiatement réinjecté au patient ou au donneur. Il s'agit d'une procédure exceptionnellement simple et sans douleur comparativement au prélèvement de moelle osseuse dans le bassin.
Cytaphérèse
Avant de procéder aux cytaphérèses, un petit tube flexible en plastique appelé cathéter est inséré dans une veine afin de pouvoir y prélever du sang. Durant cette procédure, le sang est prélevé par le cathéter et traité dans un appareil afin de retirer les cellules souches. Le reste du sang est réacheminé à travers le même cathéter (la lumière qui n'est pas utilisée dans un cathéter à deux lumières) ou en utilisant un autre cathéter. On doit prévoir trois à quatre heures par jour pendant une à cinq journées pour les cytaphérèses. Les cytaphérèses sont habituellement effectuées en externe. Les effets secondaires les plus courants ressentis durant les cytaphérèses sont de légers étourdissements, sensations de fourmillement dans les mains et les pieds. Les effets secondaires les moins fréquents comportent les frissons, les tremblements et les douleurs musculaires. Ces effets secondaires sont temporaires et sont provoqués par les changements dans le volume sanguin du patient alors qu'il circule de l'intérieur à l'extérieur de l'appareil, ainsi que par les anticoagulants ajoutés au sang afin d'éviter la coagulation sanguine durant la cytaphérèse.
Traitement des cellules souches
À la suite du prélèvement, le sang périphérique (ou occasionnellement la moelle osseuse) est acheminé vers le laboratoire de traitement, habituellement situé à l'hôpital ou à la banque de sang locale (à Besançon à l'Institut Français du Sang [IFS]). Dans le laboratoire de traitement, la moelle osseuse ou les cellules souches sanguines sont préparées pour la congélation (cryoconservation). Les cellules souches sont mélangées dans une solution contenant le composé chimique DMSO (diméthylsulfoxide) afin de les préparer pour la congélation. Les cellules souches sont par la suite congelées et conservées dans de l'azote liquide. Les cellules souches restent congelées jusqu'au moment de la greffe. Elles peuvent être congelées aussi longtemps que nécessaire. On remarque une détérioration avec le temps, mais l'on peut maintenir une excellente fonction des cellules souches pendant au moins dix ans.
De combien de cellules souches ai-je besoin ?
Plusieurs études ont été réalisées au fil des ans afin de déterminer le nombre de cellules souches requises pour recevoir un traitement à fortes doses en toute sécurité. Le nombre de cellules souches est quantifié grâce à une technique de laboratoire spécialisée surnommée "analyse des cellules CD34+ par cytométrie en flux". Un petit échantillon des cellules souches qui ont été prélevées est analysé afin de déterminer la teneur en cellules CD34+. Nous savons que le nombre minimum de cellules souches requis pour effectuer une greffe en toute sécurité est de 2 millions de cellules CD34+ par kilogramme de poids corporel. Le nombre de cellules CD34+ est vérifié dans le prélèvement quotidien et inventorié. Le processus de prélèvement se poursuit de façon quotidienne jusqu'à ce que le nombre de cellules requises soit prélevé - habituellement de 1 à 4 jours. Certains centres de transplantation vérifient le nombre de cellules CD34+ le jour même AVANT d'effectuer la cytaphérèse afin de s'assurer que le prélèvement sera optimal. La plupart des médecins greffeurs prélèvent suffisamment de cellules souches pour deux greffes (plus de 4 voire 6 millions de cellules CD34+ par kilogramme de poids corporel).
Administrer la chimiothérapie à haute dose
Lorsque les cellules souches ont été congelées et conservées, le patient est prêt à recevoir une chimiothérapie à fortes doses. Ce traitement est conçu pour éliminer les cellules myélomateuses de façon plus efficace que les doses standards de chimiothérapie. Le but de la chimiothérapie à fortes doses est d'éliminer les cellules myélomateuses dans le corps du patient. Le type de chimiothérapie à fortes doses le plus couramment utilisé pour traiter le myélome est le melphalan administré à une dose de 200 milligrammes par mètre carré (mg/m2) de surface corporelle (selon la taille et le poids du patient). En tenant compte du type de myélome et d'autres facteurs, certains patients peuvent recevoir une deuxième greffe 3-6 mois après la première (double autogreffe ou greffe en tandem). Le patient devrait discuter, avec son médecin, des avantages et inconvénients de réaliser deux greffes consécutives comparativement à la possibilité de conserver les cellules pour une deuxième greffe à une date ultérieure.
Autogreffe de cellules souches
Les cellules souches déjà prélevées sont décongelées et réinjectées dans la circulation sanguine par un cathéter (comme c'est le cas pour un individu qui reçoit une transfusion sanguine) un à deux jours après la chimiothérapie à fortes doses. C'est ce qu'on appelle une "greffe", mais ce n'est pas le terme exact car les patients en fait reçoivent leurs propres cellules souches. Ces cellules ne sont pas greffées à partir d'un donneur. La greffe est réalisée dans la chambre du patient : il ne s'agit pas d'une intervention chirurgicale. Les poches congelées de cellules souches sont décongelées dans un bain d'eau chaude, et leur contenu réinjecté dans la circulation sanguine par le cathéter. Au moment de la décongélation, le DMSO (agent de congélation) s'évapore dans l'air et crée une odeur distincte et quelque peu désagréable d'ail. La plupart des centres perfusent une poche à la fois. La perfusion se déroule sur une période de 1 à 4 heures.
Les cellules souches réinjectées circulent dans le sang et retournent dans la moelle osseuse, où elles produisent de nouveaux globules blancs, globules rouges et plaquettes. Il faut prévoir de 10 à 14 jours pour que les nouvelles cellules sanguines puissent apparaître dans la circulation en nombre suffisant. Des facteurs de croissance peuvent être administrés au patient afin d'accélérer le processus.
En plus d'anéantir la moelle osseuse, la chimiothérapie à fortes doses peut provoquer d'autres effets secondaires graves pouvant nécessiter l'hospitalisation de certains patients afin qu'ils soient traités durant cette période. (Les centres de transplantation aux USA n'exigent pas tous que les patients demeurent à l'hôpital suivant la réinjection des cellules souches ; certains sont dotés d'établissements à proximité où les patients peuvent demeurer et être suivis de façon quotidienne en clinique externe, alors que d'autres permettent aux patients dont la résidence est située à proximité de l'hôpital de dormir à la maison et d'être suivis à l'hôpital). La durée moyenne du séjour à l'hôpital (ou dans un établissement à proximité) pour la chimiothérapie, la greffe et la convalescence est environ de trois semaines. Juste avant de commencer la chimiothérapie, les patients doivent habituellement consommer d'importantes quantités de liquides afin de prévenir la déshydratation et les lésions rénales occasionnées par la chimiothérapie.
Certains des effets secondaires fréquents de la chimiothérapie incluent les nausées, les vomissements, la diarrhée, les ulcères dans la bouche ou mucite, les éruptions cutanées, la perte de cheveux, la fièvre ou les frissons et les infections.
Des médicaments conçus pour prévenir ou atténuer certains des effets secondaires du traitement sont automatiquement administrés. Les patients sont suivis étroitement pendant et après la chimiothérapie à fortes doses. Le suivi comprend une vérification quotidienne du poids ainsi que des lectures fréquentes de la pression artérielle, du rythme cardiaque et de la température.
Prévenir les Infections
Au cours des deux à trois semaines suivant la greffe, les cellules souches injectées migrent vers la moelle osseuse et commencent à produire des cellules sanguines, un processus appelé prise de greffe. Jusqu'à ce que la prise de greffe ait lieu, les patients sont à risque de développer des infections. Même une infection bénigne, comme un rhume, peut mener à de sérieuses complications puisque le système immunitaire est affaibli par la chimiothérapie à fortes doses. Il faut donc prendre des précautions particulières durant la période de convalescence. Comme le système immunitaire est très affaibli, les patients doivent demeurer à l'hôpital jusqu'à ce que les concentrations de globules blancs atteignent un niveau suffisant pour qu'ils puissent sortir. Afin de prévenir les infections, les traitements de support suivants peuvent s'avérer nécessaires :
• Des antibiotiques sont souvent prescrits afin d'aider à prévenir les infections.
• Les visiteurs doivent se laver les mains et, à l'occasion, porter un masque et des gants afin de protéger le patient.
• II est parfois interdit d'apporter des fruits, des légumes frais et des fleurs dans la chambre du patient pour éviter les infections (bactéries et infections fongiques).
• En présence d'infection et/ou de fièvre (en raison d'une diminution des taux de globules blancs), le patient peut recevoir un traitement antibiotique intraveineux.
Prise de greffe et convalescence
Une fois que les cellules souches ont été réinjectées, on doit prévoir jusqu'à deux semaines pour que les globules blancs atteignent un niveau normal. À la suite d'une greffe, plusieurs centres de transplantation utilisent, là encore, des facteurs de croissance granulocytaires (Neupogen®, Neulasta®, Granocyte®....), pour stimuler la moelle osseuse afin qu'elle produise des cellules sanguines saines. Ces injections (sous-cutanées) peuvent se poursuivre jusqu'à ce que les leucocytes atteignent un niveau normal. Durant cette période dite d'aplasie, des transfusions de globules rouges et/ou de plaquettes peuvent s'avérer nécessaires.
Attendre la prise de greffe des cellules souches greffées, la remontée des globules blancs à un niveau normal et la disparition des effets secondaires, est souvent la période la plus difficile pour le patient, sa famille et ses amis. Au cours de cette période, les patients se sentent faibles et ressentent une grande fatigue. Il est très important d'avoir un soutien. La convalescence peut se comparer à un tour sur les montagnes russes : un jour, le patient se sent beaucoup mieux, puis le lendemain plus malade que jamais. Il est important de vivre les choses au jour le jour durant cette période. Lorsque les nouvelles cellules sanguines sont produites, les symptômes disparaissent, les risques d'infections graves diminuent et les transfusions ne sont plus nécessaires.
Après être sorti de l'hôpital, le patient poursuit sa convalescence à la maison pendant deux à quatre mois. Même si les patients sont en mesure de quitter l'hôpital, leur convalescence est loin d'être terminée.
Durant les premières semaines, ces patients sont faibles et ne réussissent souvent qu'à dormir, s'asseoir et marcher un peu dans la maison. Les patients peuvent habituellement reprendre leurs activités ou retourner au travail à temps plein trois à six mois après la greffe, bien que ceci puisse varier d'un individu à un autre.
Suis-je candidat à l'intensification thérapeutique avec greffe de cellules souches ?
Le traitement intensif avec greffe de cellules souches est une option thérapeutique pour de nombreux patients atteints d'un myélome ; toutefois, cela ne guérit pas. La greffe peut prolonger la période de rémission et la durée de vie. Elle peut également procurer une meilleure qualité de vie pour la plupart des patients.
Les patients atteints d'un myélome ne sont pas tous des candidats à une greffe de cellules souches. Plusieurs facteurs doivent être considérés. Ceux-ci incluent des facteurs liés au myélome en soi et des facteurs liés au patient.
Facteurs liés au Myélome
• type de myélome
• stade de la maladie
• agressivité de la maladie
• réponse au traitement
• taux d'albumine sérique
• taux de bêta-2 microglobuline initial
• analyse des chromosomes
Facteurs liés au Patient
• âge
• état de santé
• fonction rénale, cardiaque, pulmonaire,
et hépatique
• préférence du patient
• situation familiale
• situation professionnelle
On ne peut suffisamment insister sur le fait que le myélome est une maladie très particulière à chacun. Bien qu'il existe des similarités entre les patients, chaque cas présente ses propres caractéristiques distinctes.
De nombreuses variables sont examinées avant de déterminer si une greffe est recommandée. Par conséquent, les généralités au sujet du devenir pendant et après la greffe ne sont pas appropriées. Les données récentes d'essais cliniques suggèrent qu'une induction comprenant le thalidomide, le Revlimid, et/ou le Velcade peut donner des taux de réponse et une durée de réponse comparables à ceux obtenus après HDT avec support de cellules souches ; cela permettrait à certains patients de reporter l'HDT plus tard dans l'évolution de la maladie. D'autres études sont en cours pour valider ces données.
Souvenez-vous, dans la majorité des cas, avoir un myélome laisse le temps au patient d'effectuer des recherches et de recueillir les informations nécessaires pour prendre une décision plus avertie sur l'option la plus appropriée. Par exemple, un patient peut réaliser un prélèvement de cellules souches et les conserver pour un traitement ultérieur. Cela permet au patient de bénéficier de plus d'options de traitement de première ligne. Il s'agit de facteurs à discuter avec votre médecin. Il ne faut surtout pas oublier que même si un individu semble être un bon candidat pour une greffe, la décision finale de bénéficier ou non une greffe, et quand la réaliser revient au patient.
Greffe et essais cliniques
L'autogreffe de cellules souches est considérée comme le traitement de référence pour les patients atteints d'un myélome multiple. Toutefois, bon nombre de nouvelles approches font l'objet d'études dans le but d'améliorer le devenir des patients. Ces études sont réalisées sous forme d'essais cliniques. Elles comprennent :
Une autogreffe en tandem ou double autogreffe est une approche qui englobe deux autogreffes. Un nombre suffisant de cellules souches est prélevé avant la première greffe. Trois à six mois après la première greffe, le patient reçoit un deuxième traitement similaire à fortes doses suivi de la réinjection du reste ou d'une seconde partie des cellules souches. Des données préliminaires indiquent que les greffes en tandem entraînent un meilleur contrôle de la maladie et un meilleur taux de survie chez les patients qui n'obtiennent pas une TBRP ou une RC après la première autogreffe.
Le traitement séquentiel par autogreffe suivie d'une "mini" (non myéloablative) allogreffe comprend une chimiothérapie à fortes doses avec une autogreffe afin de détruire la plupart des cellules myélomateuses, suivie 2 à 4 mois plus tard d'une mini allogreffe pour permettre aux cellules immunitaires du donneur de détruire toute cellule myélomateuse résiduelle. Dès que les cellules souches allogéniques se multiplient, les cellules immunitaires du donneur attaquent le myélome ("l'effet greffon contre myélome" mentionné précédemment). Il s'agit d'une forme d'immunothérapie. Le risque associé à cette procédure est la GVH ou maladie du greffon contre l'hôte, qui peut être très grave et mettre la vie en danger.
L'autogreffe de cellules souches suivie d'une mini-allogreffe (ou "Auto-mini Allô") a été étudiée dans le cadre d'essais cliniques chez des patients atteints de myélome depuis de nombreuses années. En 2006, une étude de l'IFM (Intergroupe Francophone du Myélome) ne retrouvait aucun bénéfice en survie globale ni en survie sans progression d'une séquence Automini Allô vs double auto. En 2007, Bruno et al quant à eux, ont trouvé une amélioration de la survie chez les patients recevant la séquence Auto-mini Allô vs double auto. Lors du congrès de l'ASH (American Society of Hematology) en Décembre 2010, une large étude clinique du groupe BMT CTN comparant double autogreffe par rapport à la séquence Auto-mini Allô (Krishnan et al) chez 710 patients dans 43 centres n'a trouvé aucune différence ni en survie sans progression ni en survie globale. Compte tenu de l'absence de bénéfice de survie et de rémission et de l'augmentation de la mortalité liée au traitement chez les patients recevant la séquence auto-mini allô, l'International Myeloma Working Group (IMWG) recommande actuellement que les mini Allô ne soient effectuées que dans le cadre d'essais cliniques.
Le traitement d'entretien est une approche qui utilise des doses diminuées de médicaments anti-myélome afin de prolonger la rémission et la survie après une greffe. À l'heure actuelle, les traitements en cours d'évaluation en entretien dans les essais cliniques comprennent principalement le Revlimid et le Velcade, seuls ou en combinaison avec des corticoïdes.
Les essais de maintenance les plus convaincants et plus récemment menées sont deux essais de phase III de Revlimid en post-greffe conduits aux États-Unis (CALGB 100104) et en France (2005-02 IFM). Leurs résultats ont été présentés lors du congrès de l'ASH en Décembre 2010 ; les deux études à ce moment-là ont démontré une survie sans progression (PFS) deux fois plus longue pour les patients qui avaient été randomisés dans le panel Revlimid en entretien. Lors du congrès de l'ASH en Décembre 2011, les données de suivi de ces essais ont été présentées. Il persiste un doublement du taux de survie sans progression pour les patients du panel Revlimid, et l'étude américaine retrouve un bénéfice en survie globale (OS).
Un fait notable de discussion et de controverse dans ces essais était que ces études ont rapporté un taux plus élevé de tumeurs malignes secondaires chez les patients qui étaient dans les panel Revlimid en entretien par rapport au placebo. L'augmentation des tumeurs malignes secondaires de ces essais reste un domaine fortement étudié, car il n'y a eu aucune augmentation de cancers secondaires rapportée chez les patients en rechute et réfractaires traités par Revlimid.
Une théorie qui prévaut est que l'augmentation des cancers secondaires pourrait découler de l'utilisation du melphalan, un agent alkylant employé dans le traitement à haute dose avant greffe dans les deux essais du CALGB et de l'IFM, ayant des effets potentiellement cancérigènes en combinaison avec Revlimid.
Sur la base des données de ces essais de phase III, le National Comprehensive Cancer Network (NCCN) a récemment reclassé l'utilisation du Revlimid en tant qu'agent de maintenance de la catégorie 2A (ce qui signifie que les résultats des essais cliniques n'ont pas encore fait l'objet d'un réexamen complet, et que la sécurité et l'efficacité sont encore préliminaires), à la catégorie 1 (ce qui signifie qu'elle est fondée sur des preuves de haut niveau, et qu'il y a un consensus uniforme du NCCN). Étant donné les avantages évidents et les risques d'un traitement d'entretien post-greffe, chaque patient doit discuter du traitement d'entretien avec son oncologue, qui évaluera les facteurs de risque individuels et la réponse à la greffe avant de faire une recommandation de traitement.
Problèmes psychosociaux
Une chimiothérapie à haute dose et une autogreffe peuvent être sources d'un grand stress pour les patients et leurs familles. Le stress physique, psychologique, émotif et financier peut être accablant. Les patients et leurs familles peuvent éprouver des sentiments de colère, de dépression et d'anxiété attribuables à un avenir incertain et un manque de contrôle. Les services de soutien offerts dans les hôpitaux et plusieurs autres organismes, incluant les groupes de soutien pour les patients atteints de myélome, sont très importants durant cette période. Nous vous conseillons vivement d'utiliser ces services, ou de demander à votre oncologue de vous orienter vers des services de consultation psychologique et/ou psychiatrique.
Questions et Réponses au sujet de l'intensification thérapeutique avec greffe de cellules souches
Vous trouverez ci-dessous certaines des questions fréquemment posées par des patients atteints d'un myélome qui ont bénéficié ou qui vont bénéficier d'une greffe de cellules souches. Il est important de discuter de ces questions et de toute autre préoccupation avec le médecin et les membres de l'équipe soignante avant de prendre une décision au sujet du plan de traitement.
Q. Pourquoi une greffe de cellules souches est-elle nécessaire pour un patient atteint de myélome multiple ?
R. La greffe permet au patient de recevoir une chimiothérapie à fortes doses afin d'éliminer un plus grand nombre de cellules myélomateuses. Ce traitement est si puissant qu'il détruit toute la moelle osseuse. Sans la moelle osseuse, il est impossible pour l'organisme de produire les cellules du sang nécessaires pour transporter l'oxygène, faciliter la coagulation sanguine et prévenir les infections. Une greffe de cellules souches remplace donc la moelle qui a été détruite, épargnant le patient des effets de la chimiothérapie à fortes doses.
Q. Suis-je un candidat pour une intensification thérapeutique avec greffe de cellules souches ?
R. Les experts en médecine n'ont pas encore établi de recommandations fixes concernant la sélection des patients qui profitent le plus d'une greffe. Depuis longtemps intégrée dans les protocoles de traitement du myélome, la réussite de la greffe repose sur l'âge du patient, sa condition physique générale, le stade de sa maladie et sa réponse aux traitements antérieurs. Seul le médecin du patient peut offrir à ce dernier la meilleure évaluation de ses chances de survie à long terme.
Q. Est-ce que les agents alkylants tels que le melphalan, le busulfan et le cyclophosphamide(endoxan) réduisent mes chances de bénéficier d'une greffe ?
R. Les agents alkylants sont l'un des moyens les plus efficaces pour éliminer les cellules myélomateuses à l'intérieur du corps. Toutefois, une utilisation prolongée - de plus de 4 à 6 mois - réduit la capacité de prélever facilement les cellules souches d'un patient. Par conséquent, lorsqu'une greffe est envisagée, il est important que le patient discuter son plan de traitement global afin de s'assurer d'avoir le plus grand nombre d'options de traitement à court et à long terme. Il faut toutefois insister sur l'importance d'effectuer la collecte de cellules souches avant d'utiliser un alkylant.
Q. Comment choisir un centre de greffe ?
R. Une greffe est une procédure médicale complexe qui nécessite une équipe spécialisée constituée de médecins, infirmières, assistante sociale, psychologues et professionnels de la santé qui comprennent la procédure, l'ont réalisée avec succès à maintes reprises et qui sont capables de gérer à la fois les problèmes médicaux et émotionnels. On retrouve aujourd'hui plusieurs centres à travers le pays qui répondent à ces critères. Bon nombre de ces centres se spécialisent dans le traitement de patients atteints de cancer. Afin d'identifier le centre qui convient le mieux aux patients atteints de myélome multiple, vous devriez en discuter avec votre médecin, d'autres patients atteints de myélome multiple et l'IMF.
Q. Que se passe-t-il dans un centre de greffe ?
R. Afin de mieux comprendre ce qui se passe dans un centre de greffe, nous vous recommandons fortement d'effectuer une visite dans un ou plusieurs centres. Planifiez une rencontre avec le personnel - médecins, infirmières et autres membres de l'équipe soignante - afin d'en apprendre davantage sur leur approche de la greffe. Visitez une chambre où votre greffe sera réalisée et où vous séjournerez pendant votre convalescence. Renseignez-vous afin de savoir ce qui sera réalisé en ambulatoire ou à l'hôpital. Il est essentiel d'être en confiance avec le centre avant d'y recevoir votre greffe. À noter que dans certains pays, de nombreux centres ont un motel à proximité ou un complexe résidentiel où sont héberger les patients après avoir reçu leur chimiothérapie à haute dose et pendant qu'ils récupèrent des les effets secondaires. Non seulement les patients ont moins de risque d'infection hors de l'hôpital, mais en plus les coûts d'hébergement privé sont bien moindres que ceux d'une hospitalisation pendant deux semaines ou plus. Les patients sont vus à l'hôpital tous les jours pour leur prise de sang, et sont à proximité en cas d'urgence.
Q. Si mon médecin convient qu'une greffe de cellules souches est un traitement approprié pour ma maladie, que puis-je faire pour m'y préparer ?
R. Un patient peut se préparer de plusieurs façons. En prenant le temps de lire cette note, le patient a déjà réalisé une étape très importante : apprendre autant que possible au sujet de la procédure. Le patient devrait discuter avec son médecin et d'autres patients et lire tout ce qu'il peut, en incluant les publications et bulletins d'information de l'IMF. Les patients devraient poser des questions au sujet de ce qu'ils ont appris et s'efforcer de lire les informations les plus récentes issues de la recherche. Nous conseillons aux patients d'apporter un magnétophone ou d'être accompagnés d'un ami lors de leur visite chez le médecin afin de pouvoir bien se concentrer. Les patients devraient partager toute l'information avec leur famille et proches afin que ces derniers sachent à quoi s'attendre - et comment ils peuvent aider dans les semaines et les mois à venir. Le médecin effectue une série d'examens pour confirmer que le patient est suffisamment bien pour bénéficier de la greffe. Toutes les données recueillies sur l'état cardiaque, pulmonaire et rénal, et des autres organes vitaux permettent au médecin d'établir une comparaison entre la santé du patient avant et après la greffe. Dans la plupart des cas, le patient n'est pas hospitalisé pour les examens puisque ceux-ci peuvent être réalisés en externe.
Q. Quels effets secondaires dois-je prévoir après la greffe ?
R. Des effets secondaires peuvent être ressentis pour chaque type de traitement, même avec d'aspirine. Chaque patient réagit différemment à la chimiothérapie et aux autres médicaments administrés durant la greffe. Il n'y a pas deux patients qui partagent les mêmes effets secondaires. Les effets indésirables les plus fréquents sont des nausées, des aphtes dans la bouche ou mucite, la perte des cheveux, et la fatigue. Les patients doivent rechercher un centre où les médecins, les infirmières et l'équipe soignante ont réalisé un bon nombre de greffes chez des patients atteints de myélome et qui ont l'expérience et l'expertise de subvenir aux besoins individuels de chaque patient.
Q. Que se passe-t-il lors de la réinjection des cellules souches ?
R. En général deux jours après la chimiothérapie à fortes doses, les cellules souches du patient sont réinjectées. Les cellules souches sont décongelées et perfusées par le cathéter du patient dans une poche. Lors de la réinjection, le patient peut ressentir de la chaleur ou se sentir étourdi. Les produits chimiques utilisés pour conserver les cellules souches ont une senteur d'ail que le patient peut faiblement percevoir. L'oncologue peut prescrire ou ajuster les traitements du patient afin qu'il soit plus confortable pendant la greffe.
Q. La greffe en soi peut-elle entraîner la mort d'un patient ?
R. Toute procédure médicale comporte des risques et l'intensification thérapeutique chez un patient atteint de myélome multiple est risquée. Néanmoins, des études médicales ont démontré que la mortalité après greffe n'excède pas 5% voire même le plus souvent 1%.
Q. Un patient peut-il rechuter après une greffe ?
R. Oui. Malheureusement, la majorité (au moins 50%) des patients atteints d'un myélome multiple rechuteront dans les 18 à 36 mois après la greffe.
Q.J'ai beaucoup entendu parler de la purge du myélome. Est-ce bénéfique ?
R. Le processus de purge élimine les cellules myélomateuses du sang périphérique prélevé chez le patient avant la greffe. Une chimiothérapie à fortes doses est utilisée pour éliminer les cellules myélomateuses qui se retrouvent dans le corps. La sélection de cellules souches ou « purge », est utilisée pour éliminer les cellules myélomateuses des cellules souches prélevées avant la greffe. Le but de cette stratégie est de réduire le nombre de cellules myélomateuses présentes dans le corps du patient ainsi que dans le sang périphérique qui lui sera réinjecté. De récentes études indiquent que cette technologie n'est pas efficace pour le myélome. Par conséquent, peu de centres ont recours à la purge de cellules souches pour traiter les patients atteints d'un myélome.
Q. Quelle est la durée du séjour à l'hôpital pour le patient greffé ?
R. Les patients sont hospitalisés pendant 2 à 3 semaines environ. La durée du séjour varie d'un patient à un autre. Certains patients peuvent être admis pour plusieurs courts séjours.
Q. À quel moment les cellules souches commencent-elles à se reproduire ?
R. Les cellules souches commencent à se reproduire ou « à prendre » dans un délai de 10 à 14 jours après la réinjection.
Q. Qu'advient-il de la qualité de vie du patient après la greffe ?
R. En général, la récupération du patient dure entre 3 à 6 mois. À ce moment, le système immunitaire peut de nouveau combattre les infections puisque la moelle osseuse produit des cellules sanguines saines. Les cheveux repoussent, mais les papilles gustatives peuvent être encore affectées. Les aliments qui avaient bon goût avant la greffe n'ont pas nécessairement bon goût après la greffe. Toutefois, dans la majorité des cas, les patients sont en mesure de reprendre leurs activités quotidiennes. Certains prennent jusqu'à un an pour reprendre leur routine. Les patients et leur entourage doivent vivre au jour le jour au début. Il y aura des mauvais et des bons jours bons, pas nécessairement dans cet ordre. Les patients doivent se préparer à se sentir différemment chaque jour tout au long de leur convalescence.
Q. Les patients greffés doivent-ils s'attendre à des changements sur le plan émotionnel?
R. Oui. Une greffe est bien plus qu'une simple procédure médicale. Puisque le patient se retrouve à se reposer sur son oncologue et sur les autres membres de l'équipe de soins, en plus de la famille et des amis, il éprouve souvent un sentiment de perte d'autonomie et de contrôle. Des sentiments d'isolement, de dépression et de détresse sont courants chez les patients greffés. Les patients et les proches devraient alors demander l'aide d'un professionnel. Vous pouvez également recevoir de l'aide auprès des groupes de soutien pour les patients.
Q. Quelles thérapies parallèles et complémentaires peuvent être administrées pendant et après la greffe ?
R. Certains patients croient que les thérapies parallèles et complémentaires sont une composante importante de leur traitement. Du fait que tous les médicaments, synthétiques et naturels, interagissent, et peuvent créer des effets secondaires imprévus, les patients devraient toujours consulter leur médecin avant de les utiliser. Le médecin doit être informé du nom des thérapies parallèles et complémentaires prises. Il est important de noter que même les médicaments en vente libre, en apparence inoffensifs, comme l'ibuprofène par exemple, peuvent être dangereux pour un patient atteint d'un myélome.
Termes et Définitions
Agent alkylant : agent de chimiothérapie comme le melphalan (Alkeran®) ou le cyclophosphamide (Endoxan). Le terme Alkylant réfère à la façon dont ces agents interagissent avec l'ADN des cellules myélomateuses et bloquent la division cellulaire.
Agent Immunomodulateur : agent qui affecte, stimule ou inhibe le système immunitaire.
Allogreffe de cellules souches : la greffe est réalisée grâce à des cellules souches qui sont prélevées chez un donneur puis administrées au patient. La plupart des allogreffes de cellules souches utilisent des cellules souches du sang périphérique du donneur. Les allogreffes standards sont rarement réalisées pour les patients atteints d'un myélome en raison du risque qu'elles présentent pour le patient. Une technique récente et, pour le myélome, plus sécuritaire (discutée ci-après), est la greffe non myéloablative ou « mini greffe », actuellement étudiée dans des essais cliniques. Afin de déterminer si le patient a un donneur compatible potentiel, une analyse de sang particulière surnommée typage HLA est effectuée. Un donneur peut être un membre de la famille ou être identifié à partir d'un registre de donneurs volontaires. Les cellules souches sont rarement obtenues auprès d'une banque de sang de cordon ombilical.
Anémie : diminution du nombre normal de globules rouges, avec un taux d'hémoglobine habituellement inférieur à 10 g/dl (taux normal entre 12 et 15 g/dl). La présence du myélome dans la moelle osseuse bloque la production de globules rouges, provoquant ainsi l'anémie, dont les symptômes sont l'essoufflement, la faiblesse et la fatigue. Autogreffe de sang périphérique: (voir autogreffe de cellules souches) une procédure qui consiste d'abord à prélever, par cytaphérèse, les cellules souches dans le sang du patient puis à les conserver, et à les réinjecter à la suite d'une chimiothérapie à fortes doses.
Autogreffe (greffe autologue) de cellules souches : réinjection de cellules souches qui sont prélevées chez un patient et perfusées au même patient lorsqu'il a reçu une chimiothérapie à fortes doses. La plupart des greffes de cellules souches chez les patients atteints de myélome sont des autogreffes.
CD34+ : marqueur utilisé pour distinguer et quantifier les cellules souches dans la circulation sanguine. Un nombre minimum de cellules souches CD34+ est requis afin de pouvoir réaliser une greffe de façon sans danger.
Cellules souches (cellules souches hématopoïétiques) : Les cellules souches (hématopoïétiques) saines génèrent des composants sanguins normaux, incluant les globules rouges, les globules blancs et les plaquettes. Ces cellules souches se trouvent normalement dans la moelle osseuse et peuvent être prélevées pour une greffe.
Cellules souches du sang périphérique (CSP) : les cellules souches sont prélevées dans le sang. Ces cellules sont similaires aux cellules souches retrouvées dans la moelle osseuse. Le terme « périphérique » signifie que les cellules proviennent du sang à l'extérieur de la moelle.
Chimiothérapie : médicaments utilisés pour détruire les cellules cancéreuses.
Cytaphérèse : procédure grâce à laquelle les cellules souches périphériques sont extraites dans le sang d'un patient ou d'un donneur. La fraction du sang contenant le plasma, les globules blancs et les plaquettes est séparée. Les globules rouges sont reperfusés au patient ou donneur. La fraction qui contient les globules blancs est celle qui contient les cellules souches.
Facteurs de croissance : médicaments qui stimulent la croissance et la libération de cellules souches sanguines dans la circulation sanguine.
Facteurs de croissance des globules blancs : protéines qui stimulent le développement et la croissance des cellules sanguines. Le Neupogen®, le Neulasta® et le Granocyte® sont des facteurs de croissance des globules blancs utilisés pour mobiliser les cellules souches de la moelle osseuse dans la circulation sanguine avant la cytaphérèse. Ces derniers peuvent également être utilisés suite à la greffe pour accélérer la remontée des globules.
Globules blancs : l'un des trois types majeurs de cellules dans le sang. Il existe plusieurs types de globules blancs ou leucocytes (neutrophiles, lymphocytes et monocytes).
Globules rouges : cellules sanguines qui transportent l'oxygène des poumons à travers le corps.
Greffe ou transplantation : les cellules souches sont utilisées pour restaurer le potentiel hématopoïétique du patient à la suite d'une chimiothérapie à fortes doses et/ou d'une radiothérapie. La greffe n'est pas forcement un traitement mais une méthode de support pour permettre un traitement de chimiothérapie à fortes doses.
Greffe de cellules souches du sang périphérique (CSP) : obtenues de la circulation sanguine du patient ou du donneur. Utiliser les CSP pour réaliser la greffe permet de prélever de façon plus facile et sécuritaire les cellules souches et de raccourcir la convalescence comparativement à la greffe de cellules souches de moelle osseuse.
Greffe de moelle osseuse : réalisée au moyen de cellules souches issues directement de la moelle osseuse du patient ou du donneur. Très peu de greffes de moelle osseuse sont actuellement réalisées en raison de la disponibilité des cellules souches du sang périphérique. La moelle osseuse peut rarement être prélevée chez les patients qui ne sont pas en mesure de mobiliser un nombre suffisant de cellules souches dans le sang périphérique.
Greffe en tandem : un terme utilisé pour désigner une double greffe. Il peut s'agir de deux autogreffes ou d'une autogreffe suivie d'une allogreffe (provenant d'un donneur). On planifie habituellement un intervalle de 3 à 6 mois entre chaque greffe.
Greffe de sang de cordon ombilical : les cellules souches sont obtenues à partir des cordons ombilicaux de nouveau-nés. Celles-ci sont congelées et conservées dans des banques de sang de cordon ombilical.
Greffe Syngénique de cellules souches : les cellules souches sont prélevées chez un jumeau monozygote (identique) du patient.
Immunoglobuline : une protéine produite par les plasmocytes (un type de globule blanc) qui aident à combattre l'infection. Également reconnu comme un anticorps.
Lésions lytiques osseuses : trous dans l'os.
Moelle osseuse : Tissu mou spongieux, retrouvé dans la plupart des os plats et longs, qui produit les globules blancs, les globules rouges et les plaquettes.
Myéloablation : la destruction de la moelle osseuse au moyen de radiothérapie et/ou de chimiothérapie. Ce terme s'applique habituellement à la destruction complète ou presque complète de la moelle osseuse.
Myélome multiple : un cancer se développant à partir des plasmocytes dans la moelle osseuse. Les plasmocytes chez les patients atteints d'un myélome multiple forment des anticorps anormaux, qui endommagent possiblement les os, la moelle osseuse et d'autres organes.
Pic monoclonal : anticorps ou parties des anticorps retrouvés en quantité anormalement élevée dans le sang ou l'urine des patients atteints d'un myélome. Le pic monoclonal correspond au profil prononcé qui apparaît sur l'électrophorèse des protéines en présence d'une protéine M. Synonyme de protéine monoclonale et protéine liée au myélome.
Plaquettes : fragments cellulaires avec granules, essentiels à la coagulation sanguine et la guérison des plaies. Les plaquettes contribuent également à la réponse immunitaire.
Plasmocyte : un type de globules blancs qui produit des anticorps.
Plasmocytome : une tumeur composée de plasmocytes malins.
Ponction de la moelle osseuse : le prélèvement, au moyen d'un trocart d'aspiration, d'un échantillon de la moelle osseuse (liquide).
Prise de greffe : le processus au cours duquel les cellules souches greffées migrent vers la moelle osseuse du patient, commencent à se multiplier et à produire de nouveaux globules, globules rouges et plaquettes.
Protéine M (protéine monoclonale) : protéine anormale, produite par les cellules myélomateuses, qui s'accumule et peut endommager la moelle. Une concentration élevée de protéine M indique que les cellules myélomateuses sont présentes en grand nombre.
Rémission ou réponse : rémission ou réponse sont utilisées de manière interchangeable. Rémission complète (RC) est l'abréviation commune pour les deux. La RC est définie par l'absence de la protéine liée au myélome dans le sérum et/ou l'urine lors d'analyses standard, l'absence de cellules myélomateuses dans la moelle osseuse et/ou les autres régions affectées par le myélome, la rémission clinique, et la normalisation des autres paramètres biologiques.
Réponse complète (RC) : la RC est l'absence de la protéine liée au myélome dans le sérum et/ou l'urine lors d'analyses standard ; l'absence de cellules myélomateuses dans la moelle osseuse et/ou autres régions affectées par le myélome ; la rémission clinique et la normalisation des autres paramètres biologiques à un niveau normal. La RC n'est pas la même chose qu'une guérison.
Sélection de cellules souches : une technique de traitement des cellules utilisée pour obtenir un produit enrichi en cellules souches et ainsi contenant moins de cellules cancéreuses potentielles. S'est avéré inutile chez les patients atteints d'un myélome.
Système immunitaire : système qui protège le corps des organismes pathogènes, des autres corps étrangers et des cancers.
Système International de Stadification (ISS) : le plus récent système de stadification du myélome, il résulte de la collaboration de plus de 20 centres de recherche clinique à travers le monde.
Très bonne réponse partielle (TBRP) : une réponse qui n'est pas vraiment une réponse complète (c'est-à-dire, pas à 100%), mais qui représente une diminution de 90% ou plus de la protéine monoclonale sérique.
Sources : Brochure Comprendre l'intensification thérapeutique avec support de cellules souches par International Myeloma Foundation 26 p.
Sites internet de référence :
Pour un premier contact : http://fr.wikipedia.org/wiki/My%C3%A9lome_multiple
Site d'information de l'Association des Malades du Myélome Multiple : www.af3m.org
Site d'information des malades sur le myélome : www.myelome.patients.info
Après le congrès de l'American Society of Hematology (décembre 2013) :![]() Quelques minutes avec Hervé Avet-Loiseau président de l'IFM.
Quelques minutes avec Hervé Avet-Loiseau président de l'IFM.
Voir également l'interview de Thierry Facon (Lille), qui a présenté les résultats très attendus d’une grande étude internationale pilotée par l’Intergroupe Francophone du Myélome, l’IFM, qui pourrait changer la prise en charge en première ligne des patients souffrant de myélome non candidats à l’autogreffe.
Ajout du 23 février 2015 : Le cancer attaqué par ses cellules souches
par Pierre Kaldy (Sciences et Avenir, n° 817 mars 2015, p. 77).
Des chercheurs américains ont découvert des molécules capables de tuer spécifiquement les cellules qui résistent aux chimiothérapies. Il s'agit peut-être de la prochaine révolution dans le domaine de la lutte contre le cancer.
Des chercheurs américains ont découvert de petites molécules capables de tuer spécifiquement les cellules souches tumorales, celles qui résistent aux chimiothérapies et aux rayons X, disséminant des métastases dans le corps. Cette stratégie, qui peut se révéler cruciale quand on sait que cette maladie tue le plus souvent par ses récidives, offre « l'une des perspectives les plus prometteuses dans son traitement », souligne Christophe Ginestier, chercheur au Centre de recherche en cancérologie de Marseille. Ainsi des médecins de la société Boston Biomédical ont identifié une molécule, le BBI608, qui bloque le développement des cellules souches d'une dizaine de cancers différents tout en épargnant celles qui régénèrent le sang. Aucun agent de chimiothérapie n'avait pu jusqu'ici entraver la prolifération de ces cellules. Sans toxicité apparente, le BBI608 a bloqué l'apparition de métastases dans deux modèles de cancer chez la souris. Ces résultats très encourageants ont incité la société à engager plusieurs essais cliniques préliminaires chez des patients atteints de diverses tumeurs incurables. Là encore, des exemples surprenants de régression de la maladie ont été obtenus après traitement avec le BBI608 et un agent de chimiothérapie. Une étude clinique à plus vaste échelle sur le cancer colorectal avancé est en cours pour vérifier cet effet. S'il reste de nombreuses étapes avant la commercialisation de nouveaux inhibiteurs de cellules souches, des patients diabétiques traités par un hypoglycémiant courant, la metformine, semblent déjà bénéficier de cette nouvelle approche. Lorsqu'ils sont atteints de certains cancers, ils présentent un taux de récidive plus faible, probablement dû au fait que la metformine apparaît également toxique pour les cellules souches de la tumeur.
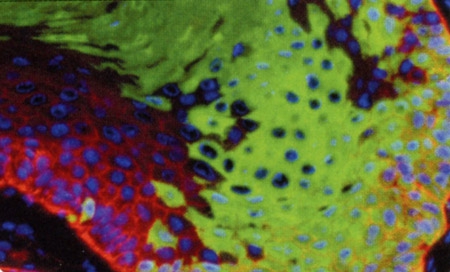
Le BBI608 bloque le développement des cellules souches tumorales
(ici en vert) tout en laissant intactes celles qui régénèrent le sang.
16:40 Publié dans Médecine | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
07/10/2013
Municipales : ours, loups, lynx, rapaces et phoques victimes de la démagogie électorale
 Municipales : ours, loups, lynx, rapaces et phoques victimes de la démagogie électorale
Municipales : ours, loups, lynx, rapaces et phoques victimes de la démagogie électorale
Les loups, les ours, les lynx ou les vautours n’ont décidément pas de chance car dans leurs existences difficiles il y a toujours une ou deux élections à l’horizon.
par Claude-Marie Vadrot
Et les municipales sont traditionnellement les plus mortifères pour la faune sauvage, même si les législatives, les cantonales ou la présidentielle déclenchent également des actions, prises de positions et déclarations démagogiques sur les espèces sauvages coupables de faire concurrence à la prédation et à la présence humaine.
Logiquement donc, les chasses au loup, l’organisation de battues administratives ou illégales et les empoisonnements ont entrainé la disparition d’au moins une dizaine de ces animaux depuis le début de l’année, dont une femelle dont les louveteaux ne survivront pas. Le pouvoir veut prouver qu’il agit avec la même fermeté et la même absence de remord contre les Roms et les loups que beaucoup d’élus rangent sans la moindre honte dans la catégorie des prédateurs « impossibles à assimiler ».
Alors les démagogues et les chasseurs crient au loup en maquillant les chiffres à la tribune de l’Assemblée nationale et du Sénat, dans les journaux régionaux ou dans Le Figaro qui accueillent leurs diatribes et statistiques mensongères. Des fantasmes qui, comme pour les Roms, n’ont rien à voir avec la réalité. Car s’il est incontestable que les 250 à 300 loups désormais présents sur le territoire mangent aussi des brebis, les dégâts n’ont rien à voir avec les statistiques brandies par ceux qui crient au loup. Les 4.524 brebis tuées ou blessées en 2012 par Canis lupus représentent 0,06 % du cheptel français de 7 millions d’ovins. Victimes toutes remboursées en 2012 aux éleveurs pour une somme de 1,5 million d’euros, loin des bilans financiers faramineux assénés par les élus de tous bords.
Cette réalité n’implique pas que le métier d’éleveur ou de berger soit facile, qu’il ne comporte pas de nombreuses difficultés qui devraient le faire accéder au rang de métier pénible pour le calcul de la retraite. Passer plusieurs mois seul dans la montagne et courir de temps à autre après son troupeau pour un salaire souvent ridicule, cela n’a rien de drôle. Mais les éleveurs, les bergers et tous les syndicats agricoles confondus se trompent en liant l’existence du loup et d’autres espèces sauvages à la crise de la filière ovine. Ils feraient mieux de tourner leur courroux vers la filière de la viande, vers les importations, vers les politiques de prix des grandes surfaces ou vers le traité qui contraint encore la France à importer de l’agneau congelé de Nouvelle-Zélande.
Ils pourraient, comme certains le font heureusement comme je viens de le constater dans la Drôme, se poser des questions sur leur instrumentation par les chasseurs qui se moquent des moutons mais craignent la concurrence pour leur gibier. Il ne faut pas oublier que ce sont les chasseurs qui pourchassent les loups et réclament un droit de tir à vue. Ce sont aussi eux qui ont abattu les derniers ours Pyrénéens, contraignant les pouvoirs publics à leur chercher des remplaçants en Slovénie.
Les mêmes problématiques entraînent le harcèlement, voir l’assassinat des ours alors qu’ils ne "consomment", en général en automne, que 0,9% des brebis qui vivent dans la montagne pyrénéenne. Des chiffres qui n’ont aucune commune mesure avec les dizaines de milliers de moutons tués chaque année par les chiens errants ou fugueurs, bien souvent ceux des chasseurs. La même remarque vaut pour les Alpes et le Massif central, puisque selon une estimation de la FNSEA, ce sont au minimum 150.000 ovins qui sont tués ou estropiés chaque année par des chiens.
La situation pré-électorale n’est pas meilleure dans les Vosges et le Jura, où, depuis 1983, les lynx tentent de se multiplier en dépit des tirs clandestins ou des campagnes d’empoisonnement menées discrètement par les chasseurs. Au point que l’espèce est en danger, alors qu’en Espagne, le sauvetage d’une espèce voisine, le Lynx pardel est désormais réussie. Mais une part de la France rance, à commencer par celle des élus locaux, ne supporte pas le sauvage, ne supporte pas que le milieu naturel ne ressemble pas à un parc urbain, que les animaux sauvages n’obéissent pas aux syndicats d’initiative, que les routes circulent encore entre des arbres. Lesquels, c’est bien connu, ont la fâcheuse habitude de se jeter sur les routes au devant des automobilistes. Rien à voir avec les loups, les lynx ou les ours ? Mais si, car les chantres et représentants d’une ruralité qui n’existe plus que dans leurs imaginations et leur nostalgie d’un autre âge, se battent depuis des années contre ce qui ne ressemble pas à un jardin à la Le Nôtre. Alors qu’en Espagne et en Italie, les loups et les ours sont efficacement protégés.
La rage envers le sauvage a entraîné au cours des derniers mois, des élus à faire détruire des nids d’hirondelles parce que ces oiseaux salissaient les rues et des inconnus à empoisonner des vautours, des gypaètes, des milans royaux, des buses ou des hérons dans de nombreux départements. Sans que la justice se saisisse des ces délits alors que comme le loup, le lynx et l’ours, il s’agit d’espèces protégées.
La vindicte contre les animaux sauvages a même atteint depuis quelques mois les phoques veau-marins qui vivent autour de la Baie de Somme. Une espèce sauvée de justesse par les naturalistes et désormais accusée (ils sont 460 !) de dévaster les bancs de poissons par des pêcheurs (et des élus) qui devraient plutôt se poser des questions sur les méfaits de la surpêche dans les mêmes secteurs.
Le "sauvage" n’intéresse ni la droite, ni l’extrême droite, ni les socialistes, ni le Front de gauche, ni le Parti communiste. Ni d’ailleurs, dans le fond, les Verts qui ont d’autres chats à fouetter puisque les animaux ne votent pas. Seules les associations de protection de la nature râlent. Mais qui les entend, qui les écoute ?
Réalité encourageante : il est à peu près certain que le loup a désormais réussi sa reconquête du territoire français et qu’il peuplera de plus en plus de départements.
Claude-Marie Vadrot
Source : Politis
21:19 Publié dans Actualité des Sciences, Environnement-Écologie, Mammifères | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
06/10/2013
Loups et élevages : une coexistence « compromettante »
 Loups et élevages : une coexistence « compromettante »
Loups et élevages : une coexistence « compromettante »
par Antoine Doré[1]
Article paru dans le Courrier de l'environnement de l'INRA n°63, août 2013 pp. 123-124.
L'année 2012 marque les vingt ans du retour officiel des loups en France. Et pourtant, aucune mesure n'est à ce jour parvenue à créer les conditions d'une coexistence parfaitement pacifique entre les loups, les moutons, et les humains. L'existence des uns semble toujours, par endroits et par moments, compromise par la présence des autres. Les situations de calme relatif rendues possibles par l'appareillage compliqué de multiples dispositifs techniques, scientifiques, juridiques, administratifs, etc.[2], restent souvent précaires.
Non, les éleveurs et leurs animaux ne seront sans doute jamais totalement tranquilles en présence des loups. Il est fort à parier également que les loups ne vivront jamais complètement en paix tant que les éleveurs et les bergers auront des troupeaux à défendre. En effet, si des mesures de protection permettent d'assurer une relative sécurité du bétail, les loups parviennent de temps à autre à les contourner et à en trouver les points faibles. Et l'immunité théorique que la Convention de Berne[3] et la Directive Habitats[4] confèrent aux loups est régulièrement écornée dans la pratique par quelques destructions illégales de ces prédateurs.
Sauf à envisager l'hégémonie destructrice d'un camp sur un autre, la situation actuelle nous oblige à faire le constat que la suppression de tout conflit relatif à la présence des loups est illusoire. L'entière réconciliation du loup et de l'agneau n'est pas pour aujourd'hui. De sorte qu'il apparaît important de concentrer les efforts sur un accompagnement du conflit qui soit l'occasion d'apprentissages collectifs et d'ajustements réciproques.
Comme l'avait bien vu le sociologue et philosophe allemand Georg Simmel, le conflit est un facteur important de cohésion sociale[5]. C'est en particulier au gré de nos querelles, discordes, désaccords, etc., que nous apprenons collectivement à vivre ensemble et que nous faisons société entre humains. C'est par le conflit que nous devons également apprendre à composer les agencements « anthropo-zoo-techniques » qui conviennent et explorer ensemble les voies possibles d'une cohabitation plus vivable pour tous : loups, moutons, éleveurs, naturalistes, chiens de protection de troupeaux, promeneurs, chasseurs, chamois, chevreuils, etc.
Dans cette optique, l'aménagement des relations tumultueuses qui s'engagent entre des humains à propos des loups est certes important. Mais l'invention des conditions d'un co-apprentissage de la conflictualité entre les loups et les éleveurs l'est sans doute plus encore. Il est temps de considérer et de traiter les loups comme de véritables parties prenantes des conflits plutôt que comme de simples révélateurs d'enjeux politiques qui ne concerneraient que l'entente entre humains. Or, cela n'est envisageable qu'en dérogeant, de manière partielle et mesurée, à la stricte protection des loups. Les éleveurs et bergers doivent pouvoir réagir face aux prédateurs récalcitrants qui parviennent à outrepasser les dispositifs de protection des troupeaux pour s'attaquer à leur gagne-pain. Et les loups doivent pouvoir sentir, sur le vif, la résistance active de ces derniers pour apprendre ou réapprendre à se tenir à distance du bétail.
Pour ne pas être fatals aux uns ou aux autres, les conflits entre humains et animaux, tout comme les conflits entre humains, doivent cependant être accompagnés, être encadrés démocratiquement. Il s'agit alors d'inventer une pratique politique du conflit qui prenne définitivement acte du caractère compromettant du vivre ensemble, qui assume pleinement le constat selon lequel toute entreprise de coexistence pose des questions importantes d'identités, c'est-à-dire, par exemple, de reconfiguration des manières d'être éleveur, mais également des manières d'être loup. Dès lors. une question primordiale s'impose : jusqu'où sommes-nous prêts à compromettre nos façons de faire, nos façons d'être, pour cohabiter avec l'autre ? Comment et jusqu'où peut-on intervenir sur les loups sans remettre en cause leur caractère sauvage défendu par les uns ? Comment et jusqu'où peut-on transformer les pratiques d'élevage sans dénaturer certaines pratiques spécifiques de conduite des troupeaux auxquelles tiennent tant les autres ? Tout l'enjeu consiste alors à inventer les dispositifs de négociation prenant à bras-le-corps de telles questions pour rendre possible l'instauration collective de « compromis du supportable ».

Le dispositif interministériel de prélèvement fixant les conditions d'autorisations ponctuelles de destruction de loups[6] est sans doute très imparfait et insatisfaisant. Il peut cependant être considéré comme la préfiguration d'un instrument d'accompagnement du conflit potentiellement efficace et démocratique, en créant les conditions de possibilité d'une négociation collective de « compromis du supportable », au sein des comités pluripartites dédiés aux grands prédateurs.
En vertu des mesures dérogatoires à la stricte protection des loups prévues par la Directive Habitats, des destructions de loups sont possibles aux conditions que des dégâts importants soient constatés, qu'il n'existe aucune autre solution satisfaisante et que cela n'affecte pas l'état favorable de conservation des populations. La traduction pratique et détaillée de ces conditions abstraites en un protocole technique fixant les conditions et modalités d'application des opérations de tir est l'occasion d'une négociation progressive de ce que les différents protagonistes peuvent supporter : d'une part, il s'agit de définir le seuil de pression de prédation supposé être supportable pour l'éleveur (nombre d'attaques constatées par l'administration pendant une durée donnée) ; d'autre part, il s'agit de définir un seuil de pression de prélèvement de loups supposé être supportable par la population (nombre maximum de loups dont la destruction peut être autorisée sans que cela n'affecte l'état favorable de conservation des populations).
Les débats qui accompagnent chaque année la publication des arrêtés préfectoraux ordonnant la réalisation de tirs de prélèvement de loups ne doivent pas être considérés comme le signe d'une défaillance du dispositif. Ils témoignent de l'invention en cours d'une coexistence qui ne peut pas être décrétée de manière autoritaire ou irénique[7], mais qui doit être pensée et construite comme un compromis réciproque des protagonistes. Tout l'enjeu des politiques publiques est alors de créer les conditions nécessaires à son élaboration.
[1] Sociologue à l'Institut national de recherche en sciences et technologies pour l'environnement et l'agriculture (IRSTEA) Chercheur associé au CSO (CNRS/Sciences-Po) et au laboratoire PACTE (CNRS/IEP/UPMF/UJF) dore.antoine@yahoo.fr
[2] Pour ne citer que quelques exemples : les mesures de protection des troupeaux (parcs de regroupement mobiles, chiens patous, etc.) ; le Réseau loup/lynx de suivi des populations ; l'arrêté fixant la liste des mammifères terrestres protégés sur l'ensemble du territoire français ; la circulaire relative à l'indemnisation des dommages causés par le loup aux troupeaux domestiques, etc.
[3] Convention relative à la conservation de la vie sauvage et du milieu naturel de l'Europe, Berne, 19 septembre 1979.
[4]Directive 92/43/CEE du Conseil, 21 mai 1992, concernant la conservation des habitats naturels ainsi que de la faune et de la flore sauvages.
[5]Simmel G., 1 W. Le conflit. Circé, Paris, 166 p
[6]Arrêté du 4 niiii 2011 fixant les conditions et limites dans lesquelles des dérogations aux interdictions de destruction peuvent être accordées par les préfets concernant le loup (Canis lupus). Journal officiel de la République française, n°0111 du 13 mai 2011 ; page 8289.
[7]Qui cherche à éviter les excès d'une attitude purement polémique. Relatif à l'irénisme (Larousse).
14:50 Publié dans Actualité des Sciences, Environnement-Écologie, Mammifères | Tags : antoine doré, inra | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
05/10/2013
Contrat de rivière Vallée du Doubs
 Contrat de rivière Vallée du Doubs : « restaurer la continuité écologique et restaurer les fonctionnalités biologiques »
Contrat de rivière Vallée du Doubs : « restaurer la continuité écologique et restaurer les fonctionnalités biologiques »
La détermination paye. Le Doubs va enfin bénéficier d’un contrat de rivière en 2014.
Le comité de rivière « Vallée du Doubs » s’est réuni pour la première fois ce mercredi. Il regroupe des élus, des services de l’État et des collectivités et des usagers, et signera en juin prochain le contrat avec ses partenaires financeurs (Collectivités, Agence de l’eau). Éric Durand, conseiller régional EELV, préside ce comité.
Pour Éric Durand : « Ce contrat de rivière permet enfin de se pencher sur notre belle rivière emblématique de notre territoire. Il va engager une série d’actions permettant de restaurer la continuité écologique de la rivière et restaurer ses fonctionnalités biologiques. Afin de mettre en œuvre ces actions, il faudra convaincre les acteurs locaux de façon à ce que chaque action soit admise et partagée par le plus grand nombre. C’est sur cette concertation et mobilisation que repose le succès de ce programme. »
Le contrat de rivière est un projet commun pour réhabiliter et valoriser le patrimoine aquatique, qui se traduit dans un programme d’aménagement et de gestion du cours d’eau.
C’est l’Établissement Public Territorial du Bassin Saône et Doubs (EPTB) qui suivra ce contrat. Il intervient sur plus de 2000 communes sur les thématiques des inondations, de l’amélioration de la qualité et de la ressource en eau, des zones humides et de la biodiversité. L’EPTB agit pour une gestion durable de l’eau, des rivières et des milieux aquatiques.
Pour le futur contrat de de rivière « Vallée du Doubs », le diagnostic réalisé par l’EPTB et le comité de suivi ont retenu trois axes :
* la restauration physique des cours d’eau et de leur continuité écologique,
* la maîtrise des pollutions d’origine agricole et industrielle,
* la sensibilisation des acteurs et du grand public en vue de leur implication.
Pour suivre ce contrat : site de l’EPTB :
http://www.eptb-saone-doubs.fr/Doubs-Vallee-du-Doubs-et
Article de France 3 :
http://blog.france3.fr/vallee-de-la-loue/2013/10/02/un-co...
08:36 Publié dans Actualité des Sciences, Environnement-Écologie, Géologie-hydrogéologie-Climatologie, Limnologie-hydrobiologie | Tags : contrat de rivière | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
03/10/2013
Les bactéries font et défont les espèces
 Les bactéries font et défont les espèces
Les bactéries font et défont les espèces
par Émilie Rauscher
(Science & Vie n° 1152, septembre 2013, pp. 106-111)
Les bactéries logées à l'intérieur de tout organisme vivant, y compris celles de la flore intestinale, influencent son évolution… Au point, parfois, de créer de nouvelles espèces. L'hypothèse avait été formulée il y a quelque temps déjà... En 1927, le microbiologiste américain Ivan Wallin notait :
"C'est une proposition pour le moins étonnante de dire que les bactéries, communément associées à la maladie, pourraient en fait être un facteur fondamental dans l'apparition de nouvelles espèces..."
Tellement étonnante, d'ailleurs, qu'elle fut rapidement oubliée, d'autant que les arguments pour la démontrer n'existaient pas... Ou plutôt pas encore. Car aujourd'hui, alors qu'ils mesurent encore à peine à quel point les bactéries sont partout – des abysses à nos cellules – ; alors qu'ils commencent à réaliser l'importance des relations ultimes et durables (symbioses) qu'elles ont tissées avec tout ce qui vit ; alors qu'ils découvrent enfin tout ce dont elles sont capables... finalement, les scientifiques en viennent à se dire qu'il y avait peut-être du vrai dans cette vieille idée folle !
Selon Bordenstein, professeur de biologie à l'université Vanderbilt (Nashville, EtatsUnis), lui, en est convaincu depuis plus de dix ans déjà : "Une nouvelle espèce pourrait bien apparaître, non seulement parce que ses gènes mutent au sein de ses propres cellules, mais aussi parce que les communautés microbiennes qu'elle héberge (dans ses intestins, etc.) changent ! " Et il a désormais de quoi étayer cette hypothèse, qui non seulement renouvelle notre compréhension de la complexe mécanique de l'évolution, mais fait des bactéries l'un des maîtres, aussi majeur que méconnu, du destin des espèces...
NOUS SOMMES TOUS DES ÉCOSYSTÈMES
Inspiré par Ivan Wallin, mais aussi par d'autres prédécesseurs visionnaires comme la biologiste américaine Lynn Margulis, qui avait perçu dès les années 1970 l'importance de la symbiose, Seth Bordenstein a patiemment réuni cas ambigus et phénomènes étranges, comme autant d'indices de l'influence des bactéries. Il mène des recherches, compile et dissèque les travaux dans lesquels des micro-organismes semblent être à l'origine d'une nouvelle espèce... Une gageure tant ce phénomène, la "spéciation", est discuté par les scientifiques : ses influences sont innombrables et ses causes multiples et difficiles à distinguer de ses conséquences.
Déjà se pose la question de ce qu'est une espèce. Cela semble simple si on regarde la chose d'un œil presbyte : de loin, les espèces se distinguent bien. De près, beaucoup moins. La faute à l'évolution et à la sélection naturelle qui poussent le vivant à changer en permanence, si bien qu'il est difficile de faire la part des choses quand une espèce se transforme ou que deux populations proches semblent s'hybrider. Par conséquent, depuis deux cent cinquante ans qu'ils travaillent dessus, les naturalistes, puis les biologistes ne se sont toujours pas accordés sur une définition claire... Retenons juste que des individus appartiennent à des espèces différentes s'ils ne peuvent pas se reproduire ensemble. Les raisons d'une telle barrière ? Soit l'acte est impossible entre eux, soit leurs hybrides sont condamnés ou stériles. Dans tous les cas, les ponts ont été coupés entre les partenaires et entre leurs espèces respectives — qui pouvaient n'en faire qu'une au départ. Incapables d'échanger des gènes, elles vont suivre chacune leur chemin évolutif et multiplier les différences. C'est ainsi qu'en partant d'un cousin de Velociraptor, on se retrouve quelques millions d'années plus tard avec des canards et des autruches. D'où viennent ces différences ? Comme le rappelle Seth Bordenstein, "les biologistes considèrent que l'apparition de nouvelles espèces est principalement dirigée par les changements qui se produisent dans nos gènes. Nous, nous démontrons que pour comprendre de façon globale comment se passe la spéciation, il faut certes considérer notre génome, mais aussi celui des micro-organismes qui sont en nous !" Pour le biologiste américain, la "cause première" de la séparation des espèces peut être, aussi, microbienne. Rappelons-nous que nous sommes de vrais écosystèmes, peuplés de nuées de bactéries. Tout comme deux populations appartenant à une même espèce peuvent être séparées physiquement par une montagne, ou génétiquement par un bouleversement chromosomique, elles peuvent l'être par ces mini-résidents !
Le chercheur a regroupé une collection inédite de cas où des bactéries ont sorti une artillerie lourde capable d'imposer cette ségrégation...
UN STRATAGÈME PARFAIT
Wolbachia est, à ce titre, exemplaire : cette bactérie infecte près de 60 % des arthropodes, l'immense groupe des insectes, acariens, araignées et crustacés. Parasite incontournable, elle s'insinue dans les cellules de son hôte et colonise la descendance des femelles. Pour favoriser sa transmission, elle réalise des prodiges.
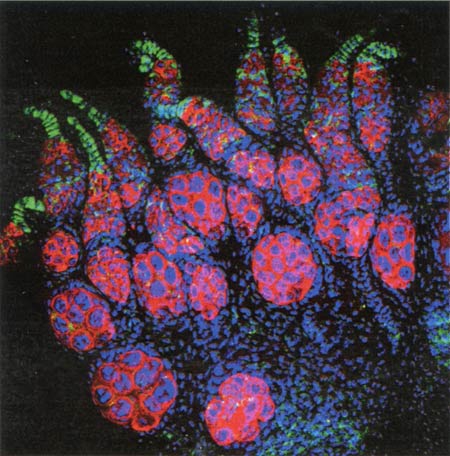
En infectant les cellules souches des organes reproducteurs de la Drosophile, la bactérie Wolbachia (en vert) modifie en sa faveur l'évolution de son hôte.
Ainsi, elle est capable d'imposer à ses hôtes une "spéciation asexuelle" : les femelles qu'elle infecte produisent sous sa houlette des ovules qui se développeront sans être fécondés par les mâles (qui deviennent ainsi inutiles). Chez des guêpes ou des acariens par exemple, on voit ainsi apparaître des lignées entièrement féminines et autonomes. "Ce cas est emblématique car immédiat, pointe Olivier Duron, spécialiste de l'évolution des symbioses à l'université de Montpellier 2. Dès l'arrivée de la bactérie, on a un isolement reproducteur, c'est-à-dire que l'individu infecté ne peut plus se reproduire avec les autres." Et qui dit isolement dit début de divergence entre les populations séparées.
Wolbachia a une seconde technique : elle sait influer sur les possibilités de reproduction de son hôte. Seules les femelles qu'elle infecte peuvent se croiser avec tous les mâles, transmettant ainsi le parasite à sa descendance. Une femelle non infectée est limitée aux mâles également non infectés, sous peine de voir ses œufs mourir. En quelques générations, près de 100 % de la population est parasitée. Ce procédé prend toute sa force quand on sait qu'il existe plusieurs types incompatibles de Wolbachia : ainsi, dans une même espèce d'arthropodes, on peut voir apparaître des groupes infectés par l'une ou l'autre souche bactérienne qui ne pourront plus se croiser !
DES ESPÈCES NAÎTRAIENT D'UN SIMPLE CHANGEMENT DE LEUR FLORE INTESTINALE
Preuve supplémentaire de la responsabilité de la bactérie : l'utilisation d'antibiotiques, en la tuant, fait tomber les barrières qu'elle dressait entre ses hôtes... À moins de s'y prendre trop tard, alors que l'évolution a déjà créé des lignées isolées. Séparées à l'origine par la bactérie, ces populations sont devenues trop différentes pour se croiser, même après sa disparition.
Ces exemples, Seth Bordenstein en connaissait l'importance, mais aussi les limites. Après tout, qu'un parasite niché au cœur même des cellules de son hôte ait un tel effet sur lui n'est sans doute pas si surprenant. Et si Wolbachia et ses consœurs sont courantes chez les arthropodes, on n'en connaît guère chez les mammifères, pour ne citer qu'eux. Ce qui limite leur impact à des groupes animaux, certes nombreux, mais bien particuliers...
Sauf que les bactéries n'ont pas besoin de s'incruster dans les cellules de leur hôte pour bouleverser sa vie. Partout dans le vivant, on observe des symbioses au cours desquelles elles se contentent de s'installer dans certains organes ! Pour rester chez les arthropodes, elles leur permettent de diversifier leur nourriture ou de s'adapter à un autre milieu, et donc de coloniser des zones interdites à leurs congénères. Grâce à elles, le termite mange du bois, le puceron conquiert de nouveaux végétaux, etc. "Puisqu'elle ouvre l'accès à une niche particulière, et donc facilite la divergence avec la population d'origine, la symbiose soutient la spéciation", souligne Olivier Duron. Voilà qui démultiplie les cas possibles !
Escherichia coli
Pourtant, Seth Bordenstein avait l'ambition d'aller encore plus loin. Pour ce défi, il reçoit en 2008 le soutien de son collègue Robert Brucker. Dans leur dernière étude, tout juste publiée, les deux biologistes soutiennent cette fois que même des bactéries banales, non symbiotiques, telles celles qui pullulent dans nos intestins, peuvent provoquer la spéciation ! "Ces dernières années, il est devenu clair que chaque animal avait des hôtes bactériens spécifiques, dont les gènes réunis (le microbiome) sont impliqués dans sa digestion comme dans son bon développement cérébral, rappelle le chercheur. Mais personne n'avait prouvé leur rôle dans la spéciation..."
Embryon hybride de Nasonia
Leurs bactéries créent une divergence entre les guêpes qui les empêche de se reproduire. Un traitement antibiotique a mis en valeur l'influence de la flore bactérienne de 3 guêpes du genre Nasonia qui les empêche de se reproduire. Sans traitement, leurs embryons hybrides ne survivraient pas, leurs flores étant incompatibles.
Avec l'aide de trois petites guêpes du genre Nasonia, d'une bonne dose d'antibiotiques et de logique, c'est désormais chose faite. Les chercheurs savaient que lorsque ces trois espèces se croisaient, leurs hybrides étaient condamnés. Ils prédirent, en s'inspirant des expériences avec Wolbachia, qu'un traitement antibiotique aurait un effet drastique... Ils ne se sont pas trompés : près de 90 % des hybrides furent sauvés ! L'incompatibilité entre les guêpes venait donc bien des bactéries. Et réinjecter les microbes restaurait leur lourde mortalité précédente. Un scénario qui a un air de déjà-vu... Sauf que, différence fondamentale, les microbes visés étaient, cette fois, simplement ceux de la flore intestinale !
UN JOUEUR DE PLUS À LA LOTERIE DE L'ÉVOLUTION
En étudiant cette dernière de plus près, Seth Bordenstein remarqua d'ailleurs que les hybrides survivant sans traitement étaient ceux qui avaient reçu une flore proche de celle d'un de leurs parents, au lieu d'un mélange chaotique. C'est donc bien cette flore qui détermine qui vit ou meurt et, ce faisant, imperméabilise les frontières entre les espèces concernées. "Cette étude est solide et l'idée qu'elle présente est séduisante. On savait que les bactéries intracellulaires pouvaient jouer sur l'isolement de populations... Mais que les bactéries intestinales en soient également capables est nouveau ! ", s'enthousiasme Olivier Duron. Ainsi, les espèces - et l'homme ne ferait pas exception - pourraient naître et prospérer par le fait de mutations dans leur génome mais aussi, simplement, par des changements dans leur flore intestinale.
Voilà une découverte qui ajoute un joueur particulièrement riche à la grande loterie de l'évolution... Et qui dit partenaire supplémentaire dit nouveaux gènes à prendre en compte : "Notre expérience donne ainsi une bonne raison de regarder 1'hologénome, c'est-à-dire la combinaison de l'ADN de l'hôte et de ses communautés de micro-organismes résidents, souligne Seth Bordenstein. L'objet de la sélection naturelle ne serait donc pas l'individu seul, mais lui et les communautés bactériennes associées." Pour le chercheur, nous étions jusqu'ici passés à côté de la plus grande part de l'information qui constitue chaque être vivant : les bactéries, ces marionnettistes invisibles et inconscients derrière l'évolution des espèces !
Proteus vulgaris
ET CHEZ L'HOMME ?
Notre part bactérienne est plus importante qu'on ne le croit : pour dix cellules humaines, nous abritons quatorze bactéries et pour dix gènes humains, nos microbes en comptent quatorze. Outre nos quelque vingt milliers de gènes, nous en comptons donc quelque trente milliers d'origine microbienne : deux patrimoines génétiques qui doivent fonctionner "en réseau".
Le rôle des bactéries dans l'évolution des insectes décrypté, on peut se demander ce qu'il en est des mammifères ou des poissons. Seth Bordenstein et Robert Brucker se posent bien sûr la question : "Nous espérons montrer que la flore intestinale et les gènes des microbes qui la composent, le microbiome, sont importants pour la spéciation animale. Une étude récente vient d'ailleurs de montrer que l'Homme et ses plus proches parents chez les primates ont des microbiomes spécifiques à chaque espèce, qui évoluent en même temps que l'ADN nucléaire (dans le noyau des cellules)." Cette coévolution plaide pour un lien fort entre notre génome et celui de notre flore. Les études se multiplient d'ailleurs pour recenser les bactéries que nous hébergeons et mieux comprendre le microbiome riche de plusieurs millions de gènes qu'elles constituent. On sait déjà qu'il existe trois "groupes bactériens" intestinaux, comme il y a des groupes sanguins, et que les perturber a des conséquences sur notre santé.
20:16 Publié dans Biologie, Médecine | Tags : spéciation, génomique, bactéries, flore bactérienne, microbiome | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |


