11/11/2009
L'Escargot (8) : la spermatogenèse
Nés de cellules souches pariétales, les gonocytes mâles se multiplient dans la lumière des tubules pour donner finalement des spermatozoïdes. Pendant ce temps, les ovocytes ne se multiplient plus sur la paroi mais prennent de l'embonpoint.
12:04 Publié dans Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, spermatogenèse | Lien permanent | Commentaires (2) | ![]() Facebook | | |
Facebook | | |
10/11/2009
L'Escargot (9) : l'ovogenèse
Nés de cellules souches pariétales, les ovocytes vont subir un accroissement considérable de leur volume par la constitution de réserves mettant en jeu toute une machinerie cellulaire.
17:19 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, ovogenèse | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
09/11/2009
L'Escargot (10) : genèse de la gonade
La genèse de la gonade permet de confirmer que les gamètes des deux sexes proviennent des mêmes cellules souches présentant une morphologie semblable à celle des cellules somatiques.
14:41 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
08/11/2009
L'Escargot (11) : Organes présumés endocrines
La différenciation des gamètes dans le sens mâle ou dans le sens femelle est sans doute due à des interactions hormonales. Il faut donc rechercher des organes endocrines susceptibles d'agir sur la gamétogenèse.
09:46 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, organes endocrines | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
07/11/2009
L'Escargot (12) : culture organotypique de la gonade isolée sur milieu anhormonal
Pour s'affranchir de l'influence de l'organisme sur la gonade, il faut l'isoler sur des milieux de culture dépourvus de toute hormone et de tester ainsi les potentialités intrinsèques des cellules souches à l'origine de la gamétogenèse. On montre ainsi que le sexe fondamental est le sexe femelle qui se manifeste spontanément en l'absence d'hormones : c'est l'autodifférenciation ovocytaire.
09:26 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, culture organotypique | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |
06/11/2009
L'Escargot (13) : culture de la gonade sur milieux enrichis
En culture d'organes sur milieu anhormonal, les gonocytes évoluent spontanément en ovocytes. Pour obtenir des spermatozoïdes, il faut ajouter au milieu de culture du sang d'escargot en phase mâle. Le schéma de la sexualisation des gonocytes est le suivant : pas d'hormones : sexe femelle ; hormones : sexe mâle.
08:39 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : sexualité, hermaphrodisme, escargot, culture organotypique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
05/11/2009
L'Escargot (14) : association de la gonade avec d'autres organes
L'ajout de sang d'escargot a montré que la spermatogenèse était induite par des facteurs humoraux. Il faut rechercher les organes effecteurs de ces facteurs masculinisants. On les trouvera dans le cerveau et le tentacule oculaire.
10:09 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : escargot, hermaphrodisme, sexualité, culture organotypique | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
04/11/2009
L'Escargot (15) Conclusion générale
 L'Escargot (15) : Interprétation de l'hermaphrodisme chez Helix aspersa
L'Escargot (15) : Interprétation de l'hermaphrodisme chez Helix aspersa
par André Guyard
(suite de l'Escargot 14)
Le présent article constitue une conclusion aux 14 articles précédents consacrés à l'Escargot et au déterminisme du sexe chez cet animal hermaphrodite.
Le comportement de la gonade d'Escargot en culture organotypique autorise à penser que la différenciation sexuelle des gonocytes est sous la dépendance d'une séquence hormonale. La confrontation des résultats de l'analyse du cycle in vivo et de l'étude expérimentale in vitro permet de mieux comprendre certaines modalités de l'expression de l'hermaphrodisme.
1) La culture de l'ébauche gonadique isolée démontre que non seulement chaque cellule-souche morphologiquement identique à une cellule somatique est sexuellement bivalente mais qu'elle est potentiellement une cellule femelle. Chez cette espèce hermaphrodite, le sexe femelle se réalise dans des conditions anhormonales. Il s'agit d'une autodifférenciation femelle.
2) Comment interpréter la protandrie ? Il faut supposer que la phase germinative qui débouche in vivo sur la spermatogenèse est déclenchée par un facteur masculinisant. L'expérimentation nous apprend que ce facteur présumé est humoral. Il est présent dans l'hémolymphe d'animaux en phase mâle et il permet l'accomplissement de la spermatogenèse in vitro. La sécrétion de cet agent est discontinue puisque sa présence dans l'hémolymphe est épisodique.
Le primum movens de l'action androgène siège au niveau du ganglion cérébroïde d'animaux d'âge postembryonnaire puisque cet organe favorise la multiplication spermatogoniale et, conjointement avec le tentacule oculaire, empêche la manifestation de l'autodifférenciation ovocytaire. Un fonctionnement endocrine discontinu du cerveau expliquerait les démarrages de spermatogenèses abortives au cours du premier mois de la vie postembryonnaire.
3) L'apparition des ovocytes un mois après l'éclosion correspondrait à un épuisement corrélatif des hormones masculinisantes cérébrales. La différenciation des protogonies dans le sens femelle coïncide dans un tubule donné avec l'arrêt de la multiplication spermatogoniale. In vitro, c'est l'époque où la seule présence des ganglions cérébroïdes ne permet plus d'assumer le contrôle de la spermatogenèse et de refréner l'autodifférenciation ovocytaire. Le taux de facteur masculinisant serait insuffisant pour imposer le sexe mâle à toute la gonade puisqu'il s'établit une espèce de gradient de sexualité dans la culture. La partie la plus proche du tissu nerveux est occupée par des spermatogonies en multiplication alors que dans la partie la plus éloignée, des gonocytes échappant probablement à l'action du facteur masculinisant s'autodifférencient en ovocytes.
4) Plus tard, au cours du cycle annuel de la gonade mature, le démarrage de la spermatogenèse puis l'apparition des ovocytes sur les parois peuvent s'expliquer de la même façon par l'intervention puis l'épuisement du facteur androgène. Or, chez les Crustacés, le cerveau qui contrôle le fonctionnement de la glande androgène a lui-même le même effet directement sur les gonocytes (J. Berreur-Bonnenfant, 1968). L'association in vitro des ganglions cérébroïdes d'animaux en spermatogenèse avec la gonade ne permet jamais la réalisation d'une spermatogenèse comparable à celle réalisée par l'adjonction d'hémolymphe d'hiver. Peut-être que cette expérience ne met en évidence que la stimuline contrôlant le fonctionnement d'un hypothétique tissu androgène.
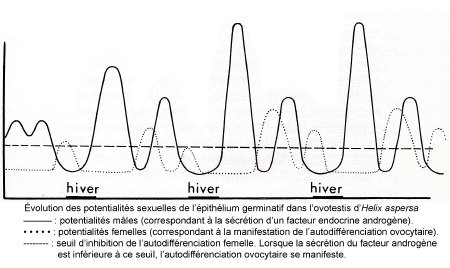
5) En outre, après accomplissement de la spermatogenèse, la lignée femelle poursuit son évolution. Or in vitro, le cerveau extirpé d'animaux en ovogenèse ne permet que la seule manifestation de la lignée femelle. C'est une nouvelle preuve de la labilité du facteur cérébral masculinisant. En sa présence en un taux suffisant, la lignée mâle entre en multiplications spermatogoniale ; en son absence ou en sa présence en quantité insuffisante, la lignée femelle se manifeste et amorce son auxocytose.
6) On peut se demander quel est le mécanisme responsable du déclenchement et de la modulation de la sécrétion de ce facteur masculinisant. D'une façon générale, il est certain que le système nerveux intervenant aussi bien dans le contrôle de la vie de nutrition et de reproduction que dans la vie de relation de l'organisme, la sécrétion des neurohormones est sousmise à l'influence des facteurs exogènes trophiques, climatiques ou psychiques, les récepteurs sensoriels (notamment le tentacule oculaire des Gastéropodes) pouvant jouer le rôle de relais. Ces considérations expliqueraient l'intervention des facteurs externes dans l'expression du phénotype cytosexuel chez les espèces hermaphrodites.
On peut également envisager que le signal du virage sexuel au niveau du cerveau provienne de l'ovotestis lui-même qui, par une sorte de feed-back déclenché par exemple par l'état de réplétion des tubules gonadiques dû à l'abondance des spermatogonies, avertisse le système nerveux central par voie humorale.
7) La participation d'autres facteurs humoraux contrôlant la physiologie de l'une ou l'autre des gamétogenèses doit être supposée pour expliquer la coexistence des deux lignées gamétiques.
Ainsi, pendant que se déroule la spermiogenèse in vivo ou en culture en présence d'hémolymphe d'hiver, l'accroissement ovocytaire est réprimé. C'est alors qu'on peut supposer l'intervention d'une inhibition de l'ovogenèse parallèlement à l'action d'un facteur spermiogénétique d'origine inconnue. Le fait que le tentacule montre un rôle constamment répressif sur l'ovogenèse est un indice en faveur de l'intervention de cet organe dans l'inhibition de l'accroissement ovocytaire.
D'autre part, un facteur cérébral semble, contrôler l'auxocytose. En culture, le ganglion cérébroïde prélevé sur des animaux en ovogenèse a une influence bénéfique sur l'accroissement ovocytaire sans qu'on puisse préjuger d'un rôle sur la vitellogenèse.
On peut soupçonner l'intervention de multiples facteurs dont les interactions constituent un jeu subtil permettant l'évolution en parallèle des deux lignées sexuelles ; ainsi la préméiose au sein des ovocytes débute fréquemment en même temps que s'amorcent les divisions réductionnelles des spermatocytes. Peut-être y a-t-il là une indication de l'intervention d'un facteur méiotique non sexualisé ?
Le schéma de la sexualisation des cellules germinales au sein de la gonade paraît plus simple. Les protogonies ou gonies indifférenciées sont sexuellement bivalentes. Elles reçoivent de la part du soma l'impulsion qui les orientera vers un sexe ou vers l'autre. C'est la nature et le cheminement de cette impulsion qui sont en cause.
Chez Helix aspersa, la culture organotypique a permis de mettre en évidence le phénomène d'autodifférenciation femelle.
Le schéma de la séquence hormonale qui contrôle la différenciation dans le sens mâle, évoqué par les résultats de l'association de la gonade avec le ganglion cérébroïde demande à être confirmé. S'agit-il de facteurs qualitativement distincts ou simplement de la modulation d'un unique facteur stimulateur de la gamétogenèse ?
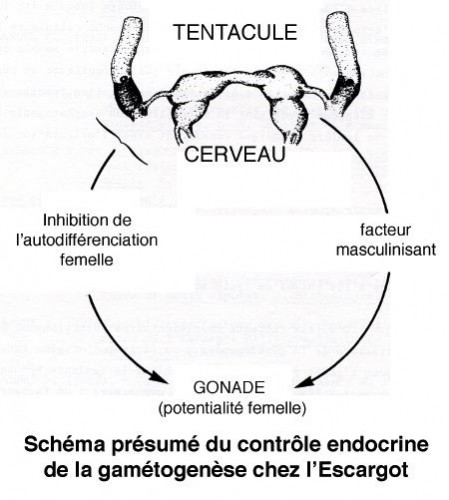
Il ne faut pas perdre de vue que ces résultats ont été obtenus avec la seule technique des cultures organotypiques. La mise en évidence d'actions endocrines ne pourra être résolue qu'avec le concours d'expériences complémentaires. Injections d'extrait cérébral et/ou tentaculaire, ablation sélective de cellules nerveuses, greffes ou implantations de ganglions, observation de la différenciation fine au niveau des organites des cellules germinales, identification chimique des substances actives constituent autant de techniques à exploiter pour poursuivre la discussion sur le contrôle de l'hermaphrodisme chez l'Escargot.
RÉSUMÉ
Helix aspersa Müll. est une espèce d'Hélicidés hermaphrodite protandre. L'étude histologique et ultrastructurale complétée par la mise en culture organotypique de la gonade a permis d'apporter quelques précisions quant aux mécanismes qui régissent la sexualisation des gonocytes.
La mise en place de la gonade est caractérisée par une période d'indifférenciation qui se prolonge jusqu'à dix jours après l'éclosion. Il n'existe qu'une seule souche cellulaire à l'origine des deux lignées germinales.
La protandrie semble due à une induction mâle d'origine cérébrale qui se manifeste en réprimant une tendance spontanée à l'autodifférenciation femelle et par un effet mitogène favorisant la multiplication spermatogoniale qui envahit la lumière gonadique consacrant ainsi l'orientation définitive du gonocyte dans le sens mâle.
Un mois après l'éclosion, l'hermaphrodisme se manifeste par la différenciation d'ovocytes en position pariétale. Ce phénomène réalité de l'autodifférenciation ovocytaire non refrénée par le cerveau dont l'action modulée selon l'âge ou la saison déterminera les phases du cycle sexuel.
D'autres facteurs complémentaires interviennent dans la réalisation de la gamétogenèse : un facteur d'origine tentaculaire dont l'effet principal est d'inhiber la tendance spontanée des gonocytes à l'autodifférenciation ovocytaire ; un facteur dont le siège est le ganglion cérébroïde qui favorise l'accroissement de la cellule femelle avec le concours de facteurs trophiques.
09:59 Publié dans Biologie, Invertébrés, Mollusques, Sexualité-embryologie | Tags : escargot, sexualité, hermaphrodisme | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |
05/10/2009
Les Cnidaires d’eau douce
 Hydres et autres Cnidaires
Hydres et autres Cnidaires
en eau douce
par André Guyard
(Texte mis à jour le 05/01/2013)
Les Cnidaires sont des Métazoaires (animaux pluricellulaires) diploblastiques (à deux feuillets), à symétrie radiaire parfois accompagnée d’une symétrie bilatérale. Ils comprennent environ dix mille espèces toutes aquatiques, la plupart marines et carnivores. Le corps possède une cavité unique, le coelentéron ou cavité gastrique. Des cellules urticantes ou cnidoblastes sont localisées dans des zones stratégiques de l’ectoderme et jouent un rôle dans la capture des proies. Les Cnidaires étaient autrefois regroupés avec les Cténaires (formes exclusivement marines) dans l’embranchement devenu caduque des Coelentérés.
ORGANISATION GÉNÉRALE
La plupart des Cnidaires ont deux stades dans leur cycle de vie sans parler de la phase larvaire : un stade fixé donc benthique - le polype - et un stade libre planctonique - la méduse.
Le corps du polype a la forme d’un sac fixé à une extrémité sur le substrat par une sole pédieuse. A l’autre extrémité, au sommet d’un petit renflement dessinant une zone hypostomiale, s’ouvre l’unique orifice du corps, la bouche entourée par des tentacules ; elle est dirigée vers le haut et met en communication avec l’extérieur la cavité gastrique dont les ramifications se terminent dans les tentacules. Le corps se divise ainsi en trois régions : corps du polype, tentacules et sole pédieuse. Le polype est capable de reproduction asexuée.
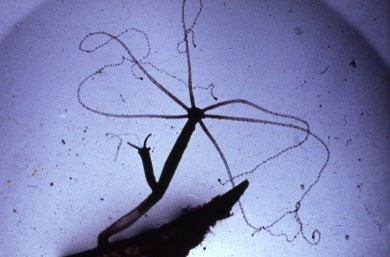
La méduse qui représente la forme libre a au contraire, l’orifice buccal dirigé vers le bas et offre l’image d’une cloche transparente dont le battant correspond à la région gastrique (manubrium).
La cloche ou ombrelle, est formée de fines digitations, les tentacules, implantés sur le pourtour d’un cercle rétréci (chez les Hydroméduses) par un voile ou velum, délimitant une cavité sous-ombrellaire dans laquelle pend le manubrium.
La bouche s’ouvre à l’extrémité de ce manubrium ; elle donne accès à un court oesophage qui aboutit dans un estomac situé au sommet de la cloche. Il en part des canaux radiaires au nombre de 4 ou d’un multiple de 4, qui rejoignent un canal circulaire ou marginal bordant l’ouverture de l’ombrelle. Ce canal envoie un diverticule dans chaque tentacule et est flanqué de deux cordons nerveux qui se prolongent également dans les tentacules.
Les gonades se développent sur les canaux ou sur le manubrium. La méduse possède des organes des sens : ocelles ou yeux rudimentaires disposés à la base des tentacules, et statocystes, ou organes d’équilibration situés entre les tentacules.
Parmi les formes d’eau douce de nos régions, on ne trouve que des représentants de la classe des Hydrozoaires. Cette classe groupe en principe des individus dont le cycle de vie est métagénétique avec alternance de générations de polypes asexués et de méduses sexuées. Cependant il existe des exceptions et c’est le cas des hydres d’eau douce (ordre des Hydrides) qui ne présentent que la forme polype et des Limnoméduses où le stade méduse devient nettement prépondérant.
LES HYDRES D’EAU DOUCE
Elles comportent plusieurs espèces commune à la belle saison. On les trouve fixées aux végétaux immergés dans les mares et les étangs.
MORPHOLOGIE EXTERNE
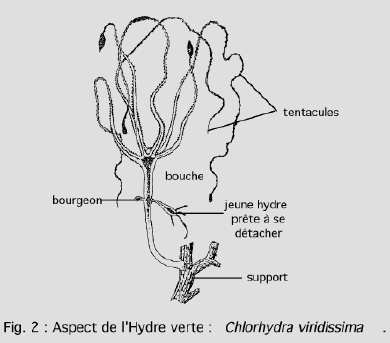
A l’état d’extension, l’hydre est un sac allongé, terminé par une couronne de six tentacules (ou 8) très longs et très contractiles qui entourent la bouche. Dans la région opposée, l’hydre est fixée par la sole pédieuse.
On distingue dans nos régions trois espèces : Pelmatohydra oligactis (fig. 1) a une colonne gastrique d’un brun noirâtre qui surmonte un pédoncule long mince et translucide, et porte des tentacules très étirés.
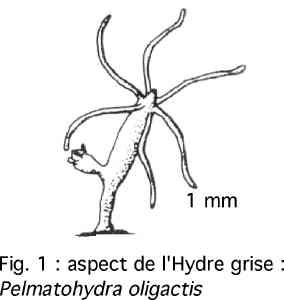
Elle doit sa couleur à la présence de
Hydra attenuata, gris brun, très pâle au niveau du pédoncule qui se prolonge par une colonne de même diamètre.
En période de reproduction, l’hydre présente à sa surface des renflements qui correspondent aux ovaires ou aux testicules. Elle peut également bourgeonner.
STRUCTURE
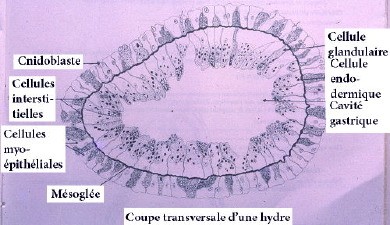
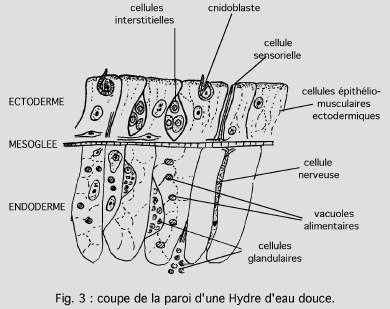
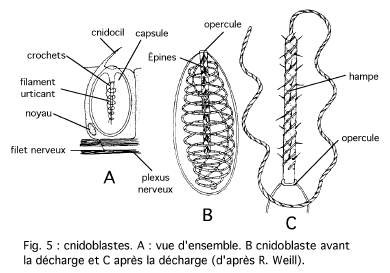
La paroi du corps (fig. 3) comporte un ectoderme unistratifié de cellules myo-épithéliales, avec des cellules nerveuses multipolaires, des massifs de cellules interstitielles, à caractères embryonnaires, pouvant redonner par multiplication et différenciation tout élément cellulaire ; des cnidoblastes ou cellules urticantes, munies d’un harpon creux injectant aux proies un poison l’actinocongestine.
L’endoderme tapisse la cavité digestive. Il est formé d’une unique couche de cellules très vacuolisées dont la base s’étendant sur la mésoglée, montre des myofibrilles transversales et leur bord libre du côté de la cavité présente des flagelles. Elles sont douées de phagocytose. On trouve également des cellules glandulaires et des cellules neuroépithéliales comme dans l’ectoderme.
La mésoglée est une substance colloïdale peu épaisse constituée par les lames basales des deux épithéliums.
BIOLOGIE
1. Locomotion et mouvements.
- Suivant le degré d’excitation, l’hydre peut se rétracter en une boule à peine visible à l’œil nu. Le réseau nerveux assure une certaine coordination aux mouvements des tentacules étalés normalement en position de chasse.
- Les déplacements se font par glissement sur la sole pédieuse ou par arpentage avec culbute (fig. 4). L’hydre présente un phototropisme variable suivant l’espèce.
- L’hydre peut quitter son support et nager par ses tentacules.

Les tentacules capturent les proies, les paralysent par les cnidoblastes et les amènent à la bouche. La digestion est extra-cellulaire dans la cavité gastrique avec un broyage dû aux mouvements du corps, puis intra-cellulaire après phagocytose dans les cellules endodermiques.
L’hydre s’accroît constamment par sa région orale par mitose de cellules interstitielles, si les conditions de vie sont favorables. Cette croissance est compensée par l’usure des cellules au niveau de la sole pédieuse. Une Hydre est ainsi totalement rénovée en un à deux mois.
4. Multiplication asexuée
- Bourgeonnement
- Scissiparité longitudinale par dédoublement de la zone de croissance.
- Régénération très facile.
À l'inverse, lorsque les biologistes allemands ont inactivé spécifiquement ce gène, les cellules souches de l'animal se sont différenciées en cellules adultes.
Bien que présent dans l'ensemble du monde animal, et donc chez l'Homme, le gène FoxO voit son expression diminuer au fil du processus normal de vieillissement... sauf chez l'hydre qui, de fait, ne vieillit pas et ne meurt jamais. En conclusion, un seul gène assure la régénération sans fin de tous les tissus du corps de l'hydre. Une propriété à exploiter pour lutter contre le vieillissement chez l'Homme ?
5. Reproduction sexuée
Elle apparaît quand les conditions de température deviennent défavorables : 10-12°C pour P. oligactis, 16-20°C pour C. viridissima et H. attenuata. P. oligactis et H. attenuata sont gonochoriques (sexes séparés). C. viridissima est hermaphrodite protandre (les spermatozoïdes sont mûrs avant les ovules).
Les gonades constituent des renflements apparaissant sur la colonne. Les testicules apparaissent dans le quart antérieur de la colonne, les ovaires à la moitié de la colonne.
Après fécondation, l’œuf commence sa segmentation totale et égale.
RÔLE BIOLOGIQUE DES HYDRES D’EAU DOUCE
Elles jouent un rôle qui passe inaperçu dans les biocénoses dulçaquicoles.
Utilisation dans les méthodes biologiques
Elles ne sont citées que dans la méthode des saprobies dans les zones :
β-mésosaprobe : Hydra vulgaris, Hydra oligactis = H. fusca et Hydra polypus existent déjà en zone α-mésosaprobe dans le périphyton des étangs des fossés et des eaux calmes.
oligosaprobe : Chlorohydra viridissima. Cordylophora lacustris : existe déjà dans la zone β-mésosaprobe.

Dans ce déversoir ferrugineux du lac Pavin (Auvergne),
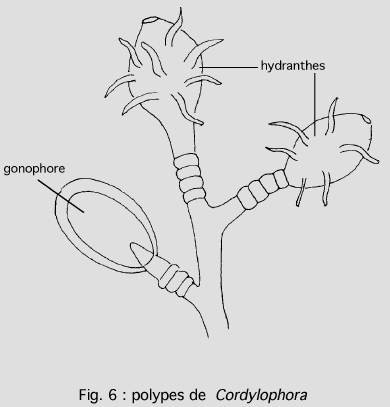
Dans les eaux saumâtres, on rencontre une espèce d’Hydraire gymnoblastique de la famille des Claviidae : Cordylophora caspia ( = lacustris). Cette espèce répandue sous toutes les latitudes, se présente sous la forme d’une colonie de polypes pouvant atteindre plusieurs cm (fig. 6). La colonie est fixée au substrat par un réseau de stolons, sur lesquels s’élèvent les hydrocaules portant les polypes (hydranthes) et les gonophores (polypes spécialisés dans la production de gamètes). Il n’y a pas de stade méduse.
Dans cet ordre, le stade méduse devient prépondérant et le polype, très régressé, de quelques millimètres de longueur, est souvent solitaire ou forme des colonies de 4 à 5 individus seulement. Les représentants vivent en eau douce ou saumâtre.
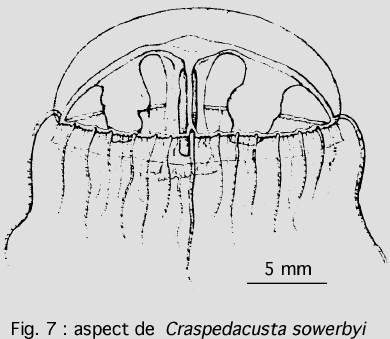

L’apparition de cette méduse en Europe vers 1880 pose des problèmes encore non résolus, par exemple celui de sa reproduction. Généralement, les méduses trouvées dans une même région sont de même sexe. Ce fait est dû probablement à l’existence d’une génération de polypes asexués décrits sous le terme de Microhydra ryderi. Mais il s’agit de la même espèce.
On ignore comment elle est arrivée là : cette méduse existe dans le bassin de l’Institut des Sciences Naturelles, place Leclerc à Besançon. Dans les années mille neuf cent soixante, elle s’est signalée par une prolifération étonnante, envahissant de ses ombrelles la totalité du volume du bassin. De nouveau dans les années quatre-vingt, autre prolifération. La forme polype, difficile à observer, persiste certainement sur les parois du bassin. Et la forme méduse, forme sexuée se manifeste lorsque les conditions de vie du polype deviennent difficiles.
Autre limnoméduse, dans les lagunes saumâtres du Sud de la France, Picard (1951) a observé la limnoméduse Odessia maeotica f. gallica qui présente annuellement deux périodes d’activité sexuelle et fait partie de la famille des Moerisiidae.
On ne connaît comme autre méduse d’eau douce que le genre africain Limnocnida.
16:23 Publié dans Cnidaires, Invertébrés, Limnologie-hydrobiologie | Lien permanent | Commentaires (5) | ![]() Facebook | | |
Facebook | | |


