26/05/2011
L'hibernation chez les Mammifères
 L'hibernation chez les Mammifères
L'hibernation chez les Mammifères
par André Guyard
Dernière mise à jour :18/12/2017
(voir ajout au bas de l'article)
Sur ce même blog, la note sur la Marmotte des Alpes aborde le problème de l'hibernation. Il faut savoir que ce sommeil hivernal n'est pas un somme de tout repos : il est ponctué de réveils périodiques. D'après André Malan, les mécanismes cellulaires, qui diminuent jusqu'à 100 fois les dépenses d'énergie de l'organisme, seraient hérités d'un ancêtre lointain.

Fig. 1 : Marmotte des Alpes © André Guyard
L'hibernation est un mécanisme qui permet aux marmottes d'échapper aux mauvaises conditions hivernales. Il s'agit d'une migration dans l'espace temps comme d'autres animaux migrent dans l'espace géographique en quittant nos contrées enneigées où toute production végétale est interdite. Face à cette disette temporaire, la solution choisie par la Marmotte comme d'autres hibernants consiste à faire des réserves, puis à s'abriter et à réduire ses dépenses afin de pouvoir survivre jusqu'au retour de la végétation. L'hibernation est précédée, à la fin de l'été, par une période de préparation où l'animal choisit et aménage son abri, et accumule des réserves. Puis l'animal entre dans son abri, et sa température interne s'abaisse jusqu'au voisinage de celle de la paroi.
Ce comportement implique des mécanismes étonnants en termes de physiologie, d'énergie et de modifications cellulaires. Ainsi, pendant l'hibernation, certains neurones ressemblent à ceux des individus atteints de la maladie d'Alzheimer, à ceci près que les modifications sont réversibles chez les premiers alors qu'elles ne le sont pas chez les seconds. Enfin, l'hibernation apparaît non pas comme une série d'adaptations récentes, mais plutôt comme un bagage commun aux anciens mammifères dont certains se sont délestés, faute d'utilisation.
Quels que soient les mammifères (échidnés, opossums pygmées, marmottes, loirs, lérots, hérissons...), l'hibernation n'est jamais continue au cours de l'hiver. Les épisodes de torpeur, avec une température basse, durent de quelques jours à quelques semaines selon les espèces, et alternent avec des "réveils" au cours desquels l'animal se réchauffe spontanément pour revenir pendant quelques heures, voire quelques jours à l'euthermie, c'est-à-dire à une température normale (environ 37 °C) en dehors de l'hibernation. Ces réveils répondent à un besoin impératif, car ils sont extrêmement coûteux en énergie: ils représenteraient 83 pour cent de la dépense totale en période d'hibernation chez un spermophile (un écureuil) canadien.
Une mort clinique apparente
Au cours des épisodes de torpeur, l'animal est dans un état de vie ralentie. Toutefois, les différentes fonctions physiologiques ne sont pas modifiées de la même façon : la respiration et la circulation sont maintenues, tandis que la filtration rénale est très diminuée, voire arrêtée. L'activité cérébrale perdure seulement dans certaines zones du cerveau, notamment les aires du tronc cérébral indispensables au contrôle des fonctions végétatives autonomes, telles que la respiration. Toute activité électrique corticale spontanée disparaît. En d'autres termes, l'animal remplit les critères légaux de mort clinique ! L'hibernation n'est donc pas un sommeil, les critères électroencéphalographiques du sommeil ayant disparu. Toutefois, l'animal reste excitable et réagit à une stimulation auditive (on le détecte par des ondes corticales déclenchées par une telle stimulation), conduisant au réveil quand le bruit est intense ou prolongé.
Lorsque l'animal est endormi, la respiration est parfois discontinue. Ainsi, chez le Lérot et le Hérisson, des bouffées de cycles ventilatoires sont interrompues par des apnées de plus d'une heure. La quantité de dioxyde de carbone dans les tissus augmente notablement pendant toute la durée d'un épisode de torpeur, conduisant à une acidification du sang et des liquides intracellulaires : on parle d'acidose respiratoire. Au moment de l'entrée en hibernation, l'animal réduit sa ventilation plus vite que ne décroît la production métabolique de dioxyde de carbone, de sorte que ce dernier s'accumule dans le sang ; à l'inverse, le réveil commence par une phase d'hyperventilation qui élimine rapidement le gaz carbonique.
Des réserves pour tout l'hiver
Certaines espèces accumulent des graines. Un hamster d'Europe peut ainsi stocker jusqu'à dix kilogrammes de céréales dans son terrier, au sec : à chaque réveil, il se restaure avant un nouvel épisode de torpeur. Pour les espèces herbivores, telle la Marmotte, ou insectivores, comme le Hérisson, le stockage est impossible. L'animal recourt alors à une accumulation de graisse corporelle, représentant couramment 50 pour cent de la masse maigre et parfois jusqu'à 100 pour cent. Le calcul montre que la somme des calories accumulées assure à peine 26 jours de survie, ce qui est insuffisant.
C'est là qu'intervient l'abaissement de la température corporelle. Celle-ci est contrôlée principalement au niveau de l'aire préoptique de l'hypothalamus, qui fonctionne à la façon d'un thermostat : lorsque la température locale est abaissée en dessous du point de consigne apparent de 37 °C, la production de chaleur de l'organisme est augmentée proportionnellement à l'écart. Craig Heller, de l'Université Stanford, a montré que ce point de consigne apparent est abaissé lors de l'entrée en hibernation, jusqu'à atteindre 2 °C chez certaines espèces. Cette température est maintenue constante pendant l'épisode d'hibernation, la thermogenèse étant augmentée si la température corporelle s'abaisse au-dessous, évitant ainsi le risque de gel.
Quant aux dépenses d'énergie, la diminution du point de consigne apparent permet à l'animal de bénéficier de l'effet Van t'Hoff-Arrhénius, c'est-à-dire l'effet de la température sur les réactions enzymatiques. Ainsi lorsque la température s'abaisse de 37 à 5 °C, la vitesse maximale de toutes les réactions enzymatiques est divisée par un facteur compris entre 12 et 15. En outre, la dépense d'énergie de l'organisme est la somme de toutes les dépenses élémentaires. Par conséquent, la loi s'applique aussi à l'organisme entier, même chez un animal de la taille du crocodile.
Avec une température d'hibernation de 5 °C, l'effet de la température réduit la dépense quotidienne du spermophile, au repos, à 9,2 kilojoules. Ces économies d'énergie lui permettraient théoriquement de survivre 620 jours (plus d'un an !). Cependant, les réveils obligatoires multiplient jusqu'à six fois la dépense totale. Reste une centaine de jours de survie, un laps de temps encore insuffisant, d'autant plus qu'une marge de sécurité est indispensable, notamment quand l'animal vit dans un pays arctique ou en altitude, où la période de végétation n'excède pas quatre mois par an. Ce délai est trop court pour que les jeunes de l'année atteignent une taille suffisante et aient le temps d'accumuler assez de graisse pour passer leur premier hiver. Pour augmenter le temps disponible pour la croissance des jeunes, les adultes sortent alors d'hibernation avant la fonte des neiges. Les combats des mâles, la recherche des conjoints et la gestation font que la naissance des petits coïncide avec le retour de la végétation. Mais pour les parents, toutes ces activités ont lieu à jeun, alors qu'ils viennent de vivre la pénurie de l'hibernation. La sélection sexuelle se fait largement sur les réserves de lipides dont ils disposent encore.
La dépression métabolique : une biochimie au ralenti
Le facteur de réduction des dépenses énergétiques est compris entre 20 et 100. Lorsque l'on suit l'entrée en hibernation ou en torpeur quotidienne, la diminution du métabolisme précède souvent celle de la température au lieu de la suivre comme si elle en était la conséquence. Comment expliquer ces observations ? Par la dépression métabolique, c'est-à-dire une réduction réversible de la dépense énergétique par des mécanismes autres que l'abaissement de température.
En euthermie, la synthèse protéique représente environ le cinquième de la dépense d'énergie du cerveau. En hibernation, cette proportion est divisée par un facteur supérieur à 100 : la synthèse protéique est quasi inexistante. Dans la figure 2, La synthèse protéique, dans un cerveau de spermophile, est mesurée par l'incorporation de leucine radioactive, un acide aminé fréquent dans les protéines. Une absence de marquage indique une absence de synthèse protéique (en a, état normal; en b, hibernation).
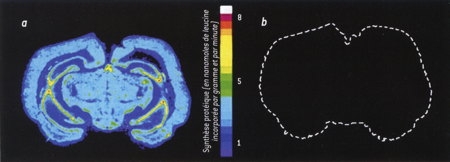
Fig. 2 : Synthèse protéique
dans un cerveau de Spermophile
© K. Freirichs
Dans les cellules, les mécanismes de la dépression métabolique agissent simultanément en de nombreux points, que ce soit dans les processus qui fournissent de l'énergie ou ceux qui en consomment. Un des mécanismes les plus fréquemment observés est la phosphorylation (la fixation d'un groupe phosphoryle, PO43-) réversible de protéines spécifiques (voir la figure 3), cette liaison diminuant leur activité. C'est le cas par exemple de la pompe à sodium-potassium de la membrane cellulaire qui transporte des ions potassium et sodium contre leur gradient de concentration à travers la membrane cellulaire. Ce transport, essentiel au fonctionnement des cellules excitables, tels les neurones ou les fibres musculaires, représente environ 50 pour cent de la dépense d'énergie du cerveau en euthermie.
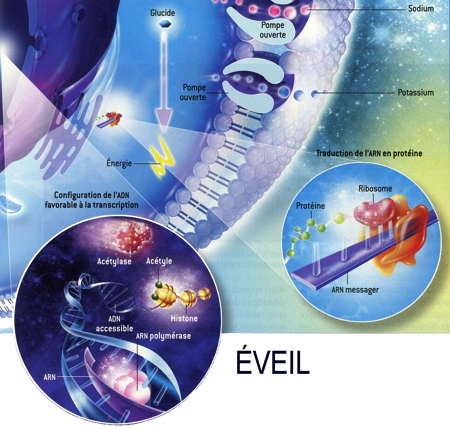
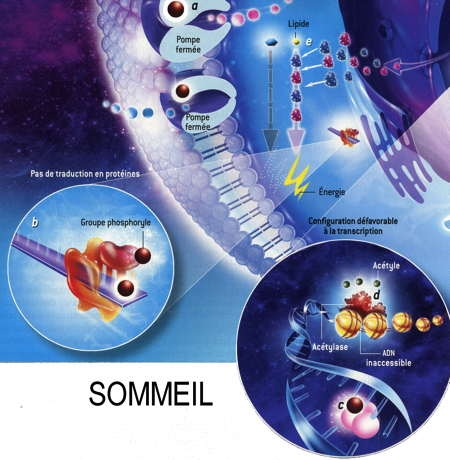
Fig. 3 : Séquence éveil-sommeil chez la Marmotte
© Virginie Denis
La figure 3 montre qu'au cours de l'hibernation chez la Marmotte, le métabolisme est notablement ralenti pendant les épisodes de torpeur (en bas), notamment par la fixation de groupes phosphoryle (en marron) sur les acteurs cellulaires qui participent aux processus coûteux en énergie. Ainsi les pompes à ions sodium ou potassium se ferment [a]. La synthèse protéique est réduite [b]. L'ARN polymérase ne transcrit plus l'ADN en ARN [c]. Les gènes de l'ADN qui s'enroule autour des histones sont inaccessibles et ne peuvent plus être exprimés [d]. Enfin, deux enzymes privilégient les lipides comme source d'énergie plutôt que les glucides [e].
De même, la quantité de formes phosphorylées de protéines ribosomales participant à la synthèse protéique est notablement augmentée en hibernation : la traduction des arn messagers en protéines en est diminuée d'autant.
Par ailleurs, l'expression des gènes est favorisée dans le noyau par la phosphorylation, mais aussi par l'acétylation (la fixation d'un groupe acétyle) des histones, les protéines autour desquelles s'enroule l'adn. Ces liaisons sont réduites de près de 40 pour cent en hibernation, tandis que l'activité des enzymes de désacétylation est augmentée.
Cependant, ces modifications n'ont pas lieu dans tout l'organisme. La dépression métabolique est particulièrement observée dans les organes dont l'activité est réduite en hibernation : le cerveau, les reins ou l'intestin. En revanche, le tissu adipeux brun, qui est une source de chaleur importante pour les réveils spontanés (voir la figure 4), n'est pas concerné.
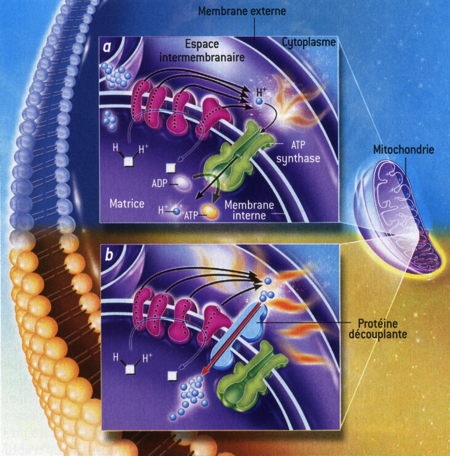
Fig. 4 : Production de chaleur dans les mitochondries
© Virginie Denis
La figure 4 explique la production de chaleur dans les mitochondries. Dans une cellule normale [a], des molécules réduites [en blanc] sont oxydées, c'est-à-dire qu'elles perdent leurs ions H+ qui sont captés et rejetés de l'autre côté de la membrane interne par les constituants de la chaîne respiratoire [en rosé]. Le gradient d'ions H+ qui en résulte (ils sont plus nombreux dans l'espace intermembranaireque dans la matrice) alimente l'ATP synthase [en vert] qui récupère l'énergie dissipée par l'oxydation et la « confine » dans des molécules d'ATP [flèche verte], la source d'énergie des cellules. Un peu d'énergie est perdue lors de ces réactions et est convertie en chaleur [les petites flammes]. Dans le tissu adipeux brun [b], le couplage de la chaîne respiratoire et de l'ATP synthase est supprimé par une protéine découplante [en bleu clair] qui réduit le gradient d'ions H+ [flèche rouge] : toute l'énergie de l'oxydation est alors convertie en chaleur [les grandes flammes].
En outre, la réduction du métabolisme s'accompagne du remplacement de la source principale d'énergie cellulaire. Dans une cellule à l'euthermie, les glucides sont les principaux pourvoyeurs d'énergie sous forme d'atp. Cette dernière restitue l'énergie emmagasinée lors des réactions biochimiques. Dans une cellule en hibernation, les glucides sont remplacés par les lipides, dont le rendement est meilleur (pour une même masse, l'énergie produite est supérieure). C'est ainsi que les gènes codant deux enzymes clés de cette réorientation, la pyruvate déshydrogénase kinase 4 et la triacylglycérol lipase, sont activés en hibernation, de même que ceux des protéines qui assurent le transport intracellulaire des lipides.
On ignore encore le détail des processus qui assurent le contrôle de l'entrée en hibernation et du réveil. L'hyperventilation observée au début du réveil, en éliminant rapidement une grande partie du dioxyde de carbone accumulé, lève rapidement l'inhibition qu'il exerçait pendant la phase de torpeur.
Réduire l'intensité métabolique comporte des risques. Le premier est qu'en supprimant le cycle de dégradation et de renouvellement des protéines, l'organisme s'expose à une accumulation de protéines détériorées. Les réveils périodiques constitueraient la principale adaptation à ce problème : le retour temporaire à un fonctionnement normal serait l'occasion d'un "nettoyage", et serait la raison d'être essentielle de ces réchauffements coûteux en énergie.
Hibernation et Alzheimer
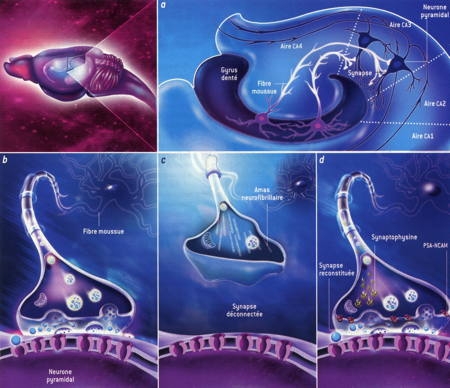
Une des découvertes récentes les plus surprenantes est celle de l'analogie entre certains processus qui se déroulent dans le cerveau en hibernation et la maladie d'Alzheimer. Un des symptômes de cette maladie est l'apparition d'amas neurofibrillaires de la protéine tau. Normalement associée aux microtubules qui assurent le transport dans le neurone, cette protéine est hyperphosphorylée chez les malades : elle se désolidarise alors des microtubules et s'assemble en filaments hélicoïdaux dans les diverses ramifications du neurone (axone et dendrites) et en perturbe le fonctionnement. Au cours du développement de la maladie, les amas neurofibrillaires apparaissent en priorité dans les zones du cerveau qui participent aux phénomènes de mémorisation, notamment dans les neurones de l'aire ca3 de l'hippocampe.
Dans l'hippocampe, les contacts synaptiques entre les fibres moussues (du gyrus denté) et les neurones pyramidaux régressent notablement au cours des épisodes d'hibernation profonde, et se restaurent complètement lors des réveils (voir la figure 5). Partant, Thomas Arendt et ses collègues des Universités de Leipzig, Groningen et Iéna, ont eu l'idée d'étudier la phosphorylation de la protéine tau dans le cerveau de spermophiles en hibernation. Surprise, dans leur hippocampe, les cycles de régression et restauration des synapses des neurones de la zone ca3 sont en phase avec des cycles parallèles d'hyperphosphorylation et de déphosphorylation de la protéine tau. À l'inverse de ce qui se passe dans la maladie d'Alzheimer, cette hyperphosphorylation est totalement réversible : les neurones recouvrent pleinement leur fonction et remplissent de nouveau leur rôle dans la mémorisation.
Fig. 5 : Déconnection des synapses de l'hippocampe au cours de l'hibernation © Virginie Denis
(Agrandissement : cliquer sur l'image)
La figure 5 montre que, dans l'hippocampe [a, chez le spermophile], une aire essentielle à la mémorisation, les fibres moussues du gyrus denté sont reliées aux neurones pyramidaux de la zone CA3 par des synapses [b]. Pendant l'hibernation, ces connexions sont interrompues par des amas neurofibrillaires, des filaments hélicoïdaux de protéines, nommées tau, fortement phosphorylées [c]. La protéine tau est normalement associée aux microtubules qui assurent le transport des constituants cellulaires. Ce mécanisme est identique à celui que l'on observe dans les neurones des individus atteints de la maladie d'Alzheimer, où l'on constate des amas délétères de protéines tau. Cependant, chez les animaux hibernants (et contrairement à ce qui se passe dans la maladie d'Alzheimer), le processus est réversible. Au réveil, les synapses se reforment [d], notamment grâce aux protéines PSA-NCAM et à la synaptophysine, tandis que, par un processus indépendant, la protéine tau est déphosphorylée et reprend sa fonction initiale.
Les fibres moussues sont le siège d'autres modifications. Elles sont riches en protéine psa-ncam, une molécule qui assure l'adhérence des cellules et dont l'expression est liée à la formation et au remodelage des synapses, des processus associés à l'apprentissage et la mémorisation. La protéine psa-ncam disparaît complètement au cours d'un épisode d'hibernation, et réapparaît progressivement lors du réveil suivant. Il en est de même d'une autre protéine, la synaptophysine, qui participe au fonctionnement de la synapse. Ces cycles sont en opposition de phase avec celui de la phosphorylation de la protéine tau : la protéine psa-ncam et la synaptophysine sont abondantes quand la protéine tau est déphosphorylée. On sait par ailleurs que l'hibernation entraîne la perte de certains apprentissages acquis, mais que cette perte est sélective, ne concernant pas la reconnaissance des congénères. Ainsi, pendant l'hibernation, l'hippocampe se détériore et se régénère pendant les éveils, les synapses étant rétablies.
La perte des connexions neuronales est-elle un moyen d'économie d'énergie, ou en est-elle une conséquence ? La phosphorylation de la protéine tau est-elle une protection, indispensable à la restauration fonctionnelle ? Quoi qu'il en soit, le fait que ces phénomènes soient réversibles constitue une piste pour un traitement de la maladie d'Alzheimer.
L'hibernation comme la reproduction sont des phénomènes saisonniers, nécessitant une anticipation sur les conditions d'approvisionnement. Nous avons vu comment chez certaines espèces la recrudescence de l'activité sexuelle des adultes au printemps intervient avant le retour d'une nourriture abondante. Inversement, l'accumulation des réserves doit anticiper la pénurie saisonnière. Bien qu'incompatibles entre elles (difficile de se reproduire quand on dort !), hibernation et reproduction partagent des mécanismes de contrôle saisonnier. Chez les mammifères, les cycles saisonniers sont contrôlés par la photopériode, c'est-à-dire le rapport de la durée du jour à celle de la nuit. L'information sur la luminosité est transmise par la rétine et analysée par l'hypothalamus qui la convertit, via la glande pinéale, en un pic de production nocturne de mélatonine. Ce mécanisme est indispensable au contrôle saisonnier de la reproduction, notamment à la production d'hormones. Or l'implantation chez des hamsters de capsules en silicone libérant de la testostérone (une hormone sexuelle) suffit à inhiber l'hibernation. Le contrôle saisonnier de l'hibernation résulterait donc de la levée de l'inhibition exercée par le système reproducteur.
Dormir ou se reproduire
Comment l'hibernation est-elle contrôlée par les hormones sexuelles ? Beaucoup de questions demeurent, mais on a montré que l'innervation par des fibres à vasopressine (des neurones qui fabriquent cette hormone) fluctue de façon saisonnière selon le taux d'hormones sexuelles. La vasopressine serait le relais entre ces hormones sexuelles et l'hibernation. De fait, lorsque ce taux d'hormones sexuelles s'effondre en automne, et que deux mois plus tard, les fibres à vasopressine disparaissent, l'hibernation commence. Ce délai est prolongé par l'implantation de capsules libérant de la vasopressine ; l'hibernation réapparaît dès la fin de cette libération.
L'expression saisonnière de l'hibernation fait l'objet d'un contrôle exercé par des protéines synthétisées dans le foie, et dont le transport vers le cerveau est assuré par le plexus choroïde de façon variable selon les saisons. Le rôle de la mélatonine et des hormones sexuelles dans le contrôle de ce transport restent à élucider.
Comment les organes résistent-ils aux variations de températures ?
Soumis à de basses températures, la plupart des organes des mammifères subissent des lésions et ne pourraient résister à une hibernation.
 Récemment, une équipe de l'Université de Groningen, aux Pays-Bas a montré que les tissus des poumons du Hamster doré changent de structure moléculaire dans les phases de torpeur (The Journal of Experimental Biology, mars 2011). Les alvéoles des poumons sont entourées de muscles lisses et de collagène, une protéine qui favorisent l'adhérence de ces alvéoles aux muscles.
Récemment, une équipe de l'Université de Groningen, aux Pays-Bas a montré que les tissus des poumons du Hamster doré changent de structure moléculaire dans les phases de torpeur (The Journal of Experimental Biology, mars 2011). Les alvéoles des poumons sont entourées de muscles lisses et de collagène, une protéine qui favorisent l'adhérence de ces alvéoles aux muscles.
Quand l'animal sombre dans la torpeur, la quantité d'actine – un composant des filaments musculaires - augmente progressivement, puis diminue pour retrouver son niveau initial deux heures après la sortie de la torpeur. De plus, la quantité de collagène augmente dans les premières 24 heures de l'hibernation avant de diminuer jusqu'au réveil.
Ainsi, chez les hamsters, la structure moléculaire des alvéoles pulmonaires peut changer rapidement et de façon réversible. Or les êtres humains souffrant d'asthme ou de troubles obstructifs chroniques présentent le même type de modifications moléculaires dans leurs poumons.
Peut-être pourra-t-on éviter ces anomalies chez l'homme quand on saura comment le Hamster retrouve si vite des poumons fonctionnels lors de ses réveils.
Adaptation récente ou processus ancestral ?
On décrivait classiquement l'hibernation comme une adaptation : à partir d'un type mammalien standard, l'amélioration des capacités de survie apportée par la faculté d'hiberner aurait conduit à la sélection des mutations génétiques correspondantes, aboutissant à une spécialisation d'espèces particulièrement performantes de ce point de vue. Dans cette conception, les similitudes des caractéristiques générales de l'hibernation observées dans des groupes par ailleurs éloignés relevaient d'un phénomène de convergence, tout comme les nageoires des phoques et celles des cétacés.
Cependant, cette conception est difficilement compatible avec la diversité des lignées de mammifères dont certaines espèces hibernent (sans compter les oiseaux). On en trouve en effet pratiquement dans tous les ordres existants qui contiennent des espèces de petite taille, depuis les plus primitifs comme les monotrèmes jusqu'aux primates. À l'exception de l'Ours, toutes les espèces hibernantes ont une masse inférieure à quelques kilogrammes, ce qui est probablement lié à la contrainte des réchauffements périodiques.
En outre, au sein d'un même groupe, on peut trouver des genres ou même des espèces voisines dont les uns hibernent et les autres pas. Ainsi, le Spermophile européen hiberne, mais pas son cousin, l'Écureuil roux de nos parcs. La séparation des deux espèces est trop récente pour avoir autorisé l'accumulation de mutations nécessaires à une adaptation complexe.
L'hypothèse selon laquelle l'hibernation correspond à un type ancestral, dont certaines caractéristiques auraient été souvent perdues faute d'emploi, est plus vraisemblable. Le gène de la protéine hp25, nécessaire au contrôle de l'hibernation, a été décrit chez plusieurs rongeurs hibernants de la famille des écureuils, mais aussi chez une espèce voisine arboricole qui n'hiberne pas. Chez cette dernière, le gène a fait l'objet d'une mutation qui l'a inactivé.
À quoi pouvait ressembler le type primitif de régulation thermique ? Un reptile de nos latitudes, le Lézard vert, en est un exemple. De tels lézards ont été placés dans des enceintes où ils étaient exposés à une température variable du plancher, de 5 à 35 °C. Le lézard, animal à "sang froid", peut ainsi contrôler sa température interne en se déplaçant. Au voisinage des équinoxes de printemps ou d'automne, il ajuste sa température à environ 30 °C le jour, tandis qu'il l'abaisse à 20 °C la nuit. En été, il maintient une température constante proche de 30 °C, voisine de celle d'un mammifère primitif, grâce à la chaleur fournie par le sol. En revanche, en hiver, il choisit spontanément une température de 12 °C environ. Le lézard se livre ainsi à une sorte d'hibernation comportementale ! À l'instar des cycles saisonniers des mammifères, cette saisonnalité est contrôlée par la photopériode via la mélatonine. Des comportements similaires ont été observés dans la nature, des batraciens et des reptiles sélectionnant des environnements froids au début de l'hiver. On a même décrit récemment des réveils périodiques chez un reptile en hibernation.
Les mammifères et les oiseaux ont ensuite acquis la production endogène de chaleur. L'alternance quotidienne entre température élevée et température basse telle qu'on l'observe chez le lézard au printemps et en automne existe encore dans de nombreuses espèces de mammifères et d'oiseaux, sous la forme d'une torpeur quotidienne, que seule la présence d'un réchauffement par thermogenèse endogène différencie du type lézard. Elle existe même à l'état juvénile chez des espèces comme le rat qui est parfaitement homéotherme à l'état adulte.
L'acidose respiratoire de l'hibernation serait aussi une caractéristique ancestrale. En effet, l'acidose respiratoire se retrouve en liaison avec une dépression métabolique saisonnière (hivernale ou estivale) dans tous les grands groupes zoologiques où s'est développée la respiration aérienne (mollusques, insectes, poissons, batraciens, reptiles, oiseaux et mammifères), et que la vie continentale expose à des disettes saisonnières.
L'hibernation humaine ?
Ce changement dans la conception de l'évolution de l'hibernation bouleverse notre approche de l'application à la médecine des données de l'hibernation. L'homme a-t-il conservé des traits primitifs, qui permettraient par exemple de mettre en jeu des phénomènes de dépression métabolique, fort utiles pour passer des caps difficiles ? Il en serait bien ainsi : on connaît maintenant un certain nombre de cas de survie à des arrêts cardiaques prolongés, en hypothermie, chez des enfants tombés dans des lacs gelés comme chez quelques adultes, qui ne peuvent s'expliquer que par la mise en jeu spontanée de mécanismes puissants de dépression métabolique qui permettent au cerveau de survivre à un arrêt circulatoire. Reste maintenant à en élucider les mécanismes afin de développer des applications cliniques. La recherche sur les mammifères hibernants est là pour nous aider.
Ajout du 18/12/2017 : Hibernation : une histoire de cellules. En hiver, certains animaux hibernent et d'autres en sont incapables. Qu'est-ce qui les distingue? La réponse se niche au cœur des cellules, a découvert une équipe américaine.
Durant l'hiver, les animaux hibernants sombre dans un état d'hypothermie contrôlée qui leur permet de conserver leur énergie aux moments où il est difficile de trouver de quoi se remplir le ventre. Qu'est-ce qui distingue ces animaux hibernants*, marmottes, hérissons et certains hamsters, de ceux qui ne le sont pas ? Une équipe de chercheurs de l'université Yale (États-Unis) s'est penchée sur les cellules de plusieurs rongeurs afin de déterminer si la capacité à hiberner ne dépendrait pas de facteurs moléculaires.
Plus spécifiquement, ils ont regardé l'expression du TRPM8, un récepteur à la surface de certains neurones et dont on sait qu'il joue un rôle essentiel dans la perception du froid. Il est ainsi activé dès que la température descend en dessous d'un certain seuil. Mais il l'est également en face d'un froid “agréable“, par exemple quand on suce une pastille au menthol.
Un récepteur moins sensible au froid
Or, ce que les chercheurs ont découvert c'est que ce récepteur est moins sensible au froid chez les rongeurs qui hibernent. Alors que chez les souris, son activité augmente quand la température chute de 30 à 10°C, le TRPM8 des hibernants reste, lui, inactif. Une désensibilisation qui pourrait être considérée comme un désavantage, mais qui permet, au contraire, aux animaux qui en sont porteurs de supporter ces moments critiques où la nourriture se fait rare et qu'il vaut mieux ne pas mettre la truffe dehors et roupiller tranquille en attendant le dégel.
* Contrairement aux idées reçues, l'ours n'hiberne pas. Sa température corporelle reste stable et il peut être facilement réveillé durant l'hiver. On dit plutôt qu'il hiverne.
Pour en savoir plus :
Malan A. (2007). - Sommeil d'hiver, Pour la Science, n° 352 février 2007 56:63 http://bit.ly/plsoer352).
Salthum-Lassalle B. (2011).- Poumons au repos, Pour la Science n°404 juin 2011. p. 14.
10:31 Publié dans Mammifères | Tags : mammifères, marmotte, hibernation | Lien permanent | Commentaires (0) | ![]() Facebook | | |
Facebook | | |