28/03/2016
Un détecteur de pollution original : la Truite
 Un détecteur de pollution original : la Truite
Un détecteur de pollution original : la Truite
par Jean-Louis Huvé[1]
La truite pourra-t-elle un jour détrôner les méthodes analytiques classiques appliquées à la détection des micropolluants d'eau douce ? Posé en ces termes, le problème de la surveillance des eaux destinées à la consommation apparaît très surprenant. En effet, pourquoi et comment un vertébré aquatique serait-il capable de rivaliser sérieusement avec des techniques analytiques modernes à haut pouvoir de résolution, parfaitement adaptées au contrôle des eaux potables ?

Cliché © Ervin Matevzic
L'idée n'appartient cependant pas au domaine de la fiction car, parallèlement aux techniques de laboratoire, certaines compagnies des eaux utilisent des truites pour détecter des vagues de pollution pouvant toucher les prises d'eau (ou zones de pompage). Le test (ichtyotest) consiste à maintenir quelques truites dans une veine d'eau à courant constant. Dans ces conditions, les poissons restent orientés face au courant et maintiennent une position relativement fixe par rapport aux bords du canal étroit dans lequel ils sont placés. Il suffit alors de surveiller électroniquement le recul éventuel du ou des animaux. Ce recul peut être considéré comme le reflet d'une modification physiologique induite par un micropolluant.
Cette méthode d'analyse comportementale présente l'avantage de la simplicité sur le plan de la mise en œuvre, mais ne tire pas parti de l'ensemble des possibilités sensorielles offertes par le poisson. En effet, la réaction motrice de fuite n'est pas nécessairement associée à la détection olfactive d'un micropolluant par l'animal. Il paraît donc plus fiable d'utiliser le poisson comme "biocapteur" en prélevant les informations électriques issues des structures olfactives pour caractériser directement le micropolluant présenté au niveau des fossettes olfactives, qu'il induise ou non une réaction de fuite. L'idée est simple, mais son application l'est moins car elle nécessite une technologie avancée. Cependant, les travaux expérimentaux de ces dernières années, effectués par le laboratoire de neurophysiologie ontogénétique de l'université Pierre et Marie Curie, à Paris[2], laissent penser qu'une telle entreprise peut actuellement dépasser le stade expérimental pour devenir un instrument de routine au service des hydrologues.
La truite détecte de nombreuses molécules.
Il a été largement démontré, depuis les études réalisées au Japon par Hara, Gorbmann[3] et Ueda[4], que l'activité électrique des bulbes olfactifs (électrobulbogramme ou EBG) est profondément modifiée lorsque les fossettes olfactives de l'animal sont stimulées par des molécules naturelles comme les acides aminés. Il existe d'ailleurs une hiérarchie relativement précise dans les niveaux de détection de ces acides aminés en fonction de leur structure chimique. D'après certains auteurs, il semblerait que la stimulation de la muqueuse olfactive de l'animal qui déclenche secondairement une modification de l'EBG puisse se faire à des concentrations extrêmement faibles, de l'ordre de quelques molécules isolées.
Il s'agit là d'ailleurs de la confirmation d'un fait élémentaire que n'importe quel plongeur peut vérifier en milieu marin lorsqu'il observe la rapidité surprenante avec laquelle de nombreuses espèces de petits poissons sédentaires se précipitent sur un oursin qui vient d'être brisé. Les gradients de concentration en matières protéiques émises à cet instant sont pourtant très faibles. Une autre confirmation indirecte, aussi anecdotique que la précédente et aussi riche d'enseignement est apportée lorsque l'on constate que les poissons migrateurs, et particulièrement les saumons, ne remontent pas une échelle à poissons où l'homme s'est lavé les mains. L'eau de lavage contient en effet un acide aminé élémentaire, la L serine, qui est relargué au moment du lavage de la peau. Il intervient comme un répulsif ("repellent" en terminologie anglosaxonne) chez le poisson.
Cette sensibilité se retrouve-t-elle pour des molécules de synthèse ? Certaines d'entre elles, classiquement regroupées dans la catégorie des micropolluants par les hydrologues et les pharmacologistes, peuvent en effet se retrouver dans les eaux continentales.
Au congrès franco-suisse de Thonon sur la pollution du lac Léman (1978), notre groupe, chargé des problèmes de pollution par le mercure, avait montré que la sensibilité olfactive de l'animal à des molécules issues de synthèse industrielle, et d'une façon générale à des résidus de synthèse, est identique à la sensibilité olfactive à des molécules naturelles[5]. Pourquoi ne pas tenter alors — l'hypothèse est séduisante — d'utiliser le poisson comme instrument de contrôle de qualité de l'eau potable en tirant parti des modifications électriques des bulbes olfactifs lorsque ce poisson est soumis à certains micropolluants ?
Une truite électronique.
Pour ne pas perturber l'animal sur le plan comportemental, tout en récupérant l'activité électrique d'une partie de son cerveau (les bulbes olfactifs), un émetteur miniaturisé a été conçu. Il est capable de transmettre des niveaux électriques de 10 à 150 µV dans une bande de fréquence de 1 à 25 Hz. L'utilisation de circuits intégrés CMOS, montés en technologie hybride, a permis de résoudre le problème. Actuellement, les truites sont équipées d'émetteurs pesant 15 grammes et alimentés par une pile au lithium facilement remplaçable, dont la durée de vie est d'un mois environ. Ils travaillent en modulation de fréquence sur une fréquence centrale de 100 KHz.
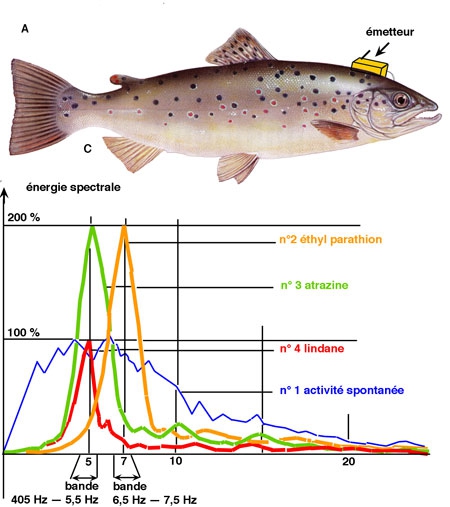
Fig. 1 : La truite peut être utilisée comme "biocapteur" des micropolluants d'eau douce en prélevant les informations électriques issues des structures olfactives de l'animal. Techniquement, le procédé est le suivant: on implante un émetteur miniaturisé relié à deux électrodes posées sur les bulbes olfactifs (A). Un décodage permet de restituer l'activité électrique des bulbes (B) ((voir fig. 2). L'électrobulbogramme ainsi recueilli est soumis à une analyse spectrale (C).
En l'absence de toute stimulation, l'énergie spectrale se répartit selon un spectre d'activité spontanée, caractérisé par une prédominance énergétique dans la zone 2 Hz - 10 Hz (courbe n° 1). L'adjonction de différents polluants dans le milieu où vit l'animal conduit à une perturbation profonde du spectre spontané, à la fois dans son amplitude et sa fréquence (courbe n° 2 : un insecticide, l'éthyl parathion ; courbe n° 4 : un insecticide, le lindane ; courbe n° 3 : un désherbant l'atrazine).
Techniquement, le processus d'implantation peut se résumer de la façon suivante : la truite, qui pèse entre 200 et 400 g, est anesthésiée puis immobilisée dans un stand d'opération où les conditions d'oxygénation et de température sont rigoureusement contrôlées. Une surveillance cardiaque et respiratoire est assurée pendant toute la durée de l'intervention, soit deux à trois heures. Au cours de cette intervention, une ouverture de quelques millimètres carrés est pratiquée dans le crâne du poisson. Par cette ouverture, sont introduites deux électrodes de platine iridié d'un diamètre nominal de 75 µm. Ces électrodes sont posées sur les bulbes olfactifs, puis raccordées à l'émetteur qui est lui-même rendu solidaire du crâne du poisson. À partir de cet instant, l'animal est placé dans un aquarium équipé pour recueillir l'émission. Un décodage utilise le principe des boucles en phases asservies (P.L.L.) permet de restituer l'activité électrique basse fréquence des bulbes olfactifs de l'animal. L'électrobulbogramme ainsi recueilli est soumis à une analyse spectrale par transformée de Fourrier rapide (FFT) dans une bande de 0 à 25 Htz.
Une répartition différente de l'énergie spectrale.
L'étude comparative des diffétents spectres d'énergie, traités par F.F.T obtenus pour différentes molécules d'origine naturelle ou artificielle, montre que des variations importantes de la répartition de l'énergie électrique en fonction des séquences d'émission de l'électrobulbogramme. On assiste ainsi à une redistribution de l'énergie globale de l'EBG qui semble caractéristique de la nature du produit et de sa concentration.
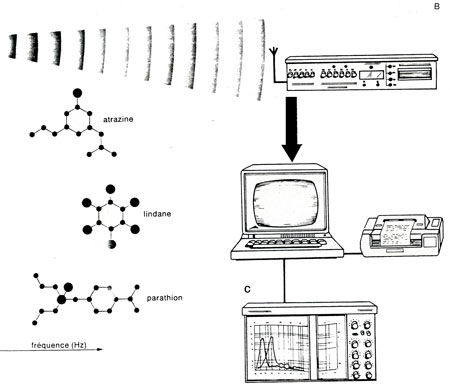
Fig. 2. : L'émetteur miniaturisé est relié à deux électrodes posées sur les bulbes olfactifs (A). Un décodage permet de restituer l'activité électrique des bulbes (B).
Au stade actuel du développement de la la méthode, un certain nombre d'acides aminés ont été testés. Deux d'entre eux, la L serine et la cystéine, servent d'ailleurs d'éléments étalon permettant de vérififier le bon fonctionnement de l'ensemble de la chaîne de mesure. En ce qui concerne les micropolluants, les résultats que nous avons obtenus portent essentiellement sur un désherbant du groupe des triazines (atrazine) et sur deux insecticides (un organochloré, le lindane, et un organophosphoré, l'éthyl parathion). Le choix de ces produits se justifie par le fait qu'ils sont utilisés en grande quantité en agriculture comme pesticides et deviennent finalement des micropolluants des eaux de ruissellement. Qualitativement, les résultats peuvent se résumer par les constatations suivantes. En l'absence de toute stimulation, l'énergie spectrale fournie par l'EBG se répartit selon un spectre d'activité spontanée. On relève une prédominance énergétique dans la zone 2 Hz — 10 Hz. L'adjontion d'éthyl parathion dans le milieu où vit l'animal conduit à une perturbation profonde du spectre spontané. Un pic énergétique centré sur la zone 6,5-7 apparaît. Son amplitude relative est en moyenne de 150 à 200 % par rapport à l'énergie spectrale spontanée considérée comme valeur 100%. La stimulation de l'animal par l'atrazine induit par contre un pic énergétique dans la zone 4,5-5, dont l'amplitude relative se situe aussi aux environs de 150 à 200 %. Enfin, le lindane se distingue par un pic centré sur la zone 4,5-5,5 Hz, mais dont l'amplitude est toujours plus faible que celle du pic énergétique déclenché par l'éthyl parathion (voir figure 1).
Ces résultats, qui en réalité sont semblables à quelques autres procédés d'analyse statistique non rapportés ici pour alléger l'exposé du principe général de la méthode permettent de caractériser un certain nombre de produits. Il est souhaitable bien évidemment de compléter ce type d'étude par d'autres investigations, afin de diversifier le nombre de familles chimiques pouvant être reconnues par le poisson.
Trouver un gramme dans 100 000 m3 d'eau en moins d'une demi-seconde.
C'est en ces termes que l'on peut caractériser les réactions sensorielles de la truite. En effet, non seulement l'animal peut détecter un produit à un tel niveau de dilution (10 ng/l), mais, en plus, ses réponses électrophysiologiques apparaissent 500 ms après le début de la stimulation.
Une telle acuité olfactive n'a rien de surprenant lorsque l'on sait qu'en 1957, Teichmann, un chercheur allemand[6] montra que l'anguille détecte 1 ml d'un dérivé aromatique dilué dans 58 fois le volume du lac de Constance ! Sur le plan quantitatif, les molécules qui ont été testées, selon la méthode exposée plus haut sont détectées de façon reproductible jusqu'à 10 ng/litre.
On constate d'ailleurs, au cours des essais de reconnaissance, un apprentissage de l'animal dont les performances s'améliorent très rapidement en quelques heures. Parallèlement, un phénomène de mémorisation à long terme semble apparaître. C'est ainsi qu'une molécule organo-minérale comme le rnéthyl-mercure, devenu célèbre après l'accident de Minamata au Japon[7], est reconnue par l'animal à des concentrations de 10 à 15 ng/litre plusieurs mois après lui avoir été présentée. Ce processus de mémorisation à long terme, qui a fait l'objet d'études importantes, notamment par Gleitman et Rozin[8], présente un intérêt non négligeable dans la mesure où il peut être utilisé pour conditionner olfactivement l'animal à certaines familles chimiques de natures très diverses.
La truite système d'alarme.
En fonction de ce qui vient d'être exposé, on peut raisonnablement envisager d'utiliser la truite comme biodétecteur à haute résolution. D'une part, la sensibilité en valeur absolue de ce poisson paraît être très proche de celle que l'on obtient par des méthodes analytiques classiques.
II est important, à ce sujet, de noter que les valeurs de concentration avancées dans cet exposé ont été vérifiées systématiquement par chromatographie en phase gazeuse, par l'Institut d'hydrologie et de climatologie (laboratoire de chimie analytique) de l'université Pierre et Marie Curie.
D'autre part, la truite fonctionne en temps réel. Comparativement aux méthodes analytiques classiques d'échantillonnage, cet avantage non négligeable conduit à une détection précoce d'un éventuel micropolluant. Enfin, l'ensemble de l'infrastructure électronique, d'une mise en œuvre facile, est transportable sur le terrain.
Dans certains cas, ceci représente un aspect intéressant de la méthode qui est alors sans commune mesure avec les contingences imposées par un laboratoire d'analyses.
En savoir plus :
[1] J.-L. Huvé (1982). — Un détecteur de pollution original - la truite, La Recherche, n° 129, vol. 13, 108-110.
[2] F. Borie, N. Chantrier, J.-L. Huvé, M.A. Thomson (1981). — C.R. Acad. Sc. Paris, 292, 235.
[3] T.J. Hara et A. Gorbmann, (1967). — Comp. Biochem Physiol., 21, 185.
T.J. Hara (1973). — Comp. Biochem. Physiol.. 44A, 407.
T.J. Hara, Y.M.C. Law et B.R. Hobden (1973). — Comp. Biochem. Physiol., 45A, 969.
[4] K. Ueda, T.J. Hara et A. Gorbmann (1967). — Comp. Biochem. Physiol., 21, 133.
[5] Congrès franco-suisse de Thonon, (1978), G.E.P.P.E. (Groupe d'études pluridisciplinaires sur la pollution des eaux, Université Pierre et Marie Curie).
[6] H. Teichmann (1957). — Naturwissenschaften, 44, 242.
[7] A. Katz. (1972). — CRC, 2 (4), 517.
[8] H. Gleitman et P. Rozin (1971). — Leaming and memory. in Fish physiology, vol. VI, W.S. Hoar and D.J. Randall (eds.). Académie Press.
18:44 Publié dans Poissons, Pollution | Tags : truite, détecteur de pollution, poissons, pollution | Lien permanent | Commentaires (1) | ![]() Facebook | | |
Facebook | | |


