CRISPR-Cas9, la technique d'édition génétique appliquée aux végétaux
18/07/2017
CRISPR-Cas9, la technique d'édition génétique appliquée aux végétaux
Les plantes sont devenues l'une des cibles préférées de CRISPR, cette technique d'édition génétique bien plus puissante et précise — et surtout beaucoup moins onéreuse — que les outils de transgenèse classique (voir dans ce même blog : CRISPR-Cas9, une technique d'édition génétique : découverte scientifique de l'année 2015).
La recherche s'est d'abord concentrée sur les végétaux qu'elle connaît et étudie depuis des décennies en particulier les céréales blé, maïs, riz. En fait, tous ceux qui présentent un intérêt agronomique ont déjà fait l'objet de manipulations génétiques et ont donné des OGM.
Dès 2014, une équipe chinoise démontre à quel point il est facile et rapide de développer un riz édité par CRISPR. Mi-2016, c'est au tour de la firme américaine Pioneer d'annoncer la production d'un maïs censé être plus résistant. Il y a quatre mois, en décembre 2016, une équipe du Cold Spring Harbor Laboratory (États-Unis) décrit dans un article des plants de tomates « crispérisés » qui fleurissent et donnent des fruits deux semaines plus tôt que les variétés actuelles.
Autre axe de recherche : sauver des plantes au bord de l'extinction. L'exemple phare est la banane, dont une seule variété originaire d'Asie, connue comme le « sous-groupe Cavendish », est disponible à la consommation. Problème : alors qu'elles représentent l'essentiel des bananes commercialisées mondialement, les cultures Cavendish sont attaquées par un champignon microscopique de l'espèce Fusarium oxysporum vivant dans le sol. Des chercheurs sud-coréens dirigés par Jae-YoungYun envisagent une parade grâce à CRISPR : inactiver chez la banane le gène du récepteur moléculaire auquel s'arrime le champignon et ainsi empêcher ce dernier de nuire.
La sauce soja et le vin pourraient aussi bénéficier indirectement de CRISPR. Dans ce cas, les chercheurs ne viseraient pas la plante mais la bactérie impliquée dans le processus de fermentation, avec pour objectif de la rendre résistante aux virus qui l'attaquent. Mieux, la recherche pourrait réussir à se concentrer sur des végétaux qu'elle a délaissés jusqu'ici. Pour Sébastien Cunnac, de l'IRD) (Institut de recherche pour le développement) de Montpellier, « l'outil est tellement puissant, facile et rapide comparé aux méthodes classiques qu'il autorise à travailler sur des végétaux non modèles car il élargit considérablement la palette d'outils de génétique ».
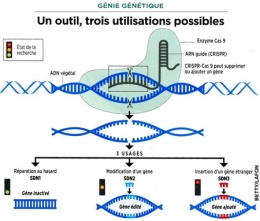
Pour le moment, rien ne distingue la « crispérisation » des plantes de ce que la nature pratique déjà par elle-même : une mutation ponctuelle, comme il s'en produit en permanence chez les végétaux tant sauvages que cultivés. Ce que les scientifiques maîtrisent bien, en effet, c'est la mutation ciblée d'une seule base sur l'ADN du végétal, opération dénommée SDN 1 (Site Directed Nuclease 1, qu'on pourrait traduire par technique d'édition des génomes 1.
Sébastien Cunnac précise ainsi qu' « en l'état actuel, il semble excessif de qualifier ces constructions d'OGM puisque le type de mutations engendrées est analogue à ce qui apparaît dans la nature ». CRISPR dans sa version SDN1 ne fait pas autre chose. Comme le résume Christophe Perin, du Cirad de Montpellier, tout dépend de ce qu'on décide de prendre en considération : « II existe deux positions pour simplifier. Soit on se focalise sur les produits et dans ce cas, l'autorisation doit être attribuée au cas par cas en fonction du gène modifié. Soit on se concentre sur la méthode pour décider que tout ce qui a été obtenu de manière non naturelle est un OGM. Mais c'est une décision sociétale, pas scientifique. »
Ainsi, CRISPR permet de faire trois types d'intervention sur le gène : son inactivation (SDN1) ; sa modification (SDN2) ; l'introduction d'un gène provenant d'un autre organisme (SDN3). Seule cette dernière opération, non maîtrisée actuellement, donnerait un organisme modifié similaire aux OGM « classiques ».
Tout dépend de quoi on parle. CRISPR n'est qu'un outil, et trois utilisations sont possibles (voir l'infographie ci-dessus). Soit une modification qui n'inclut pas l'ajout d'un gène étranger : SDN1 et SDN2. Soit une mutation plus radicale, SDN3, absolument pas maîtrisée pour le moment.
Mais il faut rester prudent, même si SDN1 et dans une moindre mesure SDN2 apparaissent bien contrôlés à l'heure actuelle, des problèmes subsistent.
Yves Bertheau (Inra, Muséum national d'histoire naturelle) en voit trois. Tout d'abord, les effets si indésirables sur la régulation du génome (ce que l'on nomme l'épigénétique). Ensuite, les effets dits hors cible que CRISPR pourrait provoquer en dehors du site visé. « Des modifications que l'on ne sait ni correctement prédire, ni détecter ni éliminer. » Enfin, le fait que pour introduire CRISPR dans les cellules, on utilise des méthodes de transgenèse vieillottes de 30 ans d'âge. Il estime que ces problèmes ne sont pas suffisamment pris en compte. Selon le chercheur, avec ces nouveaux organismes, « on se retrouve dans la même économie de promesses qu'avec les OGM ou le clonage voilà vingt ans. » Beaucoup d'annonces mirobolantes, peu d'accomplissements véritablement nouveaux.
Source : Hervé Ratel, Sciences et Avenir, n° 842 – Avril 2017 : 68-70.)


Les commentaires sont fermés.