Coraux des Antilles (9)
16/07/2010
Biocénoses récifales remarquables de la Province caraïbe. Compétition, prédation, stratégies de défense, associations : commensalisme, symbiose.
 Coraux et milieu récifal de la Province Caraïbe
Coraux et milieu récifal de la Province Caraïbe
Chapitre IX : Biocénoses récifales remarquables
par André Guyard
(suite du chapitre VIII : croissance du récif corallien)
Sans méconnaître l'importance de la bioérosion du squelette corallien par les organismes perforants et taraudants, nous ne considérerons ici que les interactions entre les animaux peuplant le récif et le Corail vivant. Nous verrons tout d'abord comment rivalisent les Coraux dans l'occupation du support puis nous décrirons les animaux qui contractent des rapports directs avec le Corail et enfin, nous observerons les animaux qui profitent de l'habitat constitué par le récif corallien.
1. Compétition entre espèces coralliennes
Les Coraux croissant très près les uns des autres entrent en compétition territoriale. Différentes stratégies sont employées pour l'acquisition de l'espace et pour accéder au substrat environnant.
1.1. Agressivité extra-cœlentérique
Certaines espèces de Coraux sont capables d'extruder leurs filaments mésentériens pour attaquer les polypes des colonies voisines. C'est le cas d'espèces appartenant aux familles des Mussidae, Meandrinidae et Faviidae. D'après ce comportement, Lang (1970) décrit une véritable hiérarchie dans l'agressivité. Pour cet auteur, les espèces se classent selon l'ordre décroissant suivant : Mussa angulosa = Scolymia lacera > Isophyllia sinuosa = Meandrina meandrites > Mycetophyllia sp > Scolymia cubensis = Isophyllastrea rigida > Montastrea annularis > Faviidae > Acroporidae > Agaricia spp. = Helioseris cucullata > autres Fungidae > Astrocoeniidae.
Ces interactions compétitives se traduisent pour les stades jeunes par une exclusion des consommateurs subordonnés, phénomène bien visible au niveau de la zone externe du platier récifal au vent (- 10 cm à - 1 m) et aux différents niveaux de la zone prérécifale là où les conditions de milieu sont plus rudes.
1.2. Morphogenèse de la colonie
Les formes ramifiées et foliacées montrent une croissance linéaire plus rapide et tendent à occuper l'espace plus rapidement que les formes massives. Mais l'exemple de M. annularis, forme massive par excellence, montre que cette espèce, malgré une capacité extra-cœlentérique moyenne, est capable de supplanter des espèces ramifiées ou foliacées à croissance plus rapide mais moins belliqueuses. C'est ce qui explique la présence de cette espèce dans la zone prérécifale entre - 5 et - 35 m et même jusqu'au delà de - 40 m dans les récifs de profondeur.
2. Compétition entre Coraux et autres organismes fixés
La présence de certaines Algues de grande taille, d'Éponges, d'Octocoralliaires ou de Zoanthaires semble gêner la croissance du Corail, ceci en l'absence de tout dommage détectable pour le Corail. En voici quelques exemples.
Les Algues Halimeda opuntia, Caulerpa racemosa var. macrophysa, Peyssonnelia rubra recouvrent souvent de larges zones habitées par Porites furcata. L'Algue brune, Lobophora variegata prolifère souvent sur des aires dépassant 20 m2 surmontant Agaricia sp. et d'autres Coraux sur une épaisseur de 20 à 30 cm.
Chondrilla nucula, une Éponge encroûtante peut largement recouvrir Porites furcata et même des colonies entières de Siderastrea siderea et de Diploria clivosa. Porites est souvent envahi par la base à partir des branches mortes du polypier par des Coraux massifs qui utilisent ce substrat et également par l'Octocoralliaire Briareum asbestinum. Il existe d'ailleurs une grande variété d'interactions entre Coraux et Gorgones. Les Gorgones peuvent modifier le taux de croissance des Coraux mais elles peuvent présenter des aires dépourvues de polypes au contact des Coraux.
Dans le talus prérécifal, l'Éponge Adociidae Siphonodictyon peut creuser directement dans les Coraux vivants et attaquer ainsi Stephanocoenia michelinii, Siderastrea siderea, Porites astreoides, Diploria strigosa et Montastrea annularis. Le Corail mou Palythoa (Zoanthaire) est fréquent dans les zones peu profondes, recouvrant souvent et éliminant Siderastrea siderea et Diploria clivosa.
Ainsi, dans le récif corallien, les organismes fixés se livrent un combat pour la conquête du substrat. Les caractères favorables pour cette compétition sont une grande taille, une longévité importante, un faible turn-over. Finalement, cette compétition aboutit à un équilibre fragile, perpétuellement remis en cause.
3. Prédateurs de Coraux
Non seulement les Coraux doivent lutter pour conquérir leur support mais ils sont également soumis à la prédation de Poissons et d'Invertébrés.
3.1. Poissons
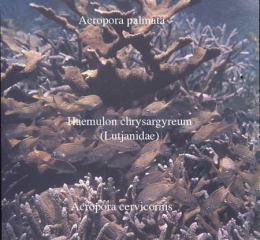
De la famille des Scaridae, les Poissons-perroquets ont les dents fusionnées en une espèce de bec qui leur permet de broyer les Coraux qu'ils ingurgitent souvent avec des Algues. De même, les Demoiselles (Pomacentridae) se nourrissent également de Coraux comme Oculina diffusa, Siderastrea siderea, Montastrea annularis, Acropora palmata, A. cervicornis, Agaricia agaricites et Porites furcata. La Demoiselle à queue jaune (Microspathodon chrysurus) s'attaque même au Corail de feu Millepora. Souvent on peut voir des bancs mixtes de Scarus croicensis (Perroquet rayé), d'Acanthurus chirurgicus (Chirurgien) et de Chaetodon capistratus (Papillon à 4 yeux) déguster ensemble Acropora cervicornis dans les eaux du lagon.
Il est sûr que la présence de nématocystes dans l'ectoderme des Coraux doit décourager la plupart des prédateurs. Cependant le fait que certains Poissons soient capables de se nourrir de Coraux montre que ces espèces sont immunisées contre le venin.
3.2. Invertébrés
Différents prédateurs de Coraux ont été décrits dans la Caraïbe. Hermodice caruncullata est un Polychète Amphinomidae qui se nourrit aux dépens de Porites porites, P. astreoides et Acropora palmata. La Cigale de mer Mithrax sculptus (Crustacé Décapode Majidae) est trouvée sur P. porites et P. furcata. L'Oursin noir Diadema antillarum attaque Montastrea spp. et Acropora palmata. Parmi les Mollusques Gastéropodes, un certain nombre d'espèces forent le squelette mort des colonies coralliennes. D'autres sont prédatrices du Corail vivant. C'est le cas de Coralliophila abbreviata et de C. caribea qui se nourrissent aux dépens de Montastrea annularis, Acropora palmata, Diploria clivosa et Favia fragum et de Calliostoma javanicum qui attaque Mussa angulosa et Agaricia spp.
Les dommages causés par ces prédateurs sont minimes et sont réparables en deux ou trois mois. Mais les aires atteintes peuvent êtres colonisées par des Algues filamenteuses qui permettent aux Éponges perforantes de s'installer et d'entamer la destruction du récif.
4. Animaux résidant dans le récif
Le récif corallien parcouru par un réseau complexe de cavités multiples constitue un excellent refuge pour des résidents permanents ou temporaires, consommateurs primaires ou secondaires des organismes du récif ou du lagon. Dans la limite de cet exposé, il n'est pas question de passer en revue tous les groupes animaux concernés. En remontant la chaîne alimentaire, nous examinerons successivement le plancton associé au récif, les animaux planctonophages, les Invertébrés prédateurs puis les Poissons herbivores et carnivores.
4.1. Communautés planctoniques associées au récif corallien
L'importance du plancton dans le milieu océanique n'est plus à démontrer. Le plancton est constitué par l'ensemble des organismes vivants dont les capacités natatoires sont insuffisantes pour lutter contre les mouvements des eaux : vagues, courants. Il s'agit de végétaux ou d'animaux pour la plupart microscopiques. Dans le milieu océanique, la fraction végétale ou phytoplancton représente le maillon des producteurs. Ces organismes, grâce à la lumière, au CO2 et aux sels minéraux dissous, fabriquent de la matière organique utilisable par la fraction animale ou zooplancton. Le plancton dans sa totalité servira de nourriture à des consommateurs secondaires.
Bien qu'il n'y ait pas de pause hivernale dans les eaux intertropicales, la production primaire (moyenne annuelle : 200 mg C.m-2j-1) y est plus faible qu'en zone tempérée (moyenne annuelle : 250 mg C.m-2j-1).
Sur le récif, bien que Algues benthiques, herbes marines, Coraux et plancton contribuent à la production récifale de carbone organique, le rendement est encore plus réduit : 6-25 mg C.m-2j-1. Dans les communautés à Porites ou à Thalassia, la respiration (émission de CO2) l'emporte sur la photosynthèse (fixation de C) et le bilan énergétique est négatif, respectivement de - 1,4 et - 3 mg C.m-2j-1.
Le plancton vivant dans la zone récifale provient du large. De sorte que la quantité de plancton du lagon est largement inférieure à celle du large. On a calculé que 91 % des Diatomées et 60 % du zooplancton franchissant le récif étaient consommés. Ainsi le plancton participe pour 0,075-0,290 mg C.m-2j-1 de gain pour le récif. Il faut souligner l'importance dans la communauté récifale de la population de suspensions feeders[1]. Si l'on excepte les Coraux qui sont eux-mêmes planctonophages, la quantité de mangeurs de plancton est de l'ordre de 38 930 individus.m-2, soit 12,8 mg.m-2.
Les Poissons de récif planctonophages comme le Cardinal (Apogon conklini) dévorent une moyenne de 102 larves zoés par heure. Ainsi, il est clair que le plancton représente un apport d'énergie non négligeable pour l'écosystème corallien. Dans ces conditions, les variations saisonnières du plancton auront un retentissement sur les variations du peuplement récifal, d'abord planctonophage puis détritivore et prédateur. Ainsi, les stades planctoniques atteignent leur abondance maximale au printemps puis à la fin de l'été. Les stades larvaires de Polychètes, Ascidies et Mésogastropodes subissent un déclin de mars à juin. Tectibranches, Mésogastropodes, Ophiures et Oursins sont plus abondants par périodes entre août et septembre. Bien que la plupart des groupes du zooplancton ont des durées de vie longues et fournissent des stades larvaires avancés dans leur développement, apanage des espèces constituant les écosystèmes matures, il existe dans le plancton de très nombreuses espèces avec des caractéristiques biologiques très variées. 3000 individus.m-2, ayant un turn-over[2] élevé représentent 7,2 % du stock total. Ainsi, de nombreux Polychètes, Crustacés et Mollusques atteignent la maturité sexuelle en 30 jours. Ces espèces produisent des pontes importantes toute l'année avec des stades méroplanctoniques de longue durée qui sont adaptés à une dispersion à grande distance.
[1]Animaux filtreurs se nourrissant de particules en suspension
[2] Taux de renouvellement de la matière vivante
En résumé, les variations saisonnières d'abondance du peuplement total sont en corrélation avec les variations d'abondance du peuplement phytoplanctonique. Or les maxima de phytoplancton correspondent aux périodes de forte pluviosité sous les Tropiques et notamment dans les Caraïbes. Le zooplancton se nourrissant de phytoplancton, l'abondance du zooplancton est en relation directe avec celle du phytoplancton dans les mers tropicales.
4.2. Microphages du récif
Outre les Coraux, de nombreuses espèces animales consomment du plancton ou les microorganismes du sédiment. Ce sont en général des espèces fixées ou peu mobiles. Pour se nourrir, elles filtrent l'eau ou le sédiment.
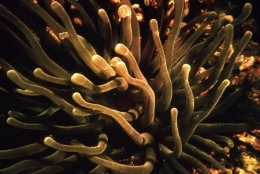
C'est le cas des Anémones de mer dont le mode de nutrition est identique à celui des Coraux. Selon sa taille, l'Actinie capture du plancton, des Invertébrés ou même de petits Poissons. Bien que fixée au substrat par sa base, elle est capable de se déplacer si le lieu ne lui convient plus.
Les Comatules qui sont des Crinoïdes, collectent également le plancton. À l'aide de leurs longs bras garnis de cils mobiles travaillant comme un filet, elles attrapent le plancton apporté par le courant.
D'autres Échinodermes, les Holothuries ou Concombres de mer rampent sur le sol grâce à leurs pieds ambulacraires. Les Holothuries sont nombreuses sur le fond du lagon dont elles labourent le sol à la recherche de la microfaune interstitielle et des débris organiques. D'autres utilisent leurs tentacules visqueux comme un filet à plancton pour capturer les petits organismes.
4.3. Invertébrés prédateurs du récif
Parmi les Invertébrés du récif, beaucoup sont d'habiles chasseurs à l'affût.
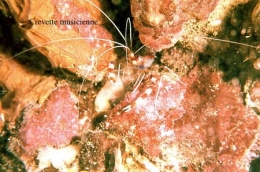
C'est le cas de la Crevette musicienne (Pontonia) qui, embusquée dans les crevasses, laisse seulement dépasser ses antennes. L'une de ses pinces est très forte et l'extrémité en est modifiée de telle sorte que la branche mobile vient frapper la partie fixe en faisant entendre un claquement caractéristique. Si un petit poisson s'approche, la Crevette surgit, ajuste sa victime et presse sur la "détente". Le choc étourdit la proie qui est aussitôt capturée.
Certains coquillages comme les Coralliophages se nourrissent directement du Corail en broûtant les colonies.
Des Gastéropodes Coralliophages s'attaquent à une colonie de Siderastrea
Parmi les coquillages, les Casques dévorent les Oursins, les Tritons se nourrissent de Bivalves et d'Étoiles de mer. Certains Cônes sont venimeux et capturent leurs victimes après les avoir paralysées avec leur dard. Les Nudibranches ou Limaces de mer portent des expansions dorsales chatoyantes qui jouent un rôle de branchies. Ces Gastéropodes Opisthobranches, dépourvus de coquille se déplacent en rampant sur une large sole pédieuse comme des Limaces. Certains sont capables de nager en utilisant les ondulations de leur manteau. Ils se nourrissent d'Hydraires ou d'Anémones de mer. Les nématocystes ingérés ne se déchargent pas, traversent la paroi intestinale et gagnent le tégument du Nudibranche, lui assurant une protection contre les prédateurs.
La Pieuvre mange des Poissons, des coquillages et des Crustacés qu'elle capture avec ses huit bras garnis d'une double rangée de ventouses après une approche discrète de sa proie suivie d'une attaque foudroyante. Son bec puissant défonce la carapace des Crustacés. La Pieuvre chasse la nuit et se réfugie le jour dans une anfractuosité. Elle se défend contre les grands prédateurs, en particulier la Murène en émettant un nuage d'encre qui déconcerte l'assaillant.
4.4. Poissons herbivores
Bien que les barrières au vent soient pourvues de larges zones à Sargasses, le récif corallien n'est jamais doté des grandes masses algales que l'on peut observer à marée basse dans les zones tempérées. Pourtant l'activité photosynthétique des récifs coralliens dérive de végétaux verts plus discrets, notamment :
- d'une faible quantité d'Algues filamenteuses ;
- d'une flore endolithique ;
- d'Algues calcaires encroûtantes ;
- de Dinoflagellés symbiotiques (Zooxanthelles) ;
- de chloroplastes libres dans les tissus de certaines espèces animales.
Dans ces conditions, on pourrait penser qu'une flore de ce type ne permette pas une profusion de Poissons herbivores. En fait, les populations de Poissons récifaux sont significativement plus abondantes que les populations ichtyologiques d'aires tempérées. Randall (1963) estime à 0,039 kg.m-2 la biomasse de Poissons sur les récifs des Iles Vierges. Au Panama, on a recensé une population de Perroquets striés (Scarus croicensis) de 3500 individus se nourrissant sur 5300 m2 et déféquant un poids sec de 2,41 kg.m-2.an-1.
L'action des Poissons herbivores se traduit par des zones broûtées ou décapées. Les herbiers au voisinage des pinacles montrent toujours une bande de sable dénudé conséquence de l'activité des Poissons phytophages. D'autre part, les régions protégées de l'activité des Poissons herbivores, comme par exemple les branches basales non vivantes des Coraux ramifiés (Porites spp., Acropora cervicornis, Eusmilia fastigiata…) abritent toujours des populations abondantes de Bivalves, Cirripèdes, Bryozoaires et même de jeunes Coraux. Ces observations ainsi que l'examen des contenus stomacaux montrent que les Poissons récifaux dits herbivores sont en réalité omnivores et qu'ils broûtent les herbiers aux alentours en supplément à la nourriture animale qu'ils trouvent sur le récif.
La majorité des auteurs estiment que les Poissons phytophages se localisent à l'étage 0-10 m de profondeur. La couverture végétale étant constamment remaniée par les Poissons, cette activité doit affecter profondément la survie et la croissance des populations benthiques récifales de faible profondeur. Goreau (1967) pense que la grande abondance des groupes d'animaux charnus et de leur tendance à atteindre de grandes dimensions dans les zones récifales plus profondes, traduit une influence décroissante des Poissons phytophages avec la profondeur.
4.5. Poissons carnivores
Au large du récif se rencontrent les grands prédateurs diurnes. Barracudas, Tazars, Thons et mêmes Requins patrouillent constamment. Ils s'introduisent dans le lagon en profitant des passes. Là ils retrouvent d'autres prédateurs comme les Pastenagues (Raies à aiguillon), les Aigles de mer (ou Mourines) et les Torpilles. Ces dernières portent latéralement à la face ventrale, une paire d'organes électriques qui provoquent une décharge qui décourage un éventuel agresseur.
Dans les anfractuosités se nichent les Murènes qui se nourrissent de tous les Poissons en difficulté et chassent la nuit. En revanche, les Mérous (Serranidae) (fig. 56) et les Sorbes (Lutjanidae) sont des espèces diurnes qui se cachent dans le récif pour la nuit.
4.6. Stratégies de défense contre les prédateurs
Les Poissons du récif, soumis à l'attaque des grands prédateurs, possèdent des moyens de défense destinés à dissuader leurs agresseurs.
Le Savon (Grammistidae) enduit de mucus abondant et visqueux est immangeable. Le Poisson-Perroquet dort dans un cocon de mucus. Un certain nombre de Poissons sont toxiques. Le Poisson-Coffre (Ostracionidae) vit dans une véritable carapace osseuse. Le Baliste est revêtu d'un tégument coriace. Sa première épine dorsale est mobile et l'articulation en est verrouillable en position relevée. Alerté, le Baliste s'enfonce la tête dans une fissure et bloque son épine en position haute. Rien ne peut le déloger. Le Poisson-Chirurgien (Acanthuridae) possède une lancette de chaque côté du pédoncule caudal. Il la brandit à la moindre menace. Le Poisson armé (Diodon) porte sur le corps des épines normalement repliées vers l'arrière. En alerte, il gonfle son abdomen d'eau et se dilate de façon considérable. Les épines redressées donnent alors à l'animal l'aspect formidable d'une sphère hérissée de piquants peu engageants.
L'art du camouflage est poussé à l'extrême dans certaines espèces. Le Poisson-Trompette (Aulostoma) se dissimule en position verticale parmi les Gorgones et se balance au même rythme qu'elles. Le même procédé est utilisé par les Poissons-Rasoirs pour se cacher parmi les piquants des Oursins Diadèmes.
Les Demoiselles (Pomacentridae) ne s'aventurent jamais loin du Corail branchu et à la moindre alerte viennent s'y réfugier avec un ensemble parfait. L'Opistognathe à front doré creuse un terrier de 30 cm dans le sédiment sableux et le borde de petits cailloux. En cas de danger, il se réfugie dans sa forteresse.
Pour tous les Poissons vivant en eau claire, la couleur joue un rôle considérable. Le camouflage coloré est utilisé aussi bien par le prédateur que par la proie pour l'attaque ou pour la défense.
Les Poissons de pleine eau, vus de dessous, ont un ventre gris argenté qui se confond avec la lumière brillante de la surface. Le gris-vert de leur dos s'harmonise avec la couleur de l'eau. C'est le cas des Barracudas, des Thons et des Tazars.
En revanche, les Poissons de récifs sont vivement colorés. Mais ces teintes violentes, projetées sur le fond multicolore du récif, servent à les dissimuler. En outre, ils adoptent des formes et des dessins qui accentuent le camouflage. Taches, bandes, faux-yeux, ne sont pas rares chez les Demoiselles, Papillons, Blennies et Gobies.
De nombreux Poissons se camouflent en changeant de couleur. Les chromatophores de leur épiderme sont des cellules qui contiennent des pigments noirs ou jaunes et qui sont contrôlés par un réseau nerveux fin et complexe. Les chromatophores se dilatent ou se contractent afin que la couleur apparaisse ou disparaisse. Le Mérou caraïbe (Epinephelus striatus) est particulièrement habile dans l'art de changer d'apparence. S'il passe d'un endroit clair à un endroit sombre, sa couleur s'harmonise aussitôt avec celle du milieu ambiant. Cette capacité d'homochromie est partagée par de nombreuses Vieilles (Labridae) du récif et se rencontre également chez les prédateurs comme les Poissons-Lézards (Synodontidae) qui, à l'affût sur les fonds sableux adoptent la couleur du substrat (fig. 57). Il en est de même pour la Rascasse (Scorpaenidae) qui s'applique sur le fond et prend l'apparence des Algues incrustées sur les rochers. Malheur à celui qui la touche : ses rayons dorsaux épineux contiennent un venin très douloureux qui peut être fatal. Les Poissons plats du fond du lagon adoptent également cette tactique pour surprendre leur proie.
Souvent des Poissons à la chair immangeable revêtent une livrée flamboyante et sont, par là-même, soigneusement évités par les prédateurs. C'est le cas de nombreux Balistes dont la chair a mauvais goût et qui sont parmi les Poissons les plus agressivement colorés.
5. Animaux associés aux Coraux
L'un des aspects les plus fascinants de la biocénose corallienne est l'extraordinaire variété des associations qu'on y rencontre, que ce soit entre espèces animales ou entre espèces animales et végétales.
Dans le mutualisme, les deux organismes sont interdépendants et ne peuvent pas vivre l'un sans l'autre. Le mutualisme poussé à l'échelon cellulaire est la symbiose. Toutes ces associations sont bénéfiques ou neutres pour l'un et/ou l'autre partenaire.
Le commensalisme est une association qui peut être bénéfique à l'un des partenaires ou aux deux mais sans être essentielle pour la survie de chaque espèce.
En revanche, dans le parasitisme, l'un des deux organismes (le parasite) se développe au détriment de l'autre (l'hôte). La relation est positive pour le parasite mais négative pour l'hôte.
Il n'est pas toujours aisé de déterminer le type d'association qui régit telle ou telle relation. Nous observerons tout d'abord les associations dans lesquelles sont impliqués les Coraux puis nous examinerons les autres types d'association entre les autres résidents du récif.
5.1. Association polypes coralliens-Zooxanthelles
L'association polype-Zooxanthelles est un type d'association mutualiste à l'échelon cellulaire (symbiose) puisque ces organismes vivent ensemble et que les bénéfices sont partagés. Ainsi, nous avons vu que les Zooxanthelles produisent par photosynthèse des composés organiques pouvant constituer jusqu'à 60 % de la nourriture des polypes et qu'elles favorisent la production de carbonate de calcium du squelette corallien. En retour, les Coraux fournissent aux Zooxanthelles un habitat et des nutriments indispensables à leur croissance comme l'azote et le phosphore qui sont rares dans les eaux de surface tropicales. Chaque espèce de Corail héberge des souches bien particulières de Zooxanthelles. Bien qu'en laboratoire, les deux types d'organismes peuvent vivre séparément, dans la nature, la perte des Zooxanthelles équivaut à la mort du Corail. Comme d'autres organismes tels les Éponges, les Crinoïdes et les Anémones de mer qui hébergent également des Algues symbiotiques, les Coraux régulent leurs populations de Zooxanthelles et expulsent normalement les individus vieillissant (environ 0,1 %). Cependant lors d'un stress comme un réchauffement de l'eau de mer, les Coraux perdent une proportion anormalement élevée de leurs Zooxanthelles en même temps que certaines de leurs propres cellules. Le mécanisme pourrait provenir d'une émission par les Algues endommagées par le réchauffement du radical superoxyde qui serait toxique pour les tissus coralliens. Or depuis le début des années 80, on assiste à des décolorations massives de Coraux dans la Caraïbe (Brown & Ogden, 1993) mais également en Polynésie (Rougerie et al, 1992). Ce phénomène serait lié à des perturbations atmosphériques et océaniques appelées El Niño Oscillations Australes (ENSO), notamment en 82-83 où les Keys de Floride et de Panama ont blanchi puis péri alors que l'eau se réchauffait de 2-3 °C.
5.2. Animaux commensaux
Le Corail vivant montre fréquemment des Protozoaires Ciliés, des Copépodes, des Plathelminthes ou des Némathelminthes se déplaçant à la surface des colonies. La présence de cette faune spécialisée relève du commensalisme, le Corail pouvant très bien vivre sans ces habitants.
5.3. Association Corail-éponge
Certains Coraux peuvent coexister longtemps avec d'autres espèces. Citons notamment l'association bénéfique de Montastrea annularis avec l'Éponge Mycale laevis qui vit à la face inférieure des Coraux aplatis en assiette (Goreau & Hartmann, 1966). Le Corail s'accroît autour de l'Éponge qui trouve là un support pour sa croissance. En revanche, la présence de Mycale protège le Corail contre les attaques des Éponges perforantes (Clionidae). Il s'agit là d'une association mutualiste.
5.4. Association Corail-Vers
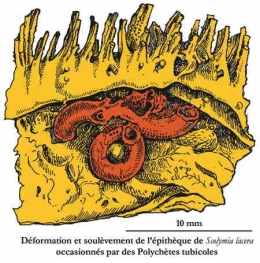
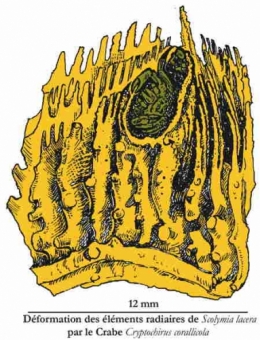
Des Annélides sessiles (Polychètes tubicoles) s'installent sur le Corail en provoquant des déformations du squelette.
Dans la région indo-pacifique, un type d'association mutualiste existe entre le Siponcle Aspidosiphon corallicola et le Corail libre Heterospsammia michelini (Goreau & Yonge, 1968). Le Ver vit dans une coquille vide sur laquelle s'installe et se développe le Corail, ménageant un orifice pour le Ver. Celui-ci peut se rétracter dans son bouclier vivant qui profite des déplacements de l'hôte.
5.5. Association Corail-Crustacés
De nombreuses Balanes sont associées aux Coraux. Des échanges métaboliques semblent exister entre elles et leur support corallien.
Une grande variété de petits Crabes et de Crevettes vit dans les branches des Acroporidae et autres familles de Coraux arborescents. La plupart des Décapodes sont des hôtes temporaires mais certaines associations relèvent du mutualisme. Des Crabes Xanthidae (Domecia, Trapezia) et des Araignées de mer (Mithrax) se nourrissent aux dépens du Corail, de son mucus ou de ses excrétats. D'autres Décapodes demeurent suffisamment longtemps au même endroit pour que l'accroissement de la surface corallienne produise une loge dans laquelle ils vivent. C'est le cas de la Crevette Paratypton ou des Crabes Hapalocarcinus et Domecia qui vivent sur Acropora et qui, enfermés dans une espèce de galle, se nourrissent de plancton et de matières en suspension par les pores de la logette. Il s'agit là d'un cas de commensalisme qui frise le parasitisme.
5.6 Association Corail-Poissons
De nombreux types d'association sont connus entre Corail et Poissons. Dans les Caraïbes, les Poissons ne sont pas des prédateurs importants de Corail (Randall, 1967). Les branches servent de refuges, la base des colonies de territoire de ponte à des Blennies. Différentes Gobies (Paragobiodon) passent leur vie entière dans une colonie donnée.
Le tableau ci-dessous résume les interactions potentielles entre les Coraux et les animaux associés au Corail.
|
Caractères coralliens |
Effets positifs possibles sur l'association |
Effets négatifs possibles sur l'association |
|
Nématocystes et mécanismes de nutrition |
Protègent les symbiontes contre les prédateurs, parasites et organismes recouvrants |
Peuvent tuer les symbiontes ou leurs stades larvaires |
|
Tissus coralliens |
Nourriture, effets répulsifs sur les prédateurs |
Enzymes pouvant détruire des stades larvaires |
|
Mucus |
Source de nourriture |
Pourrait engluer les stades larvaires |
|
Plancton capturé par le corail |
Source de nourriture |
|
|
Sédiment filtré par le corail |
Source de nourriture |
|
|
Zooxanthelles en excès et débris expulsés par le corail |
Source de nourriture |
|
|
Matériel dissous excrété par le corail |
Source de nourriture |
|
|
Squelette corallien |
Support pour symbiontes fixés. Support et protection pour la faune vagile |
Symbiontes recouverts et tués par la croissance du corail |
Interactions potentielles entre coraux et animaux associés
6. Associations remarquables où n'intervient pas directement le Corail
Il est fréquent qu'un petit animal utilise le corps d'un plus gros comme habitat. C'est le phénomène de l'inquilinisme. Le Poisson-Perle, Carapus bermudensis (Fierasferidae) passe toute sa vie dans la partie distale du tube digestif des Holothuries Holothuria mexicana et Actinopyga agassizii, n'en sortant que la nuit pour chercher sa nourriture. Pour rentrer dans le corps de son hôte, il s'introduit queue en avant dans l'orifice cloacal de l'Holothurie, sans déclencher chez cette dernière la moindre réaction de rejet.
Certaines espèces utilisent pour leur protection les coquillages vides. C'est le cas des Bernard-l'ermite ou Pagures dont l'abdomen est dépourvu de carapace et qui changent de coquille pour une plus grande à chacune de leurs mues. Certains Bernard-l'ermite agrémentent leur protection en plaçant une Anémone de mer sur la coquille qu'ils ont adoptée. L'Anémone profite de l'association en absorbant les miettes des repas du Crustacé. Le Pagure profite de la protection des nématocystes de l'Anémone. Il ne manque d'ailleurs pas de l'emporter quand il change de coquille. Certains Crabes Xanthidae utilisent également des Anémones qu'ils fixent sur leurs pinces.
Le tableau ci-dessous liste les sources d'énergie possibles exploitables par les utilisateurs.
|
Source d'énergie |
Utilisateurs |
|
Nourriture collectée à l'extérieur du récif |
Crevettes, Poissons |
|
Nourriture collectée dans l'eau au voisinage du récif, Plancton, Agrégats organiques. |
Nombreux Bivalves et Balanes, Crabes (Hapalocarcinus), Poissons (Dascyllus, Gobiodon, et Paragobiodon). |
|
Sédiments déposés sur le Corail |
Décapodes vagiles |
|
Nourriture collectée par le Corail |
Bivalves (Fungiacava) |
|
Zooxanthelles, Excrétats solides et dissous |
Bivalves (Fungiacava) |
|
Mucus |
Crabes (Trapezia), Autres Décapodes vagiles, Zooplancton |
|
Tissus coralliens |
Différents Gastéropodes, Différents Poissons, Annélides (Hermodice), Balanes (Hockia), Araignées de mer (Mithrax), Copépodes (Xarifia)
|
Sources de nourriture possibles pour les animaux associés aux Coraux
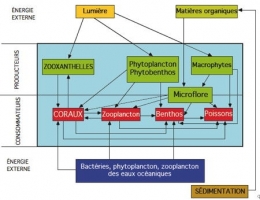
Ces quelques exemples fournissent un aperçu sommaire de la complexité des interactions qui régissent la vie communautaire dans le récif corallien. Cette métropole constitue un écosystème marin parmi les plus productifs et peut être considérée comme un réseau trophique représenté ci-dessous dans lequel nous n'avons figuré que le niveau des producteurs et le niveau des consommateurs. On pourra remarquer que le Corail, consommateur primaire et secondaire par ses capacités de capture d'organismes végétaux et animaux, participe également au niveau des producteurs par ses Zooxanthelles associées.
Suite au chapitre X.
Sources :
Guyard A. (1979). Coraux des Antilles. Le corail et son environnement. 113 p. 30 diapositives. CDDP Guadeloupe Ed.
Zlatarski V. N., Martinez Estatella N. (1982) Les Scléractiniaires de Cuba. 472 p. Acad. bulg. Sci. Ed.
L'auteur remercie chaleureusement les personnes qui ont participé à l'illustration de cet article par leurs clichés sous-marins, notamment Jean-Pierre Pointier et Edmond Civoniak.















Les commentaires sont fermés.