Coraux des Antilles (7)
18/07/2010
Croissance du Corail et répartition des récifs dans la Province Caraïbe
 Coraux et milieu récifal de la Province Caraïbe
Coraux et milieu récifal de la Province Caraïbe
Chapitre VII : Croissance et répartition des récifs
par André Guyard
(suite du chapitre VI : biologie du corail)
Croissance du récif
Le taux de croissance des coraux varie avec la luminosité. La croissance est deux fois plus rapide par temps clair que par temps nuageux et quatorze fois plus rapide à la lumière qu'à l'obscurité. L'obscurité est un facteur limitant et les colonies les plus profondes ont un squelette plus fragile et plus lent à se former. Ces phénomènes s'expliquent quand on sait l'importance de la participation des Zooxanthelles, organismes photosynthétiques dans la squelettogenèse. En moyenne, pour une colonie de 1 à 25 cm2 de surface, on peut estimer l'expansion à 10 cm2 par an. Cette valeur décroît pour des colonies plus étendues. Une surface de 25 cm2 correspond donc à un âge de 2 à 3 ans. Au-delà, les accidents et les ennemis naturels limitent le taux d'extension. Avec cette méthode, on peut estimer l'âge d'une colonie d'après son taux d'extension sous les conditions suivantes :
- la croissance n'a pas subi d'arrêt accidentel ;
- la croissance peut être comparée sur plusieurs colonies ;
- les conditions d'environnement sont restées constantes.
Le tableau 1 donne quelques résultats.
|
Espèce |
Taux d'accroissement en mm du diamètre principal mesuré par année successive
|
|||
|
|
1ère année |
2ème année |
3ème année |
4ème année |
|
Favia fragum |
7,7 |
3,5 |
3,5 |
4,0 |
|
Porites astreoides |
14 |
8 |
7,5 |
13 |
|
Manicina areolata |
15,5 |
14 |
7 |
5 |
Tableau 1 : Effet de l'âge sur la croissance de colonies mesurées individuellement sur quatre ans à Tortugas (Floride) d'après Glynn, 1973.
Nous avons vu plus haut qu'on peut déterminer l'âge par le nombre d'anneaux périodiques de croissance (Wells, 1963). La longévité d'une colonie peut atteindre 140 ans bien que l'âge moyen d'une population de coraux donnée soit de 10 ans avec un tiers seulement de polypes sexuellement matures. Après destruction par un cyclone, les espèces à croissance rapide réparent leurs dégâts dans les trois ans. Mais l'écosystème récifal ne recouvre son équilibre qu'après une période beaucoup plus longue.
Longévité récifale
Une étude de Gabioch (2000) effectuée sur le récif corallien de Tahiti au cours d'une campagne de carottages a permis de déterminer quelles espèces de coraux, d'algues et de mollusques s'étaient succédées sur le récif et à quel rythme. Ce travail a montré que la barrière de corail de Tahiti connaît une croissance ininterrompue depuis 14 000 ans, la plus importante jamais enregistrée, ce qui explique ses 80 mètres d'épaisseur. Lente durant les trois premiers millénaires, l'expansion a atteint grâce aux meilleures conditions climatiques une moyenne de 6 mm/an, un record pour la région Indo-Pacifique.
Beaucoup d'auteurs prétendent que les coraux des Antilles montrent une croissance inférieure à celle des coraux indo-pacifiques. En fait, à température égale, le taux de croissance est le même. Le tableau 2 montre l'importance de la température sur le taux de croissance.
|
Localisation |
Température |
Espèces |
Accroissement annuel en cm |
|
|
|
minimale annuelle |
|
Taille |
Diamètre |
|
Bermudes |
17,3°C |
Montastrea annularis |
0,81 |
- |
|
Bahamas |
- |
Acropora cervicornis |
4,53 |
- |
|
Floride |
20 °C |
Acropora cervicornis |
11,5 |
- |
|
Floride |
20,2 °C |
Montastrea annularis |
0,68 |
0,90 |
|
Floride |
|
Diploria strigosa |
1,00 |
1,98 |
|
Floride |
21,1 °C |
Porites furcata |
2,28 |
3,93 |
|
Barbade |
26,4 °C |
Montastrea annularis |
1,9 ± 0,4 |
1,6 ± 0,3 |
|
Barbade |
|
Porites porites |
3,7 ± 0,7 |
- |
|
Barbade |
|
Acropora cervicornis |
14,5 ± 3,1 |
- |
|
Jamaïque |
27,2 °C |
Montastrea annularis |
2,5 ± 0,7 |
2,2 ± 0,9 |
|
Jamaïque |
|
Porites porites |
4,1 ± 0,6 |
- |
|
Jamaïque |
|
Acropora cervicornis |
26,6 ± 8,2 |
- |
Tableau 2 : taux de croissance des coraux de l'Atlantique-ouest (d'après Glynn, 1973)
En combinant différentes méthodes, on peut estimer la vitesse de croissance des récifs coralliens. dont le tableau 3 fournit quelques données.
|
Localisation |
Nature du récif |
Profondeur |
croissance en mm/1000 ans |
|
Floride |
Montastrea annularis |
10 m |
4300-8500 |
|
Bermudes |
récif en coupe avec algues |
3-9 m |
1200 |
|
Bermudes |
Récif frangeant |
6 m |
1900 |
|
Jamaïque |
Base d'un récif-barrière |
25 m |
1200 |
|
Yucatán |
Récif frangeant |
5 m |
1800-3600 |
Tableau 3 : Estimation de la vitesse de croissance du récif corallien (d'après Glynn, 1973)
La plupart des coraux vivent fixés sur un substrat solide. Certains toutefois reposent sur le sable ou sur la vase. C'est le cas de Manicina areolata. Fungia, genre indo-pacifique non fixé est capable de se déplacer.
Le milieu extérieur joue un rôle de premier ordre dans la répartition des espèces. Les coraux hermatypiques sont sténoèces. Ils exigent une eau salée (33-36 g.l-1). Une trop grande dilution leur est néfaste et par suite, les récifs s'interrompent à l'embouchure des fleuves. Les Madrépores des platiers récifaux vivant sous quelques centimètres d'eau et soumis à de violentes pluies tropicales meurent si ces conditions défavorables persistent trop longtemps.
Alors que les coraux ahermatypiques acceptent des températures variables, (on connaît de tels Madrépores vivant dans les eaux polaires), les formes récifales sont sténothermes d'eaux chaudes où la température ne descend jamais au-dessous de 21°C, avec un optimum situé entre 25 et 29 C. Ces animaux sont donc limités à la strate supérieure des eaux tropicales.
Les coraux supportent mal l'émersion, quoi que certains (Acropora, Porites) découvrent parfois à marée basse. Dans ce cas, ils sécrètent un abondant mucus qui les protège de la dessication et leur permet d'attendre la marée montante.
La lumière est indispensable aux coraux hermatypiques qui, contenant des Zooxanthelles, en ont besoin pour assurer l'assimilation chlorophyllienne de leurs hôtes. Ils ne proliféreront que dans des eaux claires, dépourvues de sédiments. Les fleuves côtiers du golfe du Mexique, le complexe Orénoque-Amazone qui rejettent à la mer des quantités de sédiments constituent une véritable barrière à l'expansion des coraux dans ces régions.
Les Madrépores, animaux fixés, s'adaptent aux conditions locales qui influencent la morphologie des colonies. Par exemple, Acropora cervicornis des eaux calmes des lagons développe de longues branches fines et ramifiées alors que la même espèce, soumise au déferlement de la houle sur le platier récifal montre un squelette plus compact, des rameaux courts et épais capables de résister à l'assaut des vagues. Un courant marin dominant joue sur la forme de la colonie dont les branches s'orientent dans le sens du mouvement de l'eau.
La mortalité est très élevée au niveau des larves planulas et des petites colonies en cours d'installation. La mortalité des coraux adultes est due à des cataclysmes naturels ou provoqués : émersions prolongées accidentelles, apports d'eau douce surtout lorsqu'ils sont chargés de sédiments, arrêt de la circulation d'eau, action sévère des vagues lors des tempêtes et des cyclones, pollutions graves des zones portuaires, pêches à la dynamite, extraction de sable corallien,… On assiste depuis une décennie au blanchiment des colonies qui expriment leurs propres pigments et deviennent fluorescentes. Ce phénomène extrêmement inquiétant est dû à l'expulsion des Zooxanthelles par le corail et serait provoqué par le réchauffement général des eaux marines en zone intertropicale.
Si l'on excepte ces catastrophes, la mortalité naturelle est favorisée par la compétition pour la lumière entre les espèces qui se conduisent comme les plantes vertes d'un tapis végétal et par la prédation. Leurs ennemis naturels s'attaquent aux coraux soit
- en dévorant leurs tissus vivants ;
- en perforant leur squelette (érosion biologique).
Dans le premier cas, le tissu vivant peut évidemment repousser et la prédation peut être assimilée à un broutage. Responsables de ce broutage : de nombreux Poissons, Oursins, Annélides, Crabes et Gastéropodes (voir chapitre IX). Certaines espèces s'attaquent à tout un groupe de polypes et peuvent ainsi détruire de petites colonies.
Dans le second cas, les Mollusques perforants (Lithophaga, Fungiacava) s'attaquent au squelette calcaire, y creusant des galeries. Des Éponges (Cliona), des Oursins (Echinometra), des Vers (Sipunculus), des Crustacés, des Champignons et d'innombrables Algues filamenteuses contribuent à désintégrer le corail. Ce sont ces algues qui prolifèrent lorsque l'intégrité du récif est menacée par des facteurs physiques (turbidité, cyclones, dessalure, extensions portuaires, dragage ou exploitation de sables, pêche à la dynamite) ou climatiques (blanchissement des coraux par rejet des Zooxanthelles).
Ainsi la croissance du récif résulte d'un équilibre dynamique entre l'accroissement vers le haut de la charpente corallienne et l'érosion due aux organismes et aux éléments climatiques provoquant un flux de débris qui dévalent la pente vers le lagon ou vers le large. Des effondrements se produisent et on assiste à un tassement de l'édifice corallien.
Un autre processus majeur contrôle la croissance du récif : la lithification. Il s'agit du dépôt d'un ciment carbonaté à grain fin d'origine bactérienne dans les pores et les cavités du squelette. Cette action est complétée par la formation de calcaires par des Algues encroûtantes et des Foraminifères. La lithification conduit à une accrétion de la surface du front récifal et tend à stabiliser la raideur de la pente (profil accore).
Ainsi le Corail n'apparaît que comme un mince placage de tissu vivant qui construit un squelette croissant de quelques millimètres par an sur un édifice de coraux morts superposés. Aux Antilles, on estime à 9 m l'épaisseur du récif édifié depuis la stabilisation du niveau marin il y a 5000 ans.
Répartition des coraux dans la Province caraïbe
Nous venons de voir que les exigences biologiques des Coraux hermatypiques et de leurs symbiotes, les Zooxanthelles en limitaient la répartition autour du globe dans les régions chaudes intertropicales.
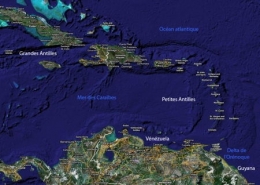
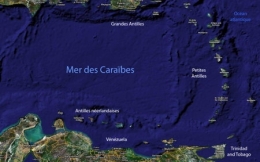
La Province caraïbe
Dans l'Atlantique nord, les formations récifales sur les côtes africaines sont très limitées par suite de l'existence d'un courant froid dans le Golfe de Guinée et des apports terrigènes de nombreux fleuves côtiers. Du côté américain, la région corallienne est limitée au nord par la température hivernale de l'eau (21 °C) au niveau du sud de la Floride. Il faut faire une exception pour les Bermudes, archipel plus septentrional (32° de latitude nord) qui présente la même faune corallienne quoique appauvrie que celle des Antilles, grâce au courant d'eau chaude constitué par le Gulf Stream. La limite sud est marquée par la barrière des sédiments terrigènes apportés par le complexe Orénoque-Amazone qui isole la Province Caraïbe de la zone corallienne brésilienne. Le Gulf Stream se forme entre le sud de la Floride et le nord des Bahamas.
Le Golfe du Mexique étant fondamentalement une zone d'apports terrigènes, seules quelques formations marginales existent le long de l'Amérique centrale et de la côte vénézuélienne. La croissance des coraux dans la zone marginale semble d'ailleurs ralentie par les conditions limites de milieu : 10 cm.an-1 pour Acropora cervicornis au Mexique pour 16 cm.an-1 à la Jamaïque (Lewis, 1969).
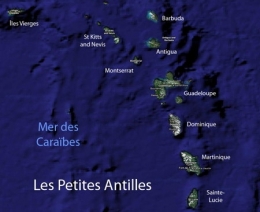
En définitive, la zone corallienne de l'Atlantique nord est centrée sur la Province Caraïbe et en particulier sur les Grandes Antilles au nord et les petites Antilles au sud.
Les différences espèces de coraux sont réparties de façon à peu près homogène dans la Province Caraïbe. Dans tous les récifs, on rencontre sept genres principaux de Scléractiniaires constructeurs : Acropora, Montastrea, Porites, Diploria, Siderastrea, Agaricia et Colpophyllia ainsi qu'un genre d'Hydrocoralliaire : Millepora. Ces huit genres représentent 90 % de la biomasse corallienne. Montastrea annularis, Acropora palmata, A. cervicornis, Diploria strigosa, D. labyrinthiformis, Porites porites, P. astreoides, Siderastrea siderea, et Colpophyllia natans constituent les espèces de Scléractiniaires dominantes, devançant en masse Agaricia agaricites et Meandrina meandrites. Dans le sud des Antilles surtout, Montastrea annularis est l'espèce dominante alors que dans les îles du nord, Acropora palmata est l'espèce prépondérante. D'après Laborel (communication personnelle), cette répartition différentielle s'explique également par le fait qu'Acropora palmata est d'apparition relativement récente et que cette espèce accuse une faible répartition verticale (quelques mètres).
En conséquence, la masse du récif est à base de Montastrea dans le cas d'un récif d'épaisseur moyenne (de 10 à 20 mètres) et à base d'Acropora palmata pour les récifs-barrières de très faible épaisseur et à pente externe réduite.
La relative pauvreté de la variété spécifique des coraux antillais vis-à-vis de celle de la faune indo-pacifique est contrebalancée par la variété des formes. Par exemple en eau profonde, Acropora palmata montre des branches s'accroissant dans toutes les directions alors qu'en eau peu profonde, les branches s'orientent en direction des vagues peut-être pour mieux résister au flot et dans les cas extrêmes où l'énergie des vagues est considérable, la colonie affecte une forme encroûtante.
Ainsi, selon l'exposition du récif aux vagues, les formes coloniales varient et entraînent la construction de récifs de structure variée.
La suite : Morphologie et genèse des récifs coralliens.
Sources :
Cabioch G. et al., Sedimentology, 46, 985, 2000.
Guyard A. (1979). Coraux des Antilles. Le corail et son environnement. 113 p. 30 diapositives. CDDP Guadeloupe Ed.
Zlatarski V. N., Martinez Estatella N. (1982) Les Scléractiniaires de Cuba. 472 p. Acad. bulg. Sci. Ed.
L'auteur remercie chaleureusement les personnes qui ont participé à l'illustration de cet article par leurs clichés sous-marins, notamment Jean-Pierre Pointier et Edmond Civoniak.


Les commentaires sont fermés.