Les lacs : généralités
16/06/2010
Notions de limnologie. Différents types de lacs. Zonation limnétique
par André Guyard
(Dernière mise à jour : 25/03/2014)
I. CARACTÈRES GÉNÉRAUX DES LACS
L'étude des lacs constitue une science appelée limnologie. Par rapport au milieu marin, les lacs n'occupent que des zones très réduites et peu profondes. Le volume réduit n'entraîne pas une diminution proportionnelle de la biomasse car ces milieux sont très favorables à la vie.
Les lacs ont des limites spatiales bien nettes favorisant l'isolement génétique.
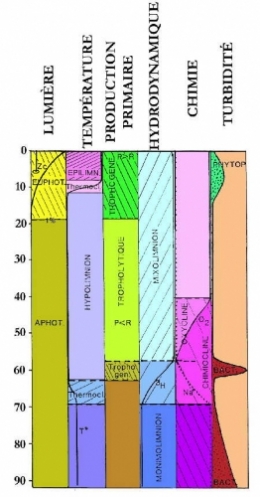
La répartition des propriétés physiques (lumière, chaleur, densité, turbulence) et chimiques (concentration en solutés) impose aux lacs une structure physique très liée à leur morphologie et dont dépend l'organisation des communautés biologiques. Celles-ci se répartissent en zones définies par un ensemble de caractères qui déterminent leur mode de fonctionnement. Cette notion de zonation est très employée en limnologie. Toutefois, les différentes zones définies par leur nature (énergétique, chimique ou écologique) se recoupent sans se superposer strictement, tant sur le plan horizontal que vertical.
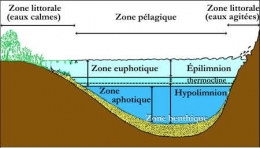
Horizontalement, on distingue une zone littorale où prolifèreront des végétaux (ceinture à macrophytes), une zone centrale ou pélagique (zone de pleine eau) et une zone benthique (fond du lac). C'est la profondeur qui est l'agent principal de la zonation horizontale.
Zonation spatiale d'un lac profond
1. Rôle de la lumière
Dans la zonation verticale, le rôle de la lumière est primordial. Aux phénomènes physiques de réflexion, diffusion et absorption qui diminuent l'intensité lumineuse et modifient la composition spectrale, s'ajoute la présence de matières en suspension (MES) qui provoquent la turbidité de l'eau et en modifient la transparence entraînant une diminution notable de la productivité des organismes chlorophylliens. Au-delà d'une certaine quantité de MES, la vie n'est plus possible.
La zonation lumineuse dans un lac s'organise de la façon suivante : la zone euphotique s'étend conventionnellement de la surface jusqu'à une profondeur de pénétration de la lumière correspondant à 1% de l'énergie lumineuse incidente au-delà de laquelle se situe la zone aphotique. La séparation de ces deux zones ne présente, en général, que peu de variations saisonnières, sauf si la transparence fluctue avec les saisons.
2. Rôle de la température
Dans les milieux aquatiques, les variations de température sont très atténuées par rapport aux variations atmosphériques. Ces variations dues au rayonnement solaire ne concernent qu'une faible épaisseur de liquide dans les eaux dormantes peu profondes, mais généralement, l'action des vents et des courants crée un brassage thermique qui atténue ces variations. Cependant, dans les lacs suffisamment profonds, il s'établit une stratification thermique très caractéristique due au fait que la densité de l'eau est maximale à la température de 4°C. Les eaux, dont la température est inférieure ou supérieure à 4°C ont donc tendance à monter. Alors, tout au moins dans les lacs tempérés, la température de l'eau suit au cours de l'année un cycle régulier.
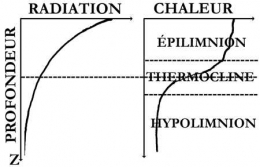
Sous nos climats, en été, l'eau se répartit généralement en trois zones :
- l'épilimnion : couche d'eau superficielle chaude assez homogène à température > 4°C qui décroît avec la profondeur ;
- une couche intermédiaire de fort gradient thermique : le métalimnion des limnologues, la thermocline des océanographes, zone de transition réduite à quelques mètres;
- l'hypolimnion ou bathylimnion, zone la plus profonde, de température basse et de nouveau homogène.
Distribution verticale du rayonnement lumineux et de la chaleur dans un lac stratifié (d'après U. Lemmin, 1995)
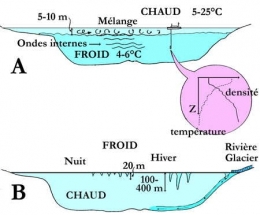
Cette zonation suit, bien sûr, un cycle saisonnier. Dans les lacs tempérés, au début du printemps (en mars-avril si le lac n'a pas gelé, plus tard sinon), l'échauffement solaire crée une couche d'eau chaude superficielle. Le vent fournit l'énergie nécessaire au mélange de l'eau chaude jusqu'à une certaine profondeur. Il se forme de petites thermoclines transitoires superficielles. L'accumulation de ces petites thermoclines amène tout d'abord une égalisation des températures permettant un brassage suivi de l'installation de la thermocline saisonnière et de la stratification thermique directe d'été. La thermocline s'approfondit en s'amplifiant (augmentation du gradient thermique) pour atteindre son plein développement en août-septembre. À partir de là, la thermocline continue à s'approfondir en s'affaiblissant, pour disparaître complètement lors du mélange hivernal. Puis, au moment de la prise en gel des eaux superficielles, la stratification thermique directe de l'été fait place à une stratification inverse d'hiver avec l'eau froide (et éventuellement la glace) en haut et l'eau plus chaude en profondeur.
Le schéma ci-dessous présente le processus des mélanges verticaux qui animent les eaux d'un lac : A. action du vent : mélange de l'épilimnion et création d'ondes internes à la thermocline ; B. mélanges de convection thermique dus aux refroidissements nocturne et hivernal, et à la pénétration d'apports d'eau froide (rivière, eau de fonte). L'épaisseur des couches limites dans l'eau et l'air est indiquée en mètres.
Dans les lacs tropicaux, la thermocline occupe une position permanente même si des fluctuations saisonnières sont possibles.
Dans les lacs tempérés de faible taille (< 20 km2), l'épaisseur de l'épilimnion est positivement corrélée à la transparence ; l'épilimnion est plus épais dans les lacs clairs, en raison d'une meilleure pénétration des radiations solaires. En agissant sur la profondeur de pénétration (absorption et dispersion), la biomasse et la structure du plancton, elle-même dépendante du peuplement de poissons, peuvent modifier la structure thermique. En automne, la baisse de température entraîne les eaux superficielles vers le fond et ces mouvements convectifs érodent progressivement la thermocline jusqu'à obtenir le brassage hivernal qui conduit à une égalisation des températures.
Ces mouvements sont écologiquement importants : les seules sources d'oxygène, outre les entrées d'eau, sont la ré-aération superficielle et la production photosynthétique dans la zone euphotique. En revanche, les eaux profondes sont mieux minéralisées. Grâce au brassage, l'ensemble bénéficie d'un renouvellement favorable à la vie des organismes.
En raison de la relation température-densité caractérisée par un maximum de densité de l'eau à 4 °C, il existe une liaison étroite entre les zonations thermique et densitaire qui détermine notamment la période de mélange des eaux. La température n'est toutefois pas la seule variable agissant sur la densité : des apports d'eaux salines (intrusion marine, sources salées) induisent des gradients de densité de l'eau (pycnoclines) généralement confondus avec des gradients chimiques (chimioclines).
Dans certains lacs profonds, comme le Léman ou le lac Majeur, des mélanges complets occasionnels (tous les 5 à 10 ans) suffisent à empêcher le développement d'une couche profonde permanente plus dense et stagnante.
Lorsque l'énergie extérieure reçue par le lac est insuffisante, les lacs à fort gradient de densité ne peuvent plus se mélanger complètement (lacs méromictiques). On distingue alors les eaux superficielles mélangées au moins annuellement (mixolimnion) des eaux profondes, qui ne se mélangent pas (monimolimnion).
Le cas du lac Pavin est intéressant. Le Pavin est l'unique représentant des lacs méromictiques en France. Cette singularité résulte de sa morphologie : c'est un lac "creux", dont la profondeur atteint 92 mètres, et peu large, puisque son diamètre est estimé à 750 mètres. Cette forme conduit à une séparation de la colonne d'eau en deux strates : la zone supérieure (mixolimnion) (jusqu'à 60 mètres de profondeur) est brassée et oxygénée tandis que la zone profonde (monimolimnion) entre 60 mètres et 92 mètres), jamais mélangée, est dépourvue d'oxygène.
Ainsi, le lac Pavin se comporte comme un "double" lac, formé par la superposition de deux compartiments aux caractéristiques physico-chimiques distinctes, mais non isolés l'un de l'autre, preuve en sont leurs étroites interactions sur les plans à la fois biologiques et chimiques.
La zone supérieure présente les caractéristiques physico-chimiques (en termes de température, concentration en oxygène dissous, pression, etc.) classiques d'un lac de région tempérée, mais partage peu de points communs avec la zone profonde. Loin de ressembler aux conditions extrêmes qui règnent dans les fosses abyssales des océans, les profondeurs du lac n'en sont pas moins drastiques. À cette profondeur, la luminosité est nulle, et il n'y a plus de dioxygène. La température ne dépasse pas 4 °C, et la pression atteint dix fois la pression atmosphérique.
Autant dire que peu d'espèces se sont adaptées à ce milieu hostile... Les organismes « supérieurs », les poissons et le zooplancton, ont déserté les profondeurs du lac, et seuls les micro-organismes y sont présents.
Les prélèvements ont révélé que la zone profonde du lac Pavin est riche en bactéries, à l'instar des fonds sous-marins. Entre 2002 et 2006, de multiples campagnes d'échantillonnage ont permis de dénombrer plus de dix millions de bactéries par millilitre d'eau prélevée dans les profondeurs du lac, une densité bactérienne dix fois supérieure à celle rencontrée dans les autres lacs. (Voir à ce propos l'article Les bactéries du Lac Pavin dans Pour la Science de janvier 2010).
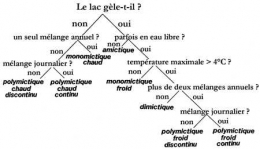
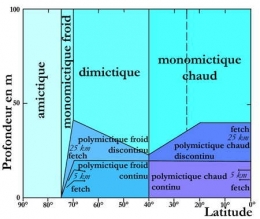
Classification thermique des lacs
Selon Hutchinson & Loeffler (1956), selon l'altitude, la latitude et les dimensions des lacs, on distingue :
- 1. Lacs amictiques : pas d'échanges thermiques appréciables entre air et eau. Couche permanente de glace en surface et une température constante et faible en dessous.
- 2. Lacs monomictiques froids, de type polaire. La température ne dépasse jamais 4°C en surface en saison chaude. Ils gèlent en hiver. Ex : lacs d'altitude dans les Alpes et les Pyrénées.
- 3. Lacs dimictiques à deux périodes de stratification, une directe en saison chaude, une inverse en saison froide et deux périodes de brassage. Lacs de type tempéré, les plus fréquents. Ex : lacs du Jura, lac d'Annecy.
- 4. Lacs monomictiques chauds, de type tropical. La température ne descend jamais en-dessous de 4°C, ni en surface, ni en profondeur. Une seule période de brassage en saison froide et une période de stratification directe en saison chaude. Lacs de type tropical de Forel, de type sub-tropical de Yoshimura ou lacs chauds de Vivier (1961). Ex : lac Léman.
- 5. Lacs oligomictiques dans lesquels l'eau est toujours chaude à toute profondeur et les périodes de circulation rares, courtes, irrégulières et réduites. Lacs de type tropical de Yoshimura et de Ruttner. Ex : lacs de faible altitude de la zone équatoriale.
- 6. Lacs polymictiques à température relativement basse mais toujours supérieure à 4°C et présentant de nombreuses voire quotidiennes périodes de circulation due à la perte de la chaleur emmagasinée et interdisant ainsi la formation d'une stratification stable. Ex : lacs de haute altitude de la zone intertropicale.
Les lacs monomictiques et dimictiques sont répartis en deux ordres :
- lacs de premier ordre dont la température en profondeur reste toujours voisine de 4°C (lacs à Omble chevalier) ;
- lacs de deuxième ordre dont la température en profondeur varie largement autour de 4°C.
Les lacs amictiques, oligomictiques et polymictiques dont la stratification n'est pas accusée sont des lacs de troisième ordre.
Ex : Léman : monomictique chaud de 1er ordre ;
Annecy : dimictique de 1er ordre ;
Abbaye : dimictique de 2e ordre.
- lacs holomictiques : toute la masse d'eau est affectée par le brassage.
- lacs méromictiques (voir ci-dessus le lac Pavin) :
- seule une couche superficielle (circulolimnion ou mixolimnion est affectée par le brassage ;
- thermocline permanente crée une chemocline (= lytocline) ;
- monimolimnion permanent jamais brassé (Ex : Tanganyika).
Cette structure est due à la densité plus grande des eaux profondes.
Influence du réchauffement climatique (ajout du 25/03/2014)
(d'après Florence Habets, Philippe Mérot, Bernard Itier et Alban Thomas (2014) Anticiper une diminution de la ressource en eau, Pour la Science n°438, avril 2014 pp. 66-69.
L'élévation des températures due au réchauffement climatique aura de multiples conséquences, souvent liées, sur la ressource en eau de la planète. Elle modifiera, tout d'abord, la répartition géographique des pluies, car la hausse des températures sera moins forte à l'équateur qu'au niveau des pôles. Or, à l'échelle de la planète, le gradient des températures est associé à la circulation des grandes masses d'air et, par conséquent, au transport de chaleur et aux vents circulant aux latitudes moyennes. En Europe, dès 2050, les précipitations devraient avoir diminué dans les zones méridionales et augmenté dans les régions septentrionales.
De surcroît, avec l'augmentation des températures, l'atmosphère contiendra davantage de vapeur d'eau, ce qui perturbera encore le régime des pluies. Dans les zones tempérées et humides, cela se traduira par une fréquence accrue des précipitations fortes (plus de dix millimètres par jour) - une tendance que l'on observe déjà sur l'ensemble des continents. Dans les régions sèches, en revanche, la hausse des températures entraînera une diminution de la fréquence des pluies, car le seuil de déclenchement des précipitations devrait être plus élevé qu'aujourd'hui.
Le surplus d'eau contenu dans un air plus chaud résulte d'une augmentation des échanges hydriques avec la surface, l'eau s'évaporant davantage. Cette "demande évaporative" accrue est facilement satisfaite au-dessus des océans : on parle alors d'"eau verte", car cette eau contribue à la production de biomasse via le processus de photosynthèse. La "demande évaporative" est plus contraignante au niveau des continents, où l'évaporation provient surtout de la végétation qui puise l'eau dans les sols. Cette forme d'eau présente sur les continents est appelée "eau bleue" nous intéresse particulièrement ici puisqu'on la trouve dans les lacs, les rivières, les nappes souterraines et les zones humides. C'est celle qu'on utilise pour les besoins en eau potable, pour l'industrie et pour l'agriculture.
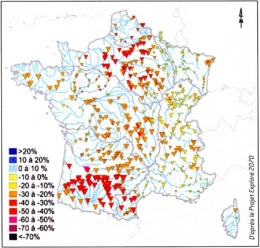
Or, qu'il s'agisse de l'eau bleue ou de l'eau verte, elles sont issues des pluies, et sont donc interdépendantes : une déperdition d'eau verte entraîne une diminution d'eau bleue. En France, on estime ainsi que le réchauffement climatique provoquera une baisse de 20 à 30 pour cent des débits annuels d'eau bleue dès 2050 (voir la carte ci-dessous). Cette diminution devrait s'accompagner de sécheresses à la fois plus fréquentes et plus longues, sans pour autant diminuer le risque de crues. Au contraire, ce risque pourrait augmenter dans certaines régions, tel le Sud-Est de la France.
Évolution attendue du débit moyen annuel des cours d'eau français. On a comparé les moyennes des années 1961 à 1990 et des moyennes prévues entre 2046 et 2065. On voit que les régions Sud-Ouest et Nord subiront des baisses aux alentours de 50 pour cent. La taille des triangles indique le degré de convergence des 14 simulations moyennées.
3. Rôle des substances dissoutes
- 3.1. L'oxygène
est important car il règle l'activité animale toute entière. La teneur en oxygène de l'eau est faible comparée à celle de l'air et elle est très dépendante de la température. Les organismes sont selon les espèces plus ou moins exigeants vis-à-vis de l'oxygène dissous. C'est seulement dans des lacs subalpins profonds que l'on trouve des Salmonidés comme l'Omble Chevalier, poisson ayant de grands besoins en oxygène. Certains animaux aquatiques résistent à une faible teneur en oxygène par des adaptations particulières : respiration de l'air en nature (dytiques, nèpes, corises) ; pigments respiratoires (Tubifex, larves de Chironomes).
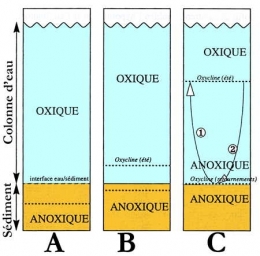
Séparation entre les compartiments oxique et anoxique dans différents types de lacs: (A) : oligotrophe, l'oxycline est toujours dans les sédiments ; (B) : mésotrophe, en été seules les eaux profondes deviennent anoxiques ; (C) : eutrophe, durant l'été l'anoxie envahit la colonne d'eau (développement de l'anoxie au printemps, = réoxygénation des eaux profondes à l'automne) (d'après J.-F. Gaillard, 1995)
- 3.2. Le gaz carbonique,
très soluble dans l'eau, a une concentration dans les eaux douces à 20 °C de 0,56 %, bien supérieure à sa concentration dans l'air (0,033 %). En outre, il se combine assez facilement avec des sels de métaux alcalins ou alcalino- terreux pour former des carbonates ou des bicarbonates qui constituent alors une réserve de CO2 facilement mobilisable. Il joue un rôle considérable au niveau des processus photosynthétiques des végétaux chlorophylliens. La consommation de CO2 par la photosynthèse rend l'eau plus acide et provoque la précipitation du carbonate. C'est là l'origine des concrétions calcaires qui recouvrent certains végétaux (Chara).
4. Faible concentration en sels dissous
Cette concentration, toujours inférieure aux 35 g/l de l'eau de mer est très variable et peut atteindre 0,5 g/l. Même avec cette faible concentration, tous les éléments biogènes ou nutriments existent dans les eaux douces. Parmi eux, les nitrates et les phosphates, nécessaires à la croissance des végétaux, sont souvent des facteurs limitants. La teneur d'une eau en nutriments exprime l'état physiologique de l'écosystème. L'état physiologique se manifeste tout d'abord par la composition des substrats et la teneur en plancton, en algues unicellulaires et filamenteuses.
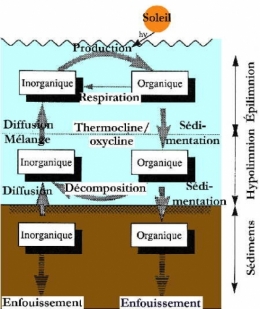
Comme le montre le schéma ci-dessous, deux types de structures trophiques se construisent sur ces bases, à partir des décomposeurs bactériens ou à partir des producteurs primaires (voir également la structure trophique des lacs).
Représentation idéalisée des transferts de matières liés aux cycles biologiques au sein d'un système lacustre stratifié (d'après J.-F. Gaillard, 1995)
Quelle que soit la structure trophique de l'écosystème, son état actuel est le terme temporaire d'une évolution antérieure, l'évolution théorique future n'étant prévisible qu'à l'échelle géologique (voir article suivant).
Cependant, les éléments biogènes et les nutriments ne sont pas répartis de façon homogène dans les systèmes aquatiques. Dans les lacs, on observe ainsi une zonation verticale chimique particulaire et sédimentaire.
- 4.1. Zonation chimique verticale
L'utilisation biologique des éléments nutritifs, la sursaturation en oxygène dissous et, parfois, la précipitation des carbonates liée à la production algale, caractérisent la zone trophogène. Ces processus peuvent présenter des variations saisonnières très marquées et culminent lorsque la production est maximale : de mai à octobre pour les lacs tempérés ne gelant pas, de juillet à septembre pour ceux qui gèlent, toute l'année pour les lacs tropicaux. Dans la zone tropholytique des lacs profonds bien oxygénés, on observe les processus inverses avec des gradients faibles et réguliers ; ce n'est qu'à l'interface eau-sédiment ou même dans celui-ci (premiers décimètres) qu'on observe à nouveau des gradients très élevés d'oxydo-réduction. Dans les lacs méromictiques, la couche profonde, le monimolimnion stagnant est vite dépourvue d'oxygène et riche en espèces chimiques réduites (Mn2+, NH4+, Fe2+, H2S, voire même CH4). À la limite monimo/mixolimnion se développe une série de gradients redox très marqués (jusqu'à un facteur 1000 en quelques mètres) qui se succèdent en profondeur suivant un ordre déterminé. Il y a donc en fait, une succession de chimioclines depuis la diminution et la disparition de l'oxygène (oxycline) jusqu'à l'apparition des espèces les plus réduites.
- 4.2. Zonation particulaire et sédimentaire
Dans la zone littorale à forte énergie dissipée, éolienne, avec érosion des berges situées sous les vents dominants, ou fluviale, il y a formation de deltas et dépôts des matériaux les plus grossiers (de granulométrie supérieure ou égale aux sables fins). Sur les flancs des cuvettes lacustres, les processus de transport et de tri (vannage) des matériaux fins (argiles) et moyens (sablons) dominent. Dans les parties les plus profondes des cuvettes, s'accumulent des matériaux en général très fins dont le dépôt est parfois perturbé par des apports catastrophiques de particules grossières (glissements, courants de turbidité).
En pleine eau (zone pélagique des écologues), la pénétration des tributaires lors des crues s'effectue sous forme de panaches chargés en MES, à des profondeurs variables selon leur densité et où les particules fines peuvent limiter la pénétration de la lumière. Les observations in situ par néphélométrie peuvent également mettre en évidence les fortes densités de particules dans les zones trophogènes superficielle (phytoplancton) ou profonde (bactéries, hydroxydes de manganèse) et l'augmentation générale des concentrations en particules dans les couches profondes des lacs.
Lumière, température, présence de matières en suspension, entraîne une zonation de la végétation, particulièrement visible en milieu lacustre (voir plus loin).
II. ZONATION VÉGÉTALE
Dans la zone pélagique et la zone littorale, les organismes phototrophes (végétaux, bactéries) ne peuvent se développer qu'en présence de lumière : ils sont donc généralement limités à la zone euphotique. La partie supérieure des lacs où la production primaire l'emporte sur la dégradation est appelée zone trophogène (littéralement productrice de nourriture) par opposition à la partie inférieure, appelée zone tropholytique, où les processus de dégradation dominent (Wetzel 1983). En général, cette zonation se traduit par une répartition verticale de la teneur en oxygène dissous : saturation ou sursaturation dans la couche trophogène (photosynthétique) et sous-saturation dans la couche tropholytique séparées par la profondeur de compensation (Zi), où la saturation moyenne sur 24 heures est de 100 %. (Voir article dans ce même blog : classification trophique des lacs). Ces zonations sont donc intimement liées et très dépendantes de la zonation lumineuse pour les lacs où la production primaire est d'origine photosynthétique. Dans des lacs méromictiques, on peut observer des pics de production primaire de bactéries chimiosynthétiques au niveau de la chimiocline déterminant une deuxième couche trophogène profonde.
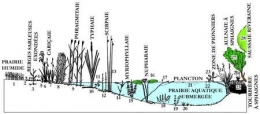
Le schéma ci-dessous représente la répartition des macrophytes dans la zone littorale d'un lac tempéré peu profond : au contact des formations prairiale (partie gauche de la figure) et arbustive (partie droite). 1. Agrostis des chiens ; 2. Écuelle d'eau ; 3. Renouée amphibie "terrestre" ; 4. Littorelle des marais "terrestre" ; 5. Scirpe lacustre ; 6. Iris d'eau ; 7. Carex vésiculeux ; 8. Baldingère faux-roseau ; 9. Roseau (Phragmites) ; 10. Massette à feuilles étroites ; 11. Renoncule aquatique ; 12. Prêle aquatique ; 13. Scirpe lacustre ; 14. Potamot nageant ; 15. Myriophylle en épi ; 16. Nénuphar blanc (Nymphea) ; 17. Renouée amphibie "aquatique" ;18. Élodée ; 19. Naïade ; 20. Littorelle lacustre "aquatique" ; 21. Phyto- et zooplancton ; 22. Lentille d'eau ; 23. Trèfle d'eau ; 24. Touradon de carex en panicule ; 25. Sphaignes ; 26. Molinie bleue ; 27. Saule cendré ; 28. Aulne glutineux.
Répartition des macrophytes dans la zone littorale d'un lac tempéré peu profond (d'après Montegut, 1987)
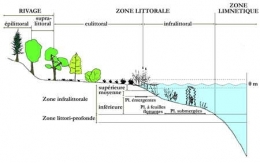
Zonation de la végétation aquatique en milieu lacustre (d'après Lachavanne et al. 1985)
Sources :
Cours d'hydrobiologie (1997) par André Guyard (DESS Eaux continentales, pollutions et aménagements).
Limnologie générale sous la direction de R. Pourriot et M. Meybeck (1995). Ed. Masson collection d'écologie 25. 956 p.


52 commentaires
Je suis étudiant
Dans mes recherches, sur les strifications thermiques et l'eutrophisation des lacs. je suis tombé sur votre article.
Je voudrais savoir comment se fait la strafication d'un lac de moins de 5 m de profondeur dans une zone tropicale chaude.
Merci de recevoir mes coordonnées.
Bonjour,
Il ne se produira aucune stratification. Étant donné la faible profondeur du lac, la température sera pratiquement homogène et élevée en climat tropical (24-28°C). En effet, sous climat tropical (latitude < 10°), il n'existe pas de variations saisonnières marquées de la température car le rayonnement solaire est intense en toute saison et la durée du jour égale à 12 plus ou moins 1 heure.
Éventuellement, dans un lac profond, une thermocline pourrait s'établir au-delà de 25 m, ce qui n'est pas le cas dans votre lac de 5 m de profondeur.
On peut dans les lacs tropicaux profonds, observer un cycle monomictique chaud durant la saison sèche alors que les pertes de chaleur par évaporation sont maximales. Dans ces conditions, il s'agit d'un cycle de mélange vertical annuel et une stratification de longue durée peut apparaître. Mais, je le répète, uniquement dans les lacs profonds.
Bonjour,
J'étudie dans le sud de la France un lac de remplissage d'une ancienne mine à ciel ouvert : diamètre du lac 500 m, profondeur 35 m. En novembre, l'eau était entre 14 et 18°C en surface jusqu'à 10m, puis de 7° jusqu'à 25m et de 9°C de 25 à 35 m. La conductivité de l'eau était de 600-800 µS/cm jusqu'à 25 m et de 1400-1500 µS/cm au delà (cela est probablement dû à l'eau de la mine qui est minéralisée et qui remonte par le fond).
Ma question est : ce type de lac est-il à votre avis mono- ou di-mictique (voire oligomictique)?
Bonjour,
D'après les données que vous produisez, la structure thermique en fin de saison chaude montre une stratification directe, c'est-à-dire que l'eau la plus chaude se trouve en surface et la plus froide en profondeur. Par suite de l'abaissement des températures et éventuellement de l'influence des vents froids, on peut donc s'attendre en automne à une bascule thermique et à un mélange si l'eau de surface devient plus froide (et plus lourde) que l'eau de profondeur.
Votre lac est-il situé en altitude et peut-il geler ? Si c'est le cas, au printemps quand les eaux de surface se seront réchauffées, on doit assister à un second mélange des eaux avec inversion du phénomène (stratification inverse). Le lac serait alors considéré comme dimictique (mélange d'automne + mélange de printemps).
Je suppose que le lac ne gèle pas. Dans ces conditions, il ne peut être que monomictique.
Étant donné la faible profondeur du lac que vous étudiez (35 m), on doit s'attendre à un comportement holomictique de votre lac, étant donné l'indice de creux réduit (lac sous climat tempéré). C'est-à-dire que le mélange d'eau doit être total.
Pratiquement, on constate le phénomène d'holomicticité quand on observe en surface des plaques de biotecton (couverture biologique des sédiments) arrachées au fond du lac.
Ce qui complique le schéma, c'est la présence d'eau salée au fond du lac comme le montrent les mesures de conductivité de l'eau profonde.
En conséquence, l'eau profonde ne participerait pas au turn over de la colonne d'eau et le lac serait méromictique, le mélange n'intéressant que l'eau douce de votre lac.
Une seule série de relevés en novembre ne suffit pas. Et cette hypothèse demande à être vérifiée en procédant à des mesures de température et de conductivité non seulement en novembre, mais également en hiver et au printemps.
En conclusion, je pense que votre lac est monomictique et que le mélange n'intéresse que la couche d'eau douce (méromicticité).
Bonjour,
Merci pour la réponse adressée à M. Gombert. Je travaille actuellement en tant que stagiaire avec lui, sur ce même lac.
Ce lac est à une altitude de 130m et est fréquemment visité.
Voici quelques détails de ce lac : les échantillons d'eau du fond (vers 30m de profondeur) sentent le H2S et sont riches en MES, ce qui n'est pas le cas de l'eau de surface (claire et sans odeur).
Nous prévoyons de réaliser des log de température et de conductivité de façon mensuelle afin de suivre son évolution.
J'aurais une petite question : si ce lac était totalement isolé de la mine souterraine, est-ce que ces variations de température et de conductivité suffiraient à l'"empêcher" d'être méromictique? Est-ce, en fait, elles pourraient entraîner un renouvellement du lac?
Merci d'avance pour votre réponse.
Bonjour,
Le fait que l'eau de profondeur sente le H2S montre que l'hypolimnion de votre lac est totalement désoxygéné et que les bactéries travaillent le sédiment en condition anoxique. J'imagine que la stagnation de cet hypolimnion est due à la présence des sels dissous provenant de la mine et qui accroissent la densité de l'eau profonde.
Mais, au fait, quel type de minerai était exploité par cette mine ?
Étant donné sa faible profondeur et de l'influence des vents, s'il était isolé de la mine, ce lac devrait holomictique. Encore faut-il tenir compte également de la conformation de la cuvette lacustre et de sa bathymétrie.
Merci pour votre réponse.
Il s'agissait du charbon.
J'aurais une autre question: il est peut-être envisagé que ce lac soit pompé pour maintenir un niveau constant d'eau. Ce pompage affecterait-il à votre avis son comportement?
Merci encore pour vos éclaircissements.
Bonjour,
Je ne sais pas quel usage est dévolu à ce lac. Est-il voué à des usages ludiques, à la pêche ?
Comment est-il alimenté ? A-t-il un ou des émissaires ?
D'une façon générale, pour les peuplements floristiques et faunistique, il est préférable que le niveau reste le plus stable possible, pour favoriser l'installation d'une ceinture végétale et pour permettre aux poissons un accès aux frayères.
En général, on obtient ce résultat en créant un seuil au niveau de l'émissaire pour pallier la baisse des eaux à l'étiage.
Je suis un peu surpris que l'on recherche une stabilisation de la hauteur de la colonne d'eau par un pompage. Cela sous-entend que la hauteur d'eau doit être stabilisée à un niveau minimal.
Dans cette option, il faut également s'interroger sur l'utilisation cette eau pompée selon sa qualité et les quantités prélevées.
Bonjour,
Ce lac est au fond d'une dépression minière et le seul exutoire possible est le pompage. C'est pourquoi nous cherchons à en savoir plus sur l'évolution possible de ce lac.
Merci pour nous avoir aidé.
bonjour, je veux savoir grand chose sur le processus de formation des lacs
bonjour!
Je suis étudiant congolais en sciences de l'environnement, si je vous ai posé la question de savoir grand chose sur le processus de formation des lacs notament ceux de l'hémisphère australe, c'est plus pour déceler l'ontogénies des ces types d'écosystèmes aquatiques
Bonjour,
Je réponds à votre demande dans l'article suivant :
http://baladesnaturalistes.hautetfort.com/archive/2011/04/05/qu-est-ce-qu-un-lac.html
salut
je suis un etudient au filiere svt et je te remercier pour les information je veu savoir plus c'est possible...merci
slt monsieur vraiment je m'excuse de dérangement.je suis une étudiante et je recherche une méthode efficace pour préserver une zone humide écologiquement.
De nombreux organismes sauront répondre à votre demande. Par exemple, l'Agence de l'Eau de votre région, le CEMAGREF, l'INRA, la DREAL… Prenez contact avec eux et exposez leur votre problème.
Je suis étudiante et mon master de recherche concerne "la pollution du lac de Tunis". Pourriez vous m'aider ? Je vous remercie infiniment.
bonjour,
je suis étudiante, j'étudie un lac de barrage situé dans le nord d'Algérie. l'aire de la retenue de barrage est de 536 ha, la profondeur maximale est de 12 m.le barrage est sur une altitude de 119.5 m.
la région est caractérisée par un climat midétirannien.
est ce qu'on peut dire que c'est un lac stratifié?
Bonjour
je suis etudiante j'etudie les lacs des monts bale,j'aimerais que vous puissiez parler sur
je suis étudiante, merci beaucoup pour cette article ,elle ma aidéé dands mon exposé .
Je vous remercie infiniment.
Bonjour,
J'aimerai vous posez une question concernant la relation qui existe entre la teneur en Oxygène dissout élevée et la forte minéralisation dans un lac monomictique chaud; est ce que il y en a une? comment peut en expliquer des teneur élevées d'O2 dissout lors de la saison d'été???
Merci d'avance
Bonjour,
Voici quelques éléments de réponse à votre question.
Effet de la minéralisation :
Les sels minéraux dissous dans l'eau ont pour effet de diminuer légèrement la pression de vapeur d'eau saturante et par conséquent la solubilité de l'oxygène. La diminution de cette dernière est exponentielle. Par exemple, elle atteint presque 20% pour une eau de mer de densité 1,035. On peut négliger le phénomène en eau douce, mais il peut avoir son intérêt en eau salée ou même saumâtre.
Effet de la température :
En ce qui concerne la température, la solubilité des gaz diminue avec la température.
En fait, la détermination précise de la solubilité de l'oxygène dans l'eau n'a pas été une opération facile. Depuis la fin du XIXe siècle, de nombreux chercheurs s'y sont employés, obtenant des résultats dont les discordances résultèrent autant du manque de fiabilité des méthodes de dosage que de la diversité des conditions expérimentales, notamment de l'humidité de l'air.
En effet, si l'air est humide, c'est-à-dire comme dilué par de la vapeur d'eau, la pression partielle de l'oxygène doit être calculée par rapport à la pression barométrique diminuée de la pression partielle de vapeur d'eau, cette dernière augmentant avec la température d'environ 1 mm de Hg/°C. Il s'agit donc de prendre aussi en compte le régime hydrique de votre région en été.
Les standard methods (1971) donnent la formule :
OD =(P-u). 0,678 / (35 + t)
avec :
OD = oxygène dissous (mg/l)
P = pression barométrique (mmHg)
u = pression de vapeur d'eau saturante (mmHg)
t = température (°C) valable pour 0°C < t < 30°C.
Une autre formule, plus simple, valable pour 4°C < t < 33°C, au niveau de la mer, à ± 0,04 mg/l est proposée par Montgomery et al (1964) :
OD = 468 / (31,6 + t)
Bonjour,
Tout d'abord je tiens à vous remercier pour l’intérêt que vous avez porté à ma question.
Moi,je travaille sur un lac du moyen atlas marocain (Aguelmame Sidi ALi) situé à une altitude de 2080m, de type endoréique et à régime pluvial.
Lors de la saison d'été d'une année qui a été qualifiée de sèche et chaude, je me suis retrouvée avec un pic de l'oxygène dissout, je ne sais plus si cette teneur élevée a un rapport avec une simple ventilation des eux de surface ou ça pourrait être en relation avec le phénomène d'évaporation qui influence sans doute la pression partielle de vapeur d'eau, car cette dernière agit comme la température donc diminue la solubilité et c'est pourquoi je me suis perdue
J'aurais besoin que vous m’éclairiez d'avantage.
Mille mercis.
Bonjour,
Il m'est difficile de me prononcer sur le cas très particulier de votre lac marocain d'altitude, d'autant plus que je ne suis plus actif dans ce domaine depuis près de quatorze année. Je ne peux donc que vous rappeler certains principes.
La dissolution de l'oxygène atmosphérique
L'air est un mélange de gaz qui contient environ 20,95% d'oxygène en volume. Quand l'air est au contact de l'eau, celle-ci dissout une certaine quantité d'oxygène en fonction des caractéristiques intrinsèques de solubilité du gaz mais aussi en fonction des conditions de milieu qui règnent dans l'atmosphère (pression atmosphérique, humidité) et dans l'eau (température, pression hydrostatique, minéralisation).
Outre la température et la minéralisation dont nous avons envisagé les effets plus haut, d'autres facteurs influencent la dissolution de l'oxygène dans l'eau.
Effet de la pression atmosphérique
D'après la loi de Henry, à l'équilibre et à une température donnée, la concentration en oxygène dissous de l'eau est proportionnelle à sa pression partielle dans la phase gazeuse.
À 10°C et sous 1 atm. (760 mm de Hg), 1 litre d'eau pure en contact avec de l'oxygène pur en dissout 38,46 ml (54,94 mg).
Mis en contact avec de l'air sec, il n'en dissout plus que 38,46 x 0,2095 soit 8,06 ml (11,51 mg), 0,2095 atmosphère représentant la pression partielle d'oxygène dans l'air (20,95% d'oxygène) sous 1 atmosphère.
Comme la pression atmosphérique diminue avec l'altitude et varie avec les conditions météorologiques, il en est de même de la pression partielle, donc de la solubilité de l'oxygène. On devrait donc s'attendre à ce que la solubilité de l'oxygène diminue avec l'altitude. À 2000 m d'altitude, l'eau pure contient 22% d'oxygène en moins qu'au niveau de la mer à température égale. Une chute de la pression atmosphérique de 30 mm de Hg entraîne une diminution de solubilité d'environ 4%.
Effet de la pression hydrostatique
Tout dépend si l'oxygène est évalué en termes de pression partielle ou en termes de solubilité. La pression partielle augmente avec la profondeur : par 10 000 m de fond, elle est 3,55 fois celle de la surface, à température égale. Par contre, la solubilité est indépendante de la pression hydrostatique dans l'eau pure et diminue légèrement dans l'eau salée : par 10 000 m de fond dans une eau salée de densité 1,023, elle est inférieure de 3% à celle de la surface à température égale.
Pratiquement, si l'on évalue la concentration en oxygène par voie titrimétrique, il n'y a pas lieu de tenir compte de la pression hydrostatique. Par contre, si l'on utilise une sonde à oxygène, qui mesure la pression partielle, il faut effectuer une correction qui atteint -5% pour 400 m de profondeur (Hitchman 1978). Ainsi, le genre d'appareils utilisés pour la mesure en oxygène est également important pour faire des comparaisons.
bonjour, je suis étudiant à la faculté des sciences departement de l'environnement, je voulais connaitre les caractéristiques limnologiques des lacs en régions tropicales....
Bonjour Professeur,
permettez moi de vous demander de bien vouloir m eclaircir sur cette situation:
je travaille sur un lac reservoir jeune (age moins de 7 ans) au Maroc,qui d apres le suivi de la temperature de l eau il sest avere qu il s agit d un lac monomictique chaud, durant ma periode d etude j ai jamais trouve d orthophosphates dans les eaux dudit barrage. ce resultat est t il valide ou non? merci pour l information.
La retenue lacustre que vous évoquez est récente. En conséquence, on peut considérer qu'il s'agit d'un lac oligotrophe. L'orthophosphate n'existe qu'en petite quantité à l'état libre, mais il est recyclé très rapidement, surtout dans les lacs oligotrophes. Les teneurs en P-PO43- sont de l'ordre de 10 à 50 µg/l en général, mais elles peuvent s'abaisser à moins d'1 µg/l dans les lacs oligotrophes (alors qu'elles peuvent atteindre 200 mg/l dans des lacs salés). La concentration peut être très faible en été, (même dans les lacs eutrophes, du fait de son absorption). Les teneurs sont faibles dans les zones de roches cristallines, plus élevées sur roches sédimentaires, très élevées s'il y a des roches phosphatées dans le voisinage.
Dans les lacs oligotrophes, plus de 90% du phosphore de l'eau est particulaire, alors que le phosphore dissous domine dans les lacs eutrophes.
Dans le phosphore soluble, on trouve l'orthophosphate libre qui est, à chaque instant, en équilibre dynamique avec l'orthophosphate des composés chimiques solides, cristallins ou amorphes, et avec l'orthophosphate adsorbé sur les particules minérales ou organiques. De ce fait, la concentration en orthophosphate, à un moment donné, dépendra du pH qui agit sur la solubilité des complexes formés et du potentiel redox qui agit sur la valence ionique de certains éléments métalliques (fer, manganèse), donc sur leur solubilité et les propriétés fixatrices des particules qui en contiennent.
Le phosphore particulaire minéral est difficile à identifier quand les éléments sont très fins (les rayons X sont inefficaces). Les minéraux phosphatés reflètent surtout l'environnement car leur formation rapide dans l'eau est douteuse. Par contre, les composés amorphes ont une cinétique de formation plus rapide et bien connue. La fixation ou la coprécipitation avec des hydroxydes métalliques ou des carbonates de calcium sont les phénomènes les plus importants. De ce fait, les formes du phosphore particulaire sont définies par des procédés d'extraction plus ou moins sélectifs.
Finalement, la teneur en phosphore minéral particulaire augmente lorsque la taille des particules diminue (relation surface/volume) de sorte que le phosphore particulaire est essentiellement lié à la fraction "argile", qu'il s'agisse d'argiles minéralogiques ou d'hydroxydes métalliques ou de carbonates fins.
On peut s'interroger sur l'origine du phosphore qu'on pourrait trouver dans votre retenue. S'agissant d'un lac oligotrophe, son origine serait allochtone.
Le phosphore est transporté par les cours d'eau sous formes particulaire ou dissoute. Son origine est diffuse (agriculture, zones naturelles) et ponctuelle (effluents urbains ou industriels). L'importance des apports dépendra de la taille du bassin versant, de sa géologie et de la densité de la population.
Le phosphore issu des sols naturels est le résultat de l'altération pédologique des roches qui contiennent essentiellement de la fluoro-apatite. L'hydrolyse de cette dernière libère le phosphate qui donnera ultérieurement du phosphore organique et des phosphates de calcium, de fer et d'aluminium. Ces phosphates sont peu solubles de sorte que le transport se fait essentiellement sous forme particulaire, lors des crues, à la suite de l'érosion des sols. Les particules contiennent 0,1% de P en moyenne. L'exportation en zones naturelles est de l'ordre de 4 mg/m2/an sur roches ignées, le double sur roches sédimentaires. Les sols cultivés fournissent beaucoup plus de sédiments et surtout ces sédiments contiennent plus de P (le double environ), car l'apport d'engrais enrichit la couche superficielle. L'exportation dépend de la pente et du type de culture (plante et façons culturales). Négligeable sous prairie, elle peut atteindre 3 g/m2/an avec le maraîchage. De 0,5 à 2,5% du phosphore des engrais sont entraînés dans les eaux.
Le phosphore apporté par les précipitations est très variable selon que l'on se trouve dans des zones naturelles ou des zones d'agriculture intensive ou industrielle. En effet, le P atmosphérique provient surtout du sol (poussières, grains de pollen, insectes etc.). Les précipitations sèches sont ainsi plus importantes que les précipitations humides.
Le phosphore des effluents urbains comprend le phosphore des excréments et celui des détergents. L'homme adulte excrète 1,3 à 1,5 g de phosphore par jour soit 475 à 550 g/an. La production annuelle par habitant dépasant 1 kg/an, on voit que les détergents peuvent constituer plus de la moitié des apports, en particulier dans les régions calcaires ou les eaux sont "dures". Les quantités rejetées à la rivière par habitant dépendent du type de traitement et varient, en valeurs moyennes, de 0,39 à 2,86 kg par an.
Méthodes de recherche des orthophosphates
Je pense que vous avez dû rechercher les orthophosphates par la méthode au molybdate. On ne peut pas dire que le lac ne contient pas d'orthophosphate, mais que la teneur en orthophosphate est inférieure au seuil de détection.
Le fractionnement des formes de phosphore dans les sédiments s'est largement inspiré des techniques d'extractions séquentielles des pédologues. Le but recherché était de quantifier les formes chimiques plus particulièrement disponibles pour les algues. Actuellement, on différencie chimiquement le P échangeable (extrait par NH4Cl) ou le P soluble dans l'eau, le P non-apatitique (lié au fer et à l'aluminium) extrait par la soude, le P apatitique ou lié au calcium, solubilisé par HCl, et enfin le P résiduel contenant le P organique. On peut aussi considérer que le phosphore est plus ou moins labile et chercher à extraire une fraction proche de celle utilisée par les algues. C'est ainsi que l'on a utilisé des complexants comme l'acide nitrilotriacétique (Golterman 1982), des résines échangeuses d'ions, et la dilution isotopique du 32P sans entraîneur. Toutes ces méthodes qui tendent à définir des compartiments ne tiennent pas compte de la dynamique des échanges.
Les sédiments du lac fonctionnent comme un piège à phosphore. Ils reçoivent du phosphore particulaire et adsorbent, éventuellement, du phosphore dissous.
Le phosphore particulaire allochtone est essentiellement détritique, le phosphore autochtone est du matériel biogène lacustre, issu des algues en particulier. Les concentrations en phosphore total des sédiments varient de 0,02 à 0,1 mgP/cm3 selon le degré d'eutrophisation.
Le phosphore échangeable représente généralement une faible partie du phosphore total des sédiments, surtout dans les lacs oligotrophes (moins de 1%). Le phosphore lié au fer et à l'aluminium est toujours important, même dans les lacs calcaires.
En dehors de l'apatite, héritée des sols, les minéraux phosphatés caractérisés sont peu abondants dans les sédiments récents car leur formation est extrêmement lente (minéraux authigènes). Seule la vivianite (Fe3(PO4)2, 8H2O) a pu être mise en évidence. Les solutions sont sursaturées vis-à-vis des minéraux cristallins.
Dans les sédiments, le P subit une diagenèse dont le résultat dépend de son origine ainsi que des processus biologiques et physico-chimiques qui s'y déroulent. Cette diagenèse entraîne la différenciation d'un profil de répartition des tonnes du phosphore en fonction de la profondeur.
Le phosphore organique est minéralisé. L'orthophosphate libéré se fixe sur les éléments métalliques, libres ou inclus dans les réseaux de silicates. Avec la profondeur, le temps et l'augmentation de pH entraînent la formation d'apatite aux dépens des formes adsorbées. L'augmentation de la teneur en phosphore dans les horizons supérieurs s'explique par la diffusion de l'orthophosphate vers la surface, selon un gradient de concentration, suivie de sa précipitation dans la zone oxydée, au contact des hydroxydes ferriques. Ce profil théorique peut-être modifié par des changements dans les apports de phosphore, par l'état d'oxygénation de la colonne d'eau ou par des variations de pH.
Bonjour M. Guyard;
Si je veux étudier un lac pour permettre une description précise de ce dernier c’est-à-dire sa classification, est ce que vous pouvez m'expliquer sur quels facteurs/propriétés/caractéristiques du lac je reposerais pour cette étude. et merci
Bonjour,
Pour établir une description d'un lac, il faut étudier :
1. la structure thermique et dynamique des eaux du lac,
2. les représentations de la matière organique dans les eaux (MOD et MOP), dans les sédiments, de la matière organique biodégradable, le rapport C/N des eaux et des sédiments, établir la composition chimique des matières dissoutes et particulaires… afin d'établir le statut trophique du lac.
3. Se rappeler qu'un lac qui fonctionne bien doit "digérer" les apports de la MO pour finalement la transformer en "poisson", étape ultime du réseau alimentaire.
Bonjour Professeur,
Merci pour votre réponse.
Bonjour,
Je suis étudiante et je travaille sur deux petits lacs naturels de l'afrique du Nord (7 et 2m de profondeur).
Selon la classification thermique (en fonction de l'altitude et la latitude) les deux lacs sont monomictique et chauds.
En réalisant des profils thermiques sur le premier lac (qui fait 7 m de profondeur) j'ai pu distinguer la mise en place des trois zones caractérisant un lac stratifié (épi, méta et hypolimnion) avec des températures variant entre 25°C (T° de surface) et 10°C (T° du fond). S’agit-il vraiment d'une stratification thermale, en prenant en considération la très faible profondeur du lac?
au niveau du second lac (2m) j'avais réalisé, à l'aide de plusieurs transect, une trentaine de point de mesure des températures de surface (17°C) et du fond (15°C). Peut-on parler d'une stratification thermique?
Merci
Bonjour,
Je suppose que vous parlez de profondeur maximale (Zmax). Étant donné cette faible profondeur de vos deux lacs que l'on peut qualifier d'étangs, la température de la colonne d'eau sera pratiquement homogène et il ne se produit aucune stratification thermique.
Éventuellement, dans un lac profond, une thermocline pourrait s'établir au-delà de 25 m, ce qui n'est pas le cas dans vos lacs de 2 m et de 7 m de profondeur.
Bonjour, je suis étuidiant en biologie au Québec et j'aimerais savoir si êtes-vous en mesure de m'expliquer pourquoi la plus grande concentration en phytoplancton dans un lac stratifié se retrouve généralement dans le métalimnion, alors qu'il y a évidemment plus de rayonnement solaire dans l'épilimnion.
Voici les strates thermiques du lac que j'étudie:
épi : 0 à 10 mètres de profondeur
méta : 10 à 18 m
hypo : 18 à 32 m
la zone euphotique se termine à 17,25 mètres de profondeur.
Merci
Bonjour,
Pour répondre à votre question, il faut savoir qu'il n'y a pas que la lumière qui est un facteur de répartition verticale du phytoplancton. D'une façon très générale, le plancton recherche une zone où trouver un optimum pour la lumière, la température, sa densité, ce qui explique d'ailleurs sa migration verticale en fonction de l'éclairement et de la température nécessaire et suffisant pour assurer un métabolisme qui correspond précisément à la quantité d'énergie radiative leur permettant une croissance optimale. De sorte que, si l'eau est très claire (lacs oligotrophes), la zone optimale pour certaines espèces de phytoplanctontes peut être plus profonde que l'épilimnion. Idem pour la température. À vous de comprendre le phénomène en fonction des paramètres physiques et de la nature des phytoplanctontes qui peuplent votre lac.
Ci-dessous quelques réflexions qui pourront vous aider à caractériser votre lac (en ne prenant en compte que la répartition vertical du plancton).
Le plancton se compose d'organismes caractérisés par une faible densité corporelle leur permettant de se maintenir dans la masse d'eau et par une inaptitude, à la différence du necton, à s'opposer à des courants très marqués. Ils possèdent, cependant, des capacités de déplacement actif susceptibles de jouer un rôle important dans le cadre d'un environnement faiblement turbulent.
Les répartitions verticale et horizontale du plancton seront, en premier lieu, fonction des caractéristiques de son environnement. Fondamentalement anisotrope et instable, celui-ci s'organise en fonction des axes définis par la lumière et la gravité. L'habitat du plancton est ainsi dominé par les gradients verticaux que façonne et remanie en permanence le couple antagoniste des énergies physiques externes. L'énergie radiative génère périodiquement (journée, saison) et entretient une stratification thermique, un gradient densitaire et un gradient très aigu d'irradiance active pour la photosynthèse. L'énergie cinétique fournie par les vents érode de façon différentielle (plus activement en surface) le gradient densitaire et les structures associées, entraînant une redistribution partielle et irrégulière des substances dissoutes et des particules. L'écologie du petit plancton, et plus spécialement celle du phytoplancton, apparaît ainsi sous contrôle d'une hiérarchie de processus météorologiques qui module ce flux d'énergies externes (passage de nuages, fronts nuageux, coup de vent, dépression locale, tempêtes, etc.).
Quelle que soit la taille des plans d'eau, flaque temporaire ou bassin océanique, l'hétérogénéité spatiale et temporelle de l'environnement physique et chimique résultera, en premier lieu, des interactions entre réchauffement solaire et brassage par le vent. Deux types de processus physiques contribuent au brassage : la diffusion (où le déplacement des organismes dû à la turbulence s'effectue sans transport d'eau) et l'advection (où les organismes sont transportés par les mouvements horizontaux et verticaux de l'eau engendrés par courants). Le premier est chaotique, le second ordonné.
L'absorption et la diffraction de la lumière par les organismes en suspension accentuent le gradient vertical de lumière. En période de stratification, l'évolution la plus probable tendra donc vers une ségrégation entre les couches éclairées et celles riches en sels nutritifs.
Diverses adaptations permettent au phytoplancton d'adapter sa densité :
Accumulation de lipides : Une augmentation de la teneur en lipides tendra à réduire la densité des cellules algales.
Sécrétion de mucilage : Bien que formés par un réseau de polysaccharides de forte densité (environ 1,5), les mucilages sécrétés par les cellules phytoplanctoniques contiennent une quantité suffisante d'eau (hygrophilie) pour que leur densité avoisine 1.
Vacuoles à gaz : Rencontrés chez différentes espèces de Cyanobactéries, ces organites particuliers aux procaryotes peuvent réduire la densité cellulaire au point d'entraîner leur flottaison. Ceci explique la formation, par temps calme, de « fleurs d'eau » à la surface des lacs (Anabaena, Microcystis, etc.).
Adaptation de la forme des phytoplanctontes pour assurer leur flottabilité
Le coefficient de forme correspond au rapport entre la surface du corps et son volume. Lorsqu'il s'accroît, les forces de friction augmentent et la vitesse de chute diminue. De ce point de vue, les organismes planctoniques de petite taille seront favorisés.
La plupart des adaptations rencontrées tendent à augmenter ce coefficient grâce à l'acquisition de formes s'éloignant du modèle sphérique et à la présence d'excroissances corporelles, d'épines et de soies. L'association des cellules en colonie, qui s'observe au sein de nombreux groupes phytoplanctoniques, permet également aux espèces un contrôle de leurs propriétés hydromécaniques. Chez les Diatomées du genre Melosira, où les frustules des cellules filles forment des chaînes rectilignes, la réduction maximale de la vitesse de sédimentation est obtenue pour des regroupements de 5 à 6 cellules, ce qui correspond à la taille de colonie la plus fréquemment rencontrée en milieu naturel.
Capacité de déplacement des espèces mobiles
Seules les espèces phytoplanctoniques flagellées peuvent se déplacer activement dans les trois dimensions. Elles restent cependant d'un à deux ordres de grandeur trop faibles pour s'opposer aux courants induits par les vents.
Caractéristiques des espèces
On distingue plusieurs types d'espèces phytoplanctoniques :
— les espèces non motiles à flottabilité négative : Les Diatomées en fournissent un bon exemple qui, sous certaines conditions ambiantes défavorables, peuvent accroître leur vitesse intrinsèque de sédimentation. Ceci leur permet, durant la stratification estivale, d'atteindre rapidement les strates proches de la thermocline où les teneurs en éléments nutritifs demeurent plus élevées. Les populations adoptant cette stratégie encourent alors le risque de quitter la zone photique et de subir des pertes par sédimentation, éventuellement compensées par un taux de croissance élevé.
— les espèces non motiles à flottabilité neutre : l'isopycnie étant favorisée par l'apparition d'un fort gradient de densité dans le milieu ambiant, la flottabilité neutre n'a généralement qu'un caractère transitoire. Elle s'observe chez des espèces de petite taille (à faible vitesse de sédimentation) comme les Chlorococcales ou chez des formes de plus grande dimension mais possédant une enveloppe mucilagineuse.
— les espèces non motiles à flottabilité positive : cette catégorie, qui inclut quelques rares Diatomées, concerne essentiellement des Cyanobactéries planctoniques. Les organismes sont soumis aux mêmes contraintes que les formes à flottabilité négative mais, à la différence de celles-ci, auront tendance à flotter plutôt qu'à sédimenter lorsqu'ils rencontrent une strate stable. Cette propriété, complétée par l'aptitude des Cyanobactéries à pouvoir photosynthétiser à de faibles intensités lumineuses, leur permet de se développer à la base de la couche photique, où les nutriments sont abondants, sans risquer d'être irrémédiablement entraînées vers le fond. La flottation a cependant des effets pervers, les cellules concentrées en surface pouvant être entraînées par le vent et s'échouer sur le rivage. Le développement de ces fleurs d'eau en surface dépend de trois conditions : une forte concentration de cellules, un taux élevé de vacuolisation et des conditions externes favorables (vent faible, forte stabilité verticale : turbulence faible).
— les espèces motiles : on retrouve ici différents types d'algues vertes et de Chrysophycées, des Dinophycées et des Cryptophycées possédant un ou plusieurs flagelles. Ces espèces ne contrôleront leur position verticale que dans des conditions de brassage faible à modéré de la masse d'eau. Chez les Péridiniens, la turbulence peut devenir un facteur défavorable à la croissance voire, chez Peridinium cinctum, inhiber la division cellulaire. Ainsi, les espèces à flottabilité négative seront favorisées par un environnement relativement turbulent alors que les autres se développeront préférentiellement dans un environnement peu turbulent très stratifié. Seules les algues appartenant aux deux dernières catégories sont en mesure d'effectuer des migrations verticales.
Facteurs contrôlant la répartition verticale du phytoplancton
En un point donné de la masse d'eau, le contrôle de l'abondance phytoplanctonique (N) est assuré par le taux de croissance (m), l'intensité du broutage (g), l'abondance des herbivores (H), la vitesse de sédimentation des cellules (v), la profondeur (z) et le coefficient de diffusion turbulente (k) :
dN/dt = mN - gNH - v(dN/dz) + k(d2N/dz2).
(A) (B) (C) (D) (E)
(A) variation locale ; (B) croissance ; (C) broutage ; (D) sédimentation ; (E) dispersion.
Une population ne persistera à une profondeur donnée que si v2 < 4 m.k. Les accumulations de biomasse planctonique se développeront au niveau des strates où seront à la fois maximisée la croissance (quantités optimales de sels nutritifs et d'énergie lumineuse pour la photosynthèse) et minimisées les pertes résultant du broutage et/ou de la sédimentation.
De façon générale, la répartition verticale du phytoplancton sera ainsi conditionnée par les interactions de facteurs endogènes et exogènes. Les premiers concernent plus spécialement la flottabilité des cellules, leur vitesse de sédimentation et d'éventuelles migrations verticales actives, alors que les facteurs externes les plus importants sont le mélange turbulent et les gradients de lumière, de température et de sels nutritifs. Les fréquences de variations temporelles de ces facteurs exogènes seront plus spécialement déterminantes pour les termes m, v et k de l'équation précédente. Selon l'échelle temporelle considérée, les processus affectant l'organisation verticale de l'espace ne susciteront pas le même type de réponse de la part du phytoplancton. Des perturbations faibles ou rapides génèrent essentiellement des réponses physiologiques alors que des stimuli plus persistants, ou de plus grande amplitude, entraînent des réponses exprimées à des niveaux d'organisation et d'intégration de plus en plus élevés. Aux petites et moyennes échelles, les perturbations des gradients verticaux affectant la production primaire auront pour origine l'état de la surface de l'eau (photosynthèse stimulée par le scintillement provoqué par les vagues), la circulation de Langmuir (30 min.), le passage de nuages (heures), de fronts nuageux (quelques jours), les coups de vent, orages ou upwellings périodiques, etc.
Les profils de répartition observés peuvent ainsi varier de façon significative avec le temps, la profondeur du bassin et en relation avec les ségrégations physico-chimiques se produisant dans la colonne d'eau (thermocline, anoxie, etc.). Ces profils doivent donc nécessairement être considérés comme des instantanés d'un processus dynamique.
Trois grands types de répartition verticale sont observés :
— un maximum superficiel survenant durant la phase de développement printanier (mise en place de la stratification). Il peut s'étendre sur la totalité de la colonne d'eau (cas de bassins lacustres peu profonds), mais n'inclut généralement pas de pic très marqué de biomasse,
— un maximum qualifié, selon l'épaisseur de la couche euphotique, de sub-superficiel ou de profond. Il se développe en période de stratification dans la partie inférieure de cette zone et se situe le plus souvent à l'intérieur de la pycnocline, quelle qu'en soit la profondeur,
— une répartition irrégulière des faibles quantités de chlorophylle dans les couches supérieures, caractérisant des situations hivernales en hautes latitudes.
Migrations verticales journalières du phytoplancton
Comme vous l'avez remarqué, la production photosynthétique du phytoplancton requiert son maintien dans la couche euphotique. L'épaisseur de cette dernière dépend du degré de trophie du milieu et peut aller de quelques dizaines de centimètres, dans les lacs hypereutrophes, à près d'une centaine de mètres dans les lacs profonds très peu minéralisés (lac Tahoë, lac Baïkal). Bien qu'il paraisse, a priori, avantageux pour les espèces d'être capables de se déplacer rapidement dans les milieux où la couche photique est très épaisse, c'est paradoxalement dans les milieux où cette couche est réduite que s'observent des migrations verticales. En fait, en milieu oligotrophe, la biomasse algale est essentiellement constituée de petites espèces dans la mesure où les faibles teneurs en sels nutritifs favorisent les formes bénéficiant d'un rapport surface-volume élevé. Les espèces connues pour effectuer des migrations verticales sont, en général, de grande taille et sont plus répandues dans les eaux fertiles.
Les migrations verticales, observables chez les Cyanobactéries et les Flagellés, apparaissent comme un moyen de contrôle physiologique des cellules par des déplacements dans des habitats différents, au gré des fluctuations journalières ou saisonnières de l'environnement et de la disponibilité des sels nutritifs.
En milieu productif, lorsque la stratification verticale persiste assez long temps, il se produit une ségrégation spatiale entre la lumière et les sels nutritifs. La migration verticale apparaît comme une adaptation visant à satisfaire alternativement les besoins de ces espèces en lumière et en sels nutritifs (optimisation de la croissance). La répartition verticale diurne semble ainsi contrôlée par des besoins en lumière ne pouvant être satisfaits que dans les strates superficielles appauvries en phosphore, alors que la distribution nocturne répond à la nécessité d'aller absorber le phosphore dans les couches plus profondes où il s'accumule. Les migrations du phytoplancton paraissent ainsi faire office de « pompe » à sels nutritifs.
Cas des Cyanobactéries : L'aptitude à utiliser de faibles intensités lumineuses, combinée à la possibilité de modifier rapidement la flottabilité des cellules, autorise une large variété de réponses adaptatives :
— migrations verticales journalières,
— formation dans certains lacs d'une couche métalimnique dense et relativement stable bien que sujette à des oscillations journalières de profondeur : cas de Oscillatoria rubescens (comme dans le lac de Narlay dans le Jura) ou O. agardhii,
— migrations saisonnières, entre eau et sédiment, de formes méromictiques comme Microcystis aeruginosa.
Cas des Flagellés : Les Flagellés s'orientent principalement par phototactisme et sont capables de modifier rapidement leur position dans la colonne d'eau en réponse aux variations de lumière. Bien que les rythmes circadiens de migration soient les plus fréquents, des réponses géotaxiques pourraient également contrôler la répartition verticale du phytoplancton.
Les populations de Flagellés tendent à se concentrer en eau superficielle durant le jour et à se disperser en eau plus profonde durant la nuit. Un évitement des couches superficielles, avec légère redescente, peut se surimposer à ce patron durant la période la plus ensoleillée. Ainsi, par fortes insolations, les cellules de Ceratium hirundinella peuvent descendre et se concentrer dans des strates où l'irradiance avoisine 100 mE.m-2.s-1, ce qui correspond précisément à la quantité d'énergie radiative leur permettant une croissance optimale.
L'amplitude des migrations est de l'ordre de 5 à 7,5 m chez Cryptomonas ovata, Gymnodinium uberrimum et Mallomonas sp., de 8 à 1 m chez Peridinium cinctum, de 15 à 18 m chez Volvox sp. — grande espèce coloniale — avec une vitesse « record » de descente de 3,6 m.h-1. Conditionnés par les gradients verticaux des facteurs mésologiques, l'amplitude des migrations et le comportement migratoire, peuvent changer au cours de la saison.
Bonjour,
je suis étudiant dans une université du sud de la France. ma question est la suivante:
j'aimerai savoir les variations des différents éléments biogènes au cours d'une année dans un lac dimictique.
Cordialement.
Connaissez-vous un modèle thermique simplifié déjà écrit et utilisé pour un lac superficiel (5m max de profondeur, de surface 6000 ha max), donc sans stratification, pour lequel un maillage en deux dimensions serait suffisant et a priori "simple" à écrire en différences finies sur un tableur ?
(Retraité, je salue vos réponses aux plus jeunes)
Bonjour,
Je suis étudiant en hydrauique à Madagascar, j'étudie actuellement un lac, ou un étang de 33ha et de profondeur ne dépassant pas le 5m. Comme vous avez dit, la stratification thermique n'existe pas dans les lacs de faible profondeur alors je me demande comment expliquer le phénomène de brassage ou de convection de l'eau à l'entrée de la saison hivernale. En effet, pendant le mois de Mai (entrée de l'hiver chez nous), la qualité de l'eau change rend le traitement difficile (le lac est utilisé pour une production d'eau potable), il est très difficile voire même impossible d'obtenir de floc. Ce phénomène dure environ 1 mois ou 20 jours et la qualité revient naturellement à la normale et le traitement aussi
Je vous remercie d'avance Monsieur.
Mes propos concernent essentiellement les lacs et étangs du Jura. Une thermocline ne peut s'installer sous le climat de notre région dans les étangs de faible profondeur et le brassage passe inaperçu.
En zone intertropicale, en faible profondeur, le brassage des eaux qui dépend également du delta de température entre la saison chaude et la saison froide pourrait se produire si l'eau de surface se refroidit suffisamment.
Bonjour,
Merci pour votre dernière réponse
Vous avez dit que le brassage peut se produire dans le lac de faible profondeur si le gradient de température est suffisant. Pour le cas du lac que j'étudie, la profondeur max est environ 5m et la différence entre la température du fond et de la surface est environ 6°C; Est ce ces paramètres peut causer un brassage. Et si oui, comment apprécier la "puissance" du brassage. C'est à dire, est ce que le brassage peut emporter les dépôts au fond du lac et perturbe la qualité de l'eau.
Je m'excuse pour l'insistance et le détail et je vous remercie d'avance.
j'ai aimer votre travail et j'aimerai avoir des informations précises sur les lacs des pays tropicaux( parametres physico-chimiques; variations spatiotemporelles)
Bonjour,
En ce qui concerne les lacs tropicaux, consultez les travaux de spécialistes comme ceux de Christian Lévêque.
Bjr Franck, est ce que vous pouvez donner votre mail et je vous enverrai les paramètres. Juste une question pourquoi vous vous intéressez au lac tropical?
Bonjour,
Merci de vous intéresser au travail de Frank et de le conseiller.
Salut à vous, je suis jeune étudiant de 2 nd cycle universitaire, et j'aimerais rentré en contact avec quelqu'un qui s'y connaît en ce qui concerne les études des lacs, caractérisation et étude de la qualité de l'eau.
Bonjour,
Prenez contact avec la station de Limnologie de l'INRA de Thonon-les-Bains
Bonjour,
Je suis étudiante en gestion de l'eau et je travaille sur les bilans d'oxygène sur les plans d'eau.
Je voudrais avoir des informations sur les différentes méthodes d'évaluation des bilans d'oxygène pour les plans d'eau au niveau national et européen.
Je vous remercie d'avance.
Bonjour,
Votre demande est complexe et mériterait un long exposé, la teneur en oxygène de l'eau dépendant de nombreux paramètres : dissolution de l'O2 atmosphérique avec effet de la pression atmosphérique, de la température, de la pression hydrostatique, de la présence de différents éléments chimiques impliqués dans l'oxydo-réduction, de la balance entre photosynthèse et respiration des organismes aquatiques…
Je me bornerai à rappeler ici les principaux paramètres mesurant la teneur en oxygène : oxygène dissous, taux de saturation, DBO5, DCO.
Bonjour,
Je vous remercie pour votre réponse, en fait moi je travaille sur le développement d'un indice pour évaluer la qualité des eaux du point de vue oxygène des plans d'eau du bassin Loire-Bretagne, c'est un indice de saturation en oxygène pondéré par la profondeur.
Dans un premier temps, je devrais analyser les différentes méthodes utilisés au niveau européen pour qualifier l'état des plans d'eau concernant le paramètre oxygène dissous pour après essayer d’améliorer la formule de cet indice.
Voir également l'article suivant :
http://baladesnaturalistes.hautetfort.com/archive/2013/06/02/cycle-et-bilan-de-l-oxygene-en-milieu-aquatique.html
Bonjour,
Suite à une recherche de ma part sur des exemples de lacs holomictiques, je suis tombée sur votre article. J'aurai souhaiter avoir des éclaircissements car en lisant votre article, j'ai eu un doute sur la notion de lac amictique. En effet, vous dites que ces lacs peuvent geler alors que dans la 8ème édition de Dunod du Précis d'Ecologie, l'auteur Roger Dajoz définit les lacs amictiques comme: "Certains lacs tropicaux dont l'eau de surface est constamment à température élevée n'ont pas de cycle saisonnier de stratification".
Vu que je prépare un cours, je préférerai ne pas me tromper. Merci d'avance.
Bonjour,
Si l'on s'en tient à la classification thermique des lacs de Hutchinson & Loeffler (1956), les lacs amictiques ne présentent pas d'échanges thermiques appréciables entre air et eau. Cela est dû à la présence d'une couche permanente de glace en surface et une température constante et faible en dessous.
La définition de Dajoz correspond à celle de lacs oligomictiques dans lesquels l'eau est toujours chaude à toute profondeur et les périodes de circulation rares, courtes, irrégulières et réduites.
Bonjour,
je suis chercheur dans une universite de la RDC appele Shalom.
Mes recherches sont orientées depuis quelques années dans deux grands Lacs du rift albertin. Vos commentaires m’édifient plus.
Bonjour,
je suis chercheur dans une universite de la RDC appele Shalom.
Mes recherches sont orientées depuis quelques années dans deux grands Lacs du rift albertin. Vos commentaires m’édifient plus.
Les commentaires sont fermés.