En culture d'organes sur milieu anhormonal, les gonocytes évoluent spontanément en ovocytes. Pour obtenir des spermatozoïdes, il faut ajouter au milieu de culture du sang d'escargot en phase mâle. Le schéma de la sexualisation des gonocytes est le suivant : pas d'hormones : sexe femelle ; hormones : sexe mâle.
 L'Escargot (13) : culture de la gonade sur milieux enrichis
L'Escargot (13) : culture de la gonade sur milieux enrichis
par André Guyard
(Dernière mise à jour le 02/07/2015)
Nous avons vu que la gonade cultivée sur milieu anorganique est incapable d'une part de permettre la vittellogenèse dans les ovocytes autodifférenciés et, d'autre part, d'assurer la différenciation et la survie de la lignée mâle.
On peut attribuer ces résultats à une malnutrition, à une insuffisance hormonale ou à l'effet conjugué de ces deux carences. Pour étudier l'hypothèse d'un défaut trophique ou d'une carence hormonale au niveau de la gonade en culture isolée, on peut ajouter au milieu de culture des substances organiques susceptibles de contenir des facteurs actifs sur la gamétogenèse.
Milieux de culture enrichis de jus d'embryon de poulet
On ajoute au milieu anhormonal du jus d'embryon de poulet après huit jours d'incubation (ce qui correspond au milieu St (Standard) de Wolff et Haffen. À cet âge où le sexe de l'embryon n'est pas encore différencié, l'existence d'hormones sexuelles est peu probable bien que leurs précurseurs aient pu être mis en évidence.
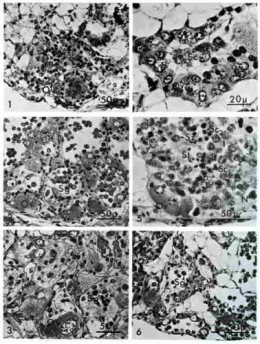
Dans les cultures de gonade juvénile sur milieu St, la survie des gonocytes est considérablement améliorée. Sans repiquage, les cultures se maintiennent pendant cinquante jours. Les spermatogonies préexistant dans la lumière des tubules sont capables d'amorcer quelques divisions mais au bout de 9 jours de culture, elles entrent en auxocytose (accroissement) (Fig. 1). Mais les spermatocytes se pycnosent et disparaissent au bout de 20 jours de culture (Fig. 2). Cependant, quand la multiplication spermatogoniale est bien engagée au moment de l'explantation, elle peut se poursuivre pendant plus d'un mois (Fig. 3).
Action d'adjuvants organiques
sur la différenciation gonocytaire
(électronographie. Légende : voir texte)
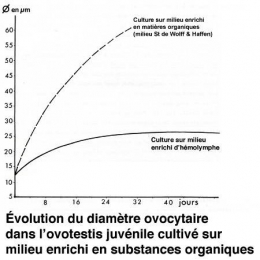
La lignée femelle évolue sur ce milieu selon les lois de l'autodifférenciation ovocytaire. De jeunes ovocytes se développent sur les parois. Quand les ovocytes sont déjà présents à l'explantation, l'accroissement cellulaire est considérable, et au bout de 15 jours, on rencontre des ovocytes de 60 µm de diamètre, dimension portée à 80 µm après un mois de culture Fig. 2 et 3). Mais jamais la vitellogenèse ne s'installe dans tout ovocyte prévitellogénétique introduit en culture.
Ainsi, un liquide riche en matières organiques comme le jus d'embryon de poulet constitue un adjuvant qui permet une survie plus longue et un début de différenciations des deux lignées gamétiques. Ce résultat montre l'importance des facteurs trophiques dans la réalisation de la gamétogenèse.
Milieux de culture enrichis d'hémolymphe d'Escargot
On peut ponctionner à l'aide d'une aiguille hypodermique stérile l'hémolymphe d'escargots adultes au niveau de la veine pulmonaire. Au contact de l'air, l'hémocyanine prend une coloration bleue. Recueillie dans des ampoules, l'hémolymphe est immédiatement lyophilisée et sera incorporée en toute saison aux milieux de culture. Cette technique nous permet de tester les capacités de l'hémolymphe prélevée au cours du cycle reproductif annuel de l'Escargot. On a pu constater que seule l'hémolymphe d'hiver (prélevée sur des adultes après accouplement) était active sur la gamétogenèse.
L'adjonction d'hémolymphe d'hiver à un milieu supportant une gonade indifférenciée ou en phase mâle entraîne un accroissement de l'indice mitotique et l'apparition de phénomènes méiotiques, non seulement dans les ovocytes mais également et surtout dans la lignée mâle où les spermatogonies après s'être métamorphosées en spermatocytes I amorcent la prophase de méiose après une semaine de culture (Fig. 4) Tout se passe comme si la gonade était restée en place dans l'organisme. On retrouve les mêmes images que celles décrites in vivo chez des animaux de cette taille à la même saison.
L'adjonction d'hémolymphe d'hiver permet de conduire la spermatogenèse d'ovotestis juvéniles à son terme au bout d'un mois. La phase mâle subit les phénomènes de réduction chromatique, s'engage dans la spermiogenèse et, après 24 jours de culture, on aperçoit les spermatides évoluer en spermatozoïdes (Fig. 5 et ci-dessous).
Après avoir atteint un diamètre de 22 µm, les ovocytes n'évoluent plus. Leur accroissement est inhibé (voir diagramme ci-dessus).
L'hémolymphe d'été (prélevée sur des adultes après accouplement) se révèle peu active sur la différenciation des lignées gamétiques et a un effet comparable à celui du jus d'embryon de poulet (Fig. 6).
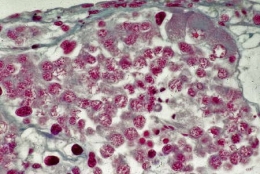
Gonade juvénile après 24 jours de culture sur hémolymphe
On note 3 ovocytes sur la paroi en haut à droite.
Les spermatocytes sont engagés dans la méiose
jusqu'au stade spermatides évoluant en spermatozoïdes.
Interprétation de ces résultats
Trois hypothèses sont à envisager :
1. Le principe actif sur la spermatogenèse dans l'hémolymphe d'hiver est absent de l'hémolymphe d'été.
2. La gonade elle-même a une réceptivité différentielle selon la saison à un principe constamment présent dans le milieu intérieur.
3. Les mécanismes de biosynthèse du principe actif sur la spermatogenèse sont présents dans les deux cas mais ne peuvent s'exprimer dans l'hémolymphe d'été en l'absence d'un principe jouant le rôle d'un facteur limitant.
Le fait que l'hémolymphe d'hiver d'animaux adultes accélère considérablement la maturation de la lignée mâle dans l'ovotestis juvénile constitue un argument de poids à l'appui de la première hypothèse. La gonade, quel que soit son âge, impubère ou mature, est réceptive à l'action de l'hémolymphe d'hiver. Seule l'hémolymphe d'hiver contiendrait les principes favorisant la lignée mâle. Ces facteurs disparaîtraient du milieu intérieur après le démarrage de la lignée mâle pour permettre à la lignée femelle, jusqu'alors inhibée de s'autodifférencier et d'évoluer. On peut donc envisager qu'il s'agît d'un agent hormonal dont la sécrétion varie en fonction de la saison.
Il reste donc à identifier l'organe ou le tissus responsable de l'action gonadotrope.
Travaux récents sur la spermatogenèse in vitro (Ajout du 01/07/2011)
En 2011, des biologistes japonais ont réussi à fabriquer du sperme de mammifères in vitro.
En utilisant un milieu de culture jusque-là réservé à la conservation de cellules embryonnaires de mammifères ou à la culture d'organes (le KSR), au lieu du milieu classique (le sérum de bœuf fœtal), des biologistes japonais sont parvenus, pour la première fois, à obtenir des spermatozoïdes matures à partir de cellules extraites de testicules de souriceaux, parfois préalablement congelés, et cultivées in vitro.
"Depuis les années 1970, aucun des essais de spermatogenèse in vitro n'avait utilisé ce milieu", explique Takehiko Ogawa, l'un des biologistes de l'université japonaise de Yokohama à l'origine de cette prouesse. L'équipe a réussi là où les autres achoppaient : passer le stade de la méiose, étape où les spermatocytes divisent par deux leur nombre de chromosomes. Non seulement les spermatozoïdes ainsi obtenus sont fonctionnels, mais, en plus, une fois inséminés, ils ont permis la naissance de plusieurs portées de souris. Un exploit à reproduire chez l'Homme pour une utilisation thérapeutique de la stérilité induite par une chimiothérapie.
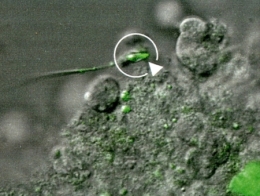
Spermatozoïde (flèche) produit in vitro
par l'équipe japonaise © T. Ogawa
Travaux récents sur la spermatogenèse in vitro (Ajout du 2 juillet 2015)
Kallistem, une société de biotechnologie française, assure avoir obtenu in vitro des spermatozoïdes à partir de spermatogonies prélevées dans les testicules d'un homme. Depuis une quinzaine d'années, plusieurs tentatives n'avaient jamais abouti à la formation de spermatides.
Une étape qui semble aujourd'hui dépassée grâce à un bioréacteur et à un nouveau procédé de culture cellulaire dont seule Kallistem a le secret. Résultat : des spermatozoïdes complets obtenus en soixante-douze jours, soit la durée d'un cycle normal de spermatogenèse humaine. Il reste à prouver que ces spermatozoïdes sont fonctionnels, efficaces pour la fécondation, et qu'ils mènent à des êtres en bonne santé.
Des travaux précliniques sont prévus dès 2016. Si la spermatogenèse in vitro est validée, cette technique permettra aux hommes dépourvus de spermatozoïdes mais possédant des spermatogonies d'avoir des enfants, ainsi qu'à ceux ayant subi des traitements toxiques avant la puberté (par exemple, contre un cancer) et dont le tissu testiculaire avait été congelé.
Sources
- Guyard A. (1971) - Étude de la différenciation de l'ovotestis et des facteurs contrôlant l'orientation sexuelle des gonocytes de l'Escargot Helix aspersa Müller. Thèse d'État soutenue à la Faculté des Sciences de l'Université de Franche-Comté.
- Documents inédits tirés de la photothèque personnelle de André Guyard.



Les commentaires sont fermés.