Cycle et bilan de l'oxygène en milieu aquatique
16/06/2010
par Guy BARROIN
INRA, station de Thonon les Bains
1. L'oxygène, un précieux déchet
Dans un univers essentiellement composé d'hydrogène, règle à laquelle ne déroge pas le système solaire, la présence d'oxygène libre en abondance dans l'atmosphère terrestre constitue une anomalie. La plus ancienne source d'oxygène terrestre a été la photolyse de la vapeur d'eau par les radiations solaires les plus énergétiques (λ < 200 nm). Strictement abiotique, cette réaction produit également de l'hydrogène qui s'échappe vers l'espace ; actuellement elle est localisée dans la haute atmosphère et sa contribution est parfaitement négligeable. Une autre source, tout aussi négligeable, est la photolyse de l'oxyde nitreux qui provient de la dénitrification bactérienne.
Il reste que la quasi totalité de l'oxygène atmosphérique est une conséquence directe de l'activité photosynthétique des organismes vivants, terrestres ou aquatiques. Ceux-ci utilisent l'eau comme donneur d'électrons pour réduire le gaz carbonique en matière organique, réaction de synthèse dont l'oxygène moléculaire est le sous-produit. L'accumulation de ce déchet métabolique est d'un intérêt tout particulier pour les organismes aérobies, végétaux et animaux. Consommé en permanence par les uns comme par les autres, il n'est produit que par les végétaux sous réserve qu'il y ait assez de lumière et de sels nutritifs.
Abondant dans l'air, sa disparition totale n'y est qu'un phénomène local et rare. En revanche, dans l'eau, où sa concentration n'excède pas 5% de ce qu'elle est dans l'air, il en est tout autrement. S'il n'est pas renouvelé, ce qui arrive fréquemment dans les écosystèmes limniques, l'oxygène finit par être totalement consommé par les phénomènes de respiration et de décomposition.
Le fait que la plus totale anoxie puisse s'installer aussi aisément concerne en premier lieu tous les organismes à respiration aérobie, influençant leur distribution, leur comportement et leur croissance physiologique, quelle que soit l'étape de leur développement. Mais la concentration en oxygène affecte aussi très fortement la solubilité de nombreuses substances et par conséquent la disponibilité des nutriments et des composés toxiques, ce qui n'est pas sans conséquence sur la biocénose.
Il n'est donc pas étonnant que l'oxygène soit, après l'eau, bien entendu, le constituant le plus fondamental et le paramètre le plus étudié des écosystèmes limniques.
2. Les termes du bilan
2.1 Un bilan en perpétuel déséquilibre
Fondamentalement, la présence de l'oxygène dans l'eau, régie par la solubilité de l'oxygène atmosphérique, tend à un certain équilibre. Elle détermine, entre autres, les états et les processus d'oxydo-réduction auxquels participent finalement peu d'éléments : C, N, O, S, Fe, Mn. Dans une eau en équilibre avec l'oxygène atmosphérique, tous ces éléments devraient théoriquement exister sous leur état d'oxydation le plus élevé : CO2, HCO3- ou CO32- pour le carbone, NO3- pour l'azote, SO42- pour le soufre, FeOOH ou Fe2O3 pour le fer et MnO2 pour le manganèse. En fait, il n'en est rien : dans une eau qui contient de l'oxygène dissous on trouve communément du carbone à l'état de matière organique et de l'azote à l'état de gaz N2. C'est que la présence d'un élément est moins le reflet exact d'un équilibre statique que la résultante d'un ensemble de réactions d'oxydo-réduction et de processus de diffusion et de mélange aux vitesses fort différentes.
En ce qui concerne les réactions d'oxydo-réduction, la situation de déséquilibre est entretenue par deux types d'activité. D'une part, l'activité photosynthétique qui, piégeant l'énergie lumineuse pour la convertir en énergie chimique, produit de la matière organique, véritable accumulateur d'états réduits. D'autre part l'activité respiratoire et minéralisatrice de tous les organismes, à commencer par celle des organismes non-photosynthétiques, qui tend à rééquilibrer la situation en catalysant l'oxydation de cette matière organique et en utilisant l'énergie ainsi libérée pour maintenir en vie les cellules en place et pour en synthétiser de nouvelles.
Finalement, la situation d'équilibre à laquelle l'oxygène aboutirait sous la seule contrainte de lois physiques est perpétuellement remise en question par la photosynthèse, par la respiration, la décomposition ainsi que par quelques réactions chimiques.
2.2 La dissolution de l'oxygène atmosphérique
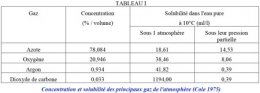
L'air est un mélange de gaz qui contient environ 20,95% d'oxygène en volume (tableau 1). Quand l'air est au contact de l'eau, celle-ci dissout une certaine quantité d'oxygène en fonction des caractéristiques intrinsèques de solubilité du gaz mais aussi en fonction des conditions de milieu qui règnent dans l'atmosphère (pression atmosphérique, humidité) et dans l'eau (température, pression hydrostatique, salinité).
Effet de la pression atmosphérique
D'après la loi de Henry, à l'équilibre et à une température donnée, la concentration en oxygène dissous de l'eau est proportionnelle à sa pression partielle dans la phase gazeuse.
À 10°C et sous 1 atm. (760 mm de Hg), 1 litre d'eau pure en contact avec de l'oxygène pur en dissout 38,46 ml (54,94 mg).
Mis en contact avec de l'air sec, il n'en dissout plus que 38,46 x 0,2095 soit 8,06 ml (11,51 mg), 0,2095 atm. représentant la pression partielle d'oxygène dans l'air (20,95% d'oxygène) sous 1 atm. (tableau I).
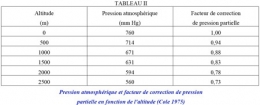
Comme la pression atmosphérique diminue avec l'altitude et varie avec les conditions météorologiques, il en est de même de la pression partielle, donc de la solubilité de l'oxygène. À 2000 m d'altitude, l'eau pure contient 22% d'oxygène en moins qu'au niveau de la mer à température égale (tableau II). Une chute de la pression atmosphérique de 30 mm de Hg entraîne une diminution de solubilité d'environ 4%.
Effet de la température
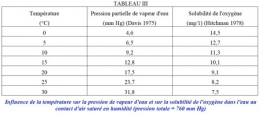
La solubilité des gaz diminue avec la température, mais la détermination précise de la solubilité de l'oxygène dans l'eau n'a pas été une opération facile. Depuis la fin du XIXe siècle, de nombreux chercheurs s'y sont employés, obtenant des résultats dont les discordances résultèrent autant du manque de fiabilité des méthodes de dosage que de la diversité des conditions expérimentales, notamment de l'humidité de l'air. En effet, si l'air est humide, c'est-à-dire comme dilué par de la vapeur d'eau, la pression partielle de l'oxygène doit être calculée par rapport à la pression barométrique diminuée de la pression partielle de vapeur d'eau, cette dernière augmentant avec la température d'environ 1 mm de Hg/°C (tableau 3). Les standard methods (1971) donnent la formule :
OD =(P-u). 0,678 / (35 + t)
OD = oxygène dissous (mg.l-1)
P = pression barométrique (mm Hg)
u = pression de vapeur d'eau saturante (mm Hg)
t = température (°C) valable pour 0°C < t < 30°C.
Une autre formule, plus simple, valable pour 4°C < t < 33°C, au niveau de la mer, à ± 0,04 mg.l-1 est proposée par Montgomery et al (1964) :
OD = 468 / (31,6 + t)
Hitchman (1978) finit par dresser un tableau à partir de la moyenne des résultats obtenus par 11 auteurs différents (tableau III).
Compte tenu de ces difficultés, Monod et al. (1984) estiment plus prudent de ne pas garantir la seconde décimale.
Effet de la pression hydrostatique
Tout dépend si l'oxygène est évalué en termes de pression partielle ou en termes de solubilité. La pression partielle augmente avec 1a profondeur : par 10 000 m de fond, elle est 3,55 fois celle de la surface, à température égale. Par contre la solubilité est indépendante de la pression hydrostatique dans l'eau pure et diminue légèrement dans l'eau salée : par 10 000 m de fond dans une eau salée de densité 1,023, elle est inférieure de 3% à celle de la surface à température égale. Pratiquement, si l'on évalue la concentration en oxygène par voie titrimétrique, il n'y a pas lieu de tenir compte de la pression hydrostatique. Par contre, si l'on utilise une sonde à oxygène, qui mesure la pression partielle, il faut effectuer une correction qui atteint -5% pour 400 m de profondeur (Hitchman 1978).
Effet de la salinité
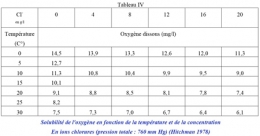
Les sels minéraux dissous dans l'eau ont pour effet de diminuer légèrement la pression de vapeur d'eau saturante et par conséquent la solubilité de l'oxygène (tableau IV). La diminution de cette dernière est exponentielle et atteint presque 20% pour une eau de mer de densité 1,035. On peut négliger le phénomène en eau douce, mais il peut avoir son intérêt en eau salée ou même saumâtre.


Les commentaires sont fermés.