Les cellules souches pluripotentes induites (iPS)
10/10/2013
 Les cellules souches pluripotentes induites (iPS)
Les cellules souches pluripotentes induites (iPS)
par Hervé Ratel
journaliste scientifique
(Sciences et Avenir n° 794, avril 2013, pp. 66-68)
(dernière mise à jour : 28 février 2014)
Le sigle iPS désigne les cellules souches pluripotentes induites, c'est-à-dire des cellules adultes rajeunies au stade embryonnaire. Un stade où elles sont capables de donner n'importe quel type de cellule de l'organisme (pluripotence). Les iPS ouvrent des perspectives majeures dans le traitement de nombreuses maladies incurables. Les premiers essais vont commencer au Japon.
Rajeunir les cellules, c'est la prouesse annoncée par ce simple sigle : iPS. Ce terme désigne les cellules souches pluripotentes induites, soit des cellules adultes reprogrammées jusqu'au stade primitif de cellules embryonnaires. Pour nombre de scientifiques, la révolution annoncée est comparable à celle des vaccins ou des antibiotiques en leur temps. Mise sous les projecteurs en octobre 2012 avec le prix Nobel décerné à leur découvreur, le Japonais Shinya Yamanaka (voir Sciences et Avenir n° 789, novembre 2012), ces cellules iPS sont en effet susceptibles de rendre d'immenses services dans le domaine des greffes de tissus, de faciliter la mise au point de médicaments pour des maladies génétiques et d'élucider certains mécanismes du cancer. Un comité d'éthique japonais a d'ailleurs donné son feu vert pour de premiers essais cliniques qui devraient débuter dès le mois d'avril 2013.
Diagramme © Institut Pasteur
Dans la course mondiale qui démarre, la France est bien placée. "Elle pourrait prendre la tête d'un consortium chargé de piloter un projet de banque européenne de cellules iPS. Celui-ci sera finalisé d'ici à la fm de cette année", pronostique Annelise Bennaceur-Griscelli (Inserm), qui coordonne la plate-forme nationale de cellules souches Ingestem, rassemblant plusieurs laboratoires de l'Hexagone.
Pourtant, les chercheurs français reviennent de loin ! En cause : la loi de bioéthique de 1994 - révisée en 2004 - qui interdit toute recherche sur les cellules souches embryonnaires humaines (CSEh). Ces dernières - qui ne sont pas des iPS - nécessitent en effet d'avoir directement recours à des embryons surnuméraires issus de fécondations in vitro. « Pour obtenir une dérogation les autorisant à travailler sur les CSEh, les chercheurs devaient remplir des documents faisant plusieurs dizaines de pages, raconte Frank Yates, enseignant-chercheur à l'école Sup'Biotech de Paris. Il fallait par exemple décrire à l'avance - exercice impossible et absurde les progrès médicaux attendus des expériences envisagées... Certains baissaient les bras ou s'exilaient à l'étranger devant ce cauchemar bureaucratique.» D'autres pays comme le Royaume-Uni, ont une réglementation moins restrictive, plus en phase avec la recherche fondamentale.
Les scientifiques abasourdis par ces résultats
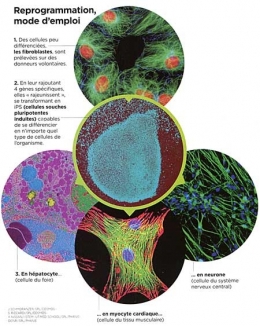
La découverte des iPS en 2006 est donc venue bouleverser la donne puisque ces cellules ne nécessitent comme matériel de départ que des cellules adultes déjà différenciées, prélevées sur des donneurs consentants. Lors de leur découverte annoncée en 2006 dans la revue Cell c'est pourtant le scepticisme qui avait dominé parmi la communauté scientifique. « J'ai eu la chance d'assister à la première conférence du PrYamanaka sur le sujet, se remémore Frank Yates. Quand il a présente ses résultats, tout le monde était abasourdi. Parvenir à reprogrammer une cellule paraissait totalement improbable. » Improbable parce que cette découverte réduisait à néant l'un des dogmes majeurs de la biologie : une cellule différenciée, comme une cellule musculaire, ne pouvait pas se transformer en une cellule d'un autre type, une cellule hépatique par exemple. Pourtant, il n'a pas fallu longtemps pour que les résultats du chercheur japonais soient reproduits et confirmés par d'autres équipes de biologistes cellulaires à travers le monde. Les cellules iPS étaient bel et bien une réalité.
Pour comprendre, il faut revenir à l'intuition de génie de Shinya Yamanaka : le chercheur a voulu savoir ce qui se passerait si on transférait des gènes actifs uniquement au stade embryonnaire, dans une cellule différenciée adulte. Pour mener l'expérience, il a, avec son équipe, identifié dans un premier temps 24 gènes de ce type, avant de restreindre la sélection à 4 d'entre eux (Oct4, Sox2, Klf4 et c-Myc). Et ça a marché ! Les cellules adultes ont "remonté le temps" jusqu'à redevenir des cellules indifférenciées. Mais cette recette est évidemment bien plus délicate à mettre en œuvre. Et elle ne fonctionne pas à tous les coups : « Dans le meilleur des cas, le taux de conversion de cellules adultes en iPSn'excède pas 5 % », précise Jean-Marc Lemaitre (Inserm, Montpellier). De très nombreux obstacles restent donc à franchir avant de trouver des applications directes aux iPS.
Un travail de culture astreignant fait à la main
La première difficulté consiste à obtenir ces fameuses iPS en quantités suffisantes. Car développer une lignée, c'est un peu comme réussir un soufflé : les ingrédients sont peu nombreux, mais rien n'est possible sans un bon tour de main, du doigté et de la patience. Une fois une iPS obtenue au bout de quelques jours, il faut en effet absolument éviter qu'elle ne se différencie à nouveau et ne redevienne une cellule adulte. Comment ? En veillant en permanence à séparer les iPS nouvellement créées du reste de leurs consœurs encore à l'état différencié dans la boîte de Pétri, ces récipients où l'on cultive les cellules en laboratoire. Un travail astreignant qui, aujourd'hui, se fait encore manuellement. Trois semaines de culture sont nécessaires pour obtenir une colonie et il faut plusieurs mois avant que cette colonie compte quelques milliers de spécimens. « De plus, les cellules iPS sont très sensibles et capricieuses. Il faut les surveiller 24 h/24 », explique Lina El Kassar. Tous les trois mois, cette biologiste de l'I-Stem au Génopole d'Evry, dans l'Essonne, accueille ainsi des chercheurs dans son atelier pour leur transmettre son savoir-faire. À l'issue du stage, chacun repart avec ses propres lignées d'iPS sur lesquelles il peut poursuivre ses travaux de recherche. Une initiative fructueuse qui a permis de former rapidement à la culture des iPS quantité de biologistes français, contribuant au bon positionnement de la France.
Autre difficulté : les iPS souffrent de défauts épigénétiques. En effet, la cure de jouvence qu'elles subissent ne parvient pas à remettre parfaitement tous les compteurs biologiques à zéro. Ainsi, les iPS - à l'inverse des CSEh, les cellules souches embryonnaires humaines - conservent de petites « étiquettes » à la surface de leurs gènes indiquant toujours leur signature de cellules adultes. Autrement dit, vues sous l'angle épigénétique, les iPS n'ont que l'apparence de cellules embryonnaires. En profondeur, elles demeurent de "vieilles" cellules. « Que ce soit pour unefuturemédecine régénératrice ou comme modèle in vitro d'une pathologie, ces désordres épigénétiques doivent êtrepris en compte, explique Marc Peschanski, directeur scientifique de l'I-Stem. Il faudra vérifier au préalable qu'ils ne constituent pas une nuisance.» Car le risque que des iPS souffrant de tels défauts deviennent cancéreuses n'est pas à écarter.
Obtenir des cellules souches pluripotentes par balnéation acide ? (janvier 2014) (Sciences et Avenir n° 805, mars 2014, p. 23)
Plonger des cellules dans un bain légèrement acide est-il de nature à les stresser suffisamment pour les transformer en cellules souches comme le proclame l'équipe de Haruku Obokata, du centre Riken, à Kobe ?
Depuis la publication fin janvier dans les colonnes de Nature du travail des Japonais, des critiques n'ont pas tardé à apparaître sur Internet, et plusieurs équipes dans le monde ont tenté de reproduire ces résultats, pour l'instant, la moisson n'est pas fameuse.
Selon le décompte du site Ipscell, sur dix tentatives, une seule s'est révélée fructueuse, et encore avec une production très modeste. « J'aurais tendance à classer ce résultat des Japonais dans les artefacts de culture, avoue Frank Yates, enseignant-chercheur à Sup'Biotech. Intuitivement, nous sommes beaucoup à penser que s'il était aussi simple d'obtenir des cellules souches, nous y serions arrivés bien avant par accident... »
Irrégularités méthodologiques, fraude délibérée, erreurs de manipulation ou travail scientifique révolutionnaire de nature à changer la face des biotechnologies ? La réponse définitive viendra sous peu, à la fin des investigations scientifiques de rigueur.
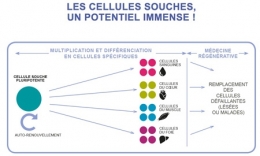
Des champs d'application très larges
Étudier une maladie.
En prélevant des cellules sur un malade, les iPS permettent de suivre le développement d'une cellule affectée d'une mutation. Ce qui était impossible avec les CSEh, car il faut disposer d'embryons porteurs de la pathologie.
Mieux comprendre le cancer.
En suivant le devenir d'une cellule à partir de son stade embryonnaire, les chercheurs espèrent élucider les mécanismes conduisant aux processus tumoraux et notamment les métastases.
Concevoir de nouveaux médicaments.
Les iPS doivent permettre à terme détester facilement l'effet de molécules potentiellement intéressantes pour bon nombre de maladies. Cette recherche est actuellement au point mort.
Élaborer une médecine régénératrice.
C'est l'objectif ultime : pouvoir remplacer des neurones, des cellules musculaires, un épiderme, etc. à partir de cellules suffisamment proches du système immunitaire du malade. Voir également sur ce même blog les articles : cellules souches et rajeunissement, des cellules souches dans la rétine, régénération de la rétine humaine, élaboration d'une rétine humaine en culture à partir de cellules souches, obtenir des neurones à l'aide de fibroblastes, créer des dents biologiques grâce à des cellules souches,
L'industrie pharmaceutique n'est pas prête à investir
Les espoirs se tournent plutôt vers la constitution de banques de cellules iPS qui seraient immunologiquement compatibles avec la majeure partie d'une population donnée : Européens, Asiatiques, etc. Soit des banques ethniques qui risquent de faire grincer bien des dents... D'autant que les firmes pharmaceutiques ne semblent pas décidées à participer à la constitution de telles banques. « Culturellement, les industriels de la pharmacie sont des chimistes, pas des biologistes, justifie Marc Peschanski. Ils ont encore du mal à travailler avec du matériel vivant. » Un avis partagé par Laurence Daheron, responsable de la plate-forme iPS/CSEh à l'université Harvard (Cambridge. États-Unis) : « L'industrie pharmaceutique commence tout juste à entrevoir le potentiel des iPS. Elle est loin d'être prête à s'investir dans la thérapie cellulaire. Il n'y a aucun changement radical à attendre de sa part pour les années à venir. Elle se contentera d'utiliser les iPS pour rester des médicaments classiques, rien de plus. »
Pourtant, tout porte à croire que le jour où la recherche publique aura prouvé le potentiel thérapeutique des iPS, la demande de millions de patients en attente d'un traitement sera suffisamment pressante pour forcer la main des industriels. Il reste juste à espérer que ces derniers auront alors la capacité de prendre le train en marche...
S'affranchir des manipulations fastidieuses in vitro en produisant in vivo des cellules souches pluripotentes induites (iPS)
Dans un article de Nature paru le 11 septembre 2013, des chercheurs espagnols sont parvenus à reprogrammer « in vivo » des cellules adultes de souris. Cette technique permet donc de s'affranchir des fastidieuses et coûteuses mises en culture des cellules adultes !
Le premier défi pour les chercheurs du Centre national de recherche sur le cancer (CNIO, Madrid) était de reproduire l'expérience de Yamanaka chez un être vivant. Ils ont choisi la souris comme organisme modèle. En utilisant des techniques de manipulation génétique, les chercheurs ont créé des souris dans lesquelles quatre gènes de Yamanaka pouvaient être activés à volonté. Lorsque ces gènes sont activés, les chercheurs ont observé que les cellules adultes étaient capables de régresser dans leur développement évolutif pour devenir des cellules souches embryonnaires dans plusieurs tissus et organes
En outre, l'équipe de Manuel Serrano a ainsi obtenu des cellules souches de meilleure qualité que celles produites in vitro. C'est un résultat spectaculaire : faire en sorte que des souris fabriquent des cellules souches pluripotentes induites, capables de fournir quasiment n'importe quelle cellule spécialisée de l'organisme. Autrement dit, qu'au sein d'un animal vivant des cellules adultes redeviennent des cellules souches embryonnaires ! Reprogrammer in vivo des cellules est désormais possible. La démonstration chez l'animal de la faisabilité d'un tel concept pourrait bouleverser la pratique de la future médecine régénératrice.
Les chercheurs espagnols ont ainsi franchi une nouvelle étape, en obtenant les mêmes résultats que Yamanaka, mais cette fois au sein du même organisme, chez la souris, sans avoir besoin de passer à travers dans des boîtes de culture in vitro. La génération de ces cellules dans un organisme apporte cette technologie encore plus proche de la médecine régénérative.
L'étape du laboratoire sera ainsi supprimée. Jusqu'à présent, on imaginait que pour greffer ces cellules iPS à un malade souffrant de diabète insuline-dépendant, d'insuffisance cardiaque ou de la maladie de Parkinson, il fallait au préalable les produire en passant par des manipulations sophistiquées et coûteuses en laboratoire. Le travail réalisé par l'équipe de Manuel Serrano bouleverse ce protocole : il sera possible d'induire la production de ces précieuses cellules souches au sein même du tissu ou de l'organe à réparer sans passer par l'étape du laboratoire. Une fois ces iPS produites par le patient, elles seraient amenées à se différencier en un type cellulaire particulier, en cellule du pancréas, du cœur, en neurone, par exemple.
Comme indiqué au début de cet article, pour reprogrammer des cellules adultes (de peau notamment) en cellules souches, il faut y introduire quatre gènes clés (Oct4, Sox2, Kfl4 et c-Myc). Ceux-ci produisent quatre facteurs de croissance jouant un rôle dans les premiers temps du développement embryonnaire. Les cellules adultes ainsi reprogrammées, dénommées iPS, sont capables de « remonter le temps » jusqu'au stade embryonnaire.
Cette technique de production, mise au point en 2006, a d'ailleurs valu le prix Nobel de médecine en 2012 au Japonais Shinya Yamanaka. Les chercheurs espagnols sont allés plus loin : l'organisme de leurs souris transgéniques fabrique lui-même ces quatre facteurs de croissance. Pour activer les quatre gènes, ils ont fait boire aux rongeurs de l'eau contenant de faibles doses d'un antibiotique : la doxycycline. Résultat : au bout de deux semaines et demie, les rongeurs ont développé des tumeurs (tératomes,) issues de cellules souches pluripotentes et contenant plusieurs types cellulaires adultes. Preuve manifeste pour les chercheurs que des cellules adultes de ces rongeurs avaient bien été reprogrammées en iPS avant qu'elles ne se transforment, à leur tour, et en divers endroits, en plusieurs types cellulaires. Par ailleurs, l'analyse de tissus de l'estomac, de l'intestin, du pancréas et des reins des rongeurs a montré la présence disséminée d'une reprogrammation cellulaire in vivo. De même, les chercheurs ont détecté la présence d'iPS dans le sang des souris qui avaient été reprogrammées pour en fabriquer.
Ces cellules iPS sont d'une qualité supérieure
Une autre surprise attendait les chercheurs : les cellules iPS produites chez ces souris et obtenues directement à partir de l'intérieur de l'organisme, ont une plus grande capacité de différenciation que ceux obtenus par culture in vitro. Plus précisément,ces ceklules ont les caractéristiques des cellules totipotentes, un état primitif jamais obtenu dans un laboratoire.
En effet, outre leur capacité à se transformer en n'importe quel type de cellule d'un embryon, elles ont pu se différencier en placenta. Ce résultat étonnant fait dire aux chercheurs que ces iPS obtenues in vivo sont à un stade encore plus précoce que les iPS produites en laboratoire. Il est évidemment hors de question d'utiliser une procédure semblable chez l'Homme, dans la mesure où les cellules reprogrammées risqueraient de former des tumeurs. En revanche, une stratégie de régénération in vivo pourrait, dans l'avenir, consister à administrer au malade, localement et pendant un temps limité, des gènes synthétiques codant les quatre facteurs de croissance identifiés par le prix Nobel Shinya Yamanaka.
D'autres pistes sont à l'étude comme administrer, au sein d'un organe ou d'un tissu malade, un cocktail de petites molécules capables d'activer le programme génétique de production de cellules iPS ou utiliser des virus rendus inoffensifs pour délivrer les quatre fameux gènes clés.
María Abad, le principal auteur de l'article et chercheur dans le groupe de Serrano, a déclaré: "Ce changement de direction dans le développement n'a jamais été observé dans la nature, nous avons démontré que nous pouvons également obtenir des cellules souches embryonnaires dans les organismes adultes et pas seulement en. le laboratoire ".
"Nous pouvons maintenant commencer à penser à des méthodes pour induire la régénération localement et de manière transitoire pour un tissu endommagé particulier.", précise Manuel Serrano.
Les cellules souches obtenues chez la souris montrent également des caractéristiques totipotentes jamais produites dans un laboratoire, équivalentes à celles présentes dans les embryons humains au stade de 72 heures de développement, quand ils sont composés de seulement 16 cellules.
En comparaison avec les cellules obtenues avec la technique développée par Yamanaka, les cellules souches obtenues par le CNIO représentent donc un état encore embryonnaire plus précoce, avec une plus grande capacité de différenciation.
Les auteurs ont même été capables d'induire la formation de structures pseudo-embryonnaires dans les cavités thoracique et abdominale des souris. Ces pseudo-embryons affichaient les trois couches typiques des embryons (ectoderme, mésoderme et endoderme), et des structures extra-embryonnaires tels que la membrane vitelline et même l'ébauche de cellules sanguines.
"Ces données nous disent que nos cellules souches sont beaucoup plus polyvalentes que les cellules iPS obtenues in vitro par Yamanaka, qui génèrent les différentes couches de l'embryon mais jamais les annexes embryonnaires, comme le placenta", a déclaré Manuel Serrano.
Les auteurs soulignent que les applications thérapeutiques possibles de leurs travaux restent lointaines, mais ils admettent que, sans doute, cela pourrait signifier une réorientation de la recherche sur les cellules souches, la médecine régénérative et l'ingénierie tissulaire.
"Nos cellules souches survivent aussi en culture, permettant ainsi de les manipuler dans un laboratoire. L'étape suivante est d'étudier si ces nouvelles cellules souches sont capables de produire efficacement différents tissus tels que ceux du pancréas, du foie ou du rein. ", a déclaré Abad.
Sources :
- María Abad, Lluc Mosteiro, Cristina Pantoja,Marta Cañamero, Teresa Rayon,Inmaculada Ors, Osvaldo Graña, Diego Megías, Orlando Domínguez,Dolores Martínez, Miguel Manzanares,Sagrario Ortega & Manuel Serrano. (2013). Reprogramming in vivo produces teratomas and iPS cells with totipotency features Nature : 10.1038/nature12586.
- Marc Gozian (2013) Des souris vivantes ont produit des cellules souches (Sciences et Avenir, n° 800, octobre 2013, pp. 78-79).
Voir également dans ce blog, l'article : Les-potentialités infinies des cellules souches.


Les commentaires sont fermés.