L’épigénétique est un modulateur clé de l’évolution
04/08/2019
L’épigénétique est un modulateur clé de l’évolution
Par Édith Heard et Vincent Colot
https://www.pourlascience.fr/sd/physique/pour-la-science-n0500-17033.php
Article paru dans Pour la Science n°500 - Juin 2019
En agissant sur la capacité de séquences mobiles d’ADN — les transposons — de se déplacer dans le génome, l’épigénétique garde sous son contrôle un puissant réservoir de variations susceptibles d’avoir un effet majeur au sein d’une même espèce. L’environnement influence-t-il ce contrôle ? Edith Heard et Vincent Colot, chercheurs spécialisés en épigénétique, nous répondent.
Propos recueillis par Marie-Neige Cordonnier 27 mai 2019 POUR LA SCIENCE N° 500 20 mn.
L’uta, un lézard du sud-ouest des États-Unis, a en général la couleur du sable qu’il habite, mais ceux qui vivent sur le volcan Pisgah, en Californie, sont noirs comme la lave refroidie qui les héberge. En revanche, si un lézard de Pisgah (à gauche) vit pendant quatre mois dans du sable clair, il reprend une couleur sableuse (à droite). Ammon Corl, de l’université de Californie à Berkeley, et ses collègues ont récemment montré que chez les lézards de Pisgah, deux gènes régulant la production de mélanine sont mutés. Selon eux, la plasticité phénotypique de l’uta l’aide à s’adapter à un nouvel environnement, puis une mutation soumise à une forte sélection positive vient fixer le phénotype le mieux adapté.
Utas, lézards du sud-ouest des États-Unis
© Corl et al., Current Biology, 2018
Comment définiriez-vous l’épigénétique aujourd’hui ?
Edith Heard : La définition sur laquelle repose mon travail est celle issue des travaux du Britannique Robin Holliday et de l’Américain Arthur Riggs menés dans les années 1970 : l’épigénétique est l’ensemble des changements d’expression des gènes qui sont transmissibles au cours des divisions cellulaires ou à travers les générations et qui n’impliquent pas de changement de la séquence d’ADN.
Mais la définition de Conrad Waddington revient en force depuis une vingtaine d’années. En 1942, ce biologiste britannique a voulu rapprocher deux domaines, la génétique et l’embryologie, afin d’établir un lien entre génotype (le patrimoine héréditaire d’un individu, porté par les gènes) et phénotype (les caractères observables de l’individu). À l’époque, on ne savait pas de quoi étaient faits les gènes. Waddington a proposé de nommer épigénétique l’étude des mécanismes du développement par lesquels les gènes déterminent les caractères. Cette définition a pris un sens plus général aujourd’hui, à mesure que l’on s’est intéressé aux variations plus ou moins grandes de phénotypes que peuvent engendrer pour un même génotype des environnements différents.
Vincent Colot : Oui, la définition de Waddington est prévalente de nos jours : pour faire court, elle englobe tous les processus de régulation de l’expression des gènes, soit dans un cadre développemental, soit en réponse à des signaux de l’environnement externe. On sait que chez les eucaryotes (les organismes dont les cellules ont un noyau), cette régulation fait intervenir de nombreux mécanismes agissant sur la chromatine – la structure compacte que forment l’ADN et les protéines (histones) autour desquelles il est enroulé dans le noyau. Pour ma part, comme Edith, ce sont les mécanismes de contrôle conduisant à une « mémoire » des états d’expression des gènes au travers des divisions cellulaires ou des générations qui m’intéressent, et leurs conséquences. C’est dans ce cadre que j’étudie plus particulièrement, chez les plantes, l’héritage au fil des générations d’une marque de la chromatine, la méthylation de l’ADN – l’ajout d’un groupement méthyle (CH3) à certains nucléotides le long de la séquence de l’ADN.
Connaît-on beaucoup de mécanismes épigénétiques ?
Vincent Colot : Oui, ils sont très variés, surtout chez les eucaryotes où la régulation de l’expression des gènes est bien plus complexe que chez les bactéries. L’ADN n’est pas juste lu et transcrit par des protéines : il est enroulé autour d’histones qui elles-mêmes sont sujettes à de nombreuses modifications chimiques, et la chromatine interagit aussi avec des ARN (des produits de lecture de l’ADN) dits non codants, car leur fonction n’est pas d’être traduits en protéines. L’organisation tridimensionnelle de la chromatine dans le noyau joue aussi un rôle important, comme Edith l’a montré à propos du chromosome X.
Edith Heard : En plus des mécanismes liés à la chromatine, il existe de nombreuses autres stratégies que les chercheurs commencent à disséquer. Le cas des criquets pèlerins Schistocerca gregaria montre à quel point ces stratégies sont diverses. Un criquet seul vit tranquillement sous les arbres, en solitaire. Mais dès que l’on met plus de trois criquets solitaires à proximité, ils changent complètement de comportement en quelques heures. Ils deviennent agressifs et se rassemblent, marchent en ligne, puis se mettent à migrer et à voler. Ils changent aussi de couleur et de morphologie, et leur descendance conserve ces attributs, qui sont même renforcés au fil des générations.
Quand le criquet pèlerin Schistocerca gregaria est solitaire, il vit tranquillement au sol, sous les arbres, et est plutôt marron-vert (à gauche). Mais si on rapproche plusieurs criquets solitaires, ceux-ci changent en quelques heures de comportement et de morphologie, devenant grégaires et agressifs, et très colorés (à droite). Ces changements sont transmis aux générations suivantes par une molécule que la mère se met à produire dans la mousse destinée à nourrir sa progéniture.
Criquet pèlerin Schistocerca gregaria
© Shutterstock.com/davemhuntphotography
Il y a quelques années, Stephen Simpson, de l’université de Sydney, et ses collègues ont essayé de voir si cette transmission était juste liée à un apprentissage comportemental : les petits auraient-ils acquis les mêmes attributs que leurs parents en apprenant à leur contact à devenir agressifs et à migrer ? En fait, pas du tout : la femelle criquet pond ses œufs fécondés sous le sable, puis ne s’en occupe plus. En revanche, elle dépose avec eux une mousse. Et si la femelle s’est transformée au préalable, la mousse sécrétée suffit à modifier le comportement, la morphologie et le métabolisme des descendants. Une seule molécule induit tous ces changements : une forme de L-dopa, un précurseur de la dopamine, un messager chimique du système nerveux. Cette molécule déclencherait toute une cascade développementale qui aurait un impact sur la physiologie. Pour moi, c’est de l’épigénétique : le comportement grégaire induit chez les individus des changements massifs d’expression des gènes (viala production accrue d’un autre messager neuronal, la sérotonine), et une fois que ce mécanisme est enclenché, il est transmis par la mère d’une génération à l’autre sans que cela soit codé dans les gamètes.
Les modifications épigénétiques peuvent-elles être héréditaires ?
Vincent Colot : Nos recherches et celles d’autres équipes travaillant chez les plantes ont établi sans aucun doute possible qu’il peut y avoir des variations héréditaires de caractères sans le moindre changement de la séquence de l’ADN. Chez la plante Arabidopsis thaliana, nous avons produit une population d’individus ayant tous un même génome, mais qui diffèrent les uns des autres par leur profil de méthylation de l’ADN. Et nous avons observé qu’une partie de ces différences sont transmises fidèlement au travers de dizaines de générations, sans que cette transmission ne repose sur un quelconque changement de la séquence d’ADN.
Et chez les animaux ?
Vincent Colot : Chez le ver Caenorhabditis elegans, on commence à avoir des preuves. L’équipe d’Oded Rechavi, à l’université de Tel-Aviv, a notamment montré, ces dernières années, qu’en réponse à différents stress environnementaux, ce ver produit des petits ARN, et que cette production se renforce au fil des générations tant que nécessaire. Un mécanisme de rétroaction détermine par ailleurs si cette réponse épigénétique sera mémorisée ou oubliée à la génération suivante.
Edith Heard : Il y a aussi des cas chez la souris avec le gène agouti, qui contrôle la distribution de mélanine dans le pelage, et donc sa couleur. Emma Whitelaw de l’institut de recherche médicale du Queensland en Australie, Robert Waterson, à l’université Duke, aux États-Unis, et leurs collègues ont par exemple montré dans les années 2000 qu’il était possible d’induire un état de méthylation au niveau de ce gène et de le conserver sur plusieurs générations. Dans ce cas, la transmission est métastable : parmi la progéniture, certaines souris ont le gène méthylé, d’autres non. Mais en sélectionnant les souris qui portent l’état recherché, on maintient la lignée. Et en jouant sur le régime alimentaire, on peut aussi favoriser la transmission de cet état.
Vincent Colot : En fait, la transmission stable telle qu’on l’a obtenue avec Arabidopsisest un cas extrême. Nos travaux montrent qu’il existe un champ continu des possibles entre une transmission très stable, mendélienne, et des transmissions quasi évanescentes.
Justement, dans la nature, où l’on a plutôt de tout, les états épigénétiques sont-ils transmis sur un nombre suffisant de générations pour donner prise à la sélection naturelle ?
Vincent Colot : Dans notre expérience, nous avons observé que deux états épigénétiques alternatifs se transmettent sur au moins une vingtaine de générations et peuvent donc donner prise à la sélection. Nous l’avons d’ailleurs testé : parmi les plants de notre système expérimental, qui ont donc tous quasiment le même génome, mais des profils distincts de méthylation de l’ADN, nous avons sélectionné des phénotypes extrêmes – des racines très longues ou très courtes, par exemple. Nous avons vu que cette sélection était fortement corrélée à la présence d’une signature épigénétique particulière (ADN méthylé versus ADN non méthylé) à quelques endroits précis du génome, en accord avec un lien causal.
Edith Heard : Mais on ne sait pas si ça marche comme ça dans la nature.
Vincent Colot : Oui, mais le variant que nous avons établi au laboratoire existe aussi dans la nature. La grande question est donc maintenant de comprendre comment il y est apparu, avant même de se demander s’il a été sélectionné.
L’épigénétique joue-t-elle un rôle dans les vagues de mutations observées dans la nature ?
Vincent Colot : Cela se pourrait. On vient en effet de trouver une telle situation au laboratoire en libérant un transposon chez Arabidopsis. Les transposons sont des séquences d’ADN capables de se déplacer de façon autonome dans le génome : ils comportent des gènes codant des enzymes dont le rôle est de les dupliquer ou de les couper et de les insérer ailleurs. Ces éléments mobiles et leurs vestiges — des transposons qui ont perdu leur mobilité au fil des mutations —, sont très nombreux et répartis dans tout le génome : chez l’humain, ceux identifiés constituent environ 50% de la séquence d’ADN, mais ils occupent en réalité sans doute plus de 80% de notre ADN, même si seul un petit nombre de transposons (les plus récents) sont encore mobiles. Or on s’est aperçu ces dernières années que les transposons et leurs dérivés sont des porteurs privilégiés de marques épigénétiques. Dans nos expériences, notamment, l’épigénétique transmissible à travers les générations est sous-tendue par la présence de transposons ou de leurs vestiges à proximité des gènes. De fait, tout le monde s’accorde à dire qu’au moins chez les mammifères et les plantes, les phénomènes épigénétiques expérimentaux qui semblent traverser les générations sont très souvent liés à la présence, à proximité d’un gène donné, d’un transposon intact ou fossile. Il est le plus souvent méthylé – c’est l’état de répression classique –, mais il arrive que la méthylation soit perdue. Peut-être que la fonction première de l’épigénétique en lien avec l’évolution est de contrôler l’activité de ces séquences mobiles et de limiter leur dissémination dans le génome.
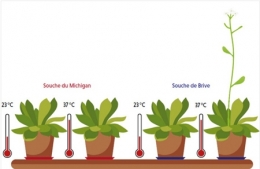
Une souche de la plante Arabidopsis thaliana poussant à Brive porte, dans un gène qui contrôle le temps de la floraison, un transposon sensible à la chaleur. Ce transposon est absent du gène chez les plus proches cousines de la souche de Brive, qui, comme celle provenant du Michigan, ont besoin d’une période de grand froid pour fleurir au printemps. L’équipe de Vincent Colot a montré que la présence du transposon confère la capacité de fleurir après un choc de chaleur. En d’autres termes, le transposon, via la modulation du contrôle épigénétique que la chaleur exerce sur lui, aurait permis à la souche de Brive de s’acclimater aux doux hivers corréziens.
Arabidopsis thaliana
A-t-on observé un tel contrôle dans la nature ?
Edith Heard : Il est clair que les transposons attirent la machinerie épigénétique, telles les enzymes qui méthylent l’ADN ou modifient les histones, souvent en lien avec le mécanisme d’interférence à ARN, par lequel les ARN non codants modifient l’expression de gènes. En général, cette machinerie inactive les transposons et, avec le temps, ceux qui n’ont pas été éliminés par la sélection naturelle dégénèrent : ils dérivent de façon neutre et accumulent des mutations. Toutefois, certains gardent leur capacité d’attirer la machinerie épigénétique et peuvent contribuer à l’évolution des réseaux de régulation des gènes.
Vincent Colot : Ces vestiges ou fossiles constituent alors des sortes de modules épigénétiques à la disposition des gènes à proximité. De très beaux travaux de Didier Trono, à l’École polytechnique fédérale de Lausanne, et de Cedric Feschotte, de l’université Cornell, aux États-Unis, ont montré que des réseaux de régulation de l’expression des gènes chez les mammifères, dont l’homme, sont en grande partie constitués de tels vestiges, qui mettent tout un ensemble de gènes sous le même type de contrôle épigénétique.
Edith Heard : On rejoint l’hypothèse qu’avait formulée Barbara McClintock lorsqu’elle a découvert les transposons vers 1950 : c’étaient pour elle des éléments de contrôle de l’expression des gènes, même si elle ne parlait pas d’épigénétique.
Comment ces éléments interviendraient-ils dans les vagues de mutations ?
Edith Heard : Les transposons pourraient jouer un rôle dans l’évolution accélérée. On sait que quand le contrôle épigénétique est altéré, comme lors de stress environnementaux, certains transposons sont remobilisés, ce qui conduit à une période transitoire d’instabilité génomique. Par exemple, un choc thermique rend la chromatine moins compacte, ce qui pourrait déclencher la mobilisation de transposons. À Hawaii, où le volcanisme crée des conditions environnementales plutôt hostiles, les espèces de drosophiles sont extraordinairement nombreuses. Des chercheurs ont émis l’hypothèse que cette diversification extrême serait la conséquence directe de cet environnement, qui aurait conduit à des « explosions » répétées d’activité des transposons. En retour, ces explosions auraient produit la variation génétique nécessaire à l’adaptation aux conditions du milieu et à la spéciation.
A-t-on des preuves d’un tel scénario où un stress environnemental remobiliserait un transposon en dérégulant son contrôle épigénétique ?
Vincent Colot : Il n’existe pas de preuve directe que cela se produit dans la nature. Il faut savoir que la mobilisation des transposons y est extrêmement rare, sauf situations très particulières. En revanche, il est possible de faire bouger au moins certains d’entre eux en laboratoire en modifiant leur contrôle épigénétique. En effet, si on ne sait pas encore vraiment ce qui déclenche la perte de méthylation en conditions naturelles, on peut l’induire en perturbant le fonctionnement des enzymes qui méthylent l’ADN. C’est ce que nous avons fait dans nos souches d’A. thaliana, et certains transposons se sont mis à bouger ! Nous avons pu observer qu’une réaction en cascade se produit à partir d’un seul transposon remobilisé. Très vite, en trois ou quatre générations seulement, on arrive à des taux de mutations infernaux : on crée bien plus de mutations par cette mobilisation que de mutations spontanées dues aux erreurs de réplication de l’ADN. En somme, dans notre expérience, la dérégulation épigénétique agit comme un accélérateur de l’évolution.
Chez les abeilles Apis mellifera, la larve de la future reine est nourrie de gelée royale, sécrétée par les abeilles, tandis que les autres mangent du pain d’abeille, un mélange de pollen et de miel. On n’a compris que récemment que la gelée royale n’est pas le seul acteur de leur plasticité phénotypique. Dans le pain d’abeille, de petits ARN issus des plantes interviendraient dans le déclenchement du programme « ouvrière »…
Apis mellifica
© Shutterstock.com/Ivan Marjanovic - Pour la Science
Que se passe-t-il ensuite ?
Vincent Colot : Le contrôle épigénétique par la méthylation de l’ADN finit par se mettre en marche et inactive d’un coup toutes les nouvelles copies du transposon générées lors de la réaction en cascade. Dès lors, on a pu s’intéresser à l’impact de chacune de ces copies et de leur état épigénétique sur les gènes voisins. Si certaines copies n’avaient aucun effet, d’autres modifiaient l’expression d’un gène à proximité. Or, parmi ces dernières, plusieurs ne le faisaient que lorsqu’elles n’étaient pas méthylées. Dès que la méthylation revenait, elles devenaient inactives et n’avaient plus du tout d’effet.
Sans que la séquence d’ADN n’ait changé…
Vincent Colot : En effet, il s’agit bien d’épigénétique ! On s’est aussi aperçu que le transposon ciblait préférentiellement certains locus particuliers, où des gènes sont impliqués dans la réponse aux changements environnementaux comme des attaques d’agents pathogènes ou des chocs thermiques. La mutagenèse induite par ce transposon n’est donc pas du tout aléatoire. Il y a peut-être eu une coévolution de plusieurs mécanismes : des transposons qui ne sont activés qu’en condition de stress — même si on ne sait pas déclencher leur mobilité de cette façon en laboratoire — et qui ciblent des gènes dont l’expression a besoin d’être régulièrement ajustée pour mieux répondre au stress.
Et dans la nature ?
Vincent Colot : On a trouvé une situation similaire en recherchant, dans la base de données du projet de séquençage 1001 Genomes d’A. thaliana, une insertion toute récente dans le gène FLC, qui est un répresseur clé de la floraison. La souche possédant cette insertion provient de Brive alors que les autres souches contenant un gène FLC très semblable, mais sans insertion, sont trouvées pour la plupart en Amérique du Nord, dans des régions aux hivers rigoureux. Or nous nous sommes aperçus que si toutes ces souches déclenchent la floraison après un épisode hivernal, qui induit la répression stable du gène FLC, seule la souche de Brive, aux hivers bien plus cléments, peut également fleurir sans froid préalable dès lors qu’elle est soumise à un choc thermique. Des travaux encore préliminaires suggèrent que c’est bien le transposon inséré dans le gène FLC qui confère à cette souche la propriété de fleurir ainsi. De fait, ce transposon perd sa méthylation après un choc thermique, ce qui suffit, comme le froid hivernal, à inhiber de manière stable l’activité du gène FLC.
Edith Heard : C’est intéressant par rapport au changement climatique ou d’autres stress environnementaux : les transposons créent un réservoir d’individus différents qui vont réagir différemment à une vague de chaleur ou de froid, et ne mourront peut-être pas tous.
Vincent Colot : Et peut-être le choc thermique induit-il aussi des transpositions, même si on ne sait pas les voir, et génère-t-il de cette façon de la diversité génétique, comme évoqué par Edith pour les mouches hawaiiennes. Dans ce contexte, l’évolution implique bien des changements de la séquence de l’ADN.
L’épigénétique n’est-elle pas quand même un puissant moteur de l’évolution ?
Vincent Colot : Si, mais plutôt de manière indirecte, en modulant la capacité des transposons à être mobilisés, notamment en réponse aux changements brusques de l’environnement, et en permettant ainsi la création rapide de mutations potentiellement adaptatives, pour certaines parce qu’elles-mêmes épigénétiquement sensibles. C’est en tout cas ce que l’exemple de l’insertion du transposon dans le gène FLC de la souche de Brive suggère.
Quels aspects vous paraissent particulièrement intéressants dans les recherches actuelles sur l’épigénétique au regard de l’évolution ?
Edith Heard : Une voie intéressante concerne ce qu’on appelle la plasticité phénotypique, qui permet une adaptation rapide, programmée, à un changement environnemental, comme celle des criquets pèlerins en fonction du nombre de congénères à proximité. Comment des individus ayant le même génome peuvent-ils avoir des phénotypes si différents selon l’environnement dans lequel ils se trouvent ? Les stratégies et mécanismes utilisés sont peu connus encore. Qu’il s’agisse de comprendre comment un poisson change de mâchoire en fonction de la nourriture disponible, ou comment un lézard des sables devient noir sur de la lave, on est encore loin d’avoir une réponse. On n’a pas simplement affaire à un gène qui serait méthylé ou non. En fait, on pense qu’à la base de la plasticité phénotypique, il y a une fluctuation d’expression des gènes. Dans une cellule, un gène est exprimé à un certain niveau qui diffère de celui de la cellule voisine. Puis de l’épigénétique pourrait contribuer à fixer tout cela.
Par exemple, selon la richesse du milieu de culture de levures de boulanger, leur capacité de produire des spores varie. Plus le milieu est pauvre et plus la levure a de chances de sporuler. Des biologistes ont montré que la capacité de changer d’état est préexistante dans la population, et ils ont identifié le gène responsable de cette capacité. D’une cellule à l’autre, son expression fluctue beaucoup et, en conséquence, les cellules ne sporulent pas en même temps. Ils ont aussi montré que c’est l’état de la chromatine autour de la région où commence la lecture du gène qui fluctue d’une cellule à l’autre, produisant cette variabilité d’expression du gène. L’avantage se situe ici à l’échelle de la population : les cellules pas encore entrées en sporulation peuvent prendre le relais en cas de retour d’un milieu riche en nutriments. À ma connaissance, c’est un des rares cas de plasticité phénotypique où l’on connaît le gène et le mécanisme.
Quel autre aspect vous semble particulièrement important en ce moment ?
Edith Heard : Le rôle éventuel des transposons et de leurs reliquats dans l’adaptabilité ; à quel point ces insertions servent de modulateurs de l’expression des gènes absolument critiques pour l’adaptation à des environnements différents. Et les plantes sont peut-être des exemples plus frappants que les animaux, car elles sont obligées d’exploiter ce qu’elles ont, alors que les animaux peuvent se déplacer.
Vincent Colot : Oui, et en particulier, il est important de comprendre quelles sont les modalités qui président au relâchement du contrôle épigénétique et à la mobilisation des transposons, et comment tout cela s’inscrit dans un processus qui favoriserait la création de mutations adaptatives en réponse à des changements brutaux de l’environnement.
Donc par rapport aux visions de Lamarck et Darwin, on est finalement un peu entre les deux ?
Vincent Colot : On fait dire tout et n’importe quoi à Lamarck. Mais si l’on veut bien accepter que l’environnement peut agir, non seulement comme un filtre, mais également comme un moteur dans la génération de la variation génétique, qui plus est comme un orienteur — imparfait — de celle-ci, le rapprochement devient intéressant.
Edith Heard : Une question que l’on se pose souvent est la suivante : un organisme peut-il acquérir des traits hérités, comme l’a proposé Lamarck ? La réponse est non. En revanche, comme l’a suggéré la biologiste américaine de l’évolution Mary Jane West-Eberhard en 2003 en s’appuyant sur des travaux sur des guêpes et des papillons, la plasticité phénotypique pourrait ouvrir la voie à des ajustements permanents, sous la forme de changements génétiques. Lamarck avait raison de dire qu’il fallait des réponses flexibles et rapides à l’environnement — comme cette plasticité phénotypique qui pourrait être le moteur de changements plus lointains —, mais si certains traits adaptatifs deviennent permanents, comme dans le cas de la couleur noire des lézards des sables, c’est parce que des mutations (peut-être liées à l’activité des transposons ?) ont fixé ces traits qui étaient plastiques auparavant. On parle d’assimilation génétique. Les mutations sont donc les moteurs ultimes de l’évolution.




Les commentaires sont fermés.