Alzheimer, Parkinson : où en est la recherche ?
19/10/2017
Alzheimer, Parkinson
Mise à jour des travaux
de l'Institut Pasteur
Une recherche synonyme d'espoir
 Aujourd'hui, rien ne permet d'agir contre la neurodégénérescence associée à des maladies tant redoutées. Face à ces pathologies, d'où peut venir l'espoir si ce n'est des laboratoires de recherche ? Il y a lieu d'être optimiste. Si le cerveau reste un organe mal connu, pour l'étudier, « nous n'avons jamais eu d'outils aussi puissants qu'aujourd'hui », souligne l'un de nos chercheurs. Les connaissances récentes sur la production de nouveaux neurones dans le cerveau ont déjà permis d'éditer des règles (fuir la routine, entretenir le lien social...) pour stimuler son cerveau que vous trouverez page 5. Par ailleurs, vous découvrirez dans ce dossier plusieurs pistes prometteuses explorées par nos équipes en vue d'agir efficacement, à l'avenir, contre des maladies neurodégénératives. Votre aide précieuse est un renfort majeur pour ces recherches. C'est avec vous que nos chercheurs peuvent espérer mettre au point les solutions tant attendues pour combattre des maladies telles qu'Alzheimer et Parkinson. Merci de votre fidélité à leurs côtés.
Aujourd'hui, rien ne permet d'agir contre la neurodégénérescence associée à des maladies tant redoutées. Face à ces pathologies, d'où peut venir l'espoir si ce n'est des laboratoires de recherche ? Il y a lieu d'être optimiste. Si le cerveau reste un organe mal connu, pour l'étudier, « nous n'avons jamais eu d'outils aussi puissants qu'aujourd'hui », souligne l'un de nos chercheurs. Les connaissances récentes sur la production de nouveaux neurones dans le cerveau ont déjà permis d'éditer des règles (fuir la routine, entretenir le lien social...) pour stimuler son cerveau que vous trouverez page 5. Par ailleurs, vous découvrirez dans ce dossier plusieurs pistes prometteuses explorées par nos équipes en vue d'agir efficacement, à l'avenir, contre des maladies neurodégénératives. Votre aide précieuse est un renfort majeur pour ces recherches. C'est avec vous que nos chercheurs peuvent espérer mettre au point les solutions tant attendues pour combattre des maladies telles qu'Alzheimer et Parkinson. Merci de votre fidélité à leurs côtés.
Pr Christian Bréchot, Directeur général de l'Institut Pasteur
Altzheimer, Parkinson :
où en est la recherche ?
L'attente de progrès médicaux est considérable face aux deux maladies neurodégénératives les plus fréquentes : les maladies d'Alzheimer et de Parkinson, qui touchent respectivement près de 900 000 et 200 000 personnes en France. D'autant que ces maladies liées à l'âge concerneront de plus en plus de gens avec le vieillissement de la population. En 2020, 1,3 million d'individus pourraient souffrir de la maladie d'Alzheimer. Mais que sait-on aujourd'hui de ces pathologies ?
Le principal facteur de risque de la maladie d'Alzheimer est l'âge. Mais un terrain génétique intervient également.
Une lente dégradation :
la maladie d'Alzheimer
Commençons par la plus répandue : la maladie d'Alzheimer. Rare avant 65 ans, elle touche 15% des personnes de 80 ans. Ses premières manifestations sont des troubles de la mémoire à court terme. Puis surviennent des troubles des « fonctions d'exécution » (ne plus savoir comment se servir de son téléphone ou effectuer une tâche routinière) et de l'orientation dans le temps et l'espace (perdre son chemin sur un trajet habituel, ne plus savoir se situer dans le temps). Le malade perd progressivement ses facultés mentales et son autonomie, et des troubles du langage, de l'écriture, du mouvement, du comportement, de l'humeur (anxiété, dépression, irritabilité) et du sommeil apparaissent. Cette évolution s'étale sur plusieurs années, avec une vitesse de progression variable d'une personne à l'autre.
Que se passe-t-il au juste dans le cerveau des malades ?
Une lente dégénérescence des neurones débute dans plusieurs régions cérébrales et notamment au niveau d'une structure nommée hippocampe, siège de la mémoire à court terme, avant de s'étendre progressivement à l'ensemble du cerveau. Deux coupables ont été identifiés : le peptide bêta amyloïde et la protéine tau. Naturellement présent dans le cerveau, le peptide bêta amyloïde s'accumule jusqu'à former des «plaques amyloïdes ou « plaques séniles ». Cette accumulation toxique pour les cellules nerveuses s'accompagne aussi de la modification de la protéine tau, une protéine de structure des neurones. Conséquence : les neurones se désorganisent. S'ensuit une dégénérescence neurofibrillaire puis la mort des cellules nerveuses. Ce processus neurodégénératif très lent met des années à s'installer avant que les symptômes de la maladie n'apparaissent.
L'âge, principal facteur de risque
Ainsi, le principal facteur de risque de la maladie d'Altzheimer est l'âge. Mais un terrain génétique intervient également. Une combinaison de plusieurs gènes peut être à l'origine d'une sensibilité individuelle accrue. Certains de ces gènes interviennent dans le métabolisme du fameux peptide amyloïde, d'autres dans l'inflammation, d'autres dans la communication entre les neurones... Il existe aussi des gènes qui, au contraire, protègent de la maladie.
L'environnement semble également jouer un rôle important. La sédentarité, des anesthésies répétées, des facteurs de risque cardiovasculaire (diabète, hypertension...) non pris en charge favoriseraient la survenue de la maladie. À l'inverse, le fait d'avoir fait des études, d'avoir eu une activité professionnelle stimulante et une vie sociale active semble retarder l'apparition des premiers symptômes et leur sévérité: il s'agit de la « réserve cognitive », qu'on peut développer en stimulant son cerveau et qui compenserait la fonction des neurones perdus.
Face à la maladie que peut-on faire ? Des médicaments peuvent ralentir l'évolution des troubles tandis que certaines approches — ateliers mémoire, soutien psychologique... — améliorent la qualité de vie des malades. Aucun traitement ne permet cependant de les guérir d'où l'importance des recherches en cours dans les laboratoires, qui laissent entrevoir de nouvelles stratégies thérapeutiques ou diagnostiques.
Alzheimer : Diagnostiquer les phases précoces
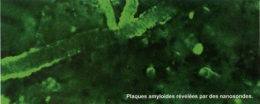
 II n'existe aujourd'hui aucun moyen de diagnostiquer la maladie d'Alzheimer au stade précoce. 20 ans s'écoulent en moyenne entre le début de la maladie et la démence. Au sein de la Plateforme d'Ingénierie des anticorps de l'Institut Pasteur, dirigée par Pierre Lafaye, une technique pour détecter les toutes premières lésions de la maladie a été mise au point... grâce à des anticorps de lama ! « Nous utilisons une petite partie des anticorps de lama, appelée "nanocorps", qui a l'avantage de pouvoir franchir la barrière hématoencéphalique, qui entoure et protège le cerveau », explique le chercheur. « Des nanocorps spécifiques des deux protéines au cœur de la maladie, la protéine tau et le peptide béta-amyloïde, sont couplés à un agent de contraste, ce qui permet de les révéler à l'IRM quand ils sont fixés aux protéines cibles. » Ces deux « nanosondes » se sont révélées efficaces dans des modèles expérimentaux pour détecter des lésions très précoces. Leur développement offre l'espoir de pouvoir prendre en charge les malades plus tôt, et donc plus efficacement.
II n'existe aujourd'hui aucun moyen de diagnostiquer la maladie d'Alzheimer au stade précoce. 20 ans s'écoulent en moyenne entre le début de la maladie et la démence. Au sein de la Plateforme d'Ingénierie des anticorps de l'Institut Pasteur, dirigée par Pierre Lafaye, une technique pour détecter les toutes premières lésions de la maladie a été mise au point... grâce à des anticorps de lama ! « Nous utilisons une petite partie des anticorps de lama, appelée "nanocorps", qui a l'avantage de pouvoir franchir la barrière hématoencéphalique, qui entoure et protège le cerveau », explique le chercheur. « Des nanocorps spécifiques des deux protéines au cœur de la maladie, la protéine tau et le peptide béta-amyloïde, sont couplés à un agent de contraste, ce qui permet de les révéler à l'IRM quand ils sont fixés aux protéines cibles. » Ces deux « nanosondes » se sont révélées efficaces dans des modèles expérimentaux pour détecter des lésions très précoces. Leur développement offre l'espoir de pouvoir prendre en charge les malades plus tôt, et donc plus efficacement.
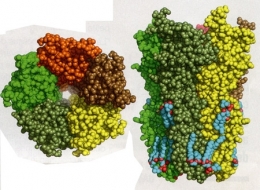
Le récepteur à la nicotine, cible pour la maladie d'Alzheimer
 Toujours très étudié à l'Institut Pasteur, le « récepteur nicotinique à l'acétylcholine » y a été identifié en 1970 par le Pr Jean-Pierre Changeux. S'il fixe la nicotine, il est naturellement le récepteur de l'acétylcholine, un neurotransmetteur impliqué dans le contrôle des mouvements, la mémoire, l'apprentissage... L'acétylcholine fait défaut dans la maladie d'Alzheimer, les neurones qui la produisent étant les premiers touchés par la dégénérescence. Les seuls traitements administrés aujourd'hui sont d'ailleurs des molécules qui empêchent sa dégradation. «Nous avons l'espoir d'agir plus précocement à l'avenir voire de manière curative », avance Uwe Maskos, chef de l'unité de Neurobiologie intégrative des systèmes cholinergiques. « Nous avons réussi à modéliser les événements qui mènent à la phase précoce de la maladie, notamment comment le peptide béta-amyloïde change l'activité du cerveau en se liant au récepteur ». Des composants « nicotine-like » capables de bloquer très spécifiquement cette liaison dangereuse, et pouvant être administrés en toute sécurité, sont actuellement recherchés.
Toujours très étudié à l'Institut Pasteur, le « récepteur nicotinique à l'acétylcholine » y a été identifié en 1970 par le Pr Jean-Pierre Changeux. S'il fixe la nicotine, il est naturellement le récepteur de l'acétylcholine, un neurotransmetteur impliqué dans le contrôle des mouvements, la mémoire, l'apprentissage... L'acétylcholine fait défaut dans la maladie d'Alzheimer, les neurones qui la produisent étant les premiers touchés par la dégénérescence. Les seuls traitements administrés aujourd'hui sont d'ailleurs des molécules qui empêchent sa dégradation. «Nous avons l'espoir d'agir plus précocement à l'avenir voire de manière curative », avance Uwe Maskos, chef de l'unité de Neurobiologie intégrative des systèmes cholinergiques. « Nous avons réussi à modéliser les événements qui mènent à la phase précoce de la maladie, notamment comment le peptide béta-amyloïde change l'activité du cerveau en se liant au récepteur ». Des composants « nicotine-like » capables de bloquer très spécifiquement cette liaison dangereuse, et pouvant être administrés en toute sécurité, sont actuellement recherchés.
Récepteur nicotinique
Altzheimer : L'espoir d'une molécule de jouvence
 Il existe dans le sang des « facteurs de jouvence » : il a été montré expérimentalement que traiter des organismes âgés avec du sang provenant d'organismes jeunes a des effets rajeunissants. Lida Katsimpardi, à l'Université de Harvard (États-Unis), a étudié et du « jeune sang » sur le cerveau âgé. « Dans des modèles expérimentaux, son administration a pour effet d'augmenter la production de nouveaux neurones et de remodeler, dans le cortex et d'autres zones, la vascularisation. Cette amélioration de la vascularisation augmente le flux sanguin, ce qui pourrait stimuler l'activité des neurones », explique la chercheuse, qui a aussi montré en 2014 qu'un facteur sanguin nommé GDF11 était capable à lui seul des mêmes effets. Aujourd'hui dans l'unité Perception et mémoire de l'Institut Pasteur, Lida Katsimpardi recherche activement d'autres molécules rajeunissantes. Je pense qu'il y a un "cocktail de jouvence" à découvrir. Ces recherches ouvrent des perspectives thérapeutiques considérables et nous allons prochainement tester l'effet de GDF11 dans un modèle de la maladie d'Alzheimer. »
Il existe dans le sang des « facteurs de jouvence » : il a été montré expérimentalement que traiter des organismes âgés avec du sang provenant d'organismes jeunes a des effets rajeunissants. Lida Katsimpardi, à l'Université de Harvard (États-Unis), a étudié et du « jeune sang » sur le cerveau âgé. « Dans des modèles expérimentaux, son administration a pour effet d'augmenter la production de nouveaux neurones et de remodeler, dans le cortex et d'autres zones, la vascularisation. Cette amélioration de la vascularisation augmente le flux sanguin, ce qui pourrait stimuler l'activité des neurones », explique la chercheuse, qui a aussi montré en 2014 qu'un facteur sanguin nommé GDF11 était capable à lui seul des mêmes effets. Aujourd'hui dans l'unité Perception et mémoire de l'Institut Pasteur, Lida Katsimpardi recherche activement d'autres molécules rajeunissantes. Je pense qu'il y a un "cocktail de jouvence" à découvrir. Ces recherches ouvrent des perspectives thérapeutiques considérables et nous allons prochainement tester l'effet de GDF11 dans un modèle de la maladie d'Alzheimer. »
Parkinson : la motricité altérée
Qu'en est-il de la maladie de Parkinson, deuxième maladie neurodégénérative la plus fréquente en France ? Les symptômes, variables d'un patient à l'autre, comprennent une difficulté à initier un mouvement, un ralentissement des gestes, une écriture de plus en plus petite et difficile, une rigidité des membres et des tremblements caractéristiques au repos. À côté de ces troubles de la motricité, la maladie peut s'accompagner de manifestations souvent invalidantes (grande fatigue, perte de l'odorat, anxiété, problèmes de déglutition et d'élocution...).
Là encore, le processus de la maladie commence des années avant l'apparition des symptômes. Ici, c'est une population de neurones particulière qui est détruite : les neurones à dopamine situés dans la substance noire du cerveau. La dopamine est un neurotransmetteur (molécule permettant aux neurones de communiquer entre eux) qui intervient dans la régulation des mouvements, d'où l'altération des fonctions motrices. Pendant un temps, le cerveau compense la baisse de dopamine ce qui permet un fonctionnement cérébral normal : 50 à 70% des neurones à dopamine doivent être détruits pour que les symptômes surviennent. Cette dégénérescence est associée à une accumulation toxique de protéines. On parle de « corps de Lewy » dans la substance noire et dans d'autres zones du cerveau : ce sont des amas pathogènes formés par une protéine, l'∝-synucléine, présente chez les malades sous une conformation anormale qui favorisa son agrégation.
Une maladie professionnelle du régime agricole
Comme pour la maladie d'Alzheimer, les causes exactes de la dégénérescence neuronale sont incertaines, et l'âge est là encore le principal facteur de risque. Des facteurs génétiques et environnementaux semblent intervenir Le rôle de l'exposition aux pesticides est par exemple bien établi : les agriculteurs exposés aux insecticides de type organochlorés ont un risque accru de maladie de Parkinson, qui fait d'ailleurs partie des maladies professionnelles du régime agricole. Le tabac ou encore le café seraient eux des facteurs protecteurs, peut-être en raison de leur effet stimulant sur les neurones à dopamine.
Aujourd'hui, les malades sont traités par des précurseurs de la dopamine (L-dopa) ou des molécules qui miment son effet, ou encore des inhibiteurs d'enzymes chargées de sa dégradation. Efficaces sur les symptômes moteurs, ces médicaments n'empêchent pas la progression de la dégénérescence neuronale et des complications surviennent après cinq à dix ans de traitement. La kinésithérapie, qui entretient muscles et articulations et améliore la marche et l'équilibre, est proposée en parallèle.
Des pistes thérapeutiques très diverses
Pour les patients capables de supporter l'intervention et présentant un handicap important associé à une résistance vis-à-vis des traitements pharmacologiques, la stimulation cérébrale profonde a montré un effet bénéfique : elle consiste à implanter des électrodes dans une région précise du cerveau pour émettre des impulsions électriques à haute fréquence de manière continue grâce à un boitier implanté sous la peau.
Des essais de thérapie cellulaire, consistant à transplanter des neurones fonctionnels pour remplacer les neurones morts ou dégénérés, ont eu lieu chez des malades parkinsoniens, avec des bénéfices mitigés. Ce type de thérapie « réparatrice », actuellement très étudiée, notamment avec les cellules souches, reste néanmoins un espoir pour l'ensemble des maladies neurodégénératives. Réparation du cerveau, molécules de jouvence, nouvelles cibles thérapeutiques (lire ci-dessus) : la recherche est particulièrement active face à ces maladies tant redoutées, et toutes les pistes sont explorées pour parvenir demain à la mise au point de traitements efficaces.
Malheureusement, efficaces sur les symptômes moteurs, les médicaments n'empêchent pas la progression de la dégénérescence neuronale.
Parkinson : Nouvelle cible thérapeutique et espoirs de thérapie cellulaire
Une découverte majeure sur une protéine impliquée dans la maladie de Parkinson a été récemment réalisée à l'Institut Pasteur.
 Cette protéine, l'∝-synucléine, est présente chez les malades sous une forme mal repliée qui s'agrège dans le cerveau, et pourrait ainsi être à l'origine de la mort neuronale (voir p. 4). Mais comment s'y propage-t-elle ?
Cette protéine, l'∝-synucléine, est présente chez les malades sous une forme mal repliée qui s'agrège dans le cerveau, et pourrait ainsi être à l'origine de la mort neuronale (voir p. 4). Mais comment s'y propage-t-elle ?
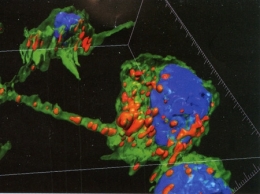
L'unité de Trafic membranaire et pathogenèse, dirigée par Chiara Zurzolo, a montré par microscopie à fluorescence que les fibrilles d'∝-synucléine pathogènes passent, en culture, de neurones en neurones par le biais de « nanotubes », des structures de communication intercellulaire récemment découvertes. « Ces nanotubes sont donc une nouvelle cible thérapeutique pour lutter contre la progression de la maladie de Parkinson mais aussi d'autres maladies neurodégénératives (Alzheimer, chorée de Huntington, maladies à prions...) dans lesquelles d'autres protéines "mal repliées", à l'étude dans mon laboratoire, sont impliquées, qui se propagent aussi via ces nanotubes », souligne Chiara Zurzolo. Son équipe, l'unité Perception et mémoire, dirigée par Pierre-Marie Lledo, et l'Institut Pasteur Hellénique à Athènes, ont également lancé une étude à partir de cellules de peau de personnes saines et de patients touchés par une forme familiale de Parkinson, chez lesquels le gène de l'∝-synucléine est muté. Grâce à une méthode aujourd'hui répandue, ces cellules de peau sont transformées en cellules souches puis différenciées en précurseurs de neurones (neuroblastes). Dans des modèles expérimentaux, ces neuroblastes sont injectés dans le cerveau, dans une région de maturation naturelle de nouveaux neurones (le bulbe olfactif), riche en neurones à dopamine, ceux précisément qui sont détruits dans la maladie de Parkinson. « Nous voulons savoir si ces neuroblastes humains peuvent se différencier en neurones dopaminergiques, et nos résultats préliminaires sont encourageants », explique Françoise Lazarini, chercheuse dans l'unité Perception et mémoire. « Nous allons aussi analyser l'effet des "neurones de malades" contenant le gène muté, et voir s'ils peuvent provoquer la maladie de Parkinson. Nous espérons à la fois ouvrir des pistes pour la thérapie cellulaire et mieux comprendre le mécanisme de la maladie, notamment le rôle de l'∝-synucléine».
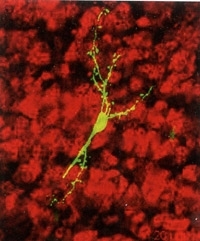
Neurones reliés par des nanotubes faisant circuler
les fibrilles d'∝-synucléine (en rouge). Visualisation 3D
« Plasticité » cérébrale et
réparation du cerveau
 Notre cerveau est extraordinairement dynamique. Cet organe de 1,5 kg, qui consomme 20% de l'énergie du corps, se modifie, se renouvelle, et même se répare. On sait depuis les années 2000 que, chez l'adulte, deux zones du cerveau (l'hippocampe et la zone sous-ventriculaire du bulbe olfactif) sont sources de nouvelles cellules nerveuses. Comment les nouveaux neurones se développent-ils ? Comment intègrent-ils des réseaux préexistants ?
Notre cerveau est extraordinairement dynamique. Cet organe de 1,5 kg, qui consomme 20% de l'énergie du corps, se modifie, se renouvelle, et même se répare. On sait depuis les années 2000 que, chez l'adulte, deux zones du cerveau (l'hippocampe et la zone sous-ventriculaire du bulbe olfactif) sont sources de nouvelles cellules nerveuses. Comment les nouveaux neurones se développent-ils ? Comment intègrent-ils des réseaux préexistants ?
Depuis 2010, une technique originale permet de stimuler sélectivement des nouveaux neurones rendus sensibles aux photons, et ainsi activables par des flashs lumineux. « Grâce à l'optogénétique, nous pouvons comprendre le rôle d'un neurone particulier, avec quel autre neurone il communique,  à quoi il sert...», explique Gabriel Lepousez, de l'unité Perception et mémoire de l'Institut Pasteur. « Nous avons ainsi montré que pour qu'un nouveau neurone s'intègre correctement dans un circuit, il lui faut établir de nombreuses connexions avec d'autres neurones, sinon il s'autodétruit. Son intégration est aussi influencée localement par l'inflammation ou le système immunitaire, et par des paramètres extérieurs au cerveau comme notre microbiote. » Qu'en est-il des espoirs de thérapie cellulaire visant à réparer des zones du cerveau lésées (par des maladies neurodégénératives ou un accident vasculaire cérébral (AVC) avec un apport de nouveaux neurones ? « L'étude de la plasticité cérébrale est la clé de ces futures thérapies » souligne le chercheur. « Mais il ne faut pas griller les étapes. En étudiant ce cerveau qui fonctionne à l'échelle de la milliseconde, nous découvrons que nous avions sous-estimé sa complexité. En revanche, nous n'avons jamais eu d'outils aussi puissants qu'aujourd'hui, et des physiciens et des mathématiciens nous aident à modéliser nos données pour mieux les analyser. Mais réparer des circuits endommagés du cerveau relève d'une médecine de très haute précision, et toutes les précautions doivent être prises pour soigner un organe si complexe, siège de notre conscience et de notre personnalité. »
à quoi il sert...», explique Gabriel Lepousez, de l'unité Perception et mémoire de l'Institut Pasteur. « Nous avons ainsi montré que pour qu'un nouveau neurone s'intègre correctement dans un circuit, il lui faut établir de nombreuses connexions avec d'autres neurones, sinon il s'autodétruit. Son intégration est aussi influencée localement par l'inflammation ou le système immunitaire, et par des paramètres extérieurs au cerveau comme notre microbiote. » Qu'en est-il des espoirs de thérapie cellulaire visant à réparer des zones du cerveau lésées (par des maladies neurodégénératives ou un accident vasculaire cérébral (AVC) avec un apport de nouveaux neurones ? « L'étude de la plasticité cérébrale est la clé de ces futures thérapies » souligne le chercheur. « Mais il ne faut pas griller les étapes. En étudiant ce cerveau qui fonctionne à l'échelle de la milliseconde, nous découvrons que nous avions sous-estimé sa complexité. En revanche, nous n'avons jamais eu d'outils aussi puissants qu'aujourd'hui, et des physiciens et des mathématiciens nous aident à modéliser nos données pour mieux les analyser. Mais réparer des circuits endommagés du cerveau relève d'une médecine de très haute précision, et toutes les précautions doivent être prises pour soigner un organe si complexe, siège de notre conscience et de notre personnalité. »
Neurones reliés par des nanotubes faisant circuler les fibrilles d'∝-synucléine (en rouge). Visualisation 3D.
Source :
2017…- Le dossier Altzheimer, Parkinson : où en est la recherche ? La lettre de l'Institut Pasteur septembre 2017 n° 98, pp. 1 à 6. Reproduction intégrale de l'article.


Les commentaires sont fermés.