Les Nématomorphes ou Gordiacés ou Gordiens
09/01/2018
Préambule
Des photos à identifier jointes à un courriel de Michel Cottet m'ont permis de reconnaître immédiatement la silhouette d'un Nématomorphe, sans doute un Gordius aquaticus. Alerté également, Jean-Yves Cretin parvenait à la même conclusion. Mais ce qui nous intriguait surtout, c'est de savoir comment cet animal aquatique parvenait à parasiter des Arthropodes terrestres. Cette discussion passionnée nous a obligés à fouiller dans internet pour comprendre la tactique de ce parasite manipulateur. C'est cette quête qui fait l'objet de cet article.
Les Nématomorphes ou
Gordiacés ou Gordiens
par André Guyard
avec le concours de Bertrand Cotte, Jean-Yves Cretin,
Michel Cottet et Jean-Louis Romand
(Article daté du 27/09/2014, modifié le 08/01/2018)
Taxinomie
Les Nématomorphes constituent, à côté des Nématodes, la seconde classe des Némathelminthes. Les Nématomorphes comprennent deux ordres :
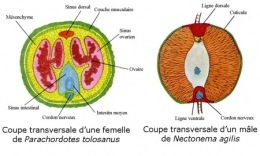
1. les Gordiida : formes d'eau douce et formes terrestres avec un champ épidermique ventral et pseudocoelome empli de mésenchyme. Une paire de gonades, des ovaires à diverticules latéraux.
Famille des Chordodidae : aréoles cuticulaires visibles et servant à la classification. Quatre sous-familles avec quatorze genres dont : Chordodes, Chordodiolus, Gordionus, Paragordius.
Famille des Gordiidae : aréoles invisibles ou absentes. Extrémité postérieure de la femelle non lobée, celle du mâle bilobée. Deux genres : Gordius, Acutogordius.
2. les Nectonematida : champs épidermiques dorsaux et ventraux, soies natatoires, pseudocoele cavitaire, une gonade, chaîne nerveuse intraépidermique. Écologie marine pélagique. Un seul genre : Nectonema de 200 mm de long, trouvé sur les côtes du Massachusetts, du golfe de Naples, des Indes néerlandaises, du Spitzberg et de la Norvège. (ex. : Nectonema agilis).
Deux gordiens sortis d'une sauterelle femelle Tettigonia viridissima qui s'était flanquée dans... la piscine de mes petites filles à Gizia (Jura) et que l'on voit déroulés dans le fond.
Cliché © Jean-Yves Cretin (11/08/2008).
Gordius aquaticus © Michel Cottet
Le ver est allongé sur les graviers sous un débris végétal
Paquet de "lombriciens aquatiques" filiformes, mais annelés avec, parmi eux, des gordiens beaucoup plus minces et lisses (2 ou 3 sont matérialisés par des flèches). Ce "tas" provient de la "source" qui coule dans ma rocaille et dont l'eau vient du toit de la maison d'une part, et d'un drainage de la nappe et des réseaux de galeries de lombrics d'autre part !
Cliché © Jean-Yves Cretin - Les Auxons Doubs (15/01/2012).
Du point de vue historique, les Gordiens sont entourés de nombreuses légendes. L'une d'elles, datant du XIVe siècle, affirme que ces animaux sont issus de crins de chevaux. Selon les pays, on les a appelés : hairworms, Saitenwurmer, dragonneaux. Placés par Linné dans les Vermes intestina, ils furent longtemps confondus avec les Nématodes, en particulier avec la filaire de Médine. Les travaux anatomiques de P. Charvet (1834), K. T. E. Siebold (1838), A. Berthold (1843) et ceux de F. Dujardin (1842) conduisirent Siebold en 1843 à les séparer des Nématodes sous le nom de Gordiacea. F. Vejdovsky (1886) en éloigna les Mermis et créa les Nematomorpha. Le fait que leurs larves parasitent des insectes fut découvert par L. Dufour en 1828, mais ce n'est qu'avec les travaux de E. Grube (1849) et G. Meisser (1856) que ces larves furent convenablement décrites. Les plus importantes contributions à l'étude des Nématomorphes furent, à la fin du XIXe siècle, celles de H. Grenacher (1868), A. Villot (1874, 1881, 1887), Vejdovsky (1886, 1888, 1894), L. Camerano (1888, 1897), O. Burger (1891) et H. B. Ward (1892). Au début du XXe siècle enfin, T. Montgomery (1903, 1904), A. Muhidorf (1914) et H. May (1919) se consacrèrent à l'étude de ce groupe.
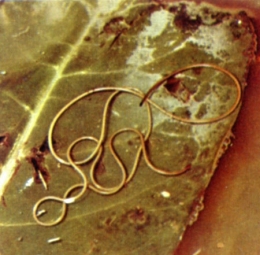
Gordius aquaticus sur une feuille (cliché DR)
Morphologie
Les Gordiens sont des vers allongés et filiformes, de couleur jaunâtre, dont la longueur peut dépasser le mètre, le diamètre n'excédant pas 2 à 3 mm. Le mâle est fréquemment plus petit que la femelle. L'extrémité postérieure, arrondie chez la femelle, est bi- ou trilobée chez le mâle et porte un cloaque terminal ou ventral.
Ce sont des parasites d'Arthropodes à l'état jeune, libres et vivant dans les eaux douces à l'état adulte.
Le type en est Gordius aquaticus Linnaeus, 1758 qui vit à l'état adulte dans l'eau douce (ruisseaux, sources, puits) ; Le corps est très grêle (30 à 90 cm de long sur 0,5 mm de diamètre), avec une coloration allant du jaune clair au marron foncé. L'extrémité antérieure est sans orifice ; l'extrémité postérieure, arrondie chez la femelle, bifurquée chez le mâle, ne montre que l'orifice cloacal. L'ouverture buccale et l'anus sont terminaux ou ventraux.
Gordius mâle enroulé © Jean-Louis Romand
Anatomie
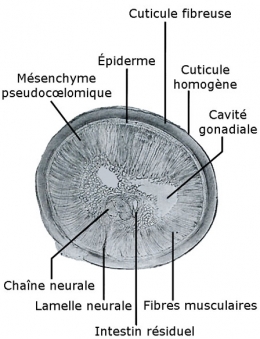
La paroi du corps des Nématomorphes présente quelques particularités (A). Elle est formée un épiderme revêtu d'une cuticule avec des soies. La cuticule est épaisse et comprend une assise homogène et une assise fibreuse. Dans la famille des Chordodidae, elle présente un aspect rugueux dû à la présence d'aréoles polygonales ou arrondies, qui peuvent porter des soies et un pore.
Comme chez les Nématodes, l'épiderme forme des épaississements, ou cordes, au nombre d'une ou deux. Sous l'épiderme, on a, insérées sur un seul champ ventral, des cellules myoépithéliales qui forment une couche musculaire. L'épiderme, cubique ou cylindrique, n'a qu'une seule assise de cellules. Selon les ordres, on trouvera soit un champ ventral, soit un ventral et un dorsal. Comme chez les Nématodes, les fibres musculaires sont longitudinales.
La cavité mésodermique est un pseudocoelome presque entièrement altéré chez Gordius par la présence de cellules mésenchymateuses.
Le tube digestif, atrophié dans ses régions antérieure et postérieure, y est remplacé par un parenchyme (pas de pharynx, et intestin partiellement atrophié). Plus ou moins régressé dans tous les stades du cycle, il ne comporte que rarement un orifice buccal. Le pharynx présente souvent un bulbe avant l'intestin. Le cloaque reçoit conduits génitaux et rectum. Le tube digestif de Nectonema rappelant ceux des Mermis et Trichuns (Nématodes aphasmidiens), diffère notablement de celui des Gordius.
Coupe histologique transversale de Gordius
Les Gordiens ne possèdent pas de protonéphridies ni de canaux excréteurs latéraux.
Leur système nerveux est analogue à celui des Nématodes. Comme celui des Échinodères et des Priapuliens, le système nerveux est épidermique. Il est constitué par une masse ganglionnaire antérieure d'où part un cordon nerveux ventral rattaché à l'épiderme par une lamelle nerveuse. La masse ganglionnaire cérébrale se prolonge par une chaîne nerveuse médioventrale qui se termine en un ganglion cloacal. Le système nerveux périphérique est encore mal connu et serait présent chez Paragordius.
Les organes des sens sont primitifs : on distingue des cellules nerveuses à fonction tactile, des soies sensitives le long du corps. Un organe photosensible, sorte de fossette située à l'avant du corps, est renfermé dans une capsule, au fond de laquelle se trouve une couche de cellules de type rétinien ; cette dernière couche est surmontée par un mince épiderme.
Les sexes sont séparés. Les mâles démunis de spicules sont plus petits que les femelles. Une paire de gonades s'étend dans le pseudocoelome. L'ovaire est prolongé par un oviducte muni d'un réceptacle séminal.
Locomotion, alimentation
Isolés, surtout les mâles, plus actifs, ils nagent au moyen de larges ondulations du corps ou rampent sur le fond. Mais on les rencontre souvent entortillés en paquets inextricables (nœuds gordiens) enchevêtrés parmi les plantes aquatiques et les débris végétaux.
Les adultes n'ont aucune activité buccale : la nutrition serait transcuticulaire et l'épiderme des jeunes produirait des enzymes capables de digérer les tissus de l'hôte qui les héberge. Aucun mécanisme excréteur n'a été décelé.
Reproduction
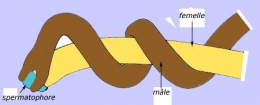
Au début de la belle saison, les biotopes favorables abondent en individus des deux sexes : bords de rivières, lacs, étangs et mares. Le mâle semble capable de détecter à distance la présence du sexe opposé et de distinguer les femelles vierges des gravides. Ces dernières ne sont pas pour autant systématiquement dédaignées. Les mâles et les femelles matures s'accouplent dans l'eau souvent au sein de volumineux pelotons. Le mâle enroule son extrémité postérieure autour de celle de la femelle et dépose une goutte de sperme au voisinage du cloaque de sa partenaire. Les spermatozoïdes remontent vers le réceptacle séminal. La ponte suit rapidement la fécondation et les œufs sont agglutinés en cordons visibles dans l'eau, au voisinage des parents.
Copulation de Gordius (spermatophore = masse de spermatozoïdes)
Développement et cycle
On peut distinguer trois stades dans l'évolution des gordiacés :
1) un stade larvaire libre,
2) un stade juvénile parasite,
3) un stade adulte libre.
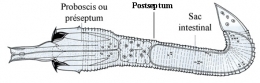
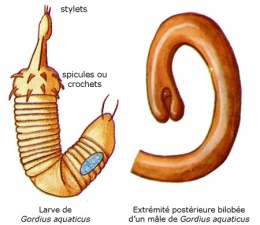
Les œufs fécondés sont pondus en chapelet par la femelle dans l'eau. La segmentation de l'œuf est égale et donne une gastrula typique. L'ectoderme de la région antérieure de l'embryon s'épaissit. On aboutit à une larve libre de 1/10e mm de longueur caractérisée par son corps transparent divisé nettement par un septum musculeux en deux régions, le préseptum (proboscis = prosoma) et le postseptum (tronc).
Larve échinodéroïde de Gordius aquaticus avec la trompe dévaginée
Larve échinodéroïde de Gordius aquaticus avec la trompe invaginée
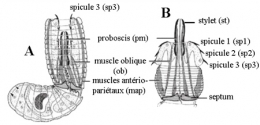
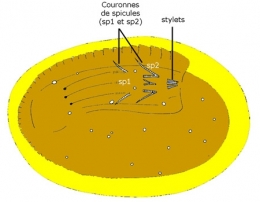
vue sous loupe binoculaire. sp : spicules, st : stylets
(cliché M. Müller 2004)
Larve de Chordodes sp. (muscles du préseptum grisés) avec trompe invaginée (A) et dévaginée (B) montrant les trois couronnes de spicules (sp1, sp2, sp3) (d'après Zapotovsky 1974).
Le préseptum se transforme en une trompe dévaginable, appareil perforant armé de deux couronnes longitudinales de spicules (crochets) chitinoïdes. Les mouvements de la trompe mue par des muscles puissants autorisent une sorte de reptation et permettront à la larve de perforer, le cas échéant, les tissus de son futur hôte.
Le tronc présente à l'intérieur un intestin privé d'ouverture à l'avant et qui se termine par une ouverture anale.
La larve dépourvue d'orifice buccal, donc incapable de s'alimenter, mène une vie aquatique libre très courte, ressemble à celle des Priapuliens et des Échinodères. Elle ne peut donc vivre longtemps et la poursuite du cycle nécessite la présence d'un hôte intermédiaire terrestre ou aquatique avant de s'installer dans l'hôte définitif Pour cela, elle dispose de ses couronnes de crochets qui vont lui permettre de s'amarrer, soit sur la végétation aquatique, soit sur un hôte aquatique.
1) Cas où l'hôte aquatique intermédiaire ne présente pas les conditions favorables
La larve peut ainsi s'enkyster par fixation sur un animal aquatique, comme une limnée (gastéropode pulmoné). Si elle est avalée par un alevin de Poissons ou un têtard d'Amphibiens, la larve du nématomorphe s'y enkyste ; elle ne se développera que si cet hôte intermédiaire porteur des kystes est dévoré par un prédateur, hôte favorable qui constituera l'hôte définitif (insecte carnassier, poisson…). Ce mode d'infection a été réalisé expérimentalement quand des Dytiques dévorent de petits poissons ou de têtards contenant des larves de Gordius enkystées (A. Dorier 1932). La suite de l'histoire rejoint alors le deuxième cas ci-dessous.
Larve de Gordius enkystée
2) Cas où la larve se trouve en présence d'un hôte intermédiaire aquatique favorable
La pénétration se fait par effraction, dans un petit animal aquatique (insecte, Myriapode ou arachnide pour les Gordiida : pagure ou crabe pour Nectonema). Le comble de l'élégance s'est de se faire avaler par une larve aquatique d'un insecte aérien : larves d'Éphéméroptères, d'Odonates, de Trichoptères, de Diptères qui seront consommées sous forme d'insecte aérien adulte par l'hôte définitif terrestre. C'est le cas de la larve échinodéroïde de Gordius, capable de s'enkyster dans un mucus sécrété par une glande située près de l'extrémité antérieure du tube digestif et pouvant attendre ainsi plusieurs semaines d'être avalée par la larve aquatique d'insecte. Parvenue dans l'intestin de cette larve, elle en traverse la paroi à l'aide de son appareil perforant et s'installe dans la cavité générale (A. Dorier 1932).
3) Cas où l'hôte définitif est un Arthropode terrestre prédateur
Pour compléter leur cycle de vie, les Gordiidés doivent effectuer une transition du milieu aquatique vers le milieu terrestre. Cependant, les larves aquatiques sont épibenthiques et leur habitat ne chevauche pas l'habitat de leurs hôtes définitifs. Cette évidence a conduit de nombreux chercheurs à suggérer que les infections d'hôtes terrestres sont acquises par l'ingestion d'insectes qui s'infectent en absorbant des larves aquatiques infestées par des kystes gordiens qui se trouvent ainsi transposés sur le milieu terrestre.
La plupart des hôtes terrestres des Gordiacés sont des Arthropodes prédateurs (Carabes, Myriapodes Chilopodes) qui s'infestent en dévorant des Insectes (Éphémères, Chironomes) tombés à terre et issus de larves aquatiques contenant des kystes de Gordius. Certains orthoptères comme les grillons bien que phytophages n'hésitent pas à dévorer ce genre d'insectes. Ce cycle de vie proposé a été testé expérimentalement par Ben Hanelt (2004) en utilisant trois espèces américaines communes de Gordiidés : Gordius robustus, Paragordius varius, et Chordodes morgani. Cet auteur a constaté que les kystes de l'ensemble des trois espèces ont survécu à la métamorphose d'un chironome Tanytarsus sp.
Carabe doré parasité par un Gordien © Jean-Louis Romand
L'observation d'autres espèces d'imagos hôtes définitifs infestés par des kystes montre que les kystes survivent à la métamorphose des insectes et restent viables et sans provoquer de réaction de défense interne de l'hôte. Les données provenant d'Éphémères Callibaetus sp naturellement infestées, montrent que l'enkystement et la survie des Gordiidés se rencontrent chez les insectes aquatiques présents dans la nature. La paratenèse entre les hôtes paraténiques a pu être constatée chez ces trois espèces. Ainsi, les kystes formés dans des hôtes paraténiques parasités peuvent être éventuellement transférés aux hôtes paraténiques normaux.
4) Cas où l'hôte définitif est un Arthropode terrestre phytophage
C'est le cas des Myriapodes Diplopodes qui peuvent s'infester en avalant des larves de Gordius qui peuvent s'entourer de mucus, se replier sur elles-mêmes et s'enkyster dans l'eau en se fixant aux végétaux d'une prairie inondable. Elles peuvent résister exondées plusieurs semaines dans un air humide et être consommées par des insectes phytophages. Expérimentalement, on a pu observer que de tels kystes soumis au suc digestif d'un insecte se gonflent et se déchirent laissant échapper les larves de Gordius qui pénètrent alors dans la cavité générale de l'insecte par effraction de la paroi intestinale.
Un orthoptère Anonconotus parasité par un Gordien
© Roger de La Grandière
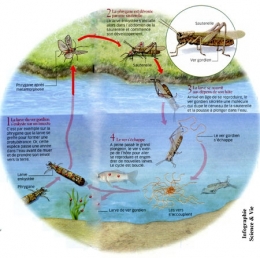
Pendant tout le cycle de l'insecte qui se métamorphose en un imago ailé, le nématomorphe s'allonge, grossit, devient un petit ver blanchâtre qui poursuit sa croissance aux dépens du tissu lipidique de l'insecte. Le stade juvénile est atteint après plusieurs semaines (ou mois) de développement dans l'hôte. Certains caractères larvaires persistent (cuticule, épiderme) ou se différencient ; d'autres (stylets, crochets de la trompe, glande à mucus) disparaissent. Les cellules épidermiques sont à l'origine du développement de la masse nerveuse antérieure. L'intestin larvaire devient définitif. Les organes génitaux du parasite se développent, son tégument chitineux s'épaissit et se colore. La taille adulte atteinte, le nématomorphe perfore alors la paroi abdominale de son hôte au voisinage de l'anus. C'est alors que le parasite va manipuler son hôte pour l'entraîner à se jeter à l'eau. Il abandonne alors celui-ci en le perforant et se retrouve en milieu aquatique.
Les quatre stades du cycle du parasite.
Hôte définitif : la sauterelle Meconema thalassinum.
(Pour l'agrandir, cliquez sur l'image)
Si par hasard, l'hôte définitif à l'eau est consommé par un prédateur, par exemple le grillon attrapé par une grenouille ou une truite, l'insecte sera mangé, mais le parasite s'en tirera intact en s'échappant par la gueule de l'amphibien ou par la gueule ou les ouïes du poisson.
Grillon des bois Nemobius sylvestris infesté par Paragordius tricuspidatus
© Pascal Goetgheluck
La manipulation de l'hôte définitif par le nématomorphe
Les travaux de l'équipe de Montpellier (Organismes Parasitiquement Modifiés : OPM) travaillant au sein de l'Institut de recherche pour le développement (IRD) ont pu démontrer cette manipulation du comportement de l'hôte par le nématomorphe Paragordius tricuspidatus adulte qui incite le grillon des bois Nemobius sylvestris, dans lequel il s'est développé, à se jeter dans une collection d'eau, où le ver peut se reproduire. Le grillon peut avaler une ou plusieurs larves du ver. La larve se développe durant près d'un an dans l'abdomen de l'insecte en se nourrissant de sa graisse et de ses organes reproducteurs. Au stade adulte, le ver contraint l'insecte à se diriger vers les espaces libres en sécrétant une substance qui agit sur son système nerveux. L'insecte est brusquement attiré par la lumière, ce qui augmente la probabilité qu'il rencontre une étendue d'eau, généralement située dans un espace découvert. Le grillon finit souvent par rencontrer un cours d'eau où il se jette, sans forcément y mourir. Le ver émerge alors par effraction hors de la cavité abdominale du grillon (voir la photo ci-dessus).
Le grillon des bois Nemobius sylvestris peut survivre à son bain forcé après la libération de son ver parasite. Mais les femelles seront stériles et présenteront une morphologie larvaire, ovipositeurs réduits en particulier qui empêcheront la réussite de la copulation.
En 2005, au sein de l'équipe OPM de Montpellier, Frédéric Thomas et Frédéric Libersat ont mis en évidence des protéines qui semblaient altérer le fonctionnement du système nerveux du grillon. Un grillon parasité se jette à l'eau non sous l'action de ses propres molécules et de ses propres gènes, mais par le jeu de certains gènes et des molécules correspondantes du nématomorphe, illustrant le concept de phénotype étendu. Cela ne va pas sans inconvénient : le parasite consacre une certaine énergie à manipuler son hôte, au détriment d'autres fonctions vitales, telles la croissance et la fécondité. Il lui faut trouver un compromis entre ces différentes fonctions. Notons que ce raisonnement reste théorique : personne n'a encore mesuré l'énergie dépensée par un parasite pour manipuler son hôte.
Malgré l'augmentation des preuves de la manipulation de l'hôte phénotypique par des parasites, les mécanismes sous-jacents causés à des hôtes infectés modifiant le comportement de l'hôte restent énigmatiques dans la plupart des cas.
Les bases biomoléculaires de la manipulation de l'hôte
Afin d'identifier les altérations biochimiques qui se produisent dans la tête du grillon Nemobius sylvestris quand il est poussé à l'eau par le nématomorphe, l'équipe de Montpellier (2006), a caractérisé les protéomes de l'hôte et du parasite pendant l'expression du comportement de recherche d'eau en élucidant les ressorts moléculaires de cette stratégie a priori unique dans le monde des parasites manipulateurs. On n'avait encore jamais constaté une telle manipulation chimique "directe".
Par une technologie appelée "analyse protéomique" (électrophorèse de protéines) qui permet de "photographier" à un instant donné l'ensemble des protéines candidates à la manipulation produites par un organe, technologie couplée à la bioinformatique appliquée à l'expression des gènes impliqués au cours de la manipulation, les chercheurs ont mis en évidence que des molécules de la famille Wnt produites par le parasite peuvent agir directement sur le développement du système nerveux central de l'hôte. C'est en injectant dans le cerveau du grillon certaines molécules que le ver réussit à déclencher ce comportement aberrant.
"Jusqu'à présent, les biologistes avaient identifié des stratégies de manipulation où le parasite incite son hôte à sécréter lui-même les substances qui vont le manipuler, explique Frédéric Thomas. Or, nous avons ici affaire à une manipulation 'directe' : c'est le ver lui-même qui sécrète les molécules qui, une fois transmises à l'hôte, influenceront son comportement."
Encore fallait-il le démontrer. Pour cela, les chercheurs ont eu l'idée d'analyser les protéines sécrétées par le cerveau du grillon Nemobius sylvestris à trois instants distincts : quelques secondes avant le saut, juste après le saut et quinze minutes après le saut. Dès lors, les chercheurs n'ont eu qu'à comparer les molécules mises en évidence avec celles habituellement fabriquées par le gordien. Résultat : "Nous avons trouvé dans le système nerveux de la sauterelle la présence de molécules Wnt produites par le ver alors qu'elles y sont habituellement absentes, rapporte le biologiste. Nul doute que leur transmission au grillon joue donc un rôle décisif dans le déclenchement du saut dans l'eau." Question : comment se fait-il que l'organisme de la sauterelle ne détecte pas l'origine étrangère de ces molécules Wnt émises par le ver ? L'explication tiendrait à une astuce dite "mimétisme moléculaire".
"II faut savoir que le grillon produit naturellement des protéines Wnt, décrit Didier Biron. Et bien, nous avons découvert que leur structure, sans être identique aux Wnt du ver, est extrêmement proche." Tel serait donc le secret du gordien : il profite de la ressemblance qui lie ses Wnt avec celles de la sauterelle pour les exfiltrer dans le système nerveux de celle dernière sans qu'elles soient détectées... et déclencher ainsi le saut. Comme le résume le chercheur : "Le gordien est un falsificateur qui accède aux manettes du comportement de son hôte en usant de ses propres molécules comme autant de fausses clés. "
Un subtil dialogue se noue
Cependant, si le principe utilisé par le ver pour manipuler le comportement du grillon est élucidé, la compréhension du processus chimique menant au saut dans l'eau demeure encore très partielle : "Les Wnt sont des protéines dites 'carrefour', dont les fonctions sont tellement nombreuses qu'elles ne nous permettent pas, à l'heure actuelle, de comprendre comment elles finissent par générer chez les orthoptères cette propension à se jeter à l'eau" explique Didier Biron. En fait, face à ce subtil dialogue moléculaire qui se noue entre l'orthoptère et le gordien, les chercheurs sont un peu comme des enquêteurs qui, via les outils d'analyse protéomique, ont placé les deux animaux sur écoute : seules des bribes de conversation leur parviennent, et ils peinent encore à établir la teneur précise des propos.
Néanmoins, une piste s'offre depuis peu : en scrutant le cerveau des grillons infestées, l'équipe montpelliéraine a remarqué que, lorsque ces derniers sont en phase de manipulation par le ver. la production de plusieurs protéines varie de façon inhabituelle. Et parmi celles notamment impliquées dans la régulation du rythme circadien de la sauterelle ou dans la croissance de son système nerveux se trouve la protéine "isoform D", qui joue un rôle important dans la géotaxie de l'insecte. C'est ce qui caractérise la position de l'animal par rapport au sol. Or, la perturbation de cette fonction pourrait justement être l'un des déclencheurs du comportement erratique du grillon avant son comportement aberrant qui le précipitera dans l'eau.
Tous ces travaux ne sont pas de pure forme. "D'ici à quelques années, s'enthousiasment les chercheurs, nous envisageons de créer une banque de données qui regrouperait l'ensemble des molécules des insectes utilisées par les parasites manipulateurs. Des informations qui pourraient se révéler utiles à la recherche médicale pour qui les connaissances acquises par les biologistes sur les stratégies des parasites se révèlent souvent précieuses dans la conception de nouveaux vaccins et médicaments." Mais avant de réaliser cet objectif, les chercheurs doivent encore se concentrer sur la relation qui unit les gordiens et leurs hôtes et, notamment, élucider la nature précise des molécules utilisées par le ver. D'où la prochaine étape, prévue pour 2006 : injecter dans le cerveau d'orthoptères sains des protéines Wnt, afin de voir si elles engendrent, seules, le comportement du saut dans l'eau.
Au niveau du système nerveux central du grillon manipulé, ils ont trouvé une expression différentielle des protéines du domaine CRAL-TRIO spécifiquement liées à la neurogenèse, le rythme circadien et les activités de neurotransmetteurs. La vision du grillon serait bouleversée et l'animal quitterait les bois pour arpenter des espaces plus lumineux, souvent aboutissant à une collection d'eau.
Du point de vue histologique, on note au niveau du cerveau, une surproduction de neurones qui aboutit à la déconnexion de synapses, alors que dans d'autres cas (voir plus bas), l'expression des protéines aboutit à une mort des neurones (apoptose). Ces deux modes d'action entraînent un oubli du comportement normal et la création d'un comportement aberrant.
Une autre étude protéomique sur les voies biochimiques altérées par les Gordiens a également permis de traiter des questions de convergence physiologique et moléculaire dans le mécanisme entraînant la modification du comportement des orthoptères, des molécules efficaces produites par d'autres espèces de nématomorphes agissant directement sur le système nerveux central de leurs hôtes orthoptères.
Ce genre d'études peut être généralisé à d'autres cas de manipulations des hôtes par les parasites. C'est le cas du nématomorphe Spinochordodes tellinii dont l'hôte définitif est la sauterelle des chênes, ou méconème tambourinaire (Meconema thalassinum). L'insecte est également brusquement attiré par la lumière, ce qui augmente la probabilité qu'il rencontre une étendue d'eau, généralement située dans un espace découvert. Dans ce cas, l'équipe de Montpellier a pu montrer que l'action des protéines manipulatrices provoquait la mort de certains neurones du cerveau de l'hôte engendrant ainsi son comportement aberrant de recherche d'eau.
On peut s'interroger sur l'implication de telles protéines manipulatrices sur d'autres parasitoses, en particulier dans le cas des affections comme le paludisme, la fièvre jaune, le chikungunya, la dengue ou la maladie du sommeil impliquant des insectes piqueurs et transmettant à l'homme, hôte définitif des parasites.
Au-delà des possibles applications médicales, les découvertes de l'équipe de Frédéric Thomas ont aussi une portée théorique. Car elles valident les prédictions de la théorie dite du "phénotype étendu", énoncée en 1982 par le biologiste britannique Richard Dawkins[1]. Le phénotype est l'ensemble des caractères physiques d'un organisme. Il dépend de l'expression du génotype, l'ensemble des gènes de cet organisme. Selon R. Dawkins, une part du génotype du parasite est aussi responsable du phénotype modifié de l'hôte : certains de ses gènes s'expriment et leurs produits agissent dans l'hôte et modifient son comportement.
[1] Au sein de la seconde édition du livre Le Gène égoïste'" initialement édité en 1976 aux Presses Universitaires d'Oxford.
Loin, encore aujourd'hui de faire l'unanimité, cette approche stipule qu'il faut cesser de considérer que les gènes n'agissent que dans les strictes limites de l'organisme dans lequel ils 'résident', mais, au contraire, les voir dotés d'un pouvoir d'action qui dépasse les limites de cet organisme. N'est-ce pas précisément ce qui se passe entre le gordien et l'insecte ? Ce sont les gènes du premier qui, via les molécules qu'ils lui permettent de sécréter, étendent leur pouvoir au dehors de l'organisme dans lequel ils résident, en modifiant in fine le comportement du deuxième. Ce qui illustre à merveille ces propos du biologiste britannique, rédigés en 1989. "Il est des cas où tout se passe comme si les gènes sortent de leur 'propre corps' et manipulent le monde extérieur"... On le voit, c'est à une nouvelle façon de regarder l'évolution que convie aussi l'étrange lien que nouent les gordiens et leurs hôtes.
Comment l'évolution a-t-elle pu favoriser une stratégie aussi tarabiscotée ? Inutile de prêter au gordien une quelconque intelligence cachée : c'est tout simplement au hasard que cette machiavélique aptitude à la manipulation doit son existence : "Au cours de l'évolution, la sélection naturelle a évidemment favorisé les vers les plus aptes à initier ce fameux 'dialogue moléculaire' avec les orthoptères" explique Frédéric Thomas. Soit, concrètement, ceux qui ont développé les mutations génétiques les rendant aptes à produire des protéines Wnt de structure comparable à celles fabriquées par ces insectes." En revanche, les vers qui n'en étaient pas capables, ou seulement imparfaitement, ont fini par disparaître. faute de pouvoir rejoindre efficacement leur lieu de reproduction.
Bibliographie
- Ben Hanelt (2004). - Life cycle and paratenesis of American Gordiids (Nematomorpha: Gordiida). J. Parasitol., 90(2), pp. 240-244.
- Kermarrec A. Némathelminthes Encyclopedia Universalis Tome XII.
- Lefèvre T. et al., The ecological significance of manipulative parasites, Trends in Ecology and Evolution, vol. 24, pp. 41-48.
- Libersat F. et al, (2009).- Manipulation of host behavior by parasitics insects and insects parasites, Annu. Re. Entomol., vol. 54, pp 189-207.
- Revoy N. (2005).- Sauterelles : un ver les pousse au suicide. Science & Vie n° 158 novembre 2005, pp 92-97.
- Thomas F. et al, (2002).- Do hairworms (Nematomorpha) manipulate the water seeking behaviour of their terrestrial hosts? J. Evolution. Biol. 15(3), pp.356-361.
- Thomas F. et al, (2010).- Biologie évolutive, De Boeck Ed. 827 p.
- Thomas F. et Libersat F. (2010).- Les parasites manipulateurs, Pour la Science n° 391 mai 2010, pp. 36-42.
- Vidéo (2010) Un film de Yves Élie : Toto le Némato. VB Films, CNRS Images.










1 commentaire
Je reçois cette page grâce à Michel Cottet.
C'est par une lecture passionnante que démarre ma journée !
De plus, je connais à présent l'origine de l'expression "noeud gordien"!
F. Robardet
Les commentaires sont fermés.