Intensification thérapeutique avec support de cellules souches dans le traitement des myélomes multiples
10/10/2013
Intensification thérapeutique avec support de cellules souches dans le traitement des myélomes multiples
(Dernière mise à jour : mars 2015)
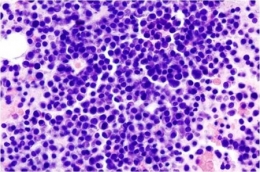
Myélome multiple : image histopathologique d'un extrait de la moelle osseuse. Coloration à l'hématoxyline et à l'éosine (illustration @Wikimedia).
Introduction
La Chimiothérapie à haute dose avec support de cellules souches est une option thérapeutique importante pour les patients éligibles, atteints de myélome multiple. Qu'elle soit réalisée dans le cadre du traitement de première ligne ou au moment de la rechute de la maladie, elle peut donner des réponses d'excellente qualité et un avantage de survie. Le traitement à haute dose avec support de cellules souches, ou greffe de cellules souches, comme on rappelle parfois, est l'étape 5 des 10 étapes pour de meilleurs soins de l'IMF. Cette note explique le rationnel et le côté pratique de la chimiothérapie à haute dose avec greffe de cellules souches en tant qu'option thérapeutique dans le myélome. Les questions abordées seront les suivantes :
• Que sont les cellules souches hématopoïétiques ?
• Pourquoi les cellules souches sont-elles recueillies et utilisées pour une greffe ?
• Quels sont les avantages et les risques de la chimiothérapie à haute dose avec greffe de cellules souches dans le cadre du traitement du myélome ?
• Quel est le rôle de la chimiothérapie à haute dose depuis l'introduction de nouvelles drogues ces dix dernières années? Peuvent-elles être associées ?
Tous les mots qui apparaissent en caractères gras, ainsi que les autres termes pertinents sont définis à la fin de cette note.
Rationnel pour l'utilisation de la chimiothérapie à haute dose avec greffe ou support de cellules souches hématopoïétiques
Les cellules myélomateuses et les cellules souches normales ou cellules souches hématopoïétiques cohabitent dans le même microenvironnement au niveau de la moelle osseuse. Comme les cellules myélomateuses s'accumulent dans la moelle osseuse, elles se mélangent avec les cellules souches normales responsables de la production des globules rouges et blancs et des plaquettes. Tous les médicaments anti-myélome atteignant le microenvironnement de la moelle osseuse peuvent donc endommager à la fois les cellules myélomateuses et les cellules souches normales.
Le melphalan, un agent de chimiothérapie appartenant à la famille des alkylants, est un traitement très efficace dans le myélome, mais il peut aussi endommager les cellules souches normales. De fortes doses de melphalan peuvent être particulièrement utiles pour éradiquer les cellules myélomateuses dans la moelle osseuse. Pour contourner le problème des dommages collatéraux sur les cellules souches normales, ces cellules souches sont collectées et congelées avant que le melphalan ne soit administré à forte dose.
Les cellules souches normales sont collectées ou recueillies chez le patient ou un donneur par un processus appelé cytaphérèse. Les cellules souches recueillies sont ensuite congelées à -80 degrés. Elles peuvent être conservées indéfiniment à cette température. Lorsque le patient recevra les fortes doses de melphalan, les cellules souches seront alors décongelées et réinjectées dans la circulation sanguine du patient par un procédé analogue à celui d'une transfusion sanguine. Les cellules souches sont ensuite capables de retourner dans la moelle osseuse, où elles vont se diviser et croître pour repeupler la moelle osseuse. Environ 36 à 48 heures après son administration, les concentrations sanguines et tissulaires de melphalan sont très faibles et ne nuisent pas à la croissance des cellules souches. L'ensemble du processus de collecte et de réinjection est appelée greffe de cellules souches, ou support de cellules souches, parce que les cellules souches "sauvent" la moelle osseuse des effets de la chimiothérapie à haute dose.
Les différents types de greffe de cellules souches
• Autogreffe de cellules souches, ou, plus exactement, intensification thérapeutique avec autogreffe de cellules souches.
Les cellules souches sont recueillies chez le patient atteint de myélome après le traitement initial et réinjectées après un traitement par melphalan à haute dose. Il s'agit du type de greffe de cellules souches le plus courant. La procédure peut être effectuée une fois (autogreffe simple) ou deux fois (double transplantation ou en tandem) voire plusieurs fois.
• Greffe Syngénique de cellules souches
Les cellules souches sont recueillies chez un vrai jumeau. Dans ce cas, les cellules souches du vrai jumeau sont réinjectées après une chimiothérapie à haute dose par melphalan ou par d'autres agents.
• Allogreffe de cellules souches
Les cellules souches sont recueillies chez un membre de la famille qui n'est pas un jumeau identique, mais parfaitement compatible par typage tissulaire (système HLA). Habituellement, le meilleur donneur est un frère ou une sœur. Encore une fois, les cellules souches sont réinjectées après la chimiothérapie à haute dose. Les effets anti-cancer de ce type de greffe découlent en partie de la chimiothérapie à haute dose, et en partie de l'effet des cellules greffées, ou transplantées, sur la maladie. Les cellules transplantées reconnaissent les cellules cancéreuses comme étrangères, les attaquent et les tuent. C'est ce qu'on appelle l'effet du greffon contre le myélome. Le problème avec les cellules souches du donneur, c'est qu'elles peuvent aussi reconnaître certaines cellules normales du receveur comme étrangères, et donc les attaquer, provoquant la maladie du greffon contre l'hôte, ou GVH. Certains cas de GVH sont contrôlables, et certains ne le sont pas. Lorsque la GVH ne peut pas être contrôlée, elle peut être mortelle. Cette procédure est rarement utilisée chez les patients atteints de myélome, avec une chimiothérapie à très forte dose parce que le risque de décès par GVH est d'environ 45%. La greffe allogénique à pleine dose a été largement abandonnée pour les patients atteints du myélome au début des années 1990.
• "Mini"allogreffe ou non myéloablative
Il s'agit d'une procédure plus sûre que l'allogreffe complète ou standard. Elle utilise une chimiothérapie d'intensité réduite en association avec une greffe de cellules souches d'un donneur compatible. Une autogreffe est le plus souvent effectuée en premier, afin de réduire la charge tumorale du myélome, puis, dans les 180 jours, une dose réduite de la chimiothérapie est administrée avant que le patient ne reçoive les cellules souches du donneur. Bien que la GVH et l'effet du greffon contre le myélome puissent encore se produire, ils ne sont généralement pas aussi graves que dans l'allogreffe standard.
• Allogreffe de cellules souches de donneur non apparenté
Les cellules souches sont recueillies chez un donneur extrafamilial. Dans ce cas, les cellules souches sont plus rarement compatibles à 100%. D'où le terme de "mismatch" fréquemment utilisé dans cette situation. Une greffe non apparentée comporte un risque beaucoup plus élevé de GVH et est une procédure globalement plus risquée.
Comment l'intensification thérapeutique avec greffe de cellules souches est intégrée dans le traitement du myélome ?
- Généralités
La chimiothérapie à haute dose avec greffe de cellules souches est utilisée dans le traitement du myélome depuis plus de deux décennies. Les médecins tentent de tuer autant de cellules myélomateuses que possible pour "réduire la masse tumorale" avant de recueillir les cellules souches puis d'administrer la chimiothérapie à forte dose (HDT). Les patients doivent donc recevoir une induction ou traitement de "première ligne" avec divers médicaments avant de commencer le processus d'intensification thérapeutique. Même en cas de réponse minimale à l'induction, les patients peuvent procéder à la collecte, au traitement à haute dose avec greffe de cellules souches ; ils ont encore d'excellents résultats. La réponse après l'HDT est beaucoup plus importante que la réponse avant, et ce tant que la maladie n'est pas progressive.
- Les options de première ligne
Plusieurs options sont disponibles comme traitement d'induction ou de première ligne. Les traitements de première ligne les plus couramment utilisés sont :
•Velcade® (bortezomib) plus dexamethasone avec une troisième drogue comme le Thalidomide (T) voire le Revlimid® (lenalidomide) (R) ou l'Endoxan (C).
Les acronymes pour ces régimes d'induction sont : VTD, VRD et VCD ou CyBorD aux USA.
• Dans d'autres pays, l'association d'un des 2 IMiDs (agents immunomodulateurs) Thalidomide ou Revlimid à la dexamethasone peut être proposée aux patients candidats à l'intensification avec un recueil des cellules souches organisé après 4 cycles.
Options de première ligne à considérer et à éviter
Généralement, la greffe de cellules souches est une option pour tous les patients atteints du myélome à la fin du traitement d'induction. Toutefois, la greffe étant une approche intensive, les patients âgés de plus de 65 ans et/ou ceux atteints d'autres pathologies médicales peuvent ne pas être en mesure de tolérer la procédure et/ou peuvent courir le risque de graves complications. Si la greffe de cellules souches est envisagée comme une option, il est important d'éviter l'usage du melphalan avant le prélèvement des cellules souches, puisque cela peut les endommager. Ainsi, la stratégie la plus souvent recommandée consiste à éviter de prime abord l'usage du melphalan. Toutefois, si la greffe de cellules souches s'avère impossible ou n'est pas souhaitée, quelle qu'en soit la raison, le melphalan par voie orale (comprimés), utilisé dans le cadre du traitement initial, peut s'avérer un traitement simple et très efficace.
En résumé
Les cellules souches sont prélevées, la chimiothérapie à forte dose est ensuite administrée et la greffe est réalisée, tout cela à la suite du traitement d'induction ou de première ligne. Les deux points majeurs du traitement d'induction sont :
• Le traitement d'induction, pour une durée de 3 à 6 mois, doit préserver les cellules souches normales.
• Théoriquement, une réponse au traitement d'induction devrait entraîner une baisse de >50% de la protéine monoclonale et/ou d'autres indicateurs de myélome actif avant le prélèvement des cellules souches. Toutefois, un taux de réponse inférieur peut suffire pour réaliser dans de bonnes conditions un prélèvement de cellules souches (qui ne sont pas malades).
Quels sont les avantages de la chimiothérapie à forte dose avec support de cellules souches ?
Amélioration de la profondeur de la réponse
L'augmentation du taux de réponse obtenu dans le cadre du traitement de première ligne est un avantage important de l'intensification thérapeutique avec greffe de cellules souches. Dans plus de la moitié des cas, les réponses s'améliorent de façon considérable avec des réponses partielles qui deviennent une TBRP (très bonne réponse partielle, baisse de 90 % de la protéine monoclonale) voire une RC (réponse complète, disparition du composant monoclonal).
Amélioration de la survie
L'introduction des nouvelles drogues dans les régimes d'induction a permis d'augmenter considérablement les taux de TBRP ou RC et, l'avantage supplémentaire du traitement à haute dose dans ce contexte est étudié spécifiquement. La chimiothérapie à haute dose a démontré un bénéfice statistiquement significatif après chimiothérapie d'induction classique (par opposition aux nouvelles associations) utilisant anciennement le VAD. Toutefois, les nouvelles combinaisons thérapeutiques peuvent produire des niveaux plus élevés de TBRP et RC que la chimiothérapie classique. Les résultats de deux études comparant les nouvelles combinaisons seules contre nouvelles combinaisons plus HDT avec greffe de cellules souches ont été présentées au congrès de la AmericanSocietyofHematology (ASH) en décembre 2011. Les données préliminaires suggèrent que, malgré des effets toxiques accrus, les nouvelles combinaisons thérapeutiques suivies de fortes doses de melphalan avec greffe de cellules souches peuvent améliorer non seulement la survie sans progression, mais aussi la survie globale. D'autres études et un suivi à plus long terme sont nécessaires pour confirmer ces données préliminaires.
Rôle de la Consolidation et de la Maintenance
Un avantage particulier de l'intensification thérapeutique est que la réponse peut se compléter dans les semaines et les mois qui suivent la procédure. Si une RC ou une TBRP sont obtenues, alors ces patients peuvent être suivis sans devoir avoir recours à un traitement d'entretien ou de maintenance. On leur proposera certainement un traitement de consolidation. Les patients qui bénéficient de l'intensification thérapeutique sont souvent en rémission plus longtemps et donc profitent de périodes plus longues avant qu'un nouveau traitement soit requis. Toutefois, selon les caractéristiques initiales de la maladie, y compris l'analyse chromosomique, le traitement d'entretien et/ou autre traitement (consolidation) peuvent être recommandés après la greffe.
Rôle d'une seconde greffe
Si une RC ou au moins une TBRP ne sont pas obtenues après une première autogreffe, une seconde autogreffe ou une autre greffe, comme la "mini-allogreffe" voir ci-dessus, peuvent être effectuées. Poursuivre les efforts pour atteindre au moins une TBRP avec une seconde greffe ne semble pas conférer un avantage aux patients.
Facteurs influençant le devenir
II est généralement admis que les patients qui obtiennent une très bonne réponse comme une RC ou une TBRP ont un meilleur devenir (en comparaison, par exemple, à une réponse partielle [RP]). Toutefois, d'autres études s'imposent. Obtenir une réponse durable, que ce soit avec une simple RP (⩾ 50% d'amélioration), TBRP (⩾ 90%) ou RC (100%), est plus important que le niveau de réponse en soi. Une réponse qui dure au moins deux ans est bien plus avantageuse. Le bénéfice d'une maladie stable, quel que soit le niveau de réponse (RP, TBRP ou RC) fait actuellement l'objet d'une étude.
Étapes importantes avant de considérer l'intensification thérapeutique avec support de cellules souches comme une option de traitement
I.
• Confirmer le diagnostic de myélome multiple actif ou symptomatique, nécessitant un traitement spécifique.
• S'il y a le moindre doute quant au diagnostic ou la prise en charge thérapeutique, cela peut être le moment opportun pour demander un second avis avant de débuter le traitement de première ligne.
II.
• Débuter le traitement de première ligne ou d'induction afin de contrôler le myélome et d'obtenir une réponse initiale.
• Éviter le melphalan ou tout autre traitement qui pourraient affecter la qualité des collectes de cellules souches. Une radiothérapie étendue sur le basin peut diminuer les réserves de cellules souches et devrait être évitée si possible.
III.
• Évaluer la réponse au traitement à chaque cycle (habituellement toutes les 3 à 4 semaines).
• Après 3 à 4 cycles, une évaluation plus complète est souvent nécessaire, comprenant un examen de la moelle osseuse et de l'imagerie afin de déterminer le niveau de réponse.
IV.
• Revoir avec votre médecin les avantages et les inconvénients d'une intensification avec greffe de cellules souches (et/ou discuter d'un prélèvement de cellules souches sans greffe immédiate).
• Si une réponse de ⩾ 50% est atteinte (RP : baisse de ⩾ 50% de la concentration de protéine liée au myélome dans le sang et/ou l'urine), la collecte de cellules souches peut être organisée si le patient et le médecin pensent que c'est la meilleure option. S'il n'est pas prévu de procéder au prélèvement et/ou à une greffe, un nouveau plan de traitement et de suivi doit être proposé.
• Si la réponse est < 50%, alors un autre traitement peut être envisagé avant de réaliser la greffe.
Comment les cellules souches sont-elles recueillies ?
Les cellules souches sont situées dans la moelle osseuse. Jusqu'à il y a environ 20 ans, le patient ou le donneur devaient être sous anesthésie générale et subir de 50 à 100 ponctions de la moelle osseuse sur la partie postérieure de l'os iliaque du bassin afin de prélever suffisamment de moelle osseuse et de cellules souches pour une greffe ultérieure. Cette procédure était évidemment douloureuse, angoissante et incommodante. Il va sans dire que ce fut une avancée majeure que de découvrir que les cellules souches pouvaient être prélevées dans la circulation sanguine en administrant au patient ou au donneur des injections de facteurs de croissance ("facteurs stimulants les colonies ou CSF") tels que le Neupogen®, le Granocyte®, le Neulasta®.... pour déclencher la libération de cellules souches médullaires dans la circulation sanguine. Améliorée au fil des années, cette procédure constitue aujourd'hui la méthode standard. Il est rarement nécessaire d'utiliser l'ancienne méthode de prélèvement dans le bassin.
Comment prélever les cellules souches dans le sang périphérique (CSP) ?
Il existe trois méthodes de prélèvement de cellules souches périphériques :
1) sous facteurs de croissance seuls, 2) sous facteurs de croissance, combinés à une chimiothérapie, 3) sous facteurs de croissance, combinés à un autre agent mobilisateur.
1. Donner des facteurs de croissance seuls
Les facteurs de croissance sont des médicaments qui stimulent la croissance et la libération des cellules souches dans le sang. Ces traitements sont administrés par voie sous-cutanée (sous la peau). Les facteurs de croissance des globules blancs (Neupogen®, Neulasta®, Granocyte®...) sont utilisés pour le recueil de cellules souches. Ce processus s'appelle la "mobilisation". Les injections sont administrées quotidiennement durant une période minimale de cinq jours. Les cellules souches sont habituellement prélevées le cinquième jour après le début des injections. Les prélèvements et les injections se poursuivent de façon quotidienne jusqu'à l'obtention d'un nombre suffisant de cellules souches. Généralement, il est programmé de collecter assez de cellules souches pour au moins 2 greffes, c'est-à-dire au moins 2-3 millions de cellules souches par kg de poids du patients par greffe (soit 4-6 million/kg au total).
2. Facteurs de croissances combinés à la chimiothérapie
L'Endoxan (ou cyclophosphamide) est la chimiothérapie la plus souvent utilisée dans ce contexte pour augmenter la libération des cellules souches dans le sang. Bien évidemment, d'autres chimiothérapies peuvent être utilisées. Votre médecin vous expliquera pourquoi, selon le cas, il peut être ou non approprié d'avoir recours à une chimiothérapie, comme l'Endoxan, en combinaison avec des facteurs de croissance. Il vous expliquera également quels sont les effets positifs et négatifs de l'Endoxan s'il est utilisé pour mobiliser les cellules souches sanguines.
En premier lieu, l'Endoxan est utilisé pour augmenter le rendement des cellules souches et est donc recommandé si l'on craint que la collecte des cellules souches soit faible. L'Endoxan a l'avantage supplémentaire d'être également un traitement pour le myélome. L'inconvénient de l'Endoxan est qu'il est administré le plus souvent en hospitalisation pour la mobilisation. Qui plus est, il peut entraîner une aplasie et, lorsque les globules blancs (système immunitaire de l'organisme) sont à des niveaux très bas, une infection peut se déclarer, nécessitant éventuellement une autre hospitalisation.
Après la chimiothérapie de mobilisation, un facteur de croissance de la lignée granulocytaire (globules blancs) sera administré par injection sous la peau quotidiennement pendant environ 10 jours. Cette procédure est donc plus longue et beaucoup plus intensive que l'utilisation de facteurs de croissance seuls. Le patient ou son entourage peuvent être éduqués pour réaliser les injections eux même à la maison. Sinon, les patients peuvent recevoir les injections de facteur de croissance avec infirmière à domicile. Une fois le nombre de cellules souches dans le sang suffisamment élevé, elles seront collectées sur 2 à 5 jours, alors que le patient continue de recevoir des injections de facteurs de croissance.
3. Autre agent mobilisateur combiné à la chimiothérapie
Le Mozobil® (plérixafor) a été approuvé par la FDA en 2008 comme un agent supplémentaire pour la mobilisation des cellules souches. Le Mozobil® est utilisé en association avec des facteurs de croissance pour libérer les cellules souches dans le sang afin qu'elles puissent être collectées et utilisées pour la greffe chez les patients atteints de myélome (ainsi que les patients atteints de lymphome non hodgkinien). Les patients sont traités avec des facteurs de croissance pendant 4 jours avant de recevoir le Mozobil. Ce dernier est injecté en sous-cutanée environ 11 heures avant la collecte de cellules souches prévue pour un maximum de 4 jours consécutifs. Le Mozobil augmente le nombre de cellules souches qui peuvent être recueillies et est particulièrement utile pour les patients qui, pour diverses raisons (telles que l'âge ou des régimes de traitements antérieurs intensifs), ont du mal à générer des cellules souches pour le recueil.
Les essais cliniques ont démontré plusieurs avantages à utiliser le Mozobil en plus des facteurs de croissance par rapport aux facteurs de croissance seuls pour la mobilisation des cellules souches. Les avantages du Mozobil sont les suivants :
• Taux de réussite plus élevés pour la mobilisation de cellules souches. Plus de patients atteignent le nombre minimum et le nombre cible de cellules souches, et sont en mesure ainsi d'avoir à la greffe. La réinjection de plus de cellules souches au patient peut se traduire par une récupération de globules blancs, de globules rouges et de plaquettes de plus longue durée (ou "durable").
• Moins de procédures de cytaphérèses nécessaires, avec donc un nombre réduit de passage sur la machine.
• Pratiquement tous les patients atteints de myélome et de lymphome non hodgkiniens ayant reçu une mobilisation par Mozobil en combinaison avec des facteurs de croissance ont été greffes avec succès.
• Une présentation durant l'ASH 2011 par Adel et al du Mémorial Sloan Kettering a démontré que l'utilisation dès le départ du Mozobil serait plus rentable que l'approche actuelle largement utilisée employant l'Endoxan, non seulement parce que le Mozobil nécessite moins de jours de cytaphérèse, mais parce que les patients qui utilisent le Mozobil ne nécessite pas d'hospitalisation.
Le recueil ou la procédure de collecte
Dans le jargon médical, le prélèvement est dénommé cytaphérèse - c'est-à-dire l'extraction des globules blancs de la circulation sanguine. La cytaphérèse est une procédure grâce à laquelle le sang du patient ou du donneur circule à travers un appareil spécial qui sépare (par une technique de centrifugation) puis extrait les cellules souches. Le reste du sang est immédiatement réinjecté au patient ou au donneur. Il s'agit d'une procédure exceptionnellement simple et sans douleur comparativement au prélèvement de moelle osseuse dans le bassin.
Cytaphérèse
Avant de procéder aux cytaphérèses, un petit tube flexible en plastique appelé cathéter est inséré dans une veine afin de pouvoir y prélever du sang. Durant cette procédure, le sang est prélevé par le cathéter et traité dans un appareil afin de retirer les cellules souches. Le reste du sang est réacheminé à travers le même cathéter (la lumière qui n'est pas utilisée dans un cathéter à deux lumières) ou en utilisant un autre cathéter. On doit prévoir trois à quatre heures par jour pendant une à cinq journées pour les cytaphérèses. Les cytaphérèses sont habituellement effectuées en externe. Les effets secondaires les plus courants ressentis durant les cytaphérèses sont de légers étourdissements, sensations de fourmillement dans les mains et les pieds. Les effets secondaires les moins fréquents comportent les frissons, les tremblements et les douleurs musculaires. Ces effets secondaires sont temporaires et sont provoqués par les changements dans le volume sanguin du patient alors qu'il circule de l'intérieur à l'extérieur de l'appareil, ainsi que par les anticoagulants ajoutés au sang afin d'éviter la coagulation sanguine durant la cytaphérèse.
Traitement des cellules souches
À la suite du prélèvement, le sang périphérique (ou occasionnellement la moelle osseuse) est acheminé vers le laboratoire de traitement, habituellement situé à l'hôpital ou à la banque de sang locale (à Besançon à l'Institut Français du Sang [IFS]). Dans le laboratoire de traitement, la moelle osseuse ou les cellules souches sanguines sont préparées pour la congélation (cryoconservation). Les cellules souches sont mélangées dans une solution contenant le composé chimique DMSO (diméthylsulfoxide) afin de les préparer pour la congélation. Les cellules souches sont par la suite congelées et conservées dans de l'azote liquide. Les cellules souches restent congelées jusqu'au moment de la greffe. Elles peuvent être congelées aussi longtemps que nécessaire. On remarque une détérioration avec le temps, mais l'on peut maintenir une excellente fonction des cellules souches pendant au moins dix ans.
De combien de cellules souches ai-je besoin ?
Plusieurs études ont été réalisées au fil des ans afin de déterminer le nombre de cellules souches requises pour recevoir un traitement à fortes doses en toute sécurité. Le nombre de cellules souches est quantifié grâce à une technique de laboratoire spécialisée surnommée "analyse des cellules CD34+ par cytométrie en flux". Un petit échantillon des cellules souches qui ont été prélevées est analysé afin de déterminer la teneur en cellules CD34+. Nous savons que le nombre minimum de cellules souches requis pour effectuer une greffe en toute sécurité est de 2 millions de cellules CD34+ par kilogramme de poids corporel. Le nombre de cellules CD34+ est vérifié dans le prélèvement quotidien et inventorié. Le processus de prélèvement se poursuit de façon quotidienne jusqu'à ce que le nombre de cellules requises soit prélevé - habituellement de 1 à 4 jours. Certains centres de transplantation vérifient le nombre de cellules CD34+ le jour même AVANT d'effectuer la cytaphérèse afin de s'assurer que le prélèvement sera optimal. La plupart des médecins greffeurs prélèvent suffisamment de cellules souches pour deux greffes (plus de 4 voire 6 millions de cellules CD34+ par kilogramme de poids corporel).
Administrer la chimiothérapie à haute dose
Lorsque les cellules souches ont été congelées et conservées, le patient est prêt à recevoir une chimiothérapie à fortes doses. Ce traitement est conçu pour éliminer les cellules myélomateuses de façon plus efficace que les doses standards de chimiothérapie. Le but de la chimiothérapie à fortes doses est d'éliminer les cellules myélomateuses dans le corps du patient. Le type de chimiothérapie à fortes doses le plus couramment utilisé pour traiter le myélome est le melphalan administré à une dose de 200 milligrammes par mètre carré (mg/m2) de surface corporelle (selon la taille et le poids du patient). En tenant compte du type de myélome et d'autres facteurs, certains patients peuvent recevoir une deuxième greffe 3-6 mois après la première (double autogreffe ou greffe en tandem). Le patient devrait discuter, avec son médecin, des avantages et inconvénients de réaliser deux greffes consécutives comparativement à la possibilité de conserver les cellules pour une deuxième greffe à une date ultérieure.
Autogreffe de cellules souches
Les cellules souches déjà prélevées sont décongelées et réinjectées dans la circulation sanguine par un cathéter (comme c'est le cas pour un individu qui reçoit une transfusion sanguine) un à deux jours après la chimiothérapie à fortes doses. C'est ce qu'on appelle une "greffe", mais ce n'est pas le terme exact car les patients en fait reçoivent leurs propres cellules souches. Ces cellules ne sont pas greffées à partir d'un donneur. La greffe est réalisée dans la chambre du patient : il ne s'agit pas d'une intervention chirurgicale. Les poches congelées de cellules souches sont décongelées dans un bain d'eau chaude, et leur contenu réinjecté dans la circulation sanguine par le cathéter. Au moment de la décongélation, le DMSO (agent de congélation) s'évapore dans l'air et crée une odeur distincte et quelque peu désagréable d'ail. La plupart des centres perfusent une poche à la fois. La perfusion se déroule sur une période de 1 à 4 heures.
Les cellules souches réinjectées circulent dans le sang et retournent dans la moelle osseuse, où elles produisent de nouveaux globules blancs, globules rouges et plaquettes. Il faut prévoir de 10 à 14 jours pour que les nouvelles cellules sanguines puissent apparaître dans la circulation en nombre suffisant. Des facteurs de croissance peuvent être administrés au patient afin d'accélérer le processus.
En plus d'anéantir la moelle osseuse, la chimiothérapie à fortes doses peut provoquer d'autres effets secondaires graves pouvant nécessiter l'hospitalisation de certains patients afin qu'ils soient traités durant cette période. (Les centres de transplantation aux USA n'exigent pas tous que les patients demeurent à l'hôpital suivant la réinjection des cellules souches ; certains sont dotés d'établissements à proximité où les patients peuvent demeurer et être suivis de façon quotidienne en clinique externe, alors que d'autres permettent aux patients dont la résidence est située à proximité de l'hôpital de dormir à la maison et d'être suivis à l'hôpital). La durée moyenne du séjour à l'hôpital (ou dans un établissement à proximité) pour la chimiothérapie, la greffe et la convalescence est environ de trois semaines. Juste avant de commencer la chimiothérapie, les patients doivent habituellement consommer d'importantes quantités de liquides afin de prévenir la déshydratation et les lésions rénales occasionnées par la chimiothérapie.
Certains des effets secondaires fréquents de la chimiothérapie incluent les nausées, les vomissements, la diarrhée, les ulcères dans la bouche ou mucite, les éruptions cutanées, la perte de cheveux, la fièvre ou les frissons et les infections.
Des médicaments conçus pour prévenir ou atténuer certains des effets secondaires du traitement sont automatiquement administrés. Les patients sont suivis étroitement pendant et après la chimiothérapie à fortes doses. Le suivi comprend une vérification quotidienne du poids ainsi que des lectures fréquentes de la pression artérielle, du rythme cardiaque et de la température.
Prévenir les Infections
Au cours des deux à trois semaines suivant la greffe, les cellules souches injectées migrent vers la moelle osseuse et commencent à produire des cellules sanguines, un processus appelé prise de greffe. Jusqu'à ce que la prise de greffe ait lieu, les patients sont à risque de développer des infections. Même une infection bénigne, comme un rhume, peut mener à de sérieuses complications puisque le système immunitaire est affaibli par la chimiothérapie à fortes doses. Il faut donc prendre des précautions particulières durant la période de convalescence. Comme le système immunitaire est très affaibli, les patients doivent demeurer à l'hôpital jusqu'à ce que les concentrations de globules blancs atteignent un niveau suffisant pour qu'ils puissent sortir. Afin de prévenir les infections, les traitements de support suivants peuvent s'avérer nécessaires :
• Des antibiotiques sont souvent prescrits afin d'aider à prévenir les infections.
• Les visiteurs doivent se laver les mains et, à l'occasion, porter un masque et des gants afin de protéger le patient.
• II est parfois interdit d'apporter des fruits, des légumes frais et des fleurs dans la chambre du patient pour éviter les infections (bactéries et infections fongiques).
• En présence d'infection et/ou de fièvre (en raison d'une diminution des taux de globules blancs), le patient peut recevoir un traitement antibiotique intraveineux.
Prise de greffe et convalescence
Une fois que les cellules souches ont été réinjectées, on doit prévoir jusqu'à deux semaines pour que les globules blancs atteignent un niveau normal. À la suite d'une greffe, plusieurs centres de transplantation utilisent, là encore, des facteurs de croissance granulocytaires (Neupogen®, Neulasta®, Granocyte®....), pour stimuler la moelle osseuse afin qu'elle produise des cellules sanguines saines. Ces injections (sous-cutanées) peuvent se poursuivre jusqu'à ce que les leucocytes atteignent un niveau normal. Durant cette période dite d'aplasie, des transfusions de globules rouges et/ou de plaquettes peuvent s'avérer nécessaires.
Attendre la prise de greffe des cellules souches greffées, la remontée des globules blancs à un niveau normal et la disparition des effets secondaires, est souvent la période la plus difficile pour le patient, sa famille et ses amis. Au cours de cette période, les patients se sentent faibles et ressentent une grande fatigue. Il est très important d'avoir un soutien. La convalescence peut se comparer à un tour sur les montagnes russes : un jour, le patient se sent beaucoup mieux, puis le lendemain plus malade que jamais. Il est important de vivre les choses au jour le jour durant cette période. Lorsque les nouvelles cellules sanguines sont produites, les symptômes disparaissent, les risques d'infections graves diminuent et les transfusions ne sont plus nécessaires.
Après être sorti de l'hôpital, le patient poursuit sa convalescence à la maison pendant deux à quatre mois. Même si les patients sont en mesure de quitter l'hôpital, leur convalescence est loin d'être terminée.
Durant les premières semaines, ces patients sont faibles et ne réussissent souvent qu'à dormir, s'asseoir et marcher un peu dans la maison. Les patients peuvent habituellement reprendre leurs activités ou retourner au travail à temps plein trois à six mois après la greffe, bien que ceci puisse varier d'un individu à un autre.
Suis-je candidat à l'intensification thérapeutique avec greffe de cellules souches ?
Le traitement intensif avec greffe de cellules souches est une option thérapeutique pour de nombreux patients atteints d'un myélome ; toutefois, cela ne guérit pas. La greffe peut prolonger la période de rémission et la durée de vie. Elle peut également procurer une meilleure qualité de vie pour la plupart des patients.
Les patients atteints d'un myélome ne sont pas tous des candidats à une greffe de cellules souches. Plusieurs facteurs doivent être considérés. Ceux-ci incluent des facteurs liés au myélome en soi et des facteurs liés au patient.
Facteurs liés au Myélome
• type de myélome
• stade de la maladie
• agressivité de la maladie
• réponse au traitement
• taux d'albumine sérique
• taux de bêta-2 microglobuline initial
• analyse des chromosomes
Facteurs liés au Patient
• âge
• état de santé
• fonction rénale, cardiaque, pulmonaire,
et hépatique
• préférence du patient
• situation familiale
• situation professionnelle
On ne peut suffisamment insister sur le fait que le myélome est une maladie très particulière à chacun. Bien qu'il existe des similarités entre les patients, chaque cas présente ses propres caractéristiques distinctes.
De nombreuses variables sont examinées avant de déterminer si une greffe est recommandée. Par conséquent, les généralités au sujet du devenir pendant et après la greffe ne sont pas appropriées. Les données récentes d'essais cliniques suggèrent qu'une induction comprenant le thalidomide, le Revlimid, et/ou le Velcade peut donner des taux de réponse et une durée de réponse comparables à ceux obtenus après HDT avec support de cellules souches ; cela permettrait à certains patients de reporter l'HDT plus tard dans l'évolution de la maladie. D'autres études sont en cours pour valider ces données.
Souvenez-vous, dans la majorité des cas, avoir un myélome laisse le temps au patient d'effectuer des recherches et de recueillir les informations nécessaires pour prendre une décision plus avertie sur l'option la plus appropriée. Par exemple, un patient peut réaliser un prélèvement de cellules souches et les conserver pour un traitement ultérieur. Cela permet au patient de bénéficier de plus d'options de traitement de première ligne. Il s'agit de facteurs à discuter avec votre médecin. Il ne faut surtout pas oublier que même si un individu semble être un bon candidat pour une greffe, la décision finale de bénéficier ou non une greffe, et quand la réaliser revient au patient.
Greffe et essais cliniques
L'autogreffe de cellules souches est considérée comme le traitement de référence pour les patients atteints d'un myélome multiple. Toutefois, bon nombre de nouvelles approches font l'objet d'études dans le but d'améliorer le devenir des patients. Ces études sont réalisées sous forme d'essais cliniques. Elles comprennent :
Une autogreffe en tandem ou double autogreffe est une approche qui englobe deux autogreffes. Un nombre suffisant de cellules souches est prélevé avant la première greffe. Trois à six mois après la première greffe, le patient reçoit un deuxième traitement similaire à fortes doses suivi de la réinjection du reste ou d'une seconde partie des cellules souches. Des données préliminaires indiquent que les greffes en tandem entraînent un meilleur contrôle de la maladie et un meilleur taux de survie chez les patients qui n'obtiennent pas une TBRP ou une RC après la première autogreffe.
Le traitement séquentiel par autogreffe suivie d'une "mini" (non myéloablative) allogreffe comprend une chimiothérapie à fortes doses avec une autogreffe afin de détruire la plupart des cellules myélomateuses, suivie 2 à 4 mois plus tard d'une mini allogreffe pour permettre aux cellules immunitaires du donneur de détruire toute cellule myélomateuse résiduelle. Dès que les cellules souches allogéniques se multiplient, les cellules immunitaires du donneur attaquent le myélome ("l'effet greffon contre myélome" mentionné précédemment). Il s'agit d'une forme d'immunothérapie. Le risque associé à cette procédure est la GVH ou maladie du greffon contre l'hôte, qui peut être très grave et mettre la vie en danger.
L'autogreffe de cellules souches suivie d'une mini-allogreffe (ou "Auto-mini Allô") a été étudiée dans le cadre d'essais cliniques chez des patients atteints de myélome depuis de nombreuses années. En 2006, une étude de l'IFM (Intergroupe Francophone du Myélome) ne retrouvait aucun bénéfice en survie globale ni en survie sans progression d'une séquence Automini Allô vs double auto. En 2007, Bruno et al quant à eux, ont trouvé une amélioration de la survie chez les patients recevant la séquence Auto-mini Allô vs double auto. Lors du congrès de l'ASH (American Society of Hematology) en Décembre 2010, une large étude clinique du groupe BMT CTN comparant double autogreffe par rapport à la séquence Auto-mini Allô (Krishnan et al) chez 710 patients dans 43 centres n'a trouvé aucune différence ni en survie sans progression ni en survie globale. Compte tenu de l'absence de bénéfice de survie et de rémission et de l'augmentation de la mortalité liée au traitement chez les patients recevant la séquence auto-mini allô, l'International Myeloma Working Group (IMWG) recommande actuellement que les mini Allô ne soient effectuées que dans le cadre d'essais cliniques.
Le traitement d'entretien est une approche qui utilise des doses diminuées de médicaments anti-myélome afin de prolonger la rémission et la survie après une greffe. À l'heure actuelle, les traitements en cours d'évaluation en entretien dans les essais cliniques comprennent principalement le Revlimid et le Velcade, seuls ou en combinaison avec des corticoïdes.
Les essais de maintenance les plus convaincants et plus récemment menées sont deux essais de phase III de Revlimid en post-greffe conduits aux États-Unis (CALGB 100104) et en France (2005-02 IFM). Leurs résultats ont été présentés lors du congrès de l'ASH en Décembre 2010 ; les deux études à ce moment-là ont démontré une survie sans progression (PFS) deux fois plus longue pour les patients qui avaient été randomisés dans le panel Revlimid en entretien. Lors du congrès de l'ASH en Décembre 2011, les données de suivi de ces essais ont été présentées. Il persiste un doublement du taux de survie sans progression pour les patients du panel Revlimid, et l'étude américaine retrouve un bénéfice en survie globale (OS).
Un fait notable de discussion et de controverse dans ces essais était que ces études ont rapporté un taux plus élevé de tumeurs malignes secondaires chez les patients qui étaient dans les panel Revlimid en entretien par rapport au placebo. L'augmentation des tumeurs malignes secondaires de ces essais reste un domaine fortement étudié, car il n'y a eu aucune augmentation de cancers secondaires rapportée chez les patients en rechute et réfractaires traités par Revlimid.
Une théorie qui prévaut est que l'augmentation des cancers secondaires pourrait découler de l'utilisation du melphalan, un agent alkylant employé dans le traitement à haute dose avant greffe dans les deux essais du CALGB et de l'IFM, ayant des effets potentiellement cancérigènes en combinaison avec Revlimid.
Sur la base des données de ces essais de phase III, le National Comprehensive Cancer Network (NCCN) a récemment reclassé l'utilisation du Revlimid en tant qu'agent de maintenance de la catégorie 2A (ce qui signifie que les résultats des essais cliniques n'ont pas encore fait l'objet d'un réexamen complet, et que la sécurité et l'efficacité sont encore préliminaires), à la catégorie 1 (ce qui signifie qu'elle est fondée sur des preuves de haut niveau, et qu'il y a un consensus uniforme du NCCN). Étant donné les avantages évidents et les risques d'un traitement d'entretien post-greffe, chaque patient doit discuter du traitement d'entretien avec son oncologue, qui évaluera les facteurs de risque individuels et la réponse à la greffe avant de faire une recommandation de traitement.
Problèmes psychosociaux
Une chimiothérapie à haute dose et une autogreffe peuvent être sources d'un grand stress pour les patients et leurs familles. Le stress physique, psychologique, émotif et financier peut être accablant. Les patients et leurs familles peuvent éprouver des sentiments de colère, de dépression et d'anxiété attribuables à un avenir incertain et un manque de contrôle. Les services de soutien offerts dans les hôpitaux et plusieurs autres organismes, incluant les groupes de soutien pour les patients atteints de myélome, sont très importants durant cette période. Nous vous conseillons vivement d'utiliser ces services, ou de demander à votre oncologue de vous orienter vers des services de consultation psychologique et/ou psychiatrique.
Questions et Réponses au sujet de l'intensification thérapeutique avec greffe de cellules souches
Vous trouverez ci-dessous certaines des questions fréquemment posées par des patients atteints d'un myélome qui ont bénéficié ou qui vont bénéficier d'une greffe de cellules souches. Il est important de discuter de ces questions et de toute autre préoccupation avec le médecin et les membres de l'équipe soignante avant de prendre une décision au sujet du plan de traitement.
Q. Pourquoi une greffe de cellules souches est-elle nécessaire pour un patient atteint de myélome multiple ?
R. La greffe permet au patient de recevoir une chimiothérapie à fortes doses afin d'éliminer un plus grand nombre de cellules myélomateuses. Ce traitement est si puissant qu'il détruit toute la moelle osseuse. Sans la moelle osseuse, il est impossible pour l'organisme de produire les cellules du sang nécessaires pour transporter l'oxygène, faciliter la coagulation sanguine et prévenir les infections. Une greffe de cellules souches remplace donc la moelle qui a été détruite, épargnant le patient des effets de la chimiothérapie à fortes doses.
Q. Suis-je un candidat pour une intensification thérapeutique avec greffe de cellules souches ?
R. Les experts en médecine n'ont pas encore établi de recommandations fixes concernant la sélection des patients qui profitent le plus d'une greffe. Depuis longtemps intégrée dans les protocoles de traitement du myélome, la réussite de la greffe repose sur l'âge du patient, sa condition physique générale, le stade de sa maladie et sa réponse aux traitements antérieurs. Seul le médecin du patient peut offrir à ce dernier la meilleure évaluation de ses chances de survie à long terme.
Q. Est-ce que les agents alkylants tels que le melphalan, le busulfan et le cyclophosphamide(endoxan) réduisent mes chances de bénéficier d'une greffe ?
R. Les agents alkylants sont l'un des moyens les plus efficaces pour éliminer les cellules myélomateuses à l'intérieur du corps. Toutefois, une utilisation prolongée - de plus de 4 à 6 mois - réduit la capacité de prélever facilement les cellules souches d'un patient. Par conséquent, lorsqu'une greffe est envisagée, il est important que le patient discuter son plan de traitement global afin de s'assurer d'avoir le plus grand nombre d'options de traitement à court et à long terme. Il faut toutefois insister sur l'importance d'effectuer la collecte de cellules souches avant d'utiliser un alkylant.
Q. Comment choisir un centre de greffe ?
R. Une greffe est une procédure médicale complexe qui nécessite une équipe spécialisée constituée de médecins, infirmières, assistante sociale, psychologues et professionnels de la santé qui comprennent la procédure, l'ont réalisée avec succès à maintes reprises et qui sont capables de gérer à la fois les problèmes médicaux et émotionnels. On retrouve aujourd'hui plusieurs centres à travers le pays qui répondent à ces critères. Bon nombre de ces centres se spécialisent dans le traitement de patients atteints de cancer. Afin d'identifier le centre qui convient le mieux aux patients atteints de myélome multiple, vous devriez en discuter avec votre médecin, d'autres patients atteints de myélome multiple et l'IMF.
Q. Que se passe-t-il dans un centre de greffe ?
R. Afin de mieux comprendre ce qui se passe dans un centre de greffe, nous vous recommandons fortement d'effectuer une visite dans un ou plusieurs centres. Planifiez une rencontre avec le personnel - médecins, infirmières et autres membres de l'équipe soignante - afin d'en apprendre davantage sur leur approche de la greffe. Visitez une chambre où votre greffe sera réalisée et où vous séjournerez pendant votre convalescence. Renseignez-vous afin de savoir ce qui sera réalisé en ambulatoire ou à l'hôpital. Il est essentiel d'être en confiance avec le centre avant d'y recevoir votre greffe. À noter que dans certains pays, de nombreux centres ont un motel à proximité ou un complexe résidentiel où sont héberger les patients après avoir reçu leur chimiothérapie à haute dose et pendant qu'ils récupèrent des les effets secondaires. Non seulement les patients ont moins de risque d'infection hors de l'hôpital, mais en plus les coûts d'hébergement privé sont bien moindres que ceux d'une hospitalisation pendant deux semaines ou plus. Les patients sont vus à l'hôpital tous les jours pour leur prise de sang, et sont à proximité en cas d'urgence.
Q. Si mon médecin convient qu'une greffe de cellules souches est un traitement approprié pour ma maladie, que puis-je faire pour m'y préparer ?
R. Un patient peut se préparer de plusieurs façons. En prenant le temps de lire cette note, le patient a déjà réalisé une étape très importante : apprendre autant que possible au sujet de la procédure. Le patient devrait discuter avec son médecin et d'autres patients et lire tout ce qu'il peut, en incluant les publications et bulletins d'information de l'IMF. Les patients devraient poser des questions au sujet de ce qu'ils ont appris et s'efforcer de lire les informations les plus récentes issues de la recherche. Nous conseillons aux patients d'apporter un magnétophone ou d'être accompagnés d'un ami lors de leur visite chez le médecin afin de pouvoir bien se concentrer. Les patients devraient partager toute l'information avec leur famille et proches afin que ces derniers sachent à quoi s'attendre - et comment ils peuvent aider dans les semaines et les mois à venir. Le médecin effectue une série d'examens pour confirmer que le patient est suffisamment bien pour bénéficier de la greffe. Toutes les données recueillies sur l'état cardiaque, pulmonaire et rénal, et des autres organes vitaux permettent au médecin d'établir une comparaison entre la santé du patient avant et après la greffe. Dans la plupart des cas, le patient n'est pas hospitalisé pour les examens puisque ceux-ci peuvent être réalisés en externe.
Q. Quels effets secondaires dois-je prévoir après la greffe ?
R. Des effets secondaires peuvent être ressentis pour chaque type de traitement, même avec d'aspirine. Chaque patient réagit différemment à la chimiothérapie et aux autres médicaments administrés durant la greffe. Il n'y a pas deux patients qui partagent les mêmes effets secondaires. Les effets indésirables les plus fréquents sont des nausées, des aphtes dans la bouche ou mucite, la perte des cheveux, et la fatigue. Les patients doivent rechercher un centre où les médecins, les infirmières et l'équipe soignante ont réalisé un bon nombre de greffes chez des patients atteints de myélome et qui ont l'expérience et l'expertise de subvenir aux besoins individuels de chaque patient.
Q. Que se passe-t-il lors de la réinjection des cellules souches ?
R. En général deux jours après la chimiothérapie à fortes doses, les cellules souches du patient sont réinjectées. Les cellules souches sont décongelées et perfusées par le cathéter du patient dans une poche. Lors de la réinjection, le patient peut ressentir de la chaleur ou se sentir étourdi. Les produits chimiques utilisés pour conserver les cellules souches ont une senteur d'ail que le patient peut faiblement percevoir. L'oncologue peut prescrire ou ajuster les traitements du patient afin qu'il soit plus confortable pendant la greffe.
Q. La greffe en soi peut-elle entraîner la mort d'un patient ?
R. Toute procédure médicale comporte des risques et l'intensification thérapeutique chez un patient atteint de myélome multiple est risquée. Néanmoins, des études médicales ont démontré que la mortalité après greffe n'excède pas 5% voire même le plus souvent 1%.
Q. Un patient peut-il rechuter après une greffe ?
R. Oui. Malheureusement, la majorité (au moins 50%) des patients atteints d'un myélome multiple rechuteront dans les 18 à 36 mois après la greffe.
Q.J'ai beaucoup entendu parler de la purge du myélome. Est-ce bénéfique ?
R. Le processus de purge élimine les cellules myélomateuses du sang périphérique prélevé chez le patient avant la greffe. Une chimiothérapie à fortes doses est utilisée pour éliminer les cellules myélomateuses qui se retrouvent dans le corps. La sélection de cellules souches ou « purge », est utilisée pour éliminer les cellules myélomateuses des cellules souches prélevées avant la greffe. Le but de cette stratégie est de réduire le nombre de cellules myélomateuses présentes dans le corps du patient ainsi que dans le sang périphérique qui lui sera réinjecté. De récentes études indiquent que cette technologie n'est pas efficace pour le myélome. Par conséquent, peu de centres ont recours à la purge de cellules souches pour traiter les patients atteints d'un myélome.
Q. Quelle est la durée du séjour à l'hôpital pour le patient greffé ?
R. Les patients sont hospitalisés pendant 2 à 3 semaines environ. La durée du séjour varie d'un patient à un autre. Certains patients peuvent être admis pour plusieurs courts séjours.
Q. À quel moment les cellules souches commencent-elles à se reproduire ?
R. Les cellules souches commencent à se reproduire ou « à prendre » dans un délai de 10 à 14 jours après la réinjection.
Q. Qu'advient-il de la qualité de vie du patient après la greffe ?
R. En général, la récupération du patient dure entre 3 à 6 mois. À ce moment, le système immunitaire peut de nouveau combattre les infections puisque la moelle osseuse produit des cellules sanguines saines. Les cheveux repoussent, mais les papilles gustatives peuvent être encore affectées. Les aliments qui avaient bon goût avant la greffe n'ont pas nécessairement bon goût après la greffe. Toutefois, dans la majorité des cas, les patients sont en mesure de reprendre leurs activités quotidiennes. Certains prennent jusqu'à un an pour reprendre leur routine. Les patients et leur entourage doivent vivre au jour le jour au début. Il y aura des mauvais et des bons jours bons, pas nécessairement dans cet ordre. Les patients doivent se préparer à se sentir différemment chaque jour tout au long de leur convalescence.
Q. Les patients greffés doivent-ils s'attendre à des changements sur le plan émotionnel?
R. Oui. Une greffe est bien plus qu'une simple procédure médicale. Puisque le patient se retrouve à se reposer sur son oncologue et sur les autres membres de l'équipe de soins, en plus de la famille et des amis, il éprouve souvent un sentiment de perte d'autonomie et de contrôle. Des sentiments d'isolement, de dépression et de détresse sont courants chez les patients greffés. Les patients et les proches devraient alors demander l'aide d'un professionnel. Vous pouvez également recevoir de l'aide auprès des groupes de soutien pour les patients.
Q. Quelles thérapies parallèles et complémentaires peuvent être administrées pendant et après la greffe ?
R. Certains patients croient que les thérapies parallèles et complémentaires sont une composante importante de leur traitement. Du fait que tous les médicaments, synthétiques et naturels, interagissent, et peuvent créer des effets secondaires imprévus, les patients devraient toujours consulter leur médecin avant de les utiliser. Le médecin doit être informé du nom des thérapies parallèles et complémentaires prises. Il est important de noter que même les médicaments en vente libre, en apparence inoffensifs, comme l'ibuprofène par exemple, peuvent être dangereux pour un patient atteint d'un myélome.
Termes et Définitions
Agent alkylant : agent de chimiothérapie comme le melphalan (Alkeran®) ou le cyclophosphamide (Endoxan). Le terme Alkylant réfère à la façon dont ces agents interagissent avec l'ADN des cellules myélomateuses et bloquent la division cellulaire.
Agent Immunomodulateur : agent qui affecte, stimule ou inhibe le système immunitaire.
Allogreffe de cellules souches : la greffe est réalisée grâce à des cellules souches qui sont prélevées chez un donneur puis administrées au patient. La plupart des allogreffes de cellules souches utilisent des cellules souches du sang périphérique du donneur. Les allogreffes standards sont rarement réalisées pour les patients atteints d'un myélome en raison du risque qu'elles présentent pour le patient. Une technique récente et, pour le myélome, plus sécuritaire (discutée ci-après), est la greffe non myéloablative ou « mini greffe », actuellement étudiée dans des essais cliniques. Afin de déterminer si le patient a un donneur compatible potentiel, une analyse de sang particulière surnommée typage HLA est effectuée. Un donneur peut être un membre de la famille ou être identifié à partir d'un registre de donneurs volontaires. Les cellules souches sont rarement obtenues auprès d'une banque de sang de cordon ombilical.
Anémie : diminution du nombre normal de globules rouges, avec un taux d'hémoglobine habituellement inférieur à 10 g/dl (taux normal entre 12 et 15 g/dl). La présence du myélome dans la moelle osseuse bloque la production de globules rouges, provoquant ainsi l'anémie, dont les symptômes sont l'essoufflement, la faiblesse et la fatigue. Autogreffe de sang périphérique: (voir autogreffe de cellules souches) une procédure qui consiste d'abord à prélever, par cytaphérèse, les cellules souches dans le sang du patient puis à les conserver, et à les réinjecter à la suite d'une chimiothérapie à fortes doses.
Autogreffe (greffe autologue) de cellules souches : réinjection de cellules souches qui sont prélevées chez un patient et perfusées au même patient lorsqu'il a reçu une chimiothérapie à fortes doses. La plupart des greffes de cellules souches chez les patients atteints de myélome sont des autogreffes.
CD34+ : marqueur utilisé pour distinguer et quantifier les cellules souches dans la circulation sanguine. Un nombre minimum de cellules souches CD34+ est requis afin de pouvoir réaliser une greffe de façon sans danger.
Cellules souches (cellules souches hématopoïétiques) : Les cellules souches (hématopoïétiques) saines génèrent des composants sanguins normaux, incluant les globules rouges, les globules blancs et les plaquettes. Ces cellules souches se trouvent normalement dans la moelle osseuse et peuvent être prélevées pour une greffe.
Cellules souches du sang périphérique (CSP) : les cellules souches sont prélevées dans le sang. Ces cellules sont similaires aux cellules souches retrouvées dans la moelle osseuse. Le terme « périphérique » signifie que les cellules proviennent du sang à l'extérieur de la moelle.
Chimiothérapie : médicaments utilisés pour détruire les cellules cancéreuses.
Cytaphérèse : procédure grâce à laquelle les cellules souches périphériques sont extraites dans le sang d'un patient ou d'un donneur. La fraction du sang contenant le plasma, les globules blancs et les plaquettes est séparée. Les globules rouges sont reperfusés au patient ou donneur. La fraction qui contient les globules blancs est celle qui contient les cellules souches.
Facteurs de croissance : médicaments qui stimulent la croissance et la libération de cellules souches sanguines dans la circulation sanguine.
Facteurs de croissance des globules blancs : protéines qui stimulent le développement et la croissance des cellules sanguines. Le Neupogen®, le Neulasta® et le Granocyte® sont des facteurs de croissance des globules blancs utilisés pour mobiliser les cellules souches de la moelle osseuse dans la circulation sanguine avant la cytaphérèse. Ces derniers peuvent également être utilisés suite à la greffe pour accélérer la remontée des globules.
Globules blancs : l'un des trois types majeurs de cellules dans le sang. Il existe plusieurs types de globules blancs ou leucocytes (neutrophiles, lymphocytes et monocytes).
Globules rouges : cellules sanguines qui transportent l'oxygène des poumons à travers le corps.
Greffe ou transplantation : les cellules souches sont utilisées pour restaurer le potentiel hématopoïétique du patient à la suite d'une chimiothérapie à fortes doses et/ou d'une radiothérapie. La greffe n'est pas forcement un traitement mais une méthode de support pour permettre un traitement de chimiothérapie à fortes doses.
Greffe de cellules souches du sang périphérique (CSP) : obtenues de la circulation sanguine du patient ou du donneur. Utiliser les CSP pour réaliser la greffe permet de prélever de façon plus facile et sécuritaire les cellules souches et de raccourcir la convalescence comparativement à la greffe de cellules souches de moelle osseuse.
Greffe de moelle osseuse : réalisée au moyen de cellules souches issues directement de la moelle osseuse du patient ou du donneur. Très peu de greffes de moelle osseuse sont actuellement réalisées en raison de la disponibilité des cellules souches du sang périphérique. La moelle osseuse peut rarement être prélevée chez les patients qui ne sont pas en mesure de mobiliser un nombre suffisant de cellules souches dans le sang périphérique.
Greffe en tandem : un terme utilisé pour désigner une double greffe. Il peut s'agir de deux autogreffes ou d'une autogreffe suivie d'une allogreffe (provenant d'un donneur). On planifie habituellement un intervalle de 3 à 6 mois entre chaque greffe.
Greffe de sang de cordon ombilical : les cellules souches sont obtenues à partir des cordons ombilicaux de nouveau-nés. Celles-ci sont congelées et conservées dans des banques de sang de cordon ombilical.
Greffe Syngénique de cellules souches : les cellules souches sont prélevées chez un jumeau monozygote (identique) du patient.
Immunoglobuline : une protéine produite par les plasmocytes (un type de globule blanc) qui aident à combattre l'infection. Également reconnu comme un anticorps.
Lésions lytiques osseuses : trous dans l'os.
Moelle osseuse : Tissu mou spongieux, retrouvé dans la plupart des os plats et longs, qui produit les globules blancs, les globules rouges et les plaquettes.
Myéloablation : la destruction de la moelle osseuse au moyen de radiothérapie et/ou de chimiothérapie. Ce terme s'applique habituellement à la destruction complète ou presque complète de la moelle osseuse.
Myélome multiple : un cancer se développant à partir des plasmocytes dans la moelle osseuse. Les plasmocytes chez les patients atteints d'un myélome multiple forment des anticorps anormaux, qui endommagent possiblement les os, la moelle osseuse et d'autres organes.
Pic monoclonal : anticorps ou parties des anticorps retrouvés en quantité anormalement élevée dans le sang ou l'urine des patients atteints d'un myélome. Le pic monoclonal correspond au profil prononcé qui apparaît sur l'électrophorèse des protéines en présence d'une protéine M. Synonyme de protéine monoclonale et protéine liée au myélome.
Plaquettes : fragments cellulaires avec granules, essentiels à la coagulation sanguine et la guérison des plaies. Les plaquettes contribuent également à la réponse immunitaire.
Plasmocyte : un type de globules blancs qui produit des anticorps.
Plasmocytome : une tumeur composée de plasmocytes malins.
Ponction de la moelle osseuse : le prélèvement, au moyen d'un trocart d'aspiration, d'un échantillon de la moelle osseuse (liquide).
Prise de greffe : le processus au cours duquel les cellules souches greffées migrent vers la moelle osseuse du patient, commencent à se multiplier et à produire de nouveaux globules, globules rouges et plaquettes.
Protéine M (protéine monoclonale) : protéine anormale, produite par les cellules myélomateuses, qui s'accumule et peut endommager la moelle. Une concentration élevée de protéine M indique que les cellules myélomateuses sont présentes en grand nombre.
Rémission ou réponse : rémission ou réponse sont utilisées de manière interchangeable. Rémission complète (RC) est l'abréviation commune pour les deux. La RC est définie par l'absence de la protéine liée au myélome dans le sérum et/ou l'urine lors d'analyses standard, l'absence de cellules myélomateuses dans la moelle osseuse et/ou les autres régions affectées par le myélome, la rémission clinique, et la normalisation des autres paramètres biologiques.
Réponse complète (RC) : la RC est l'absence de la protéine liée au myélome dans le sérum et/ou l'urine lors d'analyses standard ; l'absence de cellules myélomateuses dans la moelle osseuse et/ou autres régions affectées par le myélome ; la rémission clinique et la normalisation des autres paramètres biologiques à un niveau normal. La RC n'est pas la même chose qu'une guérison.
Sélection de cellules souches : une technique de traitement des cellules utilisée pour obtenir un produit enrichi en cellules souches et ainsi contenant moins de cellules cancéreuses potentielles. S'est avéré inutile chez les patients atteints d'un myélome.
Système immunitaire : système qui protège le corps des organismes pathogènes, des autres corps étrangers et des cancers.
Système International de Stadification (ISS) : le plus récent système de stadification du myélome, il résulte de la collaboration de plus de 20 centres de recherche clinique à travers le monde.
Très bonne réponse partielle (TBRP) : une réponse qui n'est pas vraiment une réponse complète (c'est-à-dire, pas à 100%), mais qui représente une diminution de 90% ou plus de la protéine monoclonale sérique.
Sources : Brochure Comprendre l'intensification thérapeutique avec support de cellules souches par International Myeloma Foundation 26 p.
Sites internet de référence :
Pour un premier contact : http://fr.wikipedia.org/wiki/My%C3%A9lome_multiple
Site d'information de l'Association des Malades du Myélome Multiple : www.af3m.org
Site d'information des malades sur le myélome : www.myelome.patients.info
Après le congrès de l'American Society of Hematology (décembre 2013) : Quelques minutes avec Hervé Avet-Loiseau président de l'IFM.
Quelques minutes avec Hervé Avet-Loiseau président de l'IFM.
Voir également l'interview de Thierry Facon (Lille), qui a présenté les résultats très attendus d’une grande étude internationale pilotée par l’Intergroupe Francophone du Myélome, l’IFM, qui pourrait changer la prise en charge en première ligne des patients souffrant de myélome non candidats à l’autogreffe.
Ajout du 23 février 2015 : Le cancer attaqué par ses cellules souches
par Pierre Kaldy (Sciences et Avenir, n° 817 mars 2015, p. 77).
Des chercheurs américains ont découvert des molécules capables de tuer spécifiquement les cellules qui résistent aux chimiothérapies. Il s'agit peut-être de la prochaine révolution dans le domaine de la lutte contre le cancer.
Des chercheurs américains ont découvert de petites molécules capables de tuer spécifiquement les cellules souches tumorales, celles qui résistent aux chimiothérapies et aux rayons X, disséminant des métastases dans le corps. Cette stratégie, qui peut se révéler cruciale quand on sait que cette maladie tue le plus souvent par ses récidives, offre « l'une des perspectives les plus prometteuses dans son traitement », souligne Christophe Ginestier, chercheur au Centre de recherche en cancérologie de Marseille. Ainsi des médecins de la société Boston Biomédical ont identifié une molécule, le BBI608, qui bloque le développement des cellules souches d'une dizaine de cancers différents tout en épargnant celles qui régénèrent le sang. Aucun agent de chimiothérapie n'avait pu jusqu'ici entraver la prolifération de ces cellules. Sans toxicité apparente, le BBI608 a bloqué l'apparition de métastases dans deux modèles de cancer chez la souris. Ces résultats très encourageants ont incité la société à engager plusieurs essais cliniques préliminaires chez des patients atteints de diverses tumeurs incurables. Là encore, des exemples surprenants de régression de la maladie ont été obtenus après traitement avec le BBI608 et un agent de chimiothérapie. Une étude clinique à plus vaste échelle sur le cancer colorectal avancé est en cours pour vérifier cet effet. S'il reste de nombreuses étapes avant la commercialisation de nouveaux inhibiteurs de cellules souches, des patients diabétiques traités par un hypoglycémiant courant, la metformine, semblent déjà bénéficier de cette nouvelle approche. Lorsqu'ils sont atteints de certains cancers, ils présentent un taux de récidive plus faible, probablement dû au fait que la metformine apparaît également toxique pour les cellules souches de la tumeur.
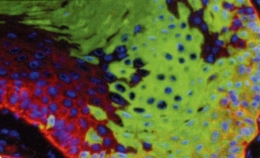
Le BBI608 bloque le développement des cellules souches tumorales
(ici en vert) tout en laissant intactes celles qui régénèrent le sang.

1 commentaire
de précieux renseignements pour mon fils ayant " bénéficié " d'une autogreffe en 2012, auquel on a arrêté le Revlimid il y a six mois pour cause de carcinome buccal. Depuis le myélome est reparti, on doit lui proposer un traitement , il ne souhaite pas une seconde autogreffe, la première ayant été trop pénible. Très inquiète sur la suite......
Les commentaires sont fermés.